A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحديد القائم على النمو وتأكيد البيوكيميائية من متطلبات الوراثية للتدهور البروتين في
In This Article
Summary
This article describes a yeast growth-based assay for the determination of genetic requirements for protein degradation. It also demonstrates a method for rapid extraction of yeast proteins, suitable for western blotting to biochemically confirm degradation requirements. These techniques can be adapted to monitor degradation of a variety of proteins.
Abstract
تدهور البروتين المنظم هو أمر حاسم لتقريبا كل وظيفة الخلوية. تأسست بكثير من ما هو معروف عن الآليات الجزيئية ومتطلبات الوراثية للتدهور البروتين وحيد الخلية في البداية في خميرة الخباز. وقد اعتمدت التحليلات الكلاسيكية للتدهور البروتين على نبض مطاردة وسيكلوهيكسيميد مطاردة منهجيات البيوكيميائية. بينما توفر هذه التقنيات الوسائل الحساسة لمراقبة تدهور البروتين، فهي شاقة، تستغرق وقتا طويلا، وانخفاض الإنتاجية. هذه الأساليب ليست قابلة للفحص السريع أو على نطاق واسع للطفرات التي تمنع تدهور البروتين. هنا، يتم وصف مقايسة على أساس نمو الخميرة لتحديد سطحي من متطلبات الجينية للتدهور البروتين. في هذا الاختبار، وتنصهر إنزيم مراسل المطلوبة للنمو في ظل ظروف انتقائية محددة لبروتين غير مستقر. خلايا تفتقر إلى إنزيم مراسل الذاتية ولكن تعبر عن انصهار بروتين يمكن أن تنمو تحت سيليشروط التفاعلية الذي نظمه فقط عندما يستقر البروتين الانصهار (أي عندما تتعرض للخطر تدهور البروتين). في مقايسة النمو وصفها هنا، ورصدت التخفيفات المسلسل من النوع البري وخلايا الخميرة متحولة إيواء ترميز البلازميد بروتين الانصهار على المتوسطة انتقائي وغير انتقائي. النمو في ظل ظروف انتقائية يتسق مع تدهور ضعف عن طفرة معينة. وينبغي تأكيد زيادة وفرة البروتين كيميائيا. ويتجلى أيضا هناك طريقة لاستخراج السريع للبروتينات الخميرة في شكل مناسب لالكهربائي والنشاف الغربي. هناك قراءات والقائم على النمو للاستقرار البروتين، جنبا إلى جنب مع بروتوكول بسيط لاستخراج البروتين لتحليل الكيمياء الحيوية، ويسهل التعرف السريع على متطلبات الجينية للتدهور البروتين. هذه التقنيات يمكن تكييفها لمراقبة تدهور مجموعة متنوعة من البروتينات قصيرة الأجل. في المثال المقدمة، الانزيم HIS3، وهو مطلوب لالحامض الاميني الحيوي، وتنصهرلDeg1 يستهدف -Sec62. Deg1 -Sec62 للتدهور بعد أن يشرك aberrantly شبكية هيولي باطني translocon. كانت خلايا إيواء Deg1 -Sec62-HIS3 قادرة على النمو في ظل ظروف انتقائية عندما استقرت البروتين.
Introduction
تدهور البروتين انتقائية ضروري للحياة حقيقية النواة، ويسهم تدهور البروتين تغير لعدد من الحالات الطبية، بما في ذلك عدة أنواع من السرطان وأمراض الاعصاب وأمراض القلب والأوعية الدموية، والتليف الكيسي 1-5. النظام اليوبيكويتين-proteasome و(UPS)، والذي يحفز تدهور البروتين انتقائية، هو الهدف العلاجي الناشئة عن هذه الظروف 6-10. ligases اليوبيكويتين نعلق تساهميا البوليمرات من حمض اليوبيكويتين 76-الأمينية إلى بروتينات 11. يتم التعرف على البروتينات التي تم تحديدها مع سلاسل polyubiquitin وبروتين محلل من قبل ~ 2.5 megadalton 26S proteasome و12. وكانت الدراسات التي بدأت في كائن وحيد الخلية نموذج خميرة الخباز (مهدها الخميرة) التأسيسي في توضيح آليات تدهور البروتين في الخلايا حقيقية النواة. وكانت أول الركيزة الفسيولوجية أثبتت من UPS الخميرة قامع النسخي MATα2 13، تم تحديد أول 14، والعديد من المكونات حفظا للغاية من UPS أو تتميز في الخميرة (على سبيل المثال 15-26). الاكتشافات التي تمت في هذا النموذج الحي تنوعا ولين العريكة وراثيا من المرجح أن تواصل تقديم نظرة ثاقبة على آليات الحفاظ عليها من التدهور بوساطة اليوبيكويتين.
الاعتراف وتدهور معظم ركائز UPS تتطلب اتخاذ إجراءات متضافرة من البروتينات متعددة. ولذلك، هدفا هاما في وصف تدهور المنظم للبروتين غير مستقر معين هو لتحديد متطلبات الوراثية لالتحلل البروتيني. النهج الكلاسيكية (مثل نبض مطاردة والتجارب سيكلوهيكسيميد مطاردة 27) لرصد تدهور البروتين في خلايا الثدييات أو الخميرة هي شاقة وتستغرق وقتا طويلا. في حين أن هذه الأنواع من منهجية توفر وسيلة حساسة للغاية للكشف عن تدهور البروتين، فهي ليست مناسبة للتحليل السريع للتدهور البروتين أو على نطاق واسع screeniنانوغرام للطفرات التي تمنع تدهور البروتين. هنا، يتم تقديم مقايسة على أساس نمو الخميرة لتحديد السريع لمتطلبات الوراثية لتحلل البروتينات غير مستقرة.
في طريقة أساس نمو الخميرة لتحليل تدهور البروتين، وهو بروتين غير مستقر من الفائدة (أو إشارة تدهور) وتنصهر، في الإطار، إلى البروتين ما هو مطلوب لنمو الخميرة تحت ظروف معينة. والنتيجة هي الركيزة الاصطناعية التي قد تكون بمثابة أداة قوية لتحديد متطلبات الوراثية من تدهور البروتين من بروتين غير مستقر في المصالح. ملائم، الأكثر استخداما سلالات الخميرة مختبر تؤوي لجنة من الطفرات في الجينات التي تكود الإنزيمات الأيضية تشارك في التركيب الحيوي معينة من الأحماض الأمينية أو القواعد النيتروجينية (على سبيل المثال 20،28-30). هذه الإنزيمات ضرورية لانتشار الخلوي في غياب المقدمة خارجيا الأيض في التوليف الذي الإنزيمات تشارك. مثلوبالتالي قد الإنزيمات الأيضية تعمل كما صحفيين القائم على النمو لتحلل البروتينات غير المستقرة التي تنصهر فيها. متطلبات الجينية للتدهور البروتين يمكن توضيح بسهولة، لأن الطفرات التي تمنع التحلل البروتيني سيسمح خلايا إيواء مراسل تدهور في النمو في ظل ظروف انتقائية.
وهناك ميزة النمو وهذا مؤشر غير مباشر أن طفرة معينة تزيد من وفرة من البروتين من الفائدة. ومع ذلك، مطلوب تحليل الكيمياء الحيوية المباشر للتأكد من أن طفرة تسمح النمو من خلال زيادة مستويات البروتين وليس عن طريق أسباب غير مباشرة أو مصطنعة. ويمكن تأكيد تأثير طفرة على وفرة البروتين عن طريق تحليل لطخة الغربي من مستويات البروتين الحالة المستقرة في الخلايا التي تفعل وليس لإيواء طفرة معينة. وهناك طريقة لاستخراج السريع والفعال للبروتينات الخميرة (حضانة متتابعة من خلايا الخميرة مع هيدروكسيد الصوديوم وعازلة عينة) في شكل مناسبلتحليلها من قبل النشاف الغربي ويقدم أيضا 31. معا، وهذه التجارب تسهيل التعرف السريع على المنظمين مرشح للتدهور البروتين.
Protocol
1. الخميرة الفحص النمو لتحديد المسوخ المرشح عيب في تدهور البروتين
- تحويل من النوع البري وخلايا الخميرة متحولة مع ترميز البلازميد بروتين غير مستقر تنصهر، في الإطار، إلى إنزيم مراسل التمثيل الغذائي.
- تطعيم transformants في 5 مل من الاصطناعية تعريف (SD) الحد الأدنى من المتوسط الذي هو انتقائية لخلايا إيواء جزيئات البلازميد. احتضان بين عشية وضحاها في 30 درجة مئوية، بالتناوب.
- قياس الكثافة البصرية في 600 نانومتر (OD 600) من كل ثقافة بين عشية وضحاها.
ملاحظة: بعد الحضانة بين عشية وضحاها، والخلايا في الثقافة قد تكون إما في مرحلة النمو لوغاريتمي أو ثابتة ولكن ينبغي أن يكون وصلت الحد الأدنى من OD 600 من 0.2. قد تتطلب سلالات الخميرة جدا بطيئة النمو مرات حضانة يلة تعد من واحد، أو تلقيح عدد أكبر من الخلايا، كما تحدد تجريبيا. - إعداد ستة أضعاف التخفيفات المسلسل من خلايا الخميرة تحول في العقيمة لوحة 96-جيدا، بدءا من الخلايا المخفف لن OD 600 من 0.2. وضع كل المحولة الخميرة إلى أن يعاير في صف مختلف في لوحة 96-جيدا.
- لكل المحولة، وحساب حجم الثقافة بين عشية وضحاها المطلوبة لتمييع الخلايا إلى OD 600 من 0.2 في الحجم النهائي من 200 ميكرولتر. إضافة هذا الحجم من الثقافة بين عشية وضحاها إلى المقابلة بشكل جيد في العمود 1. إضافة كمية مناسبة من الماء المعقم لتبرزي حجم إلى 200 ميكرولتر.
- لكل صف من الخميرة، إضافة 125 ميكرولتر من الماء المعقم إلى الآبار في الأعمدة 2 و 3 و 4.
ملاحظة: قد يتم تعبئتها ملفوفة بشكل فردي معقمة لوحات 96-جيدا مع أغطية معقمة. ويمكن استخدام الأغطية كمخازن للمياه معقمة التي يتم توزيعها في هذه الخطوة. وهذا يسمح نقل في وقت واحد من الماء المعقم لجميع الآبار في عمود معين مع pipettor الأقنية. - خلط محتويات العمود الأول (الخميرة المخفف إلى OD 600 من 0.2) من قبل pipetting صعودا وهبوطا مع pipettor الأقنية.
- Transfإيه 25 ميكرولتر من الخميرة من العمود 1 إلى العمود 2، وذلك باستخدام pipettor الأقنية. مزيج من قبل pipetting صعودا وهبوطا. نقل 25 ميكرولتر من العمود 2 إلى العمود 3، و 25 ميكرولتر من عمود إلى عمود 3 4 (يمزج جيدا في كل خطوة).
- خلط كل عينة مع pipettor الأقنية. وانطلاقا من معظم مخفف إلى الأقل يخفف أعمدة من الخميرة، وماصة 4 ميكرولتر من كل عينة على اثنين من لوحات تحتوي على وسيلة انتقائية المناسب. استخدام لوحة واحدة مع المتوسطة التي تحافظ على اختيار بلازميد (تخدم هذه اللوحة بمثابة اكتشاف الخميرة والسيطرة النمو). استخدام لوحة الثانية مع المتوسط أن يختار لصيانة بلازميد والتعبير عن بروتين غير مستقر تنصهر إلى إنزيم مراسل. لأن الخميرة تستقر بسرعة، ومزيج الخلايا عن طريق pipetting صعودا وهبوطا على فترات منتظمة.
ملاحظة: سوف جفافا لوحات تمتص بسهولة أكثر سيولة من الطازجة لوحات، وبالتالي ينصح لهذه التجارب. قد يكون المجفف لوحات رطبة من قبل حضانة في درجة حرارة الغرفة في لوالرطوبة ث ل1 - 2 أيام أو حضانات أقصر في غطاء تدفق الصفحي. لوحات قد يجف بشكل غير متساو إذا كان تدفق الهواء صفائحي موازية للمقاعد البدلاء. استخدام قالب يجعل من السهل على الفور خلايا الخميرة على مسافات منتظمة. وتقدم اثنين من عينة القوالب في الشكل 1، وهذه قد تكون طباعة، قطع، واضافته إلى داخل طبق بتري غطاء. - السماح لوحات لتجف على أعلى مقاعد البدلاء.
- احتضان لوحات عند 30 درجة مئوية لمدة 2 - 6 أيام.
- تصوير كل لوحة بعد الحضانة.
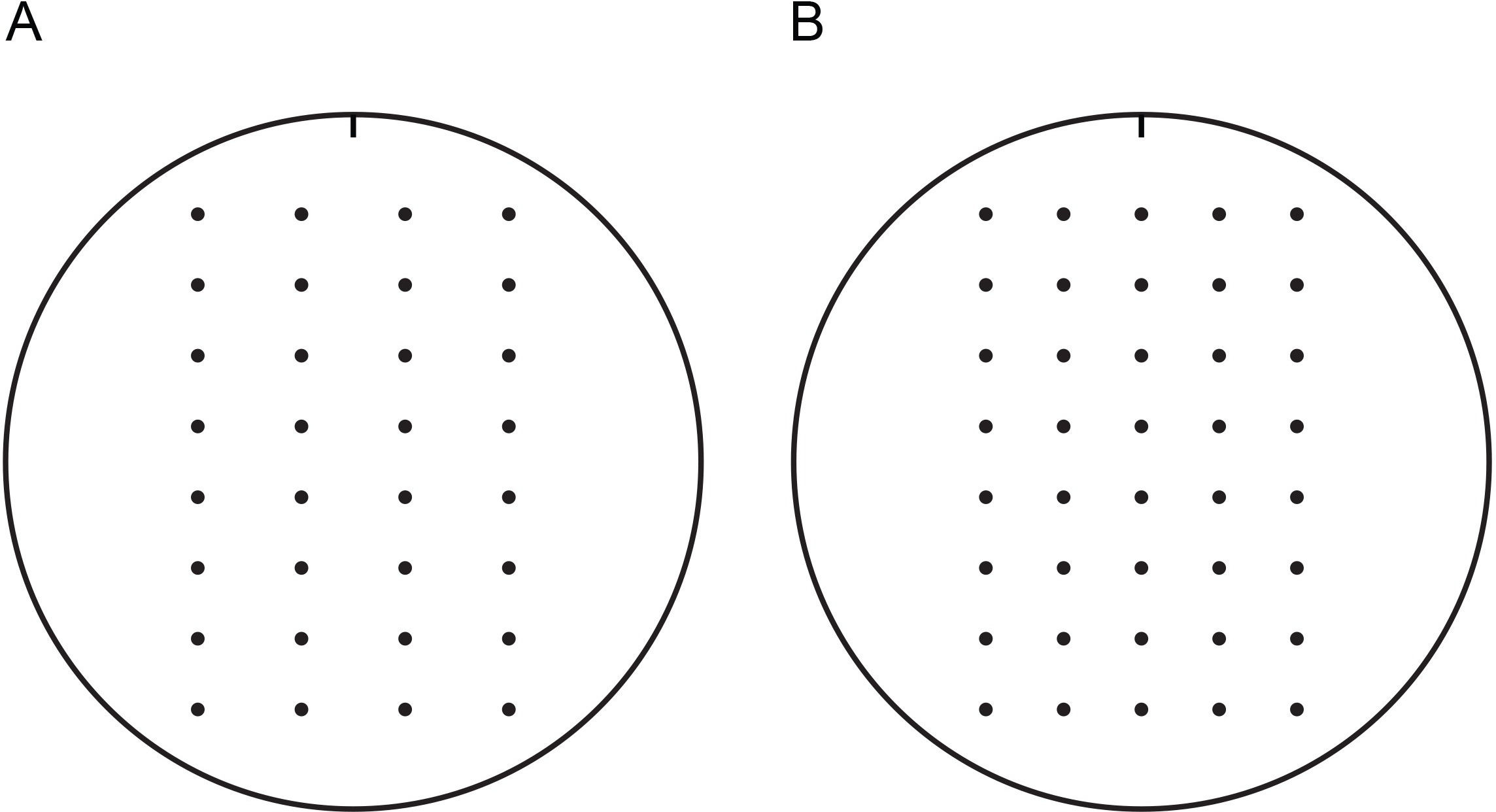
الشكل 1. قوالب لاكتشاف خلايا الخميرة على لوحات أجار 100 ملم. ويمكن استخدام هذه القوالب لتسهيل اكتشاف الخميرة على مسافات منتظمة مع pipettor الأقنية. قد تتم طباعة القوالب، وقطع بها، واضافته الى داخل طبق بتري غطاء. وضع طبق بتري مع النموغطاء داخل متوسطة مع قالب الملصقة. وتتميز القوالب مع الشق لتتبع التوجه. فمن المستحسن أن لوحات تستخدم في فحوصات النمو يتم وضع علامة بالمثل مع الشق لتتبع التوجه. قوالب لاكتشاف أربعة (A) أو خمسة (B) يتم توفير التخفيفات المسلسل من خلايا الخميرة. الرجاء انقر هنا لعرض نسخة قابلة للطباعة من هذا الرقم مع قوالب 100 ملم.
2. تأكيد البيوكيميائية دمغ المصوغات نمو الخميرة
- نمو خلايا الخميرة وبعد القلوية البروتين استخراج (معدلة من 31)
- تحويل من النوع البري وخلايا الخميرة متحولة مع ترميز البلازميد بروتين غير مستقر.
- تطعيم transformants في 5 مل من SD المتوسطة التي هي انتقائية لخلايا إيواء جزيئات البلازميد. احتضان بين عشية وضحاها في 30 درجة مئوية، بالتناوب.
- قياس OD 600 من كل متر مكعب بين عشية وضحاهاlture.
ملاحظة: بعد الحضانة بين عشية وضحاها، قد تكون الخلايا في أي مرحلة النمو لوغاريتمي أو ثابتة ولكن ينبغي أن يكون وصلت إلى OD 600 من شأنها أن تسمح التخفيف إلى OD 600 من 0.2 في 10 مل المتوسطة انتقائية جديدة (الخطوة 2.1.4). قد تتطلب سلالات الخميرة جدا بطيئة النمو مرات حضانة يلة تعد من واحد، أو تلقيح عدد أكبر من الخلايا، كما تحدد تجريبيا. - تمييع خلايا الخميرة إلى OD 600 من 0.2 في 10 مل المتوسطة انتقائية الطازجة.
- الاستمرار في احتضان خلايا في 30 درجة مئوية، بالتناوب أو الهز، وحتى الثقافات التوصل الى OD 600 بين 0.8 و 1.2 (أي هي في نمو منتصف لوغاريتمي).
ملاحظة: إذا كان البروتين غير مستقر من الفائدة هو تحت سيطرة أحد المروجين regulatable، قد تختلف التوقيت الأمثل للتحريض التعبير البروتين والحصاد خلية وفقا لدراسات السابقة أو الملاحظات التجريبية. - جمع 2.5 OD 600 وحدة الثقافة في 15 مل مخروطيآل أنبوب بواسطة الطرد المركزي عند 5،000 x ج لمدة 5 دقائق في درجة حرارة الغرفة. إزالة طاف قبل pipetting أو الطموح.
ملاحظة: واحد OD يعرف 600 وحدة كما كمية الخميرة موجودة في 1 مل من ثقافة في OD 600 من 1.0. حجم الثقافة (في مل) المطلوبة لحصد 2.5 OD 600 وحدة (V) يمكن تحديد باستخدام المعادلة التالية: V = 2.5 OD 600 وحدة / OD قياس 600 - Resuspend الخلايا في 1 مل الماء المقطر. نقل خلايا علقت لأنبوب microcentrifuge.
- بيليه الخلايا بواسطة الطرد المركزي عند 6،500 x ج لمدة 30 ثانية في درجة حرارة الغرفة. إزالة طاف قبل pipetting أو الطموح.
- Resuspend الخلايا في 100 ميكرولتر الماء المقطر pipetting صعودا وهبوطا أو vortexing ل، وإضافة 100 ميكرولتر 0.2 M هيدروكسيد الصوديوم. مزيج من قبل pipetting صعودا وهبوطا. احتضان عينات لمدة 5 دقائق في درجة حرارة الغرفة.
- خلايا بيليه (معظمها لم يصدر بعد البروتينات ولا تزال قابلة للحياة) بواسطة الطرد المركزي عند 18،000 العاشرز لمدة 5 دقائق. إزالة طاف قبل pipetting أو الطموح.
- بيليه resuspend في 50-100 ميكرولتر 1X Laemmli عينة العازلة، والتي سوف ليز الخلايا، من قبل pipetting صعودا وهبوطا أو vortexing ل.
ملاحظة: إزالة طاف القلوية التالية الطرد المركزي وإعادة تعليق لاحق من الخلايا في Laemmli عينة عازلة استخراج البروتينات في الرقم الهيدروجيني متوافقة مع دوديسيل الصوديوم وكبريتات إس دي إس بايج (SDS-PAGE) باستخدام نظام تشغيل عازلة تريس، جليكاين والنشاف الغربي. - لتفسد تماما البروتينات، واحتضان لست] في 95 درجة مئوية لمدة 5 دقائق.
قد تصبح البروتينات تجميع المعرضة لل(مثل البروتينات مع عدة قطاعات عبر الغشاء) غير قابلة للذوبان عندما حضنت في 95 ° C: ملاحظة. ولذلك، ينبغي المحتضنة لست] في درجات حرارة منخفضة (على سبيل المثال 37 ° C - 70 ° C) لمدة 10 - 30 دقيقة، كما تحدد تجريبيا، لتحليل هذه البروتينات. - لست] باردة عن طريق وضع على الجليد لمدة 5 دقائق.
- لست] الطرد المركزي في 18،000 x ج لمدة 1 دقيقة في درجة حرارة الغرفة لتكوير المواد غير القابلة للذوبان. فصل طاف (يذوب البروتين المستخرج) من خلال SDS-PAGE قبل لاحق تحليل لطخة الغربي (القسم 2.2). بدلا من ذلك، لست] تخزينها في -20 ° C.
- بروتوكول النشاف الغربي تمثيلي
- تحميل حجم تصميما تجريبيا لللست] في جل SDS-PAGE.
- تشغيل هلام في 200 V حتى صبغ الجبهة وصلت إلى الجزء السفلي من هلام.
- نقل البروتينات من هلام لفلوريد البولي فينيل (PVDF) الغشاء عن طريق التحويل الرطب في 20 V لل60-90 دقيقة على 4 درجات مئوية.
- كتلة غشاء التي تفرخ في 5٪ الحليب الخالي من الدسم في تريس مخزنة المالحة (TBS)، هزاز، لمدة 1 ساعة في درجة حرارة الغرفة أو بين عشية وضحاها في 4 درجات مئوية.
- صب عرقلة الحل.
- احتضان الغشاء مع الأجسام المضادة الأولية محددة للبروتين من الفائدة (أو علامة حاتمة منها) في 1٪ الحليب الخالي من الدسم في TBS مع 0.1٪ توين-20 (TBS / T) لمدة 1 ساعة في غرفة الشركة المصرية للاتصالاتmperature، هزاز.
- صب حل الأجسام المضادة، وغسل غشاء 3 × 5 دقائق مع TBS / T في درجة حرارة الغرفة، هزاز.
- احتضان الغشاء مع fluorophore مترافق المناسب الضد الثانوية في 1٪ الحليب الخالي من الدسم في TBS / T لمدة 1 ساعة في درجة حرارة الغرفة، هزاز.
ملاحظة: لأن fluorophores حساسة للضوء، ينبغي إعداد التخفيفات من الأجسام المضادة fluorophore مترافق في الظلام. بالإضافة إلى ذلك، ينبغي أن يحدث حضانة الأغشية في وجود الأجسام المضادة fluorophore مترافق في حاويات lightproof. ويمكن تحقيق ذلك عن طريق لف صواني الحضانة في رقائق الألومنيوم. - صب حل الأجسام المضادة، وغسل غشاء 3 × 5 دقائق مع TBS / T في درجة حرارة الغرفة، هزاز.
- الحصول على صورة غشاء باستخدام لى كو أوديسي CLX والبرمجيات صورة استوديو (أو معدات التصوير المماثلة والبرمجيات)، وفقا لتوصيات الشركة المصنعة.
- بعد التصوير الغشاء، واحتضان الغشاء مع الأجسام المضادة الأولية محددة لتحميلالبروتين السيطرة جي في 1٪ الحليب الخالي من الدسم في TBS / T لمدة 1 ساعة في درجة حرارة الغرفة، هزاز.
- صب حل الأجسام المضادة، وغسل غشاء 3 × 5 دقائق مع TBS / T في درجة حرارة الغرفة، هزاز.
- احتضان الغشاء مع fluorophore مترافق المناسب الضد الثانوية في 1٪ الحليب الخالي من الدسم في TBS / T لمدة 1 ساعة في درجة حرارة الغرفة، هزاز.
- صب حل الأجسام المضادة، وغسل غشاء 3 × 5 دقائق مع TBS / T في درجة حرارة الغرفة، هزاز.
- الحصول على صورة غشاء باستخدام لى كو أوديسي CLX والبرمجيات صورة استوديو (أو معدات التصوير المماثلة والبرمجيات)، وفقا لتوصيات الشركة المصنعة.
النتائج
لتوضيح هذه المنهجية، وقد تنصهر الإنزيم HIS3 إلى محطة-كربوكسي من طراز الشبكة الإندوبلازمية (ER) تدهور -associated (ايراد) الركيزة، Deg1 -Sec62 (الشكل 2A) لإنشاء Deg1 -Sec62-HIS3 (الشكل 3) . يمثل Deg1 -Sec62 أحد الأعضاء المؤسسين لفئة جديدة من ركائز ايراد التي تستهدف ...
Discussion
منهجية المقدمة هنا تسمح لتحديد السريع وتأكيدا الكيمياء الحيوية من متطلبات الجينية للتدهور البروتين في خلايا الخميرة. هذه التجارب تبرز فائدة وقوة الخميرة على أنها كائن وحيد الخلية نموذج (عدة مراجعات ممتازة من الخميرة البيولوجيا ومصنفات من بروتوكولات لمناولة وتخزين...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
نشكر أعضاء الحاليين والسابقين في المختبر روبنشتاين لتوفير بيئة بحثية داعمة ومتحمسة. نشكر ريان T. جيبسون للمساعدة في بروتوكول الأمثل. نشكر كافة Hochstrasser (جامعة ييل) وديتر وولف (جامعة شتوتغارت) للسلالات الخميرة والبلازميدات. نشكر المراجعين المجهولين لدينا لمساعدتهم في تحسين وضوح وفائدة هذه المخطوطة. وأيد هذا العمل من قبل على جائزة بحثية من جامعة ولاية الفصل الكرة من سيجما كاي لSGW، والمعاهد الوطنية للصحة منح (R15 GM111713) لإقليم شرق المتوسط، وهي جائزة بحوث جامعة ولاية الكرة أسباير لإقليم شرق المتوسط، وصناديق من جامعة ولاية الكرة مكتب نائب مدير الجامعة وقسم الأحياء.
Materials
| Name | Company | Catalog Number | Comments |
| Desired yeast strains, plasmids, standard medium and buffer components | Yeast strains with desired mutations may be generated in the investigator's laboratory. Wild-type yeast and a variety of mutants are also commercially available (e.g. from GE Healthcare). Plasmids encoding fusion proteins may be generated in the investigator's laboratory. | ||
| 3-amino-1H-1,2,4-triazole | Fisher Scientific | AC264571000 | Competitive inhibitor of His3 enzyme. May be included in medium to increase stringency of growth assay using His3 reporter constructs. |
| Endoglycosidase H (recombinant form from Streptomyces plicatus) | Roche | 11088726001 | May be used to assess N-glycosylation of proteins; compatible with SDS and beta-mercaptoethanol concentrations found in 1x Laemmli sample buffer. |
| Disposable borosilicate glass tubes | Fisher Scientific | 14-961-32 | Available from a variety of manufacturers |
| Temperature-regulated incubator (e.g. Heratherm Incubator Model IMH180) | Dot Scientific | 51028068 | Available from a variety of manufacturers |
| New Brunswick Interchangeable Drum for 18 mm tubes (tube roller) | New Brunswick | M1053-0450 | Tube roller is recommended to maintain overnight yeast starter cultures of yeast cells in suspension. A platform shaker or tube roller may be used to maintain larger cultures in suspension. |
| New Brunswick TC-7 Roller Drum 120V 50/60 H | New Brunswick | M1053-4004 | For use with tube roller |
| SmartSpec Plus Spectrophotometer | Bio-Rad | 170-2525 | Available from a variety of manufacturers |
| Sterile 96-well flat bottom microtest plates with lid individually wrapped | Sarstedt | 82.1581.001 | Available from a variety of manufacturers |
| Pipetman Neo P8x20N, 2-20 μl | Gilson | F14401 | Available from a variety of manufacturers |
| [header] | |||
| Pipetman Neo P8x200N, 20-200 μl | Gilson | F14403 | Single-channel and multichannel pipettors are used at various stages of the protocol. While multichannel pipettors reduce the pipetting burden at several steps, single-channel pipettors may be used throughout the entire protocol. Available from a variety of manufacturers. |
| Centrifuge 5430 | Eppendorf | 5427 000.216 | Rotor that is sold with unit holds 1.5 and 2.0 ml microcentrifuge tubes. Rotor may be swapped for one that holds 15 ml and 50 ml conical tubes. |
| Plate imaging system (e.g. Gel Doc XR+ System) | Bio-Rad | 170-8195 | A variety of systems may be used to image plates, including sophisticated imaging systems, computer scanners, and camera phones. |
| Fixed-Angle Rotor F-35-6-30 with Lid and Adapters for Centrifuge Model 5430/R, 15/50 ml Conical Tubes, 6-Place | Eppendorf | F-35-6-30 | |
| 15 ml screen printed screw cap tube 17 x 20 mm conical, polypropylene | Sarstedt | 62.554.205 | Available from a variety of manufacturers |
| 1.5 ml flex-tube, PCR clean, Natural microcentrifuge tubes | Eppendorf | 22364120 | Available from a variety of manufacturers |
| Analog Dri-Bath Heater | Fisher Scientific | 1172011AQ | Boiling water bath with hot plate may also be used to denature proteins |
| SDS-PAGE running and transfer apparatuses, power supplies, and imaging equipment or darkrooms for SDS-PAGE and transfer to membrane | Will vary by lab and application | ||
| Western blot imaging system (e.g. Li-Cor Odyssey CLx scanner and Image Studio Software) | Li-Cor | 9140-01 | Will vary by lab and application |
| EMD Millipore Immobilon PVDF Transfer Membranes | Fisher Scientific | IPFL00010 | Will vary by lab and application |
| Primary antibodies (e.g. Phosphoglycerate Kinase (Pgk1) Monoclonal antibody, mouse (clone 22C5D8)) | Life Technologies | 459250 | Will vary by lab and application |
| Secondary antibodies (e.g. Alexa-Fluor 680 Rabbit Anti-Mouse IgG (H+L)) | Life Technologies | A-21065 | Will vary by lab and application |
References
- Goldberg, A. L. Protein degradation and protection against misfolded or damaged proteins. Nature. 426, 895-899 (2003).
- Guerriero, C. J., Brodsky, J. L. The delicate balance between secreted protein folding and endoplasmic reticulum-associated degradation in human physiology. Physiological Reviews. 92, 537-576 (2012).
- Pagan, J., Seto, T., Pagano, M., Cittadini, A. Role of the ubiquitin proteasome system in the heart. Circulation Research. 112, 1046-1058 (2013).
- Rubinsztein, D. C. The roles of intracellular protein-degradation pathways in neurodegeneration. Nature. 443, 780-786 (2006).
- Turnbull, E. L., Rosser, M. F., Cyr, D. M. The role of the UPS in cystic fibrosis. BMC Biochemistry. 8, S11 (2007).
- Bedford, L., Lowe, J., Dick, L. R., Mayer, R. J., Brownell, J. E. Ubiquitin-like protein conjugation and the ubiquitin-proteasome system as drug targets. Nature Reviews Drug Discovery. 10, 29-46 (2011).
- Kar, G., Keskin, O., Fraternali, F., Gursoy, A. Emerging role of the ubiquitin-proteasome system as drug targets. Current Pharmaceutical Design. 19, 3175-3189 (2013).
- Paul, S. Dysfunction of the ubiquitin-proteasome system in multiple disease conditions: therapeutic approaches. BioEssays: News and Reviews in Molecular, Cellular and Developmental Biology. 30, 1172-1184 (2008).
- Shen, M., Schmitt, S., Buac, D., Dou, Q. P. Targeting the ubiquitin-proteasome system for cancer therapy. Expert Opinion on Therapeutic Targets. 17 (9), 1091-1108 (2013).
- Finley, D., Ulrich, H. D., Sommer, T., Kaiser, P. The ubiquitin-proteasome system of Saccharomyces cerevisiae. Genetics. 192, 319-360 (2012).
- Scheffner, M., Nuber, U., Huibregtse, J. M. Protein ubiquitination involving an E1-E2-E3 enzyme ubiquitin thioester cascade. Nature. 373, 81-83 (1995).
- Ravid, T., Hochstrasser, M. Diversity of degradation signals in the ubiquitin-proteasome system. Nature Reviews Molecular Cell Biology. 9, 679-690 (2008).
- Hochstrasser, M., Ellison, M. J., Chau, V., Varshavsky, A. The short-lived MAT alpha 2 transcriptional regulator is ubiquitinated in vivo. Proceedings of the National Academy of Sciences of the United States of America. 88, 4606-4610 (1991).
- Hochstrasser, M., Varshavsky, A. In vivo degradation of a transcriptional regulator: the yeast alpha 2 repressor. Cell. 61, 697-708 (1990).
- Bays, N. W., Gardner, R. G., Seelig, L. P., Joazeiro, C. A., Hampton, R. Y. Hrd1p/Der3p is a membrane-anchored ubiquitin ligase required for ER-associated degradation. Nature Cell Biology. 3, 24-29 (2001).
- Hampton, R. Y., Gardner, R. G., Rine, J. Role of 26S proteasome and HRD genes in the degradation of 3-hydroxy-3-methylglutaryl-CoA reductase, an integral endoplasmic reticulum membrane protein. Molecular Biology of the Cell. 7, 2029-2044 (1996).
- Swanson, R., Locher, M., Hochstrasser, M. A conserved ubiquitin ligase of the nuclear envelope/endoplasmic reticulum that functions in both ER-associated and Matalpha2 repressor degradation. Genes & Development. 15, 2660-2674 (2001).
- Goebl, M. G., et al. The yeast cell cycle gene CDC34 encodes a ubiquitin-conjugating enzyme. Science. 241, 1331-1335 (1988).
- Bachmair, A., Finley, D., Varshavsky, A. In vivo half-life of a protein is a function of its amino-terminal residue. Science. 234, 179-186 (1986).
- Chen, P., Johnson, P., Sommer, T., Jentsch, S., Hochstrasser, M. Multiple ubiquitin-conjugating enzymes participate in the in vivo degradation of the yeast MAT alpha 2 repressor. Cell. 74, 357-369 (1993).
- Varshavsky, A. Discovery of the biology of the ubiquitin system. JAMA: The Journal of the American Medical Association. 311, 1969-1970 (2014).
- Heinemeyer, W., Kleinschmidt, J. A., Saidowsky, J., Escher, C., Wolf, D. H. Proteinase yscE, the yeast proteasome/multicatalytic-multifunctional proteinase: mutants unravel its function in stress induced proteolysis and uncover its necessity for cell survival. The EMBO Journal. 10, 555-562 (1991).
- Sommer, T., Jentsch, S. A protein translocation defect linked to ubiquitin conjugation at the endoplasmic reticulum. Nature. 365, 176-179 (1993).
- Hiller, M. M., Finger, A., Schweiger, M., Wolf, D. H. ER degradation of a misfolded luminal protein by the cytosolic ubiquitin-proteasome pathway. Science. 273, 1725-1728 (1996).
- Seufert, W., Jentsch, S. In vivo function of the proteasome in the ubiquitin pathway. The EMBO Journal. 11, 3077-3080 (1992).
- Knop, M., Finger, A., Braun, T., Hellmuth, K., Wolf, D. H. Der1, a novel protein specifically required for endoplasmic reticulum degradation in yeast. The EMBO Journal. 15, 753-763 (1996).
- Zattas, D., Adle, D. J., Rubenstein, E. M., Hochstrasser, M. N-terminal acetylation of the yeast Derlin Der1 is essential for Hrd1 ubiquitin-ligase activity toward luminal ER substrates. Molecular Biology of the Cell. 24, 890-900 (2013).
- Brachmann, C. B., et al. Designer deletion strains derived from Saccharomyces cerevisiae S288C: a useful set of strains and plasmids for PCR-mediated gene disruption and other applications. Yeast. 14, 115-132 (1998).
- Sikorski, R. S., Hieter, P. A system of shuttle vectors and yeast host strains designed for efficient manipulation of DNA in Saccharomyces cerevisiae. Genetics. 122, 19-27 (1989).
- Ralser, M., et al. The Saccharomyces cerevisiae W303-K6001 cross-platform genome sequence: insights into ancestry and physiology of a laboratory mutt. Open Biology. 2, 120093 (2012).
- Kushnirov, V. V. Rapid and reliable protein extraction from yeast. Yeast. 16, 857-860 (2000).
- Rubenstein, E. M., Kreft, S. G., Greenblatt, W., Swanson, R., Hochstrasser, M. Aberrant substrate engagement of the ER translocon triggers degradation by the Hrd1 ubiquitin ligase. The Journal of Cell Biology. 197, 761-773 (2012).
- Mayer, T. U., Braun, T., Jentsch, S. Role of the proteasome in membrane extraction of a short-lived ER-transmembrane protein. The EMBO Journal. 17, 3251-3257 (1998).
- Scott, D. C., Schekman, R. Role of Sec61p in the ER-associated degradation of short-lived transmembrane proteins. The Journal of Cell Biology. 181, 1095-1105 (2008).
- Kim, I., et al. The Png1-Rad23 complex regulates glycoprotein turnover. The Journal of Cell Biology. 172, 211-219 (2006).
- Fisher, E. A., et al. The degradation of apolipoprotein B100 is mediated by the ubiquitin-proteasome pathway and involves heat shock protein 70. The Journal of Biological Chemistry. 272, 20427-20434 (1997).
- Pariyarath, R., et al. Co-translational interactions of apoprotein B with the ribosome and translocon during lipoprotein assembly or targeting to the proteasome. The Journal of Biological Chemistry. 276, 541-550 (2001).
- Yeung, S. J., Chen, S. H., Chan, L. Ubiquitin-proteasome pathway mediates intracellular degradation of apolipoprotein. B. Biochemistry. 35, 13843-13848 (1996).
- Mumberg, D., Muller, R., Funk, M. Regulatable promoters of Saccharomyces cerevisiae: comparison of transcriptional activity and their use for heterologous expression. Nucleic Acids Research. 22, 5767-5768 (1994).
- Bruckner, A., Polge, C., Lentze, N., Auerbach, D., Schlattner, U. Yeast two-hybrid, a powerful tool for systems biology. International Journal of Molecular Sciences. 10, 2763-2788 (2009).
- Amberg, D. C., Burke, D., Strathern, J. N., Burke, D. . Methods in Yeast Genetics: A Cold Spring Harbor Laboratory Course Manual. , (2005).
- Duina, A. A., Miller, M. E., Keeney, J. B. Budding yeast for budding geneticists: a primer on the Saccharomyces cerevisiae model system. Genetics. 197, 33-48 (2014).
- Guthrie, C., Fink, G. R. . Guide to Yeast Genetics and Molecular and Cell Biology. , (2004).
- Sherman, F. Getting started with yeast. Methods in Enzymology. 350, 3-41 (2002).
- Xie, Y., Rubenstein, E. M., Matt, T., Hochstrasser, M. SUMO-independent in vivo activity of a SUMO-targeted ubiquitin ligase toward a short-lived transcription factor. Genes & Development. 24, 893-903 (2010).
- Ravid, T., Kreft, S. G., Hochstrasser, M. Membrane and soluble substrates of the Doa10 ubiquitin ligase are degraded by distinct pathways. The EMBO Journal. 25, 533-543 (2006).
- Metzger, M. B., Maurer, M. J., Dancy, B. M., Michaelis, S. Degradation of a cytosolic protein requires endoplasmic reticulum-associated degradation machinery. The Journal of Biological Chemistry. 283, 32302-32316 (2008).
- Medicherla, B., Kostova, Z., Schaefer, A., Wolf, D. H. A genomic screen identifies Dsk2p and Rad23p as essential components of ER-associated degradation. EMBO Reports. 5, 692-697 (2004).
- Kohlmann, S., Schafer, A., Wolf, D. H. Ubiquitin ligase Hul5 is required for fragment-specific substrate degradation in endoplasmic reticulum-associated degradation. The Journal of Biological Chemistry. 283, 16374-16383 (2008).
- Crouse, G. F. Mutagenesis assays in yeast. Methods. 22, 116-119 (2000).
- Le Douarin, B., Pierrat, B., vom Baur, E., Chambon, F., Losson, R. A new version of the two-hybrid assay for detection of protein-protein interactions. Nucleic Acids Research. 23, 876-878 (1995).
- Boeke, J. D., Trueheart, J., Natsoulis, G., Fink, G. R. 5-Fluoroorotic acid as a selective agent in yeast molecular genetics. Methods in Enzymology. 154, 164-175 (1987).
- Toyn, J. H., Gunyuzlu, P. L., White, W. H., Thompson, L. A., Hollis, G. F. A counterselection for the tryptophan pathway in yeast: 5-fluoroanthranilic acid resistance. Yeast. 16, 553-560 (2000).
- Schafer, A., Wolf, D. H. Endoplasmic reticulum-associated protein quality control and degradation: genome-wide screen for ERAD components. Methods in Molecular Biology. 301, 289-292 (2005).
- Griggs, D. W., Johnston, M. Regulated expression of the GAL4 activator gene in yeast provides a sensitive genetic switch for glucose repression. Proceedings of the National Academy of Sciences of the United States of America. 88, 8597-8601 (1991).
- Duennwald, M. L. Growth assays to assess polyglutamine toxicity in yeast. The Journal of Visualized Experiments. (61), e3791 (2012).
- Baryshnikova, A., et al. Synthetic genetic array (SGA) analysis in Saccharomyces cerevisiae and Schizosaccharomyces pombe. Methods in Enzymology. 470, 145-179 (2010).
- Szymanski, E. P., Kerscher, O. Budding yeast protein extraction and purification for the study of function, interactions, and post-translational modifications. The Journal of Visualized Experiments. (80), e50921 (2013).
- Hjelm, H., Sjodahl, J., Sjoquist, J. Immunologically active and structurally similar fragments of protein A from Staphylococcus aureus. European Journal of Biochemistry. 57, 395-403 (1975).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved