Method Article
فائقة الدقة التصوير من الخلايا القاتلة الطبيعية المناعية المشبك على دعم الزجاج مستو الدهن طبقة ثنائية
In This Article
Summary
We describe here a combination of the glass-supported lipid bilayer technique of forming immunological synapses with the super-resolution imaging technique of stimulated emission depletion (STED) microscopy. The goal of this protocol is to provide users with the instructions necessary to successfully carry out these two techniques.
Abstract
The glass-supported planar lipid bilayer system has been utilized in a variety of disciplines. One of the most useful applications of this technique has been in the study of immunological synapse formation, due to the ability of the glass-supported planar lipid bilayers to mimic the surface of a target cell while forming a horizontal interface. The recent advances in super-resolution imaging have further allowed scientists to better view the fine details of synapse structure. In this study, one of these advanced techniques, stimulated emission depletion (STED), is utilized to study the structure of natural killer (NK) cell synapses on the supported lipid bilayer. Provided herein is an easy-to-follow protocol detailing: how to prepare raw synthetic phospholipids for use in synthesizing glass-supported bilayers; how to determine how densely protein of a given concentration occupies the bilayer's attachment sites; how to construct a supported lipid bilayer containing antibodies against NK cell activating receptor CD16; and finally, how to image human NK cells on this bilayer using STED super-resolution microscopy, with a focus on distribution of perforin positive lytic granules and filamentous actin at NK synapses. Thus, combining the glass-supported planar lipid bilayer system with STED technique, we demonstrate the feasibility and application of this combined technique, as well as intracellular structures at NK immunological synapse with super-resolution.
Introduction
المشبك المناعي (IS) يكمن في مفترق طرق حاسم لتنشيط الخلايا وظيفة 1. ومن أهم وسيلة يتم من خلالها تنفيذ العرض مستضد ومناعة خلوية بها. استخدمت أقرب الدراسات المجهرية من تشكيل المشبك نظام المكورات خلية خلية 2. فإن القيود الرئيسية مع هذا النهج هو أنه سوف ينظر معظم تقارن 'في ملفك الشخصي، كما انها كانت، وبالتالي تقييد وجهة نظر المراقب للهيكل متشابك نفسها. في عام 1999، وتناول المختبر داستن هذا القيد من خلال الاستفادة من المدعومة من الزجاج الدهون طبقة ثنائية (SLB) تقنية 3، الذي كان قد رائدة في وقت سابق من 4،5 مختبر ماكونيل. هذا النهج التخلص من المستضد تقديم الخلايا (ناقلات الجنود المدرعة) لصالح سطح مستو الدهون المدعومة من الزجاج، وإلى البروتينات التي يمكن أن تعلق والتحرك بحرية في بعدين. باستخدام هذه الطريقة، وكان داستن وزملاؤه قادرة على لند مباشرة تصل إلى طنانه المشبك باستخدام عالية الدقة مضان المجهر، وللمرة الأولى الحصول على نظرة "وجها لوجه" في هيكل IS.
مع استخدام نظام SLB، والتفاصيل التي وIS يمكن تصور قيدت فقط بالقيود تقنيات التصوير الحالية 6-8. باستخدام تقنيات الإضاءة القياسية، الحد الأدنى للقرار (أي الحد الأدنى من المسافة بين كائنين متميزة حيث أنها يمكن أن تكون حاليا) وكانت <200 نانومتر على أساس معيار رايلي في 9. هذا الحد يعيق تصوير دقيقة جدا، وهياكل على نطاق والجزيئي التي تشكل المشبك، وحتى تطوير تقنيات التصوير فائقة الدقة 10-12، اقتصر التصور من هذه الهياكل لتصوير الخلايا الثابتة باستخدام المجهر الإلكتروني.
مع ظهور الأخير لمجموعة متنوعة من التقنيات فائقة الدقة، مثل SIM (الإضاءة منظم المجهر)، PALM (photoactivated المجهري التعريب)، STORM (stochastical المجهري إعادة البناء الضوئي)، وSTED 10-12 والمحققين أصبحت الآن قادرة على دراسة هذه الهياكل متشابك بالتفصيل لم يسبق له مثيل، والذي بدوره قدم فهم أوضح متزايد من IS. وقد وصفت مزايا STED المجهري قبل 13. نحن هنا وصف فائقة الدقة التصوير مع STED المجهر مجهزة المطورة حديثا 660 نانومتر استنزاف الليزر. مقارنة التقليدية 592 نانومتر استنزاف ليزر، ليزر 660 نانومتر يسمح لاختيار أوسع من الأصباغ الفلورية (انظر http://nanobiophotonics.mpibpc.mpg.de/old/dyes/)، وخاصة هذه fluorophores الحمراء.
ووصف غيرها من المطبوعات التصوير STED من نقاط الاشتباك العصبي الخلايا القاتلة الطبيعية على الشرائح الزجاجية المغلفة الأجسام المضادة 13،14. هنا، يتم الجمع بين النظام SLB مع فائقة الدقة STED المجهر لدراسة المشبك الخلايا القاتلة الطبيعية. هذا الأسلوب له ميزة على الأضدادالشرائح المغلفة من كونه فسيفساء السوائل، الذي البروتينات السطحية جزءا لا يتجزأ من يمكن ان تتحرك بحرية في سطح ثنائي الأبعاد شقة (الطائرة س ص). هذا يحاكي أكثر بأمانة سطح العضوي والمحمول خلية المستهدفة، وبالتالي أفضل يلخص تشكيل المشبك المناعي ذات الصلة من الناحية الفسيولوجية.
والهدف من هذا البروتوكول هو تزويد المستخدم النهائي مع وصفا مفصلا لكيفية صورة المشبك المناعي للخلايا NK من خلال الجمع بين نظام SLB وفائقة الدقة STED المجهري. وسوف توفر للمستخدم النهائي مع الخطوات اللازمة ل: إعداد الجسيمات الشحمية، وبناء طبقات ثنائية جزءا لا يتجزأ من البروتين، وتحديد كثافة البروتين على طبقات ثنائية الدهون، والحصول على صور فائقة الدقة باستخدام STED المجهري. هذه التقنيات لا تقتصر على مجال علم المناعة، ويمكن استخدامها على نطاق واسع عبر مجموعة متنوعة من التخصصات.
Protocol
1. إعداد الليبوزومات
- حساب كمية الأسهم الحلول مع وقف التنفيذ الكلوروفورم من 1،2-dioleoyl-SN-glycero-3-phosphocholine (DOPC) و1،2-dioleoyl-SN-glycero-3-phosphoethanolamine-N-كاب biotinyl (البيوتين-PE) لجعل الأسهم المخفف في التركيز النهائي المطلوب. لجعل تركيزات النهائي من 400 ميكرومتر DOPC و 80 ميكرومتر الفوسفورية البيوتين-PE في 10 مل لكل منهما، تبدأ من خلال وضع 629 ميكرولتر من 10 ملغ / مل DOPC و 88 ميكرولتر 10 ملغ / مل البيوتين-PE في أنابيب الزجاج اللوني منفصلة.
ملاحظة: من المهم لتنظيف الزجاج المحاقن هاميلتون وأنابيب الزجاج اللوني عن طريق تنظيف الحل (1 L 95٪ من الإيثانول إلى 120 مل من الماء تحتوي على 60 غرام هيدروكسيد البوتاسيوم، KOH)، في حين نقل مع وقف التنفيذ الكلوروفورم حل الأوراق المالية من DOPC والبيوتين-PE. - تجفيف الكلوروفورم مع تيار من الأرجون في غطاء الكيميائية. ختم الأنبوب اللوني التي كتبها بارافيلم.
- إخضاع الجسيمات الشحمية المجفف حديثا إلى فراغ عالية في lyophilizإيه O / N لإزالة أي الكلوروفورم المتبقية. لإنجاز نفس اليوم وجافة ل60-90 دقيقة.
- بينما يمتد مجفاد، وإعداد بعض عازلة التخفيف. لهذا البروتوكول، وإعداد 25 مل يتألف من 25 ملي تريس، ودرجة الحموضة 8.0. 150 مم كلوريد الصوديوم. و2٪ (بالوزن) ن الأوكتيل-β-D-glucopyranoside (OG) المنظفات. مزج المكونات الأولين معا أولا، ثم تهجير الأكسجين مع الأرجون قبل إضافة مسحوق OG الجاف. بعد إعداد، تصفية حل OG مع 0.2 ميكرون السليلوز غشاء خلات، وتخزينها في 4 ° C.
- وبالإضافة إلى ذلك، وإعداد اثنين المسمار أعلى زجاجات من 1 L من العازلة تريس المالحة في نفس التركيزات، ولكن من دون OG. وضع شريط مغناطيسي تنظيفها الماء المقطر في الجزء السفلي من كل. إعداد 6 لترات إضافية من المخزن المؤقت تريس المالحة. إزالة الأكسجين من كل الزجاجات مع الأرجون ووضعها في 4 درجات مئوية أيضا.
- بعد تجفيد، بحل الدهون المجففة في المخزن المؤقت OG تريس المالحة لجعل حل 4 مم لكل منهما. اقتداءمجلدات، إضافة 2 مل إلى أنبوب DOPC، و 0.2 مل إلى أنبوب البيوتين-PE.
- تمزج الدهون البيوتين-PE مع الدهون DOPC. هذا يحسن من التنقل من SLB، كما البيوتين إلى جانب يمكن أن يضعف سيولة المجموعات رئيس الفوسفات. لجعل تركيز النهائي من 80 ميكرومتر البيوتين-PE، مزيج 0.2 مل من 4 ملي البيوتين-PE و 1 مل من 4 ملي DOPC. ثم يضاف 8.8 مل من المخزن المؤقت OG تريس المالحة.
- لتركيز النهائي من 400 ميكرومتر DOPC، ببساطة مزيج 1ml من 4 ملي DOPC مع 9 مل من OG تريس المالحة.
- ملء sonicator مع الماء المثلج. وضع أنبوب زجاجي يحتوي على فسفوليبيد مخففة في وسط sonicator باستخدام المشبك فائدة. يصوتن فسفوليبيد المخفف لمدة 10 دقيقة حتى يصبح حل واضح.
ملاحظة: إضافة الجليد في حمام ماء sonicator للحفاظ على درجة حرارة منخفضة منذ صوتنة سوف تولد الحرارة. - في ملء أنابيب مع الأرجون لتهجير الأوكسجين في الهواء فوق السائل، وختم لهم مع parafilm.
2. غسيل الكلى من الليبوزومات
- قطع قسمين من جفاف غسيل الكلى أنابيب (الوزن الجزيئي قطع: 12-14،000، قطر: 6.4 مم) من طول المناسب (في هذا المثال، 40 سم)، واحد لكل تخفيف فوسفورية، من لفة.
- ترطيب أقسام الأنابيب من خلال السماح لهم نقع في 200 مل من الماء المقطر في دورق زجاجي لمدة 2 دقيقة.
- الميكروويف هذا لمدة 5 دقائق في الإعداد عالية، أو على الأقل حتى يأتي الماء ليغلي.
- ربط عقدة في نهاية واحدة من كل أنبوب وشطف خارج المناطق الداخلية مع عدد قليل ملليلتر من العازلة تريس المالحة OG. بعد ذلك، الضغط بدقة من أكبر قدر من هذا غسل العازلة ممكن لتقليل كمية من العازلة المتبقية في الداخل.
- في غطاء تدفق الصفحي، إضافة الدهون الفوسفاتية المخفف إلى كل أنبوب والمشبك نهايات مفتوحة مع صغير إغلاق الأنبوب غسيل الكلى وذلك لاستبعاد كل الهواء. سوف الكامل الحظر الجوي تتطلب التضحية من حجم صغير من العينة التي كتبها تحامل تحت و# 8220؛ خط المياه ".
- تزج العينات في زجاجات معدة مسبقا من العازلة تريس المالحة دون OG. تهجير الأوكسجين في زجاجة مع الأرجون قبل إعادة الختم ومكان لاثارة O / N عند 4 درجات.
- نقل الأنابيب في زجاجة جديدة من العازلة تريس المالحة دون OG كل 12 ساعة لمدة 3 مرات على الأقل.
- قبل وقت قصير من إزالة الدهون مدال، وإعداد عدد من أنابيب صغيرة داخل أي لقسامة الدهون عن طريق ملء كل مع الأرجون لتهجير الأوكسجين.
- بعد 36 ساعة، واتخاذ زجاجات غسيل الكلى في غطاء تدفق الصفحي وإزالة أنابيب غسيل الكلى من الزجاجات. يكون حفاضة مقاعد البدلاء أو الكأس على يد لجمع الجريان السطحي الرطب.
- قطع أنابيب غسيل الكلى فوق كليب، ثم إزالة مقطع ونقل بعناية الحل الدهون مدال عبر الماصة إلى 1 مل مأخوذة في أنابيب أعدت مسبقا مملوءة بغاز الأرجون على الجليد.
- قسامة حل الحويصلية مائي، استخدم تيار الأرجون لتهجير الأكسجين مرة أخرى أنان كل أنبوب.
- تخزين الجسيمات الشحمية في 4 درجات. لا تجمد.
3. تحديد الأجسام المضادة الكثافة على الدهون طبقة ثنائية
- إعداد سلسلة تخفيف المعقدة البيروكسيديز، الأجسام المضادة fluorescently المسمى، 50 ميكرولتر في حجم لكل التخفيف، في التخصصات التالية: 0 نانومتر (فارغة)، و 10 نانومتر و 50 نانومتر، 100 نانومتر، و 500 نانومتر. (يشار إليها فيما يلي باسم "سلسلة عينة").
- إضافة 1 ميكرولتر من الخرز السيليكا إلى 6 آبار من 96-جيدا ضد أسفل اللوحة. مما لا شك فيه أن يهز حبات جيدا قبل pipetting ل، كما أنها تميل إلى تسوية.
ملاحظة: إذا كان وجود أمر حبات جافة بدلا من تعليقها، اتبع إرشادات الشركة المصنعة لتمييع. - لهذه الخرز، وإضافة 2 ميكرولتر من DOPC مختلط: الفوسفورية Biotinyl في نسبة 1: 1. هل هذا لكل بئر.
- نبض لوحة على vortexer في قوة متوسطة 3 مرات لمدة 10 ثانية كل لتشجيع التفاعل مع الخرز والدهون الفوسفاتية.
- إضافة 150 ميكرولتر من 5٪ CASعين على كل بئر. مزيج جيد من قبل pipetting صعودا وهبوطا ثلاث مرات.
- السماح لوحة احتضان في حل الكازين لمدة 10 دقيقة، ثم يغسل بها. لغسل، وملء كل بئر إلى إجمالي حجم 250 ميكرولتر مع HEPES مخزنة المالحة (HBS) مع ألبومين المصل البشري 1٪ (هائل سعيد أنعم). أجهزة الطرد المركزي في 1،000 x ج لمدة 2 دقيقة. ماصة للخروج والتخلص من أكبر 200 ميكرولتر من طاف، وكرر مرتين ليصبح المجموع ثلاث دورات الغسيل.
- إضافة 50 ميكرولتر من streptavidin في 333 نانوغرام / مل تركيز. نبض لوحة مرة أخرى 3X 10 ثانية، والسماح لها الجلوس على شاكر لمدة 15 دقيقة. غسل 3X كما في الخطوة 6 لإزالة streptavidin غير منضم.
- إضافة 50 ميكرولتر من الأجسام المضادة المعقدة البيروكسيديز fluorescently المسمى من سلسلة تخفيف أعدت سابقا (راجع الخطوة 3.1) إلى كل بئر، واستبدال لوحة على شاكر لمدة 20-30 دقيقة. غسل 3X كما في الخطوة 6 لإزالة الأجسام المضادة غير منضم.
- بعد غسل النهائي، resuspend والخرز في 100 ميكرولتر من HBS / هائل سعيد أنعم 1٪، ثم نقل إلى أنبوب FACS. كرر هذا مرتين لضمان إزالة فعالة من كل حبات من البئر، أي ما مجموعه 300 ميكرولتر، والقيام بذلك لكل بئر.
- جلب الأنابيب مما أدى إلى تدفق عداد الكريات. لقد حان الوقت لقراءتها.
- إضافة 1 قطرة من زجاجة وضع علامة "B" من شدة مضان معايرة (FIC) عدة حبة (يشار إليها فيما يلي باسم "سلسلة القياسية") إلى أنبوب FACS، وتمييع مع 300 ميكرولتر من HBS / هائل سعيد أنعم 1٪.
- قراءة هذا الأنبوب، ولكن لا تسجيل البيانات فقط حتى الآن. في الوقت الراهن، وذلك ببساطة ضمان حبات فارغة وركزت بشكل صحيح. جعل الرسم البياني يظهر مضان من الخرز قياسها في القناة المناسبة، ثم تحول الجهد ليزر الإثارة لأسفل حتى ذروة هو في الجانب الأيسر من الرسم البياني.
- إزالة أنبوب وإضافة 1 قطرة من كل من الأخرى 4 أنابيب في سلسلة (المسمى 1 إلى 4) لنفس الأنبوب. الآن، ضع الأنبوب في الجهاز مرة أخرى، وتسجيل البيانات الناتجة والتي يجب أن تظهر كما 5 قمم مختلفة.
- قراءة كل أنبوب الفردية من سلسلة العينة.
- استخدام برامج التحليل FACS، رسم بوابة تمتد على كامل عرض كل قمة في سلسلة الرسم البياني القياسية عند نقطة نصف القصوى. هذا هو بوابة واحدة لكل الذروة. تفعل الشيء نفسه لكل عينة. لاحظ MFI (متوسط كثافة مضان) لكل البوابة.
- باستخدام مدخلات برنامج جداول البيانات القيم المقاسة مؤسسات التمويل الأصغر في المكان المناسب. أيضا إدخال MESF (جزيئات قابلة للذوبان تألقي المكافئة) القيم (متوسط عدد جزيئات الفلورسنت طلاء كل حبة) لكل زجاجة في سلسلة القياسية. يمكن العثور على هذه المعلومات عن طريق اتباع التعليمات على البلاستيك جرة جاءت الأنابيب في.
- استخدام جداول البيانات ورسم MFI ضد القيم MESF، وخلق علاقة خطية بين عدد من fluorophores وكثافة يقاس.
- استخدام وحدة من "البروتينات وتسميات" في معمل حجم الصغيرة لتحديد نسبة الصبغة إلى proالبروتين في الجسم المضاد المسمى.
- المدخلات كفاءة وضع العلامات من البروتين العينة، ومتوسط قطرها من الخرز المغلفة مع الدهون، وقيمة MFI لكل إدخال. سوف جدول البيانات تلقائيا استخدام الصيغة من الرسم البياني خط إنشاؤها في الخطوة 3.16 لحساب القيم MESF لكل تخفيف البروتين وكثافة البذر من البروتين في كل عينة التركيز.
4. عزل والتثقيف NK الإنسان خلايا
- قسامة 15 مل الدم المحيطي أو معطف بافي إلى 50 مل أنبوب مخروطي الشكل. تمييع هذا الدم مع PBS تحتوي على 1٪ FBS في نسبة 1: 1.
- إضافة 13 مل من Ficoll بلطف إلى أسفل الأنبوب مع 10 مل ماصة المصلية.
- الطرد المركزي هذا الأنبوب لمدة 20 دقيقة في 1،200 x ج مع دواسة البنزين وقطع أو في أدنى إعداداتها.
- بعد الطرد المركزي، واستخدام ماصة المصلية لجمع غائم الطبقة الوسطى البيضاء العائمة من خلايا الدم وحيدات النوى المحيطية (PBMCs)، ثhich يجب الجلوس والتقاطع بين الطبقة العليا صفراء واضحة وأكثر غائم شاحبة بلون الطبقة السفلى، وكلاهما يجلس فوق طبقة الأدنى من خلايا الدم الحمراء (كرات الدم الحمراء). ملاحظة لا لجمع أي كرات الدم الحمراء في جمع PBMCs.
- ضع PBMCs التي تم جمعها في 50 مل أنبوب مخروطي الشكل الجديد، وتمييع للقدرة مع برنامج تلفزيوني يحتوي على 1٪ FBS. الطرد المركزي مرة أخرى، وهذه المرة مع الفرامل ودواسة البنزين على الحد الأقصى، لمدة 5 دقائق في 300 × ز.
- تجاهل طاف و resuspend الخلايا في 10 مل من برنامج تلفزيوني يحتوي على 1٪ FBS.
- عدد الخلايا في حين الطرد المركزي مرة أخرى في نفس الإعدادات كما في الخطوة 4.6.
- تجاهل طاف مرة أخرى، وresuspend الخلايا في R10 المتوسطة في مناطق ذات كثافة من 10 مليون خلية / مل.
- يستغرق 30 مليون خلية في أنبوب البوليسترين 5 مل، وعزل خلايا NK استخدام عدة الفصل المغناطيسي، في أعقاب تعليمات الشركة الصانعة. وبعد العزلة، عد الخلايا أكثر واحد و resuspend في كثافة 500،000 خلية / مل في R10 المتوسطة كاملة (88٪ RPMI، و 10٪ FBS، 1٪ HEPES، 1٪ البيروفات الصوديوم) تستكمل مع IL-2 (100 U / مل). الثقافة عند 37 درجة في CO 2 الحاضنة، واستبدال المتوسطة 2-3 مرات أسبوعيا.
5. تجميع بدعم الزجاج مستو الدهن طبقة ثنائية
- إعداد 100 مل من محلول البيرانا عن طريق خلط 30٪ بيروكسيد الهيدروجين مع حمض الكبريتيك بنسبة 1: 3 في كوب.
ملاحظة: دائما تحمل بأعمال مع وكلاء الضارة مثل حمض الكبريتيك في غطاء الدخان الكيميائية المعينة بشكل صحيح. - إلى هذا الحل، تزج 2 مستطيلة # 1.5 coverslips في حل سمكة البيرانا لمدة 20-30 دقيقة.
ملاحظة: من الضروري لتنظيف لل coverslips التي كتبها حل سمكة البيرانا. - بينما يجري تنظيفها لل coverslips، واتخاذ 1 أنبوب للمعدة مسبقا 400 ميكرومتر الدهون DOPC و1 أنبوب للمعدة مسبقا 80 ميكرومتر الدهون البيوتين-PE. نقلها على الجليد إلى خزان الأرجون.
- تهجير الأوكسجين في أنبوب microcentrifuge جديد مع الأرجون،ثم إضافة معا DOPC والبيوتين-PE في نسبة 1: 1. سوف تختلف حجم معين بناء على احتياجات التجريبية، ولكن ينبغي أن يكون في الحد الأدنى 2 ميكرولتر لكل منهما. تهجير الأوكسجين في أنبوب الخليط مرة أخرى مع غاز الأرجون، وأنابيب كاشف الفردية أيضا، قبل ان يعود هذا الأخير إلى الثلاجة.
- بعد الانتهاء أنهم التنظيف، وشطف جيدا لل coverslips مع الماء المقطر. تعيين لل coverslips إلى الهواء الجاف لبضع دقائق.
- سحب 1.5 ميكرولتر من خليط الحويصلية أعدت في الخطوة 5.4 وقسامة في قطرة واحدة في واحدة من غرف حارة من الشريحة الغرفة. استخدام قطرات 2 في حارة هو نموذجي، ولكن ليس من الضروري.
- بسرعة وكفاءة وضع ساترة الجافة على قطرات. تأكد من أن قطرات متباعدة بما فيه الكفاية بحيث لا تندمج مرة واحدة يتم وضع ساترة. وعلاوة على ذلك، تأكد من أن تبقى قطرات دائرية واضحة المعالم، دون لمس حواف جدران الغرفة. اضغط لأسفل بشدةفي ما بين وحول كل حارة لضمان وجود خاتم للماء بين ساترة والشريحة.
- بمناسبة مواقف قطرات باستخدام قلم علامة
- تمرير 100 ميكرولتر من مائي 5٪ الكازين من خلال غرفة لمنع طبقة ثنائية. محاولة للتأكد من أن عدم وجود فقاعات في غرفة تدفق.
- ضخ 100 ميكرولتر من streptavidin بتركيز 333 نانوغرام / مل في كل حارة. احتضان لمدة 10-15 دقيقة في RT. بعد ذلك، ويغسل عن طريق تشغيل 3 مل من HBS / هائل سعيد أنعم 1٪ خلال كل حارة لإزالة streptavidin الزائد.
- إضافة 100 ميكرولتر من المعقدة البيروكسيديز fluorescently المسمى معاداة CD16 مثل اليكسا فلور 568 في تركيز البروتين التي سبق تحديدها لتكون أكثر فعالية في القسم 3. احتضان في الظلام لمدة 20-30 دقيقة. يغسل مرة أخرى عن طريق تشغيل 3 مل من HBS / هائل سعيد أنعم 1٪ خلال كل حارة.
- تدفق 100 ميكرولتر من D-البيوتين بتركيز 25 نانومتر من خلال الغرفة من أجل ربط أي streptavidin الزائدة وبالتالي القضاء على فرصة غير محددة وملزمة للشارعreptavidin إلى الخلايا.
- عدد الخلايا القاتلة الطبيعية و resuspend بتركيز 500،000 / مل في HBS / هائل سعيد أنعم 1٪.
- بينما الغزل أسفل الخلايا، وغسل D-البيوتين للخروج من الغرفة مع 3 مل أخرى من HBS / هائل سعيد أنعم 1٪ في حارة.
- تحقق تنقل بروابط على SLB التي كتبها الانتعاش مضان بعد photobleaching من (FRAP) على مجموع مضان انعكاس الداخلي (TIRF) أو المجهري متحد البؤر قبل إضافة خلايا NK.
- وبمجرد الانتهاء من خلايا الغزل وتم معلق على التركيز المطلوب، إضافة 100 ميكرولتر من كل حارة.
- وضع الغرفة في 37 درجة 5٪ CO 2 الحاضنة لمدة 30-60 دقيقة.
- بعد هذه الفترة الحضانة، وإصلاح الخلايا مع بارافورمالدهيد 4٪ في RT لمدة 10-20 دقيقة. يغسل عن طريق تشغيل 3 مل من برنامج تلفزيوني من خلال كل حارة لإزالة امتصاص العرق.
- إضافة 400 ميكرولتر العازلة حظر (5٪ مصل حمار عادي و 0.2٪ Tritron X-100 في برنامج تلفزيوني). في احتضان RT لمدة 30 دقيقة.
- وصمة عار F-الأكتين وperforin التي كتبها adدينغ 200 ميكرولتر من المخفف phalloidin fluorescently المسمى (1 وحدة / phalloidin المسمى مل)، وfluorescently المسمى-مكافحة perforin ماب (500 نانوغرام / مل ماب مكافحة perforin). في احتضان RT لمدة 1 ساعة.
- يغسل عن طريق تشغيل 3 مل من برنامج تلفزيوني. غرفة جاهزة للتصوير.
6. التصوير من المشبك NK على الدهون طبقة ثنائية باستخدام STED
- تشغيل جميع وحدات الأجهزة اللازمة.
- بدء برنامج تحليل الصور. تمكين كل من المسح الرنانة وحدات STED. بعد إجراء هذه الاختيارات، والانتظار لمدة 3-5 دقيقة للبرنامج لبدء.
- انقر على "تكوين" التبويب في أعلى الشاشة.
- حدد "الليزر التكوين" ثم قم بتشغيل الضوء الأبيض وSTED 592 الليزر نانومتر.
- اختيار هدف 100X، ومحاذاة شعاع الليزر الإثارة مع 592 نانومتر استنزاف الليزر.
- حدد "الليزر التكوين" وحدة، وإيقاف استنزاف 592الليزر، وبدوره على 660 نانومتر استنزاف الليزر.
- ضع الشريحة على المسرح، خلال العدسة. جعل الخلايا ملزمة على المنطقة طبقة ثنائية ترسيمها في التركيز باستخدام مصباح الضوء الأبيض وخلال oculars.
- العودة إلى "شراء" علامة التبويب، مباشرة على يمين "تكوين" علامة التبويب.
- انقر على "التبديل إلى Whitelight مبيض" علامة التبويب، ثم تتحول هذه الوحدة على واسحب خط الإثارة الليزر إلى الطول الموجي المناسب.
- حدد كاشف المطلوب من القائمة من تلك المتاحة، ثم تعيين نطاق الكشف لتشمل مجموعة مناسبة من الأطوال الموجية.
ملاحظة: NEVER وضع اكتشاف مجموعة مباشرة تحت شعاع الإثارة. - انقر على زر "Seqential" في اليد اليسرى "اكتساب" شريط الأدوات لإحضار الحوار الضوئي متسلسل في الجزء السفلي من شريط الأدوات الأيسر. وهذا يسمح للمستخدم بإضافة تسلسل متعددة، كلمع شعاع الإثارة مختلف للون مختلف. انقر على "بين الإطارات"، ثم قم بتعيين تردد الإثارة، كاشف، واكتشاف مجموعة لكل لون إضافي كما في الخطوات 6.9 و 6.10.
- مرة واحدة يتم تحسين جميع الإعدادات، وضرب "ابدأ" لبدء عملية الاستحواذ.
- تطبيق برنامج إزالة التفاف الحر (هيغنز) باستخدام إعداد مصممة لإزالة التفاف STED، كما هو موضح سابقا (13).
النتائج
ويبين الشكل 1 نتيجة كثافة الأجسام المضادة على طبقة ثنائية المادة الدهنية. المبدأ هو استخدام الخرز القياسية لجعل منحنى مستوى MESF مقابل مؤسسات التمويل الأصغر عن طريق التدفق الخلوي (A). تم تحويل مؤسسات التمويل الأصغر من سلسلة العينة إلى MESF باستخدام منحنى القياسية. ويرتبط كثافة الأجسام المضادة على طبقة ثنائية المادة الدهنية خطيا مع تركيز الأجسام المضادة (B). الشكل 2 مشاهدة الثلاثي لون STED صورة NK المشبك على الزجاج دعم مستو الدهون طبقة ثنائية. مكافحة CD16 الأجسام المضادة على طبقة ثنائية الدهون يتراكم، مما اثار تشكيل-F الأكتين والاستقطاب والاختراق من perforin من خلال شبكة F-أكتين في لوحة الوصل من المشبك المناعي في الخلايا القاتلة الطبيعية. باستخدام هذا النهج مجتمعة، يمكن للمرء أن يلاحظ نظيفة وmicroclusters من fluorescently المسمى معاداة CD16 داخل SLB، والذي يعكس بشكل مباشر على تجميع CD16 على الخلايا القاتلة الطبيعية. مقارنة مع صورة متحد البؤر التقليدية، وهيكل CD16 سنتراوتمييزها ل العنقودية بسهولة أكبر في الصورة STED بسبب مضان المحيطة المنضب. وعلاوة على ذلك، يعتبر التركيب الدقيق للالهيكل الخلوي الأكتين مع تحسن كبير في القرار. وانسجاما مع الملاحظات السابقة 16،17، وينظر حبيبات التحللي-perforin إيجابي وضعه فوق مناطق منخفضة الكثافة F-أكتين في الصورة STED، تفصيل الحاسم الذي يتم فقدان معظمها في صورة مبائر.
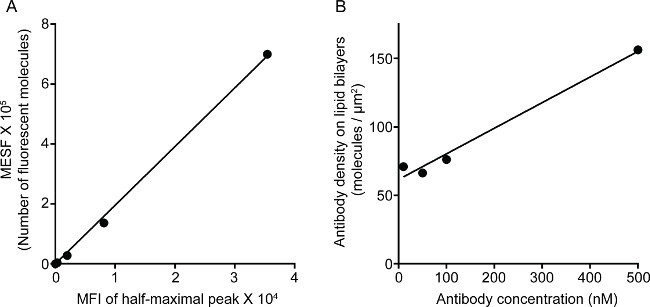
الشكل 1. كثافة 3G8 الأجسام المضادة على طبقة ثنائية الدهون. (A) الخطي علاقة بين MESF ومؤسسات التمويل الأصغر لسلسلة القياسية. (B) الخطي علاقة بين كثافة البروتين وتركيز لسلسلة البروتين عينة التخفيف، والتي تبين عدد أحادية البروتين fluorescently المسمى في وحدة المساحة بوصفها وظيفة من زيادة التركيز على الدهون المغلفة سيحبات LICA.
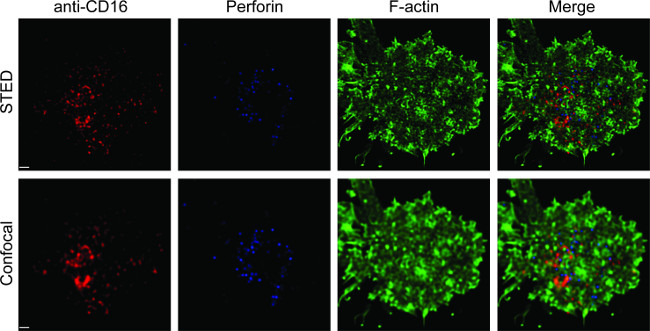
الشكل 2. STED تصوير NK المشبك على مستو الدهون طبقة ثنائية. وقد حفز خلايا NK الابتدائية على SLB تحتوي المعقدة البيروكسيديز fluorescently المسمى مكافحة CD16 (الحمراء)، ثابتة، permeabilized، ومن ثم ملطخة phalloidin (الأزرق) ومعاداة F-الأكتين (الأخضر). تم تصويرها خلية فردية أولا تحت الإعداد متحد البؤر العادي، ومن ثم الإعداد STED. تم deconvoluted الصور مبائر وSTED باستخدام برنامج هيغنز. على نطاق وبار، و1 ميكرون. انقر هنا للحصول على نسخة أكبر من هذا الرقم.
Discussion
حداثة من الدراسة الحالية هو أنه يجمع بين تقنية SLB مع STED لدراسة نقاط الاشتباك العصبي الخلايا القاتلة الطبيعية. وقد تصوير الدراسات السابقة طبقة ثنائية الدهون مع TIRF لدراسة الخلايا التائية تشكيل المشبك 8 ويشير الاتجار جزيء على غشاء البلازما 6. ووصف آخرون STED التصوير من نقاط الاشتباك العصبي الخلايا القاتلة الطبيعية باستخدام الشرائح الزجاجية المغلفة الأجسام المضادة 13،14. طريقة الهجين موضح إضافية هنا يبني على هذه الجهود عن طريق التصوير المشبك الخلايا القاتلة الطبيعية مع وضوح معزز التي يوفرها فائقة القرار التصوير على سطح طبقة ثنائية المادة الدهنية، والتي نماذج أفضل سطح ديناميكي من APC.
وعلى الرغم من SLBs هي الأغشية الاصطناعية التي تفتقر إلى من الهيكل الخلوي، الطوافات الدهنية، وبروابط أخرى أن الخلايا المستهدفة الفعلية أو ناقلات الجنود المدرعة تملك، ويمكن هذا الأسلوب ألخص الميزات الهامة مثل التنقل وتوجه بروابط. وهذا يسمح للنظام SLB لتكون بمثابة المقاربة الاختزالية في تشريح رانه مساهمة مستقبلات الفردية وبروابط لتشكيل IS وديناميات IS. أهم سمة من SLBs هو أن الباحثين لا يمكن الجمع بين هذه التقنية مع النهج التصوير عالية الدقة، مثل الفحص المجهري متحد البؤر وTIRF. إدخال STED المجهري يزيد أبعد من ذلك هذه الميزة، وتوفير رؤى غير مسبوقة في IS البحوث والتطبيقات السريرية.
أحد الانتقادات المحتملة لهذا النظام هو أن SLB لا تحاكي بشكل كاف سطح معقدة من APC، مما أدى بالتالي إلى الخصائص التشريحية يحتمل أن تكون غير الفسيولوجية في نقاط الاشتباك العصبي الناتجة عن ذلك. ولئن كان صحيحا أن مرجع محدود من جزيئات على سطح SLB لا ألخص بشكل كامل سطح بتباين بالسكان من APC، وهذا يمكن الحد أيضا يكون من المفيد في أنه يسمح للمحققين لتحديد تأثير مستقبلات ويجند الفردية التفاعلات على تشكيل المشبك .
تيوهنا عدة خطوات حاسمة في هذه العملية. من بين الأكثر أهمية هو أن تمنع الأكسدة التي من الجسيمات الشحمية من خلال باستمرار باستخدام الأرجون لتهجير الأوكسجين في أنبوب والحل، كما هو الحال في الخطوات 1.10، 2.6، و 2.11. سوف أكسدة الدهون يؤدي إلى التنقل الدهون انخفضت، مما يعوق قدرة البروتينات السطحية على التحرك بحرية والمشاركة في هيكلة متشابك. وبالمثل، بل هو أيضا حاسما لإزالة كافة الكلوروفورم في الحويصلية بالتجفيد (الخطوة 1.2). في تحديد كثافة البروتين في طبقة ثنائية الدهون، فإنه من الأهمية لتفريق أول حبات السيليكون في تعليق متجانسة خالية من التكتلات. إذا لزم الأمر، صوتنة من الخرز يمكن تطبيقها. في تجميع SLB، والخطوات الأولى (5،1-5،8) حيث يتم تنظيف لل coverslips، يتم وضع قطرات، والملصقة ساترة حيوية. وهناك خطأ في أي من هذه يمكن أن يستلزم بدء التجربة على مدى (من بداية القسم 5). لهذا السبب، فمنالممارسة الجيدة لتنظيف أكثر من coverslips سوف تكون هناك حاجة لتوفير الوقت في حالة وجود حادث.
غير التجميع هو القضية الأكثر شيوعا عند العمل مع هذا النظام. إذا، عندما تصور الخلايا في الخطوة النهائية، واحد فشل في العثور على أي نقاط الاشتباك العصبي الفلورسنت، وهناك بعض الخطوات التي يمكن اتخاذها. وصمة عار أخرى لوما شابه ذلك مستقبلات سطح الخلية ويمكن أن يضاف إلى غرفة للتحقق من أن الخلية لم تشكيل المشبك مع طبقة ثنائية، في حين أن الخلايا يمكن أن تنضم غير خصيصا لساترة الزجاج أو طبقة ثنائية السطح، ينبغي البروتينات السطحية تشارك synaptically- تظهر مجموعات متميزة كما في الطائرة من واجهة خلايا طبقة ثنائية، في حين يجب أن تظهر البروتينات السطحية unengaged تلطيخ منتشر كما حول محيط الخلية. يجب أن تفشل هذه الطريقة، ينبغي للمرء أن تحقق زنزاناتهم عن طريق التدفق الخلوي لضمان معينة علامة واحدة وتأمل ما يعبر عنه في وفرة كافية على سطح الخلية للدراسة. معين المتواجد السطحومن المعروف الإضافية لتكون ينظم إلى أسفل على المدى الطويل في الثقافة الجسم الحي.
في حين أن هذا تفاصيل بروتوكول وجه التحديد كيفية تصور NK تشكيل المشبك خلية، ونظام SLB يمكن استخدامها لدراسة تشكيل المشبك في أي خلية مناعية يمكن تخيلها ببساطة عن طريق استبدال يجند الأساسي في الخطوة 5.11. يمكن أيضا إضافة بروابط متعددة في نفس الوقت. واحد أيضا ليس من الضروري استخدام نظام streptavidin البيوتين عن التمسك البروتينات السطحية داخل طبقة ثنائية. النيكل وNTA: التفاعلات الحامض الاميني هي أيضا قابلة للحياة. ولكن نظرا لقوة عالية وخصوصية streptavidin: التفاعل البيوتين، مختبرنا يفضل هذا النظام. يمكن للمرء أن تختلف أيضا تركيز خلايا أضاف على طبقة ثنائية من الكثافة المقررة في الخطوة 5.13، فضلا عن مدة فترة حضانة لاحقة من أجل مراقبة نقاط الاشتباك العصبي في مراحل مختلفة من النضج. حتى يمكن أن يتم ذلك على الهواء مباشرة، على الرغم من أن هذا بالطبع يستبعد إمكانية تصور شارع داخل الخلاياuctures (إلا إذا وصفت بالفعل أنها مع علامة فلوري تنصهر، يستخدم المختبر لدينا عدد قليل من هذه خطوط الخلايا المتغيرة). يرجع ذلك إلى درجة عالية من التخصيص ممكن في هذا البروتوكول، يمكن للمرء استخدام تقنية SLB الأساسية، جنبا إلى جنب مع التصوير STED، لمعالجة مجموعة متنوعة بشكل لا يصدق من الأسئلة في علم المناعة وعلم الأحياء الخلوي، والكيمياء الحيوية، بما في ذلك ديناميات الدهون الأساسية 15، تشكيل المشبك 16، داخل الخلايا مما يشير إلى 17، والخلايا السرطانية الانبثاث 18.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Emily Mace and Malini Mukherjee for imaging and deconvolution analysis. Work in the Liu laboratory was supported in part by the Baylor-UTHouston Center for AIDS Research Core Support Grant number AI36211 from the National Institute of Allergy and Infectious Diseases, the Caroline Wiess Law Fund for Research in Molecular Medicine, Texas Children’s Hospital Pediatric Pilot Research Fund, and the Lymphoma SPORE Developmental Research Program from Baylor College of Medicine and the Methodist Research Institute.
Materials
| Name | Company | Catalog Number | Comments |
| 18:1 (Δ9-Cis) PC (DOPC) 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti | 850375C | Liposome preparation |
| 18:1 Biotinyl Cap PE 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl) (sodium salt) | Avanti | 870273C | Liposome preparation |
| Argon gas, compressed | Airgas | UN1006 | Liposome preparation |
| A lyophilizer | Labconco | Freezone 7740020 | Liposome preparation |
| Lyophilizer tubes | Labconco | 7540200 | Liposome preparation |
| Chromatography Columns | Santa Cruz | sc-205558 | Liposome preparation |
| 1 M Tris pH 8.0 | Ambion | AM9856 | Liposome preparation |
| 5 M NaCl | Ambion | AM9759 | Liposome preparation |
| Octyl-β-D-glucopyranoside | Sigma-Aldrich | O1008 | Liposome preparation |
| Dialysis tubing | Spectrum Labs | 132676 | Liposome preparation |
| 96-well V-bottom polystyrene plate (untreated) | Corning | 3896 | antibody density determination |
| Non-functionalized silica beads | Bangs Laboratories | SS06N | antibody density determination |
| FACS tubes | Fisher Scientific | 14-959-2A | antibody density determination |
| QuantumTM MESF beads | Bangs Laboratories | Variable | antibody density determination |
| Casein | Sigma-Aldrich | C0875 | Lipid bilayer preparation |
| HEPES buffered saline + 1% HSA | Homemade | Lipid bilayer preparation | |
| Streptavidin | Life technologies | 434301 | Lipid bilayer preparation |
| Fluorescently-labeled biotinylated protein | Homemade | Lipid bilayer preparation | |
| ibidi Sticky-Slide VI 0.4 | ibidi | 80608 | Lipid bilayer preparation |
| 25x75 mm glass coverslip | ibidi | 10812 | Lipid bilayer preparation |
| Hydrogen peroxide (30%) | Fisher Scientic | BP2633 | Lipid bilayer preparation |
| Sulfuric acid | Sigma-Aldrich | 258105 | Lipid bilayer preparation |
| D-Biotin | Invitrogen | B20656 | Lipid bilayer preparation |
| Lens paper | VWR | 54826-001 | For imaging |
| Type F Immersion Oil | Leica | 11 513 859 | For imaging |
| A Leica TCS STED microscope | Leica | For imaging |
References
- Dustin, M. L., Long, E. O. Cytotoxic immunological synapses. Immunol. Rev. 235 (1), 24-34 (2010).
- Monks, C. R., Freiberg, B. A. K. u. p. f. e. r. H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Hafeman, D. G., von Tscharner, V., McConnell, H. M. Specific antibody-dependent interactions between macrophages and lipid haptens in planar lipid monolayers. Proc Natl Acad Sci USA. 78 (7), 4552-4556 (1981).
- Tscharner, V., McConnell, H. M. Physical properties of lipid monolayers on alkylated planar glass surfaces. Biophys J. 36 (2), 421-427 (1981).
- Crites, T. J., Chen, L., Varma, R. A TIRF microscopy technique for real-time, simultaneous imaging of the TCR and its associated signaling proteins. J. Vis. Exp. , (2012).
- Prins, K. C., Vasiliver-Shamis, G., Cammer, M., Depoil, D., Dustin, M. L., Hioe, C. E. Imaging of HIV-1 envelope-induced virological synapse and signaling on synthetic lipid bilayers. J. Vis. Exp. , (2012).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. , (2008).
- Michalet, X., Weiss, S. Using photon statistics to boost microscopy resolution. Proc. Natl. Acad. Sci. U. S. A. 103 (13), 4797-4798 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu. Rev. Biochem. 78, 993-1016 (2009).
- Lippincott-Schwartz, J., Manley, S. Putting super-resolution fluorescence microscopy to work. Nat. Methods. 6 (1), 21-23 (2009).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J. Vis. Exp. , (2014).
- Rak, G. D., Mace, E. M., Banerjee, P. P., Svitkina, T., Orange, J. S. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Leutenegger, M., Ringemann, C., Lasser, T., Hell, S. W., Eggeling, C. Fluorescence correlation spectroscopy with a total internal reflection fluorescence STED microscope (TIRF-STED-FCS). Opt Express. 20 (5), 5243-5263 (2012).
- Liu, D., Bryceson, Y. T., Meckel, T., Vasiliver-Shamis, G., Dustin, M. L., Long, E. O. Integrin-dependent organization and bidirectional vesicular traffic at cytotoxic immune synapses. Immunity. 31 (1), 99-109 (2009).
- Liu, D., Peterson, M. E., Long, E. O. The adaptor protein Crk controls activation and inhibition of natural killer cells. Immunity. 36 (4), 600-611 (2012).
- Wu, J. C., et al. Antibody conjugated supported lipid bilayer for capturing and purification of viable tumor cells in blood for subsequent cell culture. Biomaterials. 34 (21), 5191-5199 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved