Method Article
Super-resolución de imagen de la célula Natural Killer inmunológica Synapse en un apoyada-Glass planar bicapa lipídica
En este artículo
Resumen
We describe here a combination of the glass-supported lipid bilayer technique of forming immunological synapses with the super-resolution imaging technique of stimulated emission depletion (STED) microscopy. The goal of this protocol is to provide users with the instructions necessary to successfully carry out these two techniques.
Resumen
The glass-supported planar lipid bilayer system has been utilized in a variety of disciplines. One of the most useful applications of this technique has been in the study of immunological synapse formation, due to the ability of the glass-supported planar lipid bilayers to mimic the surface of a target cell while forming a horizontal interface. The recent advances in super-resolution imaging have further allowed scientists to better view the fine details of synapse structure. In this study, one of these advanced techniques, stimulated emission depletion (STED), is utilized to study the structure of natural killer (NK) cell synapses on the supported lipid bilayer. Provided herein is an easy-to-follow protocol detailing: how to prepare raw synthetic phospholipids for use in synthesizing glass-supported bilayers; how to determine how densely protein of a given concentration occupies the bilayer's attachment sites; how to construct a supported lipid bilayer containing antibodies against NK cell activating receptor CD16; and finally, how to image human NK cells on this bilayer using STED super-resolution microscopy, with a focus on distribution of perforin positive lytic granules and filamentous actin at NK synapses. Thus, combining the glass-supported planar lipid bilayer system with STED technique, we demonstrate the feasibility and application of this combined technique, as well as intracellular structures at NK immunological synapse with super-resolution.
Introducción
La sinapsis inmunológica (IS) se encuentra en una coyuntura crítica para la activación de las células y la función 1. Es el medio principal por el cual la presentación de antígenos y la inmunidad mediada por células se llevan a cabo. Los estudios microscópicos tempranos de la formación de sinapsis utilizan un sistema conjugado célula-célula 2. La principal limitación de este enfoque es que la mayoría de los conjugados será visto 'en el perfil', por así decirlo, restringiendo así la vista del observador de la propia estructura sináptica. En 1999, el laboratorio Dustin dirigida esta limitación mediante la utilización de la técnica de 3 bicapa lipídica apoyado de vidrio (SLB), que había sido pionero anteriormente por el laboratorio de 4,5 McConnel. Este enfoque dispuesto de las células presentadoras de antígenos (APC) en favor de una superficie plana apoyado lípidos de vidrio, en la que las proteínas se podrían unir y se mueven libremente en dos dimensiones. Usando este método, Dustin y sus colegas fueron capaces de mirar directamente hacia arriba en tél sinapsis mediante microscopía de fluorescencia de alta resolución, y por primera vez conseguir una mirada "cara a cara" en la estructura de la SI.
Con el uso del sistema SLB, el detalle con que la SI puede ser visualizado se ha restringido solamente por las limitaciones de las técnicas de imagen actuales 6-8. El uso de técnicas de iluminación estándar, la resolución mínima (es decir, la distancia mínima entre dos objetos distintos en el que se pueden distinguir) ha sido <200 nm sobre la base del criterio de Rayleigh 9. Este límite impide la formación de imágenes de estructuras a escala molecular muy finos que componen la sinapsis, y hasta el desarrollo de técnicas de imagen super-resolución 10-12, la visualización de estas estructuras se limita a la obtención de imágenes de células fijadas mediante microscopía electrónica.
Con el reciente advenimiento de una variedad de técnicas de super-resolución, como SIM (microscopía de iluminación estructurada), PALM (microscopía fotoactivado localización), STORM (microscopía óptica reconstrucción estocástico), y STED 10-12, los investigadores pueden ahora estudiar estas estructuras sinápticas en un detalle sin precedentes, que tiene a su vez proporciona una comprensión cada vez aclarado de la SI. Las ventajas de microscopía STED se han descrito antes del 13. Aquí describimos super-resolución de imagen con microscopía STED equipado con el láser de 660 nm agotamiento de nuevo desarrollo. En comparación con el láser convencional agotamiento de 592 nm, el láser de 660 nm permite una selección más amplia de colorantes fluorescentes (ver http://nanobiophotonics.mpibpc.mpg.de/old/dyes/), especialmente en estos fluoróforos rojos.
Otras publicaciones han descrito la imagen STED de las sinapsis de las células NK en portaobjetos de vidrio recubiertas de anticuerpos 13,14. Aquí, el sistema SLB se combina con super-resolución STED microscopía para estudiar la sinapsis de las células NK. Esta técnica tiene la ventaja sobre anticuerpoportaobjetos recubiertos de ser un mosaico fluido, en el que las proteínas de la superficie embebidos pueden moverse libremente en una superficie bidimensional plana (plano xy). Esto imita más fielmente la superficie orgánica y móvil de una célula diana, y en consecuencia mejor recapitula la formación de una sinapsis inmune fisiológicamente relevante.
El objetivo de este protocolo es proporcionar al usuario final con una descripción detallada de cómo reproducir la sinapsis inmunológica de las células NK mediante la combinación del sistema SLB y super-resolución STED microscopía. Además, proporcionará al usuario final con las medidas necesarias para: preparar los liposomas, construir bicapas proteínas incrustado, determinar la densidad de la proteína en las bicapas lipídicas, y adquirir imágenes de super-resolución mediante microscopía STED. Estas técnicas no se limitan al campo de la inmunología, y pueden ser ampliamente utilizados en una variedad de disciplinas.
Protocolo
1. Preparación de liposomas
- Calcular la cantidad de soluciones madre de cloroformo-suspendido de 1,2-dioleoil-sn-glicero-3-fosfocolina (DOPC) y biotinil 1,2-dioleoil-sn-glicero-3-fosfoetanolamina-N-cap (biotina-PE) para hacer stocks diluido a la concentración final deseada. Para hacer concentraciones finales de 400 mM y 80 mM DOPC fosfolípidos biotina-PE en 10 ml cada uno, iniciar mediante la colocación de 629 l de 10 mg / ml DOPC y 88 l 10 mg / ml de biotina-PE en tubos de vidrio de cromatografía separadas.
NOTA: es importante limpiar vidrio Hamilton jeringas y tubos de vidrio de cromatografía por la solución de (1 L 95% de etanol a 120 ml de agua que contiene hidróxido de potasio 60 g, KOH) de limpieza, durante la transferencia de solución de cloroformo-suspendido de DOPC y biotina-PE. - Se seca el cloroformo con una corriente de argón en la campana química. Sellar el tubo para cromatografía de parafina.
- Someter los liposomas recién secadas a un alto vacío en un lyophilizer O / N para eliminar cualquier cloroformo residual. Para la finalización del mismo día, seco durante 60-90 min.
- Mientras se ejecuta el liofilizador, preparar un poco de tampón de dilución. Para este protocolo, se preparan 25 ml que consta de 25 mM Tris, pH 8,0; NaCl 150 mM; y 2% (en peso) n-octil-β-D-glucopiranósido (OG) de detergente. Mezclar los dos primeros ingredientes juntos primero, a continuación, desplazar el oxígeno con argón antes de añadir el polvo OG seco. Después de la preparación, se filtra la solución OG con membrana de acetato de celulosa de 0,2 micras, y se almacena a 4 ° C.
- Además, preparar dos botellas con tapa de rosca de 1 L de tampón Tris-solución salina en las mismas concentraciones, pero sin OG. Coloque una barra de agitación magnética limpiado de agua destilada en el fondo de cada uno. Preparar 6 litros adicionales de la tampón Tris-solución salina. Eliminar el oxígeno de todas las botellas con argón y colocarlos a 4 ° C también.
- Después de la liofilización, disolver los lípidos secos en el búfer OG Tris-solución salina para hacer una solución 4 mM de cada uno. Siguiendo el ejemplovolúmenes, añadir 2 ml al tubo DOPC y 0,2 ml al tubo biotina-PE.
- Mezclar los lípidos biotina-PE con los lípidos DOPC. Esto mejora la movilidad de la SLB, como la biotina acoplada puede afectar la fluidez de los grupos de cabeza de fosfato. Para hacer una concentración final de 80 mM biotina-PE, mezclar 0,2 ml de 4 mM biotina-PE y 1 ml de 4 mM DOPC. A continuación, añadir 8,8 ml del tampón de Tris-solución salina OG.
- Para obtener una concentración final de 400 mM DOPC, simplemente mezclar 1 ml de 4 mM DOPC con 9 ml de Tris-solución salina OG.
- Llenar el baño de ultrasonidos con agua con hielo. Poner el tubo de vidrio que contiene el fosfolípido diluido en el centro de la sonicador mediante el uso de una abrazadera de utilidad. Sonicar fosfolípido diluido durante 10 minutos hasta que la solución se aclare.
NOTA: Agregar hielo en el baño de agua de ultrasonidos para mantener la temperatura baja, ya sonicación generará calor. - Llene los tubos con argón para desplazar el oxígeno en el aire por encima del líquido, y sellarlos con parafilm.
2. La diálisis de liposomas
- Cortar dos secciones de tubo de diálisis seco (peso molecular de corte: 12-14,000, diámetro: 6,4 mm) de longitud adecuada (en este ejemplo, 40 cm), una para cada dilución de fosfolípidos, del rollo.
- Rehidratar las secciones de tubo por lo que les permite remojo en un 200 ml de agua destilada en un vaso de precipitados de vidrio de 2 min.
- Microondas esto durante 5 minutos a un valor alto, o al menos hasta que el agua empiece a hervir.
- Haga un nudo en un extremo de cada tubo y enjuagar el interior con unos pocos mililitros de tampón Tris-salina-OG. A partir de entonces, meticulosamente exprimir la mayor cantidad de este tampón de lavado como sea posible para reducir al mínimo la cantidad de tampón que queda dentro.
- En una campana de flujo laminar, añadir los fosfolípidos diluidas en cada tubo y sujetar los extremos abiertos con un pequeño cierre del tubo de diálisis a fin de excluir todo el aire. La exclusión de aire completa requerirá el sacrificio de un pequeño volumen de la muestra por debajo de la sujeción y# 8220; la línea de agua ".
- Sumergir las muestras en las botellas de tampón Tris-solución salina previamente preparadas sin OG. Desplazar el oxígeno en la botella con argón antes de re-sellado y lugar para agitar O / N a 4 °.
- Transferir el tubo en una nueva botella de tampón Tris-solución salina sin OG cada 12 h durante al menos 3 veces.
- Poco antes de la extracción de los lípidos dializados, preparar una serie de pequeños tubos en el que los lípidos alícuota llenando cada uno con argón para desplazar el oxígeno.
- Después de 36 h, tomar las botellas de diálisis en la campana de flujo laminar y retirar los tubos de diálisis de las botellas. Tener un pañal banco o vaso en la mano para recoger la escorrentía mojado.
- Cortar el tubo de diálisis por encima del clip, a continuación, retire el clip y transferir cuidadosamente la solución de lípidos se dializa a través de una pipeta en alícuotas de 1 ml en tubos de pre-preparados llenos de gas argón en el hielo.
- Alícuota de la solución acuosa de liposomas, use el flujo de argón para desplazar el oxígeno de nuevo in cada tubo.
- Guarde los liposomas a 4 °. No lo congele.
3. Determinación de la densidad de anticuerpos en la bicapa lipídica
- Preparar una serie de diluciones de biotinilado, el anticuerpo marcado con fluorescencia-, 50 l de volumen para cada dilución, en las siguientes concentraciones: 0 nM (en blanco), 10 nM, 50 nM, 100 nM, y 500 nM. (De aquí en adelante referido como "serie de muestras").
- Añadir 1 l de perlas de sílice en 6 pocillos de una placa de 96 pocillos de fondo en v. Asegúrese de agitar las bolas antes de pipeteado, ya que tienden a asentarse.
NOTA: Si haber ordenado los granos secos en lugar de suspendido, siga las instrucciones del fabricante para diluir. - Para estas cuentas, añadir 2 l de DOPC mixta: fosfolípidos biotinil en una relación 1: 1. Haga esto para cada bien.
- Pulso la placa en un agitador vórtex en resistencia media 3 veces durante 10 s cada uno para fomentar la interacción con los granos y los fosfolípidos.
- Añadir 150 l de 5% CASein a cada pocillo. Mezclar bien pipeteando arriba y abajo tres veces.
- Deje que la placa se incuba en la solución de caseína durante 10 minutos, luego lavar a cabo. Para lavar, llenar cada pocillo para un volumen total de 250 l con solución salina tamponada con HEPES (HBS) con albúmina 1% de suero humano (HSA). Se centrifuga a 1.000 xg durante 2 min. Pipeta y deseche las 200 l de sobrenadante y repetir dos veces para un total de tres ciclos de lavado.
- Añadir 50 l de estreptavidina a un / ml de concentración 333 ng. Pulso de la placa de nuevo 3 veces 10 segundos, y dejar que repose en un agitador durante 15 min. Lave 3x como en el paso 6 para eliminar estreptavidina no unida.
- Añadir 50 l de anticuerpo biotinilado marcado con fluorescencia a partir de la serie de dilución preparada previamente (ver paso 3,1) a cada pocillo, y reemplazar la placa en el agitador durante 20-30 min. Lave 3x como en el paso 6 para eliminar el anticuerpo no unido.
- Después del lavado final, resuspender las perlas en 100 l de HBS / 1% de HSA, a continuación, transferir a un tubo de FACS. Repita esto dos veces alasegurar la eliminación eficaz de todos los cordones del pozo, para un total de 300 l, y hacer esto para cada pozo.
- Traiga los tubos resultantes para el citómetro de flujo. Es tiempo para leerlos.
- Añadir 1 gota de la botella marcada "B" desde el kit de calibración de la intensidad de fluorescencia de perlas (FIC) (denominado en lo sucesivo como "serie estándar") a un tubo de FACS, y se diluye con 300 l de HBS / 1% de HSA.
- Leer este tubo, pero no hay que registrar los datos por el momento. Por ahora, sólo tiene que asegurarse de que las cuentas en blanco están correctamente puestos a cero. Hacer un histograma que muestra la fluorescencia de las perlas medidos en el canal adecuado, a continuación, cambiar el voltaje del láser de excitación hacia abajo hasta que el pico está en el lado extremo izquierdo del histograma.
- Retire el tubo y añadir 1 gota de cada uno de los otros 4 tubos en la serie (con la etiqueta 1 a 4) al mismo tubo. Ahora, coloque el tubo en la máquina de nuevo, y registrar los datos resultantes, que deben aparecer como 5 picos distintos.
- Lea cada tubo individual de la serie de muestras.
- El uso de software de análisis de FACS, dibujar una puerta que abarca toda la anchura de cada pico en el histograma serie estándar en el punto semi-máxima. Esa es una puerta para cada pico. Haga lo mismo para cada muestra. Nota la IMF (intensidad media de fluorescencia) para cada puerta.
- El uso de un programa de hoja de entrada de los valores de MFI medidos en el lugar apropiado. También la entrada MESF (moléculas de equivalente de Soluble Fluorocromo) valores (número promedio de moléculas fluorescentes que recubren cada perla) para cada botella en la serie estándar. Esta información se puede encontrar siguiendo las instrucciones de la plástica jar los tubos entraron.
- Utilice la hoja de cálculo se trazar la IMF en contra de los valores MESF, la creación de una correlación lineal entre el número de fluoróforos y de la intensidad medida.
- Utilice el módulo de 'proteínas y etiquetas' en el espectrofotómetro micro-volumen para determinar la relación de medio de contraste para proproteína en el anticuerpo marcado.
- Introduzca el etiquetado de eficiencia de la proteína de la muestra, el diámetro medio de las perlas recubiertas con lípidos, y el valor de MFI para cada entrada. La hoja de cálculo utilizará automáticamente la fórmula del gráfico de línea generada en la etapa 3.16 para calcular los valores MESF para cada dilución de la proteína y la densidad de siembra de la proteína de la muestra en cada concentración.
4. aislar y cultivar células NK humanas
- Alícuota de 15 ml de sangre periférica o de la capa leucocitaria en un tubo cónico de 50 ml. Diluir esta sangre con PBS que contenía 1% de FBS en la proporción de 1: 1.
- Añadir 13 ml de Ficoll suavemente a la parte inferior del tubo con una pipeta serológica de 10 ml.
- Centrífuga este tubo durante 20 minutos a 1200 xg con el acelerador y el descanso fuera o en sus valores más bajos.
- Después de la centrifugación, utilizar una pipeta serológica para recoger la capa media flotante blanca turbia de células mononucleares de sangre periférica (PBMCs), wHICH debe sentarse y la intersección entre una capa superior clara amarilla y una capa inferior de color pálido más nublado, ambos de los cuales se sienta encima de una capa inferior de glóbulos rojos (GR). NOTA favor no recoge ningún glóbulos rojos en la recogida de las PBMC.
- Colocar las PBMCs recogidos en un nuevo tubo cónico de 50 ml y diluir a la capacidad con PBS que contenía 1% de FBS. Centrifugar de nuevo, esta vez con el freno y el acelerador al máximo, durante 5 min a 300 x g.
- Desechar el sobrenadante y resuspender las células en 10 ml de PBS que contenía 1% de FBS.
- Contar las células, mientras que la centrifugación una vez más con los mismos parámetros que en el paso 4.6.
- Descartar el sobrenadante una vez más, y resuspender las células en medio R10 a una densidad de 10 millones de células / ml.
- Tomar 30 millones de células en un tubo de poliestireno de 5 ml, y aislar las células NK utilizando un kit de separación magnética, siguiendo las instrucciones del fabricante. Tras el aislamiento, contar las células y resuspender uno más a una densidad de 500,000 células / ml en medio completo R10 (88% RPMI; 10% de FBS; 1% de HEPES; 1% de piruvato de sodio) suplementado con IL-2 (100 U / ml). Cultura a 37ºC en una incubadora de CO 2, y reemplazar medio 2-3 veces a la semana.
5. Montaje de la apoyada por el cristal planar bicapa lipídica
- Preparar la solución Piranha 100 ml mediante la mezcla de peróxido de hidrógeno al 30% con ácido sulfúrico en una proporción de 1: 3 en un vaso de precipitados.
NOTA: Siempre llevar a cabo el trabajo con agentes nocivos como el ácido sulfúrico en una campana de extracción química correctamente designada. - En esta solución, sumerja 2 rectangulares # 1.5 cubreobjetos en solución de pirañas durante 20-30 min.
NOTA: Es esencial para limpiar los cubreobjetos por solución de pirañas. - Mientras que los cubreobjetos se están limpiando, tome 1 tubo de preparado previamente 400 mu M lípidos DOPC y 1 tubo de 80 mM previamente preparado lípidos biotina-PE. Transportarlos en el hielo en el tanque de argón.
- Desplazar el oxígeno en un nuevo tubo de centrífuga con argón,luego sumar el DOPC y biotina-PE en una relación 1: 1. Volumen específico variará en función de las necesidades experimentales, pero debe estar en un mínimo de 2 l cada uno. Desplazar el oxígeno en el tubo de mezcla una vez más con gas argón, y los tubos de reactivos individuales, así, antes de devolver el último a la nevera.
- Después de que hayan terminado de limpiar, enjuagar bien los cubreobjetos con agua destilada. Establecer los cubreobjetos fuera secar al aire durante unos minutos.
- Retirar 1,5 l de la mezcla de liposoma preparado en la etapa 5.4 y alícuota en una sola gota en una de las cámaras de carril de la diapositiva cámara. El uso de 2 gotas por carril es típico, pero no necesario.
- De forma rápida y eficiente colocar el cubreobjetos seco sobre las gotitas. Asegúrese de que las gotas están suficientemente separados para que no se combinan una vez que se coloca el cubreobjetos. Además, asegúrese de que las gotas permanezcan circular y bien definido, sin tocar los bordes de las paredes de la cámara. Presione hacia abajo con firmezaen entre y alrededor de cada carril para asegurar un sello hermético entre el cubreobjetos y portaobjetos.
- Marque las posiciones de las gotas usando un rotulador
- Pasar 100 l de solución acuosa al 5% de caseína través de la cámara para bloquear la bicapa. Trate de asegurarse de que no hay burbujas en la cámara de flujo.
- Inyectar 100 l de estreptavidina a una concentración de 333 ng / ml en cada carril. Se incuba durante 10-15 minutos a temperatura ambiente. A partir de entonces, se lava mediante la ejecución de 3 ml de HBS / 1% de HSA a través de cada carril para eliminar el exceso de estreptavidina.
- Añadir 100 l de biotina marcado con fluorescencia anti-CD16 tales como Alexa Fluor 568 en la concentración de proteína determinada previamente para ser más eficaces en la sección 3. Incubar en la oscuridad durante 20-30 min. Lavar a continuación mediante la ejecución de 3 ml de HBS / 1% de HSA a través de cada carril.
- El flujo 100 l de D-biotina en una concentración de 25 nM través de la cámara a fin de obligar cualquier exceso de estreptavidina y por lo tanto eliminar la posibilidad de unión no específica de streptavidin a las células.
- Contar las células NK y resuspender en una concentración de 500.000 / ml en HBS / 1% de HSA.
- Mientras desacelerándose las células, lavar la D-biotina fuera de la cámara con otro 3 ml de HBS / 1% de HSA por carril.
- Compruebe la movilidad de los ligandos en el SLB por FRAP (FRAP) en un total de fluorescencia interno de reflexión (TIRF) o microscopía confocal antes de añadir las células NK.
- Una vez que las células han terminado de hilado y han sido resuspendieron a la concentración deseada, añadir 100 l de cada carril.
- Coloque la cámara en un incubador de CO2 37 ° 5% durante 30-60 minutos.
- Después de este período de incubación, fijar las células con paraformaldehído al 4% a temperatura ambiente durante 10-20 min. Lavar mediante la ejecución de 3 ml de PBS a través de cada carril para eliminar el paraformaldehído.
- Añadir 400 l de tampón de bloqueo (5% de suero normal de burro y 0,2% Tritron X-100 en PBS). Incubar a TA durante 30 min.
- Manchas F-actina y perforina por anuncioding 200 l de diluirse phalloidin fluorescente marcada con (1 unidad / ml phalloidin etiquetado) y la etiqueta fluorescente-anti-perforina MAB (500 mAb ng / ml anti-perforina). Incubar a temperatura ambiente durante 1 hr.
- Lave ejecutando 3 ml de PBS. La cámara está listo para la formación de imágenes.
6. Obtención de imágenes de la Synapse NK en bicapa lipídica usando STED
- Encienda todos los módulos de hardware necesarios.
- Iniciar el software de análisis de imágenes. Habilitar tanto de exploración resonante y módulos STED. Después de hacer estas selecciones, espere aproximadamente 3-5 minutos para que el software para iniciar.
- Haga clic en la pestaña "Configuración" en la parte superior de la pantalla.
- Seleccione "Laser Config" y encienda la luz blanca y STED 592 láseres nm.
- Elija el objetivo 100x, y alinear el haz láser de excitación con el láser agotamiento 592 nm.
- Seleccione el módulo "Laser Config", apague el agotamiento 592láser, y a su vez en el láser agotamiento 660 nm.
- Colocar el portaobjetos en el escenario, sobre el lente. Traiga las células unidas en la región bicapa demarcada en el foco usando la lámpara de luz blanca y los oculares.
- Vuelva a la ficha "Adquisición", directamente a la derecha de la pestaña "Configuración".
- Haga clic en la pestaña "Cambiar a WhiteLight", a continuación, convertir ese módulo en y arrastre la línea láser de excitación a la longitud de onda apropiada.
- Seleccione el detector deseado de la lista de los disponibles, a continuación, establecer el rango de detección para abarcar la gama de longitudes de onda apropiada.
NOTA: NUNCA ponga el rango de detección directamente debajo del haz de excitación. - Haga clic en el botón "Seqential" en la izquierda "Adquirir" barra de herramientas para abrir el diálogo de escaneo secuencial en la parte inferior de la barra de herramientas de la izquierda. Esto permite al usuario añadir múltiples secuencias, cada unacon un haz de excitación diferente para un color diferente. Haga clic en "Entre Marcos", a continuación, establecer la frecuencia de excitación, detector, y el rango de detección para cada color adicional que en los pasos 6.9 y 6.10.
- Una vez que todos los ajustes están optimizados, pulsar "Start" para iniciar el proceso de adquisición.
- Aplicar el software libre deconvolución (Huygens) utilizando un entorno diseñado para STED deconvolución, como se ha descrito previamente 13.
Resultados
La Figura 1 muestra el resultado de la densidad de anticuerpo sobre la bicapa lipídica. El principio es usar perlas estándar para hacer la curva estándar de MESF frente a MFI a través de citometría de flujo (A). El MFI de la serie de muestras se convirtió en MESF utilizando la curva estándar. La densidad de anticuerpo sobre la bicapa lipídica se correlaciona linealmente con la concentración de anticuerpo (B). Figura 2 muestran la triple-color de la imagen STED de NK sinapsis sobre el vidrio de soporte de bicapa lipídica planar. El anticuerpo anti-CD16 en la bicapa de lípidos se acumula, provocando la formación de F-actina y la polarización y la penetración de perforina a través de la malla de F-actina en el panel focal de sinapsis inmunológica en las células NK. El uso de este enfoque combinado, se puede observar limpiamente los microclusters de la etiqueta fluorescente anti-CD16 en el SLB, que refleja directamente la agrupación de CD16 sobre la célula NK. En comparación con la imagen confocal convencional, la estructura de CD16 Central grupo se discierne más fácilmente en la imagen STED debido a la fluorescencia ambiente empobrecido. Además, la ultraestructura del citoesqueleto de actina se ve con mejorado significativamente resolución. De acuerdo con observaciones anteriores 16,17, los gránulos líticos perforina-positivas se ven posicionado sobre las regiones de baja densidad de F-actina en la imagen STED, un detalle crucial que se pierde en su mayoría en la imagen confocal.
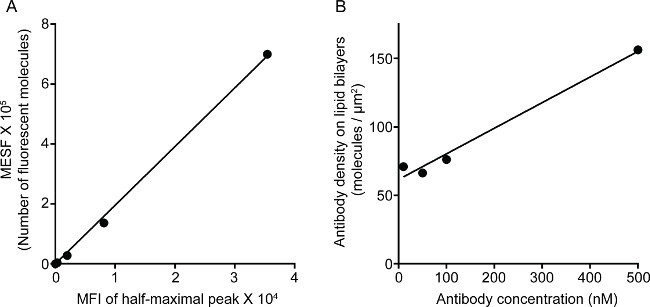
Figura 1. Densidad del anticuerpo 3G8 en bicapa lipídica. (A) La correlación lineal entre MESF y MFI para la serie estándar. (B) La correlación lineal entre la densidad de la proteína y la concentración para la serie de dilución de proteína de la muestra, que muestra el número de monómeros de proteínas marcadas con fluorescencia por unidad de área como una función del aumento de la concentración de lípidos sobre el Si recubiertosperlas lica.
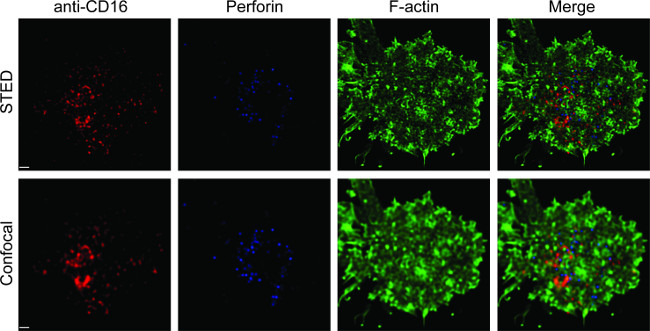
Figura 2. STED obtención de imágenes de NK sinapsis en bicapa lipídica planar. Células NK primaria se estimularon en el SLB que contiene biotina marcado con fluorescencia anti-CD16 (rojo), fijaron, permeabilizaron y tiñeron con faloidina (azul) y anti-F-actina (verde). Una célula individual fue fotografiada primero bajo el ajuste normal confocal, y luego el ajuste STED. Confocal de imágenes y STED se deconvoluted utilizando el software Huygens. Barra de escala, 1 m. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La novedad de este estudio es que combina la técnica de SLB con STED para estudiar las sinapsis de las células NK. Estudios anteriores han fotografiado la bicapa lipídica con TIRF para estudiar la formación de sinapsis de células T 8 y señalización tráfico molécula en la membrana plasmática 6. Otros han descrito STED de formación de imágenes de las sinapsis de células NK utilizando portaobjetos de vidrio recubiertas de anticuerpos 13,14. El método híbrido descrito en este documento además se basa en estos esfuerzos por imágenes de la sinapsis de las células NK con la mayor claridad ofrecida por imágenes de super-resolución en la superficie bicapa lipídica, que mejores modelos de la superficie dinámica de un APC.
Aunque SLBS son membranas artificiales que carecen de citoesqueleto, balsas de lípidos, y otros ligandos que células diana, actuales o APCs poseen, esta técnica puede recapitular características importantes tales como la movilidad y la orientación de los ligandos. Esto permite que el sistema SLB para servir como un enfoque reduccionista en la disección de tque la contribución de los receptores y ligandos individuales para la formación de la SI y la dinámica de la IS. La característica más importante de SLBS es que los investigadores pueden combinar esta técnica con enfoques de imágenes de alta resolución, como la microscopía confocal y TIRF. La introducción de la microscopía STED aumenta aún más esta ventaja, y proporciona información sin precedentes en es la investigación y sus aplicaciones clínicas.
Una crítica potencial de este sistema es que el SLB no imita adecuadamente el complejo de superficie de una APC, dando así lugar a características anatómicas potencialmente no fisiológicas en las sinapsis resultantes. Si bien es cierto que el limitado repertorio de moléculas de superficie en el SLB no recapitula totalmente la superficie heterogénea poblado de un APC, este límite también puede ser ventajoso en que permite a los investigadores determinar la influencia de las interacciones de los receptores y el ligando individuales en la formación de sinapsis .
Taquí hay varios pasos cruciales en el proceso. Entre los más crítico es que la oxidación de los liposomas puede prevenir mediante el uso constante de argón para desplazar el oxígeno en el tubo y solución, tal como en los pasos 1.10, 2.6, y 2.11. La oxidación de los lípidos dará lugar a la movilidad de los lípidos disminuido, impidiendo así la capacidad de las proteínas de la superficie de moverse libremente y participar en la estructuración sináptica. Del mismo modo, también es crucial para eliminar todo el cloroformo en el liposoma mediante liofilización (paso 1.2). En la determinación de la densidad de proteína en la bicapa lipídica, que es de importancia para dispersar primero los granos de silicio en una suspensión homogénea libre de clusters. Si es necesario, la sonicación de las perlas se puede aplicar. En el montaje de la SLB, los primeros pasos (05.01 a 05.08) en los que los cubreobjetos se limpian, las gotas se colocan, y cubreobjetos está fijado son vitales. Un error en cualquiera de estos puede requerir de comenzar el experimento más (desde el inicio de la sección 5). Por esta razón, esbuenas prácticas para limpiar más cubreobjetos que serán necesarios para ahorrar tiempo en caso de un percance.
No agrupación es el problema más frecuente cuando se trabaja con este sistema. Si, al visualizar las células en la etapa final, uno no puede encontrar ningún sinapsis fluorescentes, hay algunos pasos que se pueden tomar. Otra mancha para el receptor de la superficie celular cognado se puede añadir a la cámara para verificar que la célula no se ha formado una sinapsis con la bicapa mientras que las células pueden adherirse de forma no específica a la superficie de cubreobjetos de vidrio o bicapa, proteínas de la superficie sinápticamente implicados-debería aparecerá como grupos distintos en el plano de la interfaz célula-bicapa, mientras que las proteínas de superficie unengaged deben aparecer como tinción difusa alrededor del perímetro de la célula. En caso de que este método falla, se debe comprobar sus células a través de citometría de flujo para asegurar que el concreto marcador uno tiene la esperanza de estudiar se expresa en abundancia adecuada en la superficie celular. Cierta prote superficieins se sabe que son las reguladas por encima de largo plazo en la cultura vivo.
Si bien los detalles de este protocolo específicamente cómo visualizar la formación de sinapsis de las células NK, el sistema SLB puede ser usado para estudiar la formación de sinapsis en cualquier inmunocitos imaginable simplemente por sustitución del ligando primario en el paso 5,11. Múltiples ligandos también se pueden añadir simultáneamente. Uno también no necesita utilizar un sistema de estreptavidina-biotina para adherir las proteínas de la superficie dentro de la bicapa. Níquel-NTA: interacciones de histidina también son viables. Sin embargo, debido a la alta resistencia y especificidad de la estreptavidina: interacción biotina, nuestro laboratorio prefiere este sistema. Uno puede también variar la concentración de células añadidas en la bicapa de la densidad prescrita en el paso 5,13, así como la duración del periodo de incubación posterior a fin de observar las sinapsis en diferentes etapas de maduración. Esto se puede hacer incluso en directo, aunque esto, por supuesto, excluye la posibilidad de visualizar str intracelulaructures (a menos que ya están etiquetados con una etiqueta fluorescente fundido; nuestro laboratorio utiliza un par de dichas líneas celulares alterados). Debido al alto grado de personalización posible en este protocolo, se puede utilizar la técnica básica SLB, junto con imagen STED, para hacer frente a una gama muy variada de preguntas en inmunología, biología celular y bioquímica, incluyendo la dinámica de lípidos básicos 15, la formación de sinapsis 16, de señalización intracelular 17, y la metástasis de las células tumorales 18.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We thank Emily Mace and Malini Mukherjee for imaging and deconvolution analysis. Work in the Liu laboratory was supported in part by the Baylor-UTHouston Center for AIDS Research Core Support Grant number AI36211 from the National Institute of Allergy and Infectious Diseases, the Caroline Wiess Law Fund for Research in Molecular Medicine, Texas Children’s Hospital Pediatric Pilot Research Fund, and the Lymphoma SPORE Developmental Research Program from Baylor College of Medicine and the Methodist Research Institute.
Materiales
| Name | Company | Catalog Number | Comments |
| 18:1 (Δ9-Cis) PC (DOPC) 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti | 850375C | Liposome preparation |
| 18:1 Biotinyl Cap PE 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl) (sodium salt) | Avanti | 870273C | Liposome preparation |
| Argon gas, compressed | Airgas | UN1006 | Liposome preparation |
| A lyophilizer | Labconco | Freezone 7740020 | Liposome preparation |
| Lyophilizer tubes | Labconco | 7540200 | Liposome preparation |
| Chromatography Columns | Santa Cruz | sc-205558 | Liposome preparation |
| 1 M Tris pH 8.0 | Ambion | AM9856 | Liposome preparation |
| 5 M NaCl | Ambion | AM9759 | Liposome preparation |
| Octyl-β-D-glucopyranoside | Sigma-Aldrich | O1008 | Liposome preparation |
| Dialysis tubing | Spectrum Labs | 132676 | Liposome preparation |
| 96-well V-bottom polystyrene plate (untreated) | Corning | 3896 | antibody density determination |
| Non-functionalized silica beads | Bangs Laboratories | SS06N | antibody density determination |
| FACS tubes | Fisher Scientific | 14-959-2A | antibody density determination |
| QuantumTM MESF beads | Bangs Laboratories | Variable | antibody density determination |
| Casein | Sigma-Aldrich | C0875 | Lipid bilayer preparation |
| HEPES buffered saline + 1% HSA | Homemade | Lipid bilayer preparation | |
| Streptavidin | Life technologies | 434301 | Lipid bilayer preparation |
| Fluorescently-labeled biotinylated protein | Homemade | Lipid bilayer preparation | |
| ibidi Sticky-Slide VI 0.4 | ibidi | 80608 | Lipid bilayer preparation |
| 25x75 mm glass coverslip | ibidi | 10812 | Lipid bilayer preparation |
| Hydrogen peroxide (30%) | Fisher Scientic | BP2633 | Lipid bilayer preparation |
| Sulfuric acid | Sigma-Aldrich | 258105 | Lipid bilayer preparation |
| D-Biotin | Invitrogen | B20656 | Lipid bilayer preparation |
| Lens paper | VWR | 54826-001 | For imaging |
| Type F Immersion Oil | Leica | 11 513 859 | For imaging |
| A Leica TCS STED microscope | Leica | For imaging |
Referencias
- Dustin, M. L., Long, E. O. Cytotoxic immunological synapses. Immunol. Rev. 235 (1), 24-34 (2010).
- Monks, C. R., Freiberg, B. A. K. u. p. f. e. r. H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Hafeman, D. G., von Tscharner, V., McConnell, H. M. Specific antibody-dependent interactions between macrophages and lipid haptens in planar lipid monolayers. Proc Natl Acad Sci USA. 78 (7), 4552-4556 (1981).
- Tscharner, V., McConnell, H. M. Physical properties of lipid monolayers on alkylated planar glass surfaces. Biophys J. 36 (2), 421-427 (1981).
- Crites, T. J., Chen, L., Varma, R. A TIRF microscopy technique for real-time, simultaneous imaging of the TCR and its associated signaling proteins. J. Vis. Exp. , (2012).
- Prins, K. C., Vasiliver-Shamis, G., Cammer, M., Depoil, D., Dustin, M. L., Hioe, C. E. Imaging of HIV-1 envelope-induced virological synapse and signaling on synthetic lipid bilayers. J. Vis. Exp. , (2012).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. , (2008).
- Michalet, X., Weiss, S. Using photon statistics to boost microscopy resolution. Proc. Natl. Acad. Sci. U. S. A. 103 (13), 4797-4798 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu. Rev. Biochem. 78, 993-1016 (2009).
- Lippincott-Schwartz, J., Manley, S. Putting super-resolution fluorescence microscopy to work. Nat. Methods. 6 (1), 21-23 (2009).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J. Vis. Exp. , (2014).
- Rak, G. D., Mace, E. M., Banerjee, P. P., Svitkina, T., Orange, J. S. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Leutenegger, M., Ringemann, C., Lasser, T., Hell, S. W., Eggeling, C. Fluorescence correlation spectroscopy with a total internal reflection fluorescence STED microscope (TIRF-STED-FCS). Opt Express. 20 (5), 5243-5263 (2012).
- Liu, D., Bryceson, Y. T., Meckel, T., Vasiliver-Shamis, G., Dustin, M. L., Long, E. O. Integrin-dependent organization and bidirectional vesicular traffic at cytotoxic immune synapses. Immunity. 31 (1), 99-109 (2009).
- Liu, D., Peterson, M. E., Long, E. O. The adaptor protein Crk controls activation and inhibition of natural killer cells. Immunity. 36 (4), 600-611 (2012).
- Wu, J. C., et al. Antibody conjugated supported lipid bilayer for capturing and purification of viable tumor cells in blood for subsequent cell culture. Biomaterials. 34 (21), 5191-5199 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados