Method Article
Super-Resolution Imaging da Célula Natural Killer imunológica Synapse em um vidro com suporte Planar Lipid Bilayer
Neste Artigo
Resumo
We describe here a combination of the glass-supported lipid bilayer technique of forming immunological synapses with the super-resolution imaging technique of stimulated emission depletion (STED) microscopy. The goal of this protocol is to provide users with the instructions necessary to successfully carry out these two techniques.
Resumo
The glass-supported planar lipid bilayer system has been utilized in a variety of disciplines. One of the most useful applications of this technique has been in the study of immunological synapse formation, due to the ability of the glass-supported planar lipid bilayers to mimic the surface of a target cell while forming a horizontal interface. The recent advances in super-resolution imaging have further allowed scientists to better view the fine details of synapse structure. In this study, one of these advanced techniques, stimulated emission depletion (STED), is utilized to study the structure of natural killer (NK) cell synapses on the supported lipid bilayer. Provided herein is an easy-to-follow protocol detailing: how to prepare raw synthetic phospholipids for use in synthesizing glass-supported bilayers; how to determine how densely protein of a given concentration occupies the bilayer's attachment sites; how to construct a supported lipid bilayer containing antibodies against NK cell activating receptor CD16; and finally, how to image human NK cells on this bilayer using STED super-resolution microscopy, with a focus on distribution of perforin positive lytic granules and filamentous actin at NK synapses. Thus, combining the glass-supported planar lipid bilayer system with STED technique, we demonstrate the feasibility and application of this combined technique, as well as intracellular structures at NK immunological synapse with super-resolution.
Introdução
A sinapse imunológica (IS) encontra-se numa encruzilhada crítica para a ativação e função um celular. É o principal meio pelo qual a apresentação de antigénios e a imunidade mediada por células são realizadas. Os primeiros estudos microscópicos de formação de sinapses utilizado um sistema conjugado de célula-célula 2. A principal limitação desta abordagem é que a maioria dos conjugados será visto 'em perfil ", por assim dizer, restringindo, assim, a vista do observador da própria estrutura sináptica. Em 1999, o laboratório Dustin abordou esta limitação, utilizando a bicamada lipídica suportada em vidro (SLB) 3 técnica, que tinha sido anteriormente pioneiro pelo laboratório McConnel 4,5. Esta abordagem eliminados de células apresentadoras de antigénio (APCs) a favor de uma superfície plana de lípidos suportada em vidro, em que proteínas poderiam ser ligados e mover-se livremente em duas dimensões. Usando este método, Dustin e seus colegas foram capazes de perscrutar diretamente para dentro tele sinapse usando microscopia de fluorescência de alta resolução, e pela primeira vez obter uma aparência "face-a-face" na estrutura do IS.
Com a utilização do sistema de SLB, o detalhe com que o SI pode ser visualizada foi restringido apenas pelas limitações das técnicas de imagiologia actuais 6-8. Utilizando técnicas padrão de iluminação, a resolução mínima (isto é, a distância mínima entre dois objectos distintos em que eles podem ser distinguidos) foi <200 nm, com base no critério de Rayleigh 9. Este limite impede a imagem de, estruturas muito finas em escala molecular que compõem a sinapse, e até o desenvolvimento de técnicas de imagem de super-resolução 12/10, a visualização destas estruturas foi confinado a imagem de células fixas usando microscopia eletrônica.
Com o advento recente de uma variedade de técnicas de super-resolução, tais como microscopia SIM (iluminação estruturada), PALM (microscopia localização fotoactivado), STORM (microscopia óptica reconstrução estocástico), e STED 10-12, os pesquisadores são capazes de estudar essas estruturas sinápticas em detalhes sem precedentes, que tem, por sua vez proporcionou uma compreensão cada vez mais esclarecida da IS. As vantagens de microscopia STED foram descritos antes 13. Aqui descrevemos imagem super-resolução com microscopia STED equipado com o laser de 660 nm esgotamento recém-desenvolvida. Em comparação com o laser de 592 nm depleção convencional, o laser de 660 nm, permite uma ampla selecção de corantes fluorescentes (ver http://nanobiophotonics.mpibpc.mpg.de/old/dyes/), especialmente estes fluoróforos vermelhos.
Outras publicações têm descrito a imagiologia STED de sinapses nas células NK em lâminas de vidro revestidas com anticorpo 13,14. Aqui, o sistema é combinado com SLB microscopia STED super-resolução para estudar a sinapse da célula NK. Esta técnica tem a vantagem sobre por anticorposdiapositivos revestidos de ser um mosaico de fluido, em que as proteínas de superfície incorporados podem mover-se livremente em uma superfície plana bidimensional (plano xy). Este imita mais fielmente a superfície orgânica e móvel de uma célula alvo, e consequentemente uma melhor recapitula a formação de uma sinapse imune fisiologicamente relevante.
O objetivo deste protocolo é o de proporcionar ao usuário final com uma descrição detalhada de como a imagem da sinapse imunológica das células NK, combinando o sistema SLB e microscopia STED super-resolução. Ele irá fornecer ao usuário final com as medidas necessárias para: preparar os lipossomas, construir bilayers incorporado em proteínas, determinar a densidade de proteína nas bicamadas lipídicas, e adquirir imagens de super-resolução usando microscopia STED. Estas técnicas não são limitados ao campo da imunologia, e pode ser amplamente utilizado em uma variedade de disciplinas.
Protocolo
1. Preparação de lipossomas
- Calcular a quantidade de soluções de reserva de clorofórmio-suspenso de 1,2-dioleoil-sn-glicero-3-fosfocolina (DOPC) e 1,2-dioleoil-sn-glicero-3-fosfoetanolamina-N-biotinil tampa (Biotina-PE) as existências diluídas para a concentração final desejada. Para perfazer concentrações finais de 400 uM e 80 uM de DOPC fosfolípidos Biotina-PE com 10 ml de cada vez, começar por colocar 629 ul de 10 mg / ml de DOPC e 88 uL de 10 mg / ml de biotina-PE em tubos de cromatografia de vidro separados.
NOTA: é importante para limpar vidro seringas Hamilton e tubos de cromatografia de vidro por solução (1 L de etanol a 95% e 120 ml de água contendo hidróxido de potássio 60 g, KOH) a limpeza, durante a transferência de solução estoque suspensa-clorofórmio de DOPC e Biotina-PE. - Seca-se o clorofórmio com uma corrente de árgon no capuz química. Fechar o tubo de cromatografia por parafilm.
- Submeter os lipossomas recentemente secos a alto vácuo num lyophilizer O / N para remover qualquer clorofórmio residual. Para a conclusão do mesmo dia, secar por 60-90 min.
- Enquanto os funcionamentos liofilizador, preparar alguns tampão de diluição. Para este protocolo, preparar 25 ml consistindo em Tris 25 mM, pH 8,0; NaCl 150 mM; e 2% (em peso) de n-octil-β-D-glucopiranósido (OG) detergente. Misturar os dois primeiros ingredientes juntos em primeiro lugar, em seguida, deslocar o oxigénio com árgon antes de se adicionar o pó seco OG. Após a preparação, filtrar a solução com OG membrana de acetato de celulose de 0,2 micra, e armazenar a 4 ° C.
- Além disso, preparar duas garrafas com tampa de rosca de 1 L de tampão Tris-salino, nas mesmas concentrações, mas sem OG. Colocar uma barra de agitação magnética limpos em água destilada na parte inferior de cada um. Prepare 6 litros adicionais de tampão Tris-salino. Remover o oxigénio a partir de todos os frascos com árgon e colocá-los a 4 ° C, bem.
- Após liofilização, dissolver os lípidos secos no tampão de Tris-OG salina para fazer uma solução 4 mM de cada. Seguindo o exemplovolumes, adicionar 2 ml para o tubo de DOPC e 0,2 ml para o tubo de Biotina-PE.
- Misture os lipídios biotina-PE com os lipídios DOPC. Isto melhora a mobilidade do SLB, como a biotina acoplado pode prejudicar a fluidez dos grupos de cabeça fosfato. Para fazer uma concentração final de 80 uM de biotina-PE, misturar 0,2 mL de 4 mM de biotina-PE e 1 ml de DOPC 4 mM. Em seguida, adicionar 8,8 ml de tampão Tris-salino OG.
- Para uma concentração final de 400 uM de DOPC, simplesmente misturar 1 ml de DOPC 4 mM, com 9 ml de solução salina Tris-OG.
- Encher o sonicador com água gelada. Colocar o tubo de vidro contendo o fosfolípido diluída no centro do sonicador usando uma braçadeira utilidade. Sonicar o fosfolípido diluídos durante 10 min até que a solução se torne clara.
NOTA: Adicione o gelo no banho de água sonicador para manter a temperatura baixa, uma vez sonicação irá gerar calor. - Preencha os tubos com argônio para deslocar o oxigênio do ar acima do líquido, e feche-os com parafilme.
2. Lipossomas de diálise
- Cortar duas secções de tubo de diálise seca (Peso molecular de corte: 12-14,000, diâmetro: 6,4 milímetros) com o comprimento adequado (neste exemplo, 40 cm), um para cada diluição de fosfolípido, a partir do rolo.
- Re-hidratar as secções de tubos, permitindo-lhes absorver em 200 ml de água destilada numa proveta de vidro durante 2 min.
- Microondas este durante 5 minutos a uma regulação alta, ou, pelo menos, até a água começar a ferver.
- Dê um nó em uma extremidade de cada tubo e lavar o interior com alguns mililitros de tampão Tris-salino-OG. Depois disso, meticulosamente espremer o máximo deste tampão de lavagem possível para minimizar a quantidade de tampão restante no interior.
- Em uma câmara de fluxo laminar, adicionar os fosfolípidos diluído para cada tubo e prender as extremidades abertas com um pequeno fecho do tubo de diálise, de modo a excluir todo o ar. Exclusão completa do ar vai requerer o sacrifício de um pequeno volume da amostra por aperto abaixo do &# 8220; linha de água ".
- Mergulhar as amostras previamente preparadas nas garrafas de tampão Tris-salino, sem OG. Deslocar oxigênio na garrafa com árgon antes de voltar a vedação e lugar para agitar O / N em 4 °.
- Transferir a tubagem para um novo frasco de tampão Tris-salino, sem OG cada 12 horas durante pelo menos 3 vezes.
- Pouco tempo antes da remoção dos lípidos dialisados, preparar um número de pequenos tubos em que a aliquotar os lípidos, preenchendo cada um com árgon para deslocar o oxigénio.
- Após 36 h, tomar as garrafas de diálise para a capela de fluxo laminar e remover os tubos de diálise das garrafas. Tenha uma fralda banco ou copo na mão para recolher o escoamento molhado.
- Corte o tubo de diálise acima do clipe, em seguida, remover o clipe e transferir cuidadosamente a solução lipídica dialisados via pipeta em alíquotas de 1 ml em tubos pré-preparados preenchidos com gás argônio no gelo.
- Alíquota da solução aquosa de lipossomas, usar o fluxo de argônio para deslocar o oxigênio novamente in cada tubo.
- Armazenar os lipossomas a 4 ° C. Não congelar.
3. Determinação da Densidade de anticorpos na bicamada lipídica
- Prepara-se uma série de diluições de biotinilado, o anticorpo marcado fluorescentemente, 50 uL de volume para cada diluição, nas seguintes concentrações: 0 nM (em branco), 10 nM, 50 nM, 100 nM e 500 nM. (Doravante referida como "série de amostras").
- Adicionar 1 ml de esferas de sílica em 6 poços de uma placa de 96 poços de fundo em V. Certifique-se de apertar as contas bem antes de pipetagem, como eles tendem a se estabelecer.
NOTA: Se o mandante pérolas secas em vez de suspenso, siga as instruções do fabricante para diluir. - Para estas contas, adicionar 2 mL de DOPC mista: fosfolipídios biotinil na proporção de 1: 1. Faça isso para cada poço.
- Pulso a placa em um agitador em força média 3 vezes por 10 segundos cada para incentivar a interação com as contas e os fosfolipídeos.
- Adicionar 150 ul de 5% casein a cada poço. Misture bem por pipetagem cima e para baixo três vezes.
- Deixe a placa incubar na solução de caseína durante 10 min, em seguida, lavá-lo para fora. Para lavar, encher cada poço para um volume total de 250 ul com solução salina tamponada com HEPES (HBS) com albumina a 1% de soro humano (HSA). Centrifugar a 1000 xg por 2 min. Pipeta e descartar os melhores 200 mL de sobrenadante, e repetir duas vezes para um total de três ciclos de lavagem.
- Adicionar 50 ul de estreptavidina a um 333 ng / ml de concentração. Pulso a placa novamente 3x 10 segundos, e deixe descansar em um shaker para 15 min. Lavar 3x como na etapa 6 para remover estreptavidina não ligado.
- Adicionar 50 ul de anticorpo biotinilado marcado por fluorescência a partir da série de diluições previamente preparadas (ver passo 3.1) em cada poço, e substitui a placa no agitador durante 20-30 min. Lavar 3x como no passo 6 para remover o anticorpo não ligado.
- Após a lavagem final, voltar a suspender as pérolas em 100 ul de HBS / 1% de HSA, e transferir para um tubo de FACS. Repita isso duas vezes paraassegurar a remoção eficiente de todos os cordões do poço, para um total de 300 ul, e fazer isto para cada poço.
- Trazer os tubos resultantes para o citómetro de fluxo. É tempo de lê-los.
- Adicionar uma gota a partir do frasco marcado "B" a partir do kit de calibração grânulo intensidade de fluorescência (FIC) (daqui em diante referido como "série normal") para um tubo de FACS, e dilui-se com 300 ul de HBS / 1% de HSA.
- Leia este tubo, mas não gravar os dados ainda. Por enquanto, apenas garanta que as esferas em branco estão devidamente zerado. Adicione um histograma que mostra a fluorescência das pérolas medidos no canal apropriado, em seguida, deslocar a tensão do laser de excitação para baixo até que o pico está na extremidade da esquerda do histograma.
- Remover o tubo e adicionar 1 gota de cada um dos outros 4 tubos da série (identificada como 1 a 4) para o mesmo tubo. Agora, colocar o tubo na máquina novamente, e gravar os dados resultantes, que deve aparecer como 5 picos distintos.
- Leia cada tubo individual a partir da série de amostras.
- Usando o software de análise FACS, desenhe um portão abrangendo toda a largura de cada pico na série histograma normalizada no ponto de metade do valor máximo. Essa é uma porta para cada pico. Faça o mesmo para cada amostra. Nota o MFI (intensidade de fluorescência média) para cada porta.
- Usando um programa de planilha de entrada os valores de MFI medidos no local apropriado. Também a entrada MESF (Moléculas de equivalentes Solúvel Fluorochrome) valores (número médio de moléculas fluorescentes que revestem cada esfera) para cada garrafa na série standard. Esta informação pode ser encontrada seguindo as instruções sobre o plástico jar os tubos entrou.
- Usar a folha de cálculo irá traçar o MFI contra os valores MESF, criando uma correlação linear entre o número de fluoróforos e a intensidade medida.
- Utilizar o módulo de proteínas '&' rótulos no espectrofotómetro micro-volume, para determinar a proporção de corante de prótein em que o anticorpo marcado.
- Introduza a eficiência de marcação da proteína na amostra, o diâmetro médio dos grânulos revestidos com lípidos, e o valor de MFI para cada entrada. A folha de cálculo utiliza automaticamente a fórmula a partir do gráfico gerado linha no passo 3.16 a computar os valores MESF para cada diluição da proteína e a densidade de sementeira de proteína de amostra para cada concentração.
4. isolando e cultivando células NK Humano
- Alíquota de 15 ml de sangue periférico ou creme leucocitário em um tubo de 50 ml. Dilui-se o sangue com PBS contendo FBS a 1% à razão de 1: 1.
- Adicionar 13 ml de Ficoll suavemente para o fundo do tubo com uma pipeta 10 ml serológico.
- Centrífuga este tubo durante 20 minutos a 1.200 xg com o acelerador e a quebra de fora ou em suas configurações mais baixas.
- Após centrifugação, utilizar uma pipeta serológica para recolher a camada de meio flutuante turvo branco de células mononucleares do sangue periférico (PBMC), which deve sentar-se e a intersecção entre a camada superior amarela clara e uma camada inferior de cor pálida mais nebuloso, os quais encontram-se acima de uma camada mais baixa de glóbulos vermelhos (hemácias). NOTA Não para recolher quaisquer hemácias na cobrança do PBMC.
- Coloque as PBMCs recolhidos em um novo tubo de 50 ml e perfazer o volume de capacidade com PBS contendo 1% de FBS. Centrifugar novamente, dessa vez com o travão e do acelerador no máximo, durante 5 min a 300 x g.
- Descartar o sobrenadante e ressuspender as células em 10 ml de PBS contendo 1% de FBS.
- Contar as células enquanto centrifugação mais uma vez com as mesmas configurações como no passo 4.6.
- Descartar o sobrenadante mais uma vez, e voltar a suspender as células em meio R10 a uma densidade de 10 milhões de células / ml.
- Tomar 30 milhões de células num tubo de polistireno de 5 ml, e isolar células NK utilizando um kit de separação magnética, seguindo as instruções do fabricante. Na sequência do isolamento, contar as células mais um e ressuspender a uma densidade de 500,000 células / ml em meio completo R10 (88% de RPMI; 10% de FBS; 1% de HEPES; o piruvato de sódio a 1%) suplementado com IL-2 (100 U / ml). Cultura a 37 ° em uma incubadora de CO 2, e substituir meio 2-3 vezes por semana.
5. Montagem do Glass-suportado Planar Lipid Bilayer
- Preparar solução piranha 100 ml por mistura de 30% de peróxido de hidrogénio com ácido sulfúrico, a uma proporção de 1: 3 numa proveta.
NOTA: Sempre realizar um trabalho com agentes nocivos, como o ácido sulfúrico em um exaustor química corretamente designado. - Nesta solução, mergulhe 2 retangulares # 1.5 lamelas em solução piranha por 20-30 min.
NOTA: É essencial para limpar as lamelas por solução piranha. - Enquanto as lamelas estão sendo limpos, tomar um tubo de previamente preparado 400 um lipídios DOPC e 1 tubo de previamente preparado 80 um lipídios Biotina-PE. Transportá-los em gelo para o tanque de árgon.
- Deslocar o oxigénio em um novo tubo de microcentrifugação com árgon,em seguida, adicionar o conjunto de DOPC e Biotina-PE a uma proporção de 1: 1. O volume específico varia de acordo com as necessidades experimentais, mas deve ser no mínimo de 2 ul cada. Deslocar o oxigénio no tubo de mistura mais uma vez com árgon gasoso, e os tubos de reagente individuais, bem como, antes de retornar o último para o refrigerador.
- Depois de terminar a limpeza, lave as lamelas com água destilada. Defina as lamelas fora secar ao ar por alguns minutos.
- Retirar 1,5 mL da mistura de lipossomas, preparada no passo 5.4 e aliquotar em que uma única gota em uma das câmaras da pista deslizante câmara. A utilização de duas gotas por pista é típico, mas não é necessário.
- Rápida e eficiente colocar a lamela seca sobre as gotículas. Certifique-se de que as gotas são suficientemente espaçados de modo que eles não se fundem quando a lamela é colocada. Além disso, certifique-se de que as gotas continuam a ser circular e bem definida, sem tocar as bordas das paredes da câmara. Pressione firmementeentre e ao redor de cada pista para garantir uma vedação estanque entre a lamela e slide.
- Marque as posições das gotas usando uma caneta marcador
- Passe 100 ul de solução aquosa a 5% de caseína através da câmara para bloquear a bicamada. Tente certificar-se de que não existem bolhas na câmara de fluxo.
- Injectar 100 ul de estreptavidina a uma concentração de 333 ng / ml em cada pista. Incubar durante 10-15 minutos à temperatura ambiente. Em seguida, lavar rodando 3 ml de HBS / 1% de HSA através de cada pista para remover o excesso de estreptavidina.
- Adicionar 100 ul de biotinilado marcado por fluorescência anti-CD16, tais como Alexa Fluor 568, na concentração de proteína previamente determinado ser mais eficaz na secção 3. Incubar no escuro durante 20-30 minutos. Lave novamente executando 3 ml de HBS / 1% de HSA através de cada pista.
- Fluxo 100 ul de D-biotina a uma concentração de 25 nM, através da câmara, a fim de ligar qualquer excesso de estreptavidina e, assim, eliminar a possibilidade de ligação não específica de rreptavidin para as células.
- Contagem de células NK e ressuspender a uma concentração de 500,000 / ml em HBS / 1% de HSA.
- Enquanto centrifugando as células, lava-se a D-biotina para fora da câmara com outro 3 ml de HBS / 1% de HSA por pista.
- Verifique a mobilidade dos ligantes no SLB por recuperação de fluorescência após a fotodegradação (FRAP) em uma fluorescência total interno de reflexão (TIRF) ou microscopia confocal antes de adicionar as células NK.
- Uma vez que as células tenham acabado de fiação e foram novamente suspensas na concentração desejada, adicionar 100 ul de cada pista.
- Coloque a câmara em uma temperatura de 37 ° 5% de CO2 durante 30-60 min.
- Após este período de incubação, fixar as células com paraformaldeído a 4% à temperatura ambiente durante 10-20 min. Lavar executando 3 ml de PBS através de cada pista para remover o paraf ormaldeido.
- Adicionar 400 ul de tampão (5% de soro de burro normal e 0,2% Tritron X-100 em PBS) de bloqueio. Incubar à temperatura ambiente durante 30 min.
- Stain F-actina e perforina por anúncioding 200 ul de diluído faloidina fluorescente marcado (1 unidade / ml faloidina marcada) e fluorescentemente marcado com mAb anti-perforina (500 ng de mAb anti-perforina ml /). Incubar à temperatura ambiente durante 1 h.
- Lavar executando 3 ml de PBS. A câmara está pronto para a imagiologia.
6. Criação de Imagens do NK Synapse em Lipid Bilayer usando STED
- Ligue todos os módulos de hardware necessários.
- Inicie o software de análise de imagem. Ativar a varredura de ressonância e módulos STED. Depois de fazer essas seleções, aguarde cerca de 3-5 minutos para o software para iniciar.
- Clique na aba "Configuração", na parte superior da tela.
- Selecione "Laser Config", em seguida, ligar a luz branca e lasers STED 592 nm.
- Escolha o objetivo 100x, e alinhar o feixe de laser de excitação com o laser esgotamento 592 nm.
- Selecione o módulo "Laser Config", desligue o esgotamento 592laser, e por sua vez sobre o laser esgotamento 660 nm.
- Colocar a lâmina sobre o palco, através da lente. Trazer as células ligadas na região demarcada bicamada em foco usando a lâmpada de luz branca e as oculares.
- Retorne à guia "Aquisição", diretamente à direita do separador "Configuração".
- Clique na aba "Mudar para Whitelight", em seguida, vire esse módulo e arraste a linha de laser de excitação para o comprimento de onda apropriado.
- Selecione o detector desejado a partir da lista dos disponíveis, em seguida, defina o intervalo de detecção para abranger o conjunto adequado de comprimentos de onda.
Nota: Nunca coloque o intervalo de detecção diretamente abaixo do feixe de excitação. - Clique no botão "Seqential" na mão esquerda "Adquirir" barra de ferramentas para abrir o diálogo Scanning Sequential na parte inferior da barra de ferramentas do lado esquerdo. Isso permite que o usuário adicione várias seqüências, cadacom um feixe de excitação diferente de uma cor diferente. Clique em "Entre Frames", e em seguida, defina a frequência de excitação, detector, e alcance de detecção para cada cor adicional como nos passos 6,9 e 6,10.
- Uma vez que todas as configurações são otimizadas, clique em "Start" para iniciar o processo de aquisição.
- Aplique o software livre deconvolution (Huygens), utilizando um cenário projetado para STED deconvolution, como descrito anteriormente 13.
Resultados
A Figura 1 mostra o resultado da densidade anticorpo na bicamada lipídica. O princípio é o de utilizar grânulos padrão para fazer a curva padrão de MFI MESF contra através de citometria de fluxo (A). O MFI do conjunto de amostras, foi convertido em MESF utilizando a curva padrão. A densidade de anticorpos na bicamada lipídica é linearmente correlacionada com a concentração de anticorpos (B). A Figura 2 mostra o triple-color imagem STED de NK sinapse on-suporte de vidro bicamada lipídica planar. O anticorpo anti-CD16 sobre a bicamada lipídica acumula, provocando a formação de F-actina e a polarização de perforina e penetração através da malha de actina F no painel central da sinapse imunológica em células NK. Usando essa abordagem combinada, pode-se observar os limpa microclusters de marcação fluorescente anti-CD16 dentro do SLB, que reflete diretamente a aglomeração de CD16 da célula NK. Em comparação com a imagem confocal convencional, a estrutura de CD16 central cluster é mais facilmente percebido na imagem STED devido à fluorescência ambiente empobrecido. Além disso, a ultra-estrutura do citoesqueleto de actina é visto com resolução melhorada significativamente. Consistente com as observações anteriores 16,17, os grânulos líticos perforina-positivo são vistas posicionado sobre as regiões de baixa densidade de actina F na imagem STED, um detalhe fundamental, que é praticamente perdida na imagem confocal.
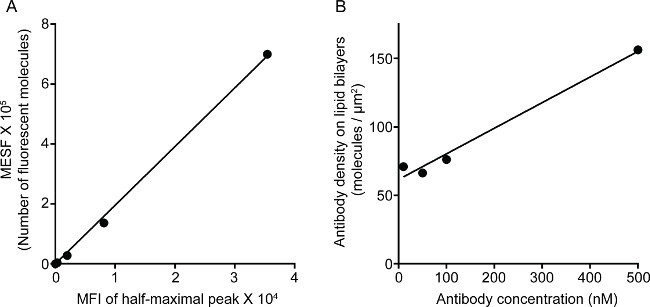
Figura 1. Densidade de anticorpo 3G8 na bicamada lipídica. (A) correlação linear entre MESF e MFI para um conjunto padrão. (B) A correlação linear entre a densidade e concentração de uma série de diluição proteína de amostra de proteína, mostrando o número de monómeros de proteína fluorescente marcado por unidade de área como uma função do aumento da concentração em si revestido por lípidosgrânulos lica.
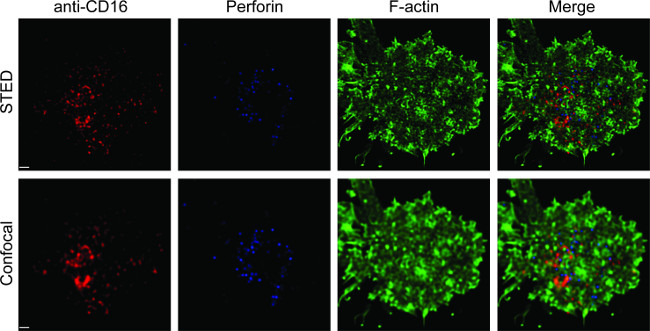
Figura 2. STED imagiologia de NK sinapse em bicamada lipídica plana. Primária células NK foram estimuladas na SLB contendo biotinilado marcado por fluorescência anti-CD16 (vermelho), fixa, permeabilizadas, e depois coradas com faloidina (azul) e anti-F-actina (verde). Uma célula individual foi fotografada em primeiro lugar sob a configuração confocal normal, e em seguida, a definição STED. Imagens confocal e STED foram deconvoluídos usando software Huygens. Scale bar, 1 um. Clique aqui para ver uma versão maior desta figura.
Discussão
A novidade do estudo é que ele combina a técnica SLB com STED estudar sinapses das células NK. Estudos anteriores obtiveram imagens da bicamada lipídica com TIRF para estudar a formação de sinapses células T 8 e tráfico molécula de sinalização da membrana plasmática 6. Outros descreveram STED imagiologia de sinapses nas células NK utilizando lâminas de vidro revestidas com anticorpo 13,14. O método híbrido aqui descrito ainda se baseia esses esforços pela imagem da sinapse das células NK com a maior nitidez proporcionada pelo super-resolução de imagem na superfície bicamada lipídica do que modelos melhores da superfície dinâmico de um APC.
Embora SLBS são membranas artificiais falta de citoesqueleto, jangadas lipídicas, e outros ligandos que as células-alvo reais ou APCs possuir, esta técnica pode recapitular características importantes, tais como a mobilidade e orientação dos ligandos. Isto permite que o sistema de SLB para servir como uma abordagem reduzida em dissecar tele contribuição dos receptores individuais e ligantes para formação da IS e da dinâmica do IS. A característica mais importante de SLBS é que os pesquisadores podem combinar esta técnica com abordagens de imagem de alta resolução, como a microscopia confocal e TIRF. A introdução de microscopia STED aumenta ainda mais essa vantagem, fornecendo insights sem precedentes em uma pesquisa e suas aplicações clínicas.
Uma crítica potencial deste sistema é que o SLB não mimetizam adequadamente a superfície de uma APC complexo, dando assim origem a características anatómicas potencialmente não-fisiológicos nas sinapses resultantes. Embora seja verdade que o repertório limitado de moléculas de superfície sobre o SLB não recapitular totalmente a superfície heterogeneamente povoada de uma APC, este limite pode também ser vantajoso na medida em que permite que os investigadores a determinar a influência das interacções do receptor e do ligando individuais sobre a formação de sinapses .
TAqui estão alguns passos cruciais no processo. Entre o mais crítico é que a oxidação dos lipossomas ser impedido através de um constante com árgon para deslocar o oxigénio do tubo e da solução, tal como nos passos 1.10, 2.6, e 2.11. A oxidação dos lípidos irá resultar numa diminuição da mobilidade lipídica, impedindo, assim, a capacidade de proteínas de superfície de se mover livremente e participar na estruturação sináptica. Da mesma forma, é também crucial para remover todo o clorofórmio no lipossoma por liofilização (passo 1.2). Na determinação da densidade de proteína na bicamada lipídica, é de importância para primeiro dispersar as pérolas de silício em uma suspensão homogénea livre de aglomerados. Se necessário, os grânulos de sonicação pode ser aplicada. Na montagem do SLB, os primeiros passos (5,1-5,8) em que as lamelas são limpos, as gotas são colocadas, e lamela é afixada são vitais. Um erro em qualquer um destes pode necessitar de começar a experiência sobre (a partir do início da secção 5). Por esta razão, éboas práticas para limpar mais lamelas do que será necessário para economizar tempo, em caso de um acidente.
Non-agrupamento é a questão mais frequente quando se trabalha com este sistema. Se, ao visualizar as células na etapa final, uma falha de encontrar quaisquer sinapses fluorescentes, existem algumas medidas que podem ser tomadas. Outra mancha para o receptor da superfície celular cognato pode ser adicionada à câmara para verificar que a célula não se formou uma sinapse com a bicamada, Enquanto as células podem aderir de forma não específica à superfície da lamela de vidro ou bicamada, as proteínas de superfície-sinapticamente envolvidos devem aparece como aglomerados distintos no plano da interface célula-bicamada, enquanto que as proteínas de superfície descomprometidos deve aparecer como coloração difusa em torno do perímetro da célula. No caso de este método falhar, deve-se verificar as suas células por citometria de fluxo para garantir que o marcador particular, uma espera para estudar é expressa em abundância adequada na superfície da célula. Certain prote superfícieins são conhecidos por ser regulada para baixo sobre a longo prazo na cultura vivo.
Embora este protocolo detalhes especificamente como visualizar a formação de sinapses de células NK, o sistema SLB pode ser utilizado para estudar a formação de sinapses em qualquer imunoc�tica imaginável simplesmente por substituição do ligante primário no passo 5.11. Vários ligandos também podem ser adicionados simultaneamente. Um também não é necessário utilizar um sistema de estreptavidina-biotina para fazer aderir as proteínas de superfície na bicamada. Nickel-NTA: interações histidina também são viáveis. No entanto, devido à elevada força e especificidade da estreptavidina: interacção biotina, o nosso laboratório prefere este sistema. Pode-se variar também a concentração de células adicionadas na bicamada da densidade prescrita no passo 5.13, assim como a duração do período de incubação subsequente, a fim de observar as sinapses em diferentes estádios de maturação. Isso pode ser feito até mesmo ao vivo, embora isso, naturalmente, exclui a possibilidade de visualizar str intracelulaructures (a menos que eles já estão marcadas com um marcador fluorescente fundido; nosso laboratório usa algumas dessas linhas de células alteradas). Devido ao alto grau de personalização possível neste protocolo, pode-se usar a técnica básica SLB, juntamente com imagens STED, para tratar de uma gama extremamente diversificada de questões em imunologia, biologia celular e bioquímica, incluindo a dinâmica de lipídios básicas 15, a formação de sinapses 16, de sinalização intracelular 17, e de células tumorais metástase 18.
Divulgações
The authors have nothing to disclose.
Agradecimentos
We thank Emily Mace and Malini Mukherjee for imaging and deconvolution analysis. Work in the Liu laboratory was supported in part by the Baylor-UTHouston Center for AIDS Research Core Support Grant number AI36211 from the National Institute of Allergy and Infectious Diseases, the Caroline Wiess Law Fund for Research in Molecular Medicine, Texas Children’s Hospital Pediatric Pilot Research Fund, and the Lymphoma SPORE Developmental Research Program from Baylor College of Medicine and the Methodist Research Institute.
Materiais
| Name | Company | Catalog Number | Comments |
| 18:1 (Δ9-Cis) PC (DOPC) 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti | 850375C | Liposome preparation |
| 18:1 Biotinyl Cap PE 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl) (sodium salt) | Avanti | 870273C | Liposome preparation |
| Argon gas, compressed | Airgas | UN1006 | Liposome preparation |
| A lyophilizer | Labconco | Freezone 7740020 | Liposome preparation |
| Lyophilizer tubes | Labconco | 7540200 | Liposome preparation |
| Chromatography Columns | Santa Cruz | sc-205558 | Liposome preparation |
| 1 M Tris pH 8.0 | Ambion | AM9856 | Liposome preparation |
| 5 M NaCl | Ambion | AM9759 | Liposome preparation |
| Octyl-β-D-glucopyranoside | Sigma-Aldrich | O1008 | Liposome preparation |
| Dialysis tubing | Spectrum Labs | 132676 | Liposome preparation |
| 96-well V-bottom polystyrene plate (untreated) | Corning | 3896 | antibody density determination |
| Non-functionalized silica beads | Bangs Laboratories | SS06N | antibody density determination |
| FACS tubes | Fisher Scientific | 14-959-2A | antibody density determination |
| QuantumTM MESF beads | Bangs Laboratories | Variable | antibody density determination |
| Casein | Sigma-Aldrich | C0875 | Lipid bilayer preparation |
| HEPES buffered saline + 1% HSA | Homemade | Lipid bilayer preparation | |
| Streptavidin | Life technologies | 434301 | Lipid bilayer preparation |
| Fluorescently-labeled biotinylated protein | Homemade | Lipid bilayer preparation | |
| ibidi Sticky-Slide VI 0.4 | ibidi | 80608 | Lipid bilayer preparation |
| 25x75 mm glass coverslip | ibidi | 10812 | Lipid bilayer preparation |
| Hydrogen peroxide (30%) | Fisher Scientic | BP2633 | Lipid bilayer preparation |
| Sulfuric acid | Sigma-Aldrich | 258105 | Lipid bilayer preparation |
| D-Biotin | Invitrogen | B20656 | Lipid bilayer preparation |
| Lens paper | VWR | 54826-001 | For imaging |
| Type F Immersion Oil | Leica | 11 513 859 | For imaging |
| A Leica TCS STED microscope | Leica | For imaging |
Referências
- Dustin, M. L., Long, E. O. Cytotoxic immunological synapses. Immunol. Rev. 235 (1), 24-34 (2010).
- Monks, C. R., Freiberg, B. A. K. u. p. f. e. r. H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Hafeman, D. G., von Tscharner, V., McConnell, H. M. Specific antibody-dependent interactions between macrophages and lipid haptens in planar lipid monolayers. Proc Natl Acad Sci USA. 78 (7), 4552-4556 (1981).
- Tscharner, V., McConnell, H. M. Physical properties of lipid monolayers on alkylated planar glass surfaces. Biophys J. 36 (2), 421-427 (1981).
- Crites, T. J., Chen, L., Varma, R. A TIRF microscopy technique for real-time, simultaneous imaging of the TCR and its associated signaling proteins. J. Vis. Exp. , (2012).
- Prins, K. C., Vasiliver-Shamis, G., Cammer, M., Depoil, D., Dustin, M. L., Hioe, C. E. Imaging of HIV-1 envelope-induced virological synapse and signaling on synthetic lipid bilayers. J. Vis. Exp. , (2012).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. , (2008).
- Michalet, X., Weiss, S. Using photon statistics to boost microscopy resolution. Proc. Natl. Acad. Sci. U. S. A. 103 (13), 4797-4798 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu. Rev. Biochem. 78, 993-1016 (2009).
- Lippincott-Schwartz, J., Manley, S. Putting super-resolution fluorescence microscopy to work. Nat. Methods. 6 (1), 21-23 (2009).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J. Vis. Exp. , (2014).
- Rak, G. D., Mace, E. M., Banerjee, P. P., Svitkina, T., Orange, J. S. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Leutenegger, M., Ringemann, C., Lasser, T., Hell, S. W., Eggeling, C. Fluorescence correlation spectroscopy with a total internal reflection fluorescence STED microscope (TIRF-STED-FCS). Opt Express. 20 (5), 5243-5263 (2012).
- Liu, D., Bryceson, Y. T., Meckel, T., Vasiliver-Shamis, G., Dustin, M. L., Long, E. O. Integrin-dependent organization and bidirectional vesicular traffic at cytotoxic immune synapses. Immunity. 31 (1), 99-109 (2009).
- Liu, D., Peterson, M. E., Long, E. O. The adaptor protein Crk controls activation and inhibition of natural killer cells. Immunity. 36 (4), 600-611 (2012).
- Wu, J. C., et al. Antibody conjugated supported lipid bilayer for capturing and purification of viable tumor cells in blood for subsequent cell culture. Biomaterials. 34 (21), 5191-5199 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados