Method Article
Супер-Resolution Imaging в естественных клеток-киллеров Иммунологические Synapse на стекло при поддержке Planar липидного бислоя
В этой статье
Резюме
We describe here a combination of the glass-supported lipid bilayer technique of forming immunological synapses with the super-resolution imaging technique of stimulated emission depletion (STED) microscopy. The goal of this protocol is to provide users with the instructions necessary to successfully carry out these two techniques.
Аннотация
The glass-supported planar lipid bilayer system has been utilized in a variety of disciplines. One of the most useful applications of this technique has been in the study of immunological synapse formation, due to the ability of the glass-supported planar lipid bilayers to mimic the surface of a target cell while forming a horizontal interface. The recent advances in super-resolution imaging have further allowed scientists to better view the fine details of synapse structure. In this study, one of these advanced techniques, stimulated emission depletion (STED), is utilized to study the structure of natural killer (NK) cell synapses on the supported lipid bilayer. Provided herein is an easy-to-follow protocol detailing: how to prepare raw synthetic phospholipids for use in synthesizing glass-supported bilayers; how to determine how densely protein of a given concentration occupies the bilayer's attachment sites; how to construct a supported lipid bilayer containing antibodies against NK cell activating receptor CD16; and finally, how to image human NK cells on this bilayer using STED super-resolution microscopy, with a focus on distribution of perforin positive lytic granules and filamentous actin at NK synapses. Thus, combining the glass-supported planar lipid bilayer system with STED technique, we demonstrate the feasibility and application of this combined technique, as well as intracellular structures at NK immunological synapse with super-resolution.
Введение
Иммунологические синапсы (IS) лежит на критическом стыке для активации и функции 1 клеток. Это является основным средством, с помощью которого представление антигена и клеточно-опосредованный иммунитет осуществляется. Самые ранние микроскопические исследования формирования синапсов использовать систему сопряженное клетка-клетка 2. Основное ограничение этого подхода заключается в том, что большинство конъюгатов будет рассматриваться "в профиль", как это было, таким образом, ограничивая мнение наблюдателя самой синаптической структурой. В 1999 году лаборатория Дастин имя это ограничение путем использования стекла при поддержке липидный бислой (SLB) метод 3, который был пионером ранее лабораторной 4,5 McConnel. Этот подход утилизировать антигенпрезентирующих клеток (АРС) в пользу стеклянной поддержке плоской поверхности липидов, в котором белки могут быть прикреплены и свободно перемещаться в двух измерениях. Используя этот метод, Дастин и его коллеги смогли заглянуть прямо вверх в тон Synapse при высоком разрешении флуоресцентной микроскопии, и впервые взглянуть "лицом к лицу" в структуре ИС.
При использовании системы SLB, детали, с которыми IS могут быть визуализированы была ограничена только ограничения тока методов визуализации 6-8. Используя стандартные методы освещения, минимальное разрешение (то есть, минимальное расстояние между двумя различными объектами, где они могут быть выделены) был <200 нм на основе критерия Рэлея 9. Это ограничение препятствует визуализации очень хорошо, молекулярно-штабных структур, которые составляют синапс, и вплоть до развития методов 10-12 изображений сверхвысокого разрешения, визуализация этих структур не ограничивается визуализации фиксированных клетках с помощью электронной микроскопии.
С недавним появлением различных методов супер-разрешением, таких как SIM (структурированного освещения микроскопии), PALM (фотоактивированные локализации микроскопия), STORM (стохастическая оптической микроскопии реконструкции), и STED 10-12, следователи теперь могут изучать эти синаптические структуры в беспрецедентных деталях, что в свою очередь дало более осветленной понимание IS. Преимущества STED микроскопии было описано ранее 13. Здесь мы опишем супер-разрешением изображений с STED микроскопии, оснащенной недавно разработанной истощения лазера 660 нм. По сравнению с обычным истощение лазера 592 нм, 660 нм лазера позволяет для более широкого выбора флуоресцентных красителей (см http://nanobiophotonics.mpibpc.mpg.de/old/dyes/), особенно таких красных флуорофоров.
В других публикациях описано STED изображений клеточных синапсов NK на покрытых антителами стеклах 13,14. При этом система SLB в сочетании с супер-разрешением STED микроскопии для изучения клеток NK синапс. Этот метод имеет преимущество перед антителос покрытием слайды будучи жидкости мозаику, в которой встроенные поверхностные белки могут свободно перемещаться в плоском двумерном поверхности (XY плоскости). Это более точно имитирует органические и подвижной поверхности клетки-мишени и, следовательно, лучше повторяет формирование физиологически соответствующей иммунной синапса.
Цель этого протокола заключается в предоставлении конечному пользователю с подробным описанием того, как к изображению иммунологического синапса NK клеток путем объединения системы SLB и супер-разрешения STED микроскопии. Это будет предоставить конечному пользователю шагов, необходимых для: подготовки липосом, построить белок встроен двухслойных, определить плотность белка на липидных бислоев, и получать изображения сверхвысокого разрешения с помощью STED микроскопии. Эти методы не ограничены к области иммунологии, и может быть широко использовано в различных областях.
протокол
1. Получение липосом,
- Рассчитать количество хлороформа суспендируют исходных растворов 1,2-диолеоил-Sn-глицеро-3-фосфохолин (DOPC) и 1,2-диолеоил-Sn-глицеро-3-фосфоэтаноламин-N- крышки биотинил (Биотин-ПЭ) чтобы разбавленные запасов в желаемой конечной концентрации. Для того, чтобы конечные концентрации 400 мкМ DOPC и 80 мкМ фосфолипидов Биотин-PE на 10 мл каждого, начать путем размещения 629 мкл 10 мг / мл DOPC и 88 мкл 10 мг / мл биотин-PE на отдельные стекла хроматографии труб.
Примечание: важно, чтобы очистить стекло Гамильтон шприцы и стеклянные трубки хроматографии путем очистки раствора (1 л 95% этанола в 120 мл воды, содержащей 60 г гидроксида калия, KOH), в то время как передача хлороформ-суспендируют исходного раствора DOPC и биотин-РЕ. - Сушат хлороформ с потоком аргона в химической капотом. Печать хроматографии трубки парафином.
- Тема вновь высушенных липосом в высоком вакууме в lyophilizэ O / N, чтобы удалить остатки хлороформ. Для этого же дня завершения, сухой 60-90 мин.
- В то время как Lyophilizer работает, подготовить некоторые буфер для разведения. Для этого протокола, подготовить 25 мл, состоящие из 25 мМ Трис, рН 8,0; 150 мМ NaCl; и 2% (по весу) н-октил-β-D-глюкопиранозид (ОГ) моющего средства. Смешайте первые два ингредиенты вместе, а затем вытесняют кислород с аргоном перед добавлением сухой OG порошок. После подготовки, фильтрации раствора с OG 0,2 мкм ацетата целлюлозы мембраны, и хранят при температуре 4 ° С.
- Кроме того, приготовить две завинчивающейся крышкой бутылки 1 л Трис-солевом буфере при тех же концентрациях, но без OG. Поместите дистиллированной бар магнитной перемешивающей водой мыть в нижней части каждого из них. Подготовка 6 дополнительных литров в Трис-солевом буфере. Удаления кислорода из всех бутылок с аргоном и помещают их на 4 ° С, а также.
- После лиофилизации, раствор ть высушенные липиды в Трис-солевом буфере OG, чтобы сделать 4 мМ раствора каждого. Следуя примеруобъемы, добавить 2 мл в DOPC трубки и 0,2 мл на Биотин-PE трубы.
- Смешайте биотин-PE липиды с DOPC липидов. Это улучшает подвижность SLB, а в сочетании биотин может привести к ухудшению текучести фосфатного головных групп. Для того, чтобы получить конечную концентрацию 80 мкМ биотин-PE, смешать 0,2 мл 4 мМ биотин-PE и 1 мл 4 мМ ДОФХ. Затем добавляют 8,8 мл в Трис-солевом буфере OG.
- Для конечной концентрации 400 мкМ ДОФХ, просто смешать 1 мл 4 мМ ДОФХ с 9 мл Трис-солевом OG.
- Заполните ультразвукового смесью воды со льдом. Поместите стеклянную трубку, содержащую разбавленный фосфолипид в центре обработки ультразвуком с помощью утилиты зажим. Разрушать ультразвуком разбавленного фосфолипид в течение 10 мин до тех пор, пока раствор не станет ясно.
Примечание: добавить лед в Sonicator водяной бане, чтобы поддерживать температуру низким, поскольку обработка ультразвуком будет генерировать тепло. - Заполните трубок аргоном, чтобы вытеснить кислород в пространстве над жидкостью воздух, и запечатать их с парафином.
2. Диализ липосом
- Вырезать из двух частей сухого диализной трубки (молекулярный вес Отключение: 12-14,000, диаметр: 6,4 мм) соответствующей длины (в данном примере, 40 см), по одному для каждой фосфолипидов разведения, от рулона.
- Увлажняет разделы насосно-компрессорных труб, позволяя им замочить в 200 мл дистиллированной воды в стеклянном стакане в течение 2 мин.
- не микроволнами в течение 5 мин при высоком значении, или, по крайней мере, до тех пор, вода закипит.
- Tie узел на одном конце каждой трубы и промыть внутреннюю с несколькими мл Трис-солевом буфере-OG. После этого тщательно выжать как можно больше этого промывочного буфера, как это возможно, чтобы свести к минимуму количество оставшегося буфера внутри.
- В ламинарном боксе, добавить разбавленные фосфолипиды в каждую пробирку и зажим открытые концы с небольшим закрытия диализа трубки таким образом, чтобы исключить весь воздух. Полное исключение воздуха потребует жертву небольшого объема образца, зажимая ниже и# 8220; линия воды ".
- Погрузить образцы в подготовленных ранее бутылок Трис-солевом буфере без OG. Вытеснения кислорода из бутылки с аргоном перед повторным уплотнением и месте перемешать O / N на 4 °.
- Передача трубку в новой бутылке Трис-солевой буфер, не OG каждые 12 ч в течение по крайней мере 3 раза.
- Незадолго до удаления Диализованный липидов, подготовить ряд малых трубок в которой аликвоту липиды, заполнив каждый аргоном для вытеснения кислорода.
- После 36 ч, принимать диализа бутылки в ламинарном боксе и удалить диализа труб из бутылок. Есть скамьи подгузник или стакан под рукой, чтобы собрать мокрой стока.
- Отрежьте трубку для диализа над клипом, затем снимите зажим и тщательно передачи диализированную липидный решение с помощью пипетки по 1 мл в аликвоты в заранее подготовленные трубок, заполненных аргоном на льду.
- Алиготе водный раствор липосом, использовать поток аргона для вытеснения кислорода снова яп каждая трубка.
- Хранить в липосомы 4 °. Не замораживать.
3. Определение плотности антител на липидный бислой
- Приготовьте серию разбавления биотинилированного, флуоресцентно-меченых антител, 50 мкл в объеме для каждого разведения, в следующих концентрациях: 0 нм (пустой), 10 нм, 50 нм, 100 нм, 500 нм. (Далее именуемые как "серии образца").
- Добавить 1 мкл шариков кремнезема в 6 лунках 96-луночного об-нижней пластины. Будьте уверены, чтобы пожать шарики и перед отбором, как они, как правило, чтобы обосноваться.
ПРИМЕЧАНИЕ: Если заказав сухие шарики, а не приостановлено, следуйте инструкциям производителя, чтобы разбавить. - Для этих бусин, добавить 2 мкл смешанного DOPC: биотинил фосфолипиды в соотношении 1: 1. Сделайте это для каждой скважины.
- Пульс пластину на вихревом на средней силы 3 раза в течение 10 сек каждой поощрять взаимодействие с бисером и фосфолипидов.
- Добавить 150 мкл 5% CASЭйн в каждую лунку. Все хорошо перемешать с помощью пипетки вверх и вниз три раза.
- Пусть пластины инкубируют в растворе казеина в течение 10 мин, затем промыть его. Мыть, заполнить каждую лунку в общем объеме 250 мкл с HEPES-солевой буферный раствор (HBS) с 1% сывороточного альбумина человека (HSA). Центрифуга на 1000 мкг в течение 2 мин. Внесите и выбросьте топ 200 мкл супернатанта и повторите дважды в общей сложности трех циклов стирки.
- Добавить 50 мкл стрептавидина на 333 нг / мл концентрации. Пульс пластину снова 3x 10 сек, и пусть он сидеть на шейкере в течение 15 мин. Вымойте 3x, как в шаге 6 для удаления несвязанного стрептавидин.
- Добавить 50 мкл флуоресцентно-меченного биотином антитела из полученного ранее серии разведений (см шаг 3,1) в каждую лунку, и заменить пластину на шейкере в течение 20-30 мин. Вымойте 3x, как в шаге 6 для удаления несвязанного антитела.
- После последней промывки, ресуспендируют бусины в 100 мкл HBS / 1% HSA, а затем перенести в FACS трубы. Повторите это дваждыобеспечить эффективное удаление всех шариков из колодца, в общей сложности 300 мкл, и сделать это для каждой скважины.
- Принесите в результате трубы с цитометром потока. Это время, чтобы прочитать их.
- Добавить 1 каплю из бутылки с пометкой "В" от калибровки интенсивности флуоресценции (FIC) борта комплект (далее упоминается как "стандартной серии") в FACS трубы, и разбавляют 300 мкл HBS / 1% HSA.
- Читайте эту трубку, но не записывать данные только пока. В настоящее время, просто убедитесь, что пустые шарики правильно обнуляется. Сделайте гистограмму, показывающую флуоресценции шариков, измеренных в соответствующий канал, то переложить напряжение лазера возбуждения, пока пик не на левый край гистограммы.
- Удалить трубку и добавить 1 каплю каждого из других трубок 4 в серии (с маркировкой от 1 до 4) в той же трубе. Теперь поместите трубку в машине снова, и записать полученные данные, которые должны появиться в 5 ярко выраженных пиков.
- Читайте каждую отдельную трубу из серии образца.
- Использование ПО FACS анализа, рисовать ворота, охватывающей всю ширину каждого пика в стандартной серии гистограммы на полумаксимальной точки. Это одни ворота для каждого пика. Сделайте то же самое для каждого образца. Обратите внимание на MFI (средней интенсивности флуоресценции) для каждого ворот.
- Использование вход программе электронных таблиц измеренных значений МФО в соответствующем месте. Также вход MESF (Молекулы эквивалентных Растворимый Флуорохром) значения (среднее число флуоресцентных молекул, покрывающих каждый шарик) для каждой бутылки в стандартной серии. Эта информация может быть найдена, следуя указаниям на пластиковой баночке трубы пришли.
- Используйте таблицу будет строить МФО со значениями MESF, создавая линейную корреляцию между количеством флуорофоров и измеренной интенсивности.
- Используйте модуль "белков и этикеток» в микро-объема спектрофотометра для определения соотношения красителя к пробелок в меченого антитела.
- Входной эффективность маркировки белка образца, средний диаметр гранул, покрытых липидами, а значение MFI, для каждой записи. Таблица будет автоматически использовать формулу из линейного графика, полученной на этапе 3,16 для вычисления значений MESF для каждого разведения белка и плотности посева белка образца при каждой концентрации.
4. выделения и культивирования человека киллеров
- Кратные 15 мл периферической крови или лейкоцитарной пленки в 50 мл коническую трубку. Развести эту кровь с PBS, содержащим 1% FBS в соотношении 1: 1.
- Добавить 13 мл Ficoll осторожно, чтобы в нижней части трубки с 10 мл серологической пипеткой.
- Центрифуга эта трубка течение 20 мин при 1200 мкг на ускорителе и разбежке или на их самых низких настройках.
- После центрифугирования использовать серологические пипетки для сбора плавающего мутный белый средний слой мононуклеарных клеток периферической крови (МКПК), шHICH должны сидеть и пересечение между светло-желтого верхнего слоя и более облачной бледно-цветной нижнего слоя, оба из которых расположены над нижний слой красных кровяных телец (эритроцитов). ПРИМЕЧАНИЕ Не для сбора любых эритроцитов в сборе МНПК.
- Поместите собранные РВМС в новом 50 мл коническую пробирку и разбавляют до отказа ФБР, содержащим 1% FBS. Центрифуга снова, на этот раз с тормозом и ускорителем, на максимум, в течение 5 мин при 300 х г.
- Жидкость над осадком сливают и клетки вновь суспендируют в 10 мл PBS, содержащим 1% FBS.
- Граф клеток, а центрифугирования еще раз те же параметры, что и в шаге 4.6.
- Жидкость над осадком сливают еще раз, и клетки вновь суспендируют в среде R10 при плотности 10 миллионов клеток / мл.
- Принимать по 30 миллионов клеток в 5 мл полистирола трубки, и изолировать NK клеток с использованием магнитного комплект разделения, в соответствии с инструкциями изготовителя. После выделения, подсчета клеток на один больше, и ресуспендируют при плотности 500,000 клеток / мл в полной среде R10 (88% RPMI, 10% FBS, 1% HEPES; 1% пирувата натрия) с добавлением IL-2 (100 ед / мл). Культура в 37 ° в CO 2 инкубаторе, и заменить среднего 2-3 раза в неделю.
5. Сборка Стекло, поддерживаемый Planar липидного бислоя
- Подготовьте 100 мл раствора пиранья путем смешивания 30% перекиси водорода с серной кислотой в соотношении 1: 3 в химическом стакане.
ПРИМЕЧАНИЕ: Всегда выполнять работу с вредными агентами, как серная кислота в должным образом обозначенных химическом вытяжном шкафу. - В этот раствор погружают 2 прямоугольных # 1,5 покровные в пираньи решение в течение 20-30 мин.
ПРИМЕЧАНИЕ: Важно, чтобы очистить покровные по пираньи решения. - В то время как покровные очищается, возьмите 1 тюбик заранее подготовленных 400 мкм DOPC липиды и 1 тюбик заранее подготовленный 80 мкм липиды Биотин-PE. Транспорт их на лед в аргоновой бака.
- Свернуть кислород в новом микроцентрифужных трубки аргоном,затем добавить вместе DOPC и биотин-PE в соотношении 1: 1. Удельный объем будет варьироваться в зависимости от экспериментальных потребностей, но должна быть не менее 2 мкл каждый. Вытеснения кислорода в смеси трубки еще раз аргоном, и отдельных реагентов, а также труб, перед возвращением последнего в холодильнике.
- После того как они закончили очистку, тщательно промойте покровные с дистиллированной водой. Установите покровные отъезда высохнуть на воздухе в течение нескольких минут.
- Вывод 1,5 мкл липосом смеси, приготовленной на стадии 5.4 и аликвоту его в одной капле в одном из переулка палат камеры слайда. Использование 2 капли на полосу типично, но не обязательно.
- Быстро и эффективно разместить сухой покровное над капелек. Убедитесь, что капли достаточно разнесены так, чтобы они не сливаются после того, как покровное помещается. Кроме того, убедитесь, что капли остаются круглыми и хорошо определен, не касаясь краев стенок камеры. Плотно прижмитемежду ними и вокруг каждой полосе, чтобы обеспечить водонепроницаемое уплотнение между покровным и горкой.
- Отметьте позиции капель с помощью маркером
- Проход 100 мкл 5% водным раствором казеина через камеру, чтобы блокировать бислой. Постарайтесь убедиться, что нет никаких пузырей в проточную камеру.
- Вводят 100 мкл стрептавидина в концентрации 333 нг / мл в каждой дорожке. Инкубируют в течение 10-15 мин при комнатной температуре. После мыть, выполнив 3 мл HBS / 1% HSA по каждой дорожке, чтобы удалить избыток стрептавидином.
- Добавить 100 мкл биотинилированного флуоресцентно-меченными анти-CD16, таких как Alexa Fluor 568 в концентрации белка было определено ранее, наиболее эффективными в разделе 3. Инкубируйте в темноте в течение 20-30 мин. Вымойте снова работает 3 мл HBS / 1% HSA по каждой полосе.
- Поток 100 мкл D-биотина в концентрации 25 нМ через камеру, чтобы связать излишки стрептавидин и, таким образом, исключить возможность неспецифического связывания из стreptavidin к клеткам.
- Количество НК-клеток и ресуспендируют в концентрации 500 000 / мл в HBS / 1% HSA.
- В то время как летел вниз клетки, мыть D-биотин из камеры с другим 3 мл HBS / 1% HSA на дорожку.
- Проверьте подвижность лигандов на SLB по флуоресценции восстановления после фотообесцвечивания (FRAP) на полное внутреннее отражение флуоресценции (TIRF) или конфокальной микроскопии до добавления NK клеток.
- После того, как клетки закончили вращение и были повторно суспендируют в нужной концентрации, добавить 100 мкл на каждую дорожку.
- Поместите камеру в 37 ° 5% CO 2 инкубаторе в течение 30-60 мин.
- После этого периода инкубации клетки фиксируют 4% параформальдегидом при комнатной температуре в течение 10-20 мин. Промыть, выполнив три мл PBS через каждую полосу, чтобы удалить параформальдегида.
- Добавить 400 мкл блокирующего буфера (5% нормальной сыворотки осла и 0,2% Tritron Х-100 в ЗФР). Инкубируют при комнатной температуре в течение 30 мин.
- Пятно F-актин и перфорин по объявлениемДин 200 мкл разведенного флуоресцентно меченного фаллоидином (1 ед / мл помечены фаллоидином) и флуоресцентно-меченными анти-перфорин МКА (500 нг / мл анти-перфорин МАБ). Инкубируют при комнатной температуре в течение 1 часа.
- Вымойте работает 3 мл PBS. Камера готова к визуализации.
6. Визуализация НК Synapse на липидный бислой, используя STED
- Включите все необходимые аппаратные модули.
- Запуск программного обеспечения для анализа изображений. Включить как резонансное сканирование и модули теплогенератором. После внесения этих настроек, подождите около 3-5 минут для программного обеспечения, чтобы начать.
- Перейдите на вкладку "Конфигурация" в верхней части экрана.
- Выберите "Лазерная Config" затем включите белым светом и STED 592 нм лазеров.
- Выберите 100x цели и совместите лазерную возбуждения луч с истощением лазера 592 нм.
- Выберите модуль "Laser Config", выключите истощение 592лазер, и очередь на истощение лазера 660 нм.
- Поместите слайд на сцене, над объективом. Принесите клеток, связанных с огороженной двухслойной области в фокусе, используя белый свет лампы и окуляров.
- Вернуться к вкладке "приобретение", непосредственно справа от вкладки "Конфигурация".
- Перейдите на вкладку "Переход к Whitelight", а затем включите этот модуль и перетащите лазерного возбуждения строку соответствующей длины волны.
- Выберите нужный детектор из списка тех, которые имеются, то установите диапазон обнаружения, чтобы охватить соответствующий диапазон длин волн.
ПРИМЕЧАНИЕ: НИКОГДА не дальность обнаружения непосредственно под пучком возбуждения. - Нажмите на кнопку "Seqential" в левой панели инструментов "Приобретение", чтобы открыть последовательного диалога сканирования в нижней части панели инструментов слева. Это позволяет пользователю добавить несколько последовательностей, каждаяс другим пучком возбуждения для другого цвета. Нажмите "между кадрами", а затем установите частоту возбуждения, детектор и дальность обнаружения для каждого дополнительного цвета, как на этапах 6,9 и 6,10.
- После того как все параметры оптимизированы, нажмите "Пуск", чтобы начать процесс покупки.
- Применить бесплатное программное обеспечение деконволюции (Гюйгенс), используя параметр предназначен для STED деконволюции, как описано выше 13.
Результаты
На рисунке 1 представлен результат плотности антител на липидный бислой. Принцип заключается в использовании стандартных шарики, чтобы сделать стандартную кривую MESF против МФО через проточной цитометрии (А). MFI серии образцов был преобразован в MESF использованием стандартной кривой. Плотность антитела на липидный бислой линейно коррелирует с концентрацией антител (B). Рисунок 2 Показать тройной цвет STED образ НК синапса на стекло-поддержки плоской липидного бислоя. Anti-CD16 антитела на липидный бислой накапливается, вызывая F-актин образование и поляризацию и проникновение перфорин через F-актина сетки в фокальной панели иммунологической синапса натуральных киллеров. Используя этот комбинированный подход, можно аккуратно соблюдать микрокластеры флуоресцентно-меченными анти-CD16 в SLB, который непосредственно является зеркальным отражением кластеризации CD16 на клетки NK. По сравнению с обычным конфокальной изображения, структура CD16 Centraл кластер легче различить на изображении STED из-за обедненного флуоресценции окружающей среды. Кроме того, ультраструктура цитоскелета видно со значительно улучшенной резолюции. В соответствии с предыдущими наблюдениями 16,17, в Перфорин-положительных литические гранулы видны расположены по регионам с низким F-актина плотности в изображении STED, решающий деталь, которая, в основном, затерянном в конфокальной изображения.
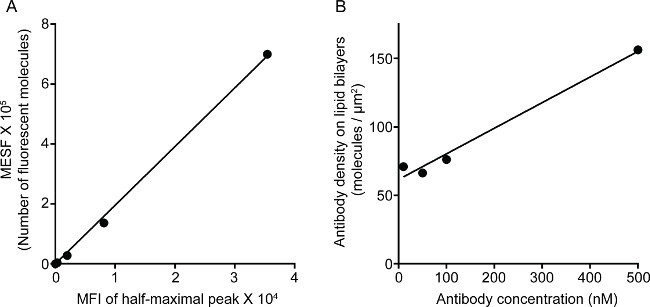
Рисунок 1. Плотность 3G8 антитела на липидный бислой. () Линейная корреляция между MESF и МФО для стандартной серии. (B) линейной корреляции между плотностью белка и концентрации для серии разведений образец белка, показывающий количество флуоресцентно-меченых белков мономеров на единицу площади, как функцию от увеличением концентрации липидов в покрытием сиЛица бусы.
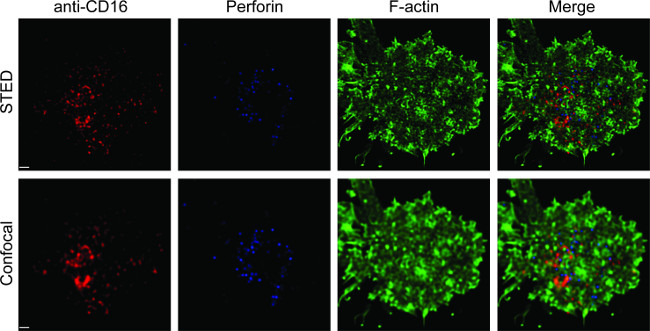
Рисунок 2. STED изображений НК синапса на плоской липидного бислоя. Первичная NK клетки стимулировали на SLB, содержащий биотинилировали флуоресцентно-меченными анти-CD16 (красный), фиксированная, проницаемыми, а затем окрашивали фаллоидином (синий) и анти-F-актина (зеленый). Отдельная клетка впервые отображаемого при нормальном уровне конфокальной, а затем установка STED. Конфокальные и теплогенератором изображения были деконволюции с использованием программного обеспечения Гюйгенса. Масштабная линейка, 1 мкм. Щелкните здесь для большей версии этой фигуры.
Обсуждение
Новизна данного исследования является то, что он сочетает в себе технику SLB с STED для изучения клеточных синапсов NK. Предыдущие исследования отображены в липидный бислой с TIRF изучать образование Т-клеток синапсов 8 и оборотом сигналов молекулы на плазматической мембране 6. Другие описали STED изображений клеточных синапсов NK с помощью антител, покрытые стеклянные слайды 13,14. Гибридный метод, описанный здесь далее строится на этих усилий визуализации клеток синапс НК с повышенной четкостью, предоставляемой супер разрешающей способностью на двухслойной липидной поверхности, что лучшие модели динамического поверхность БТР.
Хотя SLBS искусственные мембраны, лишенные цитоскелета, липидов плоты и другие лиганды, что фактические клетки-мишени или БТР обладают, эта техника может повторять важные функции, такие как мобильность и ориентации лигандов. Это позволяет системе SLB служить редукционистского подхода в рассекает тон вклад отдельных рецепторов и лигандов к образованию IS и динамики IS. Наиболее важной особенностью SLBS является то, что исследователи могут совмещать эту технику с подходами формирования изображений с высоким разрешением, например, конфокальной и TIRF микроскопии. Введение STED микроскопии еще больше увеличивает это преимущество, предоставляя беспрецедентные понимание является исследование и его клиническое применение.
Одним из потенциальных критика этой системы является то, что SLB не адекватно имитировать сложную поверхность БТР, таким образом, приводя к потенциально нефизиологических анатомических особенностей в результате синапсов. Хотя это правда, что ограниченный репертуар поверхностных молекул на SLB не полностью воспроизводят гетерогенно населенный поверхность БТР, этот предел может быть выгодно тем, что позволяет исследователям определить влияние отдельных рецепторов и лигандов взаимодействий на формирование синапсов ,
Tздесь несколько важных шагов в этом процессе. Среди наиболее важным является, что окисление липосом быть предотвращены с помощью постоянно при использовании аргона для вытеснения кислорода в трубке и решения, такие, как в шагах 1,10, 2,6 и 2,11. Окисление липидов приведет к снижению липидов мобильности, препятствуя тем самым способность поверхностных белков свободно передвигаться и участвовать в синаптической структурирования. Кроме того, важно также, чтобы удалить все хлороформ в липосомы путем лиофилизации (этап 1.2). При определении плотности белка в липидный бислой, что имеет важное значение для первого разгона кремния шарики в гомогенной суспензии свободного от кластеров. При необходимости обработку ультразвуком шариков могут быть применены. В сборке SLB, ранние этапы (5.1-5.8), где покровные чистить, капли помещаются, и покровное прикреплена являются жизненно важными. Ошибка в любой из них может потребовать начала эксперимента над (с начала раздела 5). По этой причине, онахорошая практика, чтобы очистить больше покровные, чем будут необходимы, чтобы сэкономить время в случае неудачи.
Номера для кластеризации наиболее часто вопрос при работе с этой системой. Если при визуализации клеток в конечной стадии, не удается найти все люминесцентные синапсов, есть несколько шагов, которые могут быть приняты. Другой краситель для родственного рецептором клеточной поверхности могут быть добавлены к камере, чтобы убедиться, что клетка не образуется синапс с бислой, тогда как клетки, могут прилипать неспецифически с покровным стеклом или двухслойной поверхности, синаптически-поверхностные белки, участвующие должны выглядят как отдельные кластеры в плоскости интерфейса клеток двухслойной, а незанятым поверхностные белки должны выглядеть как диффузного окрашивания по периметру клетки. В случае, если этот метод сбой, следует проверить их клетки через проточной цитометрии для того, чтобы частности маркера один рассчитывает изучить выражается в адекватной изобилии на поверхности клетки. Некоторые поверхность PROTEмодули, как известно, подавляется в течение длительного времени в естественных условиях культуры.
В то время как это подробно протокола в частности, как визуализировать образование клеток NK синапсов, система SLB может быть использован для изучения формирования синапсов в любом иммуноцита можно себе представить просто путем замены основного лиганда на этапе 5,11. Несколько лиганды также могут быть добавлены одновременно. Можно также не должны использовать систему стрептавидин-биотин для приклеивания поверхностных белков в бислой. Никель-NTA: гистидин взаимодействия также являются приемлемыми. Тем не менее, из-за высокой прочности и специфичности стрептавидином: биотин взаимодействия, в нашей лаборатории предпочитает эту систему. Можно также варьировать концентрацию клеток, добавленных на бислоя от заданной плотности в шаге 5,13, а также длительность последующего периода инкубации для того, чтобы наблюдать синапсы на различных стадиях созревания. Это даже может быть сделано в прямом эфире, хотя это, конечно, исключает возможность визуализации внутриклеточного улuctures (если они уже не помечены плавленого флуоресцентной метки, наша лаборатория использует несколько таких измененных клеток линии). В связи с высокой степенью кастомизации возможно в этом протоколе, можно использовать базовую технику SLB, наряду с STED изображений, для решения невероятно разнообразный круг вопросов в области иммунологии, клеточной биологии и биохимии, в том числе основной динамикой липидных 15, формирование синапсов 16, внутриклеточной сигнализации 17 и метастазов опухолевых клеток 18.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
We thank Emily Mace and Malini Mukherjee for imaging and deconvolution analysis. Work in the Liu laboratory was supported in part by the Baylor-UTHouston Center for AIDS Research Core Support Grant number AI36211 from the National Institute of Allergy and Infectious Diseases, the Caroline Wiess Law Fund for Research in Molecular Medicine, Texas Children’s Hospital Pediatric Pilot Research Fund, and the Lymphoma SPORE Developmental Research Program from Baylor College of Medicine and the Methodist Research Institute.
Материалы
| Name | Company | Catalog Number | Comments |
| 18:1 (Δ9-Cis) PC (DOPC) 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti | 850375C | Liposome preparation |
| 18:1 Biotinyl Cap PE 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl) (sodium salt) | Avanti | 870273C | Liposome preparation |
| Argon gas, compressed | Airgas | UN1006 | Liposome preparation |
| A lyophilizer | Labconco | Freezone 7740020 | Liposome preparation |
| Lyophilizer tubes | Labconco | 7540200 | Liposome preparation |
| Chromatography Columns | Santa Cruz | sc-205558 | Liposome preparation |
| 1 M Tris pH 8.0 | Ambion | AM9856 | Liposome preparation |
| 5 M NaCl | Ambion | AM9759 | Liposome preparation |
| Octyl-β-D-glucopyranoside | Sigma-Aldrich | O1008 | Liposome preparation |
| Dialysis tubing | Spectrum Labs | 132676 | Liposome preparation |
| 96-well V-bottom polystyrene plate (untreated) | Corning | 3896 | antibody density determination |
| Non-functionalized silica beads | Bangs Laboratories | SS06N | antibody density determination |
| FACS tubes | Fisher Scientific | 14-959-2A | antibody density determination |
| QuantumTM MESF beads | Bangs Laboratories | Variable | antibody density determination |
| Casein | Sigma-Aldrich | C0875 | Lipid bilayer preparation |
| HEPES buffered saline + 1% HSA | Homemade | Lipid bilayer preparation | |
| Streptavidin | Life technologies | 434301 | Lipid bilayer preparation |
| Fluorescently-labeled biotinylated protein | Homemade | Lipid bilayer preparation | |
| ibidi Sticky-Slide VI 0.4 | ibidi | 80608 | Lipid bilayer preparation |
| 25x75 mm glass coverslip | ibidi | 10812 | Lipid bilayer preparation |
| Hydrogen peroxide (30%) | Fisher Scientic | BP2633 | Lipid bilayer preparation |
| Sulfuric acid | Sigma-Aldrich | 258105 | Lipid bilayer preparation |
| D-Biotin | Invitrogen | B20656 | Lipid bilayer preparation |
| Lens paper | VWR | 54826-001 | For imaging |
| Type F Immersion Oil | Leica | 11 513 859 | For imaging |
| A Leica TCS STED microscope | Leica | For imaging |
Ссылки
- Dustin, M. L., Long, E. O. Cytotoxic immunological synapses. Immunol. Rev. 235 (1), 24-34 (2010).
- Monks, C. R., Freiberg, B. A. K. u. p. f. e. r. H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Hafeman, D. G., von Tscharner, V., McConnell, H. M. Specific antibody-dependent interactions between macrophages and lipid haptens in planar lipid monolayers. Proc Natl Acad Sci USA. 78 (7), 4552-4556 (1981).
- Tscharner, V., McConnell, H. M. Physical properties of lipid monolayers on alkylated planar glass surfaces. Biophys J. 36 (2), 421-427 (1981).
- Crites, T. J., Chen, L., Varma, R. A TIRF microscopy technique for real-time, simultaneous imaging of the TCR and its associated signaling proteins. J. Vis. Exp. , (2012).
- Prins, K. C., Vasiliver-Shamis, G., Cammer, M., Depoil, D., Dustin, M. L., Hioe, C. E. Imaging of HIV-1 envelope-induced virological synapse and signaling on synthetic lipid bilayers. J. Vis. Exp. , (2012).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. , (2008).
- Michalet, X., Weiss, S. Using photon statistics to boost microscopy resolution. Proc. Natl. Acad. Sci. U. S. A. 103 (13), 4797-4798 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu. Rev. Biochem. 78, 993-1016 (2009).
- Lippincott-Schwartz, J., Manley, S. Putting super-resolution fluorescence microscopy to work. Nat. Methods. 6 (1), 21-23 (2009).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J. Vis. Exp. , (2014).
- Rak, G. D., Mace, E. M., Banerjee, P. P., Svitkina, T., Orange, J. S. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Leutenegger, M., Ringemann, C., Lasser, T., Hell, S. W., Eggeling, C. Fluorescence correlation spectroscopy with a total internal reflection fluorescence STED microscope (TIRF-STED-FCS). Opt Express. 20 (5), 5243-5263 (2012).
- Liu, D., Bryceson, Y. T., Meckel, T., Vasiliver-Shamis, G., Dustin, M. L., Long, E. O. Integrin-dependent organization and bidirectional vesicular traffic at cytotoxic immune synapses. Immunity. 31 (1), 99-109 (2009).
- Liu, D., Peterson, M. E., Long, E. O. The adaptor protein Crk controls activation and inhibition of natural killer cells. Immunity. 36 (4), 600-611 (2012).
- Wu, J. C., et al. Antibody conjugated supported lipid bilayer for capturing and purification of viable tumor cells in blood for subsequent cell culture. Biomaterials. 34 (21), 5191-5199 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены