Method Article
הדמיה ברזולוציה סופר של תא הרוצח הטבעי החיסונית סינפסה על מישורי שומנים bilayer נתמך-זכוכית
In This Article
Summary
We describe here a combination of the glass-supported lipid bilayer technique of forming immunological synapses with the super-resolution imaging technique of stimulated emission depletion (STED) microscopy. The goal of this protocol is to provide users with the instructions necessary to successfully carry out these two techniques.
Abstract
The glass-supported planar lipid bilayer system has been utilized in a variety of disciplines. One of the most useful applications of this technique has been in the study of immunological synapse formation, due to the ability of the glass-supported planar lipid bilayers to mimic the surface of a target cell while forming a horizontal interface. The recent advances in super-resolution imaging have further allowed scientists to better view the fine details of synapse structure. In this study, one of these advanced techniques, stimulated emission depletion (STED), is utilized to study the structure of natural killer (NK) cell synapses on the supported lipid bilayer. Provided herein is an easy-to-follow protocol detailing: how to prepare raw synthetic phospholipids for use in synthesizing glass-supported bilayers; how to determine how densely protein of a given concentration occupies the bilayer's attachment sites; how to construct a supported lipid bilayer containing antibodies against NK cell activating receptor CD16; and finally, how to image human NK cells on this bilayer using STED super-resolution microscopy, with a focus on distribution of perforin positive lytic granules and filamentous actin at NK synapses. Thus, combining the glass-supported planar lipid bilayer system with STED technique, we demonstrate the feasibility and application of this combined technique, as well as intracellular structures at NK immunological synapse with super-resolution.
Introduction
סינפסה החיסונית (IS) נמצאת בצומת קריטית להפעלת תא ותפקוד 1. זה המדיום העיקרי שבאמצעותו מצגת אנטיגן וחסינות תא בתיווך מתבצעים. המחקרים המיקרוסקופיים המוקדמים של היווצרות הסינפסה מנוצלים מערכת המצומד תאי תאים 2. המגבלה העיקרית בגישה זו היא שרוב conjugates ייחשב "בפרופיל", כפי שהוא היה, ובכך מגביל את מבטו של הצופה של המבנה הסינפטי עצמו. בשנת 1999, המעבדה דסטין התייחסה מגבלה זו על ידי שימוש בטכניקת bilayer שומנים נתמך זכוכית (SLB) 3, שהיה חלוצה קודם לכן על ידי 4,5 המעבדה McConnel. גישה זו מסולק תאי הצגת אנטיגן (נגמ"שים) לטובת משטח שומנים מישוריים-נתמך זכוכית, שאליו יכולים להיות מצורפים חלבונים ולנוע בחופשיות בשני ממדים. באמצעות שיטה זו, דסטין ועמיתים הצליחו להציץ ישירות לתוך tהוא סינפסה באמצעות מיקרוסקופ פלואורסצנטי ברזולוציה גבוה, ובפעם הראשונה לקבל מבט "פנים אל פנים" במבנה של IS.
עם השימוש במערכת SLB, הפרטים שבה ניתן דמיינו IS הוגבל רק על ידי המגבלות של טכניקות הדמיה הנוכחיות 6-8. באמצעות שימוש בטכניקות תאורה סטנדרטית, הרזולוציה המינימלית (כלומר, מרחק מינימאלי בין שני עצמים נפרדים שבה הם יכולים להיות מכובדים) כבר <200 ננומטר על בסיס הקריטריון של ריילי 9. מגבלה זו מעכבת את ההדמיה של מבנים המרכיבים את סינפסה יפים מאוד, בקנה מידה מולקולרית, ועד פיתוח טכניקות הדמיה ברזולוציה סופר 10-12, הדמיה של מבנים אלה הייתה מרותקת להדמיה של תאים קבועים באמצעות מיקרוסקופ אלקטרונים.
עם כניסתו האחרונה של מגוון רחב של טכניקות ברזולוציה סופר, כגון SIM (מיקרוסקופיה תאורה מובנה), PALM (מיקרוסקופיה photoactivated לוקליזציה), STORM (מיקרוסקופיה אופטית שחזור stochastical), וSTED 10-12, חוקרים יכולים ללמוד מבנים הסינפטי אלה בפירוט חסר תקדים, שבו יש בתורו סיפק הבנה הבהירה יותר ויותר של עכשיו. היתרונות של מיקרוסקופיה STED תוארו לפני 13. כאן אנו מתארים הדמיה ברזולוציה סופר עם מיקרוסקופיה STED מצויד בליזר דלדול 660 ננומטר החדש שפותח. בהשוואה לליזר דלדול 592 ננומטר הקונבנציונלי, לייזר 660 nm מאפשר מבחר רחב יותר של צבעי ניאון (ראה http://nanobiophotonics.mpibpc.mpg.de/old/dyes/), במיוחד אלה fluorophores האדומה.
פרסומים אחרים תארו ההדמיה STED של סינפסות תא NK בשקופיות זכוכית מצופה נוגדן 13,14. כאן, מערכת SLB בשילוב עם מיקרוסקופ STED ברזולוציה הסופר ללמוד סינפסה תא NK. טכניקה זו יש יתרון על פני antibody-שקופיות מצופים של להיות פסיפס נוזל, שבו חלבוני המשטח המשובצים יכולים לנוע בחופשיות במשטח שטוח דו-ממדי (מישור xy). זה נאמן יותר מחקה את פני השטח האורגניים וניידים של תא מטרה, וכתוצאה מכך יותר טוב משחזר את היווצרות סינפסה החיסונית רלוונטית מבחינה פיזיולוגית.
המטרה של פרוטוקול זה היא לספק למשתמש הקצה עם תיאור מפורט של איך תמונת סינפסה החיסונית של תאי NK על ידי שילוב של מערכת SLB ומיקרוסקופיה STED ברזולוציה סופר. זה יספק למשתמש קצה עם את הצעדים דרושים כדי: להכין ליפוזומים, לבנות bilayers-משובץ חלבון, לקבוע את צפיפות החלבון על bilayers השומנים בדם, ולרכוש תמונות ברזולוציה סופר באמצעות מיקרוסקופ STED. טכניקות אלה אינן מוגבלים לתחום האימונולוגיה, ויכולות להיות מנוצלת באופן רחב על פני מגוון רחב של תחומים.
Protocol
1. הכנת ליפוזומים
- לחשב את כמות פתרונות מניות-מושעה כלורופורם של 1,2-dioleoyl-SN-glycero-3-phosphocholine (dOPC) וbiotinyl 1,2-dioleoyl-SN-glycero-3-phosphoethanolamine-N-כובע (ביוטין-PE) כדי להפוך את המניות מדוללים בריכוז הסופי הרצוי. כדי להפוך ריכוזים סופיים של 400 מיקרומטר וdOPC 80 מיקרומטר פוספוליפידים יוטין-PE בשעה 10 מיליליטר כל אחד, להתחיל על ידי הצבת 629 μl של dOPC / מיליליטר 10 מ"ג ו -88 μl 10 מ"ג / מיליליטר ביוטין-PE לתוך צינורות נפרדים כרומטוגרפיה זכוכית.
הערה: חשוב לנקות מזרקים המילטון זכוכית וצינורות זכוכית כרומטוגרפיה על ידי ניקוי פתרון (1 ליטר אתנול 95% ל -120 מיליליטר מים המכילים הידרוקסיד 60 גרם אשלגן, KOH), בעת העברת מניות פתרון-מושעה כלורופורם של dOPC וביוטין-PE. - ייבש את כלורופורם עם זרם של ארגון בשכונה הכימית. לאטום את צינור כרומטוגרפיה על ידי parafilm.
- נושא יפוזומים המיובשים החדש לואקום גבוה בlyophilizאה O / N כדי להסיר כל כלורופורם שיורית. להשלמה באותו יום, יבשה ל60-90 דקות.
- בעוד ריצות lyophilizer, להכין כמה חיץ דילול. לפרוטוקול זה, להכין 25 מיליליטר בהיקף של 25 מ"מ טריס, pH 8.0; 150 מ"מ NaCl; ו -2% (לפי משקל) חומר ניקוי n-octyl-β-D-glucopyranoside (OG). מערבבים את שני המרכיבים הראשונים ביחד ראשון, אז לעקור חמצן עם ארגון לפני הוספת אבקת OG היבשה. לאחר הכנה, לסנן את פתרון OG עם קרום אצטט 0.2 מיקרון תאית, ולאחסן ב 4 ° C.
- בנוסף, להכין שני בקבוקי בורג העליון של 1 ליטר של חיץ טריס-מלוח באותו הריכוזים, אך ללא OG. הנח בר מערבבים מגנטיים לניקוי מים מזוקק בחלק התחתון של כל אחד. הכן 6 ליטר נוסף של חיץ טריס-מלוח. הסר חמצן מכל הבקבוקים עם ארגון ומניח אותם על 4 מעלות צלזיוס, כמו גם.
- לאחר lyophilization, לפזר את השומנים המיובשים במאגר OG טריס-מלוח לעשות פתרון 4 מ"מ של כל אחד. בעקבות הדוגמאכרכים, להוסיף 2 מיליליטר לצינור dOPC, ו -0.2 מיליליטר לצינור ביוטין-PE.
- מערבבים יחד את השומנים ביוטין-PE עם שומני dOPC. זה משפר את הניידות של SLB, כביוטין בשילוב יכול לפגוע בנזילות של קבוצות ראש פוספט. כדי להפוך לריכוז סופי של 80 מיקרומטר ביוטין-PE, לערבב 0.2 מיליליטר של 4 מ"מ ביוטין-PE ו 1 מיליליטר של 4 מ"מ dOPC. לאחר מכן להוסיף 8.8 מיליליטר של חיץ OG טריס-מלוח.
- לריכוז סופי של 400 מיקרומטר dOPC, פשוט לערבב 1ml של 4 מ"מ dOPC עם 9 מיליליטר של OG טריס-מלוח.
- מלא את sonicator עם מי קרח. שים את שפופרת הזכוכית המכילה פוספוליפידים מדוללים במרכז sonicator באמצעות מהדק שירות. Sonicate פוספוליפידים בדילול למשך 10 דקות עד לפתרון הופך ברור.
הערה: הוסף קרח לאמבטיה המים sonicator כדי לשמור על הטמפרטורה נמוכה מאז sonication יפיק חום. - מלא את הצינורות עם ארגון כדי לתפוס את החמצן באוויר מעל הנוזל, ולאטום אותם עם parafilm.
2. דיאליזה של יפוזומים
- לחתוך שני חלקים של צינורות דיאליזה יבשים (משקל מולקולרי חתוך: 12-14,000, קוטר: 6.4 מ"מ) באורך המתאים (בדוגמא זו, 40 סנטימטרים), אחד עבור כל דילול פוספוליפידים, מהגליל.
- רעננותם סעיפי צינורות כך שהוא מאפשר להם לספוג ב200 מיליליטר של מים מזוקקים בכוס זכוכית למשך 2 דקות.
- מיקרוגל זה במשך 5 דקות בהגדרה גבוהה, או לפחות עד שהמים מגיעים לרתיחה.
- לקשור קשר בקצה אחד של כל צינור ולשטוף את הפנים עם כמה מיליליטרים של חיץ טריס-מלוח-OG. לאחר מכן, בקפדנות לסחוט כמה שיותר לשטוף החיץ הזה ככל האפשר כדי למזער את הכמות של חיץ נשארה בתוכו.
- בזרימה למינרית, להוסיף פוספוליפידים מדוללים לתוך צינור אחד ומהדק את הקצוות הפתוחים עם סגירת צינור דיאליזה קטנה כדי להוציא את כל האוויר. הדרת אוויר מלאה תדרוש ההקרבה של נפח קטן של המדגם על ידי כיווץ מתחת ל&# 8220; קו מים ".
- לטבול את הדגימות בבקבוקים שהוכנו קודם לכן של חיץ טריס-מלוח ללא OG. לעקור חמצן בבקבוק עם ארגון מחדש לפני איטום והמקום לעורר O / N ב 4 מעלות.
- העבר את הצינור לתוך בקבוק חדש של חיץ טריס-מלוח ללא OG כל 12 שעות לפחות 3 פעמים.
- זמן קצר לפני הסרת שומני דיאליזה, להכין מספר הצינורות הקטנים שלתוכו לaliquot שומנים על ידי מילוי כל אחד עם ארגון כדי לתפוס את החמצן.
- לאחר 36 שעות, לקחת את בקבוקי דיאליזה לזרימה למינרית ולהסיר את צינורות דיאליזה מהבקבוקים. יש לי חיתול ספסל או כוס ביד כדי לאסוף את הנגר הרטוב.
- חותך את צינורות הדיאליזה מעל קליפ, ולאחר מכן להסיר את הסרטון וזהירות להעביר את פתרון שומנים דיאליזה באמצעות pipet ל1 aliquots מיליליטר בצינורות מוכן מראש מלאים בגז ארגון על קרח.
- Aliquot פתרון liposome המימי, להשתמש בזרם הארגון לעקור חמצן שוב in כל צינור.
- אחסן את יפוזומים על 4 מעלות. לא להקפיא.
3. קביעת צפיפות נוגדן על bilayer השומנים
- הכן סדרת דילול של נוגדן biotinylated, fluorescently שכותרתו, 50 μl בנפח עבור כל דילול, בריכוזים הבאים: 0 nM (ריק), 10 ננומטר, 50 ננומטר, 100 ננומטר, 500 ננומטר ו. (מכאן והלאה המכונה "סדרת מדגם").
- הוסף 1 μl של חרוזים סיליקה ל6 בארות של צלחת-v תחתון 96-היטב. הקפד לנער את החרוזים גם לפני pipetting, כפי שהם נוטים להתיישב.
הערה: אם לאחר שהזמין חרוזים יבשים ולא על תנאי, בצע את הוראות היצרן כדי לדלל. - לחרוזים האלה, להוסיף 2 μl מעורב dOPC: פוספוליפידים Biotinyl ביחס של 1: 1. האם זה עבור כל אחד.
- Pulse את הצלחת על vortexer בחוזק בינוני 3 פעמים במשך 10 שניות כל אחד לעודד אינטראקציה עם חרוזים ופוספוליפידים.
- להוסיף 150 μl של CAS 5%ein היטב כל אחד. מערבבים היטב על ידי pipetting למעלה ולמטה שלוש פעמים.
- בואו צלחת דגירה בפתרון קזאין במשך 10 דקות, ולאחר מכן לשטוף אותו החוצה. לשטוף, למלא היטב כל אחד בהיקף כולל של 250 μl עם HEPES שנאגרו מלוח (HBS) עם אלבומין 1% בסרום אדם (HSA). צנטריפוגה XG ב 1000 למשך 2 דקות. פיפטה החוצה ולהשליך את 200 μl העליון של supernatant, וחזור פעמיים בסכום כולל של שלושה מחזורי שטיפה.
- הוסף 50 μl של streptavidin ב333 ng / ml ריכוז. Pulse הצלחת 3x 10 שניות שוב, ולתת לו לשבת על שייקר במשך 15 דקות. 3x לשטוף כמו בשלב 6 להסרת streptavidin מאוגד.
- הוסף 50 μl של נוגדן biotinylated שכותרתו fluorescently מסדרת הדילול שהוכנה קודם לכן (ראה שלב 3.1) זה טוב, ולהחליף את הצלחת על שייקר במשך 20-30 דקות. 3x לשטוף כמו בשלב 6 להסרת נוגדן מאוגד.
- לאחר לשטוף הסופי, resuspend את החרוזים בשל HBS / 1% HSA 100 μl, ולאחר מכן להעביר לצינור FACS. חזור פעמיים זה ללהבטיח את ההסרה היעילה של כל חרוזים מהבאר, עבור הסכום כולל של 300 μl, ולעשות את זה לכל אחד.
- להביא את הצינורות וכתוצאה מכך לזרימת cytometer. זה זמן לקרוא אותם.
- להוסיף 1 טיפה מהבקבוק המסומן "B" מערכת חרוז כיול עוצמת הקרינה (FIC) (להלן בשם "סדרה סטנדרטית") לצינור FACS, ולדלל עם 300 μl של HBS / 1% HSA.
- קראו הצינור הזה, אבל לא להקליט את הנתונים עדיין. לעת עתה, פשוט לוודא שהחרוזים הריקים מאופסים כראוי. הפוך ההיסטוגרמה מראה את הקרינה של חרוזים נמדדו בערוץ המתאים, ולאחר מכן להעביר את המתח של לייזר העירור למטה עד השיא הוא בצד השמאלי של ההיסטוגרמה.
- הסר את הצינור ולהוסיף 1 טיפה של כל אחד 4 הצינורות האחרים בסדרה (שכותרתו 1 עד 4) לאותו צינור. עכשיו, במקום הצינור במכונה שוב, ולהקליט את הנתונים שהתקבלו, שאמורה להופיע כ5 פסגות שונות.
- קראו כל צינור בודד מסדרת המדגם.
- שימוש בתוכנת ניתוח FACS, לצייר שער פורש את כל הרוחב של כל שיא בהיסטוגרמה הסדרה סטנדרטית בנקודת חצי מקסימלי. זה שער אחד לכל שיא. לעשות את אותו הדבר עבור כל דגימה. הערה MFI (ממוצע הקרינה בעוצמה) לכל שער.
- שימוש בקלט תכנית גיליון אלקטרוני ערכי MFI הנמדד במקום המתאים. גם קלט MESF (המולקולות של Equivalent מסיס Fluorochrome) ערכים (מספר ממוצע של מולקולות ניאון ציפוי כל חרוז) לכל בקבוק בסדרה סטנדרטית. ניתן למצוא מידע זה על ידי ביצוע ההוראות על פלסטיק צנצנת הצינורות נכנסו.
- השתמש בגיליון האלקטרוני יהיה לתכנן את MFI נגד ערכי MESF, יצירת קשר לינארי בין מספר fluorophores והעוצמה נמדדת.
- להשתמש במודול של 'חלבונים ותוויות' בספקטרופוטומטר מיקרו הנפח כדי לקבוע את היחס של צבע לפרוחלבון בנוגדן שכותרתו.
- קלט יעילות התיוג של חלבון המדגם, הקוטר הממוצע של חרוזים מצופים בשומנים, וערך MFI עבור כל ערך. הגיליון האלקטרוני באופן אוטומטי להשתמש בנוסחא מהגרף הקו שנוצר בשלב 3.16 לחישוב ערכי MESF עבור כל דילול חלבון וצפיפות הזריעה של חלבון המדגם בכל ריכוז.
4. תאי בידוד וCulturing NK האדם
- Aliquot 15 מיליליטר דם היקפי או מעיל באפי לתוך צינור חרוטי 50 מיליליטר. לדלל את הדם הזה עם PBS המכיל 1% FBS בביחס של 1: 1.
- להוסיף 13 מיליליטר של Ficoll בעדינות לחלק התחתון של הצינור עם טפטפת סרולוגיות 10 מיליליטר.
- צנטריפוגה צינור זה במשך 20 דקות ב XG 1200 עם המאיץ וההפסקה כבוי או בהגדרות הנמוכה ביותר שלהם.
- לאחר צנטריפוגה, להשתמש פיפטה סרולוגיות כדי לאסוף את השכבה הצפה מעונן הלבנה אמצע תאי הדם היקפיים mononuclear (PBMCs), which צריך לשבת והצומת שבין שכבה ברורה צהובה עליונה ושכבת מעונן יותר בצבע חיוורת נמוכה יותר, אשר שניהם יושבות מעל שכבת lowermost של תאי דם אדומים (RBCs). הערה אל לאסוף כל RBCs באיסוף PBMCs.
- הנח את PBMCs נאספה בצינור חרוטי 50 מיליליטר חדש, ולדלל את יכולת עם PBS המכיל 1% FBS. צנטריפוגה שוב, הפעם עם הבלם ודוושת גז במקסימום, במשך 5 דקות ב 300 x גרם.
- בטל supernatant ו resuspend התאים ב 10 מיליליטר של PBS המכיל 1% FBS.
- ספירת התאים תוך צנטריפוגה שוב באותן הגדרות כמו בשלב 4.6.
- בטל supernatant פעם נוספת, וresuspend התאים במדיום R10 בצפיפות של 10 מיליון תאים / מיליליטר.
- קח 30 מיליון תאים בצינור קלקר 5 מיליליטר, ובודד תאי NK באמצעות ערכת הפרדה מגנטית, הבאים להוראות היצרן. בעקבות בידוד, לספור את התאים אחד יותר וגלול בצפיפות של 500,000 תאים / מיליליטר במדיום להשלים R10 (88% RPMI; 10% FBS; HEPES 1%, 1% פירובט נתרן) בתוספת IL-2 (100 U / ml). תרבות על 37 מעלות בחממה CO 2, ולהחליף בינונית 2-3 פעמים בשבוע.
5. הרכבת מישורי השומנים bilayer נתמך-זכוכית
- הכן פתרון פיראניה 100 מיליליטר על ידי ערבוב של 30% מי חמצן עם חומצה גופרתית ביחס של 1: 3 בכוס.
הערה: תמיד לבצע את העבודה עם סוכנים רעילים כמו חומצה גופרתית במנדף הכימי המיועד כראוי. - לפתרון זה, לטבול 2 # 1.5 coverslips המלבני בפתרון פיראניה במשך 20-30 דקות.
הערה: זה חיוני כדי לנקות את coverslips על ידי פתרון פיראניה. - בעוד coverslips לניקוי, לקחת צינור 1 של הכין בעבר 400 שומני dOPC מיקרומטר וצינור 1 של הכין בעבר 80 מיקרומטר שומנים ביוטין-PE. להעביר אותם על קרח למכל הארגון.
- לעקור חמצן בצינור microcentrifuge חדש עם ארגון,לאחר מכן להוסיף יחד dOPC וביוטין-PE ביחס של 1: 1. נפח ספציפי ישתנה בהתאם לצרכי ניסוי, אבל צריך להיות במינימום 2 μl כל אחד. לעקור חמצן בצינור התערובת פעם נוספת עם גז ארגון, וצינורות מגיב פרט, כמו גם, לפני החזרה האחרונה למקרר.
- אחרי שהם סיימו לנקות, לשטוף ביסודיות את coverslips עם מים מזוקקים. הגדר את coverslips לייבוש באוויר במשך כמה דקות.
- לסגת 1.5 μl של תערובת liposome מוכנה בשלב 5.4 וaliquot אותו בטיפה אחת לתוך אחד חדרי הנתיב של חדר השקופיות. השימוש ב2 טיפות לכל נתיב הוא טיפוסי, אך לא הכרחי.
- מהירות וביעילות מקום coverslip היבש על הטיפות. ודא שהטיפין מספיק מרווחים, כך שהם לא למזג פעם coverslip ממוקם. יתר על כן, לוודא כי הטיפות יישארו עגולות ומוגדר היטב, בלי לגעת בקצוות של חדר הקירות. לחץ כלפי מטה בחוזקהבין ומסביב לכל נתיב כדי להבטיח חותם אטום למים בין coverslip והשקופיות.
- סמן את עמדותיהם של הטיפות באמצעות עט סימון
- עובר של קזאין 5% מימי 100 μl דרך החדר כדי לחסום את bilayer. נסה לוודא שאין בועות בחדר הזרימה.
- הזרק של streptavidin 100 μl בריכוז של 333 ng / ml לכל מסלול. דגירה של 10-15 דקות ב RT. לאחר מכן, לשטוף על ידי הפעלת 3 מיליליטר של HBS / 1% HSA דרך כל מסלול כדי להסיר את streptavidin העודף.
- הוספה של אנטי-CD16 biotinylated שכותרתו fluorescently 100 μl כגון Alexa פלואוריד 568 בריכוז החלבון נקבע בעבר כיעיל ביותר בסעיף 3. דגירה בחושך במשך 20-30 דקות. לשטוף שוב על ידי הפעלת 3 מיליליטר של HBS / 1% HSA דרך כל מסלול.
- זרימת D ביוטין 100 μl בננומטר ריכוז 25 דרך החדר כדי לאגד כל streptavidin עודף ובכך לחסל את הסיכוי של כריכה הלא ספציפית של streptavidin לתאים.
- ספירת תאי NK וresuspend בריכוז של 500,000 / מיליליטר בHBS / 1% HSA.
- בעוד שצנח תאים, לשטוף את D-יוטין מתוך החדר עם עוד 3 מיליליטר של HBS HSA / 1% לכל נתיב.
- בדוק את הניידות של ligands על ידי SLB התאוששות הקרינה לאחר photobleaching (FRAP) על הקרינה כוללת פנימית השתקפות (TIRF) או confocal לפני הוספת תאי NK.
- ברגע שהתאים שסיימו ספינינג וכבר resuspended בריכוז הרצוי, להוסיף 100 μl לכל מסלול.
- מניחים את החדר ב37 מעלות 5% CO 2 באינקובטור במשך 30-60 דקות.
- לאחר תקופת דגירה זה, לתקן את התאים עם paraformaldehyde 4% ב RT במשך 10-20 דקות. לשטוף על ידי הפעלת 3 מיליליטר של PBS דרך כל מסלול כדי להסיר את paraformaldehyde.
- להוסיף 400 μl חיץ חסימה (5% חמורים בדם נורמלי ושל 0.2% Tritron X-100 ב PBS). לדגור על RT למשך 30 דקות.
- כתם F- אקטין וperforin ידי מודעהדינג 200 μl של phalloidin fluorescently שכותרתו מדוללת (יחידת 1 phalloidin / כותרת מיליליטר) ומב (500 מב ng / ml אנטי-perforin) fluorescently שכותרתו אנטי-perforin. לדגור על RT עבור שעה 1.
- לשטוף על ידי הפעלת 3 מיליליטר של PBS. החדר מוכן להדמיה.
6. הדמיה של סינפסה NK על השומנים bilayer באמצעות STED
- הפעל את כל המודולים החומרה הדרושים.
- להפעיל את תוכנת ניתוח תמונה. אפשר גם סריקת תהודה ומודולים STED. לאחר ביצוע בחירות אלה, להמתין כ 3-5 דקות לתוכנה ליזום.
- לחץ על הלשונית "התצורה" בחלק העליון של המסך.
- בחר באפשרות "לייזר Config" אז להדליק את האור הלבן וSTED 592 לייזרי ננומטר.
- בחר מטרת 100x, וליישר את קרן לייזר עירור עם לייזר דלדול 592 ננומטר.
- בחר את מודול "לייזר Config", לכבות את הדלדול 592לייזר, ותור בליזר דלדול 660 ננומטר.
- מניחים את השקף על הבמה, על העדשה. להביא את התאים כרוכים באזור bilayer המסומן אל מוקד באמצעות מנורת האור הלבנה וoculars.
- לחזור לכרטיסיית "הרכישה", ישירות לזכותו של הכרטיסייה "התצורה".
- לחץ על כרטיסיית "Switch to Whitelight", לאחר מכן הפעל מודול ושבגרור את קו לייזר עירור לאורך הגל המתאים.
- בחר את הגלאי הרצוי מהרשימה של אלה זמינים, ולאחר מכן קבע את טווח הגילוי להקיף מגוון המתאים של אורכי גל.
הערה: לעולם לא לשים את טווח הגילוי ישירות מתחת לקורה העירור. - לחץ על הכפתור "Seqential" בסרגל כלים השמאלי "לרכוש" כדי להעלות את דיאלוג הסריקה רציף בתחתית השמאלית של הסרגל הכלים. זה מאפשר למשתמש להוסיף רצפים מרובים, כל אחדעם קרן עירור שונה לצבעים שונים. לחץ על "בין מסגרות", ולאחר מכן להגדיר את תדירות העירור, גלאים, וטווח גילוי לכל צבע נוסף כמו בשלבים 6.9 ו6.10.
- ברגע שכל ההגדרות מותאמות, פגע "התחל" כדי להתחיל את תהליך הרכישה.
- החל התוכנה החופשית deconvolution (Huygens) באמצעות הגדרה המיועדת לdeconvolution STED, כפי שתואר לעיל 13.
תוצאות
איור 1 מציג את התוצאה של צפיפות הנוגדן על bilayer השומנים. העיקרון הוא להשתמש חרוזים סטנדרטיים כדי להפוך את עקומת התקן של MESF לעומת MFI באמצעות cytometry זרימה (א). MFI של סדרת המדגם הוסב לMESF באמצעות העקומה סטנדרטית. צפיפות הנוגדן על bilayer השומנים מתואם באופן ליניארי עם ריכוז הנוגדנים (B). איור תמונת STED המשולש הצבע 2 תכנית של סינפסה NK על bilayer שומנים מישוריים זכוכית תמיכה. נוגדן Anti-CD16 על bilayer השומנים מצטבר, מפעילה מערך F- אקטין ואת הקיטוב וחדירה של perforin דרך הרשת F- אקטין בלוח המוקד של סינפסה החיסונית בתאי NK. שימוש בגישה משולבת זו, ניתן לצפות בצורה נקיה microclusters של fluorescently שכותרתו אנטי-CD16 בתוך SLB, אשר ישירות משקף את האשכולות של CD16 על תא NK. בהשוואה לתמונת confocal הקונבנציונלית, מבנה CENTRA CD16אשכול l ניתן להבחין בקלות רבה יותר בתמונה STED בשל הקרינה הסביבה המדולדלת. יתר על כן, ultrastructure של cytoskeleton אקטין נתפס עם רזולוציה משופרת באופן משמעותי. עולה בקנה אחד עם תצפיות קודמות 16,17, גרגרי ממס perforin חיובי נראים ממוקמים מעל האזורים של צפיפות F- אקטין נמוכה בתמונה STED, פרט מכריע שרובו הולך לאיבוד בתמונה confocal.
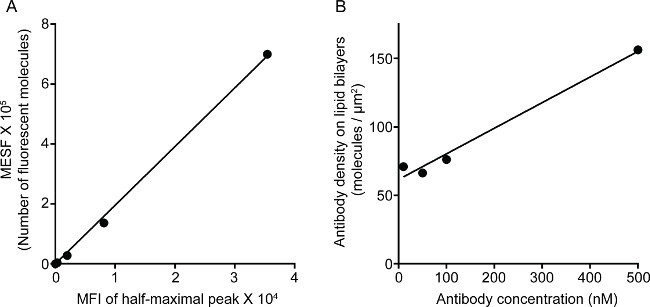
איור 1. צפיפות של נוגדן 3G8 על bilayer שומנים. () מתאם לינארי בין MESF וMFI לסדרה סטנדרטית. (ב) קשר לינארי בין צפיפות חלבון וריכוז סדרת דילול חלבון מדגם ל, המציגה את מספר המונומרים חלבון fluorescently שהכותרת ל יחידת שטח כפונקציה של ריכוז הולך וגובר על si מצופה שומניםחרוזים Lica.
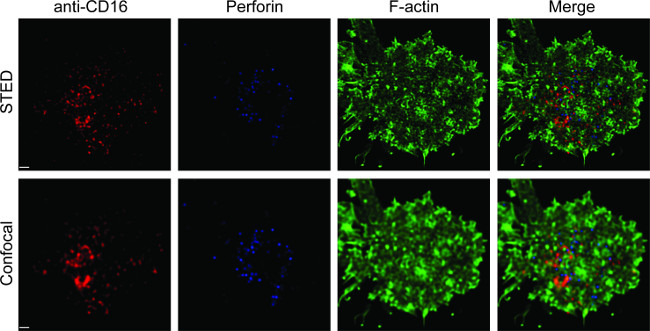
איור 2. ההדמיה STED של סינפסה NK על bilayer שומנים מישוריים. תאים הראשוניים NK היו מגורה על SLB מכיל biotinylated אנטי-CD16 (אדום) שכותרתו fluorescently, קבועים, permeabilized, ולאחר מכן מוכתם בphalloidin (כחול) ואנטי-F- אקטין (ירוק). תא יחיד היה צילם ראשון תחת הגדרת confocal הרגילה, ולאחר מכן הגדרת STED. תמונות Confocal וSTED היו deconvoluted באמצעות תוכנת הויגנס. סרגל, 1 מיקרומטר. לחץ כאן לגרסה גדולה יותר של דמות זו.
Discussion
החידוש במחקר הנוכחי הוא שהוא משלב טכניקת SLB עם STED ללמוד סינפסות תא NK. מחקרים קודמים צילמו bilayer השומנים עם TIRF ללמוד היווצרות תאי T סינפסה 8 וסחר במולקולת איתות על קרום הפלזמה 6. אחרים תארו הדמיה STED של סינפסות תא NK באמצעות שקופיות זכוכית מצופה נוגדן 13,14. השיטה ההיברידית המתוארות כאן עוד בונה על מאמצים אלה על ידי ההדמיה סינפסה תא NK עם הבהירות המשופרת המוענקת על ידי הדמיה ברזולוציה סופר על פני השטח bilayer שומנים בדם, אשר מודלים טובים יותר המשטח הדינמי של APC.
למרות SLBs הוא ממברנות מלאכותיות חסרות של שלד תא, רפסודות שומנים בדם, וligands האחר שתאי יעד בפועל או נגמ"שים בעלי, טכניקה זו יכולה לשחזר תכונות חשובות כגון הניידות והתמצאות של הליגנדים. הדבר זה מאפשר למערכת SLB לשמש כגישת הרדוקציוניסטית בt לנתחהוא התרומה של קולטנים וligands בודדים להיווצרות של IS והדינמיקה של IS. התכונה החשובה ביותר של SLBs היא שחוקרים יכולים לשלב טכניקה זו עם גישות הדמיה ברזולוציה גבוהה, כגון מיקרוסקופיה confocal וTIRF. כניסתה של מיקרוסקופיה STED עוד יותר מגדילה את היתרון הזה, מספק תובנות חסרות תקדים למחקר והיישומים הקליניים שלה.
ביקורת פוטנציאלית אחד של מערכת זו היא שSLB לא כראוי לחקות את פני השטח המורכבים של APC, ובכך הוליד תכונות אנטומיים פוטנציאל הלא-פיסיולוגיות בסינפסות וכתוצאה מכך. אמנם נכון שהרפרטואר המוגבל של מולקולות פני השטח על SLB לא לשחזר את פני השטח מאוכלסים הטרוגני של APC באופן מלא, מגבלה זו יכולה להיות גם יתרון בכך שהיא מאפשרת לחוקרים לקבוע את ההשפעה של אינטראקציות קולט ויגנד בודדות על היווצרות הסינפסה .
Tהנה כמה צעדים מכריעים בתהליך. בין הקריטי ביותר הוא חמצון של יפוזומים למנוע באמצעות כל הזמן באמצעות ארגון לעקור את החמצן בצינור והפתרון, כמו בשלבים 1.10, 2.6, 2.11 ו. חמצון של השומנים יגרום ניידות שומנים ירד, שהקשתה על היכולת של חלבוני פני השטח כדי לנוע בחופשיות ולהשתתף בבניית הסינפטי כך. כמו כן, הוא גם חיוני כדי להסיר את כל כלורופורם בliposome על ידי lyophilization (שלב 1.2). בקביעת צפיפות חלבון בbilayer השומנים בדם, יש חשיבות לפיזור ראשון חרוזים סיליקון לתוך השעיה הומוגנית חופשית מאשכולות. במידת צורך, ניתן ליישם sonication של חרוזים. בהרכבת SLB, הצעדים המוקדמים (5.1-5.8) בה coverslips מנוקים, הטיפות ממוקמות, וcoverslip מודבק חיוניים. טעות בכל אחד מאלה יכול לחייב תחילת הניסוי מעל (מהרישה של הסעיף 5). מסיבה זו, זהתרגול טוב כדי לנקות יותר מאשר coverslips יהיה צורך כדי לחסוך זמן במקרה של תקלה.
ללא אשכולות הוא הנושא השכיח ביותר בעבודה עם מערכת זו. אם, כאשר לדמיין את התאים בשלב האחרון, אחד לא מצליח למצוא שום סינפסות ניאון, יש כמה צעדים שניתן לנקוט. כתם נוסף לקולטן על פני קרום תאו המקור ניתן להוסיף לחדר כדי לוודא שהתא לא יצר סינפסה עם bilayer, בעוד תאים יכולים לדבוק הלא-במיוחד על פני השטח coverslip זכוכית או bilayer, חלבוני פני השטח synaptically-מעורבים צריכים מופיע אשכולות להבדיל במטוס של ממשק התא-bilayer, ואילו חלבוני פני השטח היה מעורבים בקרב אמורים להופיע כתמים מפוזרים כסביב ההיקף של התא. צריכה שיטה זו נכשלת, יש לבדוק התאים שלהם באמצעות זרימת cytometry כדי להבטיח שהסמן המסוים אחד מקווה ללמוד בא לידי ביטוי בשפע נאות על פני התא. הגנה של מחזור משטח מסויםידוע ins להיות למטה מוסדר מעל לטווח ארוך בתרבות vivo.
בעוד פרטי פרוטוקול זה במפורש כיצד לחזות היווצרות הסינפסה תאי NK, מערכת SLB יכול לשמש כדי לחקור היווצרות הסינפסה בכל immunocyte ניתן להעלות על הדעת, פשוט על ידי החלפה של יגנד העיקרי בשלב 5.11. ligands מרובה גם ניתן להוסיף בו-זמנית. אחד גם לא צריך להשתמש במערכת streptavidin ביוטין לדבקות חלבוני פני השטח בתוך bilayer. ניקל-נ.ת.ע: אינטראקציות היסטידין גם בת-קיימא. עם זאת, בשל החוזק הגבוה והספציפיות של streptavidin: האינטראקציה ביוטין, המעבדה שלנו מעדיפה מערכת זו. אפשר גם לשנות את הריכוז של תאים הוסיפו על bilayer מהצפיפות שנקבעה בשלב 5.13, כמו גם את משך תקופת הדגירה לאחר מכן כדי לצפות סינפסות בשלבים שונים של התבגרות. זה אפילו יכול להתבצע בשידור חי, אם כי זה כמובן אינו כולל את האפשרות של הדמיה str תאיתuctures (אלא אם כן הם כבר מסומנים עם תג ניאון התמזגו; המעבדה שלנו משתמשת בכמה שורות תאים שהשתנו כאמור). בשל הרמה הגבוהה של התאמה אישית אפשרית בפרוטוקול זה, אחד יכול להשתמש בטכניקת SLB הבסיסית, יחד עם ההדמיה STED, כדי לטפל במגוון רחב מאוד של שאלות באימונולוגיה, ביולוגיה של תא, וביוכימיה, כולל דינמיקה בסיסית שומנים 15, היווצרות הסינפסה 16, גרורות איתות תאית 17, ותאים סרטניים 18.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Emily Mace and Malini Mukherjee for imaging and deconvolution analysis. Work in the Liu laboratory was supported in part by the Baylor-UTHouston Center for AIDS Research Core Support Grant number AI36211 from the National Institute of Allergy and Infectious Diseases, the Caroline Wiess Law Fund for Research in Molecular Medicine, Texas Children’s Hospital Pediatric Pilot Research Fund, and the Lymphoma SPORE Developmental Research Program from Baylor College of Medicine and the Methodist Research Institute.
Materials
| Name | Company | Catalog Number | Comments |
| 18:1 (Δ9-Cis) PC (DOPC) 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti | 850375C | Liposome preparation |
| 18:1 Biotinyl Cap PE 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl) (sodium salt) | Avanti | 870273C | Liposome preparation |
| Argon gas, compressed | Airgas | UN1006 | Liposome preparation |
| A lyophilizer | Labconco | Freezone 7740020 | Liposome preparation |
| Lyophilizer tubes | Labconco | 7540200 | Liposome preparation |
| Chromatography Columns | Santa Cruz | sc-205558 | Liposome preparation |
| 1 M Tris pH 8.0 | Ambion | AM9856 | Liposome preparation |
| 5 M NaCl | Ambion | AM9759 | Liposome preparation |
| Octyl-β-D-glucopyranoside | Sigma-Aldrich | O1008 | Liposome preparation |
| Dialysis tubing | Spectrum Labs | 132676 | Liposome preparation |
| 96-well V-bottom polystyrene plate (untreated) | Corning | 3896 | antibody density determination |
| Non-functionalized silica beads | Bangs Laboratories | SS06N | antibody density determination |
| FACS tubes | Fisher Scientific | 14-959-2A | antibody density determination |
| QuantumTM MESF beads | Bangs Laboratories | Variable | antibody density determination |
| Casein | Sigma-Aldrich | C0875 | Lipid bilayer preparation |
| HEPES buffered saline + 1% HSA | Homemade | Lipid bilayer preparation | |
| Streptavidin | Life technologies | 434301 | Lipid bilayer preparation |
| Fluorescently-labeled biotinylated protein | Homemade | Lipid bilayer preparation | |
| ibidi Sticky-Slide VI 0.4 | ibidi | 80608 | Lipid bilayer preparation |
| 25x75 mm glass coverslip | ibidi | 10812 | Lipid bilayer preparation |
| Hydrogen peroxide (30%) | Fisher Scientic | BP2633 | Lipid bilayer preparation |
| Sulfuric acid | Sigma-Aldrich | 258105 | Lipid bilayer preparation |
| D-Biotin | Invitrogen | B20656 | Lipid bilayer preparation |
| Lens paper | VWR | 54826-001 | For imaging |
| Type F Immersion Oil | Leica | 11 513 859 | For imaging |
| A Leica TCS STED microscope | Leica | For imaging |
References
- Dustin, M. L., Long, E. O. Cytotoxic immunological synapses. Immunol. Rev. 235 (1), 24-34 (2010).
- Monks, C. R., Freiberg, B. A. K. u. p. f. e. r. H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Hafeman, D. G., von Tscharner, V., McConnell, H. M. Specific antibody-dependent interactions between macrophages and lipid haptens in planar lipid monolayers. Proc Natl Acad Sci USA. 78 (7), 4552-4556 (1981).
- Tscharner, V., McConnell, H. M. Physical properties of lipid monolayers on alkylated planar glass surfaces. Biophys J. 36 (2), 421-427 (1981).
- Crites, T. J., Chen, L., Varma, R. A TIRF microscopy technique for real-time, simultaneous imaging of the TCR and its associated signaling proteins. J. Vis. Exp. , (2012).
- Prins, K. C., Vasiliver-Shamis, G., Cammer, M., Depoil, D., Dustin, M. L., Hioe, C. E. Imaging of HIV-1 envelope-induced virological synapse and signaling on synthetic lipid bilayers. J. Vis. Exp. , (2012).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. , (2008).
- Michalet, X., Weiss, S. Using photon statistics to boost microscopy resolution. Proc. Natl. Acad. Sci. U. S. A. 103 (13), 4797-4798 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu. Rev. Biochem. 78, 993-1016 (2009).
- Lippincott-Schwartz, J., Manley, S. Putting super-resolution fluorescence microscopy to work. Nat. Methods. 6 (1), 21-23 (2009).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J. Vis. Exp. , (2014).
- Rak, G. D., Mace, E. M., Banerjee, P. P., Svitkina, T., Orange, J. S. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Leutenegger, M., Ringemann, C., Lasser, T., Hell, S. W., Eggeling, C. Fluorescence correlation spectroscopy with a total internal reflection fluorescence STED microscope (TIRF-STED-FCS). Opt Express. 20 (5), 5243-5263 (2012).
- Liu, D., Bryceson, Y. T., Meckel, T., Vasiliver-Shamis, G., Dustin, M. L., Long, E. O. Integrin-dependent organization and bidirectional vesicular traffic at cytotoxic immune synapses. Immunity. 31 (1), 99-109 (2009).
- Liu, D., Peterson, M. E., Long, E. O. The adaptor protein Crk controls activation and inhibition of natural killer cells. Immunity. 36 (4), 600-611 (2012).
- Wu, J. C., et al. Antibody conjugated supported lipid bilayer for capturing and purification of viable tumor cells in blood for subsequent cell culture. Biomaterials. 34 (21), 5191-5199 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved