Method Article
Super-Resolution Imaging der natürlichen Killerzell Immunologische Synapse auf einem Glas-gestützten Planar Lipiddoppelschicht
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
We describe here a combination of the glass-supported lipid bilayer technique of forming immunological synapses with the super-resolution imaging technique of stimulated emission depletion (STED) microscopy. The goal of this protocol is to provide users with the instructions necessary to successfully carry out these two techniques.
Zusammenfassung
The glass-supported planar lipid bilayer system has been utilized in a variety of disciplines. One of the most useful applications of this technique has been in the study of immunological synapse formation, due to the ability of the glass-supported planar lipid bilayers to mimic the surface of a target cell while forming a horizontal interface. The recent advances in super-resolution imaging have further allowed scientists to better view the fine details of synapse structure. In this study, one of these advanced techniques, stimulated emission depletion (STED), is utilized to study the structure of natural killer (NK) cell synapses on the supported lipid bilayer. Provided herein is an easy-to-follow protocol detailing: how to prepare raw synthetic phospholipids for use in synthesizing glass-supported bilayers; how to determine how densely protein of a given concentration occupies the bilayer's attachment sites; how to construct a supported lipid bilayer containing antibodies against NK cell activating receptor CD16; and finally, how to image human NK cells on this bilayer using STED super-resolution microscopy, with a focus on distribution of perforin positive lytic granules and filamentous actin at NK synapses. Thus, combining the glass-supported planar lipid bilayer system with STED technique, we demonstrate the feasibility and application of this combined technique, as well as intracellular structures at NK immunological synapse with super-resolution.
Einleitung
Die immunologischen Synapse (IS) liegt an einem kritischen Punkt für die Zell-Aktivierung und Funktion 1. Es ist das primäre Mittel, durch das die Antigenpräsentation und die zellvermittelte Immunität werden ausgeführt. Die früheste mikroskopische Untersuchungen der Synapsenbildung verwendete eine Zell-Zell-Konjugat System 2. Die Hauptbeschränkung bei diesem Ansatz ist, dass die meisten der Konjugate wird 'im Profil "angesehen werden, wie es, die Sicht nicht beeinträchtigt der synaptischen Struktur selbst des Beobachters. Im Jahr 1999 richtete die Dustin Labor diese Einschränkung durch die Nutzung der Glas-gestützten Lipiddoppelschicht (SLB) Technik 3, die zuvor von der McConnel Labor 4,5 Pionier war. Dieser Ansatz von Antigen-präsentierenden Zellen (APCs) für eine Glas unterstützt planaren Lipid-Oberfläche, in die Proteine könnten angeschlossen werden und bewegen sich frei in zwei Dimensionen angeordnet sind. Mit dieser Methode wurden Dustin und Kollegen in der Lage, direkt in die t-Peer-er Synapsen mit hochauflösenden Fluoreszenzmikroskopie, und zum ersten Mal erhalten eine "face-to-face" Blick auf die Struktur des IS.
Mit der Verwendung von SLB-System hat das Detail, mit dem das IS visualisiert werden kann nur durch die Beschränkungen der gegenwärtigen Abbildungstechniken 6-8 beschränkt. Mit Standard-Beleuchtungstechniken, die minimale Auflösung (dh Mindestabstand zwischen zwei verschiedenen Objekten, wobei sie unterschieden werden können) wurde <200 nm auf der Basis der Rayleigh-Kriterium 9. Diese Begrenzung verhindert die Bildgebung von sehr feinen, im molekularen Maßstab Strukturen, aus denen die Synapse, und bis zur Entwicklung der Superauflösungsabbildungstechniken 10-12, Visualisierung dieser Strukturen Abbildungs fixierter Zellen mittels Elektronenmikroskopie beschränkt.
Mit der jüngsten Einführung von einer Vielzahl von Superauflösung Techniken wie SIM (strukturierte Beleuchtung Mikroskopie), PALM (photoaktivierte Lokalisationsmikroskopie), STORM (stochastischen optischen Rekonstruktion Mikroskopie) und STED 10-12, sind jetzt Forscher in der Lage, diese synaptischen Strukturen in bisher unerreichter Genauigkeit, die wiederum zur Verfügung gestellt eine zunehmend geklärt Verständnis der IS zu studieren. Die Vorteile der STED-Mikroskopie haben vor 13 beschrieben. Hier beschreiben wir höchstauflösende Bildgebung mit der STED-Mikroskopie mit der neu entwickelten 660 nm Abbau Laser. Im Vergleich zu dem herkömmlichen 592 nm Verarmungs Lasers von 660 nm Laser ermöglicht eine breitere Auswahl von fluoreszierenden Farbstoffen (siehe http://nanobiophotonics.mpibpc.mpg.de/old/dyes/), insbesondere dieser roten Fluorophoren.
Andere Veröffentlichungen haben die STED-Bildgebung von NK-Zellen Synapsen auf Antikörper-beschichteten Glasobjektträger 13,14 beschrieben. Hier wird der SLB-System mit Superauflösung der STED-Mikroskopie kombiniert, um die NK-Zellsynapse studieren. Diese Technik hat den Vorteil gegenüber Antikörper-beschichteten Objektträger des Seins ein Flüssig-Mosaik, in der die eingebetteten Oberflächenproteine können frei in einem flachen zweidimensionalen Fläche (xy-Ebene) zu bewegen. Dies ahmt getreuer die organische und mobile Oberfläche einer Zielzelle und damit besser rekapituliert die Bildung einer physiologisch relevanten Immunsynapse.
Ziel dieses Protokolls ist es, die Endbenutzer mit einer detaillierten Beschreibung, wie Bild der immunologischen Synapse von NK-Zellen durch die Kombination der SLB-System und höchstauflösenden STED-Mikroskopie bieten. Es wird dem Endbenutzer mit den notwendigen Schritten zur Verfügung: bereiten die Liposomen, konstruieren Doppelschichten protein eingebettet, bestimmen die Proteindichte auf den Lipid-Doppelschichten, und erwerben Super-Resolution-Bildern mit der STED-Mikroskopie. Diese Techniken sind nicht auf das Gebiet der Immunologie beschränkt und kann allgemein in einer Vielzahl von Disziplinen verwendet werden.
Protokoll
1. Herstellung von Liposomen
- Berechnen der Menge an Chloroform suspendiert Stammlösungen aus 1,2-Dioleoyl-sn-glycero-3-phosphocholin (DOPC) und 1,2-Dioleoyl-sn-glycero-3-phosphoethanolamin-N-Biotinyl Kappe (Biotin-PE) zu verdünnter Bestände auf die gewünschte Endkonzentration zu machen. Um Endkonzentrationen von 400 uM und 80 uM DOPC Biotin-PE Phospholipide bei jeder 10 ml machen, starten, indem 629 ul 10 mg / ml DOPC und 88 ul 10 mg / ml Biotin-PE in getrennte Glasröhrchen Chromatographie.
HINWEIS: es ist wichtig, Glas Hamilton Spritzen und Glas Chromatographie Rohre reinigen von Reinigungslösung (1 l 95% igem Ethanol und 120 ml Wasser mit 60 g Kaliumhydroxid, KOH), während der Übertragung von Chloroform suspendiert Stammlösung von DOPC und Biotin-PE. - Man trocknet die Chloroform unter einem Argonstrom in der chemischen Haube. Verschließen Sie die Chromatographierohr von Parafilm.
- Betreff der neu getrocknete Liposomen auf ein Hochvakuum in einem lyophilizer O / N, um restliche Chloroform zu entfernen. Am selben Tag der Fertigstellung trocken für 60 bis 90 min.
- Während der Gefriertrocknungsanlage läuft, bereiten einige Verdünnungspuffer. Für dieses Protokoll, bereiten 25 ml aus 25 mM Tris, pH 8,0; 150 mM NaCl; und 2% (Gewicht) n-Octyl-β-D-glucopyranosid (OG) Detergens. Mischen Sie die ersten beiden Zutaten zusammen, dann verdrängt Sauerstoff mit Argon vor der Zugabe des trockenen Pulver OG. Nach der Herstellung filtern die OG-Lösung mit 0,2 Mikron Celluloseacetat-Membran, und bei 4 ° C.
- Außerdem bereiten zwei Schraubflaschen von 1 l Tris-Saline-Puffer in den gleichen Konzentrationen, jedoch ohne OG. Legen Sie ein destilliertem Wasser gereinigt Magnetrührstab im Boden jeder. Bereiten Sie 6 zusätzliche Liter der Tris-Salzpuffer. Entfernen von Sauerstoff aus allen Flaschen mit Argon und legen Sie sie bei 4 ° C als auch.
- Nach dem Gefriertrocknen, lösen die getrockneten Lipide in der Tris-Saline OG-Puffer, um eine 4 mM Lösung von jedem zu machen. Nach dem VorbildVolumen, 2 ml auf die DOPC Rohr und 0,2 ml auf die Biotin-PE-Schlauch.
- Mischen Sie die Biotin-PE Lipide mit den DOPC Lipide. Dies verbessert die Beweglichkeit des SLB, das gekoppelte Biotin kann die Fluidität der Phosphat-Kopfgruppen beeinträchtigt. Um eine Endkonzentration von 80 & mgr; M Biotin-PE machen, Mischungs 0,2 ml 4 mM Biotin-PE und 1 ml 4 mM DOPC. Dann fügen Sie 8,8 ml des Tris-Saline OG-Puffer.
- Für eine Endkonzentration von 400 uM DOPC einfach mischen 1 ml 4 mM DOPC mit 9 ml Tris-Saline OG.
- Füllen Sie das Ultraschallgerät mit Eiswasser. Setzen Sie das Glasrohr mit der verdünnten Phospholipid in der Mitte des Ultraschallgeräts mit einem Dienstprogramm Klemme. Beschallen die verdünnte Phospholipid für 10 Minuten, bis die Lösung klar wird.
HINWEIS: ice In in das Ultraschallgerät Wasserbad, um die Temperatur niedrig zu halten, da Ultraschallbehandlung erzeugt Wärme. - Füllen der Rohre mit Argon, um den Sauerstoff in der Luft über der Flüssigkeit verdrängt und verschließt diese mit Parafilm.
2. Dialyse von Liposomen
- Schneiden zwei Abschnitte trockenem Dialyseschlauch (Molekulargewicht cut-off: 12-14,000, Durchmesser: 6,4 mm) mit einer geeigneten Länge (in diesem Beispiel 40 cm), eine für jede Phospholipid Verdünnung von der Rolle.
- Rehydrierung der Schlauchabschnitte, indem sie in einen 200 ml destilliertem Wasser in einem Becherglas für 2 Minuten einweichen.
- Mikrowelle dies für 5 Minuten bei hoher Einstellung oder zumindest, bis das Wasser zum Kochen kommt.
- Binden Sie einen Knoten an einem Ende eines jeden Rohres und spülen Sie das Innere mit einigen Millilitern der Tris-Saline-OG-Puffer. Danach sorgfältig auszupressen wie viel von diesem Waschpuffer wie möglich, um die Menge an Puffer verbleibenden Inneren minimieren.
- In einer Steril, fügen Sie die verdünnte Phospholipide in jedes Röhrchen und klemmen Sie die offenen Enden mit einer kleinen Dialyseschlauch Schließung, um die gesamte Luft aus. Komplette Luftausschluss wird das Opfer ein kleines Volumen der Probe durch Klemmen unterhalb des & benötigen# 8220; Wasser-Linie ".
- Tauchen der Proben in den zuvor hergestellten Flaschen Tris-Kochsalz-Puffer ohne OG. Anschließend verdrängt Sauerstoff in der Flasche mit Argon vor dem erneuten Abdichtung und Ort, um O / N bei 4 ° rühren.
- Übertragen der Schlauch in eine neue Flasche mit Tris-Kochsalz-Puffer ohne OG alle 12 h für mindestens 3 mal.
- Kurz vor der Entfernung der Lipide, dialysiert, bereiten eine Reihe von kleinen Röhren in dem die Lipide durch Füllen jeweils mit Argon auf den Sauerstoff zu verdrängen aliquotieren.
- Nach 36 h nehmen die Dialyse-Flaschen in den Sterilbank und die Dialyseschläuche von den Flaschen zu entfernen. Haben Sie ein Bank Windel oder Becher zur Hand, um die nasse Abfluss zu sammeln.
- Schneiden Sie den Dialyseschlauch über dem Clip, und entfernen Sie den Clip und die dialysiert Lipid-Lösung via Pipette vorsichtig Transfer in 1 ml Aliquots in vorgefertigter Rohre mit Argongas auf Eis gefüllt.
- Aliquot der wässrigen Liposomenlösung, verwenden Sie den Argonstrom Sauerstoff wieder zu verdrängen in jedes Rohr.
- Bewahren Sie die Liposomen bei 4 °. Nicht einfrieren.
3. Bestimmung der Antikörperdichte am Lipid Bilayer
- Verdünnungsreihe von biotinyliertem, fluoreszenzmarkierte Antikörper, 50 & mgr; l Volumen für jede Verdünnung, bei den folgenden Konzentrationen: 0 nM (blank), 10 nM, 50 nM, 100 nM und 500 nM. (Nachstehend als "Probenserie").
- 1 ul Siliciumdioxidperlen in 6 Vertiefungen einer 96-Well-V-Bodenplatte. Achten Sie darauf, um die Perlen vor dem Pipettieren gut zu schütteln, wie sie neigen dazu, zu begleichen.
HINWEIS: Wenn mit geordneten Trockenperlen statt ausgesetzt, befolgen Sie die Anweisungen des Herstellers zu verdünnen. - Um dieser Perlen, fügen Sie 2 ul von gemischten DOPC: Biotinyl Phospholipide in einem Verhältnis 1: 1. Tun Sie dies für jede Vertiefung.
- Impuls der Platte auf einem Vortexer bei mittlerer Stärke 3 mal für jeweils 10 Sekunden, um die Interaktion mit den Kügelchen und der Phospholipide zu fördern.
- Fügen Sie 150 ul 5% casEin in jede Kammer. Gut mischen durch Auf-und Abpipettieren dreimal.
- Lassen Sie die Platte inkubiert in der Casein-Lösung für 10 Minuten, dann waschen Sie es heraus. Zu waschen, füllen Sie jede Vertiefung bis zu einem Gesamtvolumen von 250 ul mit HEPES gepufferter Salzlösung (HBS) mit 1% humanes Serumalbumin (HSA). Zentrifuge bei 1000 × g für 2 min. Pipette heraus und entsorgen Sie die Top 200 ul des Überstandes, und wiederholen Sie zweimal für insgesamt drei Waschzyklen.
- In 50 ul Streptavidin an einer 333 ng / ml-Konzentration. Pulse die Platte wieder 3x 10 s, und lassen Sie es auf einem Schüttler für 15 Minuten sitzen. Jeweils 3x wie in Schritt 6, um ungebundene Streptavidin entfernen.
- Fügen Sie 50 ul der fluoreszenzmarkierten biotinylierten Antikörper aus der zuvor hergestellten Verdünnungsreihen (siehe Schritt 3.1) in jedes Loch, und ersetzen Sie die Platte auf dem Schüttler für 20 bis 30 min. Jeweils 3x wie in Schritt 6, um ungebundene Antikörper zu entfernen.
- Nach dem letzten Waschen, Resuspendieren der Kügelchen in 100 & mgr; l HBS / 1% HSA, dann zu einer FACS-Röhrchen transferieren. Wiederholen Sie diesen Vorgang zweimalsorgen für die effiziente Entfernung von allen Perlen aus dem Brunnen, für insgesamt 300 ul, und tun dies für jede Vertiefung.
- Bringen der resultierenden Rohre mit dem Durchflußzytometer. Es ist Zeit, sie zu lesen.
- 1 Tropfen von der Flasche "B" aus der Fluoreszenzintensität Kalibrierung (FIC) Beadkit zu einer FACS-Röhrchen (im folgenden als "Standard-Reihe" bezeichnet), und mit 300 & mgr; l HBS / 1% HSA verdünnt.
- Lesen Sie dieses Rohr, aber die Daten nicht aufgezeichnet werden nur noch. Denn jetzt, nur sicherstellen, dass die leeren Perlen korrekt geeicht werden. Einen Histogramm, das die Fluoreszenz der Kügelchen in dem entsprechenden Kanal gemessen wird, dann verschiebt die Spannung der Erregungslaser nach unten, bis sich die Spitze an der äußersten linken Seite des Histogramms.
- Entfernen der Röhre und 1 Tropfen jeder der anderen 4 Röhren in der Reihe (1 bis 4 gekennzeichnet), um das gleiche Rohr. Nun stecken Sie den Schlauch in die Maschine wieder, und notieren Sie die resultierenden Daten, die als 5 verschiedene Peaks erscheinen soll.
- Lesen Sie jede einzelne Röhre von der Probenserie.
- Mit Hilfe der FACS-Analyse-Software, zeichnen ein Gatter, die die gesamte Breite jeder Spitze in der Normenreihe Histogramm an der Hälfte der maximalen Punkt. Das ist ein Tor für jeden Peak. Wiederholen Sie den Vorgang für jede Probe. Beachten Sie die MFI (mittlere Fluoreszenzintensität) für jedes Tor.
- Mit einem Tabellenkalkulationsprogramm Eingangs die gemessenen MFI-Werte an der entsprechenden Stelle. Außerdem geben Sie die MESF (Moleküle Equivalent Lösliche Fluorochrom) Werte (durchschnittliche Anzahl der Fluoreszenzmoleküle Beschichten jeder Wulst) für jede Flasche in der Normenreihe. Diese Informationen können von folgenden die Anweisungen auf dem Kunststoffgefäß in die Rohre kam zu finden.
- Verwenden Sie die Tabelle wird die MFI gegen die MESF Werte zu plotten, die Schaffung eines linearen Zusammenhang zwischen der Anzahl der Fluorophore und der gemessenen Intensität.
- Verwenden Sie das Modul "Proteine und Etiketten" in der Mikro-Volumen Spektralphotometer, das Verhältnis von Farbstoff zu Pro bestimmentein in dem markierten Antikörper.
- Eingabe der Markierungseffizienz des Testproteins, wobei der mittlere Durchmesser der mit Lipiden beschichteten Kügelchen und der MFI-Wert für jeden Eintrag. Die Tabellenkalkulation wird die Formel verwendet automatisch aus dem Liniendiagramm in Schritt 3.16 erzeugt, um die MESF Werte für jede Proteinverdünnung und der Einsaatdichte der Probe Protein bei jeder Konzentration berechnet.
4. Isolierung und Kultivierung Menschen NK Cells
- Aliquoten 15 ml peripherem Blut oder buffy coat in einen 50 ml konischen Röhrchen. Verdünne dieses Blut mit PBS, das 1% FBS in einem Verhältnis von 1: 1.
- Hinzufügen 13 ml Ficoll sanft auf den Boden des Rohres mit einer serologischen 10 ml-Pipette.
- Zentrifuge dieses Rohr für 20 Minuten bei 1200 xg mit dem Gaspedal und dem Abbruch oder auf dem niedrigsten Einstellungen.
- Nach dem Zentrifugieren mit einem serologischen Pipette, um die schwimmenden bewölkt weißen Mittelschicht peripheren mononukleären Blutzellen (PBMCs) zu sammeln, which sollten sitzen und der Schnittpunkt zwischen einer klaren gelben oberen Schicht und eine trübe blassfarbenen Unterschicht, die beide sitzen oberhalb einer untersten Schicht der roten Blutkörperchen (Erythrozyten). HINWEIS Sie nicht, Erythrozyten bei der Erhebung der PBMCs zu sammeln.
- Platzieren der gesammelten PBMCs in eine neue 50 ml konischen Röhrchen und verdünnte die Kapazität mit PBS, das 1% FBS. Zentrifuge erneut, dieses Mal mit der Bremse und Gaspedal maximal für 5 min bei 300 x g.
- Überstand verwerfen und die Zellen resuspendieren in 10 ml PBS mit 1% FBS.
- Zählen Sie die Zellen, während wieder mit den gleichen Einstellungen wie in Schritt 4.6 Zentrifugieren.
- Verwerfe den Überstand noch einmal, und die Zellen werden in R10-Medium bei einer Dichte von 10 Millionen Zellen / ml.
- Bis zu 30 Millionen Zellen in einem 5 ml-Polystyrolröhrchen und isolieren NK-Zellen unter Verwendung einer magnetischen Trenn Kit nach den Anweisungen des Herstellers. Nach der Isolierung, zählen Sie die Zellen ein weiteres und resuspendieren in einer Dichte von 500,000 Zellen / ml in R10 Vollmedium (88% RPMI, 10% FBS, 1% HEPES, 1% Natriumpyruvat) mit IL-2 (100 U / ml) ergänzt. Kultur bei 37 ° in einem CO 2 -Inkubator, und ersetzen Medium 2-3 mal wöchentlich.
5. Montage der Glas unterstützt Planar Lipiddoppelschicht
- Bereiten 100 ml Piranha-Lösung durch Mischen von 30% igem Wasserstoffperoxid mit Schwefelsäure in einem Verhältnis von 1: 3 in ein Becherglas.
HINWEIS: Führen Sie immer die Arbeit mit schädlichen Substanzen wie Schwefelsäure in einem einwandfrei bezeichnet Abzug durchführen. - In diese Lösung tauchen zwei rechteckigen # 1.5 Deckgläser in Piranha-Lösung für 20-30 min.
HINWEIS: Es ist wichtig, die Deckgläser mit Piranha-Lösung zu reinigen. - Während die Deckgläser werden gereinigt, nehmen Sie 1 Tube vorbereiteten 400 uM DOPC Lipide und 1 Tube vorbereitete 80 uM Biotin-PE Lipiden. Transportieren sie auf Eis, um die Argontank.
- Verdrängen Sauerstoff in ein neues Mikroröhre mit Argon,dann addieren Sie die DOPC und Biotin-PE in einem Verhältnis 1: 1. Das spezifische Volumen wird auf experimentellen Bedürfnisse variieren, sollte aber an jedem mindestens 2 ul sein. Anschließend verdrängt Sauerstoff in der Mischung Rohr wieder mit Argongas, und die einzelnen Glasrohre als auch, vor der Rückkehr der letzteren in den Kühlschrank.
- Nachdem sie die Reinigung beendet haben, gründlich die Deckgläser mit destilliertem Wasser spülen. Stellen Sie die Deckgläser aus an der Luft trocknen für ein paar Minuten.
- Zurückzuziehen 1,5 ul der Liposomenmischung in Schritt 5.4 hergestellten und aliquotiert sie in einem einzigen Tropfen in einem der Fahrspur Kammern des Kammerobjekt. Die Verwendung von 2 Tropfen pro Spur ist typisch, aber nicht notwendig.
- Schnell und effizient platzieren Sie den trockenen Deckglas in den Tröpfchen. Sicherzustellen, dass die Tropfen ausreichend beabstandet, so daß sie nicht zusammenführen müssen, sobald das Deckglas platziert. Darüber hinaus stellen Sie sicher, dass die Tropfen bleibt rund und gut definiert, ohne sie zu berühren die Kanten der Kammerwände. Fest andrückenin zwischen und um jede Spur, um eine wasserdichte Abdichtung zwischen dem Deckglas und Objektträger zu gewährleisten.
- Markieren Sie die Position der Tropfen mit einem Filzstift
- Pass 100 ul wässriger 5% Casein durch die Kammer, um die Doppelschicht zu blockieren. Versuchen Sie, stellen Sie sicher, dass sich keine Luftblasen in der Durchflusskammer.
- Injizieren 100 ul Streptavidin in einer Konzentration von 333 ng / ml in jeder Spur. Inkubieren Sie für 10-15 Minuten bei Raumtemperatur. Danach waschen, indem Sie 3 ml HBS / 1% HSA durch jede Spur, um das überschüssige Streptavidin entfernen.
- Füge 100 & mgr; l von biotinyliertem fluoreszenzmarkierten anti-CD16 wie Alexa Fluor 568 bei der Proteinkonzentration zuvor ermittelten am wirksamsten in Abschnitt 3. Inkubieren im Dunkeln für 20-30 min. Dann wird noch einmal, indem Sie 3 ml HBS / 1% HSA durch jede Spur.
- Ablauf 100 ul D-Biotin in einer Konzentration 25 nM durch die Kammer, um überschüssiges Streptavidin zu binden und damit die Möglichkeit einer nicht-spezifischen Bindung von streptavidin zu den Zellen.
- Graf NK Zellen und Resuspendieren in einer Konzentration von 500.000 / ml in HBS / 1% HSA.
- Während Abzentrifugieren der Zellen, waschen Sie die D-Biotin aus der Kammer mit einem weiteren 3 ml HBS / 1% HSA pro Bahn.
- Prüfen Sie die Beweglichkeit des Liganden auf die SLB durch FRAP (FRAP) auf einer Totalreflexions-Fluoreszenz (TIRF) oder konfokalen Mikroskopie vor dem Hinzufügen von NK-Zellen.
- Sobald die Zellen Spinn abgeschlossen und wurden bei der gewünschten Konzentration suspendiert ist, werden 100 & mgr; l zu jeder Bahn.
- Zeigen die Kammer in einem 37 ° mit 5% CO 2 -Inkubator für 30-60 min.
- Nach dieser Inkubationszeit fixieren die Zellen mit 4% Paraformaldehyd bei Raumtemperatur für 10-20 min. Indem 3 ml PBS über jeder Spur, um die Para entfernen waschen.
- Danach fügt man 400 & mgr; l Blockierungspuffer (5% normalem Eselserum und 0,2% Tritron X-100 in PBS). Inkubiere bei Raumtemperatur für 30 min.
- Stain F-Actin und Perforin des Anbietersding 200 ul verdünnt fluoreszenzmarkierten Phalloidin (1 Einheit / ml markiertem Phalloidin) und fluoreszenzmarkierten anti-Perforin mAb (500 ng / ml anti-Perforin mAb). Inkubiere bei Raumtemperatur für 1 Std.
- Indem 3 ml PBS waschen. Die Kammer ist für die Bildgebung.
6. Imaging der NK Synapse auf Lipiddoppelschicht mit STED
- Schalten Sie alle erforderlichen Hardware-Module.
- Starten Sie die Bildanalyse-Software. Aktivieren Sie beide Resonanz Scannen und STED-Module. Nachdem Sie diese Auswahl, warten Sie etwa 3-5 Minuten für die Software zu starten.
- Klicken Sie auf das Register "Konfiguration" am oberen Rand des Bildschirms.
- Wählen Sie "Laser Config" dann auf dem weißen Licht und STED 592 nm Laser einzuschalten.
- Wählen Sie das 100x-Objektiv, und richten Sie die Anregung Laserstrahls mit dem 592 nm Laser Erschöpfung.
- Wählen Sie den "Laser Config" Modul, schalten Sie die 592 ErschöpfungLaser, und wiederum auf dem 660 nm Laser Erschöpfung.
- Stellen Sie den Schieber auf der Bühne, über die Linse. Bringen Sie die auf der Doppelschicht abgegrenzten Region gebunden in den Fokus Zellen unter Verwendung des Weißlichtlampe und die Okulare.
- Zurück zur Registerkarte "Erwerb", direkt an der rechten Seite der Registerkarte "Konfiguration".
- Klicken Sie auf "Wechseln Sie in den Whitelight", und schalten Sie das Modul an und ziehen Sie die Anregungslaserlinie auf die entsprechende Wellenlänge.
- Wählen Sie den gewünschten Detektor aus der Liste der verfügbaren, dann setzen Sie den Erfassungsbereich, um den entsprechenden Wellenlängenbereich umfassen.
HINWEIS: NIEMALS den Erfassungsbereich direkt unterhalb der Anregungsstrahl. - Klicken Sie auf die Schaltfläche "Seqential" in der linken "Acquire" Symbolleiste, um das sequentielle Scannen Dialog in der Unterseite der Werkzeugleiste links bringen. Dies ermöglicht es dem Benutzer, mehrere Sequenzen hinzuzufügen, die jeweilsmit einer anderen Anregungsstrahl für eine andere Farbe. Klicken Sie auf "Between Frames", und stellen Sie die Frequenz, den Detektor und Erfassungsbereich für jede weitere Farbe wie in den Schritten 6.9 und 6.10.
- Sind alle Einstellungen optimiert werden, klicken Sie auf "Start", um die Übernahme zu beginnen.
- Übernehmen Sie die freie Entfaltung Software (Huygens) mit einem Rahmen für STED Entfaltung entwickelt, wie zuvor 13 beschrieben.
Ergebnisse
Abbildung 1 zeigt das Ergebnis der Antikörper-Dichte auf der Lipiddoppelschicht. Das Prinzip besteht darin, Standardperlen verwenden, um die Standardkurve der MESF gegen MFI über Durchflusszytometrie (A) zu machen. Der MFI der Probenserie wurde mit der Standardkurve in MESF umgewandelt. Die Antikörperdichte auf die Lipiddoppelschicht wird linear mit der Antikörperkonzentration (B) korreliert. 2 zeigen die Dreifach-Farb STED Bild NK Synapse auf Glas-Stütz planaren Lipiddoppelschicht. Anti-CD16-Antikörper auf die Lipiddoppelschicht ansammelt Ansteuerung F-Aktin-Bildung und die Polarisation und das Eindringen von Perforin durch die F-Actin mesh auf der fokalen Gruppe von immunologischen Synapse in NK-Zellen. Mit diesem kombinierten Ansatz kann man sauber beachten Sie die Mikrocluster von fluoreszenz innerhalb der SLB, die direkt spiegelt die Clusterbildung von CD16 auf den NK-Zell-markierten Anti-CD16. Im Vergleich zu dem herkömmlichen konfokalen Bild der Struktur der CD16 Central Cluster wird leichter in dem STED-Bild aufgrund der abgereicherten Umgebungsfluoreszenz unterschieden. Weiterhin wird die Ultrastruktur der Aktin mit deutlich verbesserter Auflösung gesehen. In Übereinstimmung mit früheren Beobachtungen 16,17 werden die Perforin-positiven lytischen Granula gesehen über Bereiche mit niedriger F-Actin Dichte in der STED-Bild, ein entscheidendes Detail, das vor allem in der konfokalen Bild verloren positioniert ist.
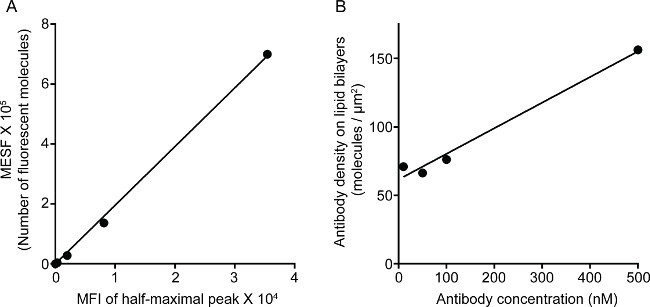
Abbildung 1. Die Dichte der 3G8-Antikörper auf die Lipiddoppelschicht. (A) lineare Korrelation zwischen MESF und MFI für Standard-Serie. (B) lineare Korrelation zwischen Proteindichte und Konzentration für Testprotein-Verdünnungsreihe, die die Anzahl von fluoreszenzmarkierten Protein Monomeren pro Flächeneinheit als Funktion der zunehmenden Konzentration an lipidbeschichteten silica Perlen.
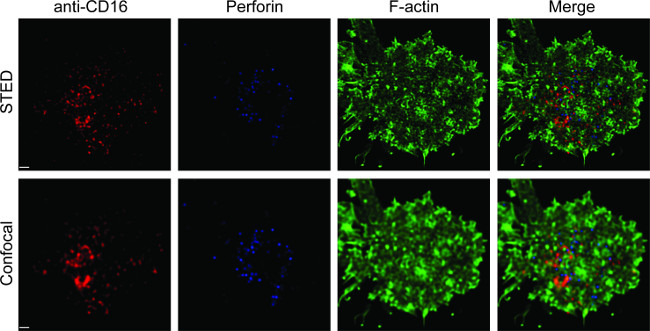
Abbildung 2. STED Bildgebung von NK Synapse auf planaren Lipiddoppelschicht. Primäre NK-Zellen wurden auf den SLB biotinylierte fluoreszenzmarkierten anti-CD16 (rot) stimuliert, fixiert, permeabilisiert, und anschließend mit Phalloidin (blau) und Anti-F-Aktin-gefärbten (grün). Eine einzelne Zelle wurde zunächst unter der normalen konfokalen Einstellung abgebildet wird, und dann wird die STED-Einstellung. Die konfokale und STED-Bilder wurden mit Huygens Software entfaltet. Maßstabsbalken, 1 um. Klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Das Neue an der vorliegenden Studie ist, dass es verbindet die SLB-Technik mit STED auf NK-Zellen Synapsen zu untersuchen. Frühere Studien haben die Lipiddoppelschicht mit TIRF abgebildet, um T-Zell-Synapsenbildung 8 und Signalmolekül Handels auf der Plasmamembran 6 studieren. Andere haben STED Bildgebung von NK-Zellen Synapsen beschrieben mit Antikörper-beschichteten Glasobjektträger 13,14. Die hier weiter beschrieben Hybridmethode baut auf diesen Bemühungen durch Abbildung der NK-Zelle Synapse mit der verbesserten Übersichtlichkeit durch höchstauflösende Bildgebung an der Lipid-Doppelschicht Oberfläche geboten, die bessere Modelle der dynamischen Oberfläche einer APC.
Obwohl SLBs sind künstliche Membranen fehlt der Zytoskelett, Lipid Rafts und andere Liganden, dass die tatsächlichen Zielzellen oder APCs besitzen, kann diese Technik wichtige Funktionen wie die Mobilität und Orientierung von Liganden zu rekapitulieren. Dies ermöglicht es dem SLB-System als reduktionistische Ansatz in Sezieren t dienener Beitrag einzelner Rezeptoren und Liganden, um die Bildung des IS und an der Dynamik der IS. Das wichtigste Merkmal der SLBs ist, dass die Forscher diese Technik mit hochauflösenden bildgebenden Methoden, wie die konfokale und TIRF-Mikroskopie zu kombinieren. Die Einführung der STED-Mikroskopie noch weiter erhöht diesen Vorteil und bietet beispiellose Einblicke in die IS-Forschung und ihrer klinischen Anwendungen.
Eine mögliche Kritik an diesem System ist, dass der SLB nicht adäquat die komplexe Oberfläche einer APC zu imitieren, wodurch zu einem potenziell nicht-physiologischen anatomische Merkmale in den resultierenden Synapsen. Während es wahr ist, dass die begrenzte Repertoire von Oberflächenmolekülen auf der SLB nicht vollständig die heterogen besiedelte Oberfläche einer APC rekapitulieren kann diese Grenze auch von Vorteil sein, da er die Forscher, den Einfluss der einzelnen Rezeptor und Liganden-Wechselwirkungen auf Synapsenbildung zu bestimmen .
Thier sind einige wichtige Schritte im Prozess. Zu den kritischsten ist, dass die Oxidation der Liposomen durch die ständig mit Argon auf den Sauerstoff in der Röhre und Lösung zu verdrängen, wie in den Schritten 1.10, 2.6 und 2.11, verhindert werden. Die Oxidation der Lipide in Lipid verringerte Mobilität führen, und verhindert so die Möglichkeit von Oberflächenproteinen, sich frei zu bewegen und sich an synaptischen Strukturierung. Ebenso ist es auch entscheidend, alle Chloroform in dem Liposom durch Lyophilisierung (Schritt 1.2) zu entfernen. Bei der Bestimmung der Proteindichte in der Lipiddoppelschicht, ist es wichtig, zuerst Dispergieren der Siliziumkörner in eine homogene Suspension frei von Clustern. Falls erforderlich, kann die Beschallung Kügelchen aufgebracht werden. In der Montage der SLB, die frühen Schritte (5,1 bis 5,8), wobei die Deckgläser gereinigt werden, die Tropfen platziert und Deckglas befestigt sind von entscheidender Bedeutung. Ein Fehler in einer dieser Punkte kann erfordern Versuchsbeginn über (ab Anfang Abschnitt 5). Aus diesem Grund ist esgute Praxis, mehr Deckgläser reinigen als benötigt werden, um Zeit im Falle einer Panne zu sparen.
Non-Clustering ist die häufigste Problem bei der Arbeit mit diesem System. Falls bei der Visualisierung der Zellen, die in dem letzten Schritt, schlägt man keine Fluoreszenz Synapsen finden, gibt es nur wenige Schritte, die ergriffen werden können. Ein weiterer Fleck für die kognate Zelloberflächenrezeptor kann an der Kammer hinzugefügt, um sicherzustellen, daß die Zelle nicht eine Synapse mit der Doppelschicht gebildet werden, während die Zellen können nicht-spezifisch an das Deckglas oder Bilayer Oberfläche haften, synaptisch-beteiligt Oberflächenproteine sollten erscheinen als unterschiedliche Cluster in der Ebene der Zelle-Doppelschicht-Schnittstelle, während unengaged Oberflächenproteine als diffuse Färbung um den Rand der Zelle erscheinen. Sollte diese Methode nicht, sollte man ihren Zellen über Durchflusszytometrie überprüfen, um sicherzustellen, dass die jeweilige Markierung muss schon zum Studium ist in ausreichender Fülle auf der Zelloberfläche exprimiert. Bestimmte Oberflächen proteIns sind dafür bekannt, über langfristige In-vivo-Kultur herunterreguliert.
Während dieses Protokolls Details speziell wie NK-Zellen Synapsenbildung sichtbar zu machen, kann der SLB-System zur Synapsenbildung in jeder erdenklichen Immunozyt einfach durch Substitution der primären Liganden in Schritt 5.11 studieren. Mehrere Liganden können auch gleichzeitig zugegeben werden. Man braucht auch nicht mit einem Streptavidin-Biotin-System zum Kleben der Oberflächenproteine innerhalb der Doppelschicht. Nickel-NTA: Histidin Wechselwirkungen sind auch sinnvoll ist. Aufgrund der hohen Festigkeit und Spezifität des Streptavidin jedoch: Biotin-Wechselwirkung, zieht unserem Labor dieses System. Man kann auch variiert die Konzentration der Zellen auf die Doppelschicht aus der vorbestimmten Dichte in Schritt 5.13 aufgenommen sowie die Dauer des anschließenden Inkubationsperiode um Synapsen in verschiedenen Stadien der Reifung zu beobachten. Dies kann sogar lebende geführt werden, obwohl dies natürlich schließt die Möglichkeit der Visualisierung intrazellulärem structures (soweit sie nicht bereits mit einem kondensierten Fluoreszenzmarkierung markiert, unserem Labor verwendet ein paar solcher veränderter Zelllinien). Aufgrund des hohen Individualisierungsgrad möglich in diesem Protokoll, kann man die Grund SLB Technik zu verwenden, zusammen mit STED-Bildgebung, um eine unglaublich breite Palette von Fragen in den Bereichen Immunologie, Zellbiologie und Biochemie anzugehen, einschließlich der wichtigsten Lipiddynamik 15, Synapsenbildung 16, intrazelluläre Signal 17 und Metastasierung von Tumorzellen 18.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
We thank Emily Mace and Malini Mukherjee for imaging and deconvolution analysis. Work in the Liu laboratory was supported in part by the Baylor-UTHouston Center for AIDS Research Core Support Grant number AI36211 from the National Institute of Allergy and Infectious Diseases, the Caroline Wiess Law Fund for Research in Molecular Medicine, Texas Children’s Hospital Pediatric Pilot Research Fund, and the Lymphoma SPORE Developmental Research Program from Baylor College of Medicine and the Methodist Research Institute.
Materialien
| Name | Company | Catalog Number | Comments |
| 18:1 (Δ9-Cis) PC (DOPC) 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti | 850375C | Liposome preparation |
| 18:1 Biotinyl Cap PE 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl) (sodium salt) | Avanti | 870273C | Liposome preparation |
| Argon gas, compressed | Airgas | UN1006 | Liposome preparation |
| A lyophilizer | Labconco | Freezone 7740020 | Liposome preparation |
| Lyophilizer tubes | Labconco | 7540200 | Liposome preparation |
| Chromatography Columns | Santa Cruz | sc-205558 | Liposome preparation |
| 1 M Tris pH 8.0 | Ambion | AM9856 | Liposome preparation |
| 5 M NaCl | Ambion | AM9759 | Liposome preparation |
| Octyl-β-D-glucopyranoside | Sigma-Aldrich | O1008 | Liposome preparation |
| Dialysis tubing | Spectrum Labs | 132676 | Liposome preparation |
| 96-well V-bottom polystyrene plate (untreated) | Corning | 3896 | antibody density determination |
| Non-functionalized silica beads | Bangs Laboratories | SS06N | antibody density determination |
| FACS tubes | Fisher Scientific | 14-959-2A | antibody density determination |
| QuantumTM MESF beads | Bangs Laboratories | Variable | antibody density determination |
| Casein | Sigma-Aldrich | C0875 | Lipid bilayer preparation |
| HEPES buffered saline + 1% HSA | Homemade | Lipid bilayer preparation | |
| Streptavidin | Life technologies | 434301 | Lipid bilayer preparation |
| Fluorescently-labeled biotinylated protein | Homemade | Lipid bilayer preparation | |
| ibidi Sticky-Slide VI 0.4 | ibidi | 80608 | Lipid bilayer preparation |
| 25x75 mm glass coverslip | ibidi | 10812 | Lipid bilayer preparation |
| Hydrogen peroxide (30%) | Fisher Scientic | BP2633 | Lipid bilayer preparation |
| Sulfuric acid | Sigma-Aldrich | 258105 | Lipid bilayer preparation |
| D-Biotin | Invitrogen | B20656 | Lipid bilayer preparation |
| Lens paper | VWR | 54826-001 | For imaging |
| Type F Immersion Oil | Leica | 11 513 859 | For imaging |
| A Leica TCS STED microscope | Leica | For imaging |
Referenzen
- Dustin, M. L., Long, E. O. Cytotoxic immunological synapses. Immunol. Rev. 235 (1), 24-34 (2010).
- Monks, C. R., Freiberg, B. A. K. u. p. f. e. r. H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Hafeman, D. G., von Tscharner, V., McConnell, H. M. Specific antibody-dependent interactions between macrophages and lipid haptens in planar lipid monolayers. Proc Natl Acad Sci USA. 78 (7), 4552-4556 (1981).
- Tscharner, V., McConnell, H. M. Physical properties of lipid monolayers on alkylated planar glass surfaces. Biophys J. 36 (2), 421-427 (1981).
- Crites, T. J., Chen, L., Varma, R. A TIRF microscopy technique for real-time, simultaneous imaging of the TCR and its associated signaling proteins. J. Vis. Exp. , (2012).
- Prins, K. C., Vasiliver-Shamis, G., Cammer, M., Depoil, D., Dustin, M. L., Hioe, C. E. Imaging of HIV-1 envelope-induced virological synapse and signaling on synthetic lipid bilayers. J. Vis. Exp. , (2012).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. , (2008).
- Michalet, X., Weiss, S. Using photon statistics to boost microscopy resolution. Proc. Natl. Acad. Sci. U. S. A. 103 (13), 4797-4798 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu. Rev. Biochem. 78, 993-1016 (2009).
- Lippincott-Schwartz, J., Manley, S. Putting super-resolution fluorescence microscopy to work. Nat. Methods. 6 (1), 21-23 (2009).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J. Vis. Exp. , (2014).
- Rak, G. D., Mace, E. M., Banerjee, P. P., Svitkina, T., Orange, J. S. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Leutenegger, M., Ringemann, C., Lasser, T., Hell, S. W., Eggeling, C. Fluorescence correlation spectroscopy with a total internal reflection fluorescence STED microscope (TIRF-STED-FCS). Opt Express. 20 (5), 5243-5263 (2012).
- Liu, D., Bryceson, Y. T., Meckel, T., Vasiliver-Shamis, G., Dustin, M. L., Long, E. O. Integrin-dependent organization and bidirectional vesicular traffic at cytotoxic immune synapses. Immunity. 31 (1), 99-109 (2009).
- Liu, D., Peterson, M. E., Long, E. O. The adaptor protein Crk controls activation and inhibition of natural killer cells. Immunity. 36 (4), 600-611 (2012).
- Wu, J. C., et al. Antibody conjugated supported lipid bilayer for capturing and purification of viable tumor cells in blood for subsequent cell culture. Biomaterials. 34 (21), 5191-5199 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten