Method Article
유리 - 지원 평면 지질 이중층에 자연 살해 세포 면역 시냅스의 슈퍼 해상도 이미징
요약
We describe here a combination of the glass-supported lipid bilayer technique of forming immunological synapses with the super-resolution imaging technique of stimulated emission depletion (STED) microscopy. The goal of this protocol is to provide users with the instructions necessary to successfully carry out these two techniques.
초록
The glass-supported planar lipid bilayer system has been utilized in a variety of disciplines. One of the most useful applications of this technique has been in the study of immunological synapse formation, due to the ability of the glass-supported planar lipid bilayers to mimic the surface of a target cell while forming a horizontal interface. The recent advances in super-resolution imaging have further allowed scientists to better view the fine details of synapse structure. In this study, one of these advanced techniques, stimulated emission depletion (STED), is utilized to study the structure of natural killer (NK) cell synapses on the supported lipid bilayer. Provided herein is an easy-to-follow protocol detailing: how to prepare raw synthetic phospholipids for use in synthesizing glass-supported bilayers; how to determine how densely protein of a given concentration occupies the bilayer's attachment sites; how to construct a supported lipid bilayer containing antibodies against NK cell activating receptor CD16; and finally, how to image human NK cells on this bilayer using STED super-resolution microscopy, with a focus on distribution of perforin positive lytic granules and filamentous actin at NK synapses. Thus, combining the glass-supported planar lipid bilayer system with STED technique, we demonstrate the feasibility and application of this combined technique, as well as intracellular structures at NK immunological synapse with super-resolution.
서문
면역 시냅스 (IS) 세포 활성화 및 기능 1 중요한 교차점에 자리 잡고 있습니다. 이 항원 제시 세포 성 면역이 수행되는 주요 매체이다. 시냅스 형성의 초기 연구는 미세 세포 - 세포 공액 시스템 (2)을 이용했다. 이 방법의 중요한 한계는 따라서 시냅스 구조 자체의 관찰자의 뷰를 제한하는, 말하자면 접합체의 대부분이, '프로파일'보여 질 것이다. 1999 년, 더스틴 연구소는 이전 McConnel 실험실 4,5에 의해 개척되었다 유리 지원 지질 이중층 (SLB) 기술 (3)를 활용하여이 제한을 해결. 단백질이 부착 된 두 개의 차원으로 자유롭게 이동 될 수있는에 유리 지원 평면 지질 표면에 찬성 항원 제시 세포 (APC를) 처분이 방법. 이 방법을 사용하여, 더스틴와 동료 t에 직접 위로 피어 할 수 있었다그는 고해상도 형광 현미경을 이용하여, 처음으로 IS의 구조에서 "일대일"모양을 얻을 시냅스.
SLB 시스템의 사용으로, IS가 가시화 될 수있는 세부 사항은 현재의 영상 기술 6-8의 제한에 의해 제한되어왔다. 표준 조명 기술을 이용하여, 최소 해상도 (즉, 그들이 구별 될 수있어서 별개의 두 개체 사이의 최소 거리) <된 레일리 기준 (9)의 200 nm의 기준으로했다. 이 제한은 시냅스를 구성하는 매우 미세한 분자 스케일 구조물의 촬상을 방해, 및 수퍼 - 해상도 이미징 기법 10-12의 개발까지 이러한 구조의 시각화는 전자 현미경을 사용하여 고정 된 세포 이미징에 국한되었다.
이러한 SIM 같이 초 해상 기술, 다양한 최근의 출현 (구조화 조명 현미경)는, PALM (광 활성화 현지화 현미경), STORM (stochastical 광학 재건 현미경) 및 STED 10-12, 연구자들은 지금 다시 IS의 점점 더 명확히 이해를 제공하고 전례가없는 세부 사항, 이러한 시냅스 구조를 연구 할 수 있습니다. STED 현미경의 장점은 (13) 이전에 설명되었다. 여기에서 우리는 새로 개발 된 660 nm의 고갈 레이저가 장착 STED 현미경 슈퍼 해상도 이미징에 대해 설명합니다. 종래의 592 nm의 공핍 레이저에 비해, 660 nm의 레이저는 형광 염료 (http://nanobiophotonics.mpibpc.mpg.de/old/dyes/ 참조), 특히 이들 적색 형광체의 폭 넓은 선택을 허용한다.
다른 게시물은 항체 코팅 된 유리 슬라이드 13, 14에 NK 세포 시냅스의 STED 영상을 설명했다. 여기서, SLB 시스템은 NK 세포 시냅스 공부 초해 STED 현미경과 결합된다. 이 기술은 항체 위에 이점을 갖는다임베디드 표면 단백질은 이차원 평면의 표면 (xy 평면)으로 자유롭게 이동할 수있는 유체 모자이크,되는 코팅 슬라이드. 이것은 더 충실 타겟 셀의 유기 및 모바일 표면을 모방하고, 결과적으로 더 중요한 생리 면역 시냅스 형성을 되풀이.
이 프로토콜의 목적은 SLB 시스템 및 수퍼 - 해상도 STED 현미경을 조합하여 NK 세포의 방법 이미지 면역 시냅스의 상세한 설명과 함께 최종 사용자에게 제공하는 것이다. 또한 필요한 단계와 최종 사용자에게 제공 할 것이다 : 리포좀을 제조, 단백질 매립 이중층을 구성, 지질 이중층에 단백질 밀도를 결정하고, STED 현미경을 사용하여 초 - 해상도 이미지를 획득. 이러한 기술은 면역학 분야에 한정되지 않고, 광범위하게 다양한 분야에 걸쳐 이용 될 수있다.
프로토콜
리포좀 1. 준비
- 1,2- dioleoyl-SN 글리세로 -3- 포스 포 콜린 (DOPC) 및 1,2- dioleoyl-SN 글리세로 -3- phosphoethanolamine-N-캡 바이오틴 클로로포름 탁 스톡 용액의 양을 계산 (비오틴 PE) 원하는 최종 농도로 희석 주식을 확인합니다. 10 ㎖를 각각 400 μM의 DOPC 80 μM 비오틴 - PE 인지질의 최종 농도를하려면 별도의 유리 크로마토 그래피 튜브에 10 ㎎ / ㎖의 DOPC의 629 μL, 88 μL 10 ㎎ / ㎖ 비오틴-PE를 배치하여 시작합니다.
참고 :이 DOPC과 비오틴 - PE의 클로로포름 중단 원액을 전송하는 동안, 용액 (120 ml의 물을 포함하는 60g의 수산화 칼륨, KOH 1 L 95 % 에탄올)을 청소하여 유리 해밀턴 주사기 및 유리 크로마토 그래피 관을 청소하는 것이 중요합니다. - 화학 후드에서 아르곤의 흐름과 함께 클로로포름을 건조. 파라 필름으로 크로마토 그래피 관을 밀봉합니다.
- lyophiliz에서 높은 진공에 새로 건조 된 리포좀을 가하지어 O / N은 잔류 클로로포름을 제거합니다. 60 ~ 90 분간 건조 당일 완료하십시오.
- 동결 건조기을 실행하는 동안, 일부 희석 버퍼를 준비합니다. 이 프로토콜의 경우, 25 mM 트리스, pH를 8.0로 구성된 25 ml의 준비; 150 mM의 NaCl을; 및 (중량) 2 % n- 옥틸-β-D-라노 시드 (OG) 세제. 다음 건조 OG 분말을 추가하기 전에 아르곤과 산소를 치환 함께 먼저 처음 두 재료를 섞는다. 제조 후, 12 ° C에서 OG 0.2 마이크론 셀룰로오스 아세테이트 막과 용액 및 저장소 필터.
- 또한,하지만 OG없이, 같은 농도에서 트리스 식염수 버퍼의 1 L의 두 나사 상단 병을 준비합니다. 각의 바닥에 증류수 세척 자기 교반 막대를 놓습니다. 트리스 식염수 버퍼의 6 추가 리터를 준비합니다. 아르곤과 모든 병에서 산소를 제거하고뿐만 아니라 4 ° C에 배치합니다.
- 동결 건조 후, 각각의 4 mM의 용액을 만들기 위해 식염수 OG 트리스 완충액 건조 지질을 용해. 예를 들어 다음볼륨, 비오틴-PE 관에 DOPC 튜브 2 ml를, 0.2 ml에 추가합니다.
- 함께 DOPC 지질과 비오틴 - PE 지질을 섞는다. 결합 된 비오틴은 포스페이트 헤드 기의 유동성을 저해 할 수 이것은, SLB의 이동도를 향상시킨다. 80 μM PE 비오틴의 최종 농도를 확인하기 위해, 0.2 mM의 4 비오틴 PE ml의 4 mM의 DOPC 1 ㎖를 혼합한다. 그런 다음 트리스 식염수 OG 버퍼의 8.8 ml를 추가합니다.
- 400 μM의 DOPC의 최종 농도를 들어, 단순히 트리스 - 식염수 OG 9 ml로 4 mM의 DOPC 1ml의 섞는다.
- 얼음 물 초음파기를 입력합니다. 유틸리티 클램프를 사용하여 초음파 처리의 중심에 인지질을 함유하는 희석 된 유리관을 넣어. 맑은 용액이 될 때까지 10 분 동안 초음파 처리 희석 인지질.
주 : 초음파가 열을 발생하기 때문에 낮은 온도를 유지하기 위해 초음파기 물을 욕조에 얼음을 추가합니다. - 액체 위의 공기에서 산소를 대체하기 위해 아르곤으로 튜브를 입력하고, 파라 필름으로 밀봉합니다.
리포좀 2. 투석
- 건조 투석 튜브의 두 부분을 잘라 (분자량 컷 - 오프 : 12-14,000, 직경 : 6.4 mm) 적당한 길이의 (이 예에서는, 40cm), 각 인지질 희석 하나를 롤에서.
- 이들을 2 분 동안 유리 비이커에서, 증류수 200ml에 침지 할 수 있도록함으로써 튜브 섹션을 재수.
- 높은 설정에서 5 분 동안이 전자 레인지, 또는 적어도 물이 끓게 올 때까지.
- 각 튜브의 한쪽 끝에서 매듭을 묶어 트리스 식염수 OG 버퍼의 몇 밀리리터로 내부를 씻어. 그 후, 내부에 남아 꼼꼼하게 버퍼의 양을 최소화하기 위해 가능한 본 세척 완충액만큼을 짠다.
- 모든 공기를 배제하도록 층류 후드에서 작은 투석 튜브의 폐쇄 단부와 개방 각 희석 튜브에 인지질을 추가 클램프. 전체 공기 배제 및 아래 클램핑하여 샘플의 작은 볼륨의 희생이 필요합니다# 8220; 물 라인 ".
- OG없이 트리스 식염수 버퍼의 이전 준비 병 샘플을 담근다. 4 ℃에서 O / N를 저어 다시 밀봉 및 장소하기 전에 아르곤와 병에 산소를 치환.
- 적어도 3 회 OG없이 트리스 완충액 식염수의 새로운 병으로 매 12 시간 동안 튜브를 전송합니다.
- 곧 투석 지질을 제거하기 전에 산소를 대체하기 위해 아르곤과 각을 작성하여 지질 나누어지는 데에 작은 튜브의 수를 준비합니다.
- 36 시간 후, 층류 후드에 투석 병을 가지고 병에서 투석 튜브를 제거합니다. 젖은 유출수를 수집하는 손에 벤치 기저귀 또는 비커 있습니다.
- 다음 클립을 조심스럽게 제거하고 얼음에 아르곤 가스로 채워진 튜브 제조 사전에 1 ㎖의 분액으로 피펫을 통해 투석 된 지질 용액을 전송하고, 상기 클립 투석 튜빙을 잘라.
- 수성 리포좀 솔루션을 나누어지는, 나는 산소를 다시 변위 아르곤 스트림을 사용n은 각 튜브.
- 4 °에서 리포좀을 저장합니다. 냉동하지 마십시오.
지질 이중층에 항체 농도 3. 결정
- 다음과 같은 농도에서, 바이오틴, 형광 표지 된 항체의 희석 시리즈, 각 희석 볼륨 50 μl를 준비합니다 (공백)이 0 ㎚, 10 nM의 50 nm의, 100 nm의, 500 nm의. (이하는 "샘플 시리즈"이라한다).
- 96 웰 V-바닥 판의 6 우물에 실리카 비드의 1 μl를 추가합니다. 그들이 정착하는 경향이 잘 피펫 팅 전에 구슬을 흔들어해야합니다.
참고 : 중단보다는 건조 구슬을 지시 한 경우, 희석 제조업체의 지침을 따르십시오. - : 1 비율로 1 바이오틴 인지질 :이 구슬에,이 혼합 DOPC의 μl를 추가합니다. 각 웰에 대해이 작업을 수행합니다.
- 구슬과 인지질과의 상호 작용을 장려하기 위해 10 초마다 중간 강도에서 3 번 vortexer를에 접시 펄스.
- 5 % CAS의 150 μl를 추가각 웰에 EIN. 피펫 팅에 의해 세 번 아래로 잘 섞는다.
- 플레이트는이어서, 10 분 동안 카제인 용액에 부화 씻어 보자. 세척, HEPES 250 μL의 총 부피로 각 웰을 채우는 1 % 인간 혈청 알부민 (HSA)과 식염수 (HBS)를 버퍼링. 2 분 동안 1,000 XG에 원심 분리기. 아웃 피펫 맨 상층 액을 200㎕를 버리고, 3 회의 세탁 총 두번 반복한다.
- 333 NG / ml의 농도에서 스트렙 타비 딘의 50 μl를 추가합니다. 다시 10 초를 3 배 판 펄스, 그리고 15 분 동안 진탕에 앉아 보자. 워시 배 단계 6과 결합되지 않은 스트렙 타비 딘를 제거합니다.
- 이전에 준비 희석 시리즈에서 형광 표지 된 비오틴 항체의 50 μl를 추가 아니라 각 (단계 3.1 참조), 20 ~ 30 분 동안 진탕에 접시를 교체합니다. 워시 배 단계 6과 결합되지 않은 항체를 제거합니다.
- 최종 세척 한 후, 다음 FACS 튜브로 전송, HBS / 1 % HSA 100 ㎕에 구슬을 재현 탁. 에이 두 번 반복300 μL의 총 아니라 모든 구슬의 효율적인 제거를 확인하고 각각의 웰에 대해이 작업을 수행합니다.
- 유량 계측기에 결과 튜브를 가져와. 그것은을 읽을 수있는 시간입니다.
- 형광 강도 캘리브레이션 (FIC) 비드 키트에서 "B"로 표시된 병에서 1 방울 추가를 FACS 튜브 (이하 "표준 시리즈"라고 함), 및 HBS / 1 % HSA 300 μL로 희석 하였다.
- 이 튜브를 읽을 수 있지만 아직 데이터를 기록하지 않습니다. 지금은 단순히 빈 구슬이 제대로 제로되어 있는지 확인합니다. 피크가 히스토그램의 왼쪽 끝에가 될 때까지 적절한 채널에서 측정 된 비드의 형광을 나타내는 히스토그램을 확인한 후 다운 여기 레이저의 시프트 전압.
- 튜브를 제거하고 같은 튜브 (1 ~ 4 표시) 시리즈의 다른 4 관의 각 1 방울을 추가합니다. 이제, 다시 기계에 튜브를 배치하고 5 별개의 봉우리로 나타납니다 결과 데이터를 기록한다.
- 샘플 시리즈에서 각각의 튜브를 읽어보십시오.
- FACS 분석 소프트웨어를 사용하여, 최대량의 절반 지점에서 일련의 표준 히스토그램의 각 피크의 전체 폭에 걸쳐 게이트를 그린다. 즉, 각 피크에 대한 하나의 게이트입니다. 각 샘플에 대해 동일한 작업을 수행합니다. MFI 각 게이트에 대한 (평균 형광 강도) 참고.
- 적절한 위치에서 스프레드 시트 프로그램을 입력 MFI 측정 값을 이용하여. 또한 입력 MESF 값 (이에 상응하는 수용성 형광 색소의 분자) 표준 시리즈의 각 병 (각 비드 코팅 형광 분자의 평균). 이 정보는 플라스틱의 방향이 튜브에 와서 항아리에 따라 찾을 수 있습니다.
- 형광체의 수 및 측정 된 세기 간의 선형 상관 관계를 생성 MESF 값들에 대해 플롯 것 MFI 스프레드 시트를 사용한다.
- Pro에 염료의 비율을 결정하기 위해 마이크로 볼륨 분광 광도계 '단백질 및 라벨'의 모듈을 사용표지 된 항체에 TEIN.
- 입력 샘플 단백질의 표지 효율, 지질 코팅 비드의 평균 직경은, 각 항목에 대한 값 MFI. 스프레드 시트를 자동으로 각 희석 및 단백질 농도에서 각 샘플의 단백질 시딩 MESF 밀도 값을 계산하는 단계에서 생성 3.16 선 그래프에서 수식을 사용한다.
4. 분리 및 배양 인간 NK 세포
- 나누어지는 15 ml의 50 ML 원뿔 튜브에 말초 혈액이나 버피 코트. PBS 1의 비율로 1 % FBS를 함유하는 혈액이 희석 : 1.
- 부드럽게 10 ml의 혈청 학적 피펫 튜브의 바닥에 피콜의 13 ML을 추가합니다.
- 원심 분리기 (20) 가속기와 1200 XG에 분 휴식 오프 또는 가장 낮은 설정에서이 튜브.
- 원심 분리 후, W (PBMC를) 말초 혈 단핵 세포의 플로팅 흐린 백색 중간층을 수집 혈청 피펫을 사용HICH 앉아서 맑은 노란색 상위 계층과 적혈구 (적혈구)의 최하층 위에 앉아 둘 다 더 흐린 옅은 색의 하위 계층 사이의 교차한다. 참고 PBMC를 수집의 모든 적혈구를 수집하지 마십시오.
- 새로운 50 ML 원뿔 튜브에 수집 된 PBMC를 배치하고 PBS 1 % FBS를 포함하여 용량을 희석. 다시 원심 분리기, 300 x g에서 5 분 동안 최대의 브레이크와 가속,이 시간.
- 뜨는을 취소하고 1 % FBS를 포함하는 PBS 10ml에 세포를 재현 탁.
- 단계 4.6에서와 같이 한 번 더 동일한 설정에서 원심 분리하는 동안 세포를 계산합니다.
- 다시 한번 상층 액을 제거하고, 천만 세포 / ml의 밀도로 배지에서 R10 세포를 재현 탁.
- 제조업체의 지시에 따라, 5 ml의 폴리스티렌 튜브 천만 세포를 가지고, 자기 분리 키트를 사용하여 NK 세포를 분리. 분리 후, 500,0의 밀도로 세포 하나 더 재현 탁를 계산R10 완전 배지에서 00 세포 / ㎖ (88 % RPMI, 10 % FBS, 1 % HEPES; 1 % 피루브산 나트륨) IL-2 (100 U / ml)로 보충. CO 2 배양기에서 37 °,과에서 문화는 2 ~ 3 회 주간 매체를 교체합니다.
5. 유리 지원 평면 지질 이중층 조립
- 비이커에 3 : 1의 비율로 황산 30 % 과산화수소를 혼합함으로써 100 ㎖의 피라냐 용액을 준비한다.
참고 : 항상 제대로 지정 화학 흄 후드에서 황산 등 유해 에이전트와의 작업을 수행. - 이 솔루션으로, 20 ~ 30 분 동안 피라나 용액이 직사각형 # 1.5 된 커버를 체험.
참고 : 피라 솔루션으로 된 커버를 청소하는 것이 필수적이다. - 된 커버를 청소하는 동안 이전에 400 μM의 DOPC 지질 및 이전에 80 μM 비오틴 - PE 지질 준비의 1 튜브 준비의 1 관을. 아르곤 탱크에 얼음을 운반.
- 아르곤으로 새로운 microcentrifuge 관에서 산소를 대체,: 1의 비율로 다음 1 DOPC과 비오틴-PE를 함께 추가합니다. 특정 볼륨이 실험의 요구에 따라 달라질 수 있지만, 최소 2 μL를 각에 있어야합니다. 냉장고에 후자를 리턴하기 전에, 한번뿐만 아니라 아르곤 가스, 개별 시약 튜브 혼합물을 튜브에서 산소를 변위.
- 그들은 청소를 마친 후, 철저하게 증류수로 된 커버를 씻어냅니다. 몇 분 동안 건조 공기 아웃 된 커버를 설정합니다.
- 단계 5.4에서 제조 한 리포솜 혼합물의 1.5 μl를 취하여 슬라이드 챔버의 챔버 레인 중 하나에 한 방울에 나누어지는. 레인 당 2 방울의 전형적인 사용되지만, 필요하지 않다.
- 신속하고 효율적으로 물방울을 통해 건조 커버 슬립을 배치합니다. coverslip에 배치되면 그들이 병합하지 않도록 방울 충분히 이격되어 있는지 확인합니다. 또한, 방울 챔버 벽의 가장자리를 건드리지 않고, 원형과 잘 정의 된 남아 있는지 확인하십시오. 단단히 누르십시오사이 각 레인의 주위에 커버 슬립 및 슬라이드 사이의 방수 씰을 보장합니다.
- 마커 펜을 사용하여 방울의 위치를 마크
- 이중층을 차단하는 챔버를 통해 수성 5 % 카제인 100 ㎕ 합격. 유량 용기에 기포가 없음을 확인하십시오.
- 각 레인에 333 ng / ml의 농도에서 스트렙 타비 딘 100 ㎕를 주입한다. 실온에서 10 ~ 15 분 동안 품어. 그 후, 여분의 스트렙 타비 딘을 제거하기 위해 각 레인을 통해 HBS / 1 % HSA 3 ㎖를 실행하여 세척한다.
- 이러한 이전에 20 ~ 30 분 동안 어둠 속에서 제 3 절 품어에 가장 효과적인 것으로 판단 단백질 농도에 알렉사 플 루어 (568)으로 바이오틴 형광 표지 된 항 CD16의 100 μl를 추가합니다. 각 레인을 통해 HBS / 1 % HSA 3 ㎖를 실행하여 다시 씻으십시오.
- 명세서의 비 - 특이 적 결합의 가능성을 초과 스트렙 타비 딘을 결합하고, 따라서 제거하기 위해 상기 챔버를 통해 농도 25 nm에서 D-100 μL 비오틴 흐름셀 reptavidin.
- HBS / 1 % HSA 500,000 / ml의 농도에서 NK 세포에 resuspend 카운트.
- 셀을 아래로 회전하는 동안, 레인 당 HBS / 1 % HSA의 또 다른 3 ml의 챔버에서 D-비오틴을 씻는다.
- 이전에 NK 세포를 추가로 총 내부 반사 형광 (TIRF) 또는 공 초점 현미경에 (FRAP)을 photobleaching에 후 형광 복구하여 SLB에 리간드의 이동성을 확인합니다.
- 세포가 구동을 완료하고 원하는 농도로 재현 탁하고 나면, 각 레인에 100 μl를 추가합니다.
- 30 ~ 60 분 동안 37 ° 5 % CO 2 배양기에서 챔버를 놓습니다.
- 이 잠복기 후, 10 ~ 20 분 동안 실온에서 4 % 파라 포름 알데히드와 세포를 고정합니다. 파라 포름 알데히드를 제거하기 위해 각 레인을 통해 PBS의 3 ㎖를 실행하여 씻으십시오.
- 버퍼 (5 % 정상 당나귀 혈청 0.2 % PBS에서 Tritron X-100)를 차단 400 μl를 추가합니다. 실온에서 30 분 동안 인큐베이션.
- 얼룩 F - 굴지 및 광고에 의해 퍼포딩 희석 형광 표지 팔로이 딘에 200 μL (1 단위 / ㎖의 표지 팔로이 딘) 및 형광 표지 항 퍼포 항체 (500 NG / ml의 항 - 퍼포 단클론 항체). 1 시간 동안 실온에서 품어.
- PBS의 3 ㎖를 실행하여 씻으십시오. 챔버는 이미징을위한 준비가되어 있습니다.
STED를 사용하여 지질 이중층에 NK 냅 6. 이미징
- 필요한 모든 하드웨어 모듈의 전원을 켭니다.
- 이미지 분석 소프트웨어를 시작. 공진 검사 및 STED 모듈을 모두 사용합니다. 이러한 선택을 한 후, 소프트웨어가 시작하기 약 3-5 분 동안 기다립니다.
- 화면 상단의 "구성"탭을 클릭합니다.
- 선택 "레이저 구성"을 선택 후 흰색 빛과 STED 592 nm의 레이저를 켭니다.
- 100 배 목표를 선택하고, 592 nm의 고갈 레이저로 여기 레이저 빔을 맞 춥니 다.
- , "레이저 구성"모듈을 선택 592 고갈을 해제레이저 및 660 nm의 고갈 레이저에 전원을 켭니다.
- 렌즈를 통해, 무대에 슬라이드를 놓습니다. 백색광 램프와 접안 렌즈를 사용하여 초점 경계가 이중층 지역에 바인딩 세포를 가져와.
- 직접 "구성"탭의 오른쪽에, "취득"탭으로 돌아갑니다.
- "스위치 WhiteLight의에"탭을 클릭 한 다음에 해당 모듈을 설정하고 적절한 파장에 여기 레이저 선을 드래그합니다.
- 다음, 적절한 파장의 범위를 포함하는 것으로 검출 범위를 설정 가능한 사람들의리스트에서 원하는 감시를 선택.
참고 : 여기 빔 바로 아래에 감지 범위를 넣어하지 마십시오. - 왼쪽 도구 모음의 맨 아래에있는 순차 주사 대화 상자를 불러옵니다 왼쪽에있는 "Seqential"버튼을 "취득"도구 모음을 클릭합니다. 따라서, 사용자가 여러 서열을 추가 할 수 있도록 각다른 색상마다 서로 다른 여기 빔과 함께. "프레임 사이"를 클릭 한 다음 단계 6.9 및 6.10에서와 같이 각각의 추가 색상의 여기 주파수 검출기 및 검출 범위를 설정합니다.
- 모든 설정이 최적화되면, 인수 과정을 시작하려면 "시작"을 누르십시오.
- 이전 13 설명한 바와 같이, STED의 디컨 볼 루션 위해 디자인 된 설정을 사용하여 무료 디컨 볼 루션 소프트웨어 (호이겐스)를 적용합니다.
결과
도 1은 지질 이중층에 항체 밀도의 결과를 나타낸다. 원리는 유동 세포 계측법 (A)를 통해 MFI 대 MESF의 표준 곡선을 만들기 위해 표준 비드를 사용하는 것이다. 일련의 샘플의 MFI는 표준 곡선을 사용 MESF로 전환시켰다. 지질 이중층에 대한 항체 농도는 선형 항체 농도 (B)과 상관된다. 유리 -지지 평면 지질 이중층에 NK 시냅스 2보기 트리플 컬러 화상 STED 도표. 지질 이중층에 항 CD16 항체 F 액틴 형성 및 편광 및 NK 세포에서의 면역 시냅스 패널에 초점 F 액틴 메시를 통해 침투하는 perforin 트리거링 축적한다. 이 결합 된 방식을 사용하여, 하나는 깨끗하게 직접 NK 세포에 CD16의 클러스터링을 반영 SLB, 내 안티 CD16 라벨 형광의 microclusters을 관찰 할 수 있습니다. 종래의 공 초점 이미지의 CD16 센트라의 구조에 비해L 클러스터는 더 쉽게 인해 고갈 된 주변 형광에 STED 이미지에서 식별됩니다. 또한, 액틴 세포 골격의 미세 구조가 크게 개선 된 해상도로 볼 수있다. 이전의 관찰 16, 17과 일치, 퍼포 양성 용해성 과립 STED 이미지, 주로 공 초점 이미지 손실 중요한 세부 낮은 F - 굴지 밀도의 영역 위에 위치 볼 수 있습니다.
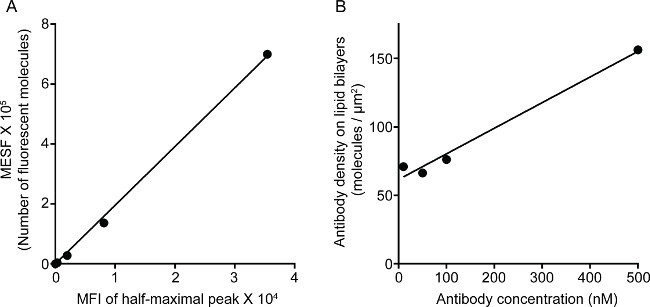
지질 이중층에 3G8 항체 그림 1. 밀도. (A) 표준 계열 MESF 및 MFI 간의 선형 상관 관계. (B) 단백질의 농도 및 샘플 단백질 희석 계열의 농도 간의 선형 상관 관계, 당 형광 표지 된 단백질 단량체의 수를 나타내는 지질 코팅시에 증가하는 농도의 함수로서 단위 영역리카 구슬입니다.
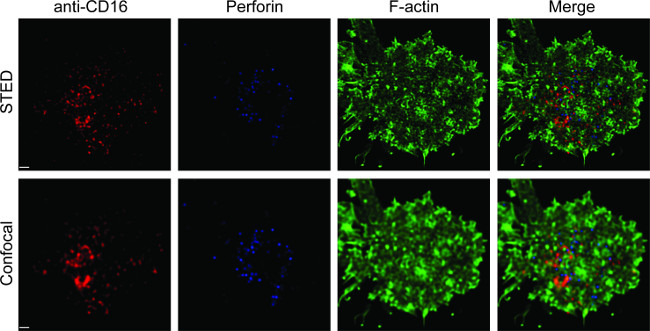
평면 지질 이중층에 NK 시냅스 그림 2. STED 촬상. 기본 NK 세포, SLB 함유 비오틴 형광 표지 된 항 CD16 (적색)에 자극 고정 투과 가능하고 팔로이 딘 (청색) 및 안티 F 액틴 염색 (녹색). 각각의 셀은 먼저 일반 공 초점 설정 아래에 몇 군데, 다음 STED 설정했다. 공 초점 및 STED 이미지는 호이겐스 소프트웨어를 사용 deconvoluted했다. 스케일 바, 1 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
본 연구의 참신은 NK 세포의 시냅스를 공부 STED와 SLB 기술을 결합한 것입니다. 이전의 연구는 세포막 6 T 세포의 시냅스 형성 (8) 및 신호 분자 인신 매매를 공부 TIRF와 지질 이중층을 이미지화했다. 다른 사람은 항체 코팅 된 유리 슬라이드 13, 14를 사용하여 NK 세포 시냅스의 STED 영상을 설명했다. 본 명세서에서 더 설명 하이브리드 방법은 지질 이중층 표면에 초 - 해상도 이미징에 의해 수득 향상된 선명도와 NK 세포에 의해 시냅스 촬상 이러한 노력을 토대로하는 APC 나은 모델의 동적 표면.
SLB 수 실제 표적 세포 또는 항원 제시 세포 골격이 소유하는 것이, 지질 뗏목 부족 인공 세포막 및 기타 리간드이지만,이 기술은 이동 방향 및 리간드로서 중요한 기능 요점을 되풀이 할 수있다. 이 SLB 시스템은 해부 t에 환원 주의적 접근 방법이 될 수 있습니다IS의 형성과 IS의 역학에 대한 개별 수용체와 리간드의 그는 기여. SLB 수의 가장 중요한 특징은 연구자는 공 초점 현미경과 같이 TIRF 고해상도 영상화 방법과이 방법을 결합 할 수 있다는 것이다. STED 현미경의 도입은 더욱 연구와 임상 응용 프로그램입니다에 전례없는 통찰력을 제공,이 장점을 증가시킨다.
이 시스템의 하나의 잠재적 인 비판은 SLB 적절 따라서 결과 시냅스에 잠재적으로 비 생리적 해부학 적 특징에 상승을 제공, APC의 복잡한 표면을 모방하지 않습니다. 이 SLB에 표면 분자의 제한된 레퍼토리가 완전히 APC의 불 균질 인구 표면 요점을 되풀이하지 않는 것은 사실이지만 그것이 시냅스 형성에 개인 수용체와 리간드 상호 작용의 영향을 결정하기 위해 수사관을 허용한다는 점에서,이 제한은 유리할 수 .
티여기에 그 과정에서 몇 가지 중요한 단계입니다. 가장 중요한 중 리포좀의 산화 단계는 1.10, 2.6, 2.11처럼 끊임없이 튜브 용액에서 산소를 변위 시키 통해 아르곤을 사용하여 방지 될 수있다. 지질의 산화에 따라서 자유롭게 이동 시냅스 구조에 참여하는 표면 단백질의 능력을 방해, 감소 된 지질 이동성을 초래할 것이다. 마찬가지로, 동결 건조한다 (스텝 1.2)에 의해 모든 리포솜 클로로포름을 제거하는 것도 중요하다. 지질 이중층에서 단백질 농도의 결정에있어서, 먼저 클러스터가없는 균질 한 현탁액에 실리콘 비드를 분산시키는 것이 중요하다. 필요한 경우, 비드의 초음파를 적용 할 수있다. 된 커버 청소되는 것을 특징으로하는 SLB 조립에서, 초기 단계 (5.1-5.8)는, 방울 배치하고, 커버 슬립은 매우 중요 부착되어 있습니다. 이들의에서의 실수 (섹션 5의 시작 부분에서)를 통해 실험을 시작하기 필요로 할 수 있습니다. 이 때문에,은사고의 경우에는 시간을 절약하기 위해 필요한 것보다 더 좋은 방법은 더 된 커버를 청소합니다.
이 시스템과 함께 작동 할 때 비 클러스터링은 가장 흔한 문제입니다. 최종 단계에서 세포를 시각화하는 경우, 어느 하나의 형광을 시냅스 찾는데 실패하는 경우, 취할 수있는 몇 가지 단계가있다. 세포가 시냅스 관여하는 표면 단백질이 해야하는, 유리 커버 슬립 또는 이중층 표면에 비특이적으로 부착 할 수 있지만 동족 세포 표면 수용체에 대한 또 다른 얼룩은, 셀이 이중층으로 시냅스 형성되지 않았 음을 확인하기 위해 상기 챔버에 첨가 될 수있다 맞물려 있지 않은 표면 단백질이 세포의 둘레와 같은 확산 염색 나타나야하는 반면, 셀 이중층 인터페이스의 평면에서와 같은 별개의 클러스터를 표시. 이 방법이 실패 할 경우, 하나는 특정 마커 하나가 세포 표면에 적절한 풍부하게 표현 공부하기를 희망하고있다 있도록 유동 세포 계측법을 통해 자신의 세포를 확인해야합니다. 특정 표면 보호 자전거인은 생체 내 문화에 장기적으로 하향 조절되는 것으로 알려져있다.
이 프로토콜 세부 사항이 구체적으로 어떻게 NK 세포의 시냅스 형성을 시각화하는 동안, SLB 시스템은 단순히 단계 5.11의 기본 리간드의 치환 상상할 수있는 모든 면역 세포에서 시냅스 형성을 연구하는 데 사용할 수 있습니다. 다수의 리간드는 또한 동시에 첨가 될 수있다. 하나는 이중층 내 표면 접착 단백질을 스트렙 타비 딘 - 비오틴 시스템을 사용할 필요가 없다. 니켈 - NTA : 히스티딘의 상호 작용도 가능한입니다. 그러나, 스트렙 타비 딘의 높은 강도와 특이성 : 비오틴 상호 작용, 우리 연구소는이 시스템을 선호한다. 하나는 단계 513에서 소정의 밀도에서 이중층 상 추가 셀의 농도뿐만 아니라 성숙의 다른 단계에서 시냅스를 관찰하기 위해 후속하는 배양 기간만큼 다를 수있다. 물론 이것은 STR 세포를 시각화 가능성을 배제하더라도 이것은 심지어 라이브 할 수uctures (그들은 이미 융합 형광 태그로 표시하지 않는 한, 우리의 실험실은 몇 이러한 변형 된 세포주를 사용한다). 때문에이 프로토콜에서 가능한 사용자 정의의 높은 수준에, 하나는 기본 지질 역학 (15), 시냅스 형성을 포함, 면역학, 세포 생물학, 생화학 질문에 믿을 수 없을만큼 다양한 범위를 해결하기 위해, STED 영상과 함께, 기본 SLB 기술을 사용할 수 있습니다 16, 17, 세포 내 신호 전달 및 종양 세포의 전이 (18).
공개
The authors have nothing to disclose.
감사의 말
We thank Emily Mace and Malini Mukherjee for imaging and deconvolution analysis. Work in the Liu laboratory was supported in part by the Baylor-UTHouston Center for AIDS Research Core Support Grant number AI36211 from the National Institute of Allergy and Infectious Diseases, the Caroline Wiess Law Fund for Research in Molecular Medicine, Texas Children’s Hospital Pediatric Pilot Research Fund, and the Lymphoma SPORE Developmental Research Program from Baylor College of Medicine and the Methodist Research Institute.
자료
| Name | Company | Catalog Number | Comments |
| 18:1 (Δ9-Cis) PC (DOPC) 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti | 850375C | Liposome preparation |
| 18:1 Biotinyl Cap PE 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl) (sodium salt) | Avanti | 870273C | Liposome preparation |
| Argon gas, compressed | Airgas | UN1006 | Liposome preparation |
| A lyophilizer | Labconco | Freezone 7740020 | Liposome preparation |
| Lyophilizer tubes | Labconco | 7540200 | Liposome preparation |
| Chromatography Columns | Santa Cruz | sc-205558 | Liposome preparation |
| 1 M Tris pH 8.0 | Ambion | AM9856 | Liposome preparation |
| 5 M NaCl | Ambion | AM9759 | Liposome preparation |
| Octyl-β-D-glucopyranoside | Sigma-Aldrich | O1008 | Liposome preparation |
| Dialysis tubing | Spectrum Labs | 132676 | Liposome preparation |
| 96-well V-bottom polystyrene plate (untreated) | Corning | 3896 | antibody density determination |
| Non-functionalized silica beads | Bangs Laboratories | SS06N | antibody density determination |
| FACS tubes | Fisher Scientific | 14-959-2A | antibody density determination |
| QuantumTM MESF beads | Bangs Laboratories | Variable | antibody density determination |
| Casein | Sigma-Aldrich | C0875 | Lipid bilayer preparation |
| HEPES buffered saline + 1% HSA | Homemade | Lipid bilayer preparation | |
| Streptavidin | Life technologies | 434301 | Lipid bilayer preparation |
| Fluorescently-labeled biotinylated protein | Homemade | Lipid bilayer preparation | |
| ibidi Sticky-Slide VI 0.4 | ibidi | 80608 | Lipid bilayer preparation |
| 25x75 mm glass coverslip | ibidi | 10812 | Lipid bilayer preparation |
| Hydrogen peroxide (30%) | Fisher Scientic | BP2633 | Lipid bilayer preparation |
| Sulfuric acid | Sigma-Aldrich | 258105 | Lipid bilayer preparation |
| D-Biotin | Invitrogen | B20656 | Lipid bilayer preparation |
| Lens paper | VWR | 54826-001 | For imaging |
| Type F Immersion Oil | Leica | 11 513 859 | For imaging |
| A Leica TCS STED microscope | Leica | For imaging |
참고문헌
- Dustin, M. L., Long, E. O. Cytotoxic immunological synapses. Immunol. Rev. 235 (1), 24-34 (2010).
- Monks, C. R., Freiberg, B. A. K. u. p. f. e. r. H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Hafeman, D. G., von Tscharner, V., McConnell, H. M. Specific antibody-dependent interactions between macrophages and lipid haptens in planar lipid monolayers. Proc Natl Acad Sci USA. 78 (7), 4552-4556 (1981).
- Tscharner, V., McConnell, H. M. Physical properties of lipid monolayers on alkylated planar glass surfaces. Biophys J. 36 (2), 421-427 (1981).
- Crites, T. J., Chen, L., Varma, R. A TIRF microscopy technique for real-time, simultaneous imaging of the TCR and its associated signaling proteins. J. Vis. Exp. , (2012).
- Prins, K. C., Vasiliver-Shamis, G., Cammer, M., Depoil, D., Dustin, M. L., Hioe, C. E. Imaging of HIV-1 envelope-induced virological synapse and signaling on synthetic lipid bilayers. J. Vis. Exp. , (2012).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. , (2008).
- Michalet, X., Weiss, S. Using photon statistics to boost microscopy resolution. Proc. Natl. Acad. Sci. U. S. A. 103 (13), 4797-4798 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu. Rev. Biochem. 78, 993-1016 (2009).
- Lippincott-Schwartz, J., Manley, S. Putting super-resolution fluorescence microscopy to work. Nat. Methods. 6 (1), 21-23 (2009).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J. Vis. Exp. , (2014).
- Rak, G. D., Mace, E. M., Banerjee, P. P., Svitkina, T., Orange, J. S. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Leutenegger, M., Ringemann, C., Lasser, T., Hell, S. W., Eggeling, C. Fluorescence correlation spectroscopy with a total internal reflection fluorescence STED microscope (TIRF-STED-FCS). Opt Express. 20 (5), 5243-5263 (2012).
- Liu, D., Bryceson, Y. T., Meckel, T., Vasiliver-Shamis, G., Dustin, M. L., Long, E. O. Integrin-dependent organization and bidirectional vesicular traffic at cytotoxic immune synapses. Immunity. 31 (1), 99-109 (2009).
- Liu, D., Peterson, M. E., Long, E. O. The adaptor protein Crk controls activation and inhibition of natural killer cells. Immunity. 36 (4), 600-611 (2012).
- Wu, J. C., et al. Antibody conjugated supported lipid bilayer for capturing and purification of viable tumor cells in blood for subsequent cell culture. Biomaterials. 34 (21), 5191-5199 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유