Method Article
يعاير بالسكان خلية الدم لل
In This Article
Summary
Drosophila blood cells, or hemocytes, cycle between resident sites and circulation. In the larva, resident (sessile) hemocytes localize to inductive microenvironments, the Hematopoietic Pockets, while circulating hemocytes move freely in the hemolymph. The goal of this protocol is the standardized isolation and quantification of these two, behaviorally distinct but interchanging, hemocyte populations.
Abstract
في الفقاريات، وينظم تكون الدم عن طريق microenvironments الاستقرائي (منافذ). وبالمثل، في نموذج اللافقاريات كائن ذبابة الفاكهة السوداء البطن، وقد تم تحديد microenvironments الاستقرائي المعروفة باسم جيوب المكونة للدم اليرقات (هبس) كمواقع التشريحية لتطوير وتنظيم خلايا الدم (hemocytes)، ولا سيما من سلالة بلعم تجديد الذات. هبس هي كرر segmentally جيوب بين البشرة وطبقات العضلات اليرقة، التي تضم أيضا الخلايا العصبية الحسية في الجهاز العصبي المحيطي. في اليرقة، يتعرضون المقيمين (لاطئة) hemocytes لمكافحة أفكارك لاصقة والعظة التكاثري من هذه الخلايا العصبية الحسية وعناصر محتملة أخرى للهبس، مثل العضلات وطبقات البطانة الظهارية. خلال التطور الطبيعي، الإفراج التدريجي عن hemocytes المقيمين من الوقود هبس سكان hemocytes المتداولة، الذي يبلغ ذروته في الإفراج عن موالحادي من hemocytes المقيمين في بداية التحول. الاعتداءات المناعة والإصابة البدنية أو اضطراب الميكانيكية تؤدي الى الافراز السابق لأوانه hemocytes المقيمين في التداول. التحول من hemocytes اليرقات بين المواقع المقيمين والدورة الدموية يزيد من الحاجة إلى معيار مشترك / إجراءات لعزل انتقائي وتحديد هذين الشعبين من خلايا الدم من يرقات ذبابة الفاكهة واحدة. وفقا لذلك، ويصف هذا البروتوكول وسيلة الآلي لاطلاق سراح وتحديد المقيمين وhemocytes تعميم من اليرقات واحدة. طريقة يسهل النهج خارج الحي، ويمكن تكييفه لخدمة مجموعة متنوعة من مراحل تطور ذبابة الفاكهة والكائنات اللافقارية الأخرى.
Introduction
وقد أدى البحث في نموذج اللافقاريات ذبابة الفاكهة السوداء البطن اكتشاف المناعة الفطرية 1، وسهلت فهم مختلف جوانب التنمية خلايا الدم ويمكن تقسيم 2-4. تكون الدم ذبابة الفاكهة في نسب hemocytes الجنينية / اليرقات، التي تنشأ في الجنين والتوسع في يرقة، وسلالته من الغدة الليمفاوية hemocytes 4،5. هنا، نقدم البروتوكول الذي يركز على نسب hemocytes الجنينية / اليرقات، التي تضم في يرقة ذبابة الفاكهة بشكل رئيسي plasmatocytes (الضامة) وخلايا الكريستال القليلة 4. في اليرقة، hemocytes الجنين لا تزال قائمة واستعمار المتكررة segmentally ومحطة جيوب المكونة للدم (هبس) الواقعة بين البشرة وطبقات العضلات من جدار الجسم اليرقات 5،6. بناء على طبيعتها كما الضامة تجديد الذات 6 إقامتهم السائدة في microenvironments الأنسجة المحلية 6و 7 و نسبهم من أقرب خلايا الدم الناشئة خلال التنمية 6،8، وتعتبر هذه الفئة من السكان خلايا الدم مماثلة لأنسجة الضامة الفقارية تجديد الذات، وهي النسب التي تم تحديدها مؤخرا النخاعي مستقل في مجموعة متنوعة من الأنواع 4،9،10. ومع ذلك، في ذبابة الفاكهة، بعض أو كل هذه الخلايا المقيمة تظهر أيضا مرونة لتؤدي إلى أنواع خلايا الدم الأخرى مثل خلايا الكريستال 11،12.
hemocytes اليرقات هي في الغالب المقيمين (اطئة)، ولكن في حالة ثابتة دينامية بين مختلف هبس. يتم اطلاق سراحهم تدريجيا في التداول، ولا سيما مع اقتراب 3 يرقة طور مرحلي الثالثة pupariation 5-7. التحديات المناعة أو الإصابة أو الميكانيكية الرصاص اضطراب سابق لأوانه، في الحالة الأخيرة عكسها، وتعبئة hemocytes المقيمين في الدملمف 4،6،13.
واشارت دراسات سابقة أن المقيمين وتداولهاhemocytes اليرقات هي من نفس النسب، ولكنها تختلف في لاصق أو صاروخ موجه ممتلكاتهم 6،7،13،14. العزلة انتقائية تعميم مقابل hemocytes المقيمين كشفت مستويات مرتفعة من انتشار بين السكان كرية دموية المقيمين، مما يشير إلى تعرضهم للمنبهات الاستقرائي من هبس اليرقات هبس 6. ذبابة الفاكهة تصطف من قبل البشرة وطبقات العضلات وزيادة تأوي مجموعات الخلايا العصبية الحسية من الجهاز العصبي المحيطي (السندات الإذنية) وظيفة الكبد تشبه oenocytes 6. وظيفيا، وقد أثبتت التجارب الاجتثاث خلية متحولة وراثية أن الخلايا العصبية الحسية الموجودة في هبس تدعم بقاء الغذائي وتوطين hemocytes اليرقات 6.
نحن هنا تصف طريقة لعزل محددة وتقدير من المقيمين وتعميم hemocytes من يرقات ذبابة الفاكهة واحدة، وبروتوكول للتعبئة كرية دموية الميكانيكية. أساليب يمكن استخدامها لخارج الجسم الحيدراسة hemocytes ويمكن أيضا أن تتكيف مع مراحل تطور ذبابة الفاكهة الأخرى مثل خادرة والكبار، وأنظمة اللافقارية الأخرى. منذ دراسات سابقة لم تفرق بين المقيمين وhemocytes المتداولة، ويوفر هذا البروتوكول معيارا مشتركا لدراسة خلايا الدم المقيمين وسوف تساعد على زيادة الاتساق في أبحاث الخلايا الدموية اللافقاريات.
أولا، يصف كرية دموية التسييل / كشط الفحص العزلة الفرق النوعي والكمي الآلي من الفلورسنت المقيمين بعلامات البروتين وتعميم السكان كرية دموية من يرقات ذبابة الفاكهة واحدة؛ وينص البروتوكول خيارين لالمجاهر العادية والبلاط مجهزة المسح الضوئي (الشكل 1). ونتيجة لذلك، يتم الحصول على نسبة من hemocytes المتداولة وعدد من hemocytes في يرقة. ويعتمد هذا الأسلوب على يرقات ذبابة الفاكهة المعدلة وراثيا التي تعبر عن بروتين فلوري بين خلايا دمهمعدد السكان. اختيار السائق كرية دموية أو مراسل يحدد النتيجة، أي التي تصور السكان من خلايا الدم وكميا. لتسمية أساسا الضامة (plasmatocytes)، والتي تتكون من الغالبية العظمى من المقيمين وتعميم السكان كرية دموية لليرقة ذبابة الفاكهة 6، وتشمل الجينات المحورة مناسبة HML Δ-DsRed 6، HmlΔ -GAL4 15، PXN -GAL4 16، CRQ-GAL4 (من قبل H. Agaisse 16)، أو آكلى لحوم البشر-GAL4 17؛ لوصفها السكان قليل نسبيا من الخلايا وضوح الشمس، وخطوط مناسبة هي BcF6-CFP و-GFP 18، أو LZ-GAL4 (من قبل J. بولوك 19)؛ لlamellocytes وضع العلامات، ونوع من الخلايا المتخصصة التي يسببها أساسا من التحديات وإصابة 13 المناعية، على سبيل المثال، MSNF9mo-mCherry يمكن استخدامها 17. يتم التعبير عن بعض السائقين المعدلة وراثيا في مجموعة واسعة من الدم متباينةالخلايا والأسلاف، مثل و- GAL4 20، التي تصف حوالي 80٪ من مجموع خلايا الدم اليرقات 20. يرجى ملاحظة أنه في جميع الحالات التي تستخدم فيها السائقين GAL4، مطلوب بالاشتراك مع UAS-GFP أو آخر البروتين الفلوري UAS-التحوير. في قسم النتائج، ويستخدم هذا الأسلوب لمراقبة عدد خلايا الدم وسلوك التداول على مدى نمو اليرقات.
ثانيا، يصف كرية دموية اضطراب الفحص خطوة السابقة تهدف إلى فصل hemocytes المقيمين عن طريق التلاعب الخارجي، والذي يسمح لاحقا تقييم قدرة hemocytes لإعادة تلتزم وموطن هبس ضمن إطار زمني محدود (30-60 دقيقة) 6. وعادة ما يتبع هذا الاختبار من قبل التسييل / كشط الفحص لتحديد نسبة تعميم hemocytes في يرقة. نقدم بروتوكول مبسط لهذا الاختبار (الشكل 1D)، والذي يستخدم اضطراب من قبل vortexing الطرافةحبات ح الزجاج، وبدلا من التلاعب يرقة واحدة مع فرشاة الطلاء كما هو موضح سابقا 6. في قسم النتائج، ويستخدم هذا الاختبار لإثبات أن تطفو hemocytes فصل عابر في الدملمف ويمكن استردادها في جزء من تعميم hemocytes. الفحص مفيد أيضا لتحديد الاختلافات في hemocytes في هم صاروخ موجه / التصاق إلى مواقع المقيمين، مقارنة على سبيل المثال، العديد من خلفيات وراثية أو شروط التحفيز. يرجى ملاحظة أن هذا التلاعب الميكانيكية يعكس عملية عكسها ويختلف عن infection- أو الناجم عن الإصابة تعبئة كرية دموية المقيمين، التي عادة ما تكون ليس عكسها في فترة زمنية قصيرة 4،13.
Protocol
1. كرية دموية التسييل / كشط الفحص
- إعداد الشرائح:
- الخيار 1 لالمجاهر بدون وظيفة مسح البلاط: للحصول على كل يرقة لتحليلها، وإعداد واحد شريحة زجاجية مع حوالي 5 آبار عنق الرحم من ركلة جزاء 2 مم الساحات لكل منهما، المقابلة لمنطقة المشاهدة مجال المجهر. إضافة حوالي 5-10 ميكرولتر من وسائل الإعلام S2 لكل (الشكل 1A). تبقي الشرائح في غرفة رطبة لمنع الآبار من الجفاف.
- الخيار 2 لالمجاهر مع وظيفة المسح الضوئي البلاط: للحصول على كل يرقة لتحليلها، وإعداد واحد شريحة زجاجية مع 3-4 الآبار عنق الرحم من ركلة جزاء ل~ 3-4 ملم الساحات لكل منهما؛ إضافة حوالي 15-20 ميكرولتر من S2 وسائل الإعلام إلى كل بئر (الشكل 1B). تبقي الشرائح في غرفة رطبة لمنع الآبار من الجفاف.
ملاحظة: الرقم أعلاه الموصى بها من الآبار غير كافية لمجاميع تصل إلى 3000 hemocytes في يرقة (أواخر 2 الثانية الطور اليرقات، ~ 2،5-3 ملم طول، التحوير وصفها غالبية larvآل خلايا الدم). عند تقييم أرقام خلايا الدم أكبر، قد تكون هناك حاجة إلى مزيد من الآبار لتجنب الإفراط في الزحام.
- جمع اليرقات:
- بخ الماء إلى قارورة تحتوي على ذبابة اليرقات واليرقات دافق في طبق بيتري، أو مغرفة بعض المواد الغذائية التي تحتوي على اليرقات في طبق بتري وتمييع مع الماء باستخدام زجاجة بخ.
- اختيار بلطف اليرقات من طبق بيتري باستخدام الفرشاة ووضعها في الماء في طبق تجويف أو على شريحة على كتلة الباردة.
ملاحظة: يرقات يمكن الاحتفاظ به لفترة زمنية محدودة في الماء أو على كتلة الباردة. استخدام العينات في غضون 45 دقيقة أو أقل لتجنب موت اليرقات أو تأثيرات غير مرغوب فيها على hemocytes.
- تشريح:
- حدد اليرقات تحت المجهر مضان على كتلة المعدن البارد. قياس الأحجام وصورة يرقات إذا رغبت في ذلك.
- عزل تعميم hemocytes ("ينزف"):
- مرة واحدة ويتم اختيار اليرقات، ووضع يرقة واحدة في أول مسحة من ركلة جزاء أيضا (الشكل 1C،2A).
- استخدام الإبر النظيفة أو 2 تشريح مقص وملقط لإجراء شق في كلا طرفي الخلفي والأمامي من اليرقة. لتجنب إزعاج hemocytes المقيمين، فمن الأفضل أن تجعل من هذه الشقوق على الجانب البطني من اليرقة. لنتائج متسقة، وجعل شقوق في نفس المواقع عن كل يرقة. ل1 شارع الطور اليرقات، 1 شق (في الجزء الأمامي بطني) كافية.
- السماح يرقة ينزف لبضع ثوان من دون أي ضغط أو التحريض البدني (الشكل 2A).
ملاحظة: إذا كنت تعمل على يرقات متعددة فمن الأفضل أن تجعل من هذه الشقوق لكل واحد قبل الانتقال إلى الخطوة التالية لتجنب الاحتفاظ اليرقات على الجليد وقتا طويلا مما قد يؤثر على سلامة العينات. - رفع بلطف اليرقة مع الإبر أو ملقط وتراجع ذلك في البئر الثاني لشطف أي المتبقية hemocytes المتداولة. بعد ذلك، اتبع مع الافراج عن hemocytes المقيمين.
عزل hemocytes المقيمين ("كشط"): - بلطف نقل اليرقة إلى البئر المقبل (الشكل 2C).
- تحديد الغدة الليمفاوية لليرقة، والذي يقع عادة حوالي 1/3 من النهاية الأمامية لليرقة، والذي قد يتألق ظهريا من خلال جدار الجسم اليرقات. تجنب الغدة الليمفاوية في حين الإفراج عن hemocytes المقيمة التي تعلق أسفل اليرقة مع إبرة في أقرب وقت ممكن إلى الغدة الليمفاوية لتجنب ثقب (الشكل 2C).
ملاحظة: خلال التطور الطبيعي تأخر نضوج الليمفاوية hemocytes الغدة مقارنة hemocytes اليرقات، وصحفيين فلوري من hemocytes متباينة قد لا تظهر إشارة في الغدة الليمفاوية من اليرقات الصغيرة. في هذه الحالات، يحتاج إلى عناية أقل لدفعها إلى الغدة الليمفاوية كما لا تلوث متباينة hemocytes اليرقات fluorescently المسمى من قبل hemocytes الغدة الليمفاوية من المتوقع. - الإفراج عن خلايا الدم المقيمين في dissectiفي عملية كشط و / أو لكز. استخدام التطريز واحد يعلقون على نحو فعال أسفل اليرقة بالقرب من الغدة الليمفاوية (انظر أعلاه) أو مناطق أخرى من الجسم حسب الحاجة. استخدام إبرة أخرى لضربة بالكوع في مجموعات من hemocytes التي هي واضحة من خلال جدار الجسم اليرقات (الشكل 2C، E)، والتي تهدف إلى فصل hemocytes. Hemocytes يمكن أيضا أن يطلق سراحه في حركة تجريف. ومع ذلك، وتمزيق للبشرة في وقت مبكر قد تفرج عن مجموعات كبيرة من خلايا الدم، التي يمكن أن تجعل العد الآلي أكثر تحديا.
ملاحظة: اعتمادا على العمر وراثى لليرقة، فإن العدد الإجمالي للhemocytes تختلف. توزيع عملية الإفراج المذكورة أعلاه على مدى عدة آبار لتجنب الاكتظاظ في بعض الآبار مع خلايا الدم، التي يمكن أن تجعل واحد تحليل صورة الخلية أكثر صعوبة. - إذا لا تزال قليلة hemocytes في الذبيحة النهائية، عد هذه hemocytes عن طريق الملاحظة من خلال المجهر واستخدام رصيده عداد اليدوية (الشكل 2E). لتسهيل الفرز، صالدانتيل الذبيحة على منطقة نظيفة من نفس الشريحة ونشرها كما رقيقة ممكن لتقليل عدد الطائرات البصرية.
- وبمجرد أن تشريح كاملة، الانتظار بين 5-10 دقيقة للخلايا ليستقر (ولكن لا تلتزم بالضرورة) قبل التصوير الآبار. احتضان شريحة في غرفة رطبة لتجنب جفاف، وتجنب التعامل معها بخشونة من الشرائح، والتي يمكن أن تعكر صفو hemocytes تسويتها.
ملاحظة: عند تحديد التهم كرية دموية، وخلايا سراح ليست ثابتة والخلايا يجب تصويرها بعد وقت قصير من التشريح، ويفضل أن يكون ذلك في غضون 30 دقيقة بعد الإفراج عن اليرقة. اعتمادا على حجم العقارات المتوسطة والخلية، فإن الغالبية العظمى من الخلايا قد استقروا داخل 5-10 دقائق، والتي ينبغي أن يتم تأكيد ذلك بالتركيز من خلال طائرات البصرية من المتوسط في البئر. ومع ذلك، سوى جزء صغير من خلايا الدم انضمت إلى سطح الشريحة قبل هذا الوقت، وهذه حقيقة تحتاج إلى النظر فيها إذا تعديل هذا البروتوكول لapproache أساس تثبيت الخليةالصورة.
- الكمي:
- التقاط صور لhemocytes استقر تحت المجهر فلوري (الشكل 2B، D، F). اتبع مع الكمي للhemocytes باستخدام برنامج يماغيج.
- إعداد الصورة ليماغيج خوارزمية الفرز الخلية:
- صورة المفتوحة جيدا باستخدام يماغيج: ملف → → المفتوحة (تحديد موقع الملف وحدد).
- تأكد من أن صورة (ق) هو 8 بت أو 16 بت. ضبط عتبة للصورة عن طريق اختيار صورة ثم انقر فوق ضبط وحدد عتبة. مراقبة "نافذة عتبة" (الشكل 3A).
- التحقق من "الخلفية الداكنة" الخيار. حدد "الأحمر" وزيادة مستوى عتبة أدنى (انظر السهم الأسود) حتى يتم وضع علامة كل خلية في الصورة مع نقطة حمراء (الخلايا التي لم يتم تغطيتها سيتبين في الرمادي؛ الشكل 3B). كما عتبة أدنىيتم زيادة بعض الخلايا سيصبح غير المراقب. هذا يمكن أن يكون مؤشرا لمدى لضبط عتبة أدنى.
ملاحظة: أحيانا مجموعات من الخلايا لا يمكن حلها وسوف تحسب واحدا تلو العداد الجسيمات. في مثل هذه الحالات، وعدد الخلايا في كتلة يمكن تقدير عن طريق فحص صورة (تكبير إذا لزم الأمر) والعد والفرز اليدوي باستخدام عداد رصيده. بدلا من ذلك، عتبة أدنى يمكن زيادة لحل مجموعات من الخلايا. أي خلايا غير مميزة الناتجة عن هذا التلاعب ويمكن بعد ذلك أن تحسب باستخدام عداد رصيده.
- تحليل عدد الخلايا باستخدام يماغيج:
- إطلاق محلل الجسيمات إلى عدد الخلايا (الشكل 3C). حدد تحليل وانقر على تحليل الجسيمات. اختياريا تحديد "تراكب الخطوط العريضة" لرؤية الجزيئات العد خوارزمية (الشكل 3D). بدلا من ذلك، وضع حد لحجم أو بكسل مجال وحدة (على سبيل المثال.، الخلية، كتلة من الخلايا، وما إلى ذلك) لخوارزمية لحساب.
- انقر فوق موافق. مراقبة نافذة ملخص مع عدد (الشكل 3E).
2. كرية دموية اضطراب الفحص
- لزعزعة hemocytes، حدد اليرقات ووضعها في أنبوب microcentrifuge 2 مل مع ما يقرب من 0.5 غرام من الخرز الزجاجي (212-600 ميكرون)، وإضافة 0.5 مل من الماء.
- دوامة الأنبوب، من جهة، وبسرعة 10 لمدة 1 دقيقة.
- استرداد اليرقات من الخرز الزجاجي عن طريق إراقة محتويات أنبوب microcentrifuge في طبق بتري وفتنتقي اليرقات مع الفرشاة.
- لمرحلة الإنعاش، ووضع اليرقات في أطباق بتري معدة مسبقا مع كميات صغيرة من الطعام ذبابة. السماح لليرقات لإعادة تأسيس نمط كرية دموية لمدة تتراوح من 45 دقيقة أو كما تريد.
ملاحظة: تخلصي من أي اليرقات التي توقفت عن الحركة، كما أنهم لقوا حتفهم في هذه العملية. ومع ذلك، فإننا نرى عادة لالضرر إيتل بعد 1 دقيقة من vortexing ل(انظر أدناه والتكميلي الشكل 1). - بعد فترة النقاهة، مع الاستمرار في التسييل / كشط الفحص كما هو موضح أعلاه في القسم 1.
النتائج
لتوضيح نتائج نموذجية من أساليب وصفها، وأول من استخدم كرية دموية التسييل / كشط الفحص لتحديد تطور أعداد كرية دموية اليرقات وإقامتهم على مدى نمو اليرقات (الشكل 4). تم عزل المقيمين وتعميم السكان كرية دموية اليرقات من اليرقات واحدة (HML Δ-GAL4، UAS-GFP، و-GAL4 لتسمية الغالبية العظمى من hemocytes اليرقات) وكميا باستخدام يماغيج. أفواج من اليرقات الحجم 1.2 ملم (~ 48 AEL ساعة أو 1 شارع الطور)، و 2.5 ملم (~ 80 ساعة AEL أو في وقت متأخر 2 الثانية الطور)، و 3.5 مم تم فحص (~ 96 ساعة AEL أو 3 طور مرحلي الثالثة) (الشكل 4) . أرقام كرية دموية توسعت على مدى نمو اليرقات، ربط مع وتجاوز التقديرات السابقة على أساس المجهر الضوئي من صبغ الملون اليرقات 7 والعد حية من البروتين المسمى hemocytes الفلورسنت من خلال بشرة اليرقات 6. في 1 شارع الإضافيةوكانت القطران اليرقات كل hemocytes تقريبا المقيمين، في حين أن جزء من hemocytes المتداولة زادت تدريجيا على مدى نمو اليرقات (الشكل 4B، C)، بما يتفق مع المنشورات السابقة 6،7.
التالي درسنا ما إذا كان أسلوب يرصد بأمانة الانتقال من hemocytes بين السكان المقيمين والمنتشرة. الاستفادة من هذه الظاهرة التي hemocytes المقيمة يمكن فصل عابر من قبل اضطراب الميكانيكية وأعادوا الانضمام إلى مواقع المقيمين بها بشكل عفوي 6، فإننا تشتت hemocytes مقيمة من قبل vortexing مع الخرز الزجاجي كما هو موضح في كرية دموية اضطراب الفحص. في الواقع، أدى اضطراب الميكانيكية اليرقات إلى زيادة هائلة في عدد السكان تعميم hemocytes على حساب hemocytes المقيمين (الشكل 5). بعد فترة نقاهة من 45 دقيقة، وكان hemocytes عاد إلى حد كبير إلى حالتها ملتصقة، سواء عن طريق التفتيش البصري والتي كمانسبة sessed الخلايا المتداولة (الشكل 5D، E). كما هو متوقع، إلا أن مجموع أرقام كرية دموية مستقرة على مر الزمن، على الرغم من التحول من hemocytes بين السكان تعميم والمقيمين.
اتخذت عدة اعتبارات إضافية في الاعتبار. للتأكد من أن vortexing للم يسبب تلف الأنسجة كبير، vortexing لمع أنجز الخرز الزجاجي في وجود التريبان الأزرق (سيغما) لفترات زمنية مختلفة (1، 5، 20 دقيقة). لم كلا 1 و 5 دقائق vortexing للا يسبب أي اضطراب النسيج واضحة، في حين أدى 20 دقيقة vortexing لفي مناطق صغيرة من ضرر، تشبه الأضرار الناجمة عن غرز إبرة تستخدم السيطرة الايجابية (التكميلي الشكل 1). بينما الضرر الداخلي البشرة أو الأنسجة الأخرى دون ضرر بشرة لا يمكن استبعاد، يبدو أن هذا السيناريو المحتمل بالأحرى hemocytes من 1 دقيقة والنمط المتوقع والإطار الزمني 5 المعالجة دقيقة اليرقات التقيد إعادة مشيرة الى انه من سلامة اليرقات لا تسويةد (التكميلي الشكل 1). في المقابل، vortexed اليرقات لمدة 20 دقيقة تعاني من نقص في إعادة التصاق، وحتى لا تظهر المرفقات تعميم hemocytes إلى مواقع البشرة الجروح، كما وصفت سابقا 14.
وأخيرا، لإثبات استنساخ الأسلوب، قارنا مكررات البيولوجية من 2.5 ملم اليرقات من اثنين من التجارب السابقة، التي أجريت من قبل المجربون متميزة. كما هو موضح في الشكل 2 التكميلي، وأظهرت كل من الأفواج العدد الإجمالي للمقارنة من hemocytes في يرقة، ونسبة hemocytes المتداولة. أظهر الطالب ر الاختبار عدم وجود فروق ذات دلالة إحصائية، مما يشير إلى أن هذه الطريقة قابلة للتكرار وقابلة للتطبيق على نطاق واسع.
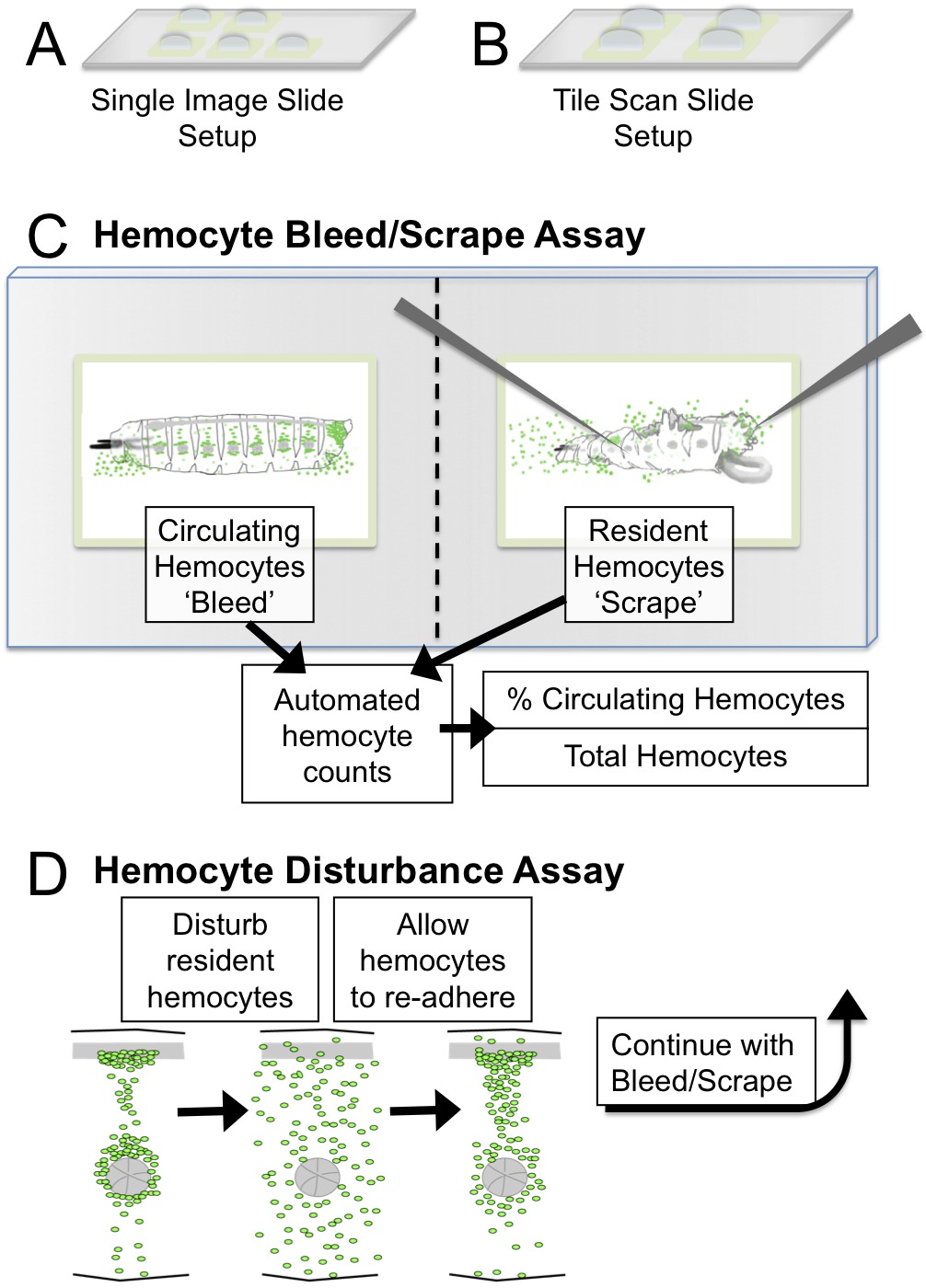
الشكل 1. كرية دموية التسييل / كشط واضطراب الفحص الصورة etup والتخطيطي. (A) صورة واحدة إعداد الشرائح: خمسة مربعات 2mm في التصوير مع هدف 5X (B) بلاط إعداد الشرائح المسح الضوئي: أربعة مربعات 3 مم للتنزف التصوير / الورطات من ≤2.5 مم اليرقات مع مجهر مسح البلاط. أهداف الموصى بها للتصوير هي 5X أو 10X. (C) انزف / كشط الفحص quantifications التخطيطي والناتجة باستخدام يماغيج (D) في اضطراب الفحص، وتعطلت نمط كرية دموية ميكانيكيا قبل vortexing اليرقات مع الخرز الزجاجي. يسمح اليرقات لاسترداد خلال فترة 45 دقيقة خلالها hemocytes إعادة الانضمام إلى جيوب المكونة للدم. خصائص لاصقة من hemocytes يمكن تقييمها بواسطة هذه الطريقة، قياس نسبة hemocytes في التداول بعد الاضطرابات. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
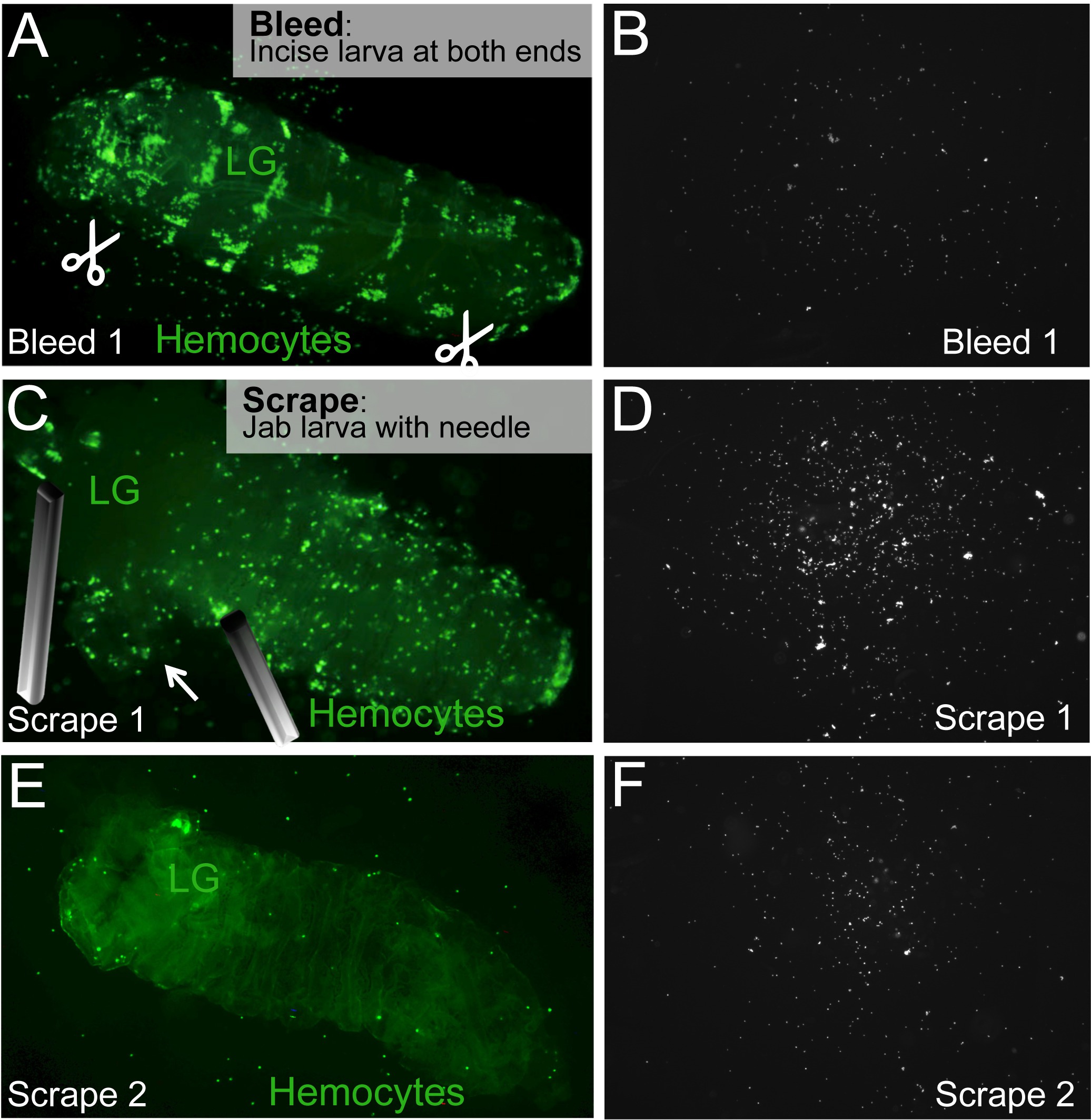
الشكل 2. التسييل / كشط الفحص للافراج عن تعميم وhemocytes المقيمين. (A) لتنزف يرقة، يتم إجراء شقوق بطني في نهايات الخلفي والأمامي لليرقة (مقص الرمز). (B) Hemocytes في التداول سوف تتدفق من شقوق وتستقر على سطح الشريحة. (C) تقع الغدة الليمفاوية (LG) وتمركزها، دون ثقب عليه. يتم الافراج hemocytes المقيم عن طريق لكز و / أو كشط اليرقة بإبرة. hemocytes (D) مقيم على الشريحة. (E، F) يتم تكرار عملية كشط حتى يتم تحرير كافة hemocytes المقيمين. يتم ترك الذبيحة اليرقات التي تحتوي على الغدة الليمفاوية سليمة وراءها. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
س: المحافظة على together.within صفحة = "دائما"> 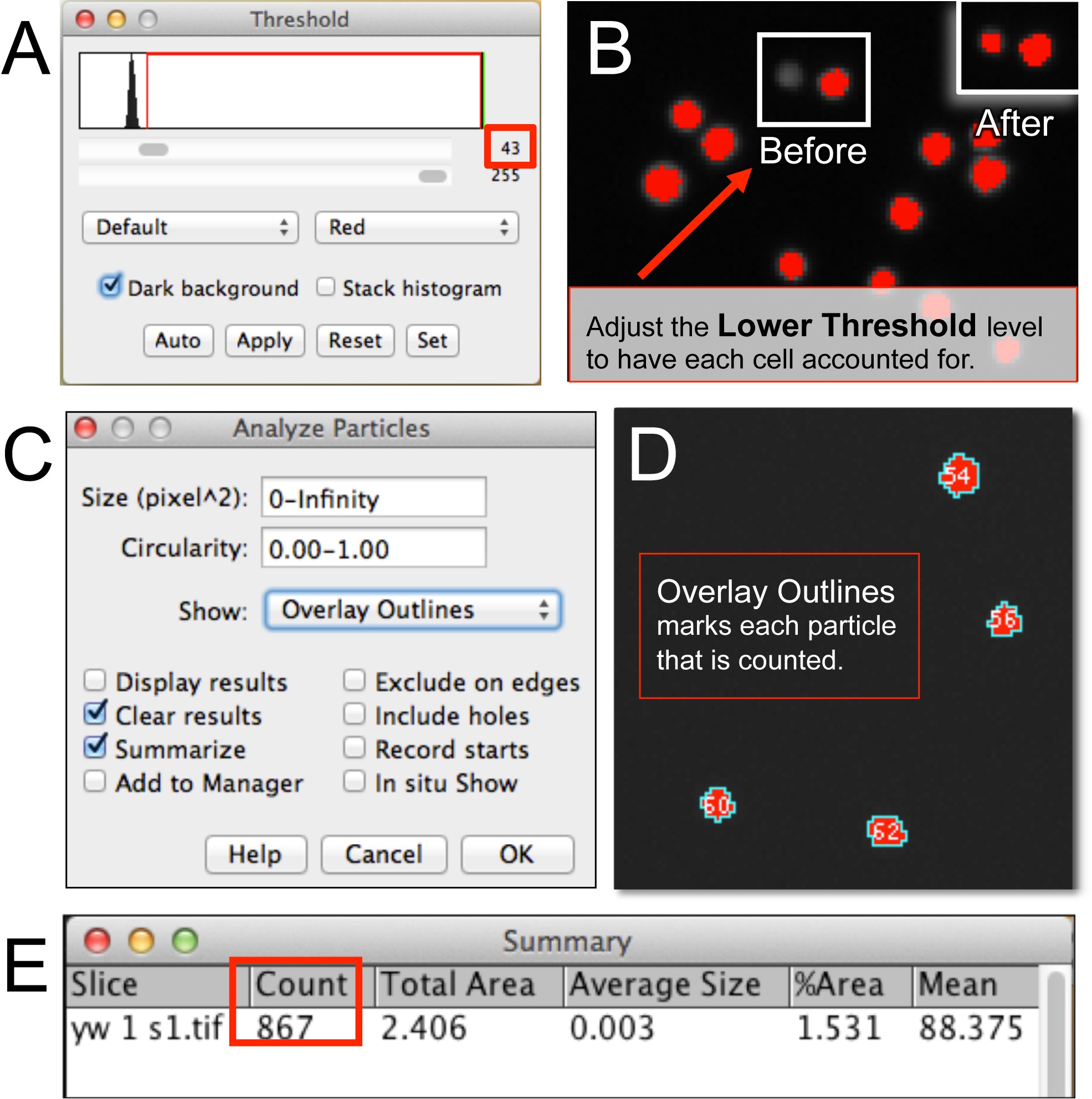
الشكل 3. الآلي الكمي لhemocytes باستخدام يماغيج. (A، B) بعد فتح ملف صورة كرية دموية في يماغيج، يتم ضبط مستوى عتبة أدنى لحصر جميع الخلايا في الصورة. (C، D) تحليل الجزيئات يتطلب تحديد حجم بكسل الخلية، دائرية، ونتيجة قراءات الشكل (على سبيل المثال، تراكب الخطوط العريضة). (E) ملخص نافذة عرض عدد من hemocytes. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الرقم 4. ممثل النتائج (1). عدد كرية دموية والدولة المقيمة على مسار نمو اليرقات. (A) لمحة عامة عن مراحل اليرقات المستخدمة؛ 1 شارع الطور (48 AEL ساعة؛ ~ 1.2 ملم طول)؛ 2 الثانية الطور (80 ساعة AEL؛ 2.5 مم طول)؛ 3 طور مرحلي الثالثة (96 ساعة AEL؛ ~ 3.5 مم طول). النمط الجيني هو HML Δ-GAL4، UAS-GFP. كان-GAL4. وأكد مراحل من خلال تقييم mouthhooks اليرقات. (B) بار الرسم البياني لتعميم وأرقام كرية دموية المقيمين في مراحل اليرقات منها. (C) نسبة تعميم hemocytes. لاحظ أن جزء من hemocytes تعميم يزيد بشكل غير متناسب على مدى نمو اليرقات. (D) مجموع hemocytes، الناتجة عن مجموع تعميم وhemocytes المقيمين في يرقة. وتم قياس كمية Hemocytes باستخدام طريقة التسييل / كشط. ن ≥ 6 يرقة / حالة، تظهر أشرطة الخطأ الانحراف المعياري، والنتائج المؤكدة في 3 تجارب تكرار مستقلة.JPG "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
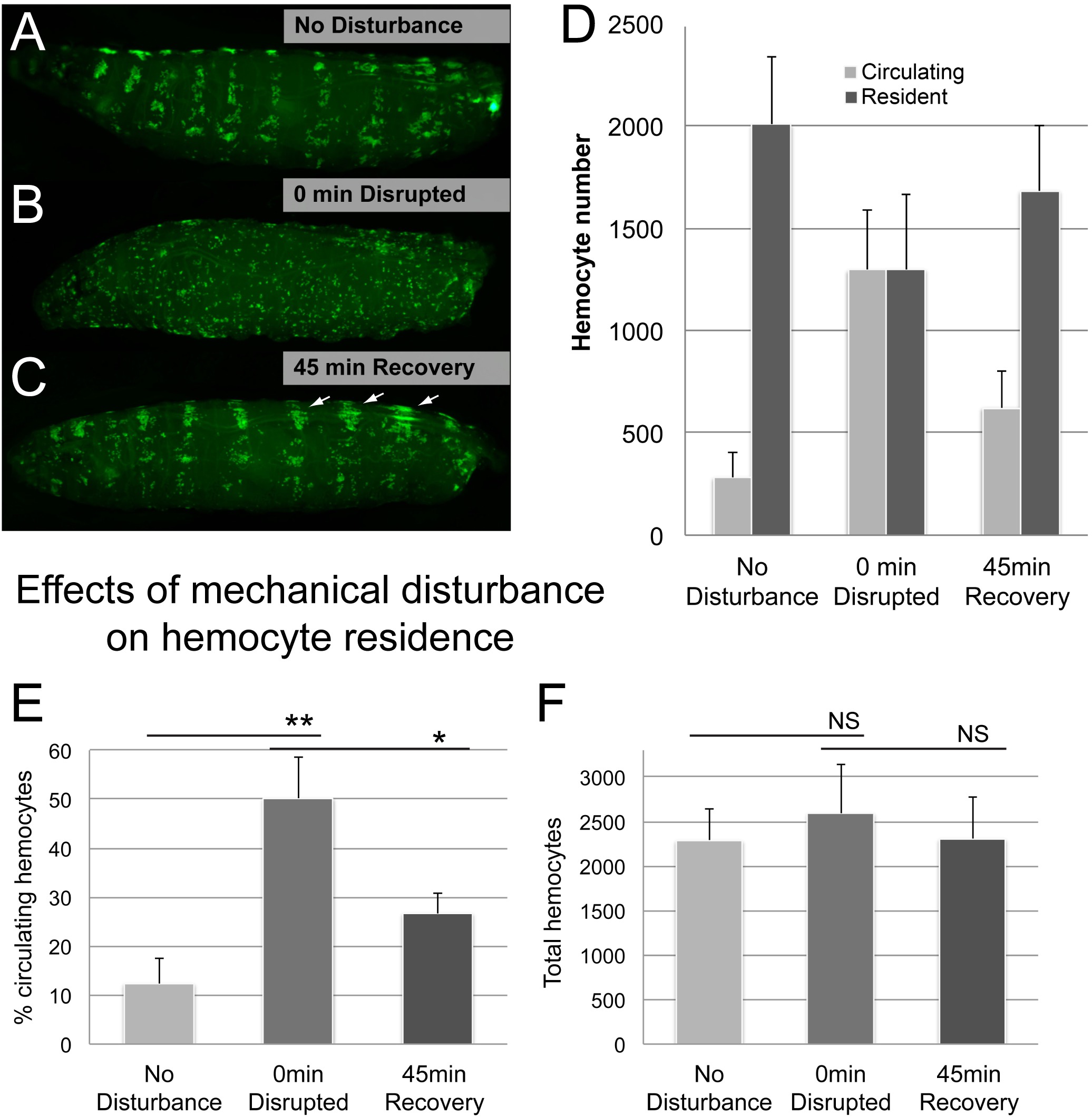
الرقم 5. ممثل النتائج (2). آثار اضطراب الميكانيكي على الإقامة كرية دموية. (AC) مثال على يرقة قبل وبعد vortexing لمع الخرز الزجاجي، تليها الانتعاش 45 دقيقة (A) لا تحكم اضطراب؛ يتم ترجمة hemocytes في جيوب المكونة للدم (B) نمط كرية دموية تعطل في 0 دقيقة بعد vortexing ليرقات في تعليق الخرز الزجاجي والماء (C) نمط كرية دموية في 45 دقيقة من الانتعاش بعد اضطراب؛. وقد نقلت العديد من hemocytes إلى جيوب المكونة للدم. ملاحظة تضخم الأوعية الدموية الظهرية المجموعات المرتبطة بها والمشارب الظهرية التي هي مواقع السائدة في وقت مبكر من تراكم بعد اضطراب (السهام). النمط الجيني هو HML Δ-GAL4، UAS-GFP؛ وقال انه اذا ستشغل-GAL4 س. (D) نسبة تعميم hemocytes كميا من خلال طريقة التسييل / كشط. (E) مجموع hemocytes، الناتجة عن مجموع تعميم وhemocytes المقيمين في يرقة. ن ≥ 4 يرقات / حالة، تظهر أشرطة الخطأ الانحراف المعياري، والنتائج المؤكدة في 3 تجارب تكرار مستقلة. اختبار t الطالب لتأكيد أهمية، NS (غير مهم) **، (P ≤ 0.05)، ** (P ≤ 0.01). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هنا، نحن تصف الطريقة الأولى لاستعادة الكمية خلايا الدم المقيمين وتعميم من يرقات ذبابة الفاكهة واحدة، وتحديد هؤلاء السكان كرية دموية اثنين. ويضم البروتوكول الإفراج متتابعة من تعميم والمقيمين خلايا الدم، تليها التصوير والعد الآلي خلية. hemocytes المقيمين اليرقات يمكن تعبئتها عابر للتداول من قبل اضطراب الميكانيكية، وهي العملية التي من المعروف أن عكس إلى حد كبير في غضون 30-60 دقيقة فترة النقاهة 6. وبناء على ذلك، تم اختبار هذا البروتوكول بطريقتين، (1) عن طريق تقييم عدد كرية دموية الإجمالي لكل يرقة وجزء من تعميم hemocytes على مدى نمو اليرقات، و (2) من خلال طرد تجريبيا hemocytes المقيمين باستخدام أسلوب الآلي، والتي أكدت ارتباط ضيق التوطين كرية دموية وعدد كرية دموية في السكان المقيمين والمنتشرة. بالإضافة إلى ذلك، وقد تجلى استنساخ طريقة التي شاركmparing مجموعتين من البيانات من مكررات البيولوجية.
في الماضي، استخدمت المختبرات مجموعة من التقنيات لقياس hemocytes اليرقات 6،13،21. هذا البروتوكول يحدد معيارا مشتركا لاسترداد وتحديد السكان خلايا الدم المقيمين وتعميم من يرقات ذبابة الفاكهة، وتوفير منصة للتكيف بسهولة. الطريقة الموصوفة أمر بالغ الأهمية للدراسات التي تركز على دور hemocytes المقيمين والمكروية بهم، والمكونة للدم جيوب 4-6، ومناسبة لدراسة ببروتين التي تحمل التحوير سلالات ذبابة الفاكهة في النوع البري والخلفيات المعدلة وراثيا. البروتوكول هو أيضا ذات الصلة للدراسات التي تركز على تعبئة كرية دموية بعد التحدي المناعة أو الإصابة، والإشارات التي يسببها وراثيا أو بيئيا الذي يقوم بتشغيل تعبئة hemocytes المقيمين أو التغيرات في مجموع عدد كرية دموية (إعادة النظر في 4). وتجدر الإشارة إلى أنه في حالات دي سابق لأوانهfferentiation والإفراج عن hemocytes من الغدة الليمفاوية، مع التمييز الجنينية / اليرقات مقابل الأنساب الغدة الليمفاوية قد تكون محدودة بسبب نمط التعبير لمراسل كرية دموية الفلورية المستخدمة.
بروتوكول المعروضة هنا يعتمد على العيش التصوير، hemocytes fluorescently المسمى. في المستقبل، يمكن تعديله للسماح للكشف عن الخلايا أفرج عنه بعد التثبيت، على سبيل المثال، وذلك باستخدام مناعية. في هذه الحالة، قد يحتاج البروتوكول يمكن تكييفها لضمان التصاق كاملة من خلايا الدم، على سبيل المثال عن طريق زيادة مرات التصاق الحضانة، وإضافة طلاء لاصق الشريحة، مثل كونكانافالين A. منذ الأسلوب يسمح استرجاع hemocytes والسابقين التلاعب بها الجسم الحي، وسوف تستفيد مجموعة واسعة من الدراسات البيولوجية والبيوكيميائية التنموية، الخلية. تم العثور على خلايا المقيمين وتعميم الدم أثناء جميع مراحل تال للمرحلة الجنينية التنموية من ذبابة الفاكهة وغيرها من اللافقاريات 22، suggestiنانوغرام أن تكيف هذه الطريقة سوف تستفيد مجموعة واسعة من الدراسات ما بعد نظام المكونة للدم اليرقات ذبابة الفاكهة.
Disclosures
The authors have nothing to disclose.
Acknowledgements
نشكر يسبر Kronhamn ودان Hultmark، مايكل Galko، ومركز بلومنغتون المالية للأسهم الطاير. شكر خاص إلى كورتني اونوديرا للحصول على المشورة مع التحليل الإحصائي. نشكر كاترينا الذهب لقراءة نقدية للمخطوطة، وكالبانا ماخيجاني، كاترينا الذهب، وأعضاء المختبر Derynck، وأعضاء المختبر Nystul للمناقشة والتعليقات على المخطوطة. وأيد هذا العمل من المنح المقدمة من برنامج UCSF للبحوث الطبية الحيوية اختراق (PBBR)، مركز اسع، مؤسسة هيلمان، جمعية السرطان الأمريكية RSG DDC-122595، جمعية القلب الأمريكية 13BGIA13730001، المؤسسة الوطنية للعلوم 1326268، المعاهد الوطنية للصحة و1R01GM112083-01 1R56HL118726-01A1 (لKB).
Materials
| Name | Company | Catalog Number | Comments |
| 6 cm/9 cm Petri dishes | One for each genotype to be evaluated | ||
| Water squirt bottle | |||
| Metal spoon/spatula | |||
| Thin paintbrush | e.g., a "liner" | ||
| Glass cavity dish | |||
| PAP pen: Super PAP PEN IM3580 | Beckman Coulter | ||
| Glass slides | Each slide will have 5 or more PAP PEN squares drawn on them. Size of squares depends on the imaging objective and magnification of the microscope camera; e.g., 2 mm squares. | ||
| Moist chamber | This will be used to prevent slides and wells from drying out: sealed container with wet paper towels lining the sides/bottom | ||
| Schneider’s Drosophila cell culture media | Invitrogen | ||
| Cold block | This is a metal block (a.k.a. heating block) chilled in bucket containing ice; preferably black-colored or other dark, non-reflective color | ||
| 2 x 1 ml syringes with needles (27 G ½") | Becton Dickinson | For dissections. | |
| Optional: Surgical spring scissors (cutting edge 2 mm) | Fine Science Tools | ||
| Glass beads, 212 - 600 μm | Sigma | ||
| 2 ml Eppendorf tubes | Eppendorf | One per genotype evaluating | |
| Vortex mixer | Fisher Scientific | ||
| Transgenic Drosophila larvae with fluorescently marked hemocytes. | Suitable transgenes include: HmlΔ-DsRed (Makhijani et al., 2011), MSNF9mo-mCherry (Tokusumi et al., 2009), BcF6-CFP and -GFP (Gajewski et al., 2007), or HmlΔ-GAL4 (Sinenko and Mathey-Prevot, 2004), Pxn-GAL4 (Stramer et al., 2005), He-GAL4 (Zettervall et al., 2004), Crq-GAL4 (by H. Agaisse (Stramer et al., 2005)), or eater-GAL4 (Tokusumi et al., 2009) combined with UAS-GFP or other fluorescent protein transgenes. | ||
| Fluorescence dissecting microscope | Leica | Here: Leica M205, optional with camera, imaging software and measuring module | |
| Inverted fluorescence microscope with camera attachment | Leica or Keyence | With or without tile scanning function (e.g., Leica DMI series, Keyence BIOREVO BZ-9000 series) |
References
- Lemaitre, B., Hoffmann, J. The host defense of Drosophila melanogaster. Annu Rev Immunol. 25, 697-743 (2007).
- Evans, C. J., Hartenstein, V., Banerjee, U. Thicker than blood: conserved mechanisms in Drosophila and vertebrate hematopoiesis. Dev Cell. 5, 673-690 (2003).
- Wood, W., Jacinto, A. Drosophila melanogaster embryonic haemocytes: masters of multitasking. Nat Rev Mol Cell Biol. 8, 542-551 (2007).
- Gold, K. S., Brückner, K. Drosophila as a model for the two myeloid blood cell systems in vertebrates. Experimental hematology. 42, 717-727 (2014).
- Makhijani, K., Brückner, K. Of blood cells and the nervous system: Hematopoiesis in the Drosophila larva. Fly. 6, 254-260 (2012).
- Makhijani, K., Alexander, B., Tanaka, T., Rulifson, E., Brückner, K. The peripheral nervous system supports blood cell homing and survival in the Drosophila larva. Development. 138, 5379-5391 (2011).
- Lanot, R., Zachary, D., Holder, F., Meister, M. Postembryonic hematopoiesis in Drosophila. Dev Biol. 230, 243-257 (2001).
- Holz, A., Bossinger, B., Strasser, T., Janning, W., Klapper, R. The two origins of hemocytes in Drosophila. Development. 130, 4955-4962 (2003).
- Sieweke, M. H., Allen, J. E. Beyond stem cells: self-renewal of differentiated macrophages. Science. 342, 1242974 (2013).
- Davies, L. C., Jenkins, S. J., Allen, J. E., Taylor, P. R. Tissue-resident macrophages. Nature immunology. 14, 986-995 (2013).
- Bretscher, A. J., et al. The Nimrod transmembrane receptor Eater is required for hemocyte attachment to the sessile compartment in Drosophila melanogaster. Biology Open. 1-9, (2015).
- Leitao, A. B., Sucena, E. Drosophila sessile hemocyte clusters are true hematopoietic tissues that regulate larval blood cell differentiation. eLife. , (2015).
- Markus, R., et al. Sessile hemocytes as a hematopoietic compartment in Drosophila melanogaster. Proc Natl Acad Sci U S A. 106, 4805-4809 (2009).
- Babcock, D. T., et al. Circulating blood cells function as a surveillance system for damaged tissue in Drosophila larvae. Proc Natl Acad Sci USA. 105, 10017-10022 (2008).
- Sinenko, S. A., Mathey-Prevot, B. Increased expression of Drosophila tetraspanin, Tsp68C, suppresses the abnormal proliferation of ytr-deficient and Ras/Raf-activated hemocytes. Oncogene. 23, 9120-9128 (2004).
- Stramer, B., et al. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. J Cell Biol. 168, 567-573 (2005).
- Tokusumi, T., Shoue, D. A., Tokusumi, Y., Stoller, J. R., Schulz, R. A. New hemocyte-specific enhancer-reporter transgenes for the analysis of hematopoiesis in Drosophila Genesis. 47, 771-774 (2009).
- Gajewski, K. M., et al. Identification of a crystal cell-specific enhancer of the black cells prophenoloxidase gene in Drosophila. Genesis. 45, 200-207 (2007).
- Lebestky, T., Chang, T., Hartenstein, V., Banerjee, U. Specification of Drosophila hematopoietic lineage by conserved transcription factors. Science. 288, 146-149 (2000).
- Zettervall, C. J., et al. A directed screen for genes involved in Drosophila blood cell activation. Proc Natl Acad Sci USA. 101, 14192-14197 (2004).
- Shim, J., Mukherjee, T., Banerjee, U. Direct sensing of systemic and nutritional signals by haematopoietic progenitors in Drosophila. Nature cell biology. 14, 394-400 (2012).
- Hartenstein, V. Blood cells and blood cell development in the animal kingdom. Annu Rev Cell Dev Biol. 22, 677-712 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved