Method Article
Untersuchung von Blut Zellpopulationen des
In diesem Artikel
Zusammenfassung
Drosophila blood cells, or hemocytes, cycle between resident sites and circulation. In the larva, resident (sessile) hemocytes localize to inductive microenvironments, the Hematopoietic Pockets, while circulating hemocytes move freely in the hemolymph. The goal of this protocol is the standardized isolation and quantification of these two, behaviorally distinct but interchanging, hemocyte populations.
Zusammenfassung
Bei Wirbeltieren ist der Hämatopoese durch induktive Mikroumgebungen (Nischen) geregelt. Ebenso in der wirbellosen Modellorganismus Drosophila melanogaster, induktive Mikroumgebungen als Larven Hematopoietic Pockets (HPS) gewusst haben, wie anatomischen Stellen für die Entwicklung und Regulierung der Blutzellen (Blutzellen), insbesondere der sich selbst erneuernden Makrophagen-Linie identifiziert. HPs sind segmentally wiederholt Taschen zwischen der Epidermis und Muskelschichten der Larven, die auch sensorischen Neuronen des peripheren Nervensystems umfassen. In der Larve werden Resident (sessile) Hämozyten an anti-apoptotischen, Klebstoffs und proliferative Signale aus diesen sensorischen Neuronen und möglicherweise anderen Komponenten HPS wie die Auskleidung Muskel und Epithelschichten belichtet. Während der normalen Entwicklung, allmähliche Freisetzung Wohnsitz Blutzellen aus den HPs Kraftstoffe die Bevölkerung der zirkulierenden Blutzellen, die in der Veröffentlichung von mo gipfeltst der residenten Blutzellen zu Beginn der Metamorphose. Immunangriffe, des Körpers oder mechanische Störung auslösen, die vorzeitige Freigabe von inländischen Blutzellen in den Verkehr. Der Schalter der Larven Hämozyten zwischen gebietsansässigen Standorte und Kreislauf erhöht den Bedarf nach einem gemeinsamen Standard / Verfahren, um selektiv zu isolieren und zu quantifizieren, diese zwei Populationen von Blutzellen aus einzigen Drosophila-Larven. Dementsprechend Dieses Protokoll beschreibt eine automatisierte Methode, um freizugeben und zu quantifizieren, die Bewohner und zirkulierenden Blutzellen aus einzelnen Larven. Das Verfahren erleichtert ex-vivo-Ansätzen, und kann angepasst sein, eine Vielzahl von Entwicklungsstadien von Drosophila und anderen wirbellosen Organismen zu dienen.
Einleitung
Forschung in der wirbellosen Modell Drosophila melanogaster hat die Entdeckung der angeborenen Immunität 1 angetrieben wird, und hat das Verständnis der verschiedenen Aspekte der Blutzellentwicklung 2-4. Drosophila Hämatopoese in die Linie der embryonalen / Larvenblutzellen, die in der Ursprung unterteilt werden erleichtert Embryo und in der Larve zu erweitern, und die Abstammung von Lymphdrüsen Hämozyten 4,5. Hier präsentieren wir ein Protokoll, das auf der Linie der embryonalen / Larvenblutzellen, die in der Drosophila Larve umfasst im Wesentlichen plasmatocytes (Makrophagen) und einige Kristallzellen 4 fokussiert. In der Larve, Blutzellen des Embryos fortbestehen und zu kolonisieren segmentweise wiederholt und Terminal Hematopoietic Pockets (HPS) zwischen der Epidermis und Muskelschichten des Larvenkörperwand 5,6 entfernt. Auf der Grundlage ihrer Natur als selbst erneuernde Makrophagen 6, ihrer überwiegenden Aufenthalt in lokalen Gewebemikroumgebungen 6, 7 und ihrer Abstammung von den frühesten Blutkörperchen Schwellen während der Entwicklung 6,8 wird diese Blutzellpopulation, die als ähnlich wirbel selbsterneuernden Gewebsmakrophagen, einem unabhängigen myeloider Abstammung kurzem in einer Vielzahl von Arten 4,9,10 identifiziert. Jedoch in Drosophila, einige oder alle dieser residenten Zellen zeigen auch Plastizität Anlass zu anderen Arten von Blutzellen, wie beispielsweise Kristallzellen 11,12 ergeben.
Larvenblutzellen sind überwiegend ansässig (sessile), sondern in einem dynamischen stationären zwischen verschiedenen HPs. Sie werden nach und nach in Verkehr gebrachten, insbesondere in der 3. Larvenstadium nähert Puparium 5-7. Immune Herausforderungen, Verletzungen oder mechanische Störung führen zu einer vorzeitigen, im letzteren Fall reversibel, Mobilisierung der Wohnsitz Blutzellen in die Hämolymphe 4,6,13.
Frühere Studien haben gezeigt, dass ansässige vorgeschlagen und zirkulierendeLarvenblutzellen sind von der gleichen Linie, unterscheiden sich aber in ihren Klebstoff oder Homing Eigenschaften 6,7,13,14. Selektive Isolierung von zirkulierenden gegen Wohnsitz Hämozyten ergab erhöhte Konzentrationen von Proliferation in der Wohn hemocyte Bevölkerung, was auf ihre Exposition gegenüber induktiven Hinweise aus HPS 6. Drosophila Larven HPs werden von Epidermis und Muskelschichten ausgekleidet und weitere Hafen sensorischen Nervenzellverbände des peripheren Nervensystems (PNS) und Leberfunktion ähnlich oenocytes 6. Funktionell Mutante und genetische Zellablation Experimente haben gezeigt, dass in den vorliegenden HPs sensorischen Neuronen unterstützen die trophischen Überleben und die Lokalisierung von Larven Hämozyten 6.
Hier beschreiben wir ein Verfahren für die spezifische Isolierung und Quantifizierung von gebietsansässigen und zirkulierenden Blutzellen aus einem Drosophila-Larven, und ein Protokoll für mechanischen hemocyte Mobilisierung. Die Verfahren können für die ex vivo verwendet werden,Untersuchung von Blutzellen und kann weiter zu anderen Drosophila Entwicklungsstadien wie die Puppe und Erwachsenen und andere wirbellose Systeme angepasst werden. Da frühere Studien nicht zwischen gebietsansässigen und zirkulierenden Blutzellen zu unterscheiden, bietet dieses Protokoll einen gemeinsamen Standard für das Studium der Wohnsitz Blutkörperchen und wird dazu beitragen, um die Konsistenz der wirbellosen Blutzellforschung zu erhöhen.
Zunächst beschreibt der Hemocyte Bleed / Scrape Assay der differentiellen Isolierung und automatische Quantifizierung von fluoreszierenden Protein markierte Wohnsitz und zirkulierenden hemocyte Populationen von einzelnen Drosophila-Larven; Das Protokoll bietet zwei Optionen für die regelmäßige und Fliesen scannen ausgestattete Mikroskope (Abbildung 1). Als Ergebnis ist der Anteil der zirkulierenden Blutzellen und die Gesamtzahl der Blutzellen pro Larve erhalten. Das Verfahren beruht auf transgene Drosophila-Larven, die fluoreszierende Protein unter ihren Blutzellen exprimierenBevölkerung. Die Wahl der hemocyte Fahrer oder Reporter bestimmt das Ergebnis, das heißt, die Bevölkerung von Blutzellen sichtbar gemacht und quantifiziert. Um vor allem kenn Makrophagen (plasmatocytes), die die überwiegende Mehrheit der Bewohner und zirkulierenden hemocyte Bevölkerung der Drosophila Larve 6 umfassen, geeignet Transgene umfassen Hml Δ-DsRed 6, HmlΔ -GAL4 15. Pxn -GAL4 16, CRQ-GAL4 (durch H. Agaisse 16) oder eater-GAL4 17; für die Kennzeichnung des relativ kleinen Population von Kristallzellen, geeignete Leitungen BcF6-CFP und -GFP 18 oder LZ-GAL4 (von J. Pollock 19); für die Kennzeichnung Lamellozyten, einem spezialisierten Zelltyp vor allem durch Immun Herausforderungen und Verletzungen 13 induziert, zB MSNF9mo-mCherry verwendet 17 werden. Einige transgene Treiber sind in einer Reihe von differenzierten Blut ausgedrücktZellen und Vorläuferzellen, wie er - GAL4 20, die etwa 80% aller Larven Blutkörperchen 20 Etiketten. Bitte beachten Sie, dass in allen Fällen, in denen GAL4-Treiber verwendet werden, zusammen mit UAS-GFP oder einem anderen fluoreszierenden Proteins UAS-Transgens erforderlich ist. Im Abschnitt Ergebnisse, wird dieses Verfahren verwendet, um Blutzellzahl und Zirkulationsverhalten im Laufe der Larvenentwicklung überwachen.
Zweitens beschreibt die Hemocyte Disturbance Assay einen vorhergehenden Schritt zur resident Hämocyten durch externe Manipulation, das anschließend ermöglicht die Bewertung der Fähigkeit von Hämozyten neu zu haften und die Heimat HABn innerhalb eines begrenzten Zeitrahmen zu lösen (30-60 min) 6. Regel dieser Assay wird durch die Bleed / Scrape Test, um den Anteil der zirkulierenden Blutzellen pro Larve bestimmen. Wir präsentieren ein vereinfachtes Protokoll für diesen Assay (1D), die Störung durch Vortexen wit verwendeth Glasperlen, anstatt Manipulation einzelner Larve mit einem Pinsel wie zuvor 6 beschrieben. Im Abschnitt Ergebnisse, ist dieser Assay verwendet werden, um die vorübergehend abgelöst hemocytes Schwimmer in der Hämolymphe zu zeigen und können in dem Bruchteil der zirkulierenden Blutzellen zurückgewonnen werden. Der Test ist auch nützlich, um Unterschiede der Blutzellen in ihrer Homing / Haftung an Wohnsitz Websites vergleicht zB verschiedene genetische Hintergründe oder Stimulationsbedingungen zu quantifizieren. Bitte beachten Sie, dass diese mechanische Manipulation reflektiert einen reversiblen Prozess und unterscheidet sich von Infektions- oder Verletzung induzierte resident hemocyte Mobilisierung, die typischerweise nicht reversibel sind in einem kurzen Zeitrahmen 4,13.
Protokoll
1. Hemocyte Bleed / Scrape Assay
- Herstellung von Folien:
- Option 1 für Mikroskope ohne Fliesen Scan-Funktion: Für jede Larve analysiert werden, bereiten einen Glasobjektträger mit ca. 5 Pap-Pen Vertiefungen von 2 mm Quadrate jeweils entsprechend der Feldbetrachtungsbereich des Mikroskops; geben Sie ca. 5 bis 10 & mgr; l S2 Medien auf jede (Abbildung 1A). Halten Sie Folien in feuchten Kammer in die Vertiefungen nicht austrocknen.
- Option 2 für Mikroskope mit Fliesen Scan-Funktion: Für jede Larve analysiert werden, bereiten einen Glasobjektträger mit 3 bis 4 Pap-Pen Wells ~ 3-4 mm Quadrate je; gibt man etwa 15 bis 20 ul S2 Medien in jede Vertiefung (1B). Halten Sie Folien in feuchten Kammer in die Vertiefungen nicht austrocknen.
HINWEIS: Die oben empfohlene Anzahl von Brunnen ist ausreichend für Summen von bis zu 3.000 Blutzellen pro Larve (späten 2. Larvenstadium, ~ 2,5-3 mm Länge, Transgen Beschriftung der Mehrheit der larval Blutkörperchen). Bei der Beurteilung der größeren Blutzellzahlen, vielleicht mehr Wells erforderlich sein, um Überfüllung zu vermeiden.
- Sammlung von Larven:
- Spritzen Wasser in ein Fläschchen mit Fliegenlarven und bündig Larven in eine Petrischale, oder mit einer Schaufel etwas zu essen, die Larven in eine Petrischale enthält und mit Spritzflasche mit Wasser verdünnen.
- Pick vorsichtig Larven aus der Petrischale mit einem Pinsel und legen Sie sie in Wasser in einem Hohlraum Schale oder auf einem Objektträger an einem kalten Block.
HINWEIS: Die Larven können für eine begrenzte Zeit in Wasser oder in einem kalten Block gehalten werden; benutzen Proben innerhalb von 45 Minuten oder weniger, um zum Tod der Larve oder unerwünschte Auswirkungen auf die Blutzellen zu vermeiden.
- Präparation:
- Wählen Larven unter einem Fluoreszenzmikroskop an einem kalten Metallblock. Messen Sie Größen und Bild Larven, falls gewünscht.
- Isolierung von zirkulierenden Blutzellen ("Bleed"):
- Sobald Larven ausgewählt sind, legen Sie eine Larve in der ersten Pap-Pen gut (1C,2A).
- Verwenden Sie 2 saubere Nadeln oder Sezieren Schere und Pinzette, um einen Einschnitt an den beiden hinteren und vorderen Enden der Larve zu machen. Resident Blutzellen nicht zu stören, ist es am besten, diese Einschnitte auf der Bauchseite der Larve zu machen. Für gleichbleibende Ergebnisse, nehmen Sie die Einschnitte in den gleichen Positionen für jede Larve. Zum 1. Larvenstadium ist ein Einschnitt (im ventralen anterior) ausreichend.
- Erlauben Larve, für ein paar Sekunden ohne Druck oder körperliche Bewegung (Abbildung 2A) bluten.
HINWEIS: Bei der Arbeit an mehreren Larven ist es besser, diese Einschnitte für jeden, bevor Sie zum nächsten Schritt zu vermeiden, halten Larven auf Eis zu lang, die Integrität der Proben "beeinträchtigen. - Heben Sie die Larve mit den Nadeln oder einer Pinzette und tauchen sie in der zweiten Wanne, um alle verbleibenden zirkulierenden Blutzellen zu spülen. Danach folgen mit der Veröffentlichung von Resident Blutzellen.
- Isolierung von Blutzellen Wohnsitz ("Scrape"):
- Die Larve sanft zu übertragen auf die nächste gut (2C).
- Identifizieren Sie die Lymphdrüsen der Larve, die in der Regel befindet sich ca. 1/3 vom vorderen Ende der Larve, und welche dorsal durch die Larvenkörperwand fluoreszieren kann. Vermeiden Sie den Lymphdrüsen unter Freisetzung Wohnsitz Blutzellen durch Fesselung die Larve mit einer Nadel so nahe wie möglich an den Lymphdrüsen zu vermeiden Punktion (2C).
HINWEIS: Während der normalen Entwicklung die Reifung der Lymphdrüse Blutzellen ist im Vergleich zum Larven Hämozyten verzögert und fluoreszierenden Reporter von differenzierten Blutzellen dürfen nicht ein Signal in der Lymphdrüse der jungen Larven zeigen. In diesen Fällen braucht weniger Augenmerk auf die Lymphknoten als keine Verunreinigung des differenzierten fluoreszenzmarkierten Larven Hämocyten durch Lymphknoten hemocytes gezahlt wird erwartet. - Lassen Wohnsitz Blutzellen in einer dissectiam Prozess der Schaben und / oder stach. Verwenden Sie eine Nadelspitze, um effektiv festzunageln die Larve in der Nähe der Lymphdrüsen (siehe oben) oder anderen Körperbereichen, wie gebraucht. Verwenden Sie eine andere Nadel, um an den Cluster von Blutzellen, die durch die Larvenkörperwand (2C, E) sichtbar sind jab, mit dem Ziel, um die Blutzellen zu trennen. Blutzellen können auch in einer Schaben Bewegung freigegeben. Allerdings reißen die Epidermis frühen können große Gruppen von Blutzellen, die automatisierte Zählung schwieriger machen könnte freizugeben.
ANMERKUNG: Je nach dem Alter und dem Genotyp der Larven, die Zahl der gesamten Blutzellen variieren. Verteilen Sie die oben über mehrere Brunnen beschriebenen Überfüllung einiger Vertiefungen mit Blutkörperchen, die einzelnen Bildzellenanalyse erschweren könnten, zu vermeiden Freigabeprozess. - Wenn paar Blutzellen in der letzten Karkasse bleiben, zählen diese Blutzellen durch Beobachtung durch das Mikroskop und die Verwendung eines Handtallykostenzähler (2E). Um das Zählen, S. erleichternschnüren die Karkasse auf eine saubere Fläche von demselben Objektträger und breitete sie so dünn wie möglich, die Anzahl der optischen Ebenen reduzieren.
- Sobald das Sezierung abgeschlossen ist, warten Sie zwischen 5-10 min für die Zellen absetzen (aber nicht unbedingt einhalten) vor dem Abbilden der Brunnen. Inkubieren Sie die Objektträger in einer feuchten Kammer, um ein Austrocknen zu verhindern und zu vermeiden, grobe Handhabung der Folien, die die Blutzellen besiedelt stören könnten.
HINWEIS: Bei der Ermittlung hemocyte zählt, freigesetzten Zellen sind nicht festgelegt, und die Zellen müssen kurz nach Dissektion abgebildet werden, vorzugsweise innerhalb von 30 Minuten nach der Entlassung aus der Larve. 10 min, welches durch Fokussierung durch die optischen Flächen des Mediums, in dem auch bestätigt werden sollte - je nach Volumen des Mediums und Zelleigenschaften, wird die überwiegende Mehrheit der Zellen innerhalb von 5 abgesetzt haben. Es wird jedoch nur ein Bruchteil von Blutzellen zur Gleitfläche zu dieser Zeit festgesetzt haben, eine Tatsache, die berücksichtigt werden muss, wenn die Änderung dieser Protokoll zur Fixierung der Zellen basierenden heranmaches.
- Quantifizierung:
- Nehmen Bilder der abgesetzten hemocytes unter einem Fluoreszenzmikroskop (2B, D, F). Folgen Sie mit Quantifizierung von Blutzellen mit ImageJ Software.
- Bild Bereiten Sie sich für ImageJ Zellzählung Algorithmus:
- Offene Bild auch mit ImageJ: Datei → Öffnen → (lokalisieren Datei und wählen Sie).
- Damit das Bild (n) 8-Bit- oder 16-Bit. Stellen Sie die Schwelle für das Bild, indem Sie Bild und klicken Sie auf Anpassen und wählen Sie Threshold. Beachten Sie die "Threshold-Fenster" (3A).
- Aktivieren Sie die Option "Dunkler Hintergrund". Wählen Sie "Rot" und erhöhen die Untergrenzwert (siehe schwarzer Pfeil), bis jede Zelle in dem Bild mit einem roten Punkt (Zellen, die nicht abgedeckt sind, werden in Graustufen zu sehen; 3B) markiert. Wie die untere Schwelleerhöht einige Zellen werden nicht markierten werden. Dies kann der Indikator dafür, wie weit in den unteren Schwellenwert zu setzen.
HINWEIS: Gelegentlich Cluster von Zellen kann nicht aufgelöst werden und würde als eine durch den Partikelzähler gezählt. In solchen Fällen kann die Anzahl der Zellen in einem Cluster durch Untersuchen des Bildes (Zoom in, wenn erforderlich) und manuelle Zählung mit einem Stückzähler geschätzt werden. Alternativ kann die untere Schwelle erhöht, um Cluster von Zellen zu lösen; alle nicht markierten Zellen aus dieser Manipulation resultiert, kann dann mit einem Strichliste Zähler gezählt werden.
- Analysieren Sie die Zellzahl mit ImageJ:
- Starten Sie die Particle Analyzer, um die Zellen (3C) zu zählen. Wählen Analysieren und klicken Sie auf Analysieren Particle. Optional wählen Sie "Overlay Outlines", um die Partikel zu sehen den Algorithmus count (3D). Alternativ können Sie ein Limit für die Größe oder Pixelfläche einer Einheit (zB., Zell, Zellklumpen, etc.) für den Algorithmus zu zählen.
- Klicken Sie auf OK. Beachten Sie eine Übersichtsfenster mit der count (3E).
2. Hemocyte Disturbance Assay
- Um Blutzellen, wählen Larven stören und legen Sie sie in einem 2 ml Mikrozentrifugenröhrchen mit ungefähr 0,5 g Glasperlen (212-600 um) und 0,5 ml Wasser.
- Das Röhrchen vortexen, mit der Hand, mit der Geschwindigkeit 10 für 1 min.
- Rufen Sie die Larven von den Glasperlen durch Verschütten des Inhalts der Mikrozentrifugenröhrchen in eine Petrischale und Kommissionierung die Larven mit einem Pinsel.
- Für die Erholungsphase, legen Larven in vorbereitete Petrischalen mit kleinen Mengen von fly Essen. Ermöglichen die Larven zur Wiederherstellung ihrer hemocyte Muster für eine Zeitdauer von 45 min oder nach Wunsch.
HINWEIS: Entsorgen Sie alle Larven, die sich bewegenden aufgehört haben, wie sie in den Prozess gestorben. Allerdings sehen wir in der Regel little Schäden nach 1 min vortexen (siehe unten und Supplemental Abbildung 1). - Nach der Erholungsphase, fahren Sie mit dem Bleed / Scrape Assay, wie oben in Abschnitt 1 beschrieben.
Ergebnisse
Um typische Ergebnisse der beschriebenen Verfahren zu veranschaulichen, haben wir zum ersten Mal das Hemocyte Bleed / Scrape Assay, das Fortschreiten der Larven hemocyte Zahlen und ihren Wohnsitz im Laufe der Larvenentwicklung (Abbildung 4) zu skizzieren. Einwohner und zirkulierenden Larven hemocyte Populationen wurden aus einzelnen Larven isoliert (Hml Δ-GAL4, UAS-GFP; He-GAL4, um zu kennzeichnen die überwiegende Mehrheit der Larven Blutzellen) und quantifiziert mit ImageJ. Kohorten von Larven bemessen 1,2 mm (~ 48 h AEL oder 1. Larvenstadium), 2,5 mm (~ 80 h AEL oder späten 2. Larvenstadium) und 3,5 mm (~ 96 Stunden AEL bzw. 3. Larvenstadium) wurden untersucht (Figur 4) . Hemocyte Zahlen im Laufe der Larvenentwicklung erweitert, korreliert mit und übertreffen den bisherigen Schätzungen, basierend auf Lichtmikroskopie von Farbstoff gefärbten Larven 7 und Live-Zählung von fluoreszierenden Protein markiert Blutzellen durch die Larvencuticula 6. Im 1. Instar Larven fast alle Blutzellen waren ansässig sind, wobei der Anteil des zirkulierenden Blutzellen allmählich im Laufe der Entwicklung der Larven (4B, C), was mit früheren Publikationen 6,7 erhöht.
Weiter untersuchten wir, ob die Methode treu überwacht den Übergang der Blutzellen zwischen dem Wohnsitz und zirkulierenden Populationen. Unter Ausnutzung des Phänomens, dass ansässige Blutzellen kann vorübergehend durch mechanische Störung gelöst werden, und sie wieder sich an ihren Wohnsitz Websites spontan 6, dispergiert wir ansässig Blutzellen durch Vortexen mit Glasperlen, wie in der Hemocyte Disturbance Assay beschrieben. Tatsächlich mechanische Störung der Larven führte zu einem dramatischen Anstieg der Population zirkulierender Blutzellen auf Kosten der residenten Hämozyten (Abbildung 5). Nach einer Erholungszeit von 45 min, Blutzellen war größtenteils auf ihre haftenden Zustand sowohl durch visuelle Inspektion und durch den als zurückkehrte,sessed Prozentsatz zirkulierender Zellen (5D, E). Wie zu erwarten, blieb insgesamt hemocyte Zahlen über die Zeit stabil, trotz der Verschiebung der Blutzellen zwischen den zirkulierenden und Wohnbevölkerung.
Einige zusätzliche Überlegungen wurden berücksichtigt. Um zu bestätigen, dass die Verwirbelung nicht die Ursache für große Gewebeschädigung, Vortexen mit Glasperlen wurde in Gegenwart von Trypanblau (Sigma) für diverse Zeitperioden (1, 5, 20 min) durchgeführt. Beide 1 und 5 min Verwirbelung verursachte keine offensichtlichen Gewebezerstörung, während 20 min vortexen ergab kleine beschädigte Bereiche, ähnlich Beschädigung durch Nadelstiche als positive Kontrolle (Supplemental Figur 1) verwendet, verursacht wird. Während innere Schäden der Epidermis oder anderen Geweben, ohne Nagelhautschäden nicht ausgeschlossen werden kann, scheint dieses Szenario eher unwahrscheinlich, wie Blutzellen von 1 min und 5 min-behandelten Larven Wiederhalten in dem erwarteten Muster und Zeitrahmen, was darauf hindeutet Larven Integrität nicht Kompromissd (Supplemental Abbildung 1). Demgegenüber verwirbelt Larven für 20 min unter einem Mangel an Wiederhaftungs gelitten und zeigte nicht einmal Befestigung des zirkulierenden Blutzellen um epidermale Wundstellen, wie es zuvor beschrieben worden ist 14.
Schließlich, um die Reproduzierbarkeit des Verfahrens zu demonstrieren, verglichen wir biologischen Replikaten von 2,5 mm Larven aus den obigen zwei Experimenten, die durch verschiedene Experimentatoren geführt wurden. Wie in Supplemental 2 dargestellt ist, zeigten beide Kohorten vergleichbare Gesamtzahl der Blutzellen pro Larve, und der Prozentsatz der zirkulierenden Blutzellen. T-Tests Schülers zeigte keine statistisch signifikanten Unterschiede, was darauf hindeutet, dass das Verfahren ist reproduzierbar und breiter anwendbar.
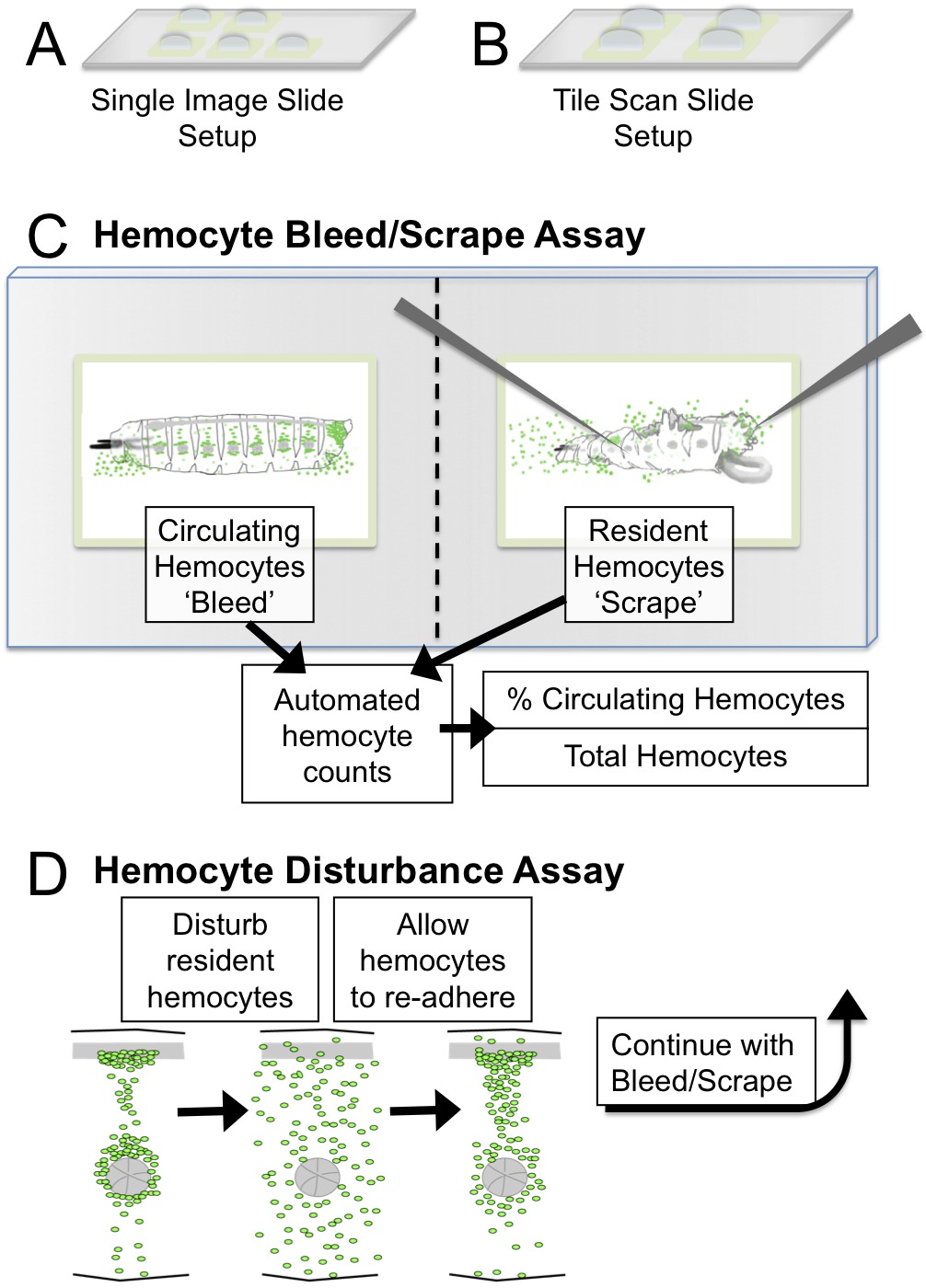
Abbildung 1. Hemocyte Bleed / Scrape und Disturbance Assay s etup und schematisch. (A) Einzelbild Slide Setup: 2mm fünf Plätze für die Bildgebung mit einem 5fach-Ziel (B) Tile Scan Slide Setup:. Vier 3 mm Quadrate für die Bildgebung Entlüftungs / Schürfwunden von ≤2.5 mm Larven mit einem Fliesenscanmikroskop. Empfehlenswerte Ziele für die Bildgebung sind 5fache oder 10fache. (C) Bleed / Scrape Assay schematische und daraus resultierende Quantifizierungen mit ImageJ. (D) in der Störungs Assay wird die hemocyte Muster mechanisch durch Vortexen Larven mit Glasperlen aufgebrochen. Larven dürfen über erholen einen Zeitraum von 45 min, während der Blutzellen wieder haften an den hämatopoetischen Taschen. Die Klebeeigenschaften von Blutzellen können nach diesem Verfahren beurteilt werden, die Quantifizierung der Anteil der Blutzellen im Kreislauf nach einer Störung. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
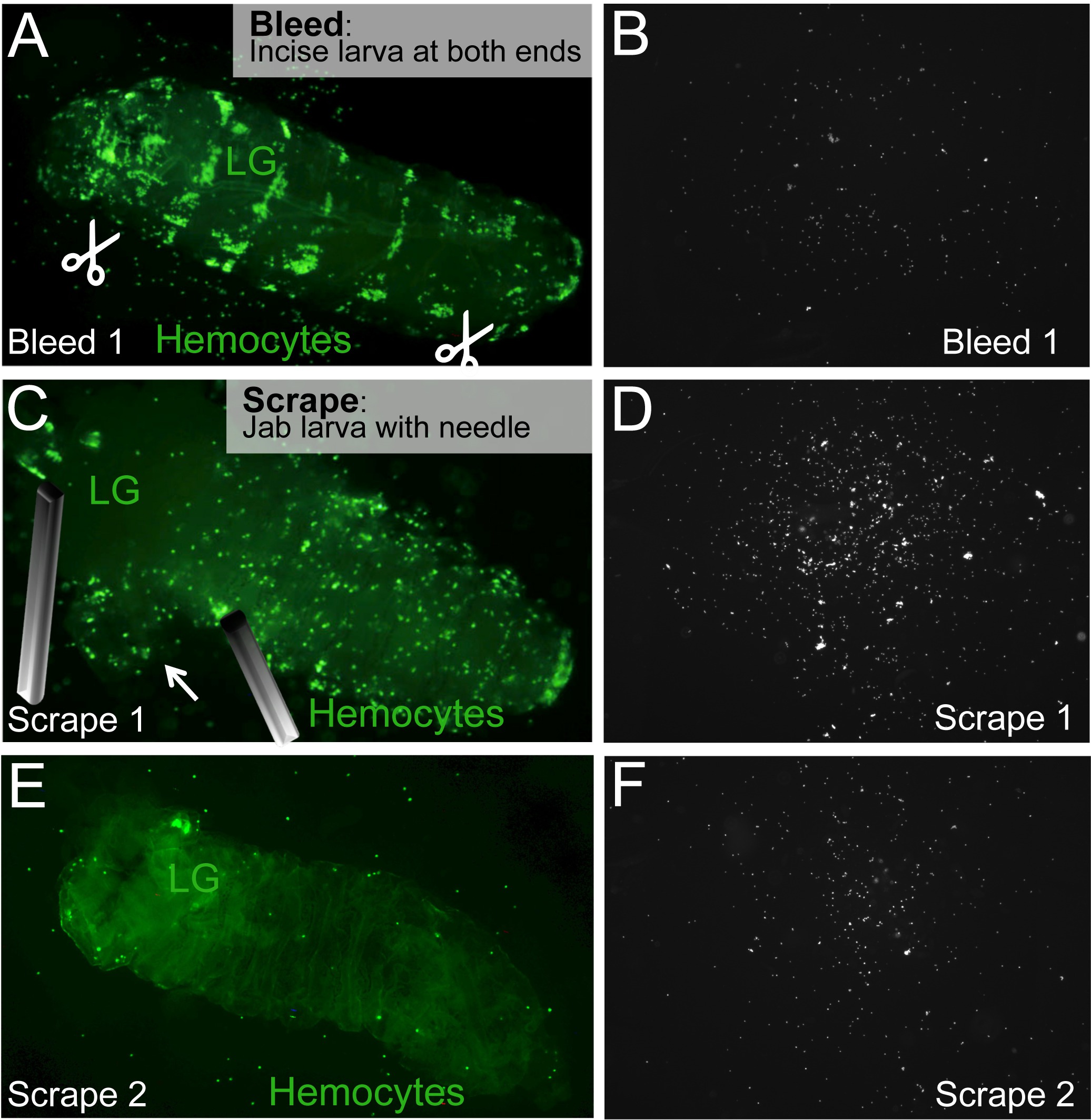
Abbildung 2. Bleed / Scrape Assay zur Freigabe zirkulierenden Blutzellen und Wohnsitz. (A) um eine Larve bluten, ventralen Einschnitte an den hinteren und vorderen Enden der Larve gemacht (Scherensymbol). (B) Blutzellen im Kreislauf wird von den Einschnitten zu fließen und sich auf der Oberfläche der Folie. (C) Die Lymphdrüsen (LG) befindet, und, festgenagelt ohne Punktierung es. Wohnhaft Blutzellen werden durch stach und / oder Abschaben der Larve mit einer Nadel freigelassen. (D) ansässige Blutzellen auf dem Objektträger. (E, F) Die Scrape Prozess wird wiederholt, bis alle residenten Blutzellen freigesetzt. Die Larven Karkasse die intakte Lymphdrüse enthält, wird zurückgelassen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
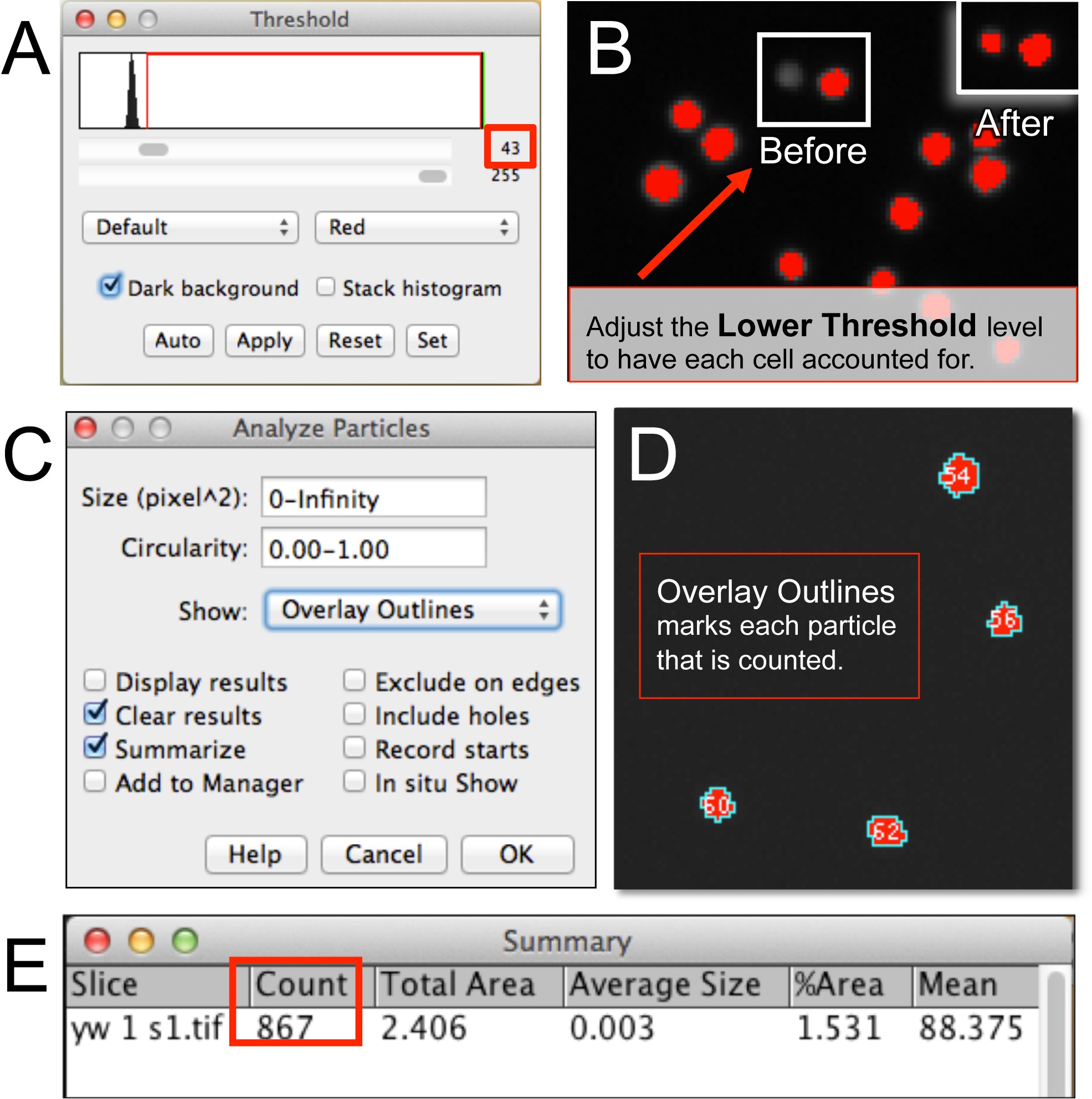
Abbildung 3. Automatisierte Quantifizierung von Blutzellen mit ImageJ. (A, B) Nach dem Öffnen einer Bild hemocyte Datei in ImageJ, die untere Schwelle Niveau wird angepasst, um für alle Zellen im Bild ausmachen. (C, D) Analysieren Partikel erfordert die Einstellung der Zellenpixelgröße, Rundheit, und das Ergebnis Auslese Format (zB Overlay Outlines). (E) Zusammenfassung Fenster mit der Anzahl der Blutzellen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 4. Repräsentative Ergebnisse (1). Hemocyte Nummer und Wohnsitz Staates über die Verlauf der Larvenentwicklung. (A) Übersicht über die Larvenstadien verwendet werden; 1. Larvenstadium (48 hr AEL; ~ 1,2 mm Länge); 2. Larvenstadium (80 hr AEL, 2,5 mm Länge); 3. Larvenstadium (96 hr AEL; ~ 3,5 mm Länge). Genotyp Hml Δ-GAL4, UAS-GFP; He-GAL4. Stages wurden durch die Bewertung Larven mouthhooks bestätigt. (B) Balkendiagramm der zirkulierenden und Resident hemocyte Nummern an den jeweiligen Larvenstadien. (C) Anteil der zirkulierenden Blutzellen. Man beachte, dass der Anteil des zirkulierenden Blutzellen erhöht proportional im Laufe der Entwicklung der Larven. (D) Gesamt Hämocyten aus der Summe von zirkulierenden und Resident hemocytes pro Larve resultieren. Blutzellen wurden mit dem Bleed / Scrape Methode quantifiziert; n ≥ 6 Larven / Zustand, Fehlerbalken zeigen die Standardabweichung, Erkenntnisse in 3 unabhängige Wiederholungsversuchen bestätigt.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
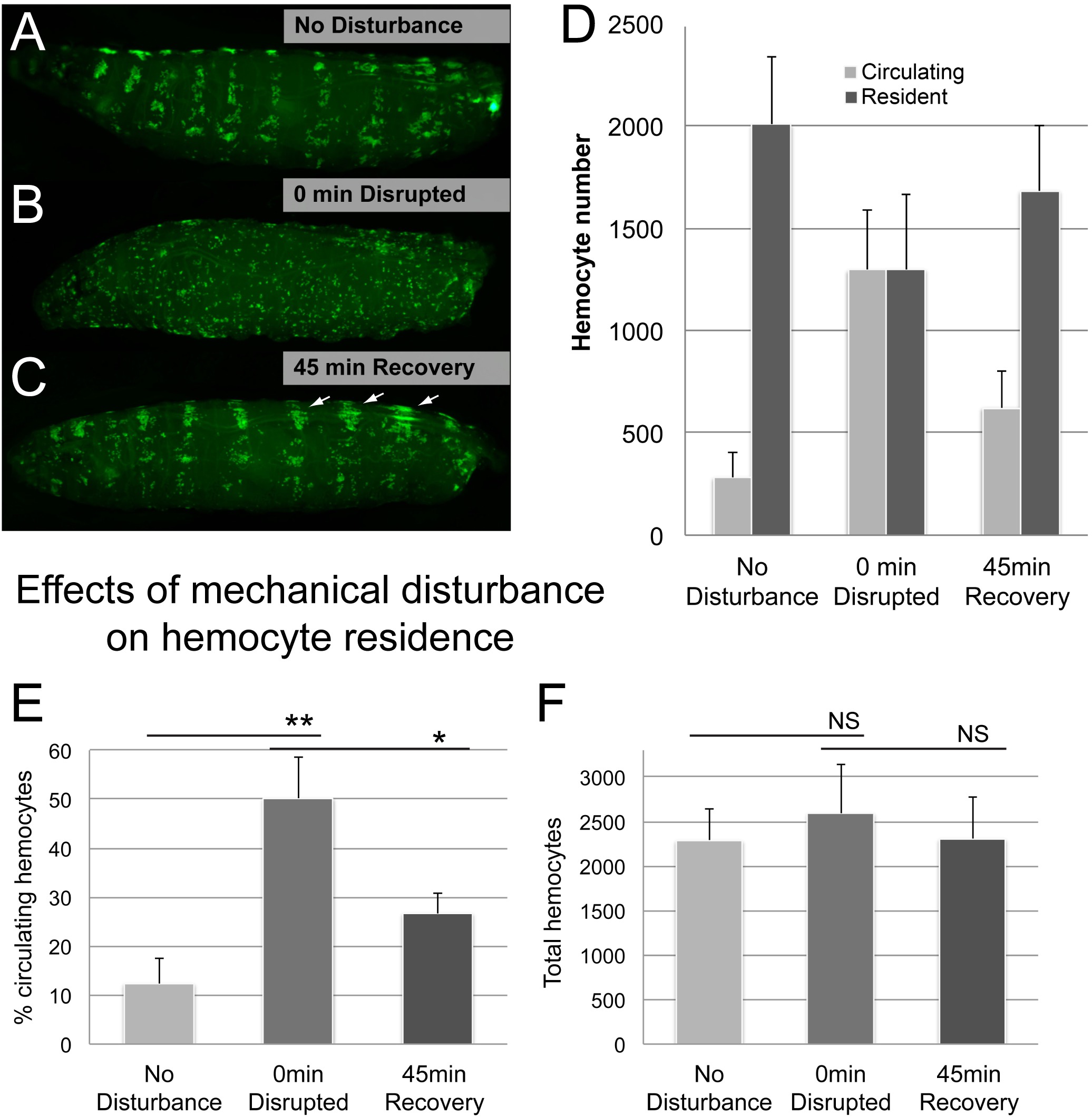
Abbildung 5. Repräsentative Ergebnisse (2). Auswirkungen von mechanischen Störungen auf hemocyte Residenz. (AC) Beispiel für eine Larve vor und nach Vortexen mit Glasperlen, gefolgt von 45 min Rückgewinnung (A) Keine Störung Kontrolle. Blutzellen werden in hämatopoetische Pockets bei 0 min nach Vortexen Larven in einer Suspension von Glasperlen und Wasser lokalisiert (B) Gestörte hemocyte Muster (C) Hemocyte Muster bei 45 min für eine Erholung nach der Störung..; viele Blutzellen haben, um die hämatopoetischen Pockets verlegt; beachten vergrößerte dorsalen Gefäß zugehörigen Cluster und Rückenstreifen, die überwiegende Stätten von frühen post Störung Ansammlung (Pfeile) sind. Genotyp Hml Δ-GAL4, UAS-GFP; He-GAL4 x yw. (D) Anteil der zirkulierenden Blutzellen durch die Bleed / Scrape Verfahren quantifiziert. (E) Gesamtblutzellen, aus der Summe der zirkulierenden Blutzellen und Resident pro Larve resultieren. n ≥ 4 Larven / Zustand, Fehlerbalken zeigen die Standardabweichung, Erkenntnisse in 3 unabhängige Wiederholungsversuchen bestätigt. T-Test auf Signifikanz bestätigen, NS (nicht signifikant), ** (p ≤ 0,05), ** (p ≤ 0,01). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Hier beschreiben wir die erste Methode zur quantitativen erholen Wohnsitz und zirkulierenden Blutzellen aus einzigen Drosophila-Larven, und zu quantifizieren, diese beiden hemocyte Populationen. Das Protokoll enthält die sequenzielle Freisetzung von zirkulierenden und Resident Blutzellen, gefolgt von bildgebenden und automatisierte Zellzählung. Larven Wohnsitz Hämozyten kann vorübergehend durch mechanische Störung in Umlauf mobilisiert werden, ein Prozess, der dafür bekannt ist, größtenteils innerhalb von 30 umgekehrt werden - 60 Minuten Erholungszeit 6. Dementsprechend wurde dieses Protokoll auf zwei Arten getestet: (1) durch die Ermittlung des Gesamt hemocyte Zahl pro Larve und Fraktion von zirkulierenden Blutzellen im Laufe der Entwicklung der Larven, und (2) durch experimentell Verdrängen resident hemocytes Verwendung eines automatisierten Verfahrens, was bestätigte, das enge Korrelation hemocyte Lokalisierung und hemocyte Nummer in der gebietsansässigen und zirkulierenden Populationen. Darüber hinaus wurde die Reproduzierbarkeit des Verfahrens durch Co zeigtenmparing zwei Datensätze von biologischen Replikaten.
In der Vergangenheit haben die Labors eine Reihe von Techniken zur Larven Hämozyten 6,13,21 quantifizieren. Dieses Protokoll wird ein gemeinsamer Standard abzurufen und zu quantifizieren, Bewohner und zirkulierenden Blutzellpopulationen aus Drosophila-Larven und bietet eine leicht anpassbare Plattform. Das beschriebene Verfahren ist entscheidend für die Studien, die über die Rolle der residenten Blutzellen und ihrer Mikroumgebung zu konzentrieren, die hämatopoetischen Pockets 4-6, und ist geeignet, um fluoreszierende Protein Transgen tragenden Drosophila-Stämmen in Wildtyp und gentechnisch veränderten Hintergründe zu untersuchen. Das Protokoll ist auch für Studien, die auf hemocyte Mobilisation nach Immun Herausforderung oder Verletzungen, und genetisch oder umweltbedingten Signalisierung, die Mobilisierung der Wohnsitz Blutzellen oder Veränderungen in der Gesamt hemocyte Nummer (4 Bewertung) löst konzentrieren relevant. Es sollte beachtet werden, dass in Fällen der vorzeitigen differentiation und Freisetzung von Blutzellen aus der Lymphdrüsen und unterscheidet embryonale / Larvengegen Lymphdrüse Abstammungslinien können durch die Expressionsmuster der Fluoreszenz hemocyte Reporter verwendet begrenzt werden.
Die hier vorgestellte Protokoll stützt sich auf Echtzeit-Bildgebung, fluoreszenzmarkierten Blutzellen. In der Zukunft kann es modifiziert werden, um den Nachweis von freigesetzten Zellen nach der Fixierung zu ermöglichen, beispielsweise mittels Immunzytochemie. In diesem Fall kann es für das Protokoll, das geeignet ist, um eine vollständige Haftung der Blutzellen, beispielsweise durch Erhöhung Adhäsion Inkubationszeiten und Hinzufügen Klebe Gleitbeschichtung, beispielsweise Concanavalin A sicherzustellen da die Methode eine Abfrage von Hämozyten und deren Manipulation ex vivo, es wird eine breite Palette von Entwicklungs, zellbiologische und biochemische Untersuchungen profitieren. Einwohner und zirkulierenden Blutzellen werden bei allen postembryonalen Entwicklungsstadien von Drosophila und andere wirbellose 22, suggesti gefundenng, dass die Anpassung dieser Methode wird eine breite Palette von Studien über die Drosophila-Larven blutbildenden Systems zu profitieren.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Wir bedanken uns bei Jesper Kronhamn und Dan Hultmark, Michael Galko und die Bloomington Stock Center für die Fliege Aktien. Besonderer Dank geht an Courtney Onodera um Rat bei der statistischen Analyse. Wir danken Katrina Gold für die kritische Durchsicht des Manuskripts und Kalpana Makhijani, Katrina Gold, Mitglieder der Derynck Labor, und die Mitglieder der Nystul Labor für Diskussionen und Anmerkungen zum Manuskript. Diese Arbeit wurde durch Zuschüsse aus dem UCSF Programm für Breakthrough Biomedical Research (PbBr), Broad Center, Hellman-Stiftung, American Cancer Society RSG DDC-122595, American Heart Association 13BGIA13730001, National Science Foundation 1.326.268, National Institutes of Health 1R01GM112083-01 und unterstützt 1R56HL118726-01A1 (um KB).
Materialien
| Name | Company | Catalog Number | Comments |
| 6 cm/9 cm Petri dishes | One for each genotype to be evaluated | ||
| Water squirt bottle | |||
| Metal spoon/spatula | |||
| Thin paintbrush | e.g., a "liner" | ||
| Glass cavity dish | |||
| PAP pen: Super PAP PEN IM3580 | Beckman Coulter | ||
| Glass slides | Each slide will have 5 or more PAP PEN squares drawn on them. Size of squares depends on the imaging objective and magnification of the microscope camera; e.g., 2 mm squares. | ||
| Moist chamber | This will be used to prevent slides and wells from drying out: sealed container with wet paper towels lining the sides/bottom | ||
| Schneider’s Drosophila cell culture media | Invitrogen | ||
| Cold block | This is a metal block (a.k.a. heating block) chilled in bucket containing ice; preferably black-colored or other dark, non-reflective color | ||
| 2 x 1 ml syringes with needles (27 G ½") | Becton Dickinson | For dissections. | |
| Optional: Surgical spring scissors (cutting edge 2 mm) | Fine Science Tools | ||
| Glass beads, 212 - 600 μm | Sigma | ||
| 2 ml Eppendorf tubes | Eppendorf | One per genotype evaluating | |
| Vortex mixer | Fisher Scientific | ||
| Transgenic Drosophila larvae with fluorescently marked hemocytes. | Suitable transgenes include: HmlΔ-DsRed (Makhijani et al., 2011), MSNF9mo-mCherry (Tokusumi et al., 2009), BcF6-CFP and -GFP (Gajewski et al., 2007), or HmlΔ-GAL4 (Sinenko and Mathey-Prevot, 2004), Pxn-GAL4 (Stramer et al., 2005), He-GAL4 (Zettervall et al., 2004), Crq-GAL4 (by H. Agaisse (Stramer et al., 2005)), or eater-GAL4 (Tokusumi et al., 2009) combined with UAS-GFP or other fluorescent protein transgenes. | ||
| Fluorescence dissecting microscope | Leica | Here: Leica M205, optional with camera, imaging software and measuring module | |
| Inverted fluorescence microscope with camera attachment | Leica or Keyence | With or without tile scanning function (e.g., Leica DMI series, Keyence BIOREVO BZ-9000 series) |
Referenzen
- Lemaitre, B., Hoffmann, J. The host defense of Drosophila melanogaster. Annu Rev Immunol. 25, 697-743 (2007).
- Evans, C. J., Hartenstein, V., Banerjee, U. Thicker than blood: conserved mechanisms in Drosophila and vertebrate hematopoiesis. Dev Cell. 5, 673-690 (2003).
- Wood, W., Jacinto, A. Drosophila melanogaster embryonic haemocytes: masters of multitasking. Nat Rev Mol Cell Biol. 8, 542-551 (2007).
- Gold, K. S., Brückner, K. Drosophila as a model for the two myeloid blood cell systems in vertebrates. Experimental hematology. 42, 717-727 (2014).
- Makhijani, K., Brückner, K. Of blood cells and the nervous system: Hematopoiesis in the Drosophila larva. Fly. 6, 254-260 (2012).
- Makhijani, K., Alexander, B., Tanaka, T., Rulifson, E., Brückner, K. The peripheral nervous system supports blood cell homing and survival in the Drosophila larva. Development. 138, 5379-5391 (2011).
- Lanot, R., Zachary, D., Holder, F., Meister, M. Postembryonic hematopoiesis in Drosophila. Dev Biol. 230, 243-257 (2001).
- Holz, A., Bossinger, B., Strasser, T., Janning, W., Klapper, R. The two origins of hemocytes in Drosophila. Development. 130, 4955-4962 (2003).
- Sieweke, M. H., Allen, J. E. Beyond stem cells: self-renewal of differentiated macrophages. Science. 342, 1242974 (2013).
- Davies, L. C., Jenkins, S. J., Allen, J. E., Taylor, P. R. Tissue-resident macrophages. Nature immunology. 14, 986-995 (2013).
- Bretscher, A. J., et al. The Nimrod transmembrane receptor Eater is required for hemocyte attachment to the sessile compartment in Drosophila melanogaster. Biology Open. 1-9, (2015).
- Leitao, A. B., Sucena, E. Drosophila sessile hemocyte clusters are true hematopoietic tissues that regulate larval blood cell differentiation. eLife. , (2015).
- Markus, R., et al. Sessile hemocytes as a hematopoietic compartment in Drosophila melanogaster. Proc Natl Acad Sci U S A. 106, 4805-4809 (2009).
- Babcock, D. T., et al. Circulating blood cells function as a surveillance system for damaged tissue in Drosophila larvae. Proc Natl Acad Sci USA. 105, 10017-10022 (2008).
- Sinenko, S. A., Mathey-Prevot, B. Increased expression of Drosophila tetraspanin, Tsp68C, suppresses the abnormal proliferation of ytr-deficient and Ras/Raf-activated hemocytes. Oncogene. 23, 9120-9128 (2004).
- Stramer, B., et al. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. J Cell Biol. 168, 567-573 (2005).
- Tokusumi, T., Shoue, D. A., Tokusumi, Y., Stoller, J. R., Schulz, R. A. New hemocyte-specific enhancer-reporter transgenes for the analysis of hematopoiesis in Drosophila Genesis. 47, 771-774 (2009).
- Gajewski, K. M., et al. Identification of a crystal cell-specific enhancer of the black cells prophenoloxidase gene in Drosophila. Genesis. 45, 200-207 (2007).
- Lebestky, T., Chang, T., Hartenstein, V., Banerjee, U. Specification of Drosophila hematopoietic lineage by conserved transcription factors. Science. 288, 146-149 (2000).
- Zettervall, C. J., et al. A directed screen for genes involved in Drosophila blood cell activation. Proc Natl Acad Sci USA. 101, 14192-14197 (2004).
- Shim, J., Mukherjee, T., Banerjee, U. Direct sensing of systemic and nutritional signals by haematopoietic progenitors in Drosophila. Nature cell biology. 14, 394-400 (2012).
- Hartenstein, V. Blood cells and blood cell development in the animal kingdom. Annu Rev Cell Dev Biol. 22, 677-712 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten