Method Article
Опробование клеток крови народам
В этой статье
Резюме
Drosophila blood cells, or hemocytes, cycle between resident sites and circulation. In the larva, resident (sessile) hemocytes localize to inductive microenvironments, the Hematopoietic Pockets, while circulating hemocytes move freely in the hemolymph. The goal of this protocol is the standardized isolation and quantification of these two, behaviorally distinct but interchanging, hemocyte populations.
Аннотация
У позвоночных, кроветворения регулируется индуктивных микросреды (ниши). Точно так же, в беспозвоночных модель организма дрозофилы, индуктивные микросреды, известные как личинки кроветворных Карманы (НР) были определены в качестве анатомических участков для развития и регулирования крови (гемоцитов), в частности, самообновлению макрофагов. НР являются сегментно повторяется карманы между эпидермисом и мышечных слоев личинки, что также включают сенсорные нейроны периферической нервной системы. В личинки, резиденты (неподвижных) гемоцитов воздействию антиапоптозную, клея и пролиферативных сигналы от этих сенсорных нейронов и потенциально других компонентов НР, таких как мышцы и футеровки эпителиальных слоев. Во время нормального развития, постепенного высвобождения гемоцитах резидентов от ГЭС топлива население оборотных гемоцитах, который завершается в освобождении месул-резидентов гемоцитах в начале метаморфоза. Иммунные нападения, физические травмы или механическое нарушение вызвать преждевременное высвобождение гемоцитах резидентов в обращении. Выключатель личинок гемоцитах между резидентами и местах обращения возникает необходимость общей стандартной процедуры / избирательно изолировать и количественно эти две популяции клеток крови из одного личинок дрозофилы. Соответственно, этот протокол описывает метод автоматического освободить и количественно житель и циркулирующих гемоцитов из одной личинки. Метод способствует исключая виво подходы, и может быть адаптирован к служить различные стадии развития дрозофилы и других беспозвоночных организмов.
Введение
Исследования в беспозвоночных модели дрозофилы привела открытие врожденного иммунитета 1, и способствовало понимание различных аспектов развития клеток крови 2-4. Дрозофилы кроветворение можно разделить на линии эмбриональных / личиночной гемоцитах, которые происходят в эмбрион и расширяться в личинки, и родословная лимфатических желез гемоциты 4,5. Здесь мы приводим протокол, который сосредотачивается на линии эмбриональных / личиночной гемоцитах, которые в личинки дрозофилы в основном содержит плазматоцитов (макрофаги) и несколько кристаллов 4 клетки. В личинки, гемоциты эмбриона сохраняются и колонизировать сегментарно повторные и терминальные кроветворных Карманы (HPS), расположенных между эпидермисом и мышечными слоями личиночной стенки тела 5,6. На основании своей природе, как самообновляющихся макрофагов 6, их преимущественного проживания в местных микросреды ткани 6, 7, и их происхождение с самых ранних клеток крови, возникающих при разработке 6,8, это население клеток крови считается похож на позвоночных самообновляющихся тканевых макрофагов, независимого миелоидной недавно идентифицированного в различных видов 4,9,10. Тем не менее, у дрозофилы, некоторые или все из этих резидентных клеток также показывают, пластичность, чтобы привести к другим типам клеток крови, таких как кристаллических ячеек 11,12.
Личинки гемоциты преимущественно житель (сидячие), но находятся в динамическом стационарном между различными НР. Они постепенно выпустили в обращение, в частности, в 3-й возрастной стадии личинки подходы pupariation 5-7. Иммунные проблемы, травмы или механическое нарушение приводит к преждевременной, в последнем случае обратимых, мобилизация резидентов гемоцитах в гемолимфе 4,6,13.
Предыдущие исследования показали, что житель и оборотныхличинок гемоциты имеют то же происхождение, но отличаются в своих липких или самонаведения свойств 6,7,13,14. Селективная изоляция оборотных против резидентов гемоцитах показал повышенные уровни распространения в популяции резидента гемоцитов, предполагая, их воздействие на индуктивных сигналов от личиночной НР НР 6. Drosophila выложены эпидермиса и мышечных слоев и далее укрывают сенсорного нейрона кластеры периферической нервной системы (ПНС) и функции печени, напоминающие oenocytes 6. Функционально, мутантные и генетические эксперименты клеток абляции показали, что сенсорные нейроны, присутствующие в НР поддерживать трофическую выживание и локализации личинок гемоцитах 6.
Здесь мы опишем метод для конкретного изоляции и количественного резидента и оборотных гемоцитах из одной личинки дрозофилы, и протокол для механической мобилизации гемоцитов. Эти методы могут быть использованы для экс вивоИзучение гемоцитов и может быть выполнено с возможностью других стадиях развития Drosophila, таких как куколки и взрослые, и других беспозвоночных систем. Так предыдущие исследования не отличить жителя и оборотных гемоцитах, этот протокол обеспечивает общий стандарт для изучения резидентов клеток крови и поможет повысить согласованность беспозвоночных исследования клеток крови.
Во-первых, гемоцитов Кровотечение / Скрип Анализ описывает дифференциальный изоляции и автоматизированной количественной флуоресцентной жителя белка отмечается и оборотных форменные элементы крови от одного населения личинок дрозофилы; Протокол предусматривает два варианта для постоянных и плитки сканирования оборудованных микроскопами (рисунок 1). В результате процент циркулирующих гемоцитов и общее количество гемоцитов в личинки получены. Метод основан на трансгенных личинок дрозофилы, которые выражают флуоресцентного белка среди их клетки кровиНаселение. Выбор водителя гемоцитов или репортера определяет исход, т.е., что популяция клеток крови визуализируется и количественно. Для маркировки, главным образом, макрофаги (плазматоцитов), которые составляют подавляющее большинство резидента и циркулирующей гемоцитов населения личинки дрозофилы 6, подходящие трансгены включают Hml Д-6, DsRed HmlΔ -GAL4 15 Рхп -GAL4 16 CRQ-GAL4 (по Х. Agaisse 16), или пожиратель-GAL4 17; для маркировки относительно небольшое население кристаллических ячеек, подходящих линий BcF6-КФП и -GFP 18, или LZ-GAL4 (Дж Поллока 19); для маркировки lamellocytes, специализированный тип клеток, главным образом, индуцируется иммунной проблем и травм 13, например, MSNF9mo-mCherry могут быть использованы 17. Некоторые водители трансгенные выражены в диапазоне дифференцированного кровиклетки и клетки-предшественники, такие как он - GAL4 20, маркирует около 80% всех личинок кровяных клеток. 20 Пожалуйста, обратите внимание, что во всех случаях, когда используются драйверы Gal4, сочетание с UAS-GFP или другого флуоресцентного белка UAS-трансгена требуется. В разделе Результаты, этот метод используется для мониторинга количества клеток крови и поведение циркуляции в течение личиночного развития.
Во-вторых, гемоцитов Нарушение Анализ описывает предыдущий шаг, предназначенный для отсоединения резидентов гемоциты внешней манипуляции, которые впоследствии позволяет оценить способности гемоцитов повторного соблюдайте и домой НР в течение ограниченного периода времени (30 - 60 мин) 6. Обычно этот анализ сопровождается Bleed / Scrape анализа для определения процентного содержания циркулирующих гемоцитов в личинки. Мы представляем упрощенную протокол для этого анализа (рис 1D), которая использует нарушение встряхиванием остроумияч стеклянные бусы, а не манипулирование одной личинки с кистью, как описано ранее 6. В разделе Результаты этого анализа используется для демонстрации того, что временно удаленные гемоциты поплавок в гемолимфе и могут быть восстановлены во фракции циркулирующих гемоцитов. Анализ также полезно для количественной оценки различий в их гемоцитах самонаведения / адгезией к резидентам сайтов, сравнивая, например, различные генетические, фоны или условия стимуляции. Пожалуйста, обратите внимание, что эта механическая манипуляция отражает обратимый процесс и отличается от infection- или травмы, вызванной мобилизации житель гемоцитов, которые обычно не обратимы в короткий промежуток времени 4,13.
протокол
1. Кровотечение гемоцитов / Скрип Анализ
- Подготовка слайдов:
- Вариант 1 для микроскопов без функции сканирования плитки: Для каждого личинка быть проанализированы, подготовить один предметное стекло с около 5 Мазок-Pen скважин 2 мм квадратов, каждый, соответствующая полю области просмотра микроскопа; добавить приблизительно 5 - 10 мкл S2 СМИ к каждому (рис 1А). Держите слайды во влажной камере, чтобы предотвратить скважин от высыхания.
- Вариант 2 для микроскопов с функцией сканирования плитка: Для каждого личинка быть проанализированы, подготовить один стекло с 3 до 4 Пап-перьевых скважин ~ 3 - 4 мм квадратов каждый; добавить приблизительно 15 - 20 мкл S2 СМИ в каждую лунку (рис 1B). Держите слайды во влажной камере, чтобы предотвратить скважин от высыхания.
ПРИМЕЧАНИЕ: выше Рекомендуемое количество скважин достаточно для сумм до 3000 гемоцитах в личинки (в конце 2-й возрастной стадии личинок, ~ 2,5 - 3 мм Длина, трансген маркировка большинство larvаль клетки крови). При оценке большего числа клеток крови, больше скважин могут быть необходимы, чтобы избежать перенаселенности.
- Коллекция личинок:
- Squirt воды в лету флакон, содержащий личинки и флеш личинки в чашку Петри, или зачерпнуть пищу, которая содержит личинки в чашку Петри и разбавить водой, используя бутылку шприца.
- Аккуратно выбрать личинок из чашки Петри с помощью кисти и поместите их в воде в полости блюдо или на слайде на холодную блока.
ПРИМЕЧАНИЕ: Личинки могут храниться в течение ограниченного времени в воде или на холодном блоке; использовать образцы в пределах 45 мин или менее, чтобы избежать личиночной смерти или нежелательные эффекты на гемоцитах.
- Вскрытие:
- Выбор личинок под флуоресцентным микроскопом в холодный металлический блок. Измерьте размеры и личинок изображения, если это необходимо.
- Выделение оборотных гемоциты ("Bleed"):
- После того, как личинки выбираются, положите одну личинку в первом Пап-перо а (рис 1С,2А).
- Используйте 2 чистые иглы или рассекает ножницы и пинцет, чтобы сделать разрез на обоих задних и передних концах личинки. Чтобы не беспокоить гемоциты резидентов, то лучше, чтобы сделать эти разрезы на брюшной стороне личинки. Для получения стабильных результатов, сделать надрезы в тех же местах, для каждого личинки. Для 1-го возрастной стадии личинок, 1 разрез (в брюшной передней) является достаточным.
- Разрешить личинки кровотечение в течение нескольких секунд без каких-либо давления или физическим перемешиванием (фиг.2А).
ПРИМЕЧАНИЕ: При работе на нескольких личинок лучше, чтобы сделать эти разрезы для каждого из, прежде чем приступить к следующему шагу, чтобы избежать сохранения личинок на льду слишком долго которые могут повлиять на целостность образцов. - Аккуратно поднимите личинку с иглами или пинцетом и опустите его в второй скважины для полоскания оставшиеся циркулирующих гемоцитов. После этого, следуйте с выходом форменных резидентов.
Выделение гемоцитах резидентов ("Скрип"): - Аккуратно перенести личинку в следующую лунку (фиг.2с).
- Определить лимфатических узлов личинки, которые, как правило находится примерно 1/3 от переднего конца личинки, и которые могут светиться дорсально через личиночной стенкой тела. Избегайте лимфатических узлов при освобождении резидентов гемоциты по сковав личинку с иглой, как можно ближе к лимфатических желез, чтобы избежать прокалывания (рис 2С).
Примечание: Во время нормального развития созревание лимфатических желез гемоцитов задерживается по сравнению с личинками гемоцитов и флуоресцентные репортеры дифференцированных гемоцитов может не показывать сигнал в лимфатических желез молодых личинок. В этих случаях, меньше внимания нужно уделить лимфатической железы, как и загрязнение дифференцированных флуоресцентно-меченных личинок гемоцитах по лимфатических узлов гемоцитах ожидается. - Отпустите резидентов клеток крови в dissectiна процесс выскабливание и / или тыкать. Используйте одну Кружево эффективно придавить личинку около лимфатических желез (см выше) или другие участки тела по мере необходимости. Используйте другой иглу воткнуть в кластерах гемоцитах, которые видны через личиночной стенки тела (рис 2С, Е), с целью отделить гемоциты. Гемоциты также может быть выпущен в движении выскабливание. Тем не менее, разрывая эпидермис рано может выпустить большие скопления клеток крови, которые могли бы сделать автоматизированный подсчет более сложным.
ПРИМЕЧАНИЕ: В зависимости от возраста и генотипа личинки, то общее количество форменных будет меняться. Распределить процесс освобождения, описанный выше в течение нескольких скважин, чтобы избежать переполненности некоторых скважинах с клетками крови, которые могли бы сделать один анализ клеточного изображения труднее. - Если несколько гемоцитов остаются в конечном каркаса, кол этих гемоцитов путем наблюдения под микроскопом и использование ручного подсчета в счетчике (рис 2E). Для облегчения подсчета, скружева тушу на чистую область того же слайда и распространить его как можно тоньше, чтобы уменьшить количество оптических плоскостей.
- После того, как вскрытие будет завершена, ждать от 5 - 10 мин для клеток урегулировать (но не обязательно придерживаться) перед визуализации скважин. Выдержите слайд во влажной камере, чтобы избежать высыхания, и избежать грубого обращения слайдов, которые могут нарушить устоявшиеся гемоциты.
ПРИМЕЧАНИЕ: При определении счету форменные элементы крови, высвобожденные клетки не являются фиксированными и клетки должны быть отображены после вскрытия вскоре, предпочтительно в течение 30 мин после выхода из личинки. В зависимости от объема средних и клеточных свойств, подавляющее большинство клеток будет решен в течение 5 - 10 мин, который должен быть подтвержден фокусировки с оптических плоскостей среды в скважине. Тем не менее, только часть клеток крови будет приклеиваться к поверхности скольжения к этому времени, факт, который должен быть рассмотрен, если изменения этого протокола для клеток фиксация основе approacheс.
- Количественное:
- Возьмите образы устоявшихся гемоцитах под флуоресцентным микроскопом (рис 2B, D, F). Следуйте с количественной гемоцитов с использованием программного обеспечения ImageJ.
- Подготовьте изображение для ImageJ алгоритма подсчета клеток:
- Открыть образ хорошо с использованием ImageJ: Файл → Открыть → (местонахождение файла и выбрать).
- Убедитесь, что изображение (ы): 8-бит или 16-бит. Отрегулируйте порог для изображения, выбрав изображение выберите Настройка и выберите Порог. Соблюдайте "Threshold окно" (рис 3а).
- Проверьте опцию "Темный фон". Выберите "Красный" и увеличить нижний уровень порога (см черную стрелку) до тех пор, каждая клетка в изображении не отмечен красной точкой (клеток, которые не покрыты можно будет увидеть в оттенках серого, рисунок 3б). Как нижний порогувеличивается некоторые клетки станут без опознавательных знаков. Это может быть показателем того, как далеко, чтобы установить нижний порог.
ПРИМЕЧАНИЕ: Иногда скопления клеток не могут быть решены и будут учитываться как один за прилавком частиц. В таких случаях, количество клеток в кластере можно оценить путем анализа изображения (увеличение при необходимости) и ручной подсчет с помощью счетчика итоговые. В качестве альтернативы, нижний порог может быть увеличена, чтобы решить кластеры клеток; любые немаркированных клеток, полученных этой манипуляции, то можно пересчитать с помощью Tally счетчик.
- Анализ количества клеток с помощью ImageJ:
- Запустите анализатор частиц сосчитать клетки (рис 3C). Выберите Анализ и нажмите на Анализ частиц. При желании выберите "Наложение Контуры", чтобы увидеть частицы кол алгоритм (рис 3D). Кроме того, установлено ограничение на размер или площадь пикселя блока (например,., Клетка, скопление клеток, и т.д.) для алгоритма рассчитывать.
- Нажмите OK. Соблюдайте итоговое окно с кол (рис 3Е).
2. Нарушение гемоцитов Анализ
- Чтобы беспокоить гемоциты, выберите личинок и поместить их в 2 мл микроцентрифужных трубки с приблизительно 0,5 г стеклянных шариков (212 - 600 мкм) и добавить 0,5 мл воды.
- Vortex трубку, вручную, на скорости 10 в течение 1 мин.
- Получить личинок из стеклянных бусин, пролив содержимое трубки микроцентрифужных в чашку Петри и выбирая личинок с кистью.
- Для фазы восстановления, поместить личинки в заранее подготовленные чашки Петри с небольшими количествами лету пищи. Разрешить личинки восстановить их гемоцитов образец в течение 45 мин или в качестве лучшего.
ПРИМЕЧАНИЕ: Отмена любых личинок, которые перестали двигаться, как они умерли в процессе. Тем не менее, мы обычно видим лittle повреждения после 1 мин встряхивания (см ниже и Справочная Рисунок 1). - После периода восстановления, по-прежнему с Bleed / Scrape анализе, как описано выше в разделе 1.
Результаты
Чтобы проиллюстрировать типичные результаты описанных методов, мы впервые использовали форменные элементы крови Bleed / скоблить Пробирной наметить прогрессирование личинок чисел гемоцитов и их место жительства за ходом развития гусениц (рисунок 4). Резидент и оборотных личинок населения форменные элементы крови были выделены из одного личинок (Hml Δ-GAL4, UAS-GFP, Он-GAL4 маркировать подавляющее большинство личинок гемоцитах) и количественно, используя ImageJ. Когорты личинок размером 1,2 мм (~ 48 ч AEL или 1-й возрастной стадии), 2,5 мм (~ 80 ч AEL или поздно 2-й возрастной стадии) и 3,5 мм (~ 96 ч AEL или 3-й возрастной стадии) были рассмотрены (фиг.4) , Число форменные элементы крови расширен в течение личиночного развития, соотнося с и превышение предыдущие оценки, основанные на световой микроскопии окрашенных красителе личинок 7 и живой подсчета флуоресцентный белок помечены гемоцитах через личиночной кутикулы 6. В 1-й модулейтар личинки почти все гемоциты проживали, в то время как доля оборотных гемоцитах постепенно увеличивать в течение личиночного развития (рис 4, б), в соответствии с предыдущих публикациях 6,7.
Далее мы исследовали добросовестно следит ли метод перехода между гемоцитах резидента и оборотных населения. Воспользовавшись явление, резиденты гемоциты можно временно отсоединить, механического возмущения и они вновь придерживаться своих сайтах резидентов спонтанно 6, мы разошлись резидентов гемоциты встряхиванием со стеклянными шариками, как описано в форменные элементы крови анормальных анализе. Действительно, механическое нарушение личинок привело к резкому увеличению населения циркулирующих гемоцитов за счет форменных резидентов (рисунок 5). После восстановительного периода 45 мин, гемоциты в значительной степени вернулись к клейкой государства, как путем визуального осмотра и АСsessed процент клеток, циркулирующих (рис 5D, Е). Как и ожидалось, общее количество гемоцитов оставались стабильными в течение долгого времени, несмотря на переход гемоцитов между оборотных и резидентов населения.
Несколько дополнительных соображений были приняты во внимание. Чтобы подтвердить, что вихревание не вызывает обширное повреждение ткани, встряхивая со стеклянными шариками проводилась в присутствии трипанового синего (Sigma) в течение различных периодов времени (1, 5, 20 мин). И 1 и 5 мин вихревание не приводит ни к каким очевидным ткани, в то время как 20 мин вихревание привело в небольших районах повреждения, напоминающие повреждения, вызванные игл стежки, используемых в качестве положительного контроля (Справочная Рисунок 1). В то время как внутренние повреждения эпидермиса или других тканей без повреждения кутикулы не может быть исключена, этот сценарий кажется маловероятным, как гемоцитов 1 мин и 5 мин обрабатывают личинки повторно придерживались в ожидаемой картины и времени, предполагая, личинки целостность не была компромиссомd (Справочная Рисунок 1). В противоположность этому, личинки перемешивали в течение 20 мин страдал от недостатка повторной адгезии, и даже не показывают прикрепление циркулирующих гемоцитов в эпидермальных раневых участков, как это было описано ранее 14.
Наконец, чтобы продемонстрировать воспроизводимости способа, мы сравнили биологических повторяет 2,5 мм личинок из указанных выше двух опытов, которые проводились с помощью различных экспериментаторов. Как показано на рисунке 2 Дополнительное, обеих группах показали сравнительно полные числа гемоцитов в личинки, а процент циркулирующих гемоцитов. Т испытания студентов не показали статистически значимых различий, предполагая, что метод является воспроизводимым и широко применяется.
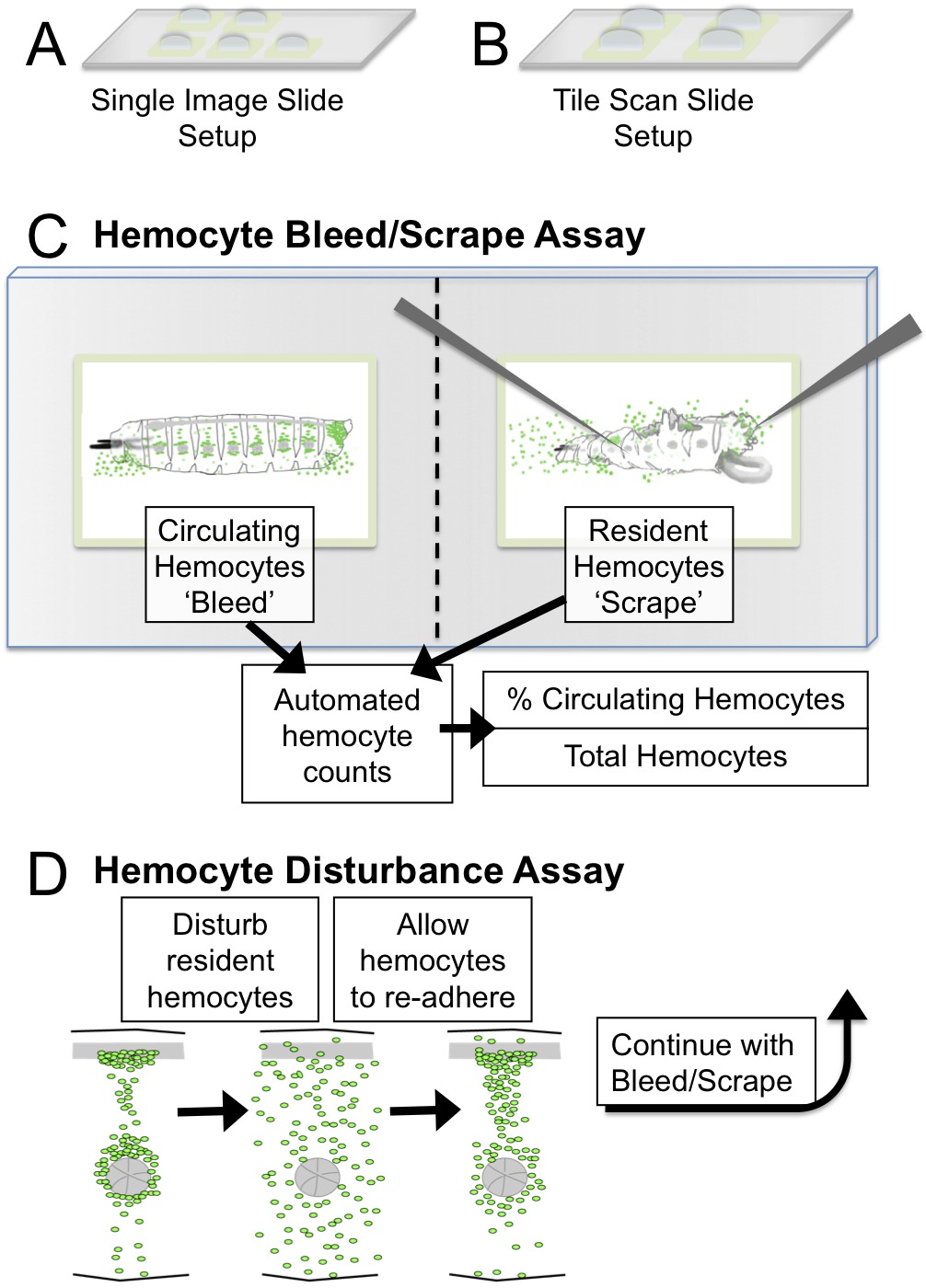
Рисунок 1. гемоцитов Кровотечение / лом и аварийных Анализ с Пуск в эксплуатацию и схематично. (А) Одно изображение Презентация установки: пять квадратов 2 мм для визуализации с целью 5X (Б) Плитка Настройка сканирования слайдов:. 3 мм четыре квадратов для кровотечения изображений / царапины на ≤2.5 мм личинок плитки микроскопом сканирования. Рекомендуемые цели визуализации являются 5X или 10X. (С) Выпускной / Скрип Аналитические схематические и в результате количественными использованием ImageJ. (D) В нарушение анализе, картина форменный элемент крови механически нарушен встряхиванием личинок со стеклянными шариками. Личинки могут восстановить в течение определенного периода 45 мин, в течение которого гемоцитов повторно прилипать к кроветворной карманов. Клеевые свойства форменных может быть оценена с помощью этого метода, количественной оценки процент форменных в обращении после возмущения. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
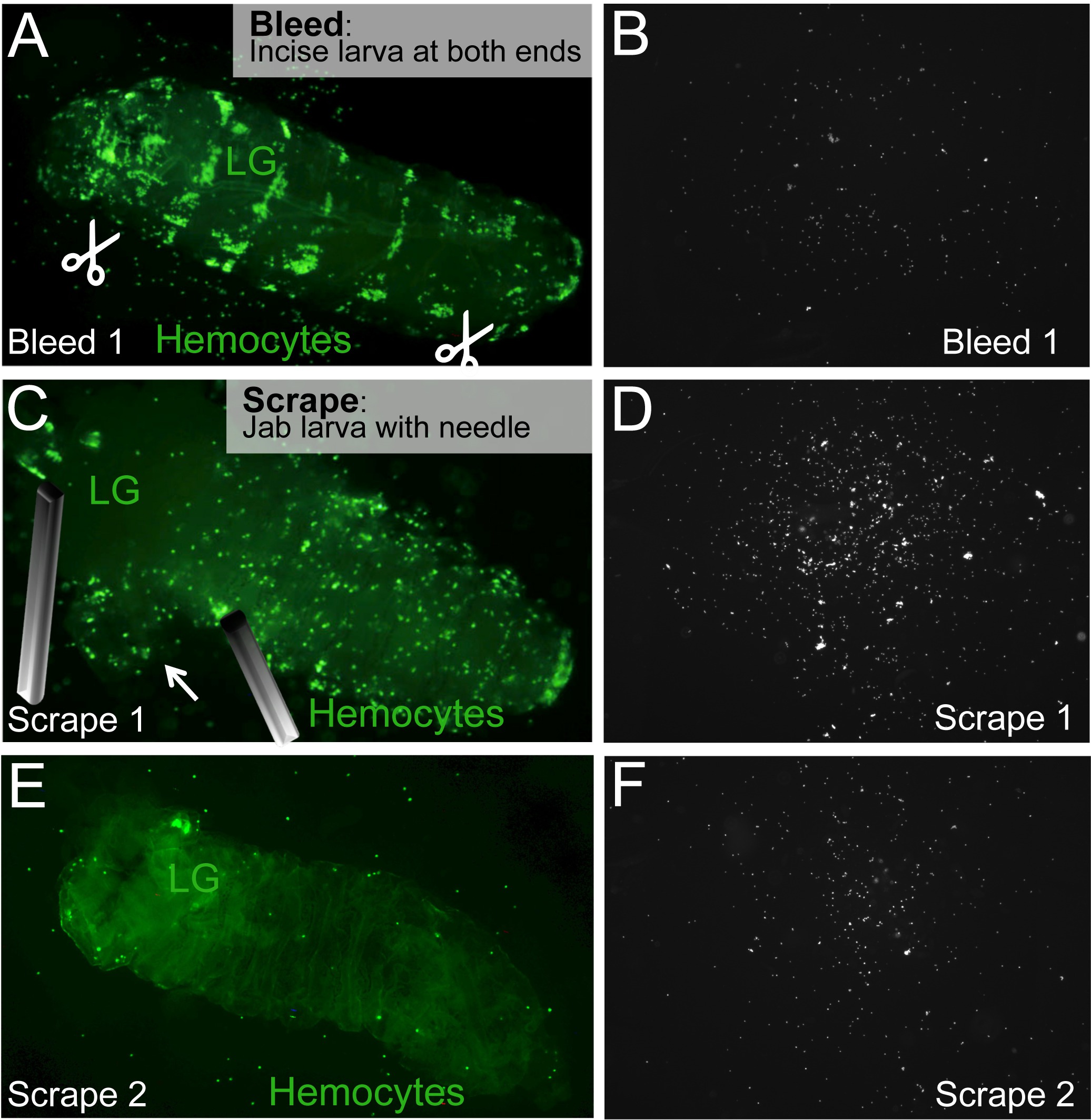
Рисунок 2. Кровотечение / Скрип Анализ выпустить оборотных и гемоциты резидентов. (A) Чтобы кровь личинки, брюшные разрезы на задних и передних концов личинки изготавливаются (ножницы символ). (Б) Гемоциты в обращении будет вытекать из разрезов и оседают на поверхности слайда. (С) Лимфа железы (LG) находится и скованы, не прокалывая его. Гемоциты резиденты освобождаются от тыча и / или выскабливание личинку с иглой. (D), резиденты гемоциты на слайде. (Е, F) Процесс Скрип повторяется, пока все гемоциты жителей не будут освобождены. Личиночная каркаса, содержащего неповрежденную лимфатических узлов остался позади. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
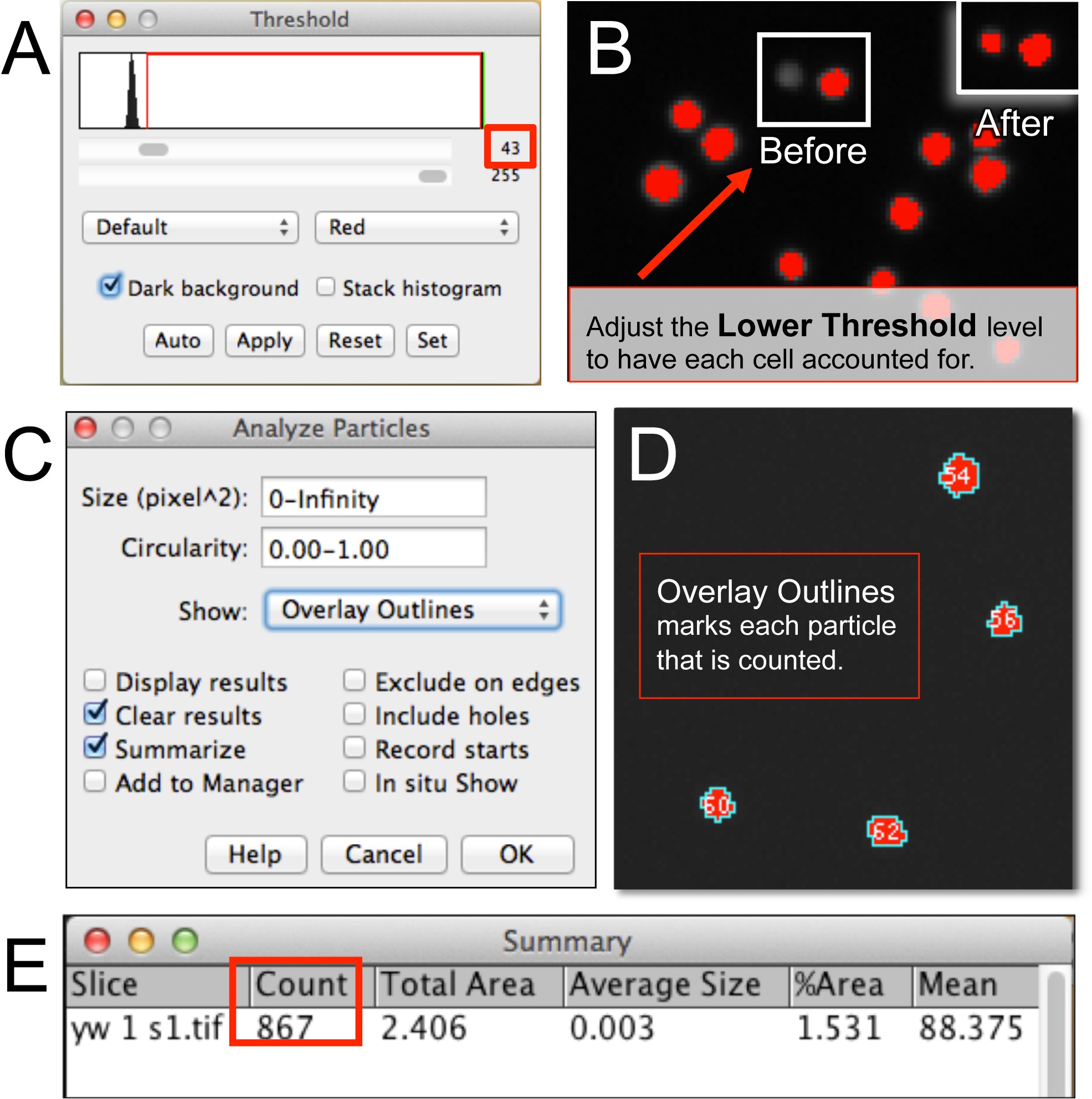
Рисунок 3. Автоматизированная количественное гемоцитах использованием ImageJ. (А, Б) После открытия файла форменный элемент крови изображения в ImageJ, Нижний Пороговый уровень устанавливается с учетом всех клеток в изображении. (С, D) Анализ Частицы требует установления размера ячейки пикселей, округлости, и результат считывания Формат (например, наложение Контуры). (Е) Резюме окно, отображающее количество форменных. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4. Представитель Результаты (1). Количество гемоцитов и резидентом государства над Курс развития личинок. (А) Обзор личиночной стадии, используемых; 1-й возрастной стадии (48 ч АЕЛ; ~ 1.2 мм длина); 2-й возрастной стадии (80 ч АЕЛ; 2,5 мм длина); 3-й возрастной стадии (96 ч АЕЛ; ~ 3.5 мм длина). Генотип Hml Δ-GAL4, UAS-GFP; Он-GAL4. Этапы были подтверждены оценки личинок mouthhooks. (Б) Бар схема циркуляции и цифры житель форменные элементы крови в соответствующих личиночной стадии. (С) в процентах оборотных гемоциты. Обратите внимание, что доля оборотных гемоцитах увеличивает непропорционально течение личиночного развития. (D) Всего гемоциты, в результате от суммы оборотных и гемоциты резидентов за личинки. Гемоциты были количественно, используя метод кровотечение / скоблить; п ≥ 6 личинки / состояние, ошибки полосы показывают стандартное отклонение, результаты подтвердили в 3 независимых экспериментах повторных.JPG "целевых =" _blank "> Нажмите здесь, чтобы посмотреть большую версию этой фигуры.
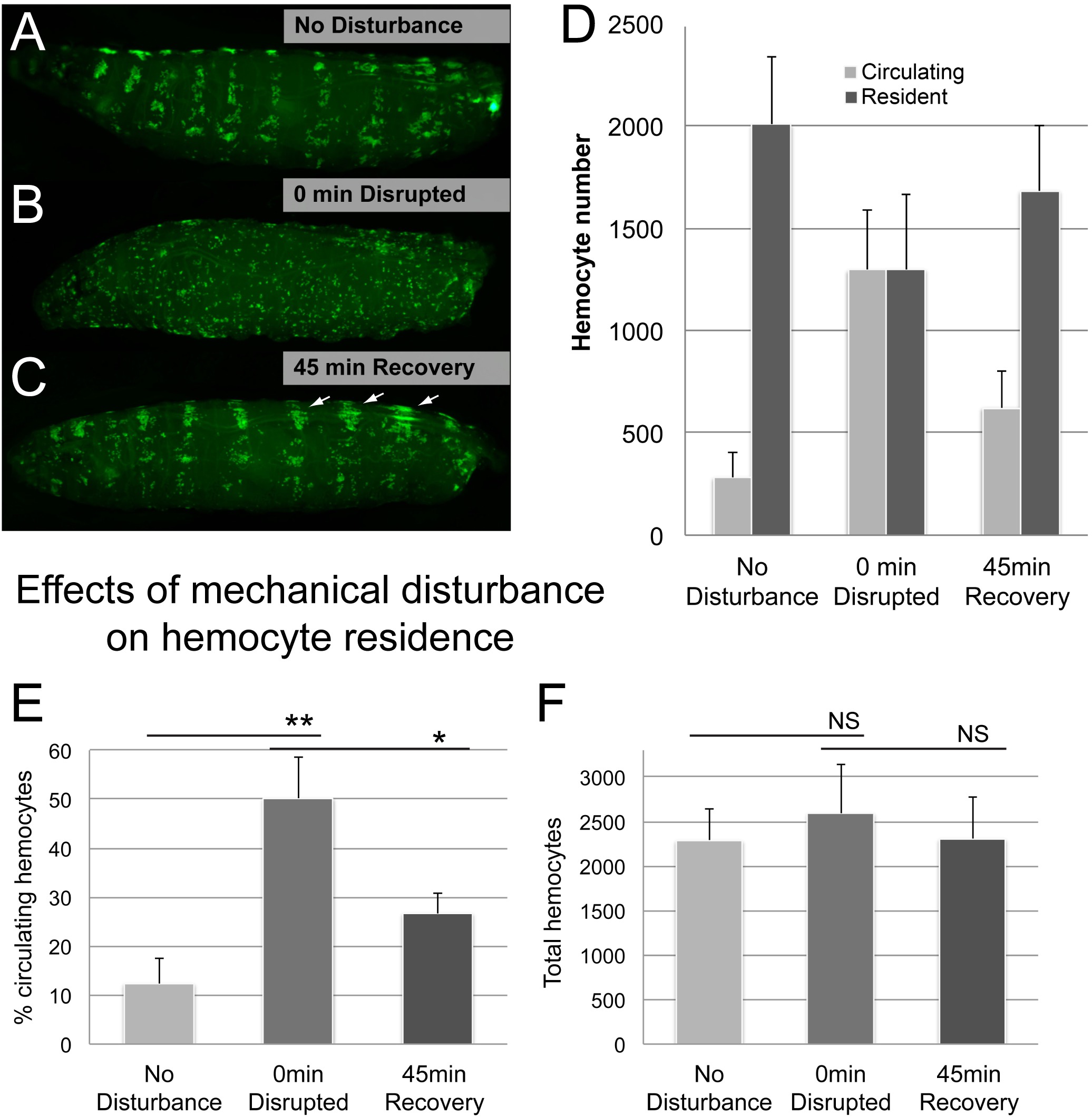
Рисунок 5. Представитель Результаты (2). Эффекты механического возмущения на гемоцитов проживания. (АС) Пример личинки до и после встряхивания со стеклянными шариками, с последующим восстановлением 45 мин (А) Нет Контроль нарушения. гемоциты локализованы в гемопоэтических Карманы (Б) нарушается рисунок гемоцитов при 0 мин после встряхивания личинок в суспензии стеклянных шариков и воды (С) гемоцитов модели в 45 мин восстановления после возмущения.. многие гемоциты переехали в гемопоэтических Карманы; обратите внимание, увеличенный спинной и емкости, связанные кластеры и спинной полосы, которые преобладают сайты начале накопления после возмущения (стрелки). Генотип Hml Δ-GAL4, UAS-GFP; Он-GAL4 х уш. (D), в процентах оборотных гемоциты количественно методом кровотечение / Scrape. (Е) Всего гемоциты, в результате от суммы оборотных и гемоциты резидентов за личинки. п ≥ 4 личинки / состояние, ошибки полосы показывают стандартное отклонение, результаты подтвердили в 3 независимых экспериментах повторных. T-тест Стьюдента для подтверждения значимости, Н. С. (не имеет значения), ** (р ≤ 0,05), ** (р ≤ 0,01). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Здесь мы опишем первый метод для количественного восстановления резидентов и циркулирующие в крови клетки от одного личинок дрозофилы, и количественно эти две популяции гемоцитов. Протокол включает в себя последовательный выпуск оборотных и резидентов клеток крови, а затем и автоматизированной обработки изображений подсчета клеток. Личинки гемоциты резиденты могут быть временно мобилизованы в обращение путем механического нарушения, процесс, который, как известно, в значительной степени восстанавливается в течение 30 - мин восстановительного периода 60 6. Соответственно, этот протокол был испытан в двух направлениях, (1) путем оценки общего числа гемоцитов за личинки и фракции циркулирующих гемоцитов в течение личиночного развития, и (2) экспериментально выбивании гемоцитов резидентные с использованием автоматизированного метода, который подтвердил тесная корреляция из гемоцитов локализации и гемоцитов числа в жителя и оборотных населения. Кроме того, воспроизводимость метода была продемонстрирована путем совместнойmparing два набора данных биологических повторностях.
В прошлом, лаборатории использовали ряд методов для количественной оценки личинок гемоциты 6,13,21. Этот протокол устанавливает общий стандарт для получения и количественно-резидентов и циркулирующих клеточных популяций крови от личинок дрозофилы, обеспечивая легко адаптируемые платформу. Метод, описанный имеет решающее значение для исследований, которые сосредоточены на роли гемоцитах резидентов и их микросреды, кроветворной Карманы 4-6, и подходит для изучения флуоресцентный белок трансгенных несущих штаммов дрозофилы в дикого типа и генетически модифицированных фоны. Протокол также имеет отношение к исследованиям, которые сосредоточены на мобилизации гемоцитов после иммунной вызов или травмы, и генетически или экологически индуцированной сигнализации, который вызывает мобилизацию резидентов гемоцитах или изменения в общем количестве гемоцитов (обзор 4). Следует отметить, что в случаях преждевременной диfferentiation и выпуск гемоцитов из лимфатических желез, выделения эмбриональных / личинок по сравнению с лимфатических узлов линий может быть ограничена паттерна экспрессии флуоресцентного гемоцитов репортера используется.
Протокол, представленные здесь опирается на живого изображения, флуоресцентно-меченных гемоцитах. В будущем, она может быть изменена, чтобы позволить обнаружение высвобожденные клетки после фиксации, например, с помощью иммуноцитохимии. В этом случае протокол может должны быть адаптированы, чтобы обеспечить полное склеивание клеток крови, например, путем увеличения времени адгезии инкубации и добавлением клейкой слайд покрытие, например, конканавалин А. Поскольку метод позволяет извлекать гемоцитов и их манипуляции экс естественных, это принесет пользу широкий спектр биологических и биохимических исследований с развитием, клеток. Резиденты и циркулирующей крови клетки находятся во всех постэмбрионального стадиях развития дрозофилы и других беспозвоночных, 22 suggestiнг, что адаптация этого метода выиграют широкий спектр исследований за пределами системы личинок Drosophila кроветворной.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Мы благодарим Йеспер Kronhamn и Дэна Hultmark, Майкл Galko, и Блумингтон Stock центр для запасов лету. Отдельное спасибо Кортни Онодера за советом с статистического анализа. Мы благодарим Катрина золото для критического чтения рукописи, и Калпана Макхиджани, Катрина Gold, сотрудников лаборатории Derynck и членов лаборатории Nystul для обсуждения и замечания по рукописи. Эта работа была поддержана грантами от программы UCSF для Прорыв биомедицинских исследований (PBBR), Широкий Центр, Hellman фонда, Американское общество рака RSG DDC-122595, американская ассоциация сердца 13BGIA13730001, Национальный научный фонд 1326268, Национальные институты здравоохранения и 1R01GM112083-01 1R56HL118726-01A1 (в КБ).
Материалы
| Name | Company | Catalog Number | Comments |
| 6 cm/9 cm Petri dishes | One for each genotype to be evaluated | ||
| Water squirt bottle | |||
| Metal spoon/spatula | |||
| Thin paintbrush | e.g., a "liner" | ||
| Glass cavity dish | |||
| PAP pen: Super PAP PEN IM3580 | Beckman Coulter | ||
| Glass slides | Each slide will have 5 or more PAP PEN squares drawn on them. Size of squares depends on the imaging objective and magnification of the microscope camera; e.g., 2 mm squares. | ||
| Moist chamber | This will be used to prevent slides and wells from drying out: sealed container with wet paper towels lining the sides/bottom | ||
| Schneider’s Drosophila cell culture media | Invitrogen | ||
| Cold block | This is a metal block (a.k.a. heating block) chilled in bucket containing ice; preferably black-colored or other dark, non-reflective color | ||
| 2 x 1 ml syringes with needles (27 G ½") | Becton Dickinson | For dissections. | |
| Optional: Surgical spring scissors (cutting edge 2 mm) | Fine Science Tools | ||
| Glass beads, 212 - 600 μm | Sigma | ||
| 2 ml Eppendorf tubes | Eppendorf | One per genotype evaluating | |
| Vortex mixer | Fisher Scientific | ||
| Transgenic Drosophila larvae with fluorescently marked hemocytes. | Suitable transgenes include: HmlΔ-DsRed (Makhijani et al., 2011), MSNF9mo-mCherry (Tokusumi et al., 2009), BcF6-CFP and -GFP (Gajewski et al., 2007), or HmlΔ-GAL4 (Sinenko and Mathey-Prevot, 2004), Pxn-GAL4 (Stramer et al., 2005), He-GAL4 (Zettervall et al., 2004), Crq-GAL4 (by H. Agaisse (Stramer et al., 2005)), or eater-GAL4 (Tokusumi et al., 2009) combined with UAS-GFP or other fluorescent protein transgenes. | ||
| Fluorescence dissecting microscope | Leica | Here: Leica M205, optional with camera, imaging software and measuring module | |
| Inverted fluorescence microscope with camera attachment | Leica or Keyence | With or without tile scanning function (e.g., Leica DMI series, Keyence BIOREVO BZ-9000 series) |
Ссылки
- Lemaitre, B., Hoffmann, J. The host defense of Drosophila melanogaster. Annu Rev Immunol. 25, 697-743 (2007).
- Evans, C. J., Hartenstein, V., Banerjee, U. Thicker than blood: conserved mechanisms in Drosophila and vertebrate hematopoiesis. Dev Cell. 5, 673-690 (2003).
- Wood, W., Jacinto, A. Drosophila melanogaster embryonic haemocytes: masters of multitasking. Nat Rev Mol Cell Biol. 8, 542-551 (2007).
- Gold, K. S., Brückner, K. Drosophila as a model for the two myeloid blood cell systems in vertebrates. Experimental hematology. 42, 717-727 (2014).
- Makhijani, K., Brückner, K. Of blood cells and the nervous system: Hematopoiesis in the Drosophila larva. Fly. 6, 254-260 (2012).
- Makhijani, K., Alexander, B., Tanaka, T., Rulifson, E., Brückner, K. The peripheral nervous system supports blood cell homing and survival in the Drosophila larva. Development. 138, 5379-5391 (2011).
- Lanot, R., Zachary, D., Holder, F., Meister, M. Postembryonic hematopoiesis in Drosophila. Dev Biol. 230, 243-257 (2001).
- Holz, A., Bossinger, B., Strasser, T., Janning, W., Klapper, R. The two origins of hemocytes in Drosophila. Development. 130, 4955-4962 (2003).
- Sieweke, M. H., Allen, J. E. Beyond stem cells: self-renewal of differentiated macrophages. Science. 342, 1242974 (2013).
- Davies, L. C., Jenkins, S. J., Allen, J. E., Taylor, P. R. Tissue-resident macrophages. Nature immunology. 14, 986-995 (2013).
- Bretscher, A. J., et al. The Nimrod transmembrane receptor Eater is required for hemocyte attachment to the sessile compartment in Drosophila melanogaster. Biology Open. 1-9, (2015).
- Leitao, A. B., Sucena, E. Drosophila sessile hemocyte clusters are true hematopoietic tissues that regulate larval blood cell differentiation. eLife. , (2015).
- Markus, R., et al. Sessile hemocytes as a hematopoietic compartment in Drosophila melanogaster. Proc Natl Acad Sci U S A. 106, 4805-4809 (2009).
- Babcock, D. T., et al. Circulating blood cells function as a surveillance system for damaged tissue in Drosophila larvae. Proc Natl Acad Sci USA. 105, 10017-10022 (2008).
- Sinenko, S. A., Mathey-Prevot, B. Increased expression of Drosophila tetraspanin, Tsp68C, suppresses the abnormal proliferation of ytr-deficient and Ras/Raf-activated hemocytes. Oncogene. 23, 9120-9128 (2004).
- Stramer, B., et al. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. J Cell Biol. 168, 567-573 (2005).
- Tokusumi, T., Shoue, D. A., Tokusumi, Y., Stoller, J. R., Schulz, R. A. New hemocyte-specific enhancer-reporter transgenes for the analysis of hematopoiesis in Drosophila Genesis. 47, 771-774 (2009).
- Gajewski, K. M., et al. Identification of a crystal cell-specific enhancer of the black cells prophenoloxidase gene in Drosophila. Genesis. 45, 200-207 (2007).
- Lebestky, T., Chang, T., Hartenstein, V., Banerjee, U. Specification of Drosophila hematopoietic lineage by conserved transcription factors. Science. 288, 146-149 (2000).
- Zettervall, C. J., et al. A directed screen for genes involved in Drosophila blood cell activation. Proc Natl Acad Sci USA. 101, 14192-14197 (2004).
- Shim, J., Mukherjee, T., Banerjee, U. Direct sensing of systemic and nutritional signals by haematopoietic progenitors in Drosophila. Nature cell biology. 14, 394-400 (2012).
- Hartenstein, V. Blood cells and blood cell development in the animal kingdom. Annu Rev Cell Dev Biol. 22, 677-712 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены