Method Article
Analizando poblaciones de células sanguíneas de la
En este artículo
Resumen
Drosophila blood cells, or hemocytes, cycle between resident sites and circulation. In the larva, resident (sessile) hemocytes localize to inductive microenvironments, the Hematopoietic Pockets, while circulating hemocytes move freely in the hemolymph. The goal of this protocol is the standardized isolation and quantification of these two, behaviorally distinct but interchanging, hemocyte populations.
Resumen
En los vertebrados, la hematopoyesis está regulada por microambientes inductivas (nichos). Del mismo modo, en el modelo de invertebrados organismo Drosophila melanogaster, microambientes inductivos conocidos como bolsillos hematopoyéticas larvales (HPS) se han identificado como sitios anatómicos para el desarrollo y la regulación de la sangre células (hemocitos), en particular del linaje de los macrófagos auto-renovación. HPs son segmentally repetida bolsas entre la epidermis y las capas musculares de la larva, que también comprenden las neuronas sensoriales del sistema nervioso periférico. En la larva, residentes (sésiles) hemocitos están expuestos a anti-apoptótica, adhesivo y señales proliferativas de estas neuronas sensoriales y, potencialmente, otros componentes de los hps, tales como el músculo y las capas epiteliales de revestimiento. Durante el desarrollo normal, la liberación gradual de hemocitos residentes de los combustibles HPs la población de hemocitos circulantes, que culmina en la liberación de most de los hemocitos residentes en el inicio de la metamorfosis. Ataques inmunológicos, lesiones físicas o perturbación mecánica desencadenan la liberación prematura de hemocitos residentes en circulación. El interruptor de hemocitos de larvas entre ubicaciones residentes y la circulación plantea la necesidad de una norma / procedimiento común para aislar selectivamente y cuantificar estas dos poblaciones de células de sangre de larvas de Drosophila sola. En consecuencia, este protocolo describe un método automatizado para liberar y cuantificar el residente y hemocitos circulantes de larvas sola. El método facilita enfoques ex vivo, y puede ser adaptado para servir a una variedad de etapas de desarrollo de Drosophila y otros organismos invertebrados.
Introducción
La investigación en el modelo de invertebrados Drosophila melanogaster ha conducido al descubrimiento de la inmunidad innata 1, y ha facilitado la comprensión de diversos aspectos del desarrollo de células sanguíneas 2-4. Drosophila hematopoyesis se puede dividir en el linaje de hemocitos embrionarias / larvales, que se originan en el embrión y expandirse en la larva, y el linaje de los ganglios linfáticos hemocitos 4,5. A continuación, presentamos un protocolo que se centra en el linaje de hemocitos embrionarias / larval, que en la larva de Drosophila comprende principalmente plasmatocitos (macrófagos) y algunas células de cristal 4. En la larva, hemocitos del embrión persisten y colonizan bolsillos segmentally repetidas y terminales hematopoyéticas (HPS), ubicado entre la epidermis y las capas musculares de la pared del cuerpo larval 5,6. Sobre la base de su naturaleza como macrófagos auto-renovación de 6, su residencia predominante en microambientes tisulares locales 6, 7, y su linaje de las células sanguíneas más tempranos emergentes durante el desarrollo 6,8, esta población de células de la sangre se considera similar a los macrófagos del tejido de vertebrados auto-renovación, un linaje mieloide independiente recientemente identificado en una variedad de especies 4,9,10. Sin embargo, en Drosophila, algunas o todas de estas células residentes muestran también la plasticidad para dar lugar a otros tipos de células sanguíneas tales como células de cristal 11,12.
Hemocitos larvas son predominantemente residente (sésiles), pero están en un estado de equilibrio dinámico entre varias postas de salud. Se liberan progresivamente en circulación, en particular, como el estadio de larva 3ª acerca pupariation 5-7. Retos inmunes, lesión o perturbación mecánica de plomo a una prematura, en este último caso reversibles, la movilización de hemocitos residentes en la hemolinfa 4,6,13.
Estudios previos han sugerido que los residentes y circulanteshemocitos larvas son del mismo linaje, pero difieren en sus propiedades adhesivas o homing 6,7,13,14. Aislamiento selectivo de circulante frente hemocitos residentes reveló niveles elevados de proliferación en la población de hemocitos residente, lo que sugiere su exposición a las señales inductivas de las HPs larvas HPs 6. Drosophila están revestidos por epidermis y las capas musculares y albergar más racimos de neuronas sensoriales del sistema nervioso periférico (SNP) y la función hepática se asemeja oenocytes 6. Funcionalmente, los experimentos de ablación de células mutantes y genéticos han demostrado que las neuronas sensoriales presentes en los HPs apoyar la supervivencia trófico y localización de los hemocitos de las larvas 6.
Aquí se describe un método para el aislamiento específico y cuantificación de residentes y circulantes hemocitos de las larvas de Drosophila sola, y un protocolo para la movilización de hemocitos mecánica. Los métodos se pueden utilizar para la ex vivoestudio de hemocitos y, además se puede adaptar a otras etapas de desarrollo de Drosophila tales como la pupa y adulto, y otros sistemas de invertebrados. Dado que los estudios anteriores no distinguen entre los residentes y los hemocitos circulantes, este protocolo ofrece un estándar común para el estudio de las células sanguíneas residentes y ayudará a aumentar la coherencia de la investigación con células de sangre de invertebrados.
En primer lugar, la purga / Ensayo Raspe Hemocyte describe el aislamiento diferencial y cuantificación automática de residente proteína marcada fluorescente y circula poblaciones hemocitos de las larvas de Drosophila sola; el protocolo ofrece dos opciones para microscopios comunes y azulejos equipadas escanear (Figura 1). Como resultado, se obtienen el porcentaje de hemocitos circulantes y el número total de hemocitos por larva. El método se basa en larvas de Drosophila transgénicos que expresan la proteína fluorescente entre sus células de la sangrepoblación. La elección del conductor hemocyte o reportero determina el resultado, es decir, que se visualiza población de células de la sangre y se cuantifica. Para etiquetar principalmente macrófagos (plasmatocitos), que comprenden la gran mayoría de la población residente y de circulación de hemocitos de la larva de Drosophila 6, transgenes adecuados incluyen Hml Δ-DsRed 6, HmlΔ Gal4 15, Pxn Gal4 16, CRQ-GAL4 (por H. Agaisse 16), o come-GAL4 17; para el etiquetado de la relativamente pequeña población de células de cristal, líneas adecuadas son BcF6-PPC y GFP 18 o lz-GAL4 (por J. Pollock 19); para lamellocytes etiquetado, un tipo de célula especializada inducida principalmente por los retos y las lesiones 13 inmunes, por ejemplo, MSNF9mo-mCherry se puede utilizar 17. Algunos conductores transgénicas se expresan en una amplia gama de sangre diferenciadacélulas y progenitores, tales como He - GAL4 20, que las etiquetas de alrededor del 80% de todas las células de la sangre de larvas 20. Tenga en cuenta que en todos los casos en que se utilizan los conductores GAL4, se requiere combinación con UAS-GFP u otra proteína UAS-transgén fluorescente. En la sección Resultados, este método se utiliza para supervisar el número de células de la sangre y el comportamiento de circulación en el transcurso del desarrollo de las larvas.
En segundo lugar, la perturbación Ensayo Hemocyte describe una etapa precedente diseñado para separar los hemocitos residentes por manipulación externa, lo que permite posteriormente la evaluación de la capacidad de los hemocitos de volver a adherirse y el hogar de HPs dentro de un marco de tiempo limitado (30 - 60 min) 6. Típicamente este ensayo es seguido por el / Ensayo Raspe Bleed para determinar el porcentaje de hemocitos circulantes por larva. Se presenta un protocolo simplificado para este ensayo (Figura 1 D), que utiliza la perturbación por el ingenio vórtexperlas de vidrio h, en lugar de manipulación de la larva individual con un cepillo de pintura como se ha descrito previamente 6. En la sección de resultados, este ensayo se usa para demostrar que flotador hemocitos transitoriamente individual en la hemolinfa y puede ser recuperada en la fracción de hemocitos circulantes. El ensayo también es útil para cuantificar las diferencias de hemocitos en su homing / adherencia a los sitios residentes, comparando por ejemplo, los diversos antecedentes genéticos o condiciones de estimulación. Tenga en cuenta que esta manipulación mecánica refleja un proceso reversible y es distinta de la movilización hemocyte residente Infección o inducida por la lesión, que por lo general no son reversibles en un corto período de tiempo 4,13.
Protocolo
1. Hemocyte Bleed / Ensayo Raspe
- Preparación de diapositivas:
- Opción 1 para los microscopios de barrido baldosas sin función: Para cada larva a analizar, preparará un portaobjetos de vidrio con cerca de 5 pozos Pap-pluma de 2 mm cuadrados cada una, correspondiente a la zona de visión de campo del microscopio; añadir aproximadamente 5 - 10 l de los medios de comunicación a cada S2 (Figura 1A). Mantenga portaobjetos en cámara húmeda para evitar que los pozos se sequen.
- Opción 2 para microscopios con función de exploración del azulejo: Para cada larva a analizar, preparar una diapositiva de cristal con 3 a 4 pozos Pap-pluma de ~ 3 - 4 mm cuadrados cada uno; añadir aproximadamente 15 - 20 l de los medios de comunicación S2 a cada pocillo (Figura 1B). Mantenga portaobjetos en cámara húmeda para evitar que los pozos se sequen.
NOTA: El número de arriba recomendada de pozos es suficiente para los totales de hasta 3.000 hemocitos por larva (finales de larvas 2º, ~ 2,5-3 mm de longitud, transgén etiquetar la mayoría de larval células sanguíneas). Al evaluar el número de células de sangre más grandes, podrían ser necesarios más pozos para evitar el hacinamiento.
- Colección de larvas:
- Aplique agua en un vial que contiene larvas de mosca y larvas a ras en una placa de Petri, o cuchara algo de comida que contiene larvas en una placa Petri y se diluye con agua usando una botella con atomizador.
- Recoger suavemente las larvas de la placa de Petri con un pincel y colocarlos en el agua en un plato de cavidad o en una diapositiva en un bloque frío.
NOTA: Las larvas se puede mantener durante un tiempo limitado en el agua o en un bloque de frío; utilizar muestras dentro de 45 minutos o menos para evitar la muerte de las larvas o los efectos no deseados en hemocitos.
- Disección:
- Seleccionar larvas bajo un microscopio de fluorescencia en un bloque de metal frío. Mida tamaños y larvas imagen si lo desea.
- Aislamiento de hemocitos circulantes ("Bleed"):
- Una vez que se seleccionan las larvas, coloque una larva en el primer Pap-pen así (Figura 1C,2A).
- Utilice 2 agujas limpias o tijeras de disección y pinzas para hacer una incisión en los extremos anterior y posterior de la larva. Para evitar molestar hemocitos residentes, lo mejor es hacer las incisiones en la parte ventral de la larva. Para obtener resultados consistentes, hacer las incisiones en los mismos lugares por cada larva. Por 1ª estadio las larvas, 1 incisión (en el ventral anterior) es suficiente.
- Permita larva a sangrar durante unos segundos y sin ningún tipo de presión o agitación física (Figura 2).
NOTA: Si está trabajando en larvas múltiple es mejor hacer estas incisiones para cada uno antes de continuar con el siguiente paso para evitar mantener las larvas en el hielo demasiado tiempo que podría afectar a la integridad de las muestras. - Levante con cuidado la larva con las agujas o fórceps e introducirlo en el segundo pozo para enjuagar cualquier hemocitos circulantes restantes. Después de eso, siga con el lanzamiento de hemocitos residentes.
- El aislamiento de hemocitos residentes ("Raspe"):
- Transferir suavemente la larva al siguiente pozo (Figura 2C).
- Identificar la glándula de la linfa de la larva, que normalmente se encuentra aproximadamente a un tercio desde el extremo anterior de la larva, y que puede emitir fluorescencia dorsalmente a través de la pared del cuerpo larval. Evite la glándula linfática mientras suelta hemocitos residentes fijando por la larva con una aguja lo más cerca posible a la glándula de la linfa para evitar la punción (Figura 2C).
NOTA: Durante el desarrollo normal de la maduración de las glándulas linfáticas hemocitos se retrasa en comparación con hemocitos larvarios, y los reporteros fluorescentes de hemocitos diferenciadas no puede mostrar una señal en la glándula de la linfa de las larvas jóvenes. En estos casos, necesita menos atención a pagar a la glándula linfática como no hay contaminación del diferenciados hemocitos larvales marcados con fluorescencia por hemocitos de las glándulas de la linfa que se espera. - Suelte glóbulos residentes en un dissectiel proceso de raspado y / o golpeando. Utilice una punta de aguja para fijar de manera efectiva por la larva, cerca de la glándula linfática (ver arriba) u otras áreas del cuerpo como sea necesario. Utilice otra aguja para pinchar en los grupos de hemocitos que son visibles a través de la pared corporal de larvas (Figura 2C, E), con el objetivo de separar los hemocitos. Hemocitos también puede ser liberado en un movimiento de raspado. Sin embargo, rasgando la epidermis temprana puede liberar grandes racimos de células de la sangre, lo que podría hacer el conteo automatizado más difícil.
NOTA: Dependiendo de la edad y el genotipo de la larva, el número de hemocitos totales variará. Distribuir el proceso de liberación se ha descrito anteriormente en varios pozos para evitar el hacinamiento de algunos pozos con células de la sangre, lo que podría hacer que el análisis de imágenes de células individuales más difícil. - Si algunos hemocitos permanecen en la canal final, contar estos hemocitos por observación a través del microscopio y el uso de un contador de conteo manual (Figura 2E). Para facilitar el recuento, pencaje de la carcasa en un área limpia de la misma diapositiva y difundirlo lo más finas posible para reducir el número de planos ópticos.
- Una vez que la disección está completa, espere entre el 5 - 10 min para sedimentar las células (pero no necesariamente se adhieren) antes de la formación de imágenes de los pozos. Incubar el portaobjetos en una cámara húmeda para evitar la desecación, y evitar la manipulación brusca de las diapositivas, que podrían perturbar los hemocitos asentadas.
NOTA: Cuando se determinan los recuentos de hemocitos, células liberadas no son fijos y las células deben obtener imágenes poco después de la disección, preferiblemente dentro de 30 minutos después de la liberación de la larva. Dependiendo del volumen de medio y celulares propiedades, la gran mayoría de las células se han asentado dentro de 5 a 10 minutos, que debe ser confirmado por centrarse través de los planos ópticas del medio en el pozo. Sin embargo, sólo una fracción de células de la sangre se han adherido a la superficie de deslizamiento en ese momento, un hecho que debe tenerse en cuenta si la modificación de este protocolo para approache basada fijación de célulass.
- Cuantificación:
- Tomar imágenes de los hemocitos asentados bajo un microscopio de fluorescencia (Figura 2 B, D, F). Siga con cuantificación de hemocitos utilizando el software ImageJ.
- Imagen Prepárese para ImageJ algoritmo de recuento de células:
- Abrir imagen del bien utilizando ImageJ: Archivo → Abrir → (localizar el archivo y seleccionar).
- Asegúrese de que la imagen (s) es de 8 bits o 16 bits. Ajuste el umbral para la imagen seleccionando Imagen y luego haga clic en Ajustar y seleccione Umbral. Observe la ventana "Umbral" (Figura 3A).
- Marque la opción "Fondo Oscuro". Seleccione "Red" y aumentar el nivel inferior de umbral (véase la flecha negro) hasta que cada célula en la imagen está marcado con un punto rojo (células que no están siendo cubiertos se verá en escala de grises; Figura 3B). A medida que el umbral inferiorse incrementaron algunas células se convertirán en no marcado. Esto puede ser el indicador de hasta qué punto para establecer el umbral inferior.
NOTA: De vez en cuando grupos de células no se pueden resolver y se cuentan como uno por el contador de partículas. En tales casos, el número de células en un clúster se puede estimar mediante el examen de la imagen (zoom si es necesario) y el conteo manual usando un contador de recuento. Alternativamente, el umbral inferior se puede aumentar para resolver grupos de células; las células no marcadas resultantes de esta manipulación se pueden entonces contaron usando un contador de recuento.
- Analizar el número de células usando ImageJ:
- Inicie el Analizador de partículas para contar las células (Figura 3C). Seleccione Analizar y haga clic en Analizar partículas. Opcionalmente seleccione "Overlay contornos" para ver las partículas de la cuenta algoritmo (Figura 3D). Alternativamente, establecer un límite para el tamaño o área de píxeles de una unidad (por ejemplo,., Célula, grupo de células, etc.) para el algoritmo para contar.
- Haga clic en Aceptar. Observar una ventana de resumen con el conde (Figura 3E).
2. Hemocyte Perturbación Ensayo
- Para molestar hemocitos, seleccione larvas y colocarlos en un tubo de microcentrífuga de 2 ml con aproximadamente 0,5 g de perlas de vidrio (212 - 600 micras) y añadir 0,5 ml de agua.
- Vortex el tubo, a mano, a la velocidad de 10 durante 1 min.
- Recuperar las larvas de las perlas de vidrio por derramar el contenido del tubo de microcentrífuga en un plato de Petri y elegir las larvas con un pincel.
- Para la fase de recuperación, coloque larvas en platos preparados con anterioridad Petri con pequeñas cantidades de comida mosca. Permitir que las larvas de restablecer su patrón de hemocitos por un período de 45 min o como se desee.
NOTA: Deseche las larvas que han dejado de moverse, ya que han muerto en el proceso. Sin embargo, vemos típicamente ldaños oco después de 1 minuto de vórtice (ver a continuación y Suplementario Figura 1). - Después de que el período de recuperación, continuar con el / Ensayo Raspe Bleed como se ha descrito anteriormente en la Sección 1.
Resultados
Para ilustrar los resultados típicos de los métodos descritos, se utilizó por primera vez la purga / Ensayo Raspe Hemocyte para delinear la progresión de números hemocyte larvas y su residencia en el transcurso del desarrollo de las larvas (Figura 4). Residente y circula poblaciones larvarias de hemocitos fueron aisladas de las larvas sola (Hml Δ-GAL4, UAS-GFP; Él-GAL4 etiquetar la gran mayoría de los hemocitos de las larvas) y se cuantificó usando ImageJ. Las cohortes de larvas de tamaño 1.2 mm (~ 48 AEL hora o 1 st estadio), 2,5 mm (~ 80 AEL hr o tarde 2º estadio), y 3,5 mm fueron examinados (~ 96 AEL hr o 3er estadio) (Figura 4) . Número de hemocitos se expandieron a lo largo del desarrollo larvario, se correlaciona con y superando las estimaciones previas sobre la base de microscopía de luz de tinte manchado larvas 7 y contando en directo de proteína marcada hemocitos fluorescentes a través de la cutícula larval 6. En 1 ins stlarvas de alquitrán de casi todos los hemocitos fueron residente, mientras que la fracción de hemocitos circulantes aumentó progresivamente durante el curso del desarrollo de las larvas (Figura 4B, C), consistente con las publicaciones anteriores 6,7.
A continuación examinamos si el método monitorea fielmente la transición de hemocitos entre el residente y poblaciones circulantes. Tomando ventaja del fenómeno que hemocitos residentes pueden ser transitoriamente individual aislada por la perturbación mecánica y que re-se adhieren a sus sitios residentes espontáneamente 6, nos dispersamos hemocitos residentes por agitación con perlas de vidrio como se describe en el Ensayo de perturbaciones Hemocyte. De hecho, la perturbación mecánica de las larvas condujo a un aumento espectacular en la población de hemocitos circulantes a expensas de hemocitos residentes (Figura 5). Después de un período de recuperación de 45 min, hemocitos habían regresado en gran medida a su estado adherente, tanto por inspección visual y por el comosessed porcentaje de células circulantes (Figura 5D, E). Como era de esperar, el número total de hemocitos se mantuvieron estables en el tiempo, a pesar del cambio de hemocitos entre las que circulan y residentes poblaciones.
Varias consideraciones adicionales fueron tomadas en cuenta. Para confirmar que vórtex no causar daños importantes tejido, vórtex con perlas de vidrio se realizó en presencia de azul de tripano (Sigma) durante diversos períodos de tiempo (1, 5, 20 min). Tanto 1 y 5 min vórtex no causó ninguna interrupción del tejido obvia, mientras que 20 min vórtex resultó en pequeñas áreas de daño, se asemeja a los daños causados por puntos de sutura aguja utilizada como control positivo (Figura Suplementaria 1). Mientras que el daño interno de la epidermis o en otros tejidos sin dañar la cutícula no se puede excluir, parece este escenario bastante improbable como hemocitos de 1 min y 5 larvas de re-adherido en el patrón esperado y los plazos min-tratada, lo que sugiere la integridad de las larvas no era de compromisod (Figura Suplementario 1). En contraste, las larvas vórtex durante 20 min sufrido de una falta de re-adherencia, y ni siquiera muestran la unión de hemocitos circulantes a los sitios de heridas epidérmicas, como se ha descrito previamente 14.
Por último, para demostrar la reproducibilidad del método, se compararon las réplicas biológicas de 2,5 mm larvas de los dos experimentos anteriores, que se llevaron a cabo por los experimentadores distintas. Como se ilustra en la Figura 2 Suplementario, ambas cohortes mostraron números totales comparables de hemocitos por larva, y el porcentaje de hemocitos circulantes. T prueba de Student no mostró diferencias estadísticamente significativas, lo que sugiere que el método es reproducible y ampliamente aplicables.
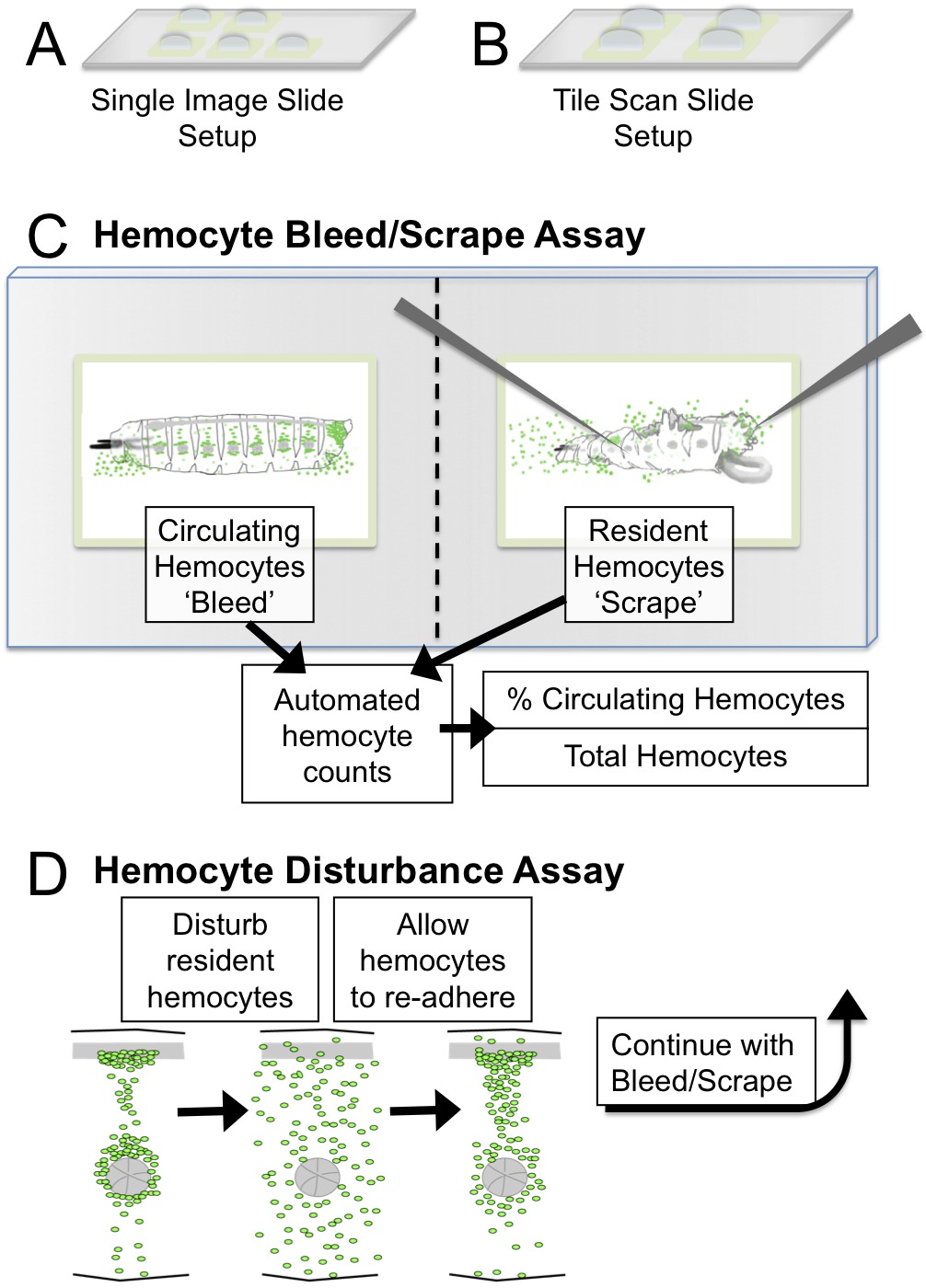
Figura 1. Hemocyte Bleed / Raspe y Disturbio Ensayo s etup y esquemática. (A) de una única imagen de instalación de diapositivas: cinco cuadrados de 2 mm para imágenes con un objetivo de 5X (B) Azulejos de configuración de diapositivas Scan:. Cuatro plazas 3 mm para purga de imágenes / raspaduras de ≤2.5 mm larvas con un microscopio de barrido de baldosas. Objetivos recomendados para imágenes son 5X o 10X. (C) Bleed / Raspe ensayo cuantificaciones esquemáticos y resultantes utilizando ImageJ. (D) en el ensayo de perturbación, el patrón de hemocitos se interrumpe mecánicamente por agitación larvas con cuentas de vidrio. Las larvas se les permitió recuperarse durante un período de 45 min durante el cual hemocitos volver a adherirse a los bolsillos hematopoyéticas. Las propiedades adhesivas de hemocitos pueden ser evaluados por este método, cuantificando el porcentaje de hemocitos en circulación después de la perturbación. Por favor haga clic aquí para ver una versión más grande de esta figura.
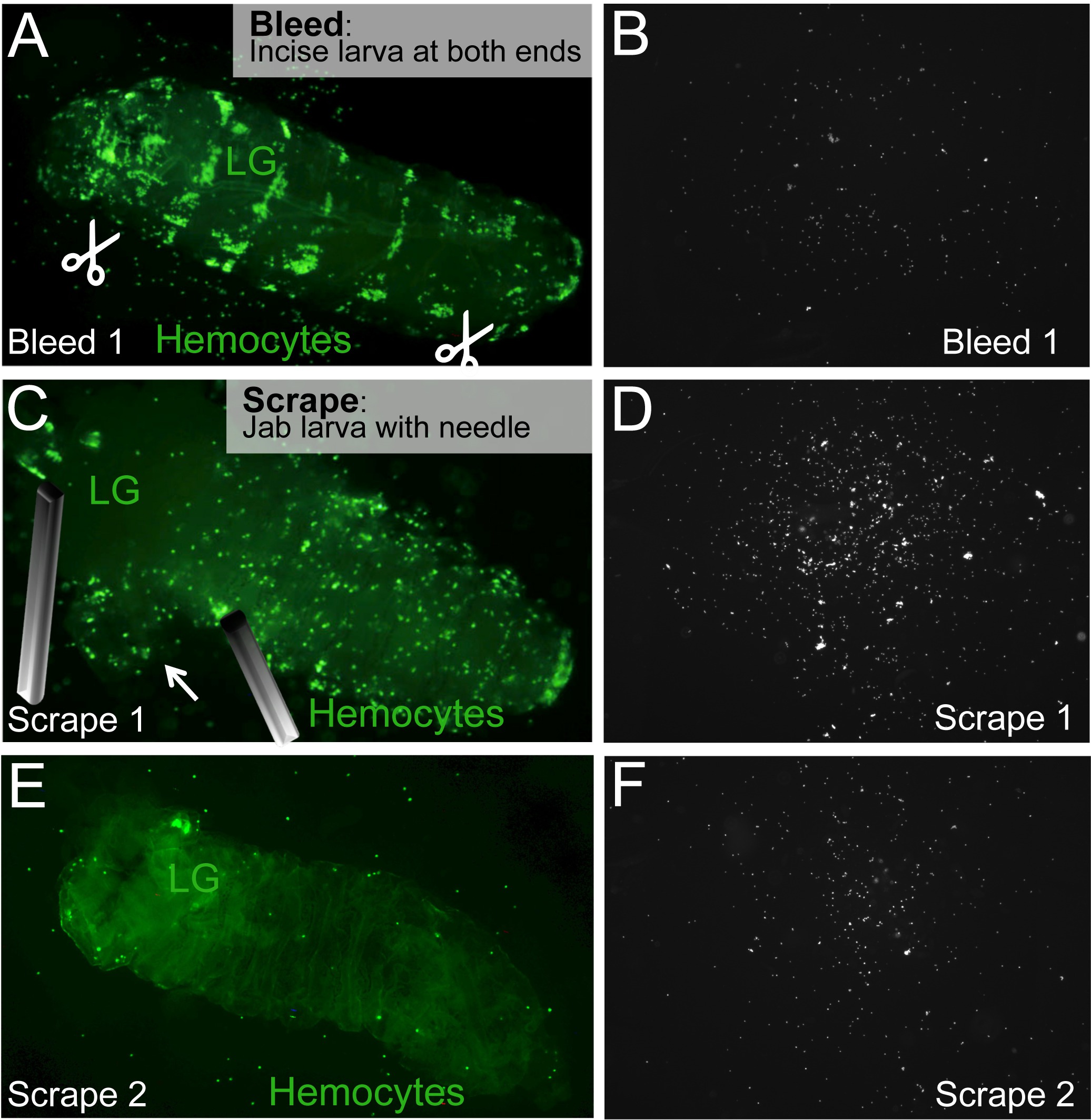
Figura 2. Bleed / Ensayo Raspe para liberar circulante y hemocitos residentes. (A) Para purgar una larva, incisiones ventrales en los extremos anterior y posterior de la larva se hacen (tijeras de símbolos). (B) hemocitos en circulación, que saldrán de las incisiones y asentarse en la superficie de la diapositiva. (C) El ganglio linfático (LG) se encuentra inmovilizado y, sin pincharlo. Hemocitos residentes son liberados por golpeando y / o raspado de la larva con una aguja hemocitos (D) residentes en la diapositiva.. (E, F) El proceso Raspe se repite hasta que todos los hemocitos residentes son liberados. El cadáver de larvas que contiene la glándula linfática intacta se quede atrás. Por favor haga clic aquí para ver una versión más grande de esta figura.
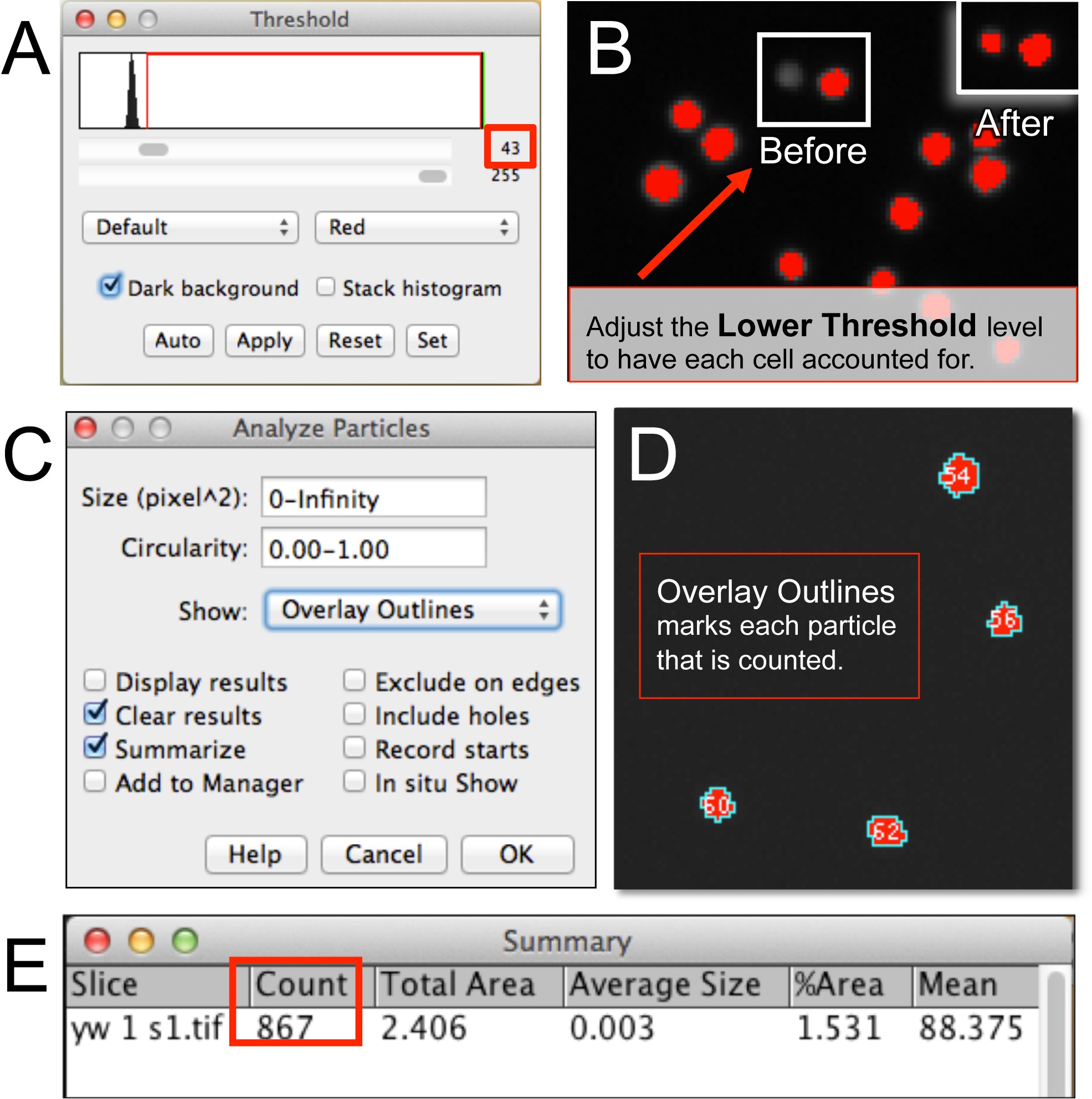
Figura 3. automatizado cuantificación de hemocitos usando ImageJ. (A, B) Después de abrir un archivo de imagen de hemocitos en ImageJ, el nivel umbral inferior se ajusta para tener en cuenta todas las celdas de la imagen. (C, D) Analizar partículas requiere establecer el tamaño de píxel de células, la circularidad, y la lectura del resultado formato (por ejemplo, superposición de contornos). (E) ventana Resumen muestra el número de hemocitos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Los resultados representativos (1). Número de hemocitos y estado de residencia durante el curso del desarrollo larval. (A) Información general de las etapas larvales utilizados; 1 st estadio (48 hr AEL; ~ longitud 1,2 mm); 2º (AEL 80 h; 2,5 mm de longitud) instar; 3º estadio (96 hr AEL; ~ 3.5 mm de longitud). El genotipo es Hml Δ-GAL4, UAS-GFP; Él-GAL4. Etapas fueron confirmados mediante la evaluación mouthhooks larvales. (B) Diagrama de Abogados de circulante y número de hemocitos residente en las respectivas fases larvarias. (C) Porcentaje de hemocitos circulantes. Tenga en cuenta que la fracción de hemocitos circulantes aumenta desproporcionadamente en el transcurso de desarrollo de las larvas. (D) hemocitos totales, resultante de la suma de circulante y hemocitos residentes por larva. Hemocitos se cuantificaron utilizando el método de purga / Raspe; n ≥ 6 larvas / estado, barras de error muestran la desviación estándar, los hallazgos confirmados en 3 replicar experimentos independientes.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
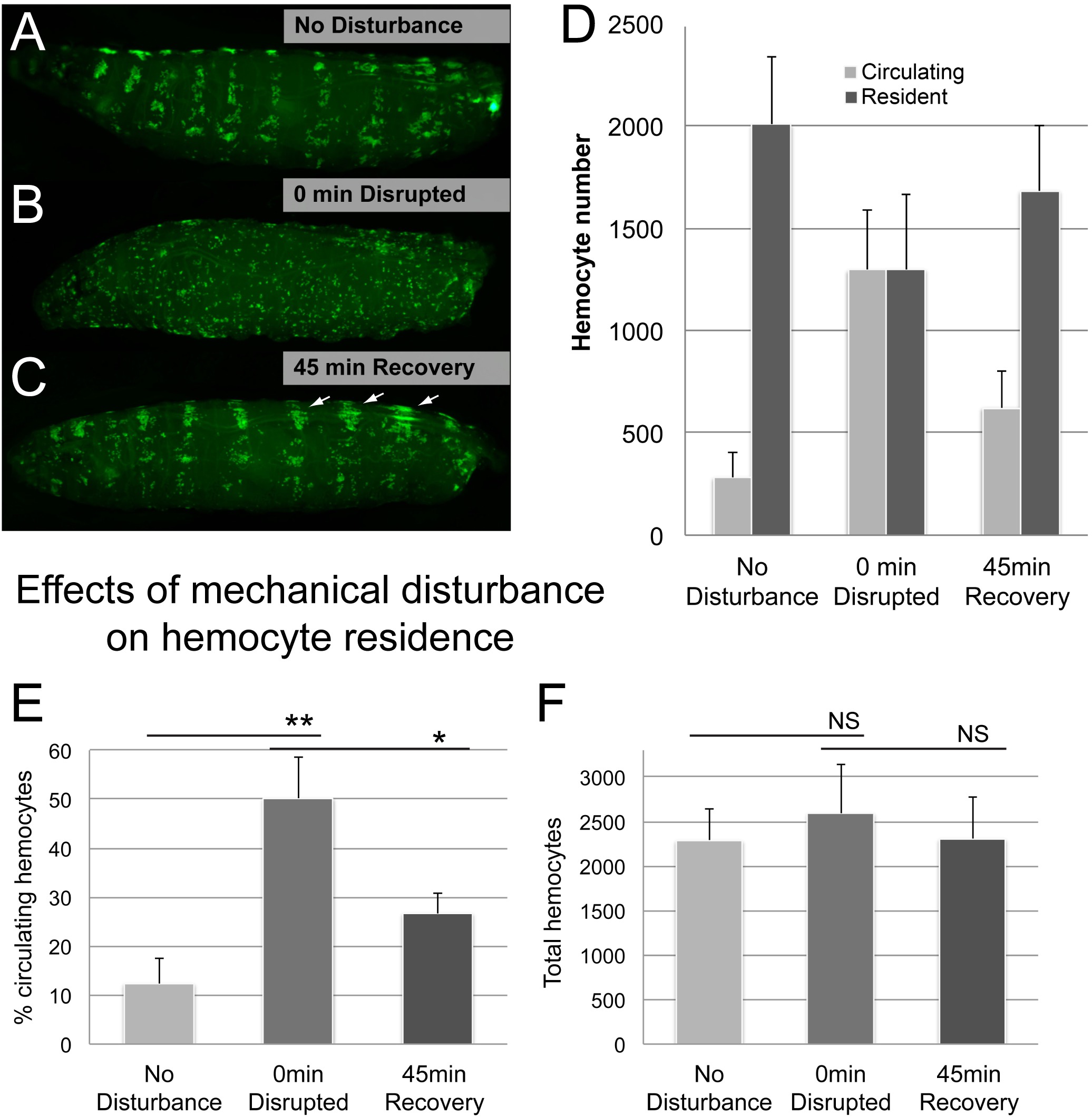
Figura 5. Los resultados representativos (2). Efectos de la perturbación mecánica en la residencia de hemocitos. (AC) Ejemplo de una larva antes y después vórtex con cuentas de vidrio, seguido por la recuperación de 45 min (A) No hay control de disturbios.; hemocitos se localizan en los bolsillos hematopoyéticas (B) Patrón hemocyte Interrumpió a 0 minutos después de vórtex larvas en una suspensión de cuentas de vidrio y agua (C) Patrón Hemocyte a los 45 min de la recuperación posterior a la perturbación..; muchos hemocitos se han trasladado a los bolsillos hematopoyéticas; nota ampliada dorsal-vasos grupos asociados y rayas dorsales que son sitios predominantes de la acumulación temprana posterior a la perturbación (flechas). El genotipo es Hml Δ-GAL4, UAS-GFP; Él-GAL4 x yw. (D) Porcentaje de hemocitos cuantificados por el método de purga / Raspe circulante. (E) hemocitos totales, resultante de la suma de circulante y hemocitos residentes por larva. n ≥ 4 larvas / estado, barras de error muestran la desviación estándar, los hallazgos confirmados en 3 replicar experimentos independientes. La prueba t de Student para confirmar importancia, NS (no significativo), ** (p ≤ 0,05), ** (p ≤ 0,01). Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
A continuación, describimos el primer método para recuperar cuantitativamente glóbulos residentes y circulantes de larvas de Drosophila sola, y cuantificar estas dos poblaciones de hemocitos. El protocolo comprende la liberación secuencial de circulantes y residentes células de la sangre, seguido por formación de imágenes y el recuento de células automatizado. Hemocitos residentes larvas pueden ser transitoriamente movilizaron en circulación por perturbación mecánica, un proceso que se conoce que se invierta en gran medida dentro de un 30 - período de recuperación min 60 6. En consecuencia, este protocolo se probó en dos formas, (1) mediante la evaluación del número total de hemocitos por larva y la fracción de la circulación de hemocitos en el transcurso de desarrollo de las larvas, y (2) por desalojar experimentalmente hemocitos residentes usando un método automatizado, que confirmó la estrecha correlación de la localización de hemocitos y el número de hemocitos en el residente y poblaciones circulantes. Además, la reproducibilidad del método se demostró por comparing dos conjuntos de datos de réplicas biológicas.
En el pasado, los laboratorios han utilizado una serie de técnicas para cuantificar hemocitos larval 6,13,21. Este protocolo establece un estándar común para recuperar y cuantificar las poblaciones de células de la sangre que residan y que circulan a partir de larvas de Drosophila, proporcionando una plataforma fácilmente adaptable. El método descrito es fundamental para los estudios que se centran en el papel de hemocitos residentes y su microambiente, hematopoyético Bolsillos 4-6, y es adecuado para estudiar las cepas transgénicas portadoras de la proteína fluorescente de Drosophila en el tipo salvaje y fondos modificados genéticamente. El protocolo también es relevante para los estudios que se centran en la movilización hemocyte después de la estimulación inmune o lesión, y la señalización genéticamente o ambientalmente inducida que activa movilización de hemocitos residentes o cambios en el número de hemocitos totales (revisado en 4). Cabe señalar que, en los casos de di prematuraferenciación y la liberación de los hemocitos de la glándula linfática, distinguiendo embrionario / larval frente a linajes de glándula de linfa pueden estar limitadas por el patrón de expresión del reportero hemocyte fluorescente usada.
El protocolo que aquí se presenta se basa en vivo de formación de imágenes, hemocitos marcados con fluorescencia. En el futuro, puede ser modificado para permitir la detección de células liberadas después de la fijación, por ejemplo, usando inmunocitoquímica. En este caso, puede ser necesario el protocolo que ser adaptado para asegurar la adhesión completa de las células de la sangre, por ejemplo mediante el aumento de los tiempos de incubación de adhesión, y la adición de recubrimiento de deslizamiento adhesivo, tal como concanavalina A. Dado que el método permite la recuperación de hemocitos y su manipulación ex vivo, se beneficiará de una amplia gama de estudios biológicos y bioquímicos de desarrollo, de células. Células residentes y sangre circulante se encuentran en todas las etapas de desarrollo de los postembryonic Drosophila y otros invertebrados 22, suggesting que la adaptación de este método se beneficiará de una amplia gama de estudios más allá del sistema hematopoyético de larvas de Drosophila.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Agradecemos a Jesper Kronhamn y Dan Hultmark, Michael Galko, y la Bolsa de Centro Bloomington para las poblaciones de la mosca. Un agradecimiento especial a Courtney Onodera de asesoramiento con el análisis estadístico. Damos las gracias a Katrina Oro para la lectura crítica del manuscrito, y Kalpana Makhijani, Katrina Oro, los miembros del laboratorio Derynck, y los miembros del laboratorio Nystul para su discusión y comentarios sobre el manuscrito. Este trabajo fue apoyado por becas de la UCSF Programa para la Investigación Biomédica Breakthrough (pBBR), Broad Center, Fundación Hellman, la Sociedad Americana del Cáncer RSG DDC-122595, American Heart Association 13BGIA13730001, National Science Foundation 1.326.268, Institutos Nacionales de Salud y 1R01GM112083-01 1R56HL118726-01A1 (en KB).
Materiales
| Name | Company | Catalog Number | Comments |
| 6 cm/9 cm Petri dishes | One for each genotype to be evaluated | ||
| Water squirt bottle | |||
| Metal spoon/spatula | |||
| Thin paintbrush | e.g., a "liner" | ||
| Glass cavity dish | |||
| PAP pen: Super PAP PEN IM3580 | Beckman Coulter | ||
| Glass slides | Each slide will have 5 or more PAP PEN squares drawn on them. Size of squares depends on the imaging objective and magnification of the microscope camera; e.g., 2 mm squares. | ||
| Moist chamber | This will be used to prevent slides and wells from drying out: sealed container with wet paper towels lining the sides/bottom | ||
| Schneider’s Drosophila cell culture media | Invitrogen | ||
| Cold block | This is a metal block (a.k.a. heating block) chilled in bucket containing ice; preferably black-colored or other dark, non-reflective color | ||
| 2 x 1 ml syringes with needles (27 G ½") | Becton Dickinson | For dissections. | |
| Optional: Surgical spring scissors (cutting edge 2 mm) | Fine Science Tools | ||
| Glass beads, 212 - 600 μm | Sigma | ||
| 2 ml Eppendorf tubes | Eppendorf | One per genotype evaluating | |
| Vortex mixer | Fisher Scientific | ||
| Transgenic Drosophila larvae with fluorescently marked hemocytes. | Suitable transgenes include: HmlΔ-DsRed (Makhijani et al., 2011), MSNF9mo-mCherry (Tokusumi et al., 2009), BcF6-CFP and -GFP (Gajewski et al., 2007), or HmlΔ-GAL4 (Sinenko and Mathey-Prevot, 2004), Pxn-GAL4 (Stramer et al., 2005), He-GAL4 (Zettervall et al., 2004), Crq-GAL4 (by H. Agaisse (Stramer et al., 2005)), or eater-GAL4 (Tokusumi et al., 2009) combined with UAS-GFP or other fluorescent protein transgenes. | ||
| Fluorescence dissecting microscope | Leica | Here: Leica M205, optional with camera, imaging software and measuring module | |
| Inverted fluorescence microscope with camera attachment | Leica or Keyence | With or without tile scanning function (e.g., Leica DMI series, Keyence BIOREVO BZ-9000 series) |
Referencias
- Lemaitre, B., Hoffmann, J. The host defense of Drosophila melanogaster. Annu Rev Immunol. 25, 697-743 (2007).
- Evans, C. J., Hartenstein, V., Banerjee, U. Thicker than blood: conserved mechanisms in Drosophila and vertebrate hematopoiesis. Dev Cell. 5, 673-690 (2003).
- Wood, W., Jacinto, A. Drosophila melanogaster embryonic haemocytes: masters of multitasking. Nat Rev Mol Cell Biol. 8, 542-551 (2007).
- Gold, K. S., Brückner, K. Drosophila as a model for the two myeloid blood cell systems in vertebrates. Experimental hematology. 42, 717-727 (2014).
- Makhijani, K., Brückner, K. Of blood cells and the nervous system: Hematopoiesis in the Drosophila larva. Fly. 6, 254-260 (2012).
- Makhijani, K., Alexander, B., Tanaka, T., Rulifson, E., Brückner, K. The peripheral nervous system supports blood cell homing and survival in the Drosophila larva. Development. 138, 5379-5391 (2011).
- Lanot, R., Zachary, D., Holder, F., Meister, M. Postembryonic hematopoiesis in Drosophila. Dev Biol. 230, 243-257 (2001).
- Holz, A., Bossinger, B., Strasser, T., Janning, W., Klapper, R. The two origins of hemocytes in Drosophila. Development. 130, 4955-4962 (2003).
- Sieweke, M. H., Allen, J. E. Beyond stem cells: self-renewal of differentiated macrophages. Science. 342, 1242974 (2013).
- Davies, L. C., Jenkins, S. J., Allen, J. E., Taylor, P. R. Tissue-resident macrophages. Nature immunology. 14, 986-995 (2013).
- Bretscher, A. J., et al. The Nimrod transmembrane receptor Eater is required for hemocyte attachment to the sessile compartment in Drosophila melanogaster. Biology Open. 1-9, (2015).
- Leitao, A. B., Sucena, E. Drosophila sessile hemocyte clusters are true hematopoietic tissues that regulate larval blood cell differentiation. eLife. , (2015).
- Markus, R., et al. Sessile hemocytes as a hematopoietic compartment in Drosophila melanogaster. Proc Natl Acad Sci U S A. 106, 4805-4809 (2009).
- Babcock, D. T., et al. Circulating blood cells function as a surveillance system for damaged tissue in Drosophila larvae. Proc Natl Acad Sci USA. 105, 10017-10022 (2008).
- Sinenko, S. A., Mathey-Prevot, B. Increased expression of Drosophila tetraspanin, Tsp68C, suppresses the abnormal proliferation of ytr-deficient and Ras/Raf-activated hemocytes. Oncogene. 23, 9120-9128 (2004).
- Stramer, B., et al. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. J Cell Biol. 168, 567-573 (2005).
- Tokusumi, T., Shoue, D. A., Tokusumi, Y., Stoller, J. R., Schulz, R. A. New hemocyte-specific enhancer-reporter transgenes for the analysis of hematopoiesis in Drosophila Genesis. 47, 771-774 (2009).
- Gajewski, K. M., et al. Identification of a crystal cell-specific enhancer of the black cells prophenoloxidase gene in Drosophila. Genesis. 45, 200-207 (2007).
- Lebestky, T., Chang, T., Hartenstein, V., Banerjee, U. Specification of Drosophila hematopoietic lineage by conserved transcription factors. Science. 288, 146-149 (2000).
- Zettervall, C. J., et al. A directed screen for genes involved in Drosophila blood cell activation. Proc Natl Acad Sci USA. 101, 14192-14197 (2004).
- Shim, J., Mukherjee, T., Banerjee, U. Direct sensing of systemic and nutritional signals by haematopoietic progenitors in Drosophila. Nature cell biology. 14, 394-400 (2012).
- Hartenstein, V. Blood cells and blood cell development in the animal kingdom. Annu Rev Cell Dev Biol. 22, 677-712 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados