Method Article
אוכלוסיות תאי דם Assaying של
In This Article
Summary
Drosophila blood cells, or hemocytes, cycle between resident sites and circulation. In the larva, resident (sessile) hemocytes localize to inductive microenvironments, the Hematopoietic Pockets, while circulating hemocytes move freely in the hemolymph. The goal of this protocol is the standardized isolation and quantification of these two, behaviorally distinct but interchanging, hemocyte populations.
Abstract
בבעלי חוליות, hematopoiesis מוסדר על ידי מייקרו-סביבות אינדוקטיביים (נישות). כמו כן, בmelanogaster תסיסנית אורגניזם מודל חסר חוליות, מייקרו-סביבות אינדוקטיביים הידועים ככיסי Hematopoietic זחל (HPS) זוהו כאתרים אנטומיים לפיתוח וההסדרה של דם תאים (hemocytes), בפרט של שושלת מקרופאג העצמית חידוש. HPS הוא segmentally חזר כיסים בין האפידרמיס ושכבות שרירים של הזחל, המהווה גם כן תאי עצב תחושתיים של מערכת עצבים ההיקפית. בזחל, תושב hemocytes (הנייח) חשוף לאנטי-אפופטוטיים, דבק ורמזי שגשוג מתאי העצב התחושתי אלה ורכיבים שעלולים להיות אחרים של HPS, כגון השרירים הבטנה ושכבות אפיתל. במהלך התפתחות נורמלית, שחרור הדרגתי של hemocytes התושב מדלקי HPS האוכלוסייה של hemocytes במחזור, ששיאו בשחרורו של מורח 'של hemocytes התושב בתחילת מטמורפוזה. תקיפות חיסוניים, פגיעה פיזית או הפרעה מכאנית לעורר את שחרורו המוקדם של hemocytes התושב למחזור. המתג של hemocytes זחל בין מקומות תושב ומחזור הדם מעלה את הצורך בתקן / הליך נפוץ לבודד באופן סלקטיבי ולכמת שתי אוכלוסיות של תאי דם אלה מזחלים תסיסנית יחידים. בהתאם לכך, פרוטוקול זה מתאר שיטה אוטומטית לשחרר ולכמת את התושב וhemocytes במחזור מזחלים בודדים. השיטה מאפשרת גישות vivo לשעבר, ועשויה להיות מותאמת לשרת מגוון של שלבי התפתחות של דרוזופילה ואורגניזמים חסרי חוליות אחרות.
Introduction
מחקר במודל חסר חוליות דרוזופילה melanogaster יש מונע הגילוי של חסינות מולדת 1, ויש להקל את ההבנה של היבטים שונים של התפתחות תאי דם 2-4. Hematopoiesis תסיסנית ניתן לחלק את שושלת היוחסין של hemocytes זחל / העוברי שמקורם ב עובר ולהרחיב בזחל, והשושלת של בלוטת הלימפה hemocytes 4,5. כאן, אנו מציגים פרוטוקול המתמקד בשושלת של hemocytes העוברי / זחל, אשר בזחל תסיסנית כוללת בעיקר plasmatocytes (מקרופאגים) וכמה תאי גביש 4. כיסים בזחל, hemocytes של העובר להתמיד וליישב segmentally חזרו ומסוף Hematopoietic (HPS) ממוקמים בין האפידרמיס ושכבות שרירים של קיר גוף זחל 5,6. בהתבסס על אופיים כמקרופאגים עצמיים חידוש 6, המגורים העיקריים שלהם במייקרו-סביבות רקמות מקומיות 6, 7, והשושלת שלהם מתאי הדם המוקדמים מתעוררים במהלך הפיתוח 6,8, אוכלוסיית תאי הדם הזה נחשבת דומה למקרופאגים חוליות עצמי חידוש רקמות, שושלת מיאלואידית עצמאית זוהתה לאחרונה במגוון רחב של מינים 4,9,10. עם זאת, בדרוזופילה, חלק או את כל תאי התושב אלה מראים גם גמישות ללהצמיח סוגים אחרים של תאי דם כגון תאי גביש 11,12.
hemocytes הזחל הוא בעיקר תושב (נייחים), אבל נמצא במצב יציב דינמי בין HPS השונים. הם משתחררים בהדרגה למחזור, בפרט כזחל instar 3 rd גישות pupariation 5-7. אתגרים חיסוניים, פציעה או להוביל הפרעה מכאנית למוקדם, במקרה האחרון הפיכים, גיוס של hemocytes התושב אל hemolymph 4,6,13.
מחקרים קודמים הציעו כי תושב ומחזורhemocytes זחל הוא מאותו השושלת, אך נבדלים בתכונות הדבקה או ביותם 6,7,13,14. בידוד סלקטיבי של מחזור לעומת hemocytes התושב גילה רמות גבוהות של ריבוי באוכלוסיית hemocyte התושב, המצביע על החשיפה שלהם לרמזים אינדוקטיביים מHPS זחל HPS 6. תסיסנית מכוסים על ידי עור ושכבות שרירים ונמל נוסף אשכולות נוירון חושיים של מערכת העצבים ההיקפית (PNS) ותפקוד כבד דומה oenocytes 6. מבחינה תפקודית, ניסויי אבלציה התא שעברו מוטציה הגנטיים והוכיחו כי תאי עצב תחושתיים נוכחי בHPS לתמוך בהישרדות ולוקליזציה הטרופיות של hemocytes זחל 6.
כאן אנו מתארים שיטה לבידוד הספציפי והכימות של התושב וhemocytes במחזור מזחלים תסיסנית אחת, ופרוטוקול לגיוס hemocyte מכאני. השיטות יכולות לשמש לvivo לשעברמחקר של hemocytes ועוד יכול להיות מותאם לשלבי התפתחות אחרים תסיסנית כגון גולם ובוגר, ומערכות חסרי חוליות אחרות. מאז מחקרים קודמים לא הבחינו בין התושב וhemocytes במחזור, פרוטוקול זה מספק סטנדרטי לחקר תאי דם תושב נפוץ ויעזור להגדיל את העקביות של מחקר בתאי דם חסר חוליות.
ראשית, Hemocyte בליד / לגרד Assay מתאר את בידוד ההפרש וכימות אוטומטי של תושב מסומן חלבון פלואורסצנטי ומחזור אוכלוסיות hemocyte מזחלים תסיסנית יחידים; הפרוטוקול מספק שתי אפשרויות למיקרוסקופים לסרוק מצוידים רגילים ואריח (איור 1). כתוצאה מכך, השיעור של hemocytes במחזור ואת המספר הכולל של hemocytes לזחל מתקבלים. השיטה מסתמכת על זחלים תסיסנית מהונדסים המבטאים חלבון פלואורסצנטי בין תאי הדם שלהםאוּכְלוֹסִיָה. הבחירה של נהג hemocyte או כתב קובעת את התוצאה, כלומר, שאוכלוסייה של תאי דם דמיין ולכמת. לתייג בעיקר מקרופאגים (plasmatocytes), המהווה את הרוב המכריע של התושב ואוכלוסיית hemocyte במחזור של זחל תסיסנית 6, transgenes המתאים כוללים Hml 6 Δ-DsRed, HmlΔ -GAL4 15, Pxn -GAL4 16, Crq-GAL4 (על ידי ח Agaisse 16), או אוכל-GAL4 17; לתיוג האוכלוסייה הקטנה יחסית של תאי גביש, קווים מתאימים הם BcF6-CFP ו-GFP 18, או LZ-GAL4 (על ידי ג 'פולוק 19); לlamellocytes תיוג, סוג תא מיוחד בעיקר נגרם על ידי אתגרים ופציעה 13 חיסוניים, למשל, MSNF9mo-mCherry ניתן להשתמש 17. כמה נהגים מהונדסים באים לידי ביטוי במגוון של דם מובחןתאים ואבות, כגון הוא - GAL4 20, אשר תוויות כ -80% מכלל תאי דם זחל 20. אנא שים לב כי בכל המקרים שבי GAL4 נהגים משמשים, שילוב עם כטב"מ-GFP או אחר כטב"מ-transgene חלבון פלואורסצנטי נדרש. בסעיף התוצאות, שיטה זו משמשת כדי לפקח מספר תאי דם וזרימת התנהגות במהלך התפתחות זחל.
שנית, Hemocyte ההפרעה Assay מתאר שלב מקדים שנועד לנתק hemocytes התושב על ידי מניפולציה חיצונית, אשר לאחר מכן מאפשרת ההערכה של היכולת של hemocytes מחדש לדבוק ובית לHPS בתוך מסגרת זמן מוגבלת (30 - 60 דקות) 6. בדרך כלל assay זה ואחריו בליד / לגרד Assay כדי לקבוע את אחוז מחזור hemocytes לזחל. אנו מציגים פרוטוקול פשוט עבור assay זה (איור 1D), המשתמש בהפרעה על ידי שנינות vortexingחרוזי זכוכית h, ולא מניפולציה של זחל יחיד עם מברשת צבע כפי שתואר לעיל 6. בסעיף התוצאות, assay זה משמש על מנת להוכיח כי לצוף hemocytes זמני מנותק בhemolymph וניתן לשחזר בכל החלק של מחזור hemocytes. Assay שימושי גם לכמת הבדלים של hemocytes בביות / ההדבקה שלהם לאתרי תושב, השוואה לדוגמא, רקע גנטי שונים או תנאי גירוי. אנא שים לב כי מניפולציה מכאנית זו משקפת תהליך הפיך ושונה מגיוס hemocyte התושב מדלקת או מושרה פציעה, שהם בדרך כלל לא הפיכים במסגרת זמן קצרה 4,13.
Protocol
1. Hemocyte בליד / לגרד Assay
- הכנת שקופיות:
- אפשרות 1 למיקרוסקופים ללא פונקצית סריקת אריח: לכל זחל להיות מנותח, להכין שקופיות זכוכית אחד עם כ -5 בארות פאפ-עט של 2 ריבועי מ"מ כל אחד, מתאימה לאזור הצפייה תחום מיקרוסקופ; להוסיף כ 5 - 10 μl של תקשורת S2 לכל אחד (איור 1 א). שמור שקופיות בתא לח כדי למנוע בארות מהתייבשות.
- אפשרות 2 למיקרוסקופים עם פונקצית סריקת אריח: לכל זחל להיות מנותח, להכין שקופיות זכוכית אחד עם 3 עד 4 בארות פאפ-עט של ~ 3 - ריבועי 4 מ"מ כל אחת; להוסיף כ 15 - 20 μl של תקשורת S2 היטב כל אחד (איור 1). שמור שקופיות בתא לח כדי למנוע בארות מהתייבשות.
הערה: המספר המומלץ מעל הבארות מספיק לסיכומים של עד 3,000 hemocytes לזחל (זחלי instar 2 nd מאוחר, ~ 2.5-3 אורך מ"מ, transgene תיוג רוב larvאל תאי דם). בהערכת מספרי תאי דם גדולים יותר, יש צורך בבארות יותר, כדי למנוע מעל צפיפות.
- אוסף של זחלים:
- להשפריץ מים לתוך בקבוקון זבוב המכיל זחלים וזחלי סומק לתוך צלחת פטרי, או לגרוף קצת אוכל שמכיל זחלים לתוך צלחת פטרי ולדלל עם מים באמצעות בקבוק להשפריץ.
- בעדינות להרים זחלים מתוך צלחת פטרי באמצעות מכחול ולמקם אותם במים בצלחת חלל או בשקופית על גוש קר.
הערה: יכולים להיות כל הזמן זחלים לזמן מוגבל במים או בבלוק קר; להשתמש דגימות תוך 45 דקות או פחות, כדי למנוע מות זחל או תופעות לא רצויות בhemocytes.
- נתיחה:
- בחר זחלים תחת מיקרוסקופ פלואורסצנטי בגוש מתכת קר. למדוד גדלים וזחלי תמונה אם תרצה בכך.
- בידוד של מחזור hemocytes ("Bleed"):
- ברגע שזחלים נבחרים, למקם את זחל אחד בפאפ-העט הראשון גם (איור 1 ג,2 א).
- השתמש 2 מחטים נקיות או מספריים ומלקחיים לנתח לעשות חתך בשני הקצוות האחוריים והקדמיים של הזחל. כדי להימנע מלהפריע hemocytes התושב, עדיף לעשות חתכים אלה בצד הגחוני של הזחל. לקבלת תוצאות עקביות, להפיק את החתכים באותם מקומות לכל זחל. ל1 זחלי instar st, חתך 1 (בגחון הקדמי) הוא מספיק.
- לאפשר זחל לדמם במשך כמה שניות, ללא כל לחץ או התרגשות פיזית (איור 2 א).
הערה: אם עובד על זחלים מרובים עדיף לעשות חתכים אלה עבור כל אחד לפני שתמשיכו לשלב הבא, כדי למנוע שמירה על זחלים ארוך מדי שעלול להשפיע על התקינות 'דגימות קרח. - רם בעדינות את הזחל עם המחטים או מלקחיים ולטבול אותו לתוך הבאר השנייה כדי לשטוף כל hemocytes במחזור שנותר. לאחר ש, בצע עם שחרורו של hemocytes התושב.
- בידוד של hemocytes התושב ("לגרד"):
- בעדינות להעביר את הזחל לטוב הבא (איור 2 ג).
- זהה את בלוטת הלימפה של הזחל, אשר בדרך כלל ממוקם כ 1/3 מהקצה הקדמי של הזחל, ואשר עשוי לזרוח dorsally דרך קיר גוף הזחל. הימנע בלוטת הלימפה בזמן שחרור hemocytes התושב על ידי מצמיד את הזחל עם מחט הקרובה ככל האפשר לבלוטת הלימפה כדי למנוע ניקוב (איור 2 ג).
הערה: במהלך התפתחות נורמלית של התבגרות hemocytes בלוטת הלימפה מתעכבת לעומת hemocytes זחל, וכתבי ניאון של hemocytes הבדיל לא יכולים להראות אות בבלוטת הלימפה של זחלים צעירים. במקרים אלה, פחות תשומת לב צריכה להיות משולמת לבלוטת הלימפה כאין זיהום של hemocytes זחל fluorescently שכותרתו המובחן על ידי hemocytes בלוטת הלימפה צפויה. - לשחרר תאי דם תושב בdissectiבתהליך של גירוד ו / או דקר. השתמש ברקמה אחת להצמיד ביעילות את הזחל בסמוך לבלוטת הלימפה (ראה לעיל) או באזורי גוף אחרים לפי צורך. השתמש במחט אחרת לתקוע באשכולות של hemocytes הנראים מבעד לקיר גוף הזחל (איור 2 ג, ה), במטרה להפריד את hemocytes. Hemocytes גם ניתן לשחרר בתנועת גירוד. עם זאת, קורע את העור מוקדם עשוי לשחרר אשכולות גדולים של תאי דם, אשר יכול להפוך ספירה אוטומטית מאתגרת יותר.
הערה: בהתאם לגיל וגנוטיפ של הזחל, מספר hemocytes הכולל ישתנה. להפיץ את תהליך השחרור שתואר לעיל על פני כמה בארות כדי למנוע צפיפות של כמה בארות עם תאי דם, אשר יכול להפוך ניתוח תמונת תא בודד קשה יותר. - אם כמה hemocytes להישאר בפגר הסופי, לספור hemocytes אלה על ידי התבוננות מבעד למיקרוסקופ ושימוש בדלפק נקודות ידני (איור 2E). כדי להקל על ספירה, עמ 'התחרה הפגר על אזור נקי מאותו השקופיות ולהפיץ אותו כדק ככל האפשר כדי לצמצם את מספר המטוסים אופטיים.
- ברגע שהנתיחה הושלמה, לחכות בין 5 - 10 דקות לתאים להתיישב (אך לא בהכרח לדבוק) לפני ההדמיה הבארות. דגירה השקופיות בתא לח כדי למנוע התייבשות, ולהימנע מטיפול האגרסיבי של השקופיות, שעלול להפריע לhemocytes התיישב.
הערה: כאשר ספירת hemocyte קביעה, תאים שוחררו אינם קבועות והתאים חייבים להיות צילמו זמן קצר לאחר נתיחה, רצוי תוך 30 דקות לאחר שחרור מהזחל. בהתאם לכמות של נכסים בינוניים ותא, רובם המכריע של תאים התיישבו בתוך 5 - 10 דקות, שאמור להיות מאושר על ידי התמקדות במטוסים האופטיים של המדיום בבאר. עם זאת, רק חלק קטן מתאי דם דבק אל פני השטח השקופיות בזמן הזה, עובדה שצריכה להיחשב אם שינוי פרוטוקול זה לapproache מבוסס קיבוע תאים.
- קְבִיעַת כָּמוּת:
- קח תמונות של hemocytes התיישב תחת מיקרוסקופ פלואורסצנטי (איור 2 ב ', ד', ו '). עקוב עם כימות של hemocytes באמצעות תוכנת ImageJ.
- הכן תמונה לאלגוריתם ספירת תאי ImageJ:
- תמונה פתוחה של ImageJ באמצעות היטב: קובץ → להרחיב → (לאתר את הקובץ ובחר).
- ודא שהתמונה (ים) היא 8 סיביות או 16 סיביות. התאם את הסף לתמונה על ידי בחירת תמונה ולאחר מכן לחץ על התאם סף בחר. שים לב "חלון הסף" (איור 3 א).
- בדוק את האפשרות "רקע כהה". בחר "אדום" ולהגדיל את רמת הסף התחתונה (ראה חץ שחור) עד שכל תא בתמונה מסומן בנקודה אדומה (תאים שאינם מכוסים יהיה לראות בגוונים אפורים; איור 3). כסף התחתוןהוא גדל כמה תאים יהפכו מסומנים. זה יכול להיות אינדיקטור לכמה רחוק כדי לקבוע את הסף התחתון.
הערה: לפעמים אשכולות של תאים לא ניתן לפתור ויהיה נחשבים כאחד על ידי מונה החלקיקים. במקרים כאלה, מספר התאים באשכול יכול להיות מוערך על ידי בחינת התמונה (זום במידת צורך) וספירה ידנית באמצעות דלפק נקודות. לחלופין, הסף התחתון יכול להיות מוגבר כדי לפתור אשכולות של תאים; כל תאים מסומנים כתוצאה ממניפולציה זה אז יכול להיות נספרו באמצעות דלפק נקודות.
- לנתח מספר תא באמצעות ImageJ:
- הפעל את מנתח החלקיקים לספור את התאים (איור 3 ג). בחר לנתח ולחץ על ניתוח חלקיקים. לחלופין בחר "שכבת קווי המתאר" כדי לראות את חלקיקי ספירת האלגוריתם (איור 3D). לחלופין, לקבוע הגבלה לאזור הגודל או פיקסל של יחידה (למשל., תא, גוש של תאים, וכו ') לאלגוריתם לספור.
- לחץ על אישור. שים לב חלון סיכום עם הספירה (איור 3E).
2. Hemocyte ההפרעה Assay
- להפריע hemocytes, זחלים בחרו ולמקם אותם בצינור microcentrifuge 2 מיליליטר עם כ 0.5 גרם של חרוזי זכוכית (212-600 מיקרומטר) ולהוסיף 0.5 מיליליטר מים.
- מערבולת הצינור, ביד, במהירות 10 דקות 1.
- אחזר את הזחלים מחרוזי הזכוכית על ידי שפיכת התכולה של צינור microcentrifuge לתוך צלחת פטרי ובוחר את הזחלים עם מכחול.
- בשלב ההתאוששות, למקם את הזחלים בצלחות פטרי הכינו בעבר עם כמויות קטנות של מזון זבוב. לאפשר הזחלים להקים מחדש דפוס hemocyte לתקופה של 45 דקות או לפי צורך.
הערה: מחק כל זחלים שהפסיקו לזוז, כפי שהם מתו בתהליך. עם זאת, אנחנו בדרך כלל רואים lנזק ittle לאחר 1 דקות של vortexing (ראה להלן ומשלימת איור 1). - לאחר תקופת ההתאוששות, ימשיך עם בליד / לגרד Assay כמתואר לעיל בסעיף 1.
תוצאות
כדי להמחיש את תוצאות אופייניות לשיטות שתוארו, היינו ראשון Hemocyte בליד / לגרד Assay להתוות את ההתקדמות של מספרי hemocyte זחל ומקום מגוריהם במהלך התפתחות זחל (איור 4). תושב ומחזור אוכלוסיות hemocyte זחל היו מבודד מזחלים בודדים (Hml Δ-GAL4, כטב"מ-GFP; הוא-GAL4 לתייג הרוב המכריע של hemocytes זחל) ולכמת באמצעות ImageJ. קבוצות של זחלים בגודל 1.2 מ"מ (~ AEL 48 שעות או 1 instar st), 2.5 מ"מ (~ 80 שעות AEL או מאוחר 2 instar ND), ו -3.5 מ"מ (~ 96 שעות AEL או 3 rd instar) נבדק (איור 4) . מספרי Hemocyte התרחבו במהלך התפתחות זחל, correlating עם ועולה על הערכות קודמות מבוססת על מיקרוסקופ אור של זחלי צבע מוכתם 7 וספירה חיה של hemocytes חלבון הנקרא ניאון דרך ציפורן זחל 6. בתוספות 1 stזחלי זפת כמעט כל hemocytes היה תושב, תוך שבריר של hemocytes במחזור גדל בהדרגה במהלך התפתחות זחל (איור 4, C), עולה בקנה אחד עם פרסומים קודמים 6,7.
הבא בדקנו האם השיטה בנאמנות מנטרת את המעבר של hemocytes בין התושב והאוכלוסיות במחזור. מנצלים את התופעה שhemocytes התושב יכול להיות מנותק זמני על ידי הפרעה מכאנית והם מחדש לדבוק אתרי התושב שלהם באופן ספונטני 6, אנחנו מפוזרים hemocytes התושב על ידי vortexing עם חרוזי זכוכית, כמתואר בHemocyte ההפרעה Assay. ואכן, הפרעה מכאנית של זחלים הובילה לעלייה דרמטית באוכלוסייה של מחזורי hemocytes על חשבון hemocytes התושב (איור 5). לאחר תקופת החלמה של 45 דקות, hemocytes חזר במידה רבה למצב החסיד, הן על ידי בדיקה ויזואלית ועל ידי כאחוז העריך אז תאים במחזור (איור 5D, E). כצפוי, הכולל מספרי hemocyte נשארו יציבים לאורך זמן, למרות השינוי של hemocytes בין האוכלוסיות במחזור והתושב.
כמה שיקולים נוספים נלקחו בחשבון. כדי לאשר vortexing שלא לגרום נזק לרקמות גדול, vortexing עם חרוזי זכוכית בוצעו בנוכחות trypan הכחולה (Sigma) לתקופות זמן שונות (1, 5, 20 דקות). שני vortexing דקות 1 ו -5 לא לגרום לכל הפרעה רקמה ברורה, תוך 20 דקות vortexing הביא באזורים הקטנים של נזק, שמזכיר נזק שנגרם עקב תפרים מחט משמשים כביקורת חיובית (איור משלימה 1). בעוד הנזק הפנימי של עור או ברקמות אחרות ללא נזק לציפורן לא ניתן לשלול, תרחיש זה נראה די סביר כhemocytes של 1 דקות ו -5 שטופלו דקות זחלים בתבנית הצפויה ומסגרת זמן-דבקה מחדש, מה שמרמז על שלמות זחל לא הייתה פשרהד (איור משלימה 1). לעומת זאת, זחלי vortexed במשך 20 דקות סבלו מחוסר מחדש הידבקות, ואפילו לא הראו קשר של מחזורי hemocytes לאתרי אפידרמיס פצע, כפי שתוארו קודם לכן 14.
לבסוף, כדי להדגים שחזור של השיטה, השווינו משכפל ביולוגי של 2.5 מ"מ זחלים משני ניסויים לעיל, שנערכו על ידי הנסיינים שונים. כפי שמודגם באיור 2 נוסף, שתי הקבוצות הראו מספרי השוואה כולל של hemocytes לזחל, ואחוז hemocytes במחזור. הבדיקות לא של התלמיד לא הראו הבדלים משמעותיים מבחינה סטטיסטית, המצביע על כך השיטה היא שחזור והחלים רחב.
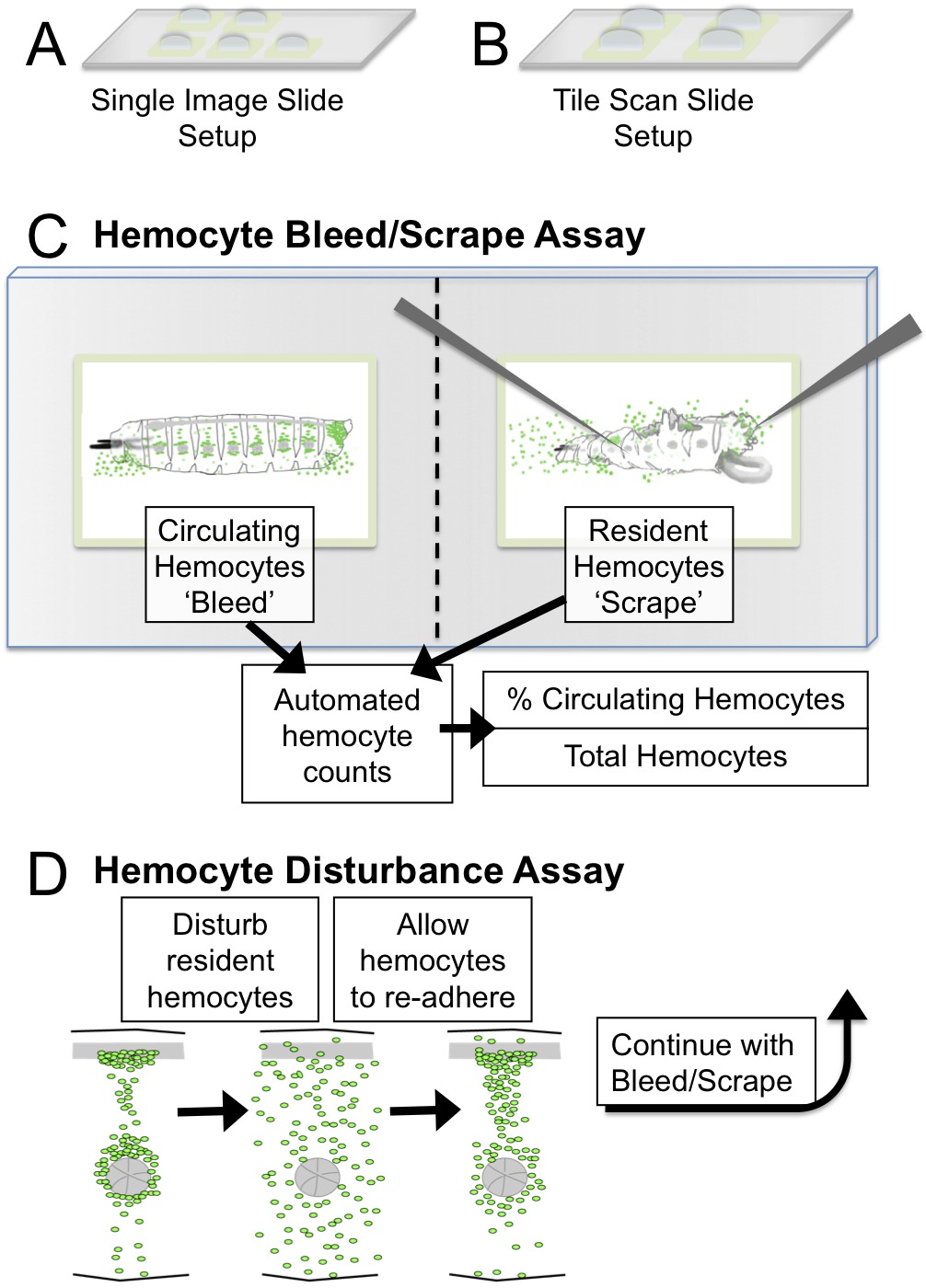
איור 1. Hemocyte בליד / לגרד והפרעה Assay של etup וסכמטי. הגדרות () יחידה תמונת שקופיות: חמישה ריבועים 2 מ"מ להדמיה עם מטרת 5X (ב) התקנת שקופיות סריקת טייל:. ארבעה ריבועים 3 מ"מ ללדמם הדמיה / שריטות של זחלי מ"מ ≤2.5 עם מיקרוסקופ סריקת אריח. יעדים מומלצים להדמיה הם 5X או 10X. (ג) Bleed / quantifications סכמטי וכתוצאה לגרד Assay באמצעות ImageJ. (ד) בAssay ההפרעה, דפוס hemocyte מופר באופן מכאני על ידי vortexing זחלים עם חרוזי זכוכית. זחלים מותר להתאושש על פני תקופה של 45 דקות שבמהלכו hemocytes מחדש לדבוק בכיסי Hematopoietic. מאפייני ההדבקה של hemocytes ניתן להעריך בשיטה זו, כימות אחוז hemocytes במחזור לאחר הפרעה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
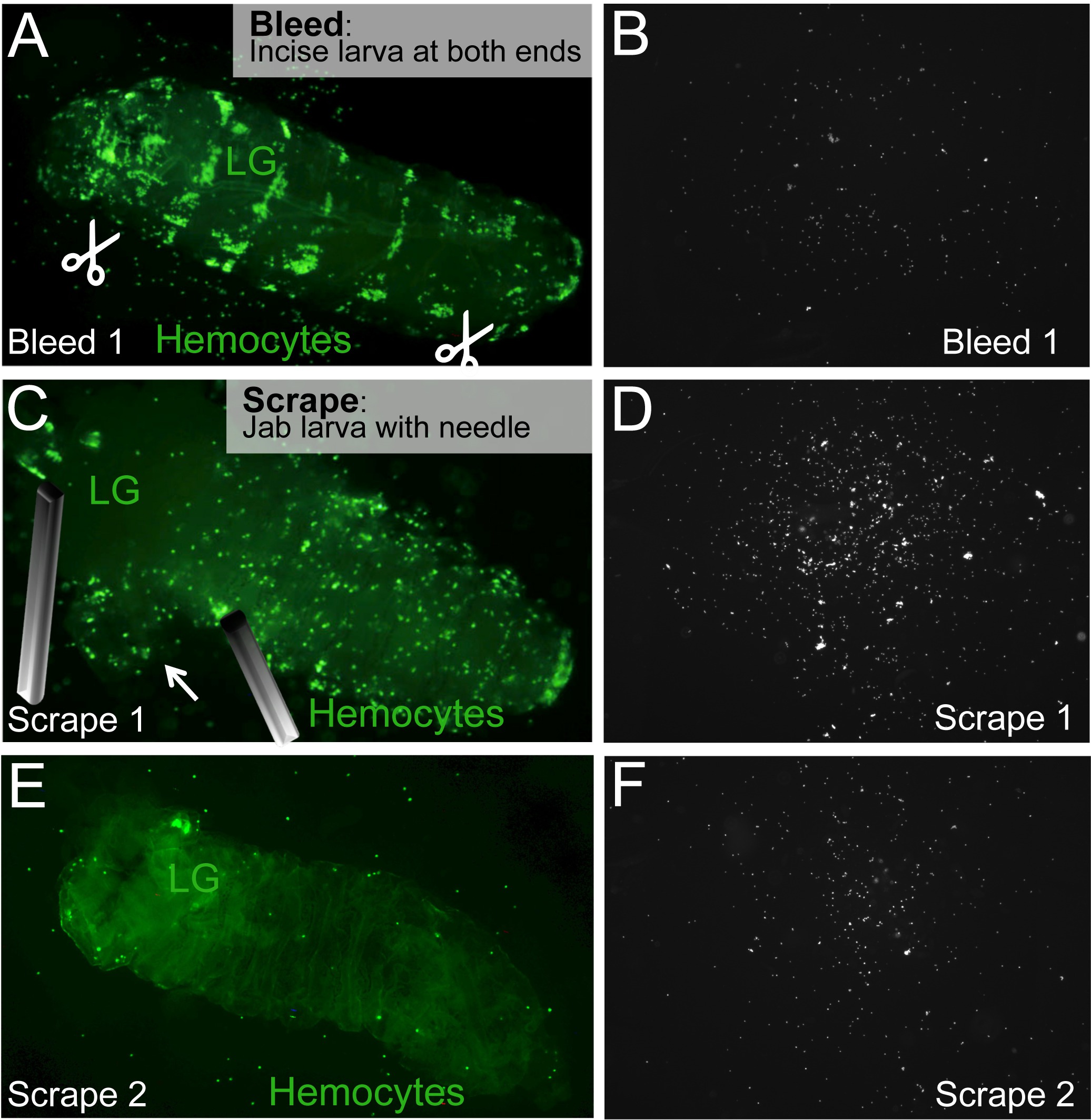
איור 2. בליד / לגרד Assay לשחרר במחזור וhemocytes התושב. () לדמם זחל, חתכים הגחון בקצוות האחוריים והקדמיים של הזחל עשויים (מספריים סמל). (ב) hemocytes במחזור יזרום מהחתכים ולהתיישב על פני השטח של השקופית. (ג) בלוטת הלימפה (LG) ממוקמת ומרותק, ללא ניקובו. hemocytes התושב פורסם על ידי תחיבה ו / או מגרדים את הזחל עם מחט. hemocytes התושב (ד ') בשקופית. (E, F) התהליך חוזר על עצמו עד לגרד כל hemocytes התושב משתחררים. פגר הזחל מכיל בלוטת הלימפה שלמה הוא נשאר מאחור. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
o: לשמור-together.within עמודים = "תמיד"> 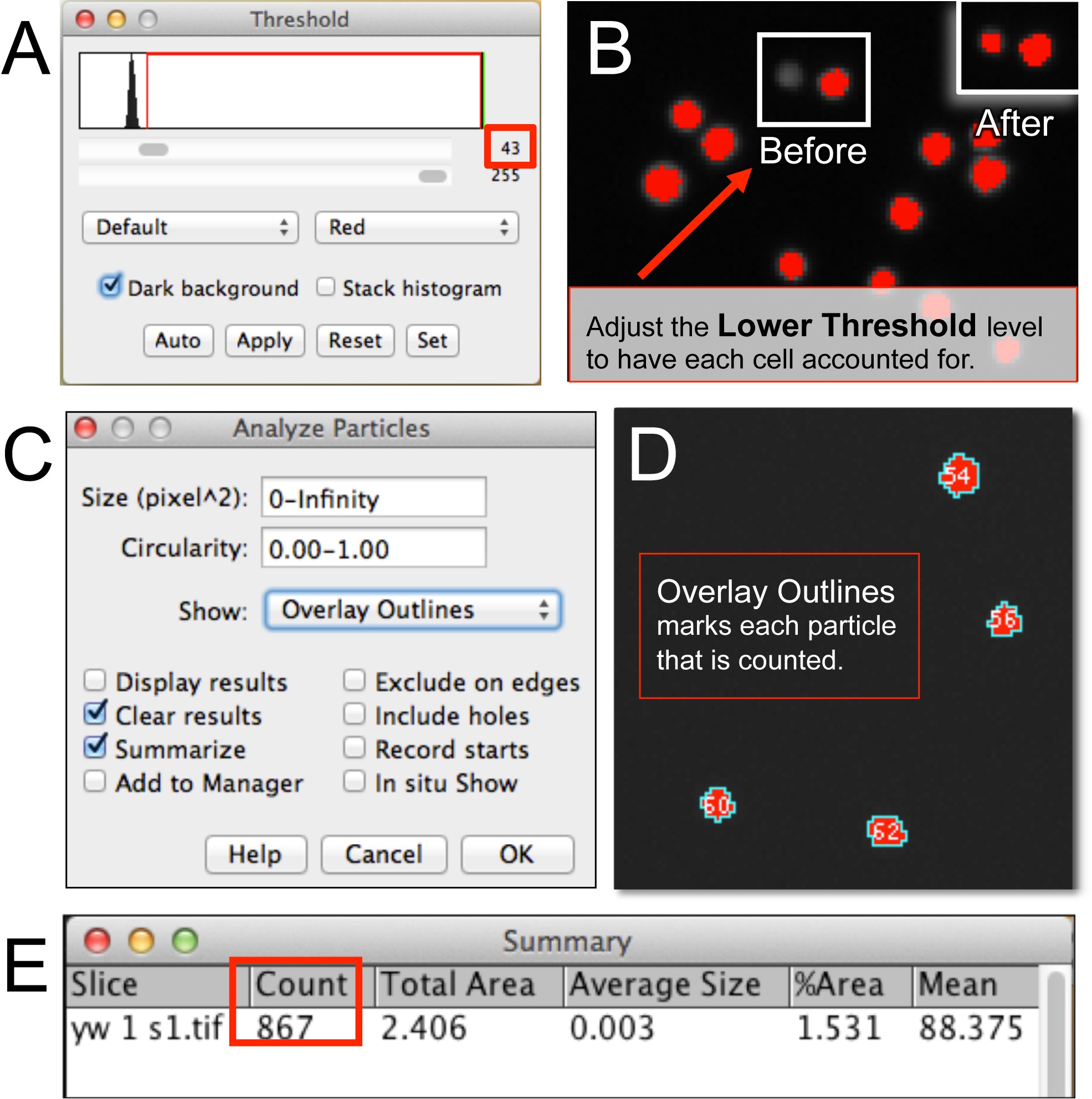
איור 3. אוטומטי כימות של hemocytes באמצעות ImageJ. (A, B) לאחר פתיחת קובץ תמונת hemocyte בImageJ, רמת הסף התחתונה מותאמת לדין וחשבון על כל התאים בתמונה. (C, D) לנתח חלקיקים דורש הגדרת גודל פיקסל תא, מעגלי, ואת הודעת התוצאה פורמט (למשל, שכבת קווי המתאר). (ה) חלון סיכומו מוצגות מספר hemocytes. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 4. נציגי תוצאות (1). מספר Hemocyte ומדינת תושב על במהלך התפתחות זחל. סקירה של שלבי הזחל בשימוש (); 1 st instar (AEL 48 שעות; ~ 1.2 מ"מ אורך); (AEL שעה 80; אורך 2.5 מ"מ) 2 nd instar; 3 rd instar (96 שעות AEL; ~ אורך מ"מ 3.5). גנוטיפ הוא Hml Δ-GAL4, כטב"מ-GFP; הוא-GAL4. שלבים אושרו על ידי הערכת mouthhooks זחל. תרשים בר (B) של מחזור ומספרי hemocyte התושב בשלבי זחל בהתאמה. אחוז (ג) במחזור hemocytes. שים לב שהחלק של hemocytes במחזור מגביר פרופורציונלי במהלך התפתחות זחל. (ד) סך hemocytes, כתוצאה מהסכום של המחזור וhemocytes התושב לזחל. Hemocytes היו לכמת בשיטה בליד / לגרד; n ≥ 6 זחלים / מצב, ברים שגיאה להראות סטיית תקן, ממצאים אישרו ב 3 ניסויים לשכפל עצמאיים.jpg "target =" _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
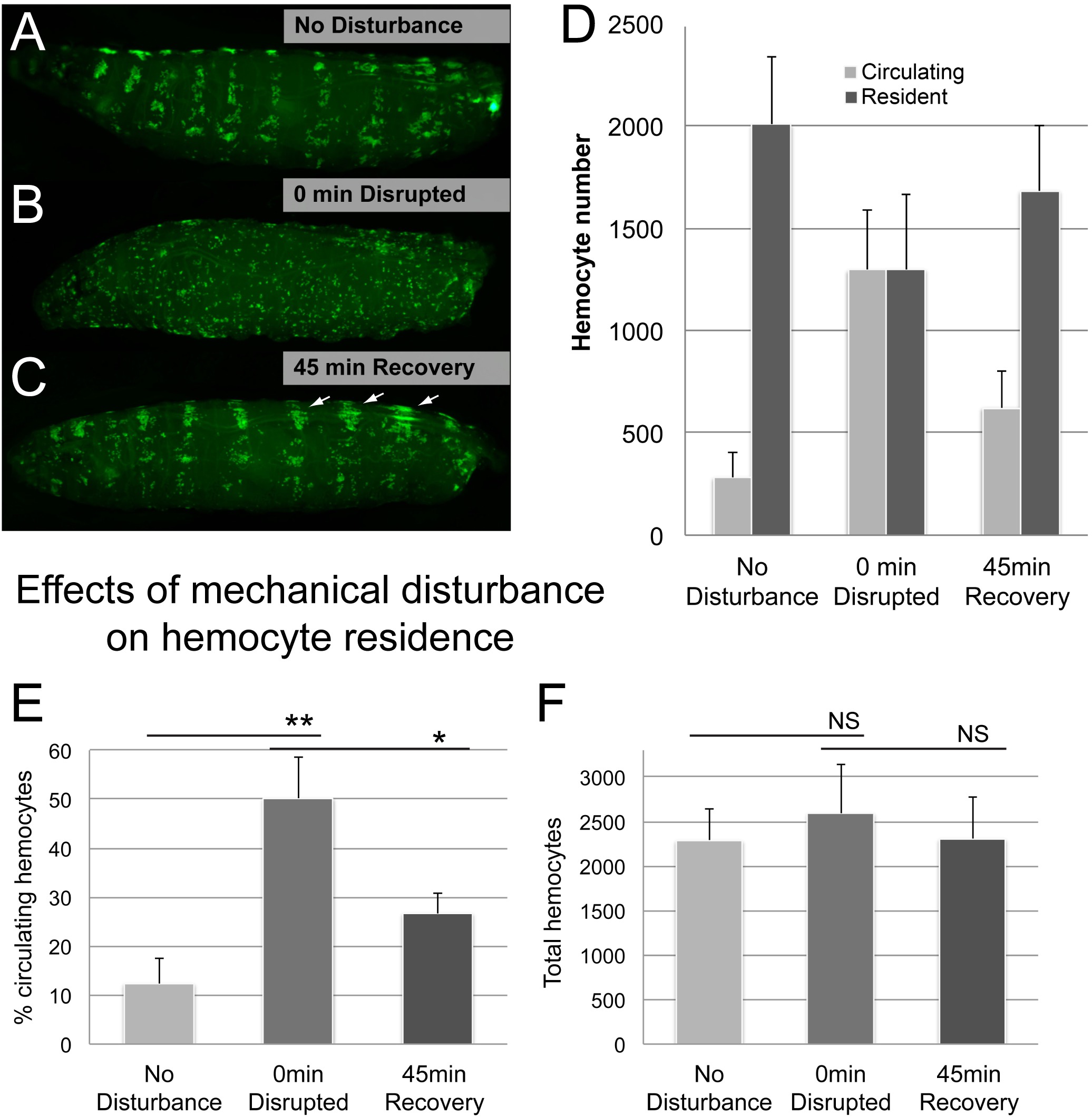
איור 5. נציגי תוצאות (2). השפעות של הפרעה מכאנית במגורי hemocyte. (AC) דוגמא של זחל לפני ואחרי vortexing עם חרוזי זכוכית, ואחריו התאוששות 45 דקות () אין שליטת הפרעה.; hemocytes הם מקומיים בכיסי Hematopoietic (ב) דפוס hemocyte שיבשו ב0 דקות לאחר vortexing זחלים בהשעיה של חרוזי זכוכית ומים דפוס Hemocyte (ג) ב 45 דקות של פוסט הפרעה-התאוששות..; hemocytes רבים עבר לכיסי Hematopoietic; שים לב אשכולות הקשורים גב-כלי מוגדל ופסי גב שהם אתרים עיקריים של הצטברות הודעה הפרעה-מוקדם (חיצים). גנוטיפ הוא Hml Δ-GAL4, כטב"מ-GFP; הוא-GAL4 YW x. אחוז (ד ') במחזור של hemocytes לכמת בשיטה בליד / לגרד. (E) סה"כ hemocytes, כתוצאה מהסכום של המחזור וhemocytes התושב לזחל. n ≥ 4 זחלים / מצב, ברים שגיאה להראות סטיית תקן, ממצאים אישרו ב 3 ניסויים לשכפל עצמאיים. מבחן t כדי לאשר משמעות, NS (לא משמעותי), ** (p ≤ 0.05), ** (p ≤ 0.01). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
כאן, אנו מתארים את השיטה הראשונה להתאושש כמותית תאי דם תושב ומחזור מהזחלים תסיסנית אחת, ולכמת שתי אוכלוסיות hemocyte אלה. הפרוטוקול כולל את השחרור רציף של תאי דם במחזור והתושב, ואחריו הדמיה וספירה תאים אוטומטית. hemocytes תושב הזחל יכול להיות מגויס זמני למחזור על ידי הפרעה מכאנית, תהליך שידוע להיות הפוכים במידה רבה בתוך 30 - תקופת החלמה דקות 60 6. בהתאם לכך, פרוטוקול זה נבדק בשתי דרכים, (1) על ידי בחינה של מספר hemocyte כולל לזחל וחלק של מחזור hemocytes במהלך התפתחות זחל, ו- (2) על ידי ניסוי פירוק hemocytes התושב באמצעות שיטה אוטומטית, אשר אישר את מתאם הדוק של לוקליזציה hemocyte ומספר hemocyte בתושב ואוכלוסיות במחזור. בנוסף, שחזור של השיטה הודגם על ידי שיתוףmparing שני מערכי נתונים של משכפל ביולוגי.
בעבר, מעבדות השתמשו במגוון של טכניקות לכמת hemocytes זחל 6,13,21. פרוטוקול זה קובע סטנדרט לאחזור ולכמת אוכלוסיות תאי דם תושב ומחזור מזחלי דרוזופילה, מתן פלטפורמה להתאמה בקלות משותף. השיטה המתוארת היא קריטית עבור מחקרים המתמקדים בתפקיד של hemocytes התושב ומייקרו-הסביבה שלהם, Hematopoietic Pockets 4-6, והוא מתאים ללמוד זני חלבון פלואורסצנטי נשיאת transgene דרוזופילה בסוג בר ורקעים מהונדסים גנטי. הפרוטוקול רלוונטי גם למחקרים המתמקדים בגיוס hemocyte אחרי אתגר חיסוני או פציעה, ואיתות גנטית או סביבתי הנגרמת על שמפעיל גיוס של hemocytes או שינויים במספר כולל hemocyte (בדיקה ב 4) התושב. יש לציין כי, במקרים של די המוקדמתfferentiation ושחרורו של hemocytes מבלוטת הלימפה, הבחנה / זחל עוברי לעומת שושלות בלוטת הלימפה עשויים להיות מוגבל על ידי דפוס הביטוי של כתב hemocyte הניאון משמש.
הפרוטוקול המובא כאן מסתמך על חיים הדמיה, hemocytes fluorescently שכותרתו. בעתיד, זה ניתן לשינוי על מנת לאפשר זיהוי של תאים שוחררו לאחר קיבוע, למשל, באמצעות immunocytochemistry. במקרה זה, הפרוטוקול ייתכן שיהיה הצורך מותאם כדי להבטיח הדבקה מלאה של תאי הדם, לדוגמא על ידי הגדלת פעמים דגירה הידבקות, והוספת שקופיות ציפוי דבק, כגון א concanavalin מאז השיטה מאפשרת אחזור של hemocytes ולשעבר המניפולציה שלהם vivo, זה יועיל למגוון רחב של מחקרים ביולוגיים וביוכימיים התפתחותית, תא. תאי תושב ודם במחזור נמצאים בכל שלבי postembryonic ההתפתחותי של דרוזופילה וחסרת חוליות אחרות 22, suggesting הסתגלות של שיטה זו תיהנה מגוון רחב של מחקרים מעבר למערכת hematopoietic זחל תסיסנית.
Disclosures
The authors have nothing to disclose.
Acknowledgements
אנו מודים Jesper Kronhamn ודן Hultmark, מיכאל Galko, והמרכז במלאי Bloomington עבור מניות הזבוב. תודה מיוחדת לקורטני Onodera לייעוץ עם ניתוח סטטיסטי. אנו מודים קתרינה זהב לקריאה ביקורתית של כתב היד, וקלף Makhijani, קתרינה זהב, חברי המעבדה Derynck, ואנשי המעבדה Nystul לדיון והערות על כתב היד. עבודה זו נתמכה על ידי מענקים מתכנית קליפורניה בסן פרנסיסקו ליו-הרפואי פריצת הדרך במחקר (PBBR), רוד מרכז, הלמן קרן, האגודה האמריקנית לסרטן RSG DDC-122,595, איגוד לב האמריקאי 13BGIA13730001, הקרן הלאומית למדע 1,326,268, המכונים הלאומי לבריאות 1R01GM112083-01 ו 1R56HL118726-01A1 (לKB).
Materials
| Name | Company | Catalog Number | Comments |
| 6 cm/9 cm Petri dishes | One for each genotype to be evaluated | ||
| Water squirt bottle | |||
| Metal spoon/spatula | |||
| Thin paintbrush | e.g., a "liner" | ||
| Glass cavity dish | |||
| PAP pen: Super PAP PEN IM3580 | Beckman Coulter | ||
| Glass slides | Each slide will have 5 or more PAP PEN squares drawn on them. Size of squares depends on the imaging objective and magnification of the microscope camera; e.g., 2 mm squares. | ||
| Moist chamber | This will be used to prevent slides and wells from drying out: sealed container with wet paper towels lining the sides/bottom | ||
| Schneider’s Drosophila cell culture media | Invitrogen | ||
| Cold block | This is a metal block (a.k.a. heating block) chilled in bucket containing ice; preferably black-colored or other dark, non-reflective color | ||
| 2 x 1 ml syringes with needles (27 G ½") | Becton Dickinson | For dissections. | |
| Optional: Surgical spring scissors (cutting edge 2 mm) | Fine Science Tools | ||
| Glass beads, 212 - 600 μm | Sigma | ||
| 2 ml Eppendorf tubes | Eppendorf | One per genotype evaluating | |
| Vortex mixer | Fisher Scientific | ||
| Transgenic Drosophila larvae with fluorescently marked hemocytes. | Suitable transgenes include: HmlΔ-DsRed (Makhijani et al., 2011), MSNF9mo-mCherry (Tokusumi et al., 2009), BcF6-CFP and -GFP (Gajewski et al., 2007), or HmlΔ-GAL4 (Sinenko and Mathey-Prevot, 2004), Pxn-GAL4 (Stramer et al., 2005), He-GAL4 (Zettervall et al., 2004), Crq-GAL4 (by H. Agaisse (Stramer et al., 2005)), or eater-GAL4 (Tokusumi et al., 2009) combined with UAS-GFP or other fluorescent protein transgenes. | ||
| Fluorescence dissecting microscope | Leica | Here: Leica M205, optional with camera, imaging software and measuring module | |
| Inverted fluorescence microscope with camera attachment | Leica or Keyence | With or without tile scanning function (e.g., Leica DMI series, Keyence BIOREVO BZ-9000 series) |
References
- Lemaitre, B., Hoffmann, J. The host defense of Drosophila melanogaster. Annu Rev Immunol. 25, 697-743 (2007).
- Evans, C. J., Hartenstein, V., Banerjee, U. Thicker than blood: conserved mechanisms in Drosophila and vertebrate hematopoiesis. Dev Cell. 5, 673-690 (2003).
- Wood, W., Jacinto, A. Drosophila melanogaster embryonic haemocytes: masters of multitasking. Nat Rev Mol Cell Biol. 8, 542-551 (2007).
- Gold, K. S., Brückner, K. Drosophila as a model for the two myeloid blood cell systems in vertebrates. Experimental hematology. 42, 717-727 (2014).
- Makhijani, K., Brückner, K. Of blood cells and the nervous system: Hematopoiesis in the Drosophila larva. Fly. 6, 254-260 (2012).
- Makhijani, K., Alexander, B., Tanaka, T., Rulifson, E., Brückner, K. The peripheral nervous system supports blood cell homing and survival in the Drosophila larva. Development. 138, 5379-5391 (2011).
- Lanot, R., Zachary, D., Holder, F., Meister, M. Postembryonic hematopoiesis in Drosophila. Dev Biol. 230, 243-257 (2001).
- Holz, A., Bossinger, B., Strasser, T., Janning, W., Klapper, R. The two origins of hemocytes in Drosophila. Development. 130, 4955-4962 (2003).
- Sieweke, M. H., Allen, J. E. Beyond stem cells: self-renewal of differentiated macrophages. Science. 342, 1242974 (2013).
- Davies, L. C., Jenkins, S. J., Allen, J. E., Taylor, P. R. Tissue-resident macrophages. Nature immunology. 14, 986-995 (2013).
- Bretscher, A. J., et al. The Nimrod transmembrane receptor Eater is required for hemocyte attachment to the sessile compartment in Drosophila melanogaster. Biology Open. 1-9, (2015).
- Leitao, A. B., Sucena, E. Drosophila sessile hemocyte clusters are true hematopoietic tissues that regulate larval blood cell differentiation. eLife. , (2015).
- Markus, R., et al. Sessile hemocytes as a hematopoietic compartment in Drosophila melanogaster. Proc Natl Acad Sci U S A. 106, 4805-4809 (2009).
- Babcock, D. T., et al. Circulating blood cells function as a surveillance system for damaged tissue in Drosophila larvae. Proc Natl Acad Sci USA. 105, 10017-10022 (2008).
- Sinenko, S. A., Mathey-Prevot, B. Increased expression of Drosophila tetraspanin, Tsp68C, suppresses the abnormal proliferation of ytr-deficient and Ras/Raf-activated hemocytes. Oncogene. 23, 9120-9128 (2004).
- Stramer, B., et al. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. J Cell Biol. 168, 567-573 (2005).
- Tokusumi, T., Shoue, D. A., Tokusumi, Y., Stoller, J. R., Schulz, R. A. New hemocyte-specific enhancer-reporter transgenes for the analysis of hematopoiesis in Drosophila Genesis. 47, 771-774 (2009).
- Gajewski, K. M., et al. Identification of a crystal cell-specific enhancer of the black cells prophenoloxidase gene in Drosophila. Genesis. 45, 200-207 (2007).
- Lebestky, T., Chang, T., Hartenstein, V., Banerjee, U. Specification of Drosophila hematopoietic lineage by conserved transcription factors. Science. 288, 146-149 (2000).
- Zettervall, C. J., et al. A directed screen for genes involved in Drosophila blood cell activation. Proc Natl Acad Sci USA. 101, 14192-14197 (2004).
- Shim, J., Mukherjee, T., Banerjee, U. Direct sensing of systemic and nutritional signals by haematopoietic progenitors in Drosophila. Nature cell biology. 14, 394-400 (2012).
- Hartenstein, V. Blood cells and blood cell development in the animal kingdom. Annu Rev Cell Dev Biol. 22, 677-712 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved