Method Article
زرع Miniosmotic مضخات والتسليم استشفاف المسالك لدراسة إعادة تنظيم الدماغ في حالة المرضية
In This Article
Summary
In order to study brain reorganization under pathological conditions we used miniosmotic pumps for direct protein delivery into the brain circumventing the blood brain barrier. Tract tracers are then injected to study alterations in brain connectivity under the influence of the protein.
Abstract
Pharmacological treatment in animal models of cerebral disease imposes the problem of repeated injection protocols that may induce stress in animals and result in impermanent tissue levels of the drug. Additionally, drug delivery to the brain is delicate due to the blood brain barrier (BBB), thus significantly reducing intracerebral concentrations of selective drugs after systemic administration. Therefore, a system that allows both constant drug delivery without peak levels and circumvention of the BBB is in order to achieve sufficiently high intracerebral concentrations of drugs that are impermeable to the BBB. In this context, miniosmotic pumps represent an ideal system for constant drug delivery at a fixed known rate that eludes the problem of daily injection stress in animals and that may also be used for direct brain delivery of drugs. Here, we describe a method for miniosmotic pump implantation and post operatory care that should be given to animals in order to successfully apply this technique. We embed the aforementioned experimental paradigm in standard procedures that are used for studying neuroplasticity within the brain of C57BL6 mice. Thus, we exposed animals to 30 min brain infarct and implanted with miniosmotic pumps connected to the skull via a cannula in order to deliver a pro-plasticity drug. Behavioral testing was done during 30 days of treatment. After removal the animals received injections of anterograde tract tracers to analyze neuronal plasticity in the chronic phase of recovery. Results indicated that neuroprotection by the delivered drug was accompanied with increase in motor fibers crossing the midline of the brain at target structures. The results affirm the value of these techniques for drug administration and brain plasticity studies in modern neuroscience.
Introduction
The delivery of proteins and pharmacological compounds into the brain are important strategies for studying mechanisms underlying brain diseases and evaluating candidate molecules for new treatments 1,2. In experimental neurosciences, the delivery of vectors such as plasmids or adenoviruses has become an important tool for studying long-term actions of proteins in the brain 3,4. Single injections of vectors present the advantage of a system which by itself will maintain highly stable levels of the therapeutic agent in the brain 4. However, for long term experiments with purified drugs systemic administration by intraperitoneal injection induces stress in mice or rats, and is not the best choice when a targeted brain response is needed, requiring also large doses of drug5. Miniosmotic pumps represent an ideal system for prolonged direct drug delivery into the brain by circumventing both low accessibility to the brain and also peaks of drug concentration, as the delivery of the drug happens directly into a targeted place in the brain and at a fixed flow rate determined by the pump model that is chosen2,6,7. Indeed, this system has allowed us to successfully study brain recovery after stroke by delivery of several drugs such as recombinant human erythropoietin (rhEpo) and vascular endothelial growth factor 6,7.
Brain plasticity is essential for the rewiring of connections in response to brain injuries. Plasticity is a broad concept that ranges from the formation or elimination of synaptic contacts, growth of dendritic spines and also elongation or retraction of long distance connections8,9. The brain was previously believed to not be capable of reconstructing connections after a lesion. However many approaches have shown that if properly stimulated it can reestablish connectivity 6,7,10. One technique that is particularly useful to study this is the use of tract tracers. Anterograde tract tracers are compounds that can enter neurons at the soma and then distribute all along the axons until these reach their target structures. Two examples are cascade blue (CB) and biotinylated dextran amine (BDA). Conversely, retrograde tract tracers, such as cholera toxin B (CTB) or fluorogold (FG) enter the neuron through the axon terminal and then distribute back to the soma thus revealing the site of origin of neurons targeting the injection site.
Here, we present the methods that we use for implantation of miniosmotic pumps for direct delivery of proteins or drugs that have potential effects on neural plasticity as well as the injection of BDA and FG to unveil input and output connections to the motor cortex. BDA will also be used as an example of a tract tracer used to demonstrate increased plasticity of axons emerging from the co after stroke under rhEpo treatment.
Protocol
وقد أجريت التجارب على الحيوانات بموافقة الحكومة (G1361 / 13، AZ84-02.04.2013.A192 وG1362 / 13، AZ84-02.04.2013.A194؛ Bezirksregierung دوسلدورف) على أساس المبادئ التوجيهية المعاهد الوطنية للصحة للرعاية واستخدام الحيوانات المختبرية.
1. إعداد Miniosmotic مضخات
- في بيئة معقمة (أي والثقافة خلية غطاء محرك السيارة)، للحصول على مضخة، القسطرة، وتدفق مشرف، الدماغ ضخ قنية وأقراص هل لاستخدامها (الشكل 1).
- لإيصال الأدوية مباشرة إلى البطينين استخدام واحدة القرص الفاصل بحيث سوى غيض من الإبرة قنية في اتصال مع البطين. عقد قنية رأسا على عقب مع ملقط. إضافة قطرتين من اصقة cyanoacrylate (CA) وأعرض واحدة القرص الفاصل.
- ترك قنية على سطح مستو تواجه صعودا بحيث الغراء بين القرص هل ويجف قنية.
- قطع القسطرة في أقسام حوالي 2.5 سم.
- لعصاممضخة الفصل، يعد الحد الأدنى من 300-350 ميكرولتر من الحل من الفائدة حيث ستكون هناك حاجة لملء تماما المضخة وبالتالي البثق كل الهواء داخل منه لمنع تشكيل فقاعات داخل القسطرة، وسوف فقاعات تعوق تدفق الحل في الدماغ.
- ربط بعناية القسطرة لمشرف التدفق.
- باستخدام حقنة 2 مل متصلة إبرة المقدمة من ضخ عدة في الدماغ، وملء المضخة حتى كمية قليلة من محلول يهرب من مضخة، وبالتالي منع فقاعات الهواء داخله.
- ملء بعناية مشرف تدفق والقسطرة الالتفات الى منع أي فقاعات المتبقية داخل القسطرة.
- إدخال وسيط تدفق داخل المضخة.
- شغل مرة واحدة، وربط بعناية قنية إلى نهاية القسطرة. إذا لوحظ أن فقاعة تتشكل إزالة قنية وبعناية إعادة ملء القسطرة مع مركبة أو محلول الدواء ثم إعادة إدخال قنية.
- ضع بوالنائب في وعاء مع محلول ملحي معقم ونترك الامر عند 37 درجة CO / N.
- قبل الزرع إعادة فحص لتشكيل فقاعة. إذا لزم الأمر (أي، لوحظ فقاعات) إزالة قنية وإعادة ملء الأنبوب. إعادة قنية. وهذا ينبغي أن يستغرق سوى بضع ميكرولتر من الحل.
2. زرع Miniosmotic مضخات
ملاحظة: لتم تخدير هذه التجارب الحيوانات بنسبة 1٪ الأيزوفلورين (30٪ O 2، 70٪ N 2 O). ولكن إذا كان هذا غير متوفر، واستخدام الحقن داخل الصفاق التخدير من الممكن 11 أيضا.
- تحديد الحيوان في الجهاز المجسم تحت التخدير وتغطية العينين مع مرهم وقائية لمنع جفاف بينما تحت التخدير. تأكيد التخدير عن طريق ملاحظة عدم وجود استجابة في hindpaw عند الضغط بالأصابع أو مع ملقط. لا المضي قدما حتى الحيوان نائما تماما.
- قطع الفراء على انهالإعلان إما مع مقص أو آلة الحلاقة. قطع أكبر قدر ممكن من دون الإضرار الجلد.
- تنظيف البشرة مع 70٪ من الإيثانول ومطهر مع خصائص مضادة للجراثيم وفطريات.
- مع مشرط فتح شق 1 سم قليلا إلى اليمين من خط الوسط وفضح الجمجمة.
- تنظيف الجمجمة مع مسحة القطن. نقع عليه مع 70٪ من الإيثانول وتمريرها عبر الجمجمة. وسيحفز هذا الجمجمة حتى يجف.
- إذا كانت الجمجمة ونزيف خفيف، واستخدام cauterizer للقضاء على أي نزيف النقاط. الدم يمنع CA من الجفاف بشكل صحيح على العظام مرة واحدة هو مزروع قنية.
- استخدام الجهاز المجسم لجعل علامة على وجهة الجمجمة حيث سيتم زرع قنية. للدفعات البطين على الإحداثيات نصف الكرة المخية الأيسر هي -0.2 مم الذيلية، 0.9 ملم الجانبي لbregma (الشكل 2A).
- حفر بلطف على الجمجمة بجعل زاوية 45 درجة. هذا يمنع الحفر من الذهاب بطريق الخطأ في الدماغن. حفر مرارا وتكرارا لبضع ثوان ثم تحقق من مدى عمق حفرة. وقف الحفر مرة واحدة وقد ضعفت الجمجمة ولكن لا يزال لم تنفذ بشكل كامل.
- كسر السحايا مع غيض من إبرة معقمة حتى يتحقق الوصول الكامل إلى الدماغ. القيام بذلك بلطف حتى لا يتلف الدماغ.
- تنظيف الجمجمة مع 70٪ من الإيثانول باستخدام قطعة من القطن.
- إدخال ملقط على التوالي تحت جلد الحيوان في اتجاه انتيرو الذيلية. استخدام ملقط لفتح الفضاء تحت الجلد في الجزء الخلفي من الحيوان حيث سيتم زرع المضخة. إدخال المضخة في الجزء الخلفي من الحيوان ترك القسطرة والقنية الخارج (الشكل 2B). ستبقى المضخة في هذا المنصب حتى يتم إزالته، ولا تحتاج إلى أي نوع من التثبيت.
- وضع بعناية أربع قطرات صغيرة من الغراء بجانب إبرة في قنية.
- إدخال الإبرة بعناية من خلال الجمجمة دون نقله جانبية. لأنه عقد في المنصب لمدة 15-30 ثانية شntil يتم إرفاق قنية تماما (الشكل 2C.1). مرة واحدة في مكان، وسوف قنية تصل إلى 2.5 ملم في الاتجاه بطني ظهراني إذا تم استخدام واحد القرص الفاصل. إذا تعلق بشكل صحيح، فإن قنية لا تزال تعلق على العظام حتى نهاية التجربة.
- ضع إصبع واحد على علامة التبويب القابلة للإزالة وثم استخدام اليد الأخرى لخفض تشغيله من قبل عنقه مع مجموعة من مقص (الشكل 2C.2).
- إغلاق الجرح على الجلد مع خياطة 5-0 وإضافة بضع قطرات من محلول البوفيدون اليود (PVP-I) على رأس الجرح لمنع الإصابة (الشكل 2D).
- نقل الحيوان إلى قفص جديد. لا تضع الحيوانات تعمل مع الحيوانات التي لم يتم تشغيلها. الحفاظ على الحيوانات التي تم زرعها مع المضخات وحدها في أقفاصها في عهد إدارة المخدرات.
- لا تترك الفئران غير المراقب حتى تكون مستيقظا واستعادت الاستلقاء القصية.
3. مضخة Removaل
ملاحظة: عادة التجربة ستنتهي في نهاية التسليم في الوقت المحدد المسموح به من قبل المضخة، ومع ذلك فمن الممكن لإزالة مضخة من أجل القيام بالمزيد من التجارب الثانوية كمتابعة لتسليم المخدرات. من أجل القيام المسالك حقن التتبع من الضروري بالتالي لإزالة المضخة.
- وضع الحيوان في الجهاز seterotactic تحت التخدير وتغطية العينين مع مرهم وقائية لمنع جفاف بينما تحت التخدير. تأكيد التخدير عن طريق ملاحظة عدم وجود استجابة في hindpaw عند الضغط بالأصابع أو مع ملقط. لا المضي قدما حتى الحيوان نائما تماما.
- فتح بعناية الجلد من خلال قطع شق القيام به في يوم غرس المضخة.
- مع المشبك الجراحية عقد قنية وتخلعها. كان يجب إزالتها بسهولة من الجمجمة. كما هو متوقع النزيف لطيف، والتوقف عن ذلك عن طريق وضع قطعة من القطن والانتظار لمدة 1-2 دقيقة.
- سحب المضخة بها القسطرة. هوليرة لبنانية أنه يخرج عن طريق دفع ذلك، وخلق الضغط على الجلد.
- إغلاق الجرح مرة أخرى مع 5-0 خياطة وإضافة بضع قطرات من PVP-I.
- نقل الحيوان إلى قفص جديد. لا تضع الحيوانات تعمل مع الحيوانات التي لم يتم تشغيلها. الحيوانات التي خضعت لعملية جراحية يمكن وضعها معا.
- لا تترك الفئران غير المراقب حتى تكون مستيقظا واستعادت الاستلقاء القصية.
- السماح للحيوان لاسترداد لمدة 10 أيام قبل الانتقال إلى حقن الجهاز التتبع.
4. الضغط المسالك الراسم حقن في 45 درجة الزوايا على الحق موتور اللحاء
- وضع الحيوان على الجهاز المجسم تحت التخدير وتغطية العينين مع مرهم وقائية لمنع جفاف بينما تحت التخدير. تأكيد التخدير عن طريق ملاحظة عدم وجود استجابة في hindpaw عند الضغط بالأصابع أو مع ملقط. لا المضي قدما حتى الحيوان نائما تماما.
- فتح جرح في الرأس.
- Cالعجاف الجمجمة مع 70٪ من الإيثانول باستخدام قطعة من القطن.
- إدخال الزجاج 5 ميكرولتر حقنة (26S GA) على حامل العمودي للجهاز. تأكد من أن الطرف الأدنى من حامل الزجاج هو على وجه التحديد في قطعة القابضة. يجب أن لا تكون الحقنة أقل بكثير جدا أنها بعد ذلك سوف يكون من المستحيل لوضعه في 45 درجة من الوضع الرأسي وتنفيذ أعمال الحقن.
- توجيه الحقنة مباشرة على bregma ثم تحديد الإحداثيات المطلوبة. لحقن على الإحداثيات القشرة الحركية هي: النقطة رقم 1: +0.5 مم منقاري و 2.5 ملم الوحشي فيما يتعلق bregma. نقطة رقم 2: +1.34 مم منقاري، 2.5 مم الجانبي فيما يتعلق bregma.
- مرة واحدة وقد تم تحديد الإحداثيات، تشير إلى وضعهم على الجمجمة مع علامة مع طرف رقيقة. جعل نقطة واحدة فقط في الجمجمة حيث إطلاق الحبر الزائد قد تخفي صحيح تنسيق.
- حفر بعناية الجمجمة عقد حفر في 45 درجة. كما في الخطوة 2.8، والتحقق من الجمجمة كثيرا حتى أنه ليس الأداء الإقتصادي الأداء تماماorated من أجل تجنب تلف في خلايا المخ الناجمة عن الحفر. استخدام غيض من حقنة للتأكد من أن تمت إزالة كل العظام.
- تحميل 600 NL المسالك التتبع التخفيف في حقنة.
- ضبط الوضع الرأسي إلى 45 درجة نحو الجانب الأيمن من الحيوان. تحت المجهر، ضع غيض من إبرة الحقنة في الحق في الجبهة من الحفرة.
- تحريكه في الاتجاه العمودي بمقدار 1.5 مم. السماح للإبرة ثابت في هذا المنصب لمدة 30 ثانية إلى 1 دقيقة قبل القيام حقن الضغط.
- ضخ 300 NL من التتبع التخفيف في ثلاث خطوات من 100 NL فصلها عن بعضها البعض من خلال 30 ثانية. بعد حقن الماضي، وترك حقنة ثابتة لمدة 30 ثانية إلى 1 دقيقة من أجل تجنب التتبع في التدفق من الدماغ.
- سحب ببطء من الحقنة، انتقال أكثر من ذلك الثقب الثاني وكرر نفس العملية مع 300 NL المتبقية التي هي داخل الحقنة.
- بعد الحقنة الثانية، وإزالة حقنة، والشروع في إغلاق WOUالثاني مع 5-0 خياطة وإضافة بضع قطرات من PVP-I.
- نقل الحيوان إلى قفص جديد. لا تضع الحيوانات تعمل مع الحيوانات التي لم يتم تشغيلها. الحيوانات التي خضعت لعملية جراحية يمكن وضعها معا. لا تترك الفئران غير المراقب حتى تكون مستيقظا واستعادت الاستلقاء القصية.
- السماح للحيوان لاسترداد لمدة 10 يوما قبل التضحية.
5. المسالك الراسم المراقبة
- تخدير الحيوان بالكامل في المبادئ التوجيهية المؤسسية. تأكيد التخدير عن طريق ملاحظة عدم وجود استجابة في hindpaw عند الضغط بالأصابع أو مع ملقط. لا المضي قدما حتى الحيوان نائما تماما.
- يروي الحيوانات مع بارافورمالدهيد 4٪ في برنامج تلفزيوني (الرقم الهيدروجيني 7) في إطار البروتوكولات القياسية 6.
- إزالة الدماغ وظيفة الإصلاح من قبل O / N الغمر في 4٪ امتصاص العرق.
- Cryoprotect العقول في السكروز بنسبة 30٪ حتى تغرق في العقول. ثم إزالة العقول وتجميدها قبل 10 ثانية IMMErsion في النيتروجين السائل. إبقاء العقول في -80 درجة مئوية حتى يتم إنتاج المقاطع.
- إنتاج المقاطع في 20 ميكرون لتحليل الوراء المسالك التتبع وبنسبة 40 ميكرون لتقدمي تحليل المسالك التتبع من قبل باجتزاء على cryostate.
ملاحظة: يمكن ملاحظة FG المسمى الخلايا العصبية كما الخلايا البيضاء تحت ضوء الأشعة فوق البنفسجية الإثارة. تم الكشف عن BDA التي كتبها O / N الحضانة مع مجمع أفيدين-البيوتين البيروكسيديز و3،3 'diaminobenzidine مع إضافة النيكل عند 0.4٪ لتعزيز النقيض من الألياف 6،7.
النتائج
قدمنا الحيوانات لمدة 30 دقيقة من وسط المخ انسداد الشريان بواسطة طريقة خياطة داخل اللمعة الأمر الذي أدى إلى آفة في المخطط اليسار ومن ثم تسليمها rhEpo مباشرة إلى الدماغ عن طريق مضخات miniosmotic (الشكل 1، الشكل 3) خلال 30 يوما تبدأ بعد 3 أيام السكتة الدماغية 6. ويبين الشكل 4 التخطيطي الجهاز الشوكي القشرة التي كانت تتبع بعد CB وBDA الحقن والمنطقة حيث تم حقن استشفاف. أظهرنا تحسنا من قوة قبضة والأداء الحركي (الشكل 5) بعد 14 و 42 يوما من تسليم rhEpo على التوالي. تسليم BDA في حق القشرة الحركية من الحيوانات التي تلقت السكتة الدماغية على المخطط الأيسر، وأظهرت زيادة في الألياف الحركية عبور خط منتصف على مستوى النواة الحمراء والوجه (الشكل 5)، مما يدل على تلطيخ الناجح لتنبت الألياف كما لذلك من العلاج الدوائي مع miniosmot مضخات جيم. كما زادت العلاج rhEpo بقاء الخلايا العصبية، وتأخر كثرة الخلايا النجمية منتشر، خفضت تشكيل ندبة الدبقية وزيادة الأوعية الدموية في الفترة المدروسة 6. باستخدام هذه التقنية نفسها لحقن الجهاز التتبع يمكننا بنجاح اكتشاف نواة مهادي التي تتصل القشرة عن طريق الحقن من الوراء المسالك التتبع FG (الشكل 6).

ويمكن ملاحظة الشكل 1. مكونات المضخة miniosmotic المستخدمة في هذا البروتوكول. القرص الفاصل، قنية والتبويب القابلة للإزالة، القسطرة، وتدفق مشرف ومضخة miniosmotic. يمكن أن ينظر إلى الجانب من مضخة تجميعها بشكل كامل في الشكل 2A. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
ithin صفحة = "1"> 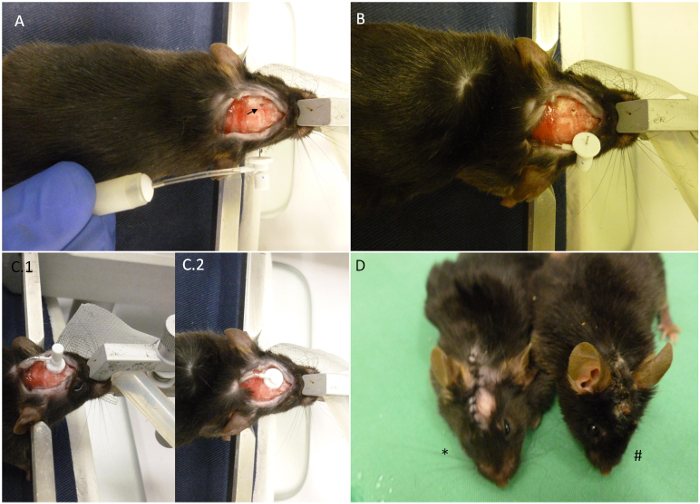
الشكل 2. ملخص للنقاط الرئيسية زرع مضخة. (A) ويرد الماوس كما وضعت على جهاز المجسم مع مضخة miniosmotic تشييده بشكل كامل القادمة إليها. السهم يشير إلى الإحداثيات المختارة للزرع. (B) وقد تم إدخال المضخة على ظهر الحيوان ويبقى فقط قنية على السطح الخارجي. وقد تم بالفعل حفر الجمجمة. (C) جانب من جوانب الرأس بعد الزرع. (C.1) قنية هي على الموقف ولكن لم يتم خفض علامة التبويب القابلة للإزالة. (C.2) تم قطع لسان القابلة للإزالة وخياطة من الجرح يمكن أن تبدأ الآن. (D) وتظهر النجمة حيوان زرعها مؤخرا بالمقارنة مع حيوان 30 يوما بعد الزرع (#). عندما يضم بشكل صحيح، يجب أن يبقى الجرح مغلقة حتى نهاية الإجراء كما هو مبين في الصورة.ove.com/files/ftp_upload/52932/52932fig2large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
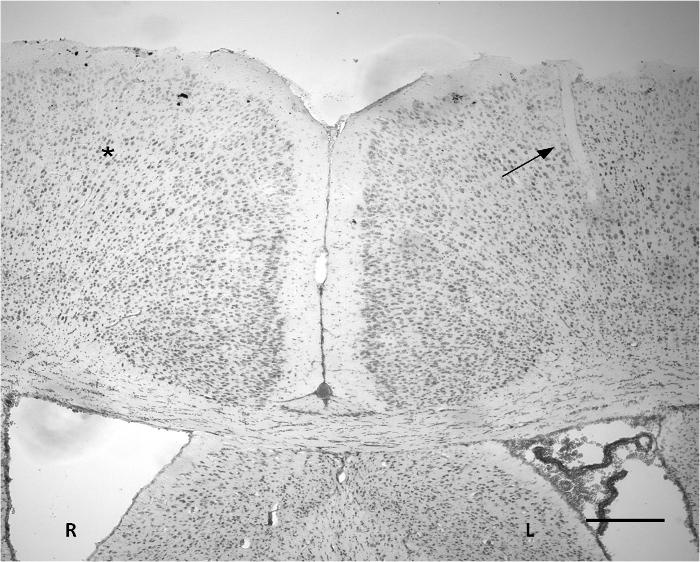
الشكل 3. نيسل تلطيخ تشير إلى موقع زرع على القشرة. ويمكن ملاحظة شق صغير في جزء من القشرة اليسرى (السهم). عرض المنطقة اخترقت حوالي 50 ميكرون. وتوجد التعديلات الأنسجة شديدة واضحة على أساس نيسل تلطيخ بالمقارنة مع المنطقة المقابل المقابلة (*). R: النصف الأيمن. L: نصف الكرة المخية الأيسر. على نطاق وبار = 300 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
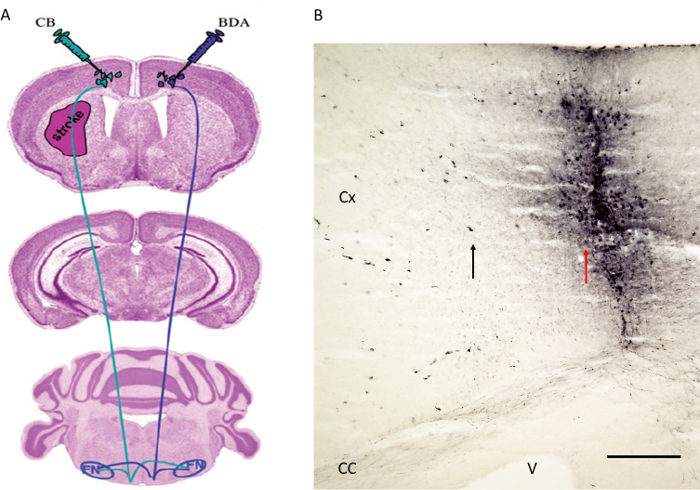
الرقم 4. المسالكاستراتيجية حقن التتبع كما نشرت قبل بواسطة Reitmeier وآخرون 6،7. (A) تم حقن تشير إلى مواقع الحقن تخطيطي للالتتبع المسالك BDA في القشرة الحركية المقابل في حين CB في القشرة الحركية في نصف الكرة محتشية. وتلت الألياف إلى النواة الحمراء (لا يظهر) ونواة الوجه (انظر الشكل 5). (ب) موقع الحقن من التتبع تقدمي المسالك BDA بجوار القشرة الحركية هو مبين. لاحظ السهم الأحمر يشير إلى مسار الإبرة في حين أن السهم الأسود يظهر عدد قليل من الخلايا القشرية المسمى مع BDA. CX: اللحاء. CC: الجسم الثفني. V: البطين. FN: نواة الوجه. شريط النطاق في B = 200 ميكرون. ويرد الشكل 4A بعد الحصول على اذن 6. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
ثم يتم الكشف عن الرقم 5. استرداد المخ محتشية بعد تسليم rhEpo. (A) BDA حقن في القشرة الحركية contralesional في الألياف قشري بصلي على مستوى النواة الوجه (Bregma -5.8 ملم إلى -6.3 ملم). ووضعت خطوط التقاطع على كل الكرة الأرضية بالتوازي مع خط الوسط والألياف عبور كل سطر في الاتجاه إلى نصف الكرة ipsilesional وcontralesional احصي وأعرب عن كنسبة مئوية من إجمالي الألياف وصفت في الجهاز القشري. إرثروبويتين زادت المعابر الألياف في الاتجاه إلى بيانات نواة الوجه contralesional وسيلة + - SD. وقد تم تحليل البيانات عن طريق باتجاه واحد ANOVA تليها أقل اختبارات فروق ذات دلالة إحصائية، §P <0.05 مقارنة مع الفئران المعالجة مركبة غير الدماغية. أظهر (B) السلوك موتور تحسنا من ناحية قوة قبضة والتنسيق في اختبار روتا قضيب. البيانات VALU متوسطوفاق + - SD. وقد تم تحليل البيانات عن طريق ذات اتجاهين التدابير المتكررة ANOVA، تليها في اتجاه واحد ANOVA / الأقل أهمية الاختلافات الاختبارات لكل نقطة في الوقت. §P <0.05 مقارنة مع خط الأساس قبل الدماغية. * P <0.05 مقارنة مع سيارة الفئران المعالجة الدماغية. أرقام ترد 5A وباء بعد الحصول على اذن 6. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
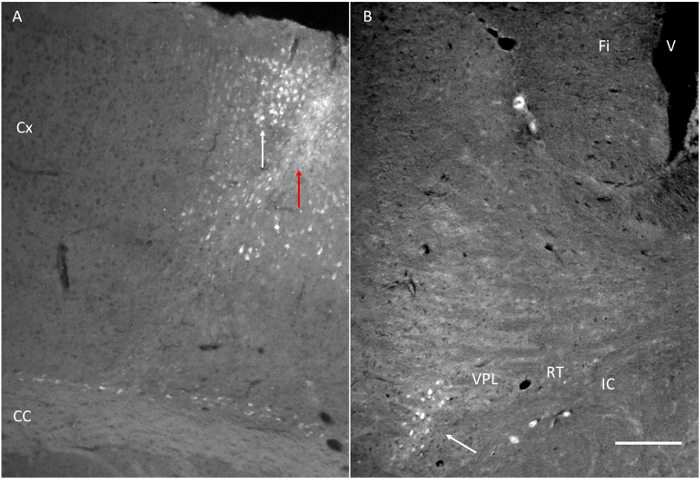
الرقم الهياكل 6. الهدف صلت بعد حقن fluorogold (FG). (A) موقع حقن FG المقبل إلى القشرة الحركية كما هو مبين في الشكل 1. لاحظ السهم الأحمر يشير إلى مسار الإبرة والسهم الأبيض يشير إلى وجود عدد قليل من الخلايا المسمى في القشرة. (B) حقن FG قرب المحركتم الكشف عن القشرة في VPL. فاي: الخمل. IC: كبسولة الداخلية. RT: نواة مهادي شبكي. VPL: مهادي نواة خلفية وحشية بطني. على نطاق وبار = 200 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
لسنوات عديدة، وقد ركزت الأبحاث على الظروف العصبية مثل السكتة الدماغية أو إصابات في الدماغ على تطوير علاجات اعصاب التي تهدف إلى تعزيز بقاء الخلايا العصبية في مرحلة السكتة الدماغية الحادة. الغالبية العظمى من العلاجات المخدرات التي تم العثور عليها لتكون فعالة في نماذج القوارض فشلت عندما تترجم إلى العيادة. وتشمل أسباب هذا الفشل العلاجي ولكن لا تقتصر على عدم وجود آثار المخدرات متواصلة مما أدى إلى استمرار الانتعاش عصبي وظيفي. وبالتالي فمن المهم وضع استراتيجيات تعمل على إعادة تشكيل الدماغ على المدى الطويل. لأن تعزيز بقاء الخلايا العصبية وحدها ليست كافية للسماح ناجح الانتعاش السكتة الدماغية، كما اقترح عدد كبير من التجارب غير الناجحة العصبية، وتحفيز اللدونة العصبية قد تم الحصول عليها مؤخرا مصلحة كبرى في هذا المجال.
يعني لتسليم المخدرات هي حقن داخل الصفاق، وذيل ط داخل الأوعية الدمويةnjection، حقن الفخذ، حقن المجسم واحدة من ناقلات في الدماغ واصل تسليم المستمر بواسطة مضخات miniosmotic. هذا الأخير يمكن أن تشمل تسليم النظامية، وإذا لم يكن لمضخة قنية، أو التي يمكن أن جهاز توجيه، كما بينا للتسليم في الدماغ. باستثناء مضخات miniosmotic واستخدام ناقلات فيروسية، وجميع استراتيجيات أخرى لحث تركيزات المخدرات المتقلبة. لإجراء التجارب على المدى الطويل وبالتالي يصبح من الضروري أن يقدم الحيوان إلى الضغط من تلقي الحقن المتكررة. وBBB يفرض عائقا هاما للامتصاص الدماغ للبروتينات أو المخدرات من الدم، مما أدى إلى الحاجة لكبيرة من البروتين أو المخدرات جرعات من أجل تحقيق تركيزات العلاجية في الدماغ. على سبيل المثال بيليجريني وآخرون (2013) 5 تسليمها rhEpo عن طريق الحقن داخل الصفاق بجرعة أي ما يعادل 75 وحدة دولية / يوم للحيوان من 30 غرام (750 وحدة دولية / يوم لمدة 300 غرام الفئران). وبالمقارنة، فإن تسليم rhEp المستهدفةس إلى الدماغ يسمح لنا باستخدام جرعة أقل بكثير من فقط 10 وحدة دولية / يوم في دراستنا لنجاح الانتعاش السكتة الدماغية، والتي مكنتنا من تحقيق الانتعاش خلال فترة زمنية كبيرة بسعر ثابت من 0.25 ميكرولتر / ساعة.
في هذا العمل أظهرنا طريقة زرع minipumps مع قنية متصلة الجمجمة من أجل تقديم البروتين تعزيز مرونة rhEpo مباشرة إلى البطين، وبالتالي الالتفاف على BBB. بهذه الطريقة، وروجت rhEpo الانتعاش العصبية في عدد من الطرق، بما في ذلك الحد من حجم احتشاء، والحد من تشكيل ندبة الدبقية وتحريض الأوعية الدموية. كما عزز rhEpo بقاء الخلايا العصبية وزيادة التوقعات من القشرة الحركية contralesional نحو النواة الحمراء مزالة العصب والنوى الوجه. تم الكشف عن البكتيريا من الألياف عن طريق الحقن من التتبع تقدمي المسالك BDA في القشرة الحركية (أرقام 4A و 5A). والمتعلقات وظيفية لتنتشر من الألياف هو العلاقات العامةovided من تحسين المهارات الحركية (الشكل 5B). بالإضافة إلى ذلك، لقد أظهرنا أن النهج نفسه لحقن الجهاز التتبع يمكن تطبيقها على كشف النقاب عن اتصالات-المهادي القشري عن طريق الحقن من الوراء المسالك التتبع FG (الشكل 6B).
في إعداد المضخة miniosmotic، فمن الأهمية بمكان أن ينظر في نقطة الهدف واستخدام الفواصل. نحن نستخدم هل احد للحد من طول الإبرة من قبل 0.5MM كما في هذه الطريقة غيض جدا من الإبرة على اتصال مع البطين في إحداثيات معينة (-0.2 مم الذيلية، 0.9 ملم الوحشي، و 2.5 مم ظهراني بطني، مع يتعلق bregma). ولكن إذا البنى العميقة هي الهدف من هذا البحث، ثم سوف تكون هناك حاجة إلى الفواصل. وبالمثل، إذا هو المطلوب نقطة التسليم الخارجية المزيد (أي.، القشرة)، ثم المزيد من أقراص هل سيكون ضروريا. يجب أن تكون القسطرة طويلة بما فيه الكفاية بحيث مضخة ليست قريبة جدا من الرأس، لأنها سوف تعيق تحركات مذكرة التفاهمحد ذاتها، ولكن أيضا ليست طويلة جدا ومرة واحدة زرعها الطول المفرط قد يسبب القسطرة لثني، مما يزيد من خطر إزالة قنية من قبل الحركة الطبيعية من الفأرة. مقطع من 2 سم من القسطرة يعطي نتائج جيدة جدا من حيث التنقل والاستقرار للزرع (الشكلان 1 و 2). حضانة المضخة عند 37 درجة CO / N يسمح للمضخة لبدء ضخ المخدرات في الدماغ في لحظة زرع على الفور.
في زرع مضخة miniosmotic فمن الأهمية بمكان أن نؤكد أن الجمجمة تجفف بشكل صحيح قبل زرع قنية. عادة تنظيف مع 70٪ من الإيثانول من شأنها أن تحفز العظام لتجف، ولكن إذا وجدت النزيف المستمر، ولمس الجمجمة بلطف مع cauterizer سوف تجف تماما. ومن الأهمية بمكان أن نؤكد أن إدخال الإبرة كما العمودي وبطء ممكن. مرة واحدة في الموقف، وعلى الرغم من الغراء هو تجفيف، ووضع الإصبع على رأس قنية يمنعها من التحرك جانبيا اوفإيه الجمجمة. وينبغي إيلاء عناية خاصة على الجرح ووضع قنية. من المهم أن شق لا يتم تنفيذ بالضبط على خط الوسط من الجمجمة ولكن قليلا إلى الجانب الأيمن. عند إغلاق الجرح، إذا تم إجراء شق في خط الوسط، والجلد سوف يكون فوق طاقتها، مما يزيد من خطر فتح الجروح. وجعل شق قليلا إلى جانب واحد يسمح النقاط خياطة ليكون بعيدا عن أعلى جزء من قنية. ونتيجة لذلك سيكون هناك أقل من التوتر في نقاط خياطة وسوف الجرح تلتئم بشكل صحيح. وينبغي قفص الحيوانات وحده، وفحص كل يوم، وخصوصا خلال 10-15 يوما الأولى بعد الزرع. في حالة تفزر الجرح، الجروح يجب أن تكون مغلقة في أقرب وقت ممكن. إذا قنية إزالة أو تقدم الحيوان عدوى، لابد من انتهاء التجربة. لا ينصح بإعادة غرس قنية. من المهم جدا لزرع ناجحة لاستخدام كميات كافية من إعلان النسيجhesive (ليس كثيرا!) لأنه يحط من العظام ويزيد من خطر إزالة قنية. ومع ذلك باستخدام لاصق صغير جدا أيضا لن يعقد قنية تعلق على العظام. يمكن للمضخات miniosmotic تحمل الأدوية الذائبة في مجموعة واسعة من المواد، ويجري القيد الوحيد لهذا أن المذيب حيويا. بالإضافة إلى ذلك، بالنظر إلى أن حجم صغير يجب (200 ميكرولتر) واحد تحديد ما إذا كان التركيز المطلوب للتجربة هو مناسب ولن يسبب هطول الأمطار داخل المضخة.
الجهاز تتبع إما تقدمي أو رجعي استشفاف هو أسلوب جدا راسخة لدراسة الربط الدماغ واللدونة. يجب أن تعطى الرعاية للإطارات استخدام المجسم عند حقن لضمان الدقة في استهداف منطقة الدماغ يرغب المرء في دراسة (أي، لمنع حقن في الجسم الثفني عند حقن القشرة).
لجميع التدخلات الجراحية وسعيا للحد من الألم والتهاب، ينبغي أن يعامل الحيوانات مع 0.1 ملغم / كغم البوبرينورفين قبل التدخل وCaprofen في 4 ملغم / كغم مرة واحدة في اليوم لمدة ثلاثة أيام بعد تدخل.
وفي الختام، فإن هذا النهج يوفر أداة مناسبة لدراسة تأثير البروتينات أو المركبات الدوائية في الدماغ المصاب، وهو ما يمثل الطريقة التي هي مناسبة تماما لإجراء دراسات عن ليونة الدماغ.
Disclosures
الإنتاج والوصول المفتوح رسوم النشر التي تقدمها شركة DURECT، التي تنتج مضخات miniosmotic المستخدمة في هذه المادة.
Acknowledgements
This work was supported by the Dr. Werner Jackstädt Foundation (to Eduardo Sanchez-Mendoza), the German Academic Exchange Service (DAAD; to Jeismar Carballo), the German Research Council (HE3173/2-1, HE3173/2-2, and HE3173/3-1; to Dirk M. Hermann), Heinz Nixdorf Foundation (to Dirk M. Hermann).
Materials
| Name | Company | Catalog Number | Comments |
| Alzet miniosmotic pump. Model 2004. | Alzet | 000298 | Drug container |
| Brain infusion kit 3 1-3 mm | Alzet | 0008851 | Drug brain delivery system |
| Loctite 454 Prism gel | Loctite | 45404 | Cyanoacrylate adhesive for cannula adhesion to the skull |
| 75N glass syringe | Hamilton | 87900/00 | Injection of tract tracers |
| Biotin Dextran Amine (10,000 MW) | Molecular probes | N-7167 | Anterograde tract tracer |
| Fluorogold | Fluorochrome, LLC. | Retrograde tract tracer | |
| Quintessential Stereotaxic Injector (QSI) | Stoelting | 53311 | Stereotactic device for coordinate determination, pump implantation and tract tracer injection. |
References
- Doeppner, T. R., et al. MicroRNA-124 protects against focal cerebral ischemia via mechanisms involving Usp14-dependent REST degradation. Acta Neuropathol. 126, 251-265 (2013).
- Hoyo-Becerra, C., et al. Rapid Regulation of Depression-Associated Genes in a New Mouse Model Mimicking Interferon-alpha-Related Depression in Hepatitis C Virus Infection. Mol Neurobiol. , (2014).
- Puntel, M., et al. Gene transfer into rat brain using adenoviral vectors. Curr Protoc Neurosci. Chapter 4, Unit 4.24 (2010).
- Miao, J., et al. Overexpression of adiponectin improves neurobehavioral outcomes after focal cerebral ischemia in aged mice. CNS Neurosci Ther. 19, 969-977 (2013).
- Pellegrini, L., et al. Therapeutic benefit of a combined strategy using erythropoietin and endothelial progenitor cells after transient focal cerebral ischemia in rats. Neurol Res. 35, 937-947 (2013).
- Reitmeir, R., et al. Post-acute delivery of erythropoietin induces stroke recovery by promoting perilesional tissue remodelling and contralesional pyramidal tract plasticity. Brain. 134, 84-99 (2011).
- Reitmeir, R., et al. Vascular endothelial growth factor induces contralesional corticobulbar plasticity and functional neurological recovery in the ischemic brain. Acta Neuropathol. 123, 273-284 (2012).
- Hermann, D. M., Chopp, M. Promoting brain remodelling and plasticity for stroke recovery: therapeutic promise and potential pitfalls of clinical translation. Lancet Neurol. 11, 369-380 (2012).
- Overman, J. J., et al. A role for ephrin-A5 in axonal sprouting, recovery, and activity-dependent plasticity after stroke. Proc Natl Acad Sci U S A. 109, E2230-E2239 (2012).
- Wolf, W. A., Martin, J. L., Kartje, G. L., Farrer, R. G. Evidence for Fibroblast Growth Factor-2 as a Mediator of Amphetamine-Enhanced Motor Improvement following Stroke. PLoS One. 9, e108031 (2014).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rulicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51, 443-456 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved