Method Article
Implantation de miniosmotique Pompes et livraison de traceurs pour étudier la réorganisation des secteurs du cerveau dans des conditions physiopathologiques
Dans cet article
Résumé
In order to study brain reorganization under pathological conditions we used miniosmotic pumps for direct protein delivery into the brain circumventing the blood brain barrier. Tract tracers are then injected to study alterations in brain connectivity under the influence of the protein.
Résumé
Pharmacological treatment in animal models of cerebral disease imposes the problem of repeated injection protocols that may induce stress in animals and result in impermanent tissue levels of the drug. Additionally, drug delivery to the brain is delicate due to the blood brain barrier (BBB), thus significantly reducing intracerebral concentrations of selective drugs after systemic administration. Therefore, a system that allows both constant drug delivery without peak levels and circumvention of the BBB is in order to achieve sufficiently high intracerebral concentrations of drugs that are impermeable to the BBB. In this context, miniosmotic pumps represent an ideal system for constant drug delivery at a fixed known rate that eludes the problem of daily injection stress in animals and that may also be used for direct brain delivery of drugs. Here, we describe a method for miniosmotic pump implantation and post operatory care that should be given to animals in order to successfully apply this technique. We embed the aforementioned experimental paradigm in standard procedures that are used for studying neuroplasticity within the brain of C57BL6 mice. Thus, we exposed animals to 30 min brain infarct and implanted with miniosmotic pumps connected to the skull via a cannula in order to deliver a pro-plasticity drug. Behavioral testing was done during 30 days of treatment. After removal the animals received injections of anterograde tract tracers to analyze neuronal plasticity in the chronic phase of recovery. Results indicated that neuroprotection by the delivered drug was accompanied with increase in motor fibers crossing the midline of the brain at target structures. The results affirm the value of these techniques for drug administration and brain plasticity studies in modern neuroscience.
Introduction
The delivery of proteins and pharmacological compounds into the brain are important strategies for studying mechanisms underlying brain diseases and evaluating candidate molecules for new treatments 1,2. In experimental neurosciences, the delivery of vectors such as plasmids or adenoviruses has become an important tool for studying long-term actions of proteins in the brain 3,4. Single injections of vectors present the advantage of a system which by itself will maintain highly stable levels of the therapeutic agent in the brain 4. However, for long term experiments with purified drugs systemic administration by intraperitoneal injection induces stress in mice or rats, and is not the best choice when a targeted brain response is needed, requiring also large doses of drug5. Miniosmotic pumps represent an ideal system for prolonged direct drug delivery into the brain by circumventing both low accessibility to the brain and also peaks of drug concentration, as the delivery of the drug happens directly into a targeted place in the brain and at a fixed flow rate determined by the pump model that is chosen2,6,7. Indeed, this system has allowed us to successfully study brain recovery after stroke by delivery of several drugs such as recombinant human erythropoietin (rhEpo) and vascular endothelial growth factor 6,7.
Brain plasticity is essential for the rewiring of connections in response to brain injuries. Plasticity is a broad concept that ranges from the formation or elimination of synaptic contacts, growth of dendritic spines and also elongation or retraction of long distance connections8,9. The brain was previously believed to not be capable of reconstructing connections after a lesion. However many approaches have shown that if properly stimulated it can reestablish connectivity 6,7,10. One technique that is particularly useful to study this is the use of tract tracers. Anterograde tract tracers are compounds that can enter neurons at the soma and then distribute all along the axons until these reach their target structures. Two examples are cascade blue (CB) and biotinylated dextran amine (BDA). Conversely, retrograde tract tracers, such as cholera toxin B (CTB) or fluorogold (FG) enter the neuron through the axon terminal and then distribute back to the soma thus revealing the site of origin of neurons targeting the injection site.
Here, we present the methods that we use for implantation of miniosmotic pumps for direct delivery of proteins or drugs that have potential effects on neural plasticity as well as the injection of BDA and FG to unveil input and output connections to the motor cortex. BDA will also be used as an example of a tract tracer used to demonstrate increased plasticity of axons emerging from the co after stroke under rhEpo treatment.
Protocole
Les expérimentations animales ont été réalisées avec l'approbation du gouvernement (G1361 / 13, AZ84-02.04.2013.A192 et G1362 / 13, AZ84-02.04.2013.A194; Bezirksregierung Düsseldorf) basée sur les lignes directrices des NIH pour le soin et l'utilisation des animaux de laboratoire.
1. Préparation de miniosmotique Pompes
- Dans un environnement stérile (par exemple., Culture cellulaire hotte), obtenir la pompe, un cathéter, modérateur, le cerveau canule de perfusion et les disques d'écartement à utiliser (figure 1) couler.
- Pour l'administration de médicaments directement dans les ventricules utiliser une rondelle d'écartement de sorte que seule la pointe de l'aiguille de canule est en contact avec le ventricule. Tenez la canule à l'envers avec une pince. Ajouter deux gouttes de colle cyanoacrylate (CA) et d'introduire un disque d'écartement.
- Laisser la canule sur une surface plane tournée vers le haut de sorte que la colle entre le disque d'écartement et le séchage de la canule.
- Couper le cathéter dans les sections de 2,5 cm environ.
- Pour eaPompe à ch, préparer un minimum de 300 à 350 ul de la solution d'intérêt comme il sera nécessaire pour remplir complètement la pompe à extruder ainsi que tout l'air à l'intérieur de celui-ci pour empêcher la formation de bulles à l'intérieur du cathéter. bulles entraver l'écoulement de la solution dans le cerveau.
- Branchez soigneusement le cathéter à l'animateur de flux.
- En utilisant une seringue de 2 ml relié à l'aiguille fournie par le kit de perfusion cérébrale, remplir la pompe jusqu'à ce qu'une petite quantité de solution échappe à la pompe, empêchant ainsi les bulles d'air à l'intérieur.
- Remplissez soigneusement le modérateur d'écoulement et le cathéter de prêter attention à empêcher les bulles restantes à l'intérieur du cathéter.
- Présentez le modérateur d'écoulement à l'intérieur de la pompe.
- Une fois rempli, soigneusement connecter la canule à l'extrémité du cathéter. Si on observe que une bulle est formée retirer la canule et soigneusement remplir le cathéter avec le véhicule ou la solution de médicament et ensuite réintroduire la canule.
- Placez le PUPoint de fusion dans un récipient avec une solution saline stérile et le laisser à 37 ° CO / N.
- Avant l'implantation revérifier pour la formation de bulles. Si nécessaire (ie., Les bulles sont observées) enlever la canule et remplir le tube. Rebranchez la canule. Ce ne devrait prendre que quelques microlitres de solution.
2. Implantation de miniosmotique Pompes
Remarque: Pour ces expériences par animaux ont été anesthésiés à l'isoflurane à 1% (30% O 2, 70% N 2 O). Toutefois, si ce ne sont pas disponibles, l'utilisation des injections intraperitoneales de l'anesthésie est également possible 11.
- Localisez l'animal dans le dispositif stéréotaxique sous anesthésie et couvrir les yeux avec un onguent protecteur pour prévenir la sécheresse tandis que sous anesthésie. Confirmer anesthésie par l'observation d'une absence de réponse dans la patte arrière lorsqu'il est pressé avec les doigts ou avec une pince. Ne pas procéder jusqu'à ce que l'animal est complètement endormi.
- Couper la fourrure sur ilannonce soit avec des ciseaux ou un appareil de rasage. Couper autant que possible sans endommager la peau.
- Nettoyer la peau avec 70% d'éthanol et de désinfectant avec des propriétés antibactériennes et fongicides.
- Avec un scalpel ouvrir une incision de 1 cm légèrement à droite de la ligne médiane et exposer le crâne.
- Nettoyez le crâne avec un coton-tige. Faire tremper avec 70% d'éthanol et le passer sur le crâne. Cela entraînera le crâne de sécher.
- Si le crâne a de légers saignements, utiliser un cauterizer pour éliminer tous les points de saignement. Sang empêche le CA de sécher correctement sur l'os une fois que la canule est implanté.
- Utilisez l'appareil stéréotaxique de faire une marque sur le point du crâne où la canule sera implanté. Pour infusions ventriculaires sur les coordonnées de l'hémisphère gauche sont -0.2 mm caudale, 0,9 mm latéral bregma (figure 2A).
- Percer délicatement sur le crâne faisant un angle de 45 °; cela empêche le forage d'aller accidentellement dans le brain. Forer à plusieurs reprises pendant quelques secondes, puis vérifier la profondeur du trou est. Arrêtez de forage une fois que le crâne a été amincie mais toujours pas pleinement pénétré.
- Cassez les méninges avec la pointe d'une aiguille stérile jusqu'à un accès complet au cerveau est atteint. Faire doucement afin de ne pas endommager le cerveau.
- Nettoyez le crâne avec 70% d'éthanol en utilisant un coton-tige.
- Présentez une pince droites sous la peau de l'animal dans une direction antéro-caudale. Utilisez la pince pour ouvrir l'espace sous la peau dans le dos de l'animal où la pompe sera implanté. Introduire la pompe dans le dos de l'animal de quitter le cathéter et la canule à l'extérieur (figure 2B). La pompe restera dans cette position jusqu'à ce qu'elle soit retirée et n'a pas besoin de tout type de fixation.
- Placez soigneusement quatre petites gouttes de colle à côté de l'aiguille dans la canule.
- Introduire délicatement l'aiguille à travers le crâne sans le déplacer latéralement. Maintenez-le en position pendant 15-30 secondes uusqu'à la canule est complètement attaché (Figure 2C.1). Une fois en place, la canule sera atteindre 2,5 mm dans la direction ventrale dorso si une rondelle d'écartement a été utilisé. Si elle est correctement attaché, la canule restera attaché à l'os jusqu'à la fin de l'expérience.
- Placez un doigt sur l'onglet amovible et ensuite utiliser l'autre main pour couper par son col avec un ensemble de ciseaux (Figure 2C.2).
- Fermer la plaie sur la peau avec une suture 5-0 et ajouter quelques gouttes d'une solution de povidone-iode (PVP-I) au-dessus de la plaie pour empêcher l'infection (Figure 2D).
- Déplacez l'animal dans une nouvelle cage. Ne placez pas des animaux exploités avec des animaux qui ne sont toujours pas exploités. Gardez les animaux qui ont été implantés avec des pompes seules dans leurs cages pendant la période d'administration du médicament.
- Ne pas laisser sans surveillance souris jusqu'à ce qu'ils sont éveillés et ont retrouvé décubitus sternal.
3. Pompe removal
Remarque: Habituellement, l'expérience se terminera à la fin du délai de livraison autorisé par la pompe, mais il est possible de retirer la pompe afin de faire des expériences secondaires comme un suivi de la délivrance de médicaments. Pour ce faire voies injections traçantes il est donc nécessaire de retirer la pompe.
- Placer l'animal dans le dispositif seterotactic sous anesthésie et couvrir les yeux avec une pommade de protection pour empêcher tout siccité sous anesthésie. Confirmer anesthésie par l'observation d'une absence de réponse dans la patte arrière lorsqu'il est pressé avec les doigts ou avec une pince. Ne pas procéder jusqu'à ce que l'animal est complètement endormi.
- Ouvrir délicatement la peau en coupant à travers l'incision effectuée le jour de l'implantation de la pompe.
- Avec une pince chirurgicale maintenir la canule et le sortir. Il doit être facilement retiré du crâne. Comme devrait saignements douce, l'arrêter en plaçant un coton-tige et d'attendre pendant 1-2 min.
- Retirer la pompe par le cathéter. Illp il sortir en le poussant, créant une pression sur la peau.
- Fermer la plaie à nouveau avec une suture 5-0 et ajouter quelques gouttes de PVP-I.
- Déplacez l'animal dans une nouvelle cage. Ne pas mettre les animaux exploités avec des animaux qui ne sont toujours pas exploités. Les animaux qui ont subi une chirurgie peuvent être mis ensemble.
- Ne pas laisser sans surveillance souris jusqu'à ce qu'ils sont éveillés et ont retrouvé décubitus sternal.
- Permettre à l'animal de récupérer pendant 10 jours avant de procéder à l'injection de traceur des voies.
4. Pression Tract Tracer injection à 45 ° Angles sur le droit Motor Cortex
- Placez l'animal sur le dispositif stéréotaxique sous anesthésie et couvrir les yeux avec un onguent protecteur pour prévenir la sécheresse tandis que sous anesthésie. Confirmer anesthésie par l'observation d'une absence de réponse dans la patte arrière lorsqu'il est pressé avec les doigts ou avec une pince. Ne pas procéder jusqu'à ce que l'animal est complètement endormi.
- Ouvrez la blessure à la tête.
- Cappuyer le crâne avec 70% d'éthanol en utilisant un coton-tige.
- Présentez un verre seringue de 5 pi (26S bis) sur le support vertical du dispositif. Assurez-vous que l'extrémité inférieure du support de verre est précisément à la pièce de maintien. La seringue ne doit pas être trop loin en dessous comme alors, il sera impossible de le placer à 45 ° de la position verticale et effectuer l'injection.
- Orienter la seringue directement sur bregma et puis recherchez les coordonnées désirées. Pour une injection sur les coordonnées du cortex moteur sont: le Point n ° 1: +0,5 mm rostrale et 2,5 mm latéral par rapport à bregma. Point # 2: 1,34 mm rostrale, 2,5 mm latéral par rapport à bregma.
- Une fois les coordonnées ont été localisés, indiquer leur position sur le crâne avec un marqueur avec une pointe fine. Faire un seul point dans le crâne que la libération excessive d'encre pourraient cacher la bonne coordonnée.
- Percez soigneusement le crâne tenant la perceuse à 45 °. Comme dans l'étape 2.8, consultez le crâne fréquemment afin qu'il ne soit pas entièrement perfest filmée afin d'éviter des dommages au cerveau causés par le forage. Utilisez la pointe d'une seringue pour assurer que tous les os a été enlevée.
- Chargez 600 nl de voies traceur dilution dans la seringue.
- Ajuster la position verticale de 45 ° vers la droite de l'animal. Sous le microscope, placer la pointe de l'aiguille de la seringue juste en face du trou.
- Le déplacer dans la direction verticale de 1,5 mm. Laissez l'aiguille stable dans cette position pendant 30 secondes à 1 minute avant de faire des injections de pression.
- Injecter 300 nl de dilution traceur en trois étapes de 100 nl séparées les unes des autres par 30 sec. Après la dernière injection, laissez la seringue stable pour 30 secondes à 1 minute afin d'éviter le traceur à circuler sur le cerveau.
- Tirez doucement sur la seringue, le transférer sur le deuxième trou et répétez le même processus avec le 300 nl restant qui sont à l'intérieur de la seringue.
- Après la seconde injection, retirer la seringue et procéder à fermer le woue avec une suture 5-0 et ajouter quelques gouttes de PVP-I.
- Déplacez l'animal dans une nouvelle cage. Ne pas mettre les animaux exploités avec des animaux qui ne sont toujours pas exploités. Les animaux qui ont subi une chirurgie peuvent être mis ensemble. Ne pas laisser sans surveillance souris jusqu'à ce qu'ils sont éveillés et ont retrouvé décubitus sternal.
- Permettre à l'animal de récupérer pendant 10 jours avant de les sacrifier.
5. Tract Tracer Observation
- Anesthésier l'animal entièrement par les directives institutionnelles. Confirmer anesthésie par l'observation d'une absence de réponse dans la patte arrière lorsqu'il est pressé avec les doigts ou avec une pince. Ne pas procéder jusqu'à ce que l'animal est complètement endormi.
- Perfuser les animaux avec du paraformaldéhyde 4% dans du PBS (pH 7) sous des protocoles standard 6.
- Retirer le cerveau et après correction par O / N immersion dans 4% de paraformaldehyde.
- Cryoprotect cerveaux en saccharose à 30% jusqu'à ce que les cerveaux évier. Ensuite, retirer les cerveaux et les congeler par 10 sec immérsion dans l'azote liquide. Gardez cerveaux à -80 ° C jusqu'à ce que les sections sont produites.
- Produire des sections à 20 um pour l'analyse rétrograde du traceur et de l'appareil à 40 um pour l'analyse du traceur antérograde des voies en sectionnant sur un cryostate.
Remarque: les neurones FG étiquetés peuvent être observés que les cellules blanches sous la lumière ultraviolette excitation. BDA est détecté par O / N incubation avec un complexe avidine-biotine-peroxydase et 3,3 'diaminobenzidine avec addition de nickel à 0,4% pour augmenter le contraste des fibres 6,7.
Résultats
Nous avons soumis les animaux à 30 min de l'occlusion de l'artère cérébrale moyenne par la méthode de suture intraluminale induire une lésion dans le striatum gauche puis livré rhEpo directement dans le cerveau au moyen de pompes miniosmotiques (figure 1, figure 3) pendant 30 jours à partir de 3 jours après AVC 6. La figure 4 montre un schéma de la cortico voies vertébrale qui a été tracée après l'injection CB et BDA et la zone où les traceurs ont été injectés. Nous avons montré une amélioration de la force de préhension et de la performance du moteur (Figure 5) après 14 et 42 jours de la livraison rhEpo respectivement. Livraison de BDA dans le cortex moteur droit d'animaux qui ont reçu un coup sur le striatum gauche, a montré une augmentation des fibres motrices franchissant la ligne médiane au niveau du noyau rouge et du visage (figure 5), ce qui démontre une coloration réussie de germination fibres comme une conséquence d'un traitement pharmacologique avec miniosmotPompes ic. traitement rhEpo également augmenté la survie neuronale, retardé astrocytose diffuse, réduit la formation de cicatrice gliale et a augmenté l'angiogenèse dans la période étudiée 6. En utilisant la même technique pour l'injection de traceur de l'appareil on peut détecter avec succès noyaux thalamiques qui sont connectés au cortex par injection du traceur rétrograde des voies FG (Figure 6).

Figure 1. Composants de la pompe miniosmotique utilisé dans ce protocole. Le disque d'écartement, canule et languette amovible, cathéter, modérateur et circuler pompe miniosmotique peuvent être observées. L'aspect de la pompe entièrement assemblé peut être vu dans la figure 2A. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
SEIN-page = "1"> 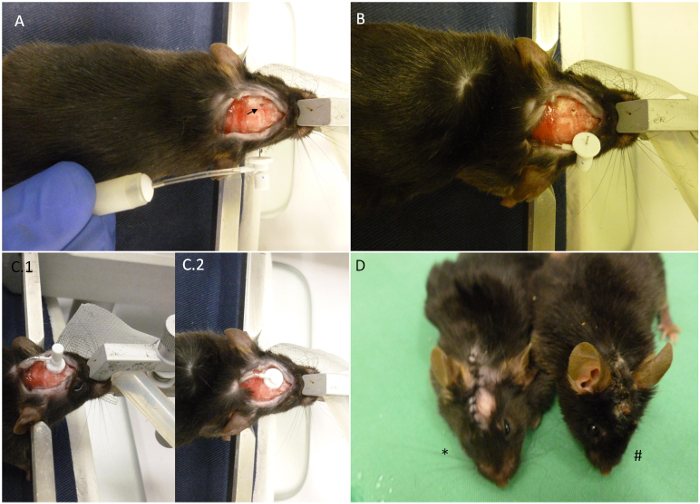
Figure 2. Résumé des principaux points pompe d'implantation. (A) La souris est affiché comme placé sur le dispositif stéréotaxique avec la pompe miniosmotique entièrement construit à côté de lui. La flèche indique les coordonnées sélectionnées pour l'implantation. (B) La pompe a été introduit sur le dos de l'animal et que la canule reste à l'extérieur. Le crâne a déjà été foré. (C) Aspect de la tête après l'implantation. (C.1) La canule est en position, mais l'onglet amovible n'a pas été coupé. (C.2) L'onglet amovible a été coupé et des coutures la plaie peut alors commencer. (D) L'astérisque indique un animal récemment implanté par rapport à un animal de 30 jours après l'implantation (#). Lorsque logé correctement, la plaie doit rester fermée jusqu'à la fin de la procédure, comme indiqué sur l'image.ove.com/files/ftp_upload/52932/52932fig2large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
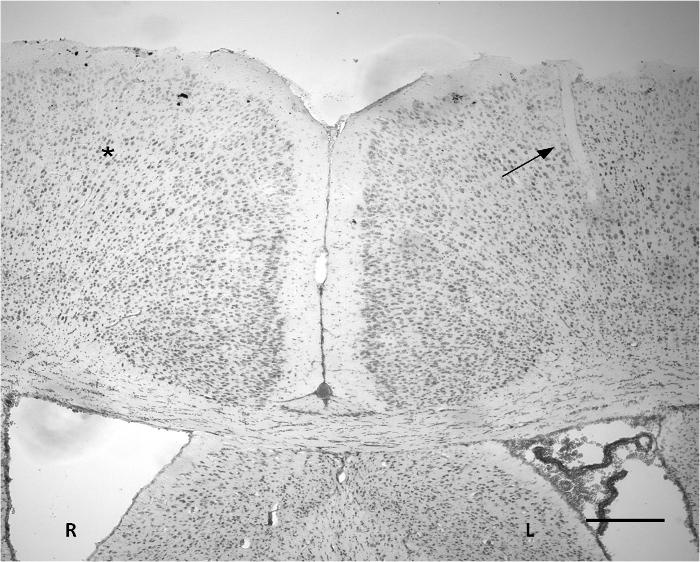
Figure 3. coloration de Nissl indiquant le site d'implantation sur le cortex. Une petite incision peut être observé sur une partie du cortex gauche (flèche). La largeur de la zone pénétrée est d'environ 50 um. L'n'y a pas d'altérations tissulaires graves évidentes fondées sur coloration de Nissl par rapport à la zone controlatérale correspondant (*). R: Hémisphère droit. L: hémisphère gauche. Barre d'échelle = 300 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
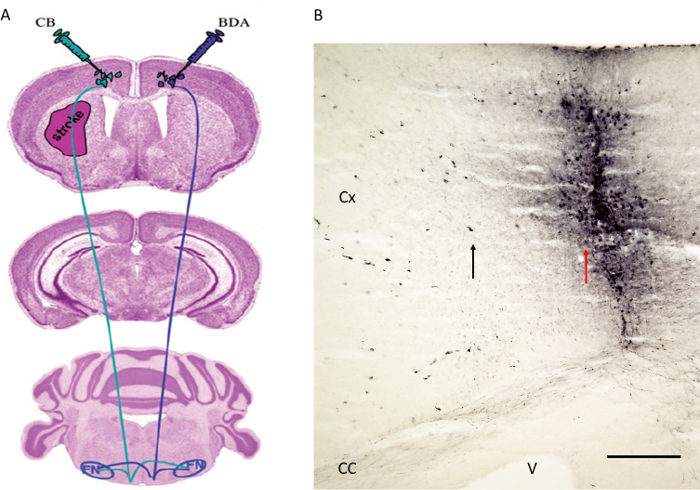
Figure 4. Tractla stratégie d'injection de traceur tel que publié auparavant par Reitmeier et al. 6,7. (A) Schéma indiquant les sites d'injection pour le traceur des voies BDA au cortex moteur controlatéral alors été injectés dans les CB du cortex moteur de l'hémisphère infarci. Les fibres ont été suivis dans le noyau rouge (non représentée) et le noyau facial (voir figure 5). (B) Le site d'injection du traceur antérograde des voies BDA côté du cortex moteur est représenté. Notez la flèche rouge indiquant le trajet de l'aiguille alors que la flèche noire montre quelques cellules corticales étiquetés avec le BDA. Cx: Cortex. CC: du corps calleux. V: ventricule. FN: noyau facial. La barre d'échelle en B = 200 um. Figure 4A est reproduit avec l'aimable autorisation 6. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Figure 5. Recouvrement de cerveau infarci une livraison de rhEpo après. (A) injecté dans le BDA cortex moteur contralésionnel est ensuite détecté en fibres de corticobulbaires au niveau du noyau facial (Bregma -5,8 mm à -6,3 mm). Lignes d'intersection sur chaque hémisphère ont été établis parallèlement à la ligne médiane et fibres qui traversent chaque ligne en direction de l'hémisphère ipsilésionnelle et contralésionnel ont été comptés et exprimés en pourcentage de fibres marqués au total dans le tractus cortico-spinal. Érythropoïétine augmenté passages de fibres dans le sens des données de noyau facial contralésionnel sont des moyens + - SD. Les données ont été analysées par une ANOVA suivie par les moindres différences essais importants, §P <0,05 par rapport aux souris non ischémiques traités avec le véhicule. (B) le comportement du moteur a montré une amélioration de la force de préhension de la main et de la coordination dans le test de la tige de rotation. Les données sont Valu moyenneses + - SD. Les données ont été analysées par des mesures répétées ANOVA à deux voies, suivie d'une ANOVA / moins importantes différences tests pour chaque point de temps. §P <0,05 par rapport aux valeurs de base pré-ischémique; * P <0,05 par rapport aux souris ischémiques traités par le véhicule. Les figures 5A et B sont reproduits avec l'aimable autorisation 6. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
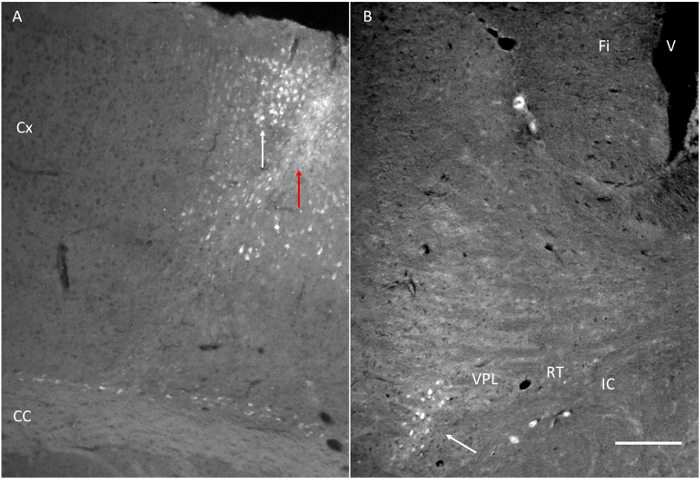
Figure structures 6. cibles atteintes après injection de FluoroGold (FG). (A) au site d'injection du FG à côté du cortex moteur comme indiqué sur la Figure 1. Notez la flèche rouge indiquant la piste de l'aiguille et la flèche blanche indiquant quelques cellules marquées dans le cortex. (B) FG injecté à proximité du moteurcortex est détecté dans le VPL. Fi: Fimbria. IC: capsule interne. RT: noyau réticulaire thalamique. VPL: thalamique noyau postéro-ventrale. Barre d'échelle = 200 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Pendant de nombreuses années, la recherche sur les maladies neurodégénératives comme accident vasculaire cérébral ischémique ou une lésion cérébrale traumatique a mis l'accent sur le développement de thérapies neuroprotectrices qui visent à favoriser la survie neuronale dans la phase de l'AVC aigu. La grande majorité des thérapies médicamenteuses qui ont été trouvés pour être efficace dans des modèles rongeurs échoué quand il est traduit à la clinique. Les raisons de cet échec thérapeutique comprennent, mais ne sont pas limités à l'absence d'effets de drogues entraînant la persistance prolongée récupération neurologique fonctionnelle. Il est donc important de développer des stratégies de promotion cerveau remodelage à plus long terme. Parce que la promotion de la survie neuronale est seul ne suffit pas pour permettre la récupération de course réussie, comme suggéré par le grand nombre d'essais infructueux de neuroprotection, la stimulation de la plasticité neuronale a récemment obtenu un intérêt majeur dans le domaine.
Moyens pour la livraison de la drogue sont de injection intrapéritonéale, la queue i intravasculairenjection, injection fémorale, seule injection stéréotaxique de vecteurs dans le cerveau et la prestation continue constante par des pompes miniosmotiques. Ce dernier peut inclure l'administration systémique, si la pompe n'a pas une canule, ou qui peut être orgue dirigé, comme nous l'avons montré pour la livraison dans le cerveau. A l'exception des pompes miniosmotiques et l'utilisation de vecteurs viraux, toutes les autres stratégies vont induire des concentrations de médicament fluctuantes. Pour les expériences à long terme, il devient donc nécessaire de soumettre l'animal à la contrainte de recevoir des injections fréquentes. Le Bureau impose un obstacle important pour l'absorption de cerveau de protéines ou de médicaments à partir du sang, ce qui entraîne la nécessité de médicaments protéiques ou des doses considérables en vue d'atteindre des concentrations thérapeutiques dans le cerveau. Par exemple Pellegrini et al. (2013) 5 rhEpo délivrée par injection intraperitoneale à une dose équivalente à 75 UI / jour pour un animal de 30 g (750 UI / jour pour un rat de 300 g). En comparaison, la fourniture de RHEP cibléeo pour le cerveau nous a permis d'utiliser une dose beaucoup plus faible de seulement 10 UI / jour dans notre étude pour la reprise de la course réussie, qui nous a permis de parvenir à la reprise sur une grande échelle de temps à un taux fixe de 0,25 pi / h.
Dans ce travail, nous avons montré la méthode d'implantation de mini-pompes avec une canule reliée au crâne afin de délivrer la protéine de plasticité promotion rhEpo directement dans le ventricule, contournant ainsi le Bureau. Par ce procédé, la récupération neurologique rhEpo promu en un certain nombre de façons, y compris la réduction de la taille de l'infarctus, à la réduction de la formation de cicatrice gliale et de l'induction de l'angiogenèse. rhEpo également favorisé la survie neuronale accrue et des projections du cortex moteur contralésionnel vers le noyau rouge dénervé et les noyaux faciaux. La germination des fibres a été révélée par injection du traceur antérograde des voies BDA dans le cortex moteur (figures 4A et 5A). Une corrélation fonctionnelle à la germination des fibres est provided par l'amélioration de la motricité (figure 5B). En outre, nous avons montré que la même approche pour l'injection de traceur de l'appareil peut être appliqué à dévoiler les connexions thalamo-corticales par injection du traceur rétrograde des voies FG (Figure 6B).
Dans la préparation de la pompe miniosmotique, il est essentiel de considérer le point de cible et l'utilisation d'entretoises. Nous utilisons une entretoise de réduire la longueur de l'aiguille de 0,5 mm par que de cette manière la pointe de l'aiguille est en contact avec le ventricule aux coordonnées données (-0,2 mm caudale, 0,9 mm latéral, 2,5 mm dorso ventrale, avec rapport au bregma). Toutefois, si des structures plus profondes sont la cible de la recherche, alors aucun entretoises seront nécessaires. De même, si un point de livraison plus externe est souhaitée (ie., Le cortex), puis plusieurs disques d'écartement sera nécessaire. Le cathéter doit être suffisamment long pour que la pompe ne soit pas trop près de la tête, car il va gêner les mouvements du moucomme tel, mais également la durée excessive pas trop long, car une fois implanté peut provoquer le cathéter de se plier, ce qui augmente le risque de retrait de la canule par le mouvement naturel de la souris. Une section de 2 cm de cathéter donne de très bons résultats en termes de mobilité et de la stabilité de l'implant (figures 1 et 2). L'incubation de la pompe à 37 ° CO / N permet à la pompe de démarrer immédiatement pompage du médicament dans le cerveau au moment de l'implantation.
Dans la pompe miniosmotique implantation, il est essentiel d'assurer que le crâne est correctement séché avant l'implantation de la canule. Habituellement, le nettoyage avec 70% d'éthanol va induire l'os à sécher, mais si le saignement continue est trouvé, touchant le crâne doucement avec un cauterizer complètement sécher. Il est essentiel d'assurer que la mise en place de l'aiguille est aussi verticale que possible et lent. Une fois en position, et pendant que la colle est sèche, placer le doigt sur le dessus de la canule l'empêche de se déplacer latéralement over le crâne. Une attention particulière devrait être accordée à la blessure et le placement de la canule. Il est important que l'incision est effectuée exactement au-dessus pas la ligne médiane du crâne mais légèrement vers le côté droit. Lors de la fermeture de la plaie, si l'incision a été faite à la ligne médiane, la peau sera débordé, augmentant ainsi le risque de l'ouverture de la plaie. Faire légèrement l'incision d'un côté va permettre aux points de suture à être loin de la plus haute partie de la canule. En conséquence, il y aura moins de tension sur les points de suture et la plaie se cicatriser correctement. Les animaux doivent être mis en cage seul et vérifié chaque jour, surtout pendant les 10-15 premiers jours après l'implantation. En cas de déhiscence de la plaie, les plaies doivent être fermés dès que possible. Si la canule est retirée ou l'animal présente une infection, l'expérience doit être terminé. Re-implantation de la canule est déconseillée. Il est très important pour l'implantation réussie d'utiliser des quantités suffisantes de l'annonce de tissusadhésif (pas trop!) car il se dégrade l'os et augmente le risque de retrait de la canule. Cependant, l'utilisation trop peu de colle ne sera également pas tenir la canule fixée à l'os. Les pompes peuvent transporter miniosmotiques médicaments dissous dans une grande variété de substances, la seule limitation étant à ce que le solvant est biocompatible. En outre, étant donné que le volume est petit (200 ul) doit déterminer si une concentration requise pour l'essai est adapté à la et ne cause pas de précipitation à l'intérieur de la pompe.
Tract traçage soit antérograde ou rétrograde traceurs est une technique très bien établi pour étudier la connectivité du cerveau et de la plasticité. Soins doit être donnée à l'utilisation des cadres de stéréotaxie lors de l'injection pour assurer l'exactitude sur le ciblage de la zone du cerveau on veut étudier (par exemple, pour éviter l'injection sur le corps calleux lors de l'injection du cortex).
Pour toutes les interventions chirurgicales et afin de réduire la douleur etl'inflammation, les animaux doivent être traités avec 0,1 mg / kg buprénorphine avant l'intervention et Caprofen à 4 mg / kg une fois par jour pendant trois jours après l'intervention.
En conclusion, cette approche fournit un outil approprié pour étudier l'effet des protéines ou des composés pharmacologiques dans le cerveau lésé, ce qui représente une méthode qui est bien adapté pour les études sur la plasticité du cerveau.
Déclarations de divulgation
Production et Open Access frais de publication prévues par DURECT Corporation, qui produit des pompes miniosmotiques utilisés dans le présent article.
Remerciements
This work was supported by the Dr. Werner Jackstädt Foundation (to Eduardo Sanchez-Mendoza), the German Academic Exchange Service (DAAD; to Jeismar Carballo), the German Research Council (HE3173/2-1, HE3173/2-2, and HE3173/3-1; to Dirk M. Hermann), Heinz Nixdorf Foundation (to Dirk M. Hermann).
matériels
| Name | Company | Catalog Number | Comments |
| Alzet miniosmotic pump. Model 2004. | Alzet | 000298 | Drug container |
| Brain infusion kit 3 1-3 mm | Alzet | 0008851 | Drug brain delivery system |
| Loctite 454 Prism gel | Loctite | 45404 | Cyanoacrylate adhesive for cannula adhesion to the skull |
| 75N glass syringe | Hamilton | 87900/00 | Injection of tract tracers |
| Biotin Dextran Amine (10,000 MW) | Molecular probes | N-7167 | Anterograde tract tracer |
| Fluorogold | Fluorochrome, LLC. | Retrograde tract tracer | |
| Quintessential Stereotaxic Injector (QSI) | Stoelting | 53311 | Stereotactic device for coordinate determination, pump implantation and tract tracer injection. |
Références
- Doeppner, T. R., et al. MicroRNA-124 protects against focal cerebral ischemia via mechanisms involving Usp14-dependent REST degradation. Acta Neuropathol. 126, 251-265 (2013).
- Hoyo-Becerra, C., et al. Rapid Regulation of Depression-Associated Genes in a New Mouse Model Mimicking Interferon-alpha-Related Depression in Hepatitis C Virus Infection. Mol Neurobiol. , (2014).
- Puntel, M., et al. Gene transfer into rat brain using adenoviral vectors. Curr Protoc Neurosci. Chapter 4, Unit 4.24 (2010).
- Miao, J., et al. Overexpression of adiponectin improves neurobehavioral outcomes after focal cerebral ischemia in aged mice. CNS Neurosci Ther. 19, 969-977 (2013).
- Pellegrini, L., et al. Therapeutic benefit of a combined strategy using erythropoietin and endothelial progenitor cells after transient focal cerebral ischemia in rats. Neurol Res. 35, 937-947 (2013).
- Reitmeir, R., et al. Post-acute delivery of erythropoietin induces stroke recovery by promoting perilesional tissue remodelling and contralesional pyramidal tract plasticity. Brain. 134, 84-99 (2011).
- Reitmeir, R., et al. Vascular endothelial growth factor induces contralesional corticobulbar plasticity and functional neurological recovery in the ischemic brain. Acta Neuropathol. 123, 273-284 (2012).
- Hermann, D. M., Chopp, M. Promoting brain remodelling and plasticity for stroke recovery: therapeutic promise and potential pitfalls of clinical translation. Lancet Neurol. 11, 369-380 (2012).
- Overman, J. J., et al. A role for ephrin-A5 in axonal sprouting, recovery, and activity-dependent plasticity after stroke. Proc Natl Acad Sci U S A. 109, E2230-E2239 (2012).
- Wolf, W. A., Martin, J. L., Kartje, G. L., Farrer, R. G. Evidence for Fibroblast Growth Factor-2 as a Mediator of Amphetamine-Enhanced Motor Improvement following Stroke. PLoS One. 9, e108031 (2014).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rulicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51, 443-456 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon