Method Article
ミニ浸透圧の移植は、病態生理学的状態で脳の再編成を検討するためにポンプ冊子トレーサーの配達
要約
In order to study brain reorganization under pathological conditions we used miniosmotic pumps for direct protein delivery into the brain circumventing the blood brain barrier. Tract tracers are then injected to study alterations in brain connectivity under the influence of the protein.
要約
Pharmacological treatment in animal models of cerebral disease imposes the problem of repeated injection protocols that may induce stress in animals and result in impermanent tissue levels of the drug. Additionally, drug delivery to the brain is delicate due to the blood brain barrier (BBB), thus significantly reducing intracerebral concentrations of selective drugs after systemic administration. Therefore, a system that allows both constant drug delivery without peak levels and circumvention of the BBB is in order to achieve sufficiently high intracerebral concentrations of drugs that are impermeable to the BBB. In this context, miniosmotic pumps represent an ideal system for constant drug delivery at a fixed known rate that eludes the problem of daily injection stress in animals and that may also be used for direct brain delivery of drugs. Here, we describe a method for miniosmotic pump implantation and post operatory care that should be given to animals in order to successfully apply this technique. We embed the aforementioned experimental paradigm in standard procedures that are used for studying neuroplasticity within the brain of C57BL6 mice. Thus, we exposed animals to 30 min brain infarct and implanted with miniosmotic pumps connected to the skull via a cannula in order to deliver a pro-plasticity drug. Behavioral testing was done during 30 days of treatment. After removal the animals received injections of anterograde tract tracers to analyze neuronal plasticity in the chronic phase of recovery. Results indicated that neuroprotection by the delivered drug was accompanied with increase in motor fibers crossing the midline of the brain at target structures. The results affirm the value of these techniques for drug administration and brain plasticity studies in modern neuroscience.
概要
The delivery of proteins and pharmacological compounds into the brain are important strategies for studying mechanisms underlying brain diseases and evaluating candidate molecules for new treatments 1,2. In experimental neurosciences, the delivery of vectors such as plasmids or adenoviruses has become an important tool for studying long-term actions of proteins in the brain 3,4. Single injections of vectors present the advantage of a system which by itself will maintain highly stable levels of the therapeutic agent in the brain 4. However, for long term experiments with purified drugs systemic administration by intraperitoneal injection induces stress in mice or rats, and is not the best choice when a targeted brain response is needed, requiring also large doses of drug5. Miniosmotic pumps represent an ideal system for prolonged direct drug delivery into the brain by circumventing both low accessibility to the brain and also peaks of drug concentration, as the delivery of the drug happens directly into a targeted place in the brain and at a fixed flow rate determined by the pump model that is chosen2,6,7. Indeed, this system has allowed us to successfully study brain recovery after stroke by delivery of several drugs such as recombinant human erythropoietin (rhEpo) and vascular endothelial growth factor 6,7.
Brain plasticity is essential for the rewiring of connections in response to brain injuries. Plasticity is a broad concept that ranges from the formation or elimination of synaptic contacts, growth of dendritic spines and also elongation or retraction of long distance connections8,9. The brain was previously believed to not be capable of reconstructing connections after a lesion. However many approaches have shown that if properly stimulated it can reestablish connectivity 6,7,10. One technique that is particularly useful to study this is the use of tract tracers. Anterograde tract tracers are compounds that can enter neurons at the soma and then distribute all along the axons until these reach their target structures. Two examples are cascade blue (CB) and biotinylated dextran amine (BDA). Conversely, retrograde tract tracers, such as cholera toxin B (CTB) or fluorogold (FG) enter the neuron through the axon terminal and then distribute back to the soma thus revealing the site of origin of neurons targeting the injection site.
Here, we present the methods that we use for implantation of miniosmotic pumps for direct delivery of proteins or drugs that have potential effects on neural plasticity as well as the injection of BDA and FG to unveil input and output connections to the motor cortex. BDA will also be used as an example of a tract tracer used to demonstrate increased plasticity of axons emerging from the co after stroke under rhEpo treatment.
プロトコル
動物実験は、政府の承認を得て実施した(G1361 / 13、AZ84-02.04.2013.A192およびG1362 / 13、AZ84-02.04.2013.A194; Bezirksregierungデュッセルドルフ)実験動物の管理と使用に関するNIHガイドラインに基づきます。
ミニ浸透圧ポンプの調製
- 無菌環境で( すなわち 、細胞培養フード)、ポンプ、カテーテルを得るモデレータ、脳注入カニューレ及びスペーサディスクに使用される( 図1)が流れます。
- カニューレ針の先端部のみが、心室と接触するように直接脳室への薬物の送達のための一つのスペーサーディスクを使用します。ピンセットで逆さまにカニューレを保持します。シアノアクリレート系接着剤(CA)の2滴を追加し、1スペーサーディスクをご紹介します。
- スペーサーディスクとカニューレとの間に接着剤が乾燥するように上向きに平らな面にカニューレを残します。
- 約2.5センチのセクションで、カテーテルをカット。
- EAについてそれは、カテーテル内の気泡の形成を防止するために、その内部に完全に、従ってすべての空気を押し出すポンプを満たすために必要とされるように、CHポンプは、関心対象の溶液の300-350μLの最小を準備する。 気泡がフローを妨げるであろう脳へのソリューションを提供します。
- 慎重に流量調節にカテーテルを接続します。
- 脳注入キットにより提供される針に接続された2ミリリットルの注射器を使用して、ソリューションの少し量がポンプをエスケープするまでポンプを埋め、したがって内部の気泡を防止します。
- 慎重に流量調節を充填し、注意を払って、カテーテルは、カテーテルの内部に残っている泡を防止します。
- ポンプ内部の流れのモデレータをご紹介します。
- 満たされたら、慎重にカテーテルの端部にカニューレを接続します。それは、気泡が形成されることが観察された場合に、カニューレを取り外して慎重にビヒクル又は薬物溶液でカテーテルを再充填した後、カニューレを再導入します。
- PUを配置滅菌食塩水で容器に融点と37°のCO / Nのままにしておきます。
- 移植前に気泡形成のために再検査。必要に応じて( すなわち、気泡が観察された)場合はカニューレを取り外し、チューブを補充します。カニューレを再接続します。これにより、ソリューションのわずか数マイクロリットルを取る必要があります。
ミニ浸透圧ポンプの2注入
注:これらの実験のために動物を1%イソフルラン(30%のO 2、70%N 2 O)で麻酔しました。これが利用できない場合は、麻酔の腹腔内注射を使用することも可能である11。
- 麻酔下で定位装置に動物を見つけて、麻酔下ながら乾燥を防ぐために、保護軟膏で目をカバーしています。指またはピンセットで押すと後足における応答の欠如を観察することによって麻酔を確認してください。動物が完全に眠っているまで、先に進まないでください。
- 彼の上に毛皮をカット広告ハサミやシェービングマシンのいずれか。肌にダメージを与えることなく、できるだけ多くをカットします。
- 抗菌剤および殺菌剤の特性を有する70%エタノールと消毒剤で皮膚をきれいにしてください。
- メスで正中線の右側にわずか1cmの切開を開き、頭蓋骨を露出させます。
- 綿棒で頭蓋骨をきれいにしてください。 70%エタノールでそれを浸し、頭蓋骨の上に渡します。これを乾燥頭蓋骨を誘導します。
- 頭蓋骨は、光の出血がある場合は、任意の出血点を解消するために焼灼器を使用しています。血液は、カニューレが移植されると、骨の上に適切に乾燥するのCAを防ぐことができます。
- カニューレが移植される頭蓋骨のポイントにマークを作るために定位デバイスを使用してください。左半球座標上心室注入用-0.2ミリメートルの尾、ブレグマに0.9ミリメートル、横方向( 図2A)です。
- 静かに45°の角度をなす頭蓋骨の上にドリル。これは誤ってbraiに入るのドリルを防止N。繰り返し数秒間ドリルして、穴がどのように深いご確認ください。頭蓋骨が薄く、まだ完全には浸透していないされた後の掘削を停止します。
- 脳への完全なアクセスが達成されるまで滅菌針の先端で髄膜を破ります。脳に損傷を与えないように静かに行ってください。
- 綿棒を用いて70%エタノールで頭蓋骨をきれいにしてください。
- 前 - 尾側方向に動物の皮膚の下にストレートピンセットを紹介します。ポンプが移植される動物の背中に皮膚の下のスペースを開くために鉗子を使用してください。 ( 図2B)の外側カテーテルとカニューレを残す動物の背中にポンプを導入。それが削除され、固定のいずれかの種類を必要としなくなるまで、ポンプは、この位置のままになります。
- 慎重に次のカニューレ内針に接着剤の4少し滴を配置します。
- 慎重に横に移動することなく、頭蓋骨を通して針をご紹介します。 15〜30秒uのための位置にそれを保持カニューレが完全に装着されているntil( 図2C.1)。代わりに、一度つのスペーサディスクが使用されている場合、カニューレは、背腹側方向に2.5ミリメートルに達します。正しく取り付けられている場合、カニューレは、実験終了まで骨に付着したままになります。
- 取り外し可能なタブの上に一本の指を置き、次にハサミのセット( 図2C.2)との首を切断する一方を使用しています。
- 5-0縫合糸で皮膚に傷を閉じて( 図2D)の感染を防ぐために傷の上にポビドンヨード溶液(PVP-I)の数滴を追加します。
- 新しいケージに動物を移動します。まだ動作していない動物と手術動物を置かないでください。薬物投与の時間の間に彼らのケージで単独のポンプを移植された動物を保管してください。
- 彼らが目を覚ましていると胸骨横臥位を取り戻しまで無人マウスを放置しないでください。
3.ポンプRemovaリットル
注意:通常の実験は、ポンプによって許可された配信時間の終了時に終了します、しかし、それは、薬物送達のフォローアップとして、二次の実験を行うためにポンプを除去することができます。管トレーサー注射を行うためには、ポンプを除去する必要があります。
- 麻酔下seterotacticデバイスで動物を置き、麻酔下ながら乾燥を防ぐために、保護軟膏で目をカバーしています。指またはピンセットで押すと後足における応答の欠如を観察することによって麻酔を確認してください。動物が完全に眠っているまで、先に進まないでください。
- 慎重にポンプ注入の日に行って切開して切断することにより、皮膚を開きます。
- 外科手術用クランプでカニューレを保持し、それを引き出します。これは、簡単に頭蓋骨から削除する必要があります。穏やかな出血が予想されるように、綿棒を配置することによって、それを停止し、1〜2分待ちます。
- カテーテルによってポンプを引き出します。彼皮膚上の圧力を作成し、それを押して出てくる、それをのlp。
- 5-0縫合糸で再び傷口を閉じて、PVP-Iの数滴を追加します。
- 新しいケージに動物を移動します。まだ動作していない動物と手術動物を入れないでください。手術を受けた動物は、一緒に置くことができます。
- 彼らが目を覚ましていると胸骨横臥位を取り戻しまで無人マウスを放置しないでください。
- 動物が道トレーサー注入に進む前に10日間回復させます。
右モータ皮質に45°の角度で4圧力トラクトトレーサー注入
- 麻酔下で定位デバイス上で動物を置き、麻酔下ながら乾燥を防ぐために、保護軟膏で目をカバーしています。指またはピンセットで押すと後足における応答の欠如を観察することによって麻酔を確認してください。動物が完全に眠っているまで、先に進まないでください。
- ヘッド傷を開きます。
- C言語綿棒を使用して、70%エタノールで頭蓋骨を傾きます。
- デバイスの垂直ホルダーに5μlのガラスシリンジ(26S GA)を導入。ガラスホルダーの下端が正確に保持片であることを確認します。注射器は、それが垂直位置から45度でそれを配置し、注入を実行することは不可能になりすぎて、その下にあってはなりません。
- ブレグマ上に直接注射器を向けますし、目的の座標を見つけます。ポイント#1:0.5ミリメートル吻側と2.5ミリメートルは、ブレグマに対して横方向運動皮質座標上注射のためにあります。ポイント#2:1.34ミリメートル吻側、ブレグマに対して2.5ミリメートル、横。
- 座標が配置された後、細い先端を有するマーカーと頭蓋骨の上に自分の位置を示しています。正しい座標を隠す可能性がある過度のインクリリースと頭蓋骨で1ドットのみを行います。
- 慎重に45°にドリルを保持している頭蓋骨をドリル。それは完全にPERFないようにステップ2.8のように、頻繁に頭蓋骨をチェックドリルによって引き起こされる脳の損傷を避けるためにorated。すべての骨が除去されたことを確認するために、注射器の先端を使用してください。
- シリンジに道トレーサー希釈の600 NLをロードします。
- 動物の右側に向かって45°の垂直位置を調整します。顕微鏡下で、右の穴の前に、注射器の針の先端を配置します。
- 1.5ミリメートルによって垂直方向に移動します。圧力注射を行う前に1分30秒のためのこの位置に針が安定してみましょう。
- 30秒によって互いに分離100 NLの3つのステップでトレーサー希釈の300 NLを注入します。最後の注射の後、脳の外に流れるようにトレーサーを回避するために1分30秒のための安定した注射器を残します。
- ゆっくりと、注射器を引き出し二穴の上にそれを再配置し、シリンジ内にある残りの300 NLと同じプロセスを繰り返します。
- 二回目の注射後、注射器を取り外し、wouを閉じるに進みます5-0縫合糸でNDとPVP-Iの数滴を追加します。
- 新しいケージに動物を移動します。まだ動作していない動物と手術動物を入れないでください。手術を受けた動物は、一緒に置くことができます。彼らが目を覚ましていると胸骨横臥位を取り戻しまで無人マウスを放置しないでください。
- 動物が屠殺前に10日間回復させます。
5.トラクトトレーサー観測
- 完全に制度ガイドラインに従って動物を麻酔。指またはピンセットで押すと後足における応答の欠如を観察することによって麻酔を確認してください。動物が完全に眠っているまで、先に進まないでください。
- 標準プロトコル6の下にPBS中の4%パラホルムアルデヒド(pHが7)を用いて動物を灌流。
- 脳を削除し、ポストの4%パラホルムアルデヒド中のO / Nを浸漬することによってそれを修正。
- 脳が沈むまで、30%スクロース中の脳をCryoprotect。その後、脳を除去し、10秒のインマすることによって、それらを凍結液体窒素中でrsion。セクションが生成されるまで-80℃で脳をしてください。
- クライオスタットで切片によって逆行管トレーサー分析用と順行道トレーサー分析のため40ミクロンで20ミクロンでセクションを生成します。
注:FG標識されたニューロンは、紫外線励起下での白血球として観察することができます。 BDAは、ファイバ6,7のコントラストを向上させるために0.4%のニッケルを添加したアビジン-ビオチン-ペルオキシダーゼ複合体と3,3 'ジアミノベンジジンでO / Nインキュベーションによって検出されます。
結果
我々は左線条体病変を誘導腔内縫合法により中大脳動脈閉塞の30分に動物を提出してから3日後に開始する30日の間にミニ浸透圧ポンプ( 図1、 図3)を用いて、脳に直接のrhEPOを配信しますストローク6。 図4は、CBとBDA注入とトレーサーを注入した領域の後に追跡した皮質脊髄路の概略図を示します。我々は、それぞれのrhEPO送達の14及び42日後に握力とモータの性能( 図5)の改善を示しました。左線条体にストロークを受けた動物の権利運動野にBDAの送達は、発芽として繊維の染色に成功を実証し、赤と顔面神経核( 図5)のレベルでミッドラインを横切る運動神経線維の増加を示しましたminiosmotでの薬物治療の結果ICポンプ。 rhEPO処置はまた、びまん性星状細胞増加を遅延グリア瘢痕形成を減少させ、研究期間6における血管新生を増加し、ニューロンの生存を増加させました。管トレーサー注射のためにこの同じ技術を使用して、我々は正常に逆行管トレーサーFG( 図6)を注入することにより皮質に接続されている視床核を検出することができます。

図このプロトコルで使用されるミニ浸透圧ポンプの1コンポーネント。スペーサーディスク、カニューレと取り外し可能なタブ、カテーテル、流れモデレータとミニ浸透圧ポンプを観察することができます。完全に組み立てられたポンプの側面は、 図2Aに見ることができる。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ithinページ= "1"> 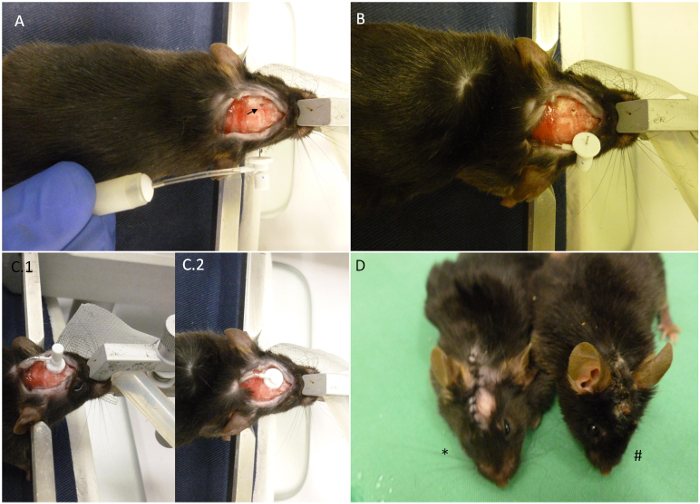
ポンプ注入キーポイントの2概要図。その隣に完全に構築ミニ浸透圧ポンプを用いて定位デバイスに配置として(A)マウスが示されています。矢印は、移植のために選択された座標を示している。(B)ポンプは、動物の背中に導入されており、唯一のカニューレが外側に残ります。移植後の頭の頭蓋骨が既に掘削されている。(C)アスペクト。(C.1)カニューレが位置にあるが、取り外し可能なタブがカットされていません。(C.2)取り外し可能なタブはカットし、ステッチのされています傷は今開始することができます。(D)アスタリスクは30日、移植(#)の後に動物に比べて、最近移植動物を示しています。正しく収容されたときの画像に示すように、傷は、プロシージャが終了するまで、閉じたままにしてください。ove.com/files/ftp_upload/52932/52932fig2large.jpg「ターゲット= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。
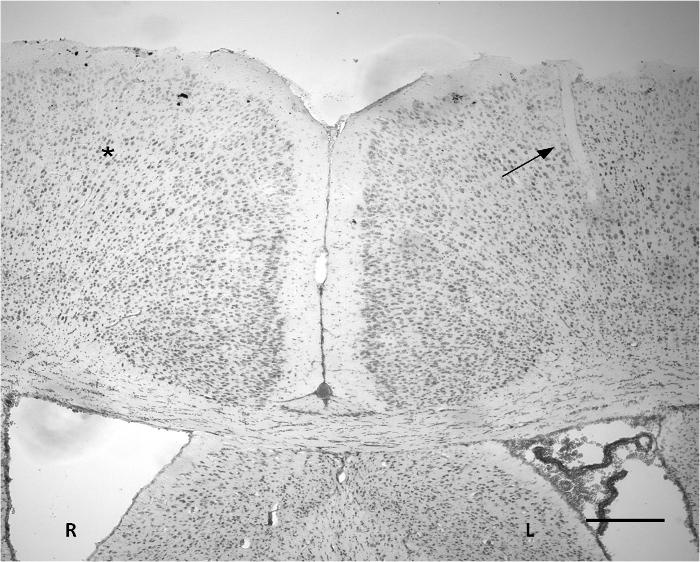
皮質に移植部位を示す図3.ニッスル染色。小切開は、左皮質(矢印)の一部に観察することができます。浸透した領域の幅は約50μmです。ザは、対応する反対側の面積(*)と比較して、ニッスル染色に基づいて明白な重篤な組織の変更はありません。 R:右半球。 L:左半球。スケールバー=300μmの。 この図の拡大版をご覧になるにはこちらをクリックしてください。
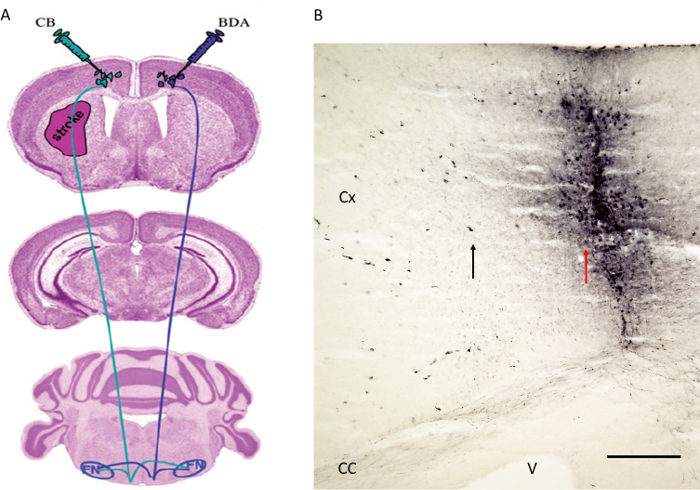
図4.トラクトReitmeier らによって以前に公開されたトレーサー注入戦略。6,7。 (A)CBのに対し、反対運動皮質で道トレーサーBDAの回路図を示す注射部位は、梗塞半球の運動皮質に注射しました。繊維が示されている赤核(図示せず)と、顔面神経核( 図5参照)。(B)次の運動皮質に順行管トレーサーBDAの注射部位に追跡しました。黒い矢印は、BDAで標識されたいくつかの皮質細胞を示しているのに対し、針トラックを示す赤い矢印に注意してください。 CX:皮質。 CC:脳梁。 V:心室。 FN:顔面神経核。 B = 200μm単位のスケールバー。 図4(a)は、一種の許可6で再生される。 この図の拡大版をご覧になるにはこちらをクリックしてください。

rhEPOの納入後脳梗塞の図5.回復。(A)BDAはその後、顔面神経核(ブレグマ-6.3 mmまで-5.8ミリメートル)のレベルで皮質延髄線維内で検出されたcontralesional運動皮質に注入。各半球の交差線が正中線とipsilesionalとcontralesional半球の方向の各ラインを横切る繊維に平行に描かれたがカウントされ、皮質脊髄路の総ラベル繊維のパーセンテージとして表しました。 contralesional顔面神経核データの方向に繊維交差を増加エリスロポエチンは+手段です - SD。データは、ビヒクル処置非虚血マウスと比較し§P<0.05、ANOVAは最下位の差の検定に続いて、一方向により分析した。(B)モータの動作では、ロタロッドテストにおける手の握力と調整の改善を示しました。データは、平均バリューですES + - SD。データは、各時点のために、一方向ANOVA /最小有意差検定を行い、双方向の反復測定ANOVAによって分析しました。 §P<虚血前のベースラインと比較して0.05。 * P <媒体処置虚血マウスと比較して0.05。 図5AおよびBは一種の許可6で再現されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
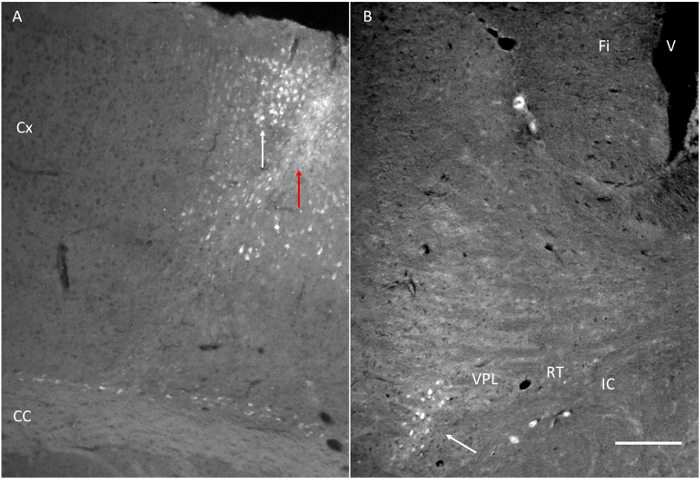
図6.ターゲット構造は、フルオロゴールド(FG)の注入後に到達した。(A)運動皮質の隣FGの注射部位図1に示すように、針トラックとのいくつかの標識された細胞を示す白い矢印を示す赤い矢印に注意してください。皮質。(B)FGはモーターの近くに注入皮質はVPLで検出されます。 Fiの:采。 IC:内部のカプセル。 RT:視床網様核。 VPL:視床腹側後側部の核。スケールバー=200μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
長年にわたり、虚血性脳卒中または外傷性脳損傷などの神経変性疾患の研究は、急性脳卒中期におけるニューロンの生存を促進することを目的と神経保護療法の開発に注力してきました。診療所に変換する際のげっ歯類モデルにおいて有効であることが見出されている薬物療法の大部分は失敗しました。この治療の失敗の理由としては、機能的な神経学的回復を持続する、その結果持続薬物効果の欠如に限定されるものではありません。それは長い目で脳のリモデリングを促進戦略を開発することが重要です。失敗した神経保護試験の多数によって示唆されるように、単独でニューロンの生存の促進は、成功した脳卒中の回復を可能にするのに十分ではないため、神経可塑性の刺激は最近、フィールド内の主要な関心を得ています。
薬物送達のための手段は、腹腔内注射、尾の血管内のIでありますnjection、大腿注射、単一定位脳へのベクターの注入とミニ浸透圧ポンプにより一定の送達を継続します。我々は、脳への送達のために示したようにポンプは、カニューレを持っていない、または器官指向とすることができる場合には、後者は、全身送達を含めることができます。ミニ浸透圧ポンプの例外およびウイルスベクターを使用すると、他のすべての戦略が変動する薬物濃度を誘導します。長期の実験のために、それは、このように頻繁な注射を受けたストレスに動物を提出することが必要となります。 BBBは、脳内の治療濃度を達成するために巨大なタンパク質または薬剤の投与量を必要とし、その結果、血液からのタンパク質または薬物の脳への取り込みのための重要な障害を課します。例えばペジェグリーニ監督ら(2013年)5 30グラム(300グラムのラット750 IU /日)の動物を75 IU /日に線量当量で腹腔内注射によってのrhEPOを配信。 rhEpの比較では、標的送達脳へのoを0.25マイクロリットル/時間の一定の割合に大きな時間スケールにわたって回復を達成することができました、私たちは成功した脳卒中の回復のために私たちの研究では10 IU /日のはるかに低い用量を使用することができました。
本研究では、このようにBBBを回避する、心室に直接可塑性促進タンパク質のrhEPOをお届けするために、頭蓋骨に接続カニューレとミニポンプを移植する方法を示しています。この方法によって、のrhEPOは、梗塞サイズの縮小、グリア瘢痕形成の減少及び血管形成の誘導を含む、いくつかの方法で神経学的回復を促進しました。 rhEPOはまた、ニューロンの生存を促進し、除神経赤核と顔面神経核に向かってcontralesional運動野からの投射を増加させました。繊維の発芽は運動皮質( 図4Aおよび図5A)に順行管トレーサーBDAを注射することによって明らかにしました。繊維の発芽への機能的相関はPRです運動技能の向上( 図5B)によってovided。さらに、我々は、管トレーサー注入のための同様のアプローチは、逆行管トレーサーFG( 図6B)の注入により視床皮質接続を明らかにするために適用することができることを示しています。
ミニ浸透圧ポンプの製造では、ターゲットポイントとスペーサの使用を考慮することが重要です。私たちはで、針の非常に先端が与えられた座標(-0.2ミリメートルの尾、横0.9ミリメートル、2.5ミリメートル背腹で心室に接触している。この方法のように0.5ミリメートルによって、針の長さを短くするために、1つのスペーサーを使用ブレグマに対して)。深い構造は、研究の対象とされている場合は、その後、何のスペーサが必要とされません。同様に、もし複数の外部配信ポイント(すなわち、皮質)、次に以上のスペーサーディスクが必要となることが望まれます。ポンプヘッドに近づきすぎないように、それはMOUの動きを妨げますようカテーテルは、十分な長さでなければなりませんSEだけでなく、長すぎるように一度注入し、過剰な長さは、このように、マウスの自然な動きによって、カニューレの除去の危険性を増加させ、カテーテルが曲がることがありません。カテーテルの2センチ部は、インプラント( 図1および2)の移動性及び安定性の点で非常に良好な結果を与えます。 37°のCO / Nにおけるポンプのインキュベーションは、ポンプが直ちに注入の瞬間に脳内に薬剤をポンピング開始することができます。
ミニ浸透圧ポンプの移植では、頭蓋骨が適切にカニューレを移植する前に乾燥されることを保証することが重要です。通常、乾燥する骨を誘導する70%エタノールで洗浄するが、連続的な出血が見つかった場合、焼灼器で穏やかに頭蓋骨をタッチすると、完全に乾燥します。これは、針の導入が可能な限り垂直と遅いことを保証することが重要です。一度位置で、かつ接着剤が乾燥している間、カニューレの上に指を置くと、OV横に移動するのを防ぎますえー頭蓋骨。特別なケアは、カニューレの傷や配置に与えられるべきです。それは、切開が正確に頭蓋骨の中央ライン上ではなくやや右側に行われていないことが重要です。創傷を閉鎖すると切開が中間線で行われた場合、皮膚は、このように創傷開口のリスクを増加させ、過延伸になります。片側にわずかに切開を作ることは、縫合ポイントはカニューレの最も高い部分から離れてできるようになります。結果として、そこに縫合点にはあまりの緊張になり、傷が適切に治癒します。動物だけではケージに入れ、特に移植後の最初の10〜15日の間、毎日チェックする必要があります。巻か裂開の場合は、傷ができるだけ早く閉じする必要があります。カニューレが除去されるか、動物が感染を示した場合、実験を終了しなければなりません。カニューレの再注入は推奨されません。移植の成功は、組織の広告の適切な量を使用することは非常に重要ですhesive(あまりない!)、それが骨を劣化させ、カニューレの除去のリスクを増大させるように。しかし、あまりにも少ない接着剤を用いても、骨に取り付けられたカニューレを保持しています。ミニ浸透圧ポンプは、溶媒は、生体適合性であるこれにのみ制限され、多種多様な物質に溶解薬を運ぶことができます。さらに、ボリュームが小さいことを考えると(200μL)1は、実験に必要な濃度が適しているかどうかを判断しなければならないし、ポンプ内部の降水量が発生することはありません。
順行または逆行性トレーサーのいずれかを使用したトレースの道は、脳の接続性と可塑性を研究するために非常によく確立された技術です。一つは勉強したい脳の領域をターゲットに正確さを保証するために注入する場合には注意が使用定位フレームに与えられなければならない(皮質を注入する際、すなわち 、脳梁に注射を防ぐため)。
すべての外科的介入のための痛みを軽減するために、と炎症は、動物は介入後3日間一日一回に4mg / kgの介入とCaprofen前には0.1mg / kgのブプレノルフィンで治療すべきです。
結論として、このアプローチは、脳の可塑性の研究のために適している方法を示す、損傷した脳内のタンパク質または薬理学的化合物の効果を研究するための適切なツールを提供します。
開示事項
この記事で使用するミニ浸透圧ポンプを生産DURECT株式会社が提供する生産とオープンアクセス出版手数料。
謝辞
This work was supported by the Dr. Werner Jackstädt Foundation (to Eduardo Sanchez-Mendoza), the German Academic Exchange Service (DAAD; to Jeismar Carballo), the German Research Council (HE3173/2-1, HE3173/2-2, and HE3173/3-1; to Dirk M. Hermann), Heinz Nixdorf Foundation (to Dirk M. Hermann).
資料
| Name | Company | Catalog Number | Comments |
| Alzet miniosmotic pump. Model 2004. | Alzet | 000298 | Drug container |
| Brain infusion kit 3 1-3 mm | Alzet | 0008851 | Drug brain delivery system |
| Loctite 454 Prism gel | Loctite | 45404 | Cyanoacrylate adhesive for cannula adhesion to the skull |
| 75N glass syringe | Hamilton | 87900/00 | Injection of tract tracers |
| Biotin Dextran Amine (10,000 MW) | Molecular probes | N-7167 | Anterograde tract tracer |
| Fluorogold | Fluorochrome, LLC. | Retrograde tract tracer | |
| Quintessential Stereotaxic Injector (QSI) | Stoelting | 53311 | Stereotactic device for coordinate determination, pump implantation and tract tracer injection. |
参考文献
- Doeppner, T. R., et al. MicroRNA-124 protects against focal cerebral ischemia via mechanisms involving Usp14-dependent REST degradation. Acta Neuropathol. 126, 251-265 (2013).
- Hoyo-Becerra, C., et al. Rapid Regulation of Depression-Associated Genes in a New Mouse Model Mimicking Interferon-alpha-Related Depression in Hepatitis C Virus Infection. Mol Neurobiol. , (2014).
- Puntel, M., et al. Gene transfer into rat brain using adenoviral vectors. Curr Protoc Neurosci. Chapter 4, Unit 4.24 (2010).
- Miao, J., et al. Overexpression of adiponectin improves neurobehavioral outcomes after focal cerebral ischemia in aged mice. CNS Neurosci Ther. 19, 969-977 (2013).
- Pellegrini, L., et al. Therapeutic benefit of a combined strategy using erythropoietin and endothelial progenitor cells after transient focal cerebral ischemia in rats. Neurol Res. 35, 937-947 (2013).
- Reitmeir, R., et al. Post-acute delivery of erythropoietin induces stroke recovery by promoting perilesional tissue remodelling and contralesional pyramidal tract plasticity. Brain. 134, 84-99 (2011).
- Reitmeir, R., et al. Vascular endothelial growth factor induces contralesional corticobulbar plasticity and functional neurological recovery in the ischemic brain. Acta Neuropathol. 123, 273-284 (2012).
- Hermann, D. M., Chopp, M. Promoting brain remodelling and plasticity for stroke recovery: therapeutic promise and potential pitfalls of clinical translation. Lancet Neurol. 11, 369-380 (2012).
- Overman, J. J., et al. A role for ephrin-A5 in axonal sprouting, recovery, and activity-dependent plasticity after stroke. Proc Natl Acad Sci U S A. 109, E2230-E2239 (2012).
- Wolf, W. A., Martin, J. L., Kartje, G. L., Farrer, R. G. Evidence for Fibroblast Growth Factor-2 as a Mediator of Amphetamine-Enhanced Motor Improvement following Stroke. PLoS One. 9, e108031 (2014).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rulicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51, 443-456 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved