Method Article
Die Implantation von miniosmotische Pumpen und Lieferung von Tract Tracer Brain Reorganisation in pathophysiologischen Bedingungen Studieren
In diesem Artikel
Zusammenfassung
In order to study brain reorganization under pathological conditions we used miniosmotic pumps for direct protein delivery into the brain circumventing the blood brain barrier. Tract tracers are then injected to study alterations in brain connectivity under the influence of the protein.
Zusammenfassung
Pharmacological treatment in animal models of cerebral disease imposes the problem of repeated injection protocols that may induce stress in animals and result in impermanent tissue levels of the drug. Additionally, drug delivery to the brain is delicate due to the blood brain barrier (BBB), thus significantly reducing intracerebral concentrations of selective drugs after systemic administration. Therefore, a system that allows both constant drug delivery without peak levels and circumvention of the BBB is in order to achieve sufficiently high intracerebral concentrations of drugs that are impermeable to the BBB. In this context, miniosmotic pumps represent an ideal system for constant drug delivery at a fixed known rate that eludes the problem of daily injection stress in animals and that may also be used for direct brain delivery of drugs. Here, we describe a method for miniosmotic pump implantation and post operatory care that should be given to animals in order to successfully apply this technique. We embed the aforementioned experimental paradigm in standard procedures that are used for studying neuroplasticity within the brain of C57BL6 mice. Thus, we exposed animals to 30 min brain infarct and implanted with miniosmotic pumps connected to the skull via a cannula in order to deliver a pro-plasticity drug. Behavioral testing was done during 30 days of treatment. After removal the animals received injections of anterograde tract tracers to analyze neuronal plasticity in the chronic phase of recovery. Results indicated that neuroprotection by the delivered drug was accompanied with increase in motor fibers crossing the midline of the brain at target structures. The results affirm the value of these techniques for drug administration and brain plasticity studies in modern neuroscience.
Einleitung
The delivery of proteins and pharmacological compounds into the brain are important strategies for studying mechanisms underlying brain diseases and evaluating candidate molecules for new treatments 1,2. In experimental neurosciences, the delivery of vectors such as plasmids or adenoviruses has become an important tool for studying long-term actions of proteins in the brain 3,4. Single injections of vectors present the advantage of a system which by itself will maintain highly stable levels of the therapeutic agent in the brain 4. However, for long term experiments with purified drugs systemic administration by intraperitoneal injection induces stress in mice or rats, and is not the best choice when a targeted brain response is needed, requiring also large doses of drug5. Miniosmotic pumps represent an ideal system for prolonged direct drug delivery into the brain by circumventing both low accessibility to the brain and also peaks of drug concentration, as the delivery of the drug happens directly into a targeted place in the brain and at a fixed flow rate determined by the pump model that is chosen2,6,7. Indeed, this system has allowed us to successfully study brain recovery after stroke by delivery of several drugs such as recombinant human erythropoietin (rhEpo) and vascular endothelial growth factor 6,7.
Brain plasticity is essential for the rewiring of connections in response to brain injuries. Plasticity is a broad concept that ranges from the formation or elimination of synaptic contacts, growth of dendritic spines and also elongation or retraction of long distance connections8,9. The brain was previously believed to not be capable of reconstructing connections after a lesion. However many approaches have shown that if properly stimulated it can reestablish connectivity 6,7,10. One technique that is particularly useful to study this is the use of tract tracers. Anterograde tract tracers are compounds that can enter neurons at the soma and then distribute all along the axons until these reach their target structures. Two examples are cascade blue (CB) and biotinylated dextran amine (BDA). Conversely, retrograde tract tracers, such as cholera toxin B (CTB) or fluorogold (FG) enter the neuron through the axon terminal and then distribute back to the soma thus revealing the site of origin of neurons targeting the injection site.
Here, we present the methods that we use for implantation of miniosmotic pumps for direct delivery of proteins or drugs that have potential effects on neural plasticity as well as the injection of BDA and FG to unveil input and output connections to the motor cortex. BDA will also be used as an example of a tract tracer used to demonstrate increased plasticity of axons emerging from the co after stroke under rhEpo treatment.
Protokoll
Tierversuche wurden mit Genehmigung der Regierung durchgeführt (G1361 / 13, AZ84-02.04.2013.A192 und G1362 / 13, AZ84-02.04.2013.A194; Bezirksregierung Düsseldorf), basierend auf NIH Leitlinien für die Pflege und Verwendung von Labortieren.
1. Herstellung von Pumpen miniosmotische
- In einer sterilen Umgebung (dh., Zellkultur Kapuze), erhalten Sie die Pumpe, Katheter, Strömungsmoderator, Gehirninfusionskanüle und die Distanzscheiben verwendet werden (Abbildung 1).
- Zur Abgabe von Medikamenten direkt in die Herzkammern verwenden eine Abstandsscheibe, so daß nur die Spitze des Kanülennadel in Kontakt mit der Herzkammer. Halten Sie die Kanüle auf den Kopf mit einer Pinzette. Zwei Tropfen Cyanacrylat-Klebstoff (CA) und die Einführung einer Distanzscheibe.
- Verlassen die Kanüle auf eine flache Oberfläche nach oben weist, so daß der Kleber zwischen der Zwischenscheibe und die Kanüle trocknet.
- Schneiden des Katheters in Abschnitte von etwa 2,5 cm.
- Für each Pumpe, bereiten eine minimale von 300-350 ul der Lösung von Interesse, wie es benötigt wird, um die Pumpe somit alle Luft Extrudieren vollständig zu füllen, in der es um die Bildung von Luftblasen innerhalb des Katheters zu verhindern. Bubbles wird die Strömung von der behindern Lösung in das Gehirn.
- Sorgfältig verbinden den Katheter zur Strömungsmoderator.
- Mit einem 2-ml-Spritze auf die Nadel durch das Gehirn Infusionssatz vorgesehen ist, füllen Sie die Pumpe, bis eine kleine Menge der Lösung entweicht die Pumpe und verhindert Luftblasen im Inneren.
- Den Fluss Moderator sorgfältig auszufüllen und Katheter Aufmerksamkeit auf alle Blasen im Inneren des Katheters restlichen verhindern.
- Führen Sie den Durchfluss Moderator in der Pumpe.
- Im gefüllten Zustand sorgfältig zusammen die Kanüle an dem Ende des Katheters. Wenn beobachtet wird, dass eine Blase gebildet Entfernen der Kanüle und sorgfältig Nachfüllen des Katheters mit Vehikel oder Arzneimittellösung und anschließend wieder einführen Kanüle.
- Setzen Sie den pump in einem Behälter mit steriler Kochsalzlösung und lassen Sie ihn bei 37 ° CO / N.
- Vor der Implantation prüfen für Blasenbildung. Falls erforderlich (dh., Blasen beobachtet werden) entfernen Sie die Kanüle und füllen Sie das Rohr. Schließen Sie die Kanüle. Dieses sollte nur wenige Mikroliter der Lösung erfolgen.
2. Die Implantation von miniosmotische Pumps
Anmerkung: Für diese Versuche wurden Tiere mit 1% Isofluran (30% O 2, 70% N 2 O) anästhesiert. Jedoch, wenn diese nicht verfügbar ist, ist auch die Verwendung von intraperitoneale Injektionen von Anästhesie möglich 11.
- Suchen Sie das Tier in der stereotaktischen Gerät unter Narkose und decken Sie die Augen mit einer Schutzsalbe zur Trockene, während der Narkose zu verhindern. Anästhesie Bestätigen Sie durch Beobachten einer fehlende Reaktion in der Hinterpfote, wenn sie mit den Fingern oder mit einer Pinzette gedrückt. Fahren Sie nicht fort, bis das Tier vollständig eingeschlafen.
- Schneiden Sie das Fell über die erAnzeige entweder mit einer Schere oder einem Schermaschine. Geschnitten, so viel wie möglich, ohne die Haut zu beschädigen.
- Reinigen Sie die Haut mit 70% Ethanol und Desinfektionsmittel mit antibakterielle und fungizide Eigenschaften.
- Mit einem Skalpell öffnen Sie eine 1 cm Inzision leicht nach rechts von der Mittellinie und setzen die Schädel.
- Reinigen Sie den Schädel mit einem Wattestäbchen. Legen Sie ihn mit 70% Ethanol und gibt sie über den Schädel. Dies wird veran der Schädel, um zu trocknen.
- Wenn der Schädel hat leichte Blutungen, verwenden Sie ein Ausbrenner, alle Blutungen Punkte zu beseitigen. Blut verhindert, dass die CA ordnungsgemäß Trocknen über den Knochen, wenn die Kanüle implantiert.
- Verwenden Sie die stereotaktische Gerät an eine Markierung auf den Punkt des Schädels, wo die Kanüle wird implantiert werden zu machen. Ventrikuläre Infusionen auf der linken Hemisphäre Koordinaten -0.2 mm kaudal, 0,9 mm lateral zum Bregma (2A).
- Vorsichtig bohren über den Schädel, einen Winkel von 45 °; Dies verhindert, dass der Bohrer versehentlich gehen in die brain. Mehrmals bohren für einige Sekunden und dann prüfen, wie tief das Loch. Stoppen Sie Bohren, sobald der Schädel wurde ausgedünnt, aber immer noch nicht vollständig durchdrungen.
- Brechen Sie die Hirnhäute mit der Spitze einer sterilen Nadel bis zum vollen Zugriff auf das Gehirn erreicht. Do so sanft, so daß das Gehirn nicht beschädigt.
- Reinigen Sie den Schädel mit 70% Ethanol mit einem Wattestäbchen.
- Einführung einer geraden Pinzette unter der Haut des Tieres in einer von vorn nach kaudal. Verwenden Sie die Pinzette, um den Raum unter die Haut in den Rücken des Tieres, wo die Pumpe implantiert werden zu öffnen. Einführung der Pumpe in den Rücken des Tieres wobei der Katheter und die Kanüle Außenseite (2B). Die Pumpe wird in dieser Position verbleiben, bis sie entfernt und bildet nicht jede Art von Befestigung halten.
- Vorsichtig vier kleinen Tropfen Klebstoff neben der Nadel in die Kanüle.
- Die Nadel durch den Schädel vorsichtig einführen, ohne seitwärts bewegen. Halten Sie es in Position für 15-30 sec until die Kanüle vollständig gebunden (Abbildung 2C.1). Einmal im Ort, wird die Kanüle 2,5 mm in der dorso ventral zu erreichen, wenn eine Distanzscheibe verwendet wurde. Wenn sie richtig angebracht ist, wird die Kanüle in den Knochen befestigt ist, bis zum Ende des Experimentes bleiben.
- Setzen Sie einen Finger auf die Registerkarte abnehmbar und dann mit der anderen Hand, die ihm der Hals mit einer Reihe von Scheren (Abbildung 2C.2) abgeschnitten.
- Schließen Sie die Wunde auf der Haut mit einem 5-0 Naht und fügen Sie ein paar Tropfen des PVP-Jod-Lösung (PVP-I) oben auf der Wunde eine Infektion zu verhindern (2D).
- Bewegen Sie das Tier in einen neuen Käfig. Operierten Tiere mit den Tieren, die noch nicht betätigt worden sind, legen. Halten Tiere, die mit der während der Zeit der Verabreichung des Arzneimittels Pumpen allein in ihre Käfige implantiert wurden.
- Mäuse nicht unbeaufsichtigt, bis sie wach und haben Brustlage wieder.
3. Pumpe removal
Hinweis: In der Regel das Experiment wird am Ende der Lieferzeit von der Pumpe erlaubt zu beenden, aber es ist möglich, die Pumpe, um Sekundär Experimente zu entfernen als Folgemaßnahme zu der Medikamentenabgabe. Um Trakt Tracer Injektionen tun, ist es daher notwendig, um die Pumpe zu entfernen.
- Legen Sie das Tier in der seterotactic Gerät unter Narkose und decken Sie die Augen mit Schutzsalbe zur Trockene, während der Narkose zu verhindern. Anästhesie Bestätigen Sie durch Beobachten einer fehlende Reaktion in der Hinterpfote, wenn sie mit den Fingern oder mit einer Pinzette gedrückt. Fahren Sie nicht fort, bis das Tier vollständig eingeschlafen.
- Die Haut vorsichtig öffnen, indem durch den Einschnitt am Tag des Pumpenimplantation durchgeführt.
- Mit einem chirurgischen Klammer Halten Sie die Kanüle und herausziehen. Es sollte leicht aus dem Schädel entfernt werden. Als sanfte Blutungen zu erwarten ist, stoppen, indem Sie ein Wattestäbchen und warten Sie 1-2 min.
- Ziehen Sie die Pumpe durch den Katheter. Erlp es heraus, indem Sie sie, wodurch Druck über die Haut.
- Schließen Sie die Wunde wieder mit einem 5-0 Naht und fügen Sie ein paar Tropfen des PVP-I.
- Bewegen Sie das Tier in einen neuen Käfig. Nicht mit den Tieren, die noch nicht betätigt worden sind, setzen Sie operierten Tieren. Tiere, die Operation unterzogen haben können zusammengestellt werden.
- Mäuse nicht unbeaufsichtigt, bis sie wach und haben Brustlage wieder.
- Lassen Sie das Tier 10 Tage lang, bevor Sie mit Trakt Tracer-Injektion zu erholen.
4. Druck Tract Tracer Injection bei 45 ° Winkel auf der rechten Motor Cortex
- Legen Sie das Tier auf der stereotaktischen Gerät unter Narkose und decken Sie die Augen mit einer Schutzsalbe zur Trockene, während der Narkose zu verhindern. Anästhesie Bestätigen Sie durch Beobachten einer fehlende Reaktion in der Hinterpfote, wenn sie mit den Fingern oder mit einer Pinzette gedrückt. Fahren Sie nicht fort, bis das Tier vollständig eingeschlafen.
- Öffnen Sie die Kopfwunde.
- Clehnen den Schädel mit 70% Ethanol mit einem Wattestäbchen.
- Einführung einer 5 & mgr; l-Glasspritze (26S ga) auf der vertikalen Halterung des Gerätes. Sicherstellen, dass das untere Ende der Glashalter ist genau an der Haltestück. Die Spritze nicht zu weit darunter, da dann wird es unmöglich, sie auf 45 ° von der vertikalen Position zu bringen und führen die Injektion.
- Richten Sie die Spritze direkt über Bregma und suchen Sie dann die gewünschten Koordinaten. Für eine Injektion an den motorischen Kortex Koordinaten: Punkt # 1: 0,5 mm rostral und 2,5 mm lateral bezüglich Bregma. Point # 2: 1,34 mm rostral, 2,5 mm lateral bezüglich Bregma.
- Sobald Koordinaten lokalisiert wurden, zeigen ihre Position über den Schädel mit einem Marker mit einer dünnen Spitze. Machen Sie nur ein Punkt im Schädel wie überschüssige Tinte Mitteilung könnte verstecken das richtige Koordinaten.
- Bohren Sie vorsichtig den Schädel hält den Bohrer bei 45 °. Wie in Schritt 2.8, überprüfen Sie die Schädel häufig, so dass es nicht vollständig perfum Schädigung des Gehirns durch den Bohrer zu vermeiden dampft. Verwenden Sie die Spitze einer Spritze, um sicherzustellen, dass alle Knochen entfernt wurde.
- Laden 600 nl der Trakt Tracerverdünnung in die Spritze.
- Einstellen der vertikalen Position um 45 ° in Richtung der rechten Seite des Tieres. Unter dem Mikroskop, legen Sie die Spitze der Spritzennadel direkt vor das Loch.
- Bewegt es in der vertikalen Richtung um 1,5 mm. Lassen Sie die Nadel stabil in dieser Position für 30 Sekunden bis 1 Minute, bevor Sie Druckinjektionen.
- Injizieren 300 nl Tracer Verdünnung in drei Stufen von 100 nl voneinander durch 30 Sekunden getrennt. Nach der letzten Injektion, lassen Sie die Spritze stabil für 30 Sekunden bis 1 Minute, um den Tracer aus dem Gehirn fließen zu vermeiden.
- Ziehen Sie den Spritzen, verlagern sie über das zweite Loch, und wiederholen Sie den gleichen Vorgang mit den verbleibenden 300 nl, die in der Spritze sind.
- Nach der zweiten Injektion, entfernen Sie die Spritze und füllen Sie die Sie suchen zu schließennd mit einem 5-0 Naht und fügen Sie ein paar Tropfen des PVP-I.
- Bewegen Sie das Tier in einen neuen Käfig. Nicht mit den Tieren, die noch nicht betätigt worden sind, setzen Sie operierten Tieren. Tiere, die Operation unterzogen haben können zusammengestellt werden. Mäuse nicht unbeaufsichtigt, bis sie wach und haben Brustlage wieder.
- Damit die Tiere für 10 Tage vor der Tötung erholen.
5. Tract Tracer Beobachtung
- Betäuben das Tier vollständig pro Institutionsrichtlinien. Anästhesie Bestätigen Sie durch Beobachten einer fehlende Reaktion in der Hinterpfote, wenn sie mit den Fingern oder mit einer Pinzette gedrückt. Fahren Sie nicht fort, bis das Tier vollständig eingeschlafen.
- Perfusion der Tiere mit 4% Paraformaldehyd in PBS (pH 7) unter Standard-Protokolle 6.
- Entfernen Sie das Gehirn und senden Sie fix durch O / N Eintauchen in 4% Paraformaldehyd.
- Cryoprotect Gehirne in Saccharose bei 30%, bis die Köpfe sinken. Dann entfernen Sie die Gehirne und frieren sie um 10 Sek immersion in flüssigem Stickstoff. Halten Gehirne bei -80 ° C bis Abschnitten hergestellt werden.
- Produzieren Abschnitte bei 20 & mgr; m für die retrograde Trakt Tracer Analyse und bei 40 & mgr; m für die anterograde Trakt Tracer Analyse durch Schneiden auf einem Kryostaten.
Hinweis: FG markierten Neuronen als weiße Zellen unter UV-Lichtanregung beobachtet werden. BDA durch O / N Inkubation mit einem Avidin-Biotin-Peroxidase-Komplex und 3,3 Diaminobenzidin mit Zugabe von Nickel von 0,4% ermittelt, um den Kontrast der Fasern 6,7 zu erhöhen.
Ergebnisse
Wir während 30 Tagen, beginnend 3 Tage nach der eingereichten Tieren bis 30 min der mittleren Hirnarterie durch den intraluminalen Fadenmethode Induktion einer Läsion in das linke Striatum und dann geliefert rhEpo direkt in das Gehirn durch miniosmotische Pumpen (Abbildung 1, Abbildung 3) Takt 6. 4 zeigt eine schematische Darstellung des cortico Spinaltraktes die nach CB und BDA Einspritzung und dem Bereich, wo Tracer injiziert verfolgt wurde. Wir zeigten eine Verbesserung der Greifkraft und Motorleistung (Abbildung 5) nach 14 und 42 Tagen nach der Lieferung bzw. rhEpo. Lieferung von BDA in die rechte Motorkortex von Tieren, die einen Anschlag auf der linken Striatum empfangen, zeigten einen Anstieg der motorischen Fasern Überqueren der Mittellinie auf dem Niveau des roten und Facialiskern (Figur 5), was zeigt, erfolgreich Anfärbung Sprießen Fasern eine Folge der pharmakologischen Behandlung mit miniosmotic-Pumpen. rhEpo Behandlung erhöhte auch das neuronale Überleben, verzögerte diffuse Astrozytose, verringert glialen Narbenbildung und eine erhöhte Angiogenese in der untersuchten Periode 6. Durch Verwendung dieser gleichen Technik für Trakt Tracerinjektion können wir erfolgreich Thalamuskernen die zum Cortex durch Injektion des retrograden Trakt Tracer FG (Figur 6) verbunden sind, zu detektieren.

Figur 1. Bestandteile der miniosmotische Pumpe in diesem Protokoll verwendet. Die Distanzscheibe, Kanüle und entfernbaren Streifen, Katheter, Flußmoderator und miniosmotische Pumpe beobachtet werden. Der Aspekt der komplett montierten Pumpe kann in 2A gesehen werden. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
ithin-page = "1"> 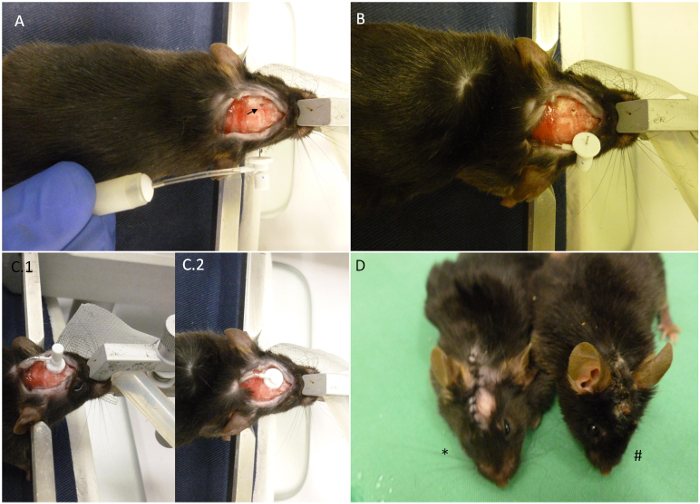
Abbildung 2. Zusammenfassung der Pumpenimplantation wichtigsten Punkte. (A) Die Maus ist gezeigt, wie auf der stereotaktischen Vorrichtung mit dem vollständig aufgebauten miniosmotische Pumpe daneben angeordnet. Der Pfeil zeigt die zur Implantation ausgewählten Koordinaten. (B) Die Pumpe wurde an der Rückseite des Tieres eingeführt wurde und nur die Kanüle an der Außenseite bleibt. Der Schädel wurde bereits gebohrt. (C) Seiten des Kopfes nach der Implantation. (C.1) Die Kanüle ist auf Position aber die Registerkarte abnehmbare nicht geschnitten worden. (C.2) Die entfernbaren Streifen geschnitten wurde und das Nähen von Die Wunde kann nun beginnen. (D) Der Stern zeigt eine kürzlich implantierte Tier im Vergleich zu einem Tier 30 Tage nach der Implantation (#). Wenn es richtig untergebracht ist, sollte die Wunde geschlossen, bis zum Ende des Verfahrens bleiben, wie auf dem Bild gezeigt.ove.com/files/ftp_upload/52932/52932fig2large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
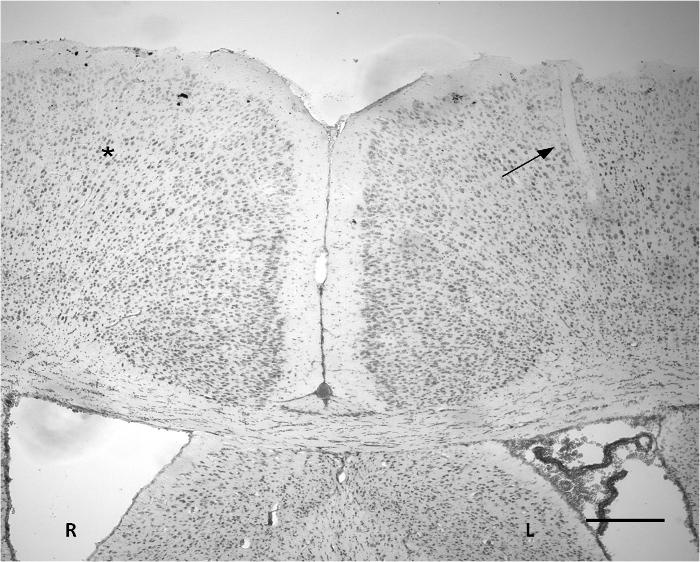
Abbildung 3 Nissl-Färbung, die die Stelle der Implantation auf dem Kortex. Ein kleiner Schnitt auf Teil des linken Cortex (Pfeil) beobachtet werden. Die Breite des durchdrungenen Bereich ist etwa 50 um. Die keine offensichtlichen schweren Gewebeveränderungen anhand von Nissl-Färbung im Vergleich zu der entsprechenden Gegenfläche (*). R: rechte Hemisphäre. L: Linke Hemisphäre. Maßstabsbalken = 300 & mgr; m. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
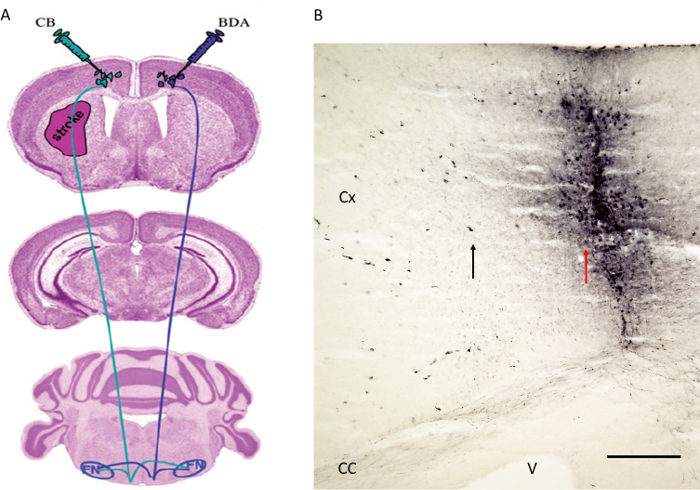
Abbildung 4. TractTracer-Einspritzstrategie wie zuvor durch Reitmeier et al. 6,7 publiziert. (A) Schematische anzeigt Injektionsstellen für die Darm-Trakt Tracer BDA an der kontralateralen motorischen Kortex der Erwägung, dass CB wurde in der motorischen Kortex des Infarkt Hemisphäre injiziert. Fasern wurden auf dem roten Nucleus (nicht gezeigt) und Facialiskern (siehe Abbildung 5). (B) Die Injektionsstelle der anterograde Trakt Tracer BDA neben der motorischen Kortex gezeigt folgt. Beachten Sie den roten Pfeil, der die Nadelbahn der Erwägung, dass der schwarze Pfeil zeigt einige Rindenzellen mit dem BDA beschriftet. Cx: Cortex. CC: Corpus callosum. V: Ventrikels. FN: Gesichts Kern. Maßstabsleiste in B = 200 & mgr; m. 4A wird mit freundlicher Genehmigung 6 wiedergegeben. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 5. Wiederherstellung eines Infarkt Gehirn nach Lieferung rhEpo. (A) BDA injiziert im kontraläsionalen motorischen Kortex wird dann in kortikobulbären Fasern auf der Ebene des Facialiskern (Bregma -5,8 mm bis -6,3 mm) festgestellt. Schnittlinien auf jeder Hemisphäre wurden parallel zur Mittellinie und Fasern überquert jede Zeile in Richtung zur ipsilesional und kontraläsionalen Halbkugel gezogen wurden gezählt und als Prozentsatz des gesamten markierten Fasern in der Pyramidenbahn ausgedrückt. Erythropoietin erhöhten Faserkreuzungen in Richtung zu den kontraläsionelle Facialiskern Daten sind Mittelwerte + - SD. Die Daten wurden durch Einweg-ANOVA analysiert, gefolgt von mindestens signifikanten Unterschiede Tests §P <0,05 im Vergleich zu Vehikel-behandelten nicht-ischämischen Mäusen. (B) Motor Verhalten zeigten eine Verbesserung der Handkraft und Koordination in der rota Stange Test. Die Daten sind Mittel valun + - SD. Daten wurden durch Zweiweg-ANOVA mit wiederholten Messungen analysiert, gefolgt von Einweg-ANOVA / am wenigsten signifikanten Unterschiede Tests für jede Zeitpunkt. §P <0,05 im Vergleich mit vorher ischämischen Grundlinie; * P <0,05 im Vergleich zu Vehikel-behandelten ischämischen Mäusen. 5A und B sind mit freundlicher Genehmigung 6 wiedergegeben. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
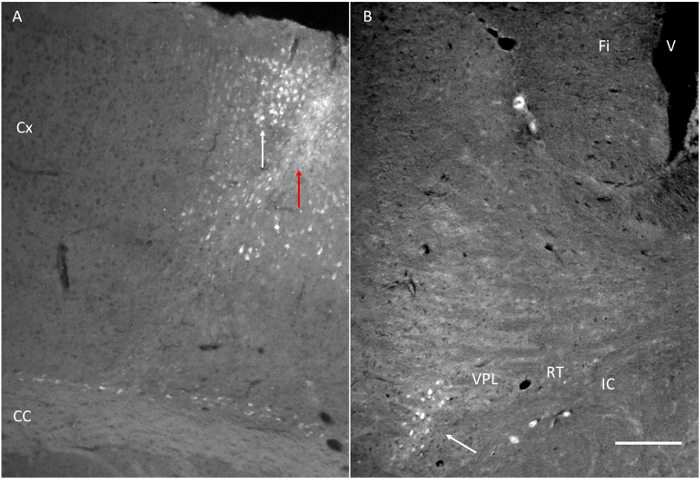
Figur 6. Zielstrukturen nach Injektion Fluorogold (FG) erreicht ist. (A) an der Injektionsstelle von FG neben dem Motorkortex, wie in 1 angezeigt. Beachten Sie den roten Pfeil, der die Nadelbahn und der weiße Pfeil zeigt einige markierte Zellen in die Rinde. (B) FG injiziert in der Nähe des MotorsCortex ist in der VPL erkannt. Fi: Fimbria. IC: Interne Kapsel. RT: Nucleus reticularis. VPL: Thalamus ventralen posterolateralen Kern. Maßstabsbalken = 200 & mgr; m. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Seit vielen Jahren hat die Forschung zu neurodegenerativen Erkrankungen wie Schlaganfall oder Schädel-Hirn-Verletzungen auf die Entwicklung von neuroprotektiven Therapien, die das Überleben von Neuronen in der akuten Schlaganfallphase zu fördern Ziel konzentriert. Die große Mehrheit der Drogen-Therapien, die gefunden wurden, um wirksam in Nagetiermodellen gescheitert, wenn in die Klinik übersetzten. Gründe für diese Therapieversagen umfassen, sind jedoch nicht auf das Ausbleiben einer nachhaltigen Arzneimittelwirkungen, was zu persistierende funktionelle neurologische Erholung beschränkt. Es ist daher wichtig, Strategien zu fördern Gehirn Umbau auf längere Sicht zu entwickeln. Denn die Förderung der neuronalen Überlebens allein nicht ausreicht, um erfolgreich Schlaganfall Erholung zu ermöglichen, wie durch die große Anzahl von erfolglosen Neuroprotektion Studien vorgeschlagen, die Stimulation der neuronalen Plastizität sich jüngst großes Interesse auf dem Gebiet.
Bedeutet für die Arzneimittelabgabe sind intraperitoneale Injektion, Schwanz intravaskuläre injection, Oberschenkel Injektion einzigen stereotaktische Injektion der Vektoren in das Gehirn und weiterhin konstante Lieferung von miniosmotische Pumpen. Letzteres kann eine systemische Verabreichung umfassen, wenn die Pumpe nicht über eine Kanüle oder die Orgel gerichtet werden können, wie wir für die Lieferung in das Gehirn gezeigt. Mit Ausnahme miniosmotische Pumpen und die Verwendung von viralen Vektoren, werden alle anderen Strategien schwankArzneimittelKonzentrationen induzieren. Für Langzeitexperimente somit wird es notwendig, um das Tier zum Druck des Empfangs häufige Injektionen vor. Die BBB erlegt erhebliches Hindernis für die Aufnahme in das Gehirn von Proteinen oder Medikamenten aus dem Blut, was zu der Notwendigkeit von großen Protein oder Medikamentendosierungen, um therapeutische Konzentrationen im Gehirn zu erreichen. Beispiels Pellegrini et al. (2013) geliefert rhEpo durch intraperitoneale Injektion in einer Dosis entsprechend 75 IU / Tag für ein Tier von 30 g (750 IU / Tag für einen 300 g Ratte) 5. Zum Vergleich: Die gezielte Abgabe von RHEPo an das Gehirn es uns ermöglicht, eine viel geringere Dosis von 10 IE / Tag in unserer Studie für eine erfolgreiche Wiederherstellung nach Schlaganfall, die es uns ermöglicht, Rückgewinnung über einen großen Zeitskala zu einem festen Zinssatz von 0,25 & mgr; l / h zu erzielen.
In dieser Arbeit haben wir das Verfahren der Implantation von Minipumpen mit einer Kanüle an dem Schädel, um die Plastizität fördernde Protein rhEpo direkt in den Ventrikel zu liefern, so dass unter Umgehung der BBB verbunden ist. Durch dieses Verfahren gefördert rhEpo neurologische Erholung in einer Anzahl von Wegen, einschließlich der Verringerung der Infarktgröße, Verringerung des glialen Narbenbildung und die Induktion von Angiogenese. rhEpo gefördert neuronale Überleben und erhöhte Projektionen aus dem kontraläsionalen motorischen Kortex in Richtung der denervierten roten Kern und Gesichts Kernen. Der Austrieb der Fasern wurde durch Injektion der anterograde Trakt Tracer BDA in den motorischen Cortex (4A und 5A), offenbart. Eine funktionelle Entsprechung zu dem Sprießen der Fasern prdurch die Verbesserung der motorischen Fähigkeiten (5B) ovided. Darüber hinaus haben wir gezeigt, dass der gleiche Ansatz für Trakt Tracerinjektion angewendet werden, um thalamo-kortikalen Verbindungen durch Injektion des retrograden Tracers FG-Darm-Trakt (6B) zu enthüllen werden.
Bei der Herstellung des miniosmotische Pumpe ist es wichtig, den Zielpunkt und die Verwendung von Abstandhaltern zu betrachten. Wir verwenden ein Abstandhalter, um die Länge der Nadel um 0,5 mm, wie auf diese Weise die Spitze der Nadel in Kontakt mit der Herzkammer auf den angegebenen Koordinaten (-0,2 mm caudal zu reduzieren, 0,9 mm lateral 2,5 mm dorso ventral mit bezüglich Bregma). Jedoch, wenn tiefere Strukturen sind das Ziel der Forschung, dann werden keine Abstandshalter erforderlich. Ebenso, wenn eine externe Abgabestelle gewünscht (dh., Dem Kortex), dann mehrere Distanzscheiben erforderlich. Der Katheter muss lang genug sein, damit die Pumpe nicht zu nah an den Kopf, als sie Bewegungen des mou behindernse, aber auch nicht zu lange im implantierten Überlänge kann bewirken, dass der Katheter zu biegen, so dass die Gefahr der Kanüle Entfernung durch die natürliche Bewegung der Maus. Ein Abschnitt von 2 cm des Katheters liefert sehr gute Ergebnisse hinsichtlich der Beweglichkeit und Stabilität des Implantats (1 und 2). Inkubation der Pumpe bei 37 ° CO / N kann die Pumpe sofort zu starten Pumpen des Arzneimittels in das Gehirn im Augenblick der Implantation.
Im miniosmotische Pumpenimplantation ist es entscheidend, sicherzustellen, daß der Schädel ist, bevor die Implantation der Kanüle getrocknet. Normalerweise Reinigung mit 70% Ethanol wird der Knochen, um zu trocknen zu induzieren, aber wenn kontinuierliche Blutungen gefunden wird, berührt den Schädel vorsichtig mit einem Ausbrenner vollständig trocknen. Es ist kritisch, um sicherzustellen, dass die Einführung der Nadel als vertikale und langsam wie möglich. Einmal in Position, und während der Klebstoff trocknet, indem die Finger auf der Oberseite der Kanüle verhindert, dass sie sich seitwärts bewegt over den Schädel. Besondere Sorgfalt sollte auf die Wunde und die Platzierung der Kanüle gegeben. Wichtig ist, daß der Schnitt nicht genau über der Mittellinie des Schädels, aber leicht zur rechten Seite durchgeführt. Beim Schließen der Wunde, wenn der Einschnitt an der Mittellinie gemacht, die Haut wird überdehnt werden, wodurch das Risiko von Wundöffnung zunimmt. Dem Schnitt leicht zu einer Seite ermöglicht die Nahtstellen, um weg von dem höchsten Teil der Kanüle ist. Als Folge wird es weniger Spannung auf die Nahtstellen und die Wunde wird richtig zu heilen. Die Tiere sollten nur in Käfigen gehalten werden und überprüft jeden Tag, besonders während der ersten 10-15 Tage nach der Implantation. Im Falle Wunddehiszenz haben Wunden so schnell wie möglich geschlossen werden. Wenn die Kanüle entfernt wird, oder das Tier stellt eine Infektion wurde das Experiment beendet. Reimplantation der Kanüle wird nicht empfohlen. Es ist sehr wichtig für eine erfolgreiche Implantation ausreichende Mengen an Gewebe ad verwendenKLEBEND (nicht zu viel!), wie es verschlechtert die Knochen und erhöht das Risiko der Kanüle entfernen. Jedoch mit zu wenig Klebstoff wird auch die Kanüle bis auf die Knochen befestigt nicht halten. Die miniosmotische Pumpen können in einer breiten Vielfalt von Stoffen gelöste Arzneimittel tragen, wobei die einzige Einschränkung dieser daß das Lösungsmittel biokompatibel. Zusätzlich, da das Volumen klein ist (200 ul) bestimmt werden, ob die für das Experiment benötigte Konzentration ist geeignet und wird nicht Ausfällung innerhalb der Pumpe führen.
Tract Verfolgung entweder mit anterograden oder retrograde Tracer ist eine sehr gut etablierte Technik zum Gehirn-Konnektivität und Plastizität zu untersuchen. Sorgfalt muss für die Verwendung der stereotaktischen Rahmen bei der Injektion, um die Genauigkeit über die Ausrichtung der Gehirnbereich zu studieren wünscht, einen Nutzen zieht (das heißt zur Injektion auf dem Balken zu verhindern, wenn das Einspritzen des Cortex).
Für alle chirurgischen Eingriffe und um Schmerzen zu reduzieren undEntzündungen, sollten die Tiere mit 0,1 mg / kg Buprenorphin 4 mg / kg einmal täglich für drei Tage nach der Operation behandelt werden vor dem Eingriff und Caprofen.
Abschließend bietet dieser Ansatz eine richtige Werkzeug für die Untersuchung Wirkung von Proteinen oder pharmakologische Verbindungen im verletzten Gehirn, die eine Methode, die gut für Studien über die Plastizität des Gehirns geeignet ist.
Offenlegungen
Produktion und Open-Access-Publikationsgebühren von DURECT Corporation, die die miniosmotische Pumpen in diesem Artikel verwendete produziert bereitgestellt.
Danksagungen
This work was supported by the Dr. Werner Jackstädt Foundation (to Eduardo Sanchez-Mendoza), the German Academic Exchange Service (DAAD; to Jeismar Carballo), the German Research Council (HE3173/2-1, HE3173/2-2, and HE3173/3-1; to Dirk M. Hermann), Heinz Nixdorf Foundation (to Dirk M. Hermann).
Materialien
| Name | Company | Catalog Number | Comments |
| Alzet miniosmotic pump. Model 2004. | Alzet | 000298 | Drug container |
| Brain infusion kit 3 1-3 mm | Alzet | 0008851 | Drug brain delivery system |
| Loctite 454 Prism gel | Loctite | 45404 | Cyanoacrylate adhesive for cannula adhesion to the skull |
| 75N glass syringe | Hamilton | 87900/00 | Injection of tract tracers |
| Biotin Dextran Amine (10,000 MW) | Molecular probes | N-7167 | Anterograde tract tracer |
| Fluorogold | Fluorochrome, LLC. | Retrograde tract tracer | |
| Quintessential Stereotaxic Injector (QSI) | Stoelting | 53311 | Stereotactic device for coordinate determination, pump implantation and tract tracer injection. |
Referenzen
- Doeppner, T. R., et al. MicroRNA-124 protects against focal cerebral ischemia via mechanisms involving Usp14-dependent REST degradation. Acta Neuropathol. 126, 251-265 (2013).
- Hoyo-Becerra, C., et al. Rapid Regulation of Depression-Associated Genes in a New Mouse Model Mimicking Interferon-alpha-Related Depression in Hepatitis C Virus Infection. Mol Neurobiol. , (2014).
- Puntel, M., et al. Gene transfer into rat brain using adenoviral vectors. Curr Protoc Neurosci. Chapter 4, Unit 4.24 (2010).
- Miao, J., et al. Overexpression of adiponectin improves neurobehavioral outcomes after focal cerebral ischemia in aged mice. CNS Neurosci Ther. 19, 969-977 (2013).
- Pellegrini, L., et al. Therapeutic benefit of a combined strategy using erythropoietin and endothelial progenitor cells after transient focal cerebral ischemia in rats. Neurol Res. 35, 937-947 (2013).
- Reitmeir, R., et al. Post-acute delivery of erythropoietin induces stroke recovery by promoting perilesional tissue remodelling and contralesional pyramidal tract plasticity. Brain. 134, 84-99 (2011).
- Reitmeir, R., et al. Vascular endothelial growth factor induces contralesional corticobulbar plasticity and functional neurological recovery in the ischemic brain. Acta Neuropathol. 123, 273-284 (2012).
- Hermann, D. M., Chopp, M. Promoting brain remodelling and plasticity for stroke recovery: therapeutic promise and potential pitfalls of clinical translation. Lancet Neurol. 11, 369-380 (2012).
- Overman, J. J., et al. A role for ephrin-A5 in axonal sprouting, recovery, and activity-dependent plasticity after stroke. Proc Natl Acad Sci U S A. 109, E2230-E2239 (2012).
- Wolf, W. A., Martin, J. L., Kartje, G. L., Farrer, R. G. Evidence for Fibroblast Growth Factor-2 as a Mediator of Amphetamine-Enhanced Motor Improvement following Stroke. PLoS One. 9, e108031 (2014).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rulicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51, 443-456 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten