Method Article
Implantação de miniosmóticas Bombas e Entrega de Tracers Trato de Estudar Reorganização do cérebro em condições fisiopatológicas
Neste Artigo
Resumo
In order to study brain reorganization under pathological conditions we used miniosmotic pumps for direct protein delivery into the brain circumventing the blood brain barrier. Tract tracers are then injected to study alterations in brain connectivity under the influence of the protein.
Resumo
Pharmacological treatment in animal models of cerebral disease imposes the problem of repeated injection protocols that may induce stress in animals and result in impermanent tissue levels of the drug. Additionally, drug delivery to the brain is delicate due to the blood brain barrier (BBB), thus significantly reducing intracerebral concentrations of selective drugs after systemic administration. Therefore, a system that allows both constant drug delivery without peak levels and circumvention of the BBB is in order to achieve sufficiently high intracerebral concentrations of drugs that are impermeable to the BBB. In this context, miniosmotic pumps represent an ideal system for constant drug delivery at a fixed known rate that eludes the problem of daily injection stress in animals and that may also be used for direct brain delivery of drugs. Here, we describe a method for miniosmotic pump implantation and post operatory care that should be given to animals in order to successfully apply this technique. We embed the aforementioned experimental paradigm in standard procedures that are used for studying neuroplasticity within the brain of C57BL6 mice. Thus, we exposed animals to 30 min brain infarct and implanted with miniosmotic pumps connected to the skull via a cannula in order to deliver a pro-plasticity drug. Behavioral testing was done during 30 days of treatment. After removal the animals received injections of anterograde tract tracers to analyze neuronal plasticity in the chronic phase of recovery. Results indicated that neuroprotection by the delivered drug was accompanied with increase in motor fibers crossing the midline of the brain at target structures. The results affirm the value of these techniques for drug administration and brain plasticity studies in modern neuroscience.
Introdução
The delivery of proteins and pharmacological compounds into the brain are important strategies for studying mechanisms underlying brain diseases and evaluating candidate molecules for new treatments 1,2. In experimental neurosciences, the delivery of vectors such as plasmids or adenoviruses has become an important tool for studying long-term actions of proteins in the brain 3,4. Single injections of vectors present the advantage of a system which by itself will maintain highly stable levels of the therapeutic agent in the brain 4. However, for long term experiments with purified drugs systemic administration by intraperitoneal injection induces stress in mice or rats, and is not the best choice when a targeted brain response is needed, requiring also large doses of drug5. Miniosmotic pumps represent an ideal system for prolonged direct drug delivery into the brain by circumventing both low accessibility to the brain and also peaks of drug concentration, as the delivery of the drug happens directly into a targeted place in the brain and at a fixed flow rate determined by the pump model that is chosen2,6,7. Indeed, this system has allowed us to successfully study brain recovery after stroke by delivery of several drugs such as recombinant human erythropoietin (rhEpo) and vascular endothelial growth factor 6,7.
Brain plasticity is essential for the rewiring of connections in response to brain injuries. Plasticity is a broad concept that ranges from the formation or elimination of synaptic contacts, growth of dendritic spines and also elongation or retraction of long distance connections8,9. The brain was previously believed to not be capable of reconstructing connections after a lesion. However many approaches have shown that if properly stimulated it can reestablish connectivity 6,7,10. One technique that is particularly useful to study this is the use of tract tracers. Anterograde tract tracers are compounds that can enter neurons at the soma and then distribute all along the axons until these reach their target structures. Two examples are cascade blue (CB) and biotinylated dextran amine (BDA). Conversely, retrograde tract tracers, such as cholera toxin B (CTB) or fluorogold (FG) enter the neuron through the axon terminal and then distribute back to the soma thus revealing the site of origin of neurons targeting the injection site.
Here, we present the methods that we use for implantation of miniosmotic pumps for direct delivery of proteins or drugs that have potential effects on neural plasticity as well as the injection of BDA and FG to unveil input and output connections to the motor cortex. BDA will also be used as an example of a tract tracer used to demonstrate increased plasticity of axons emerging from the co after stroke under rhEpo treatment.
Protocolo
Experimentos em animais foram realizados com a aprovação do governo (G1361 / 13, AZ84-02.04.2013.A192 e G1362 / 13, AZ84-02.04.2013.A194; Bezirksregierung Düsseldorf) com base em orientações do NIH para o Cuidado e Uso de Animais de Laboratório.
1. Preparação de bombas mini-osmóticas
- Em um ambiente estéril (por exemplo., Cultura celular capuz), obter a bomba, um cateter, regulador de fluxo, a infusão de cérebro cânula e os discos espaçadores para ser utilizado (Figura 1).
- Para a entrega de drogas directamente nos ventrículos usar um disco espaçador, de modo que apenas a ponta da cânula da agulha está em contacto com o ventrículo. Segure a cânula de cabeça para baixo com uma pinça. Adicionar duas gotas de cola de cianoacrilato (CA) e introduzir um disco espaçador.
- Deixar a cânula sobre uma superfície plana virada para cima de modo que a cola entre o disco espaçador e a secagem da cânula.
- Cortar o cateter em secções de cerca de 2,5 cm.
- Para eAbomba CH, preparar um mínimo de 300-350 ul da solução de interesse, uma vez que será necessária para preencher completamente a bomba de extrusão, assim, todo o ar dentro do mesmo para impedir a formação de bolhas no interior do cateter. bolhas irá impedir o fluxo do solução para o cérebro.
- Conecte cuidadosamente o cateter ao moderador do fluxo.
- Utilizando uma seringa de 2 ml conectado à agulha fornecida pelo kit de infusão cérebro, encher a bomba até que uma pequena quantidade de solução escapa a bomba, evitando bolhas de ar no seu interior.
- Preencher cuidadosamente o regulador de fluxo e cateter prestar atenção para evitar quaisquer bolhas restantes dentro do cateter.
- Introduzir o regulador de fluxo no interior da bomba.
- Uma vez preenchido, ligar-se cuidadosamente a cânula para a extremidade do cateter. Se observa-se que uma bolha é formada remover a cânula e cuidadosamente encher o cateter com veículo ou solução do fármaco e, em seguida, reintroduzir a cânula.
- Coloque o pupf num recipiente com solução salina estéril e deixá-lo a 37 ° CO / N.
- Antes da implantação verifique novamente para a formação de bolhas. Se necessário (ie., As bolhas são observadas) remover a cânula e encher o tubo. Volte a ligar a cânula. Isso deve levar apenas alguns microlitros de solução.
2. Implantação de miniosmóticas Bombas
Nota: Para estas experiências os animais foram anestesiados com isoflurano a 1% (30% de O2, 70% de N 2 O). No entanto, se este não está disponível, a utilização de injecções intraperitoneais de anestesia Também é possível 11.
- Localize o animal no dispositivo estereotáxico sob anestesia e cobrir os olhos com uma pomada de protecção para evitar a secura e sob anestesia. Confirmar anestesia por observação de uma falta de resposta na pata traseira quando pressionada com os dedos ou com uma pinça. Não continue até que o animal está completamente adormecido.
- Corte a pele sobre o que eleanúncio, quer com tesoura ou uma máquina de barbear. Cortar, tanto quanto possível, sem danificar a pele.
- Limpe a pele com etanol e 70% desinfetante com propriedades antibacterianas e fungicidas.
- Com um bisturi abrir uma incisão de 1 cm ligeiramente para a direita da linha média e expor o crânio.
- Limpe o crânio com um cotonete. Mergulhe-o com etanol 70% e passá-lo sobre o crânio. Isto irá induzir o crânio para secar.
- Se o crânio tem sangramento leve, use uma cauterizador para eliminar todos os pontos de sangramento. Sangue impede que o CA de secar adequadamente sobre o osso uma vez que a cânula é implantada.
- Utilizar o dispositivo estereotáxico para fazer uma marca no ponto do crânio onde a cânula vai ser implantado. Para infusões ventriculares nas coordenadas hemisfério esquerdo são -0,2 mm caudal, 0,9 mm lateral em relação ao bregma (Figura 2A).
- Suavemente broca sobre o crânio que faz um ângulo de 45 °; isto impede que a broca de entrar acidentalmente na Brain. Perfurar repetidamente por alguns segundos e, em seguida, verificar o quão profundo o buraco é. Pare de perfurar uma vez que o crânio foi diluído mas ainda não totalmente penetrado.
- Ruptura das meninges com a ponta de uma agulha estéril até que o acesso completo ao cérebro é alcançada. Faça isso com cuidado para não danificar o cérebro.
- Limpar o crânio com etanol a 70%, utilizando um cotonete.
- Introduzir um fórceps simples, sob a pele do animal numa direcção ântero-caudal. Utilizar as pinças para abrir o espaço sob a pele no dorso do animal, em que a bomba vai ser implantado. Introduzir a bomba na parte de trás do animal deixando a cânula do cateter e do lado de fora (Figura 2B). A bomba permanecerá nesta posição até que seja removido e não necessita de qualquer tipo de fixação.
- Colocar-se cuidadosamente quatro pequenas gotas de cola ao lado da agulha na cânula.
- Introduzir cuidadosamente a agulha através do crânio sem movê-lo para o lado. Segurá-la na posição de 15-30 seg uté a cânula é completamente ligado (Figura 2C.1). Uma vez no lugar, a cânula vai atingir 2,5 mm no sentido ventral dorso se um disco espaçador foi usado. Se forem correctamente ligados, a cânula irá ficar aderente ao osso, até ao final da experiência.
- Coloque um dedo sobre a guia removível e, em seguida, use a outra mão para cortá-lo por seu pescoço com um conjunto de tesouras (Figura 2C.2).
- Fechar a ferida na pele com uma sutura 5-0 e adição de algumas gotas de uma solução de povidona-iodo (PVP-I) em cima da ferida para prevenir a infecção (Figura 2D).
- Mova o animal em uma gaiola nova. Não coloque animais operados com animais que ainda não foram explorados. Manter os animais que foram implantados com bombas sozinho nas suas gaiolas durante o tempo de administração do fármaco.
- Não deixe camundongos sem vigilância até que eles estão acordados e recuperaram decúbito esternal.
3. Bomba de tirar raeu
Nota: Normalmente o experimento vai terminar no final do tempo de entrega autorizados pela bomba, no entanto, é possível retirar a bomba, a fim de fazer experiências secundárias como um acompanhamento para a entrega da droga. A fim de fazer injeções tracer trato é, portanto, necessária para remover a bomba.
- Colocar o animal no dispositivo seterotactic sob anestesia e cobrir os olhos com pomada de protecção para evitar a secura e sob anestesia. Confirmar anestesia por observação de uma falta de resposta na pata traseira quando pressionada com os dedos ou com uma pinça. Não continue até que o animal está completamente adormecido.
- Abrir cuidadosamente a pele por corte através da incisão feita no dia da implantação da bomba.
- Com uma pinça cirúrgica segurar a cânula e retire-o. Deve ser facilmente removida do crânio. Como o sangramento suave é esperado, pará-lo, colocando um cotonete e esperar por 1-2 min.
- Puxe a bomba pelo cateter. Elelp-lo sair, empurrando-o, criando pressão sobre a pele.
- Fechar a ferida novamente com uma sutura 5-0 e adição de algumas gotas de PVP-I.
- Mova o animal em uma gaiola nova. Não coloque animais operados com animais que ainda não foram explorados. Os animais que foram submetidos a cirurgia podem ser colocados juntos.
- Não deixe camundongos sem vigilância até que eles estão acordados e recuperaram decúbito esternal.
- Permitir que o animal possa recuperar durante 10 dias antes de prosseguir para a injeção do radiofármaco trato.
4. Pressão Tract Tracer Injeção em ângulos de 45 ° sobre o Direito Motor Cortex
- Colocar o animal no dispositivo estereotáxico sob anestesia e cobrir os olhos com uma pomada de protecção para evitar a secura e sob anestesia. Confirmar anestesia por observação de uma falta de resposta na pata traseira quando pressionada com os dedos ou com uma pinça. Não continue até que o animal está completamente adormecido.
- Abra o ferimento na cabeça.
- Cinclinar o crânio com 70% de etanol com um cotonete.
- Introduzir uma seringa de vidro de 5 mL (26S GA) no suporte vertical do dispositivo. Certifique-se a extremidade inferior do suporte de vidro é precisamente na peça de retenção. A seringa não deve estar muito abaixo que, em seguida, como será impossível para colocá-la em 45 ° a partir da posição vertical e fazer a injecção.
- Orientar a seringa diretamente sobre bregma e em seguida, localize as coordenadas desejadas. Para uma injecção nas coordenadas do córtex motor são as seguintes: Ponto # 1: +0,5 mm rostral e 2,5 mm lateral em relação ao bregma. Ponto # 2: +1,34 mm rostral, 2,5 mm lateral em relação ao bregma.
- Uma vez que as coordenadas foram localizados, indicar a sua posição sobre o crânio com um marcador com uma ponta fina. Faça apenas um ponto no crânio como liberação excessiva de tinta pode esconder coordenar a correta.
- Perfurar o crânio segurando cuidadosamente a broca de 45 °. Como no passo 2.8, verifique o crânio com freqüência para que ele não é totalmente perforated, a fim de evitar danos no cérebro causadas pela broca. Utilizar a ponta de uma seringa para assegurar que todo o osso foi removida.
- Coloque 600 nl de canal de diluição marcador dentro da seringa.
- Ajustar a posição vertical a 45 ° para o lado direito do animal. Sob o microscópio, coloque a ponta da agulha da seringa a direita na frente do buraco.
- Movê-lo na direcção vertical por 1,5 mm. Deixe a agulha firme nesta posição por 30 segundos a 1 minuto antes de fazer injeções de pressão.
- Injectar 300 nl de diluição de marcador em três passos de 100 nl separadas umas das outras por 30 seg. Após a última injecção, deixar a seringa estável durante 30 segundos a 1 minuto, a fim de evitar o traçador a fluir para fora do cérebro.
- Lentamente, retire a seringa, realocá-lo em relação ao segundo buraco e repetir o mesmo processo com o 300 nl restantes que estão dentro da seringa.
- Após a segunda injecção, remover a seringa e prossiga para fechar a você estánd com uma sutura 5-0 e adicione algumas gotas de PVP-I.
- Mova o animal em uma gaiola nova. Não coloque animais operados com animais que ainda não foram explorados. Os animais que foram submetidos a cirurgia podem ser colocados juntos. Não deixe camundongos sem vigilância até que eles estão acordados e recuperaram decúbito esternal.
- Permitir que o animal possa recuperar durante 10 dias antes do sacrifício.
5. Tract Tracer Observação
- Anestesiar o animal totalmente as orientações institucionais. Confirmar anestesia por observação de uma falta de resposta na pata traseira quando pressionada com os dedos ou com uma pinça. Não continue até que o animal está completamente adormecido.
- Perfundir os animais com paraformaldeído a 4% em PBS (pH 7) no âmbito de protocolos padrão 6.
- Remover o cérebro e pós correção pelo O / N imersão em paraformaldeído a 4%.
- Cryoprotect cérebros em sacarose a 30% até o cérebro afundar. Em seguida, retire os miolos e congelá-los por 10 seg Immersion em azoto líquido. Manter cérebros a -80 ° C até as secções são produzidos.
- Produção de secções a 20 uM para análise traçador retrógrado e no tracto 40 um marcador para a análise tracto anterógrada por seccionamento em um cryostate.
Nota: FG neurónios rotulados pode ser observado como as células brancas de excitação sob luz ultravioleta. BDA é detectado por O / N a incubação com um complexo de avidina-biotina peroxidase e-3,3 'diaminobenzidina com a adição de níquel em 0.4% para aumentar o contraste das fibras de 6,7.
Resultados
Nós apresentado animais a 30 minutos de oclusão da artéria cerebral média através do método de sutura intraluminal, induzindo uma lesão no corpo estriado esquerdo e em seguida entregue rhEpo directamente para o cérebro por meio de bombas mini-osmóticas (figura 1, figura 3) durante 30 dias, com início 3 dias após acidente vascular cerebral 6. A Figura 4 mostra um diagrama esquemático do tracto espinal córtico que foi rastreada e depois CB BDA injecção e a área onde traçadores foram injectados. Nós mostramos uma melhora da força de preensão e de desempenho motor (Figura 5) após 14 e 42 dias da entrega rhEpo respectivamente. Entrega de BDA no córtex motor direito dos animais que receberam um acidente vascular cerebral no estriado esquerdo, mostrou um aumento em fibras motoras cruzar a linha média ao nível do núcleo vermelho e facial (Figura 5), demonstrando a coloração de sucesso de brotamento de fibras tão uma consequência do tratamento farmacológico com miniosmotBombas ic. tratamento rhEpo também aumentou a sobrevivência neuronal, atrasou astrocitose difusa, reduziu a formação de cicatriz glial e aumento da angiogênese no período estudado 6. Ao usar esta mesma técnica para injecção traçador tracto podemos detectar com êxito núcleos talâmicos que estão ligados ao córtex por injecção do traçador FG retrógrada do tracto (Figura 6).

Figura 1. Componentes da bomba miniosmóticas utilizado neste protocolo. O disco espaçador, cânula e guia removível, cateter, o fluxo moderador e bomba miniosmóticas podem ser observados. O aspecto da bomba totalmente montada pode ser visto na Figura 2A. Por favor clique aqui para ver uma versão maior desta figura.
ithin-page = "1"> 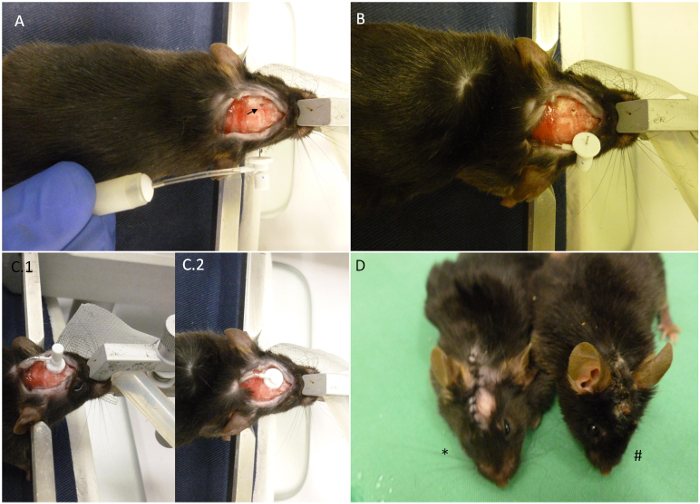
Figura 2. Resumo da implantação da bomba de pontos-chave. (A) O mouse é mostrado colocado no dispositivo estereotáxico com a bomba miniosmóticas totalmente construído ao lado dele. A seta indica as coordenadas seleccionadas, para implantação. (B) A bomba foi introduzido no dorso do animal, e só a cânula permanece no exterior. O crânio foi perfurado já. (C) Aspecto da cabeça após a implantação. (C.1) A cânula é em posição, mas a guia removível não tenha sido cortado. (C.2) A aba removível ter sido cortada e costura de a ferida pode começar agora. (D) O asterisco mostra um animal recentemente implantadas, em comparação com um animal 30 dias após a implantação (#). Quando instalado correctamente, a ferida deve permanecer fechada até o final do processo, como mostrado na imagem."target =" _ blank ove.com/files/ftp_upload/52932/52932fig2large.jpg "> Clique aqui para ver uma versão maior desta figura.
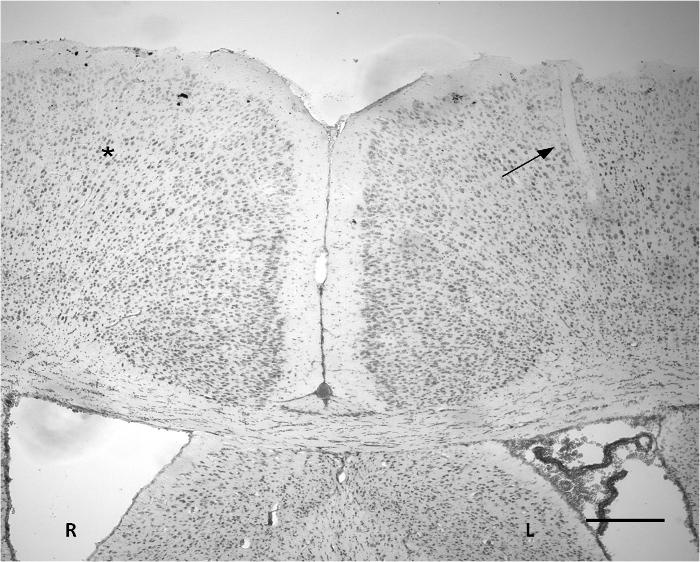
Figura 3. coloração de Nissl indicando o local da implantação no córtex. Uma pequena incisão pode ser observado na parte do córtex esquerda (seta). A largura da área de penetração é cerca de 50 uM. O há alterações graves no tecido evidentes com base na coloração de Nissl em comparação com a área correspondente contralateral (*). R: hemisfério direito. L: hemisfério esquerdo. Scale bar = 300 mm. Por favor clique aqui para ver uma versão maior desta figura.
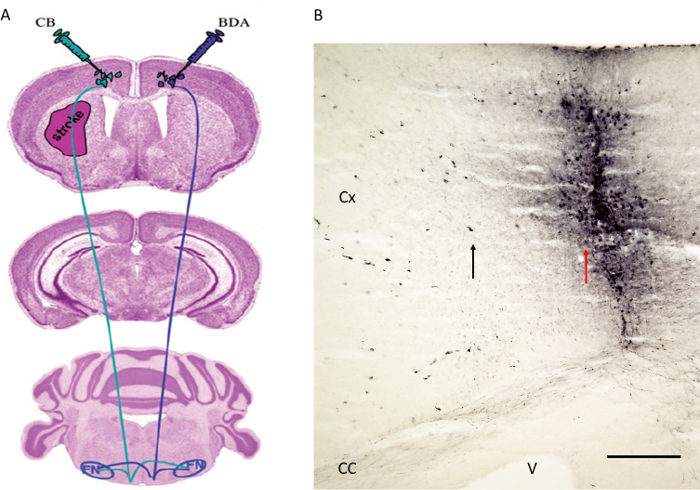
Figura 4. Tractestratégia de injeção do radiofármaco como publicado antes por Reitmeier et al. 6,7. (A) esquemáticos que indiquem os locais de injeção para o traçador trato BDA no córtex motor contralateral Considerando CB foi injetado no córtex motor do hemisfério enfartado. As fibras foram seguidos para o núcleo vermelho (não representado) e núcleo facial (ver Figura 5). (B) O local de injecção do traçador tracto anterógrada BDA ao lado do córtex motor é mostrado. Observe a seta vermelha que indica a faixa agulha enquanto que a seta preta mostra algumas células corticais marcadas com o BDA. Cx: Cortex. CC: corpo caloso. V: Ventrículo. FN: núcleo Facial. Barra de escala em B = 200 mm. Figura 4A é reproduzido com a devida permissão 6. Por favor clique aqui para ver uma versão maior desta figura.

Figura 5. Recuperação de um cérebro enfartado após a entrega de rhEpo. (A) BDA injectado no córtex motor contralesional é então detectado em fibras corticobulbares ao nível do núcleo facial (bregma -5,8 mm para -6,3 mm). Linhas de interseção em cada hemisfério foram elaboradas paralelamente à linha mediana e fibras que cruzam cada linha em direção ao hemisfério ipsilesional e contralesional foram contadas e expressas como percentagem do total de fibras marcadas no trato corticoespinhal. Eritropoietina aumentou travessias de fibra em direção aos contralesional dados núcleo facial são meios + - SD. Os dados foram analisados por ANOVA one-way seguido por testes de menos significativos diferenças, §P <0,05 em comparação com ratos não isquémicos tratados com o veículo. (B) Comportamento Motor mostrou uma melhora de força de preensão manual e coordenação no teste de rota rod. Os dados são médias ValuES + - SD. Os dados foram analisados por duas vias para medidas repetidas ANOVA, seguido de variância one-way / menos significativos testes diferenças para cada ponto de tempo. §P <0,05 em comparação com os valores basais pré-isquêmica; * P <0,05 comparada com os ratos tratados com veículo isquêmicos. As Figuras 5A e B são reproduzidas com a devida permissão 6. Por favor clique aqui para ver uma versão maior desta figura.
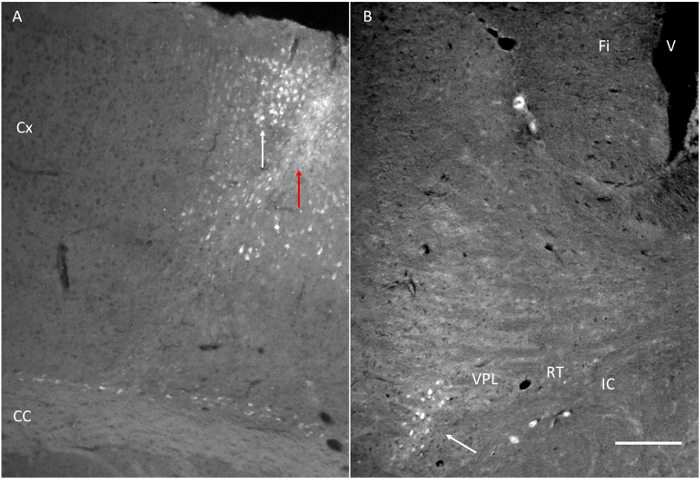
Figura 6. estruturas alvo atingido após a injecção de Fluorogold (FG). (A) no local de injecção de FG ao lado do córtex motor, conforme indicado na Figura 1. Note-se a seta vermelha indica o percurso da agulha e a seta branca indica algumas células marcadas em o córtex. (B) FG injectado próximo do motorcórtex é detectado no VPL. Fi: Fimbria. IC: cápsula interna. RT: núcleo reticular Thalamic. VPL: Thalamic núcleo póstero ventral. Barra de escala = 200 mm. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Por muitos anos, a investigação sobre doenças neurodegenerativas, como acidente vascular cerebral isquêmico ou lesão cerebral traumática tem-se centrado no desenvolvimento de terapias neuroprotetoras que visam promover a sobrevivência neuronal na fase aguda acidente vascular cerebral. A grande maioria de drogas terapêuticas que têm sido encontrados para ser eficaz em modelos de roedores com falha quando traduzida para a clínica. As razões para esta falha terapêutica incluem, mas não se restringem à falta de efeitos de drogas sustentadas resultando na persistência da recuperação neurológica funcional. Assim, é importante para desenvolver estratégias que promovam a remodelação do cérebro no longo prazo. Como a promoção de sobrevivência neuronal por si só não é suficiente para permitir a recuperação bem-sucedida do curso, tal como sugerido pelo grande número de tentativas mal sucedidas de neuroproteção, a estimulação de plasticidade neuronal recentemente obteve grande interesse no campo.
Meios para a entrega da droga são a injeção intraperitoneal, cauda i intravascularnjection, injecção femoral, a injecção estereotáxica de vectores única no cérebro e continuou entrega constante por bombas mini-osmóticas. Estes últimos podem incluir a entrega sistémica, se a bomba não tem uma cânula, ou que pode ser dirigido órgão, como mostramos para entrega no cérebro. Com a excepção das bombas mini-osmóticas e a utilização de vectores virais, todas as outras estratégias irá induzir concentrações de droga flutuantes. Para os experimentos de longa duração torna-se, assim, necessário apresentar o animal ao estresse de receber injecções frequentes. O BBB impõe um obstáculo importante para a captação no cérebro de proteínas ou fármacos a partir do sangue, resultando na necessidade de grandes dosagens de proteína ou de drogas, a fim de atingir as concentrações terapêuticas no cérebro. Por exemplo Pellegrini et al. (2013) 5 entregue rhEpo por injecção intraperitoneal com uma dose equivalente a 75 IU / dia para um animal, de 30 g (750 UI / dia para um rato de 300 g). Em comparação, a entrega de rhEp alvoo para o cérebro nos permitiu usar uma dose muito menor de apenas 10 IU / dia em nosso estudo para recuperação bem sucedida do curso, o que nos permitiu conseguir a recuperação através de uma escala de tempo grande em uma taxa fixa de 0,25 l / h.
Neste trabalho, demonstraram que o método de implantação de mini-bombas com uma cânula ligada ao crânio, a fim de proporcionar a proteína de promover plasticidade rhEpo directamente no ventrículo, contornando assim a certificação. Por este método, rhEpo promoveu a recuperação neurológica em um número de maneiras, incluindo a redução do tamanho do enfarte, a redução da formação de cicatrizes gliais e a indução da angiogénese. rhEpo também promoveu a sobrevivência neuronal e aumento projeções do córtex motor contralesional para o núcleo vermelho desnervado e núcleos faciais. O surgimento das fibras foi revelado por injecção do traçador tracto anterógrada BDA no córtex motor (Figuras 4A e 5A). Um correlato funcional para o surgimento das fibras é provided pela melhora das habilidades motoras (Figura 5B). Além disso, mostrámos que a mesma abordagem para injecção tracto traçador pode ser aplicado para revelar ligações tálamo-corticais por injecção do traçador retrógrado tracto FG (Figura 6B).
Na preparação da bomba mini-osmóticas, é importante considerar o ponto-alvo e a utilização de espaçadores. Usamos um espaçador para reduzir o comprimento da agulha por 0,5 milímetros como, desta forma a ponta da agulha está em contacto com o ventrículo nas coordenadas indicadas (-0,2 mm caudal, 0,9 mm lateral, 2,5 mm ventral dorso, com relação ao bregma). No entanto, se estruturas mais profundas são o alvo da pesquisa, em seguida, será necessária sem espaçadores. Da mesma forma, se um ponto de distribuição mais externa é desejada (isto é., O córtex), em seguida, mais discos espaçadores será necessário. O cateter deve ser longa o suficiente para que a bomba não é muito perto da cabeça, uma vez que irá impedir o movimento do mouse, mas também comprimento excessivo não muito tempo, como uma vez implantado pode fazer com que o cateter de dobrar, aumentando assim o risco de a remoção da cânula pela circulação natural do rato. A secção de 2 cm de cateter dá muito bons resultados em termos de mobilidade e estabilidade do implante (Figuras 1 e 2). A incubação da bomba a 37 ° CO / N permite que a bomba comece imediatamente a bombear o fármaco no cérebro, no momento da implantação.
No implante de bomba mini-osmóticas é crítico para assegurar que o crânio é bem seco antes da implantação da cânula. Normalmente, a limpeza com 70% de etanol, vai induzir o osso para secar, mas se a hemorragia contínua é encontrado, tocando o crânio suavemente com um cauterizador vai secar completamente. É crítico para assegurar que a introdução da agulha é como vertical e lenta quanto possível. Uma vez em posição, e ao mesmo tempo a cola está a secar, colocando o dedo no topo da cânula impede que se mova lateralmente OVer o crânio. Cuidado especial deve ser dado à ferida e colocação da cânula. É importante que a incisão não é realizada exactamente sobre a linha média do crânio, mas ligeiramente para o lado direito. Ao fechar a ferida, se a incisão na linha do meio, a pele será sobrecarregado, aumentando assim o risco de abertura da ferida. Fazer a incisão ligeiramente para um lado vai permitir que os pontos de sutura para ser longe da parte mais alta da cânula. Como consequência, haverá menos tensão sobre os pontos de sutura e a ferida irá curar devidamente. Os animais devem ser enjaulado sozinho verificado todos os dias, especialmente durante os primeiros 10-15 dias após a implantação. Em caso de deiscência da ferida, as feridas tem que ser fechado tão rapidamente quanto possível. Se a cânula for removida ou o animal apresenta uma infecção, a experiência tem que ser terminado. Re-implantação da cânula não é recomendado. É muito importante para o sucesso da implantação a utilização de quantidades adequadas de tecido anúncioadesiva (não muito!), uma vez que degrada o osso e aumenta o risco de a remoção de uma cânula. No entanto usando muito pouco adesivo também não vai segurar a cânula ligado ao osso. As bombas mini-osmóticas podem transportar drogas dissolvidas em uma ampla variedade de substâncias, sendo a única limitação a isto que o solvente é biocompatível. Além disso, dado que o volume é pequeno (200 ul) deve-se determinar se a concentração necessária para a experiência é adequado e não irá provocar a precipitação dentro da bomba.
Rastreamento com qualquer anterógradas ou retrógradas traçadores trato é uma técnica muito bem estabelecido para estudar a conectividade cerebral e plasticidade. Cuidados devem ser tomados para os quadros uso estereotáxica quando se injecta para garantir a precisão na segmentação a área do cérebro que se deseja estudar (ou seja, para evitar a injeção no corpo caloso ao injetar o córtex).
Para todas as intervenções cirúrgicas e de modo a reduzir a dor einflamação, os animais devem ser tratados com 0,1 mg / kg de buprenorfina antes da intervenção e Caprofen a 4 mg / kg uma vez por dia durante três dias após a intervenção.
Em conclusão, esta abordagem proporciona uma ferramenta adequada para o estudo de efeito de proteínas ou compostos farmacológicos no cérebro lesionado, que representa um método que é bem adequado para estudos sobre a plasticidade do cérebro.
Divulgações
Produção e Open Access taxas de publicação fornecidas por DURECT Corporation, que produz as bombas miniosmóticas usado neste artigo.
Agradecimentos
This work was supported by the Dr. Werner Jackstädt Foundation (to Eduardo Sanchez-Mendoza), the German Academic Exchange Service (DAAD; to Jeismar Carballo), the German Research Council (HE3173/2-1, HE3173/2-2, and HE3173/3-1; to Dirk M. Hermann), Heinz Nixdorf Foundation (to Dirk M. Hermann).
Materiais
| Name | Company | Catalog Number | Comments |
| Alzet miniosmotic pump. Model 2004. | Alzet | 000298 | Drug container |
| Brain infusion kit 3 1-3 mm | Alzet | 0008851 | Drug brain delivery system |
| Loctite 454 Prism gel | Loctite | 45404 | Cyanoacrylate adhesive for cannula adhesion to the skull |
| 75N glass syringe | Hamilton | 87900/00 | Injection of tract tracers |
| Biotin Dextran Amine (10,000 MW) | Molecular probes | N-7167 | Anterograde tract tracer |
| Fluorogold | Fluorochrome, LLC. | Retrograde tract tracer | |
| Quintessential Stereotaxic Injector (QSI) | Stoelting | 53311 | Stereotactic device for coordinate determination, pump implantation and tract tracer injection. |
Referências
- Doeppner, T. R., et al. MicroRNA-124 protects against focal cerebral ischemia via mechanisms involving Usp14-dependent REST degradation. Acta Neuropathol. 126, 251-265 (2013).
- Hoyo-Becerra, C., et al. Rapid Regulation of Depression-Associated Genes in a New Mouse Model Mimicking Interferon-alpha-Related Depression in Hepatitis C Virus Infection. Mol Neurobiol. , (2014).
- Puntel, M., et al. Gene transfer into rat brain using adenoviral vectors. Curr Protoc Neurosci. Chapter 4, Unit 4.24 (2010).
- Miao, J., et al. Overexpression of adiponectin improves neurobehavioral outcomes after focal cerebral ischemia in aged mice. CNS Neurosci Ther. 19, 969-977 (2013).
- Pellegrini, L., et al. Therapeutic benefit of a combined strategy using erythropoietin and endothelial progenitor cells after transient focal cerebral ischemia in rats. Neurol Res. 35, 937-947 (2013).
- Reitmeir, R., et al. Post-acute delivery of erythropoietin induces stroke recovery by promoting perilesional tissue remodelling and contralesional pyramidal tract plasticity. Brain. 134, 84-99 (2011).
- Reitmeir, R., et al. Vascular endothelial growth factor induces contralesional corticobulbar plasticity and functional neurological recovery in the ischemic brain. Acta Neuropathol. 123, 273-284 (2012).
- Hermann, D. M., Chopp, M. Promoting brain remodelling and plasticity for stroke recovery: therapeutic promise and potential pitfalls of clinical translation. Lancet Neurol. 11, 369-380 (2012).
- Overman, J. J., et al. A role for ephrin-A5 in axonal sprouting, recovery, and activity-dependent plasticity after stroke. Proc Natl Acad Sci U S A. 109, E2230-E2239 (2012).
- Wolf, W. A., Martin, J. L., Kartje, G. L., Farrer, R. G. Evidence for Fibroblast Growth Factor-2 as a Mediator of Amphetamine-Enhanced Motor Improvement following Stroke. PLoS One. 9, e108031 (2014).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rulicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51, 443-456 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados