A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مضان غشاء حيوي قوة دقق: الكميات المتزامنة من حركية مستقبلات يجند والتي يسببها ملزم بين الخلايا اشارة على خلية واحدة
* These authors contributed equally
In This Article
Summary
We describe a technique for concurrently measuring force-regulated single receptor-ligand binding kinetics and real-time imaging of calcium signaling in a single T lymphocyte.
Abstract
الغشاء مستقبلات يجند التفاعل تتوسط العديد من الوظائف الخلوية. ملزمة حركية وإشارات المصب الناجمة عن هذه التفاعلات الجزيئية المرجح تتأثر البيئة الميكانيكية التي ملزما ويشير تجري. أظهرت دراسة حديثة أن قوة ميكانيكية يمكن أن تنظم الاعتراف المستضد من قبل، ويتسبب في مستقبلات الخلايا التائية (TCR). وقد أصبح هذا ممكنا بفضل التكنولوجيا الجديدة التي قمنا بتطويرها ومضان يطلق قوة غشاء حيوي التحقيق (fBFP)، الذي يجمع بين جزيء واحد قوة التحليل الطيفي مع مضان المجهري. باستخدام خلايا الدم الحمراء في الانسان فائقة النعومة كما استشعار القوة حساسة، وكاميرا عالية السرعة والوقت الحقيقي تتبع تقنيات التصوير، وfBFP هو من ~ 1 السندات الإذنية (10 -12 N)، ~ 3 ~ نانومتر و 0.5 مللي ثانية في القوة، القرار المكانية والزمانية. مع fBFP، يمكن للمرء أن قياس بدقة حركية مستقبلات يجند واحدة ملزمة بموجب المادة القوة في وقت واحد صورة أثار ملزم كال داخل الخلاياcium يشير على خلية حية واحدة. هذه التكنولوجيا الجديدة يمكن استخدامها لدراسة أخرى الغشاء مستقبلات يجند التفاعل ويشير في الخلايا الأخرى في إطار التنظيم الميكانيكي.
Introduction
خلية الى خلية والخلية الى خارج الخلية مصفوفة بوساطة (ECM) التصاق عن طريق الربط بين مستقبلات سطح الخلية والبروتينات ECM، و / أو الدهون 1. ملزمة تمكن خلايا لتشكيل هياكل وظيفية 1، وكذلك الاعتراف، والتواصل، والتفاعل مع البيئة 1-3. على عكس البروتينات القابلة للذوبان (مثل السيتوكينات وعوامل النمو) التي تربط من ثلاثي الأبعاد (3D) المائع على مستقبلات سطح الخلية، مستقبلات التصاق الخلايا تشكل السندات مع بروابط بهم عبر فجوة ضيقة صلي لسد سطحين معارضة التي تقيد الجزيئية نشر في الأبعاد (2D) واجهة اثنين 4-7. وعلى النقيض من حركية 3D والتي يتم قياسها عادة من قبل المقايسات ملزمة التقليدية (على سبيل المثال، صدى مأكل السطح أو SPR)، حركية 2D يجب أن يكون كميا مع تقنيات متخصصة مثل قوة المجهر الذري (AFM) 10/08، غرفة 11،12 التدفق، micropipette 13،14، البصريملاقط 15 وقوة غشاء حيوي التحقيق (حزب الحرية) 16-21.
أكثر من مجرد توفير الربط المادي للتماسك الخلوي، جزيئات الالتصاق هي العنصر الرئيسي في آلية إشارات للخلية للتواصل مع محيطه. لم يكن هناك اهتمام متزايد في فهم كيفية إشراك يجند من جزيئات الالتصاق يبدأ الإشارات بين الخلايا وكيفية transduced إشارة أولية داخل الخلية. حدسي، خصائص مستقبلات يجند ملزمة يمكن أن تؤثر على الإشارات التي يدفع. ومع ذلك، فإنه من الصعب تشريح العلاقات الميكانيكية بين التفاعل خارج الخلية والأحداث الإشارات بين الخلايا باستخدام الفرقة التقليدية للفحوصات البيوكيميائية بسبب العديد من القيود المفروضة عليها، على سبيل المثال، وهو القرار الزماني الفقراء والانعدام التام للقرار المكاني. الطرق التي تسمح لكل من الفيزياء الحيوية (2D حركية ملزمة مستقبلات يجند) والكيمياء الحيوية (إشارات) ملاحظات على الهواء مباشرة الحاليةوتشمل خلايا ركائز من صلابة الانضباطي 22، المطاط الصناعي صفائف العمود 23 والأجهزة تدفق غرفة / ميكروفلويديك تدمج مع القدرة مضان 24-26. ومع ذلك، قراءات من الإشارات وملزمة مستقبلات يجند لها التي يمكن الحصول عليها بشكل منفصل (في معظم الأحيان عن طريق وسائل مختلفة)، مما يجعل من الصعب تشريح العلاقات الزمانية والمكانية للخصائص السندات مع إشارات الأحداث.
BFP التقليدي هو التحليل الطيفي قوة فائق الحساسية لقرار الزمانية المكانية عالية (17). ويستخدم خلية مرنة الدم الحمراء (RBC) كجهاز استشعار القوة، مما يتيح قياس حركية 2D جزيء واحد، الخواص الميكانيكية والتغيرات متعلق بتكوين 14،16،19-21،27-29. A BFP التصوير الفلورسنت مقرها (fBFP) يرتبط حركية مستقبلات يجند الملزمة مع الخلايا مما يشير الى اثار ملزم على نطاق واسع جزيء واحد. مع هذا الإعداد، في أنشطة الخلايا مما يشير الى الوضع الطبيعي في سياق mechani السطحولوحظ التحفيز كال في الخلايا T-27. وfBFP هي متعددة ويمكن استخدامها لدراسات التصاق الخلايا والإشارات بوساطة جزيئات أخرى في خلايا أخرى.
Protocol
هذا البروتوكول يتبع المبادئ التوجيهية للوتمت الموافقة من قبل لجنة أخلاقيات البحوث البشرية من معهد جورجيا للتكنولوجيا.
1. كرات الدم الحمراء الإنسان العزلة، Biotinylation والأسمولية تعديل
ملاحظة: الخطوة 1.1 يجب أن يؤديها الطبية المهنية مثل ممرضة مدربة، مع الموافقة على مجلس المراجعة المؤسسية البروتوكول.
- الحصول على 8-10 ميكرولتر (قطرة واحدة) من الدم من وخز الاصبع وإضافة إلى 1 مل من كربونات / بيكربونات العازلة (الجدول 1 و 2). بلطف دوامة أو ماصة للخليط وأجهزة الطرد المركزي لمدة 1 دقيقة في 900 ز س. تجاهل طاف ويغسل مرة واحدة أكثر من ذلك.
- في كوب صغير يزن 3،5-4 ملغ من البيوتين-PEG3500-NHS رابط (الجدول 1). اذابته في كربونات / بيكربونات العازلة لجعل النهائي تركيز 3 ملغ / مل.
- مزيج 171 ميكرولتر من كربونات / بيكربونات العازلة، 10 ميكرولتر من حزمة RBC وميكرولتر من 1049البيوتين PEG3500-NHS حل رابط واحتضانها في RT لمدة 30 دقيقة. يغسل RBC مرة واحدة مع كربونات / بيكربونات العازلة ومن ثم مرتين مع N2-5٪ عازلة (الجدول 1 و 2).
- وفي الوقت نفسه، ضع زجاجة رابط مع غطاء خففت في مجفف الزجاج فراغ مليئة المجففات في الجزء السفلي، وفراغ لمدة 5 دقائق، وملء المجفف مع الأرجون. إحكام الغطاء وأخذ زجاجة بها. ختم زجاجة من البلاستيك البارافين فيلم (الجدول 1)، وضعه في وعاء مملوء المجففات على الجزء السفلي وتخزينها في -20 ° C.
ملاحظة: الخطوات التي تنطوي على استخدام البيوتين-PEG3500-NHS رابط، بما في ذلك 1،2-1،4 (باستثناء حضانة ويغسل في 1.3)، يجب أن تنجز بأسرع وقت ممكن. - تمييع نيستاتين في N2-5٪ عازلة لجعل تركيز النهائي من 40 ميكروغرام / مل. مزيج 5 ميكرولتر من البيروكسيديز RBC مع 71.4 ميكرولتر من النيستاتين (الجدول 1) حل واحتضان لمدة 1 ساعة على 0 و# 176؛ C. يغسل مرتين مع N2-5٪ العازلة ومخزن مع N2-5٪ عازلة + 0.5٪ BSA (الجدول 1) في الثلاجة (4 ° C).
2. الزجاج الخرزة Silanization
- تنظيف السطح الخرزة
- تزن 50 ملغ من الخرز الزجاجي مسحوق وإعادة تجميدها في 500 ميكرولتر من المياه DI.
- خلط 0.5 مل من H 30٪ 2 O 2 (الجدول 1) مع 9.5 مل من الماء DI في دورق 50 مل، ثم يضاف 2 مل من تتركز NH 4 OH (الجدول 1) وجلب هذا الحل إلى المرجل على طبق ساخن .
- إضافة الخرز الزجاجي في حل الغليان ويستمر في الغليان لمدة 5 دقائق أخرى. دوامة بلطف حل كل دقيقة.
- بعد الغليان، ونقل ~ 5 مل من هذا حبة تعليق الساخن إلى 15 مل الدقيقة أنبوب الطرد المركزي وأعلى حتى مع الماء RT DI. أجهزة الطرد المركزي في 3500 x ج لمدة 5 دقائق، وإزالة والتخلص من طاف.
- نقل 5 مل أخرى من حبة تعليق ساخن وإضافة إلى الخرز غسلها، أعلى حتى مع المزيد من المياه DI، وتخلط جيدا، وأجهزة الطرد المركزي مرة أخرى. كرر هذا الإجراء حتى يتم استخدام حوالي 50 مل من الماء DI، والتي ستكون ما مجموعه 4 إلى 5 مرات من الغسيل.
- نقل تعليق حبة إلى قارورة 1 مل. تكرار غسل الخرز مع الميثانول (الجدول 1) بواسطة الطرد المركزي في 17000 x ج لمدة 5 دقائق لمدة 3 مرات، وأخيرا إعادة تعليق الخرز في 1 مل من الميثانول بنسبة 100٪.
- حبة سطح Thiolation
- إلى 50 مل أنبوب الطرد المركزي إضافة 45.6 مل من الميثانول، 0.4 مل من حمض الخليك (الجدول 1)، 1.85 مل من الماء DI، 1.15 مل من 3 Mercaptopropyltrimethoxysilane (MPTMS) (الجدول 1) و 1 مل الخرز تعليق أعد في 2.1، ثم في احتضان RT لمدة 3 ساعة.
- بعد رد الفعل، وإزالة جميع المواد الداخلة في التفاعل عن طريق الغسيل مرة واحدة مع الميثانول النقي، وإعادة تعليق الخرز في 500 ميكرولتر من الميثانول. بالتساوي تقسيم هذا المركز الزجاج حبة التعليق إلى مجموعة من 20 قارورة زجاجية جافة ونظيفة معقبعات المسمار. تتبخر قبالة الميثانول باستخدام طائرة من الأرجون الجاف وتناوب ببطء قارورة وذلك لجعل طبقة رقيقة من حبات جافة على جانبي كل قارورة.
- ضع قارورة من الخرز داخل فرن التجفيف قبل ساخنة في 120 درجة مئوية لمدة 5 دقائق ثم تأخذ بها، وسرعان ما وضع الغطاء (الصورة) وهو مبني على. ضع قارورة في مجفف الزجاج فراغ مليئة المجففات في الجزء السفلي، وفراغ مجفف مع مضخة فراغ حتى تبرد.
- تطهير مجفف بالمكنسة الكهربائية مع الأرجون جافة لتحقيق المجفف إلى الضغط الجوي العادي. إزالة الغطاء المجفف وبسرعة إعادة تشديد الغطاء (ق) على القارورة. ختم القنينات مع فيلم البلاستيك البارافين وتخزينها في RT في صندوق تخزين جاف مظلم.
- عند استخدام الفوري، واتخاذ قارورة واحدة من الخرز الجافة ويغسل مرة واحدة مع العازلة الفوسفات (الجدولين 1 و 2)، إعادة تعليق في 50 ميكرولتر من العازلة الفوسفات وتخزينها في 4 ° C. وسوف يحال هذا المستحضر حبة مركزة لكما "حبات MPTMS" في الخطوات التالية.
ملاحظة: مع التخزين السليم، يمكن أن حبات MPTMS يظل ساريا لمدة تصل إلى ثلاثة أشهر.
3. حبة Functionalization
- طلاء تساهميا البروتينات على الخرز
- تأخذ حجم معين (على سبيل المثال، 2.5 ميكرولتر) من الأسهم البروتين وتخلط مع حجم مساو من كربونات / بيكربونات العازلة لجعل الحل 1.
ملاحظة: حجم يعتمد على تركيز الأسهم وكثافة موقع النهائية المرجوة من البروتين على سطح الخرز. - في كوب صغير تزن 2-3 ملغ من MAL-PEG3500-NHS رابط (الجدول 1) وحله مع كربونات / بيكربونات عازلة للوصول إلى تركيز النهائي من 0.231 ملغ / مل.
- مزيج الحل 1 مع حجم مساو من الحل رابط أعدت في 3.1.2. احتضان الخليط في RT لمدة 30 دقيقة لجعل الحل 2.
- وفي الوقت نفسه، ضع زجاجة رابط مع غطاء خففت في كوب فراغ مجفف وilled مع المجففات في الجزء السفلي، وفراغ لمدة 5 دقائق، وملء المجفف مع الأرجون. إحكام الغطاء وأخذ زجاجة بها. ختم زجاجة مع فيلم البارافين البلاستيك، وضعه في وعاء مملوء المجففات على الجزء السفلي وتخزينها في -20 ° C.
ملاحظة: الخطوات التي تنطوي على استخدام MAL-PEG3500-NHS رابط، بما في ذلك 3.1.2-3.1.4 (باستثناء حضانة في 3.1.3)، تحتاج إلى أن يتحقق بأسرع وقت ممكن. - مزيج 5 ميكرولتر من الخرز MPTMS مع الحل 2 وإضافة العازلة الفوسفات (الجدول 1) لجعل الحجم النهائي من 250 ميكرولتر.
- احتضان حبات بين عشية وضحاها في RT، ويغسل 3 مرات مع العازلة الفوسفات، وإعادة تعليق في 100 ميكرولتر من العازلة الفوسفات وتخزينها في 4 ° C.
- تأخذ حجم معين (على سبيل المثال، 2.5 ميكرولتر) من الأسهم البروتين وتخلط مع حجم مساو من كربونات / بيكربونات العازلة لجعل الحل 1.
- إعداد البروتين / الخرز ستربتافيدين (SA) المغلفة
- اتبع بروتوكول 3.1.1-3.1.4.
- مزيج 5 ميكرولتر من الخرز MPTMS مع الحل 2 و 5 ميكرولتر من 4 ملغ / مل ستربتافيدين-Maleimide (SA-MAL) (الجدول 1) الحل ثم قم بإضافة العازلة الفوسفات لجعل الحجم النهائي من 250 ميكرولتر.
- احتضان حبات بين عشية وضحاها في RT، ويغسل 3 مرات مع العازلة الفوسفات، وأخيرا إعادة تعليق في 100 ميكرولتر من العازلة الفوسفات وتخزينها في 4 ° C.
- طلاء ستربتافيدين على الزجاج الخرز
- مزيج 5 ميكرولتر من الخرز MPTMS مع 5 ميكرولتر من 4 ملغ / مل SA حل وإضافة 140 ميكرولتر من العازلة الفوسفات.
- احتضان حبات بين عشية وضحاها في RT، ويغسل 3 مرات مع العازلة الفوسفات، وإعادة تعليق في 50 ميكرولتر من العازلة الفوسفات وتخزينها في 4 ° C.
- طلاء الخرز SA المغلفة مع البروتين المعقدة البيروكسيديز
- مزيج 5 ميكرولتر من الخرز SA المغلفة مع بروتين (حجم اعتمادا على كثافة الطلاء المطلوب) وإضافة العازلة الفوسفات لجعل الحجم النهائي لتكون 100 ميكرولتر.
- احتضان الخليط بين عشية وضحاها في 4 درجات مئوية أو لمدة 3 ساعة على RT، ويغسل 3 مرات مع العازلة الفوسفات، وإعادة تعليق في 50 ميكرولتر فتاهosphate العازلة وتخزينها في 4 درجات مئوية.
4. خلية التحضير
ملاحظة: لتنقية الخلايا، اتبع القياسية بروتوكولات تنقية الخلايا المقابلة لنوع من الخلايا في الاستخدام، على سبيل المثال خلايا T-27 أو بعض خطوط الخلايا 21،29.
- للتجارب fBFP، بعد الانتهاء من إعداد تعليق الخلية، إضافة Fura2-AM (الجدول 1) الذائبة في DMSO في تعليق خلية للوصول إلى تركيز النهائي من 2 ميكرومتر، واحتضان لمدة 30 دقيقة في RT ثم يغسل مرة واحدة. الحفاظ على هذا التعليق الخلية تحميل fluorescently في الظلام حتى الاستخدام.
5. إعداد لبال micropipettes وغرفة خلية
- إعداد بال micropipettes
- قطع الأنابيب الشعرية الطويلة الزجاج (الجدول 1) مع قطع الزجاج إلى قطع قصيرة من حوالي 3 بوصات في الطول. جبل قطعة واحدة على مجتذب micropipette (الجدول 1)، انقر فوق "سحب" ولكنطن بحيث سيكون ساخنا وسط الشعرية من قبل الجهاز، وسوف يتم سحبها الشعرية على طرفي لجعل اثنين من الشعيرات الدموية مع نصائح حادة (بال micropipettes الخام).
ملاحظة: وذلك باتباع التوجيهي المنتج، والتشكل المرجوة من ماصة الخام لديها 6-8 ملم تفتق و0.1-0.5 ميكرون طرف. - جبل ماصة الخام على حامل ماصة للحدادة micropipette (الجدول 1). الحرارة إلى ذوبان مجال الزجاج على تزويرها. إدراج غيض من ماصة الخام داخل المجال الزجاج. تهدئة مجال الزجاج وسحب ماصة الخام لكسر من الخارج وترك طرفها داخل المجال. كرر هذا الإجراء حتى يتم الحصول على فوهة طرف المطلوب.
ملاحظة: أمثلة من القطر الداخلي micropipette نصيحة: 2،0-2،4 ميكرون لRBC، ~ 1.5 ميكرون للحبة، ~ 2-4 ميكرومتر لخلايا T و-7 ميكرون لخلية هجين.
- قطع الأنابيب الشعرية الطويلة الزجاج (الجدول 1) مع قطع الزجاج إلى قطع قصيرة من حوالي 3 بوصات في الطول. جبل قطعة واحدة على مجتذب micropipette (الجدول 1)، انقر فوق "سحب" ولكنطن بحيث سيكون ساخنا وسط الشعرية من قبل الجهاز، وسوف يتم سحبها الشعرية على طرفي لجعل اثنين من الشعيرات الدموية مع نصائح حادة (بال micropipettes الخام).
- بناء غرفة الخليوي
ملاحظة: تم بناء غرفة الخليوي على أساس-جنون المنزله صاحب الغرفة، والتي تتكون من قطعتين من المربعات المعدنية (النحاس / الألومنيوم) ومقبض التي تربط بين بعضهم البعض (الشكل 1D). - قطع 40 مم × 22 مم × 0.2 مم ساترة باستخدام قطع الزجاج إلى قسمين 40 مم × 11 مم × 0.2 مم قطعة (ساترة 1 و 2). الغراء ساترة 1 قبل الشحوم إلى الجانب العلوي من صاحب غرفة في الطريقة التي الجسور الساحات معدنيين، وبالمثل ساترة الغراء 2 إلى الجانب السفلي، التي ستشكل خلية غرفة المتوازية ساترة (الشكل 1D).
- استخدام ماصة لحقن 200 ميكرولتر من العازلة التجريبية بين لل coverslips اثنين. تأكد يوليها العازلة لكلا coverslips. تناوب بلطف ويهز الغرفة للسماح المخزن المؤقت لمس طرفي الغرفة.
- حقن بعناية الزيوت المعدنية إلى جانبي الغرفة المرافقة المنطقة العازلة التجريبية بذلك ختم عازلة من الهواء الطلق. حقن تعليق من الخرز التحقيق (على سبيل المثال، والخرز PMHC المغلفة)، كرات الدم الحمراء والأهداف(على سبيل المثال، خلايا تي) في المناطق العليا والوسطى والدنيا من المنطقة العازلة على التوالي.
6. BFP التجربة
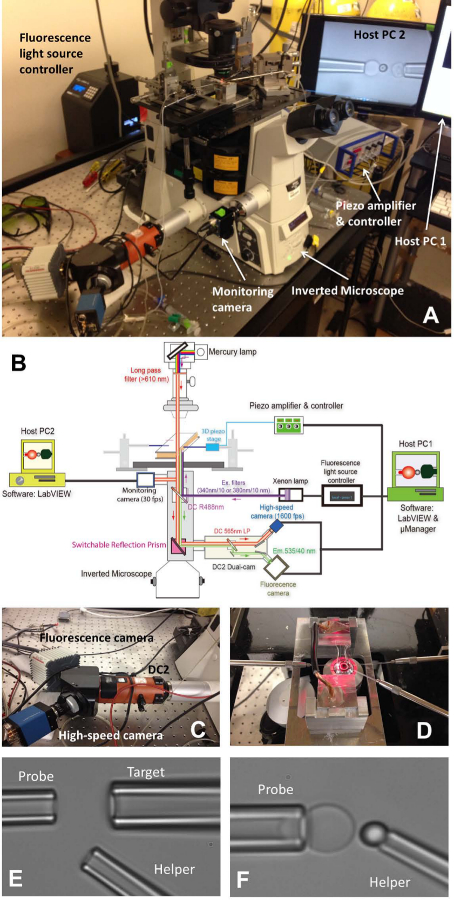
الشكل 1: fBFP التجمع (أ) الصورة نظرة عامة على نظام الأجهزة fBFP. (ب) الرسم التخطيطي للنظام الأجهزة fBFP. (C) ونظام ثنائي كام "DC2" (البرتقالي) على الذي الكاميرا عالية السرعة (الأزرق) وكاميرا مضان (أبيض) تم تركيبه. (D) المرحلة المجهر أن تتكيف مع دائرة التجربة وثلاثة أنظمة التلاعب micropipette. الميكروسكوب لتحديد BFP في غرفة التجريبية (E و F). (E) بال micropipettes تظهر التجمع ماصة التحقيق (يسار)، ماصة الهدف (أعلى اليمين) والمساعد ماصة (أقل صآيت). (F) مسبار حبة التنسيب. تم التلاعب A حبة التحقيق من قبل ماصة مساعد وتعلق على قمة RBC لتشكيل قوة التحقيق. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
- تشغيل المجهر (الجدول 1) ومصدر الضوء. ضع دائرة على خشبة المسرح المجهر الرئيسية (الشكل 1A، D).
- تثبيت كافة بال micropipettes ثلاثة من حزب الحرية (1D الشكل اليسار: التحقيق، للاستيلاء على RBC، والحق: الهدف، للاستيلاء على خلية أو حبة، وانخفاض الحق: المساعد، للاستيلاء على حبة).
- استخدام حاقن الصغرى (الجدول 1) إلى الردم وmicropipette مع العازلة التجريبية. خلع حامل ماصة (الجدول 1) والاحتفاظ بها في مكان أدنى للسماح الماء يقطر من غيض. إدراج بسرعة micropipette في طرف حامل والتأكد من عدم وجود فقاعة الهواء يحصل في micropipetteخلال الإدراج. تشديد حامل المسمار.
- تحميل كل حامل ماصة على المناظر له الصغرى مناور. دفع micropipette نحو الغرفة بحيث النصائح دخول المنطقة العازلة الغرفة. ضبط الموقف من micropipette والعثور عليها تحت المجهر مجال الرؤية.
- التحرك مرحلة حامل غرفة للعثور على المستعمرات من ثلاثة عناصر (كرات الدم الحمراء، والأهداف والخرز التحقيق) واحدة تلو الأخرى. ضبط الموقف من micropipette المقابلة عن طريق تحويل المقابض من المتلاعبين السماح غيض من نهج micropipette خلية واحدة / حبة. نضح الخلية / حبة عن طريق ضبط الضغط داخل micropipette المقابلة. وعن بال micropipettes ثلاثة التقاط العناصر المقابلة لها.
- التحرك مرحلة حامل الغرفة لإيجاد مساحة مفتوحة بعيدا عن مستعمرات العناصر حقن حيث سيتم تنفيذ التجربة. تبديل وضع البصرية المجهر لتصور الصورة على شركاتبرنامج uter على شاشة الكمبيوتر. نقل كافة العناصر الثلاثة على نصائح ماصة في حقل الرؤية للبرنامج.
- محاذاة حبة التحقيق وRBC، والمناورة بعناية حبة التحقيق الى ذروة RBC، تؤثر لفترة وجيزة حبة على RBC وبلطف التراجع. ضبط الضغط من micropipette المساعد لتفجير بلطف حبة بعيدا، بحيث سوف تترك لصقها على RBC قمة (الشكل 1F). الابتعاد عن micropipette مساعد وتوحيد الهدف والتحقيق حبة (الشكل 2A).
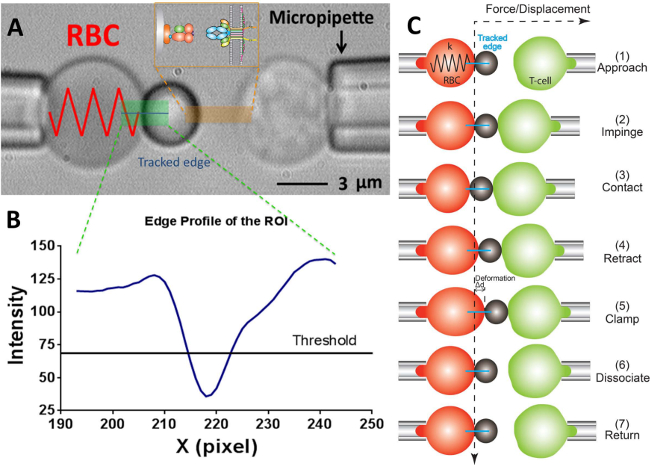
ويتكون نظام حزب الحرية ودورة تجربتها (A) الفيديو صورة مجهرية تصور تحقيق قوة (يسار) وهدف T-الخلية (يمين) يستنشق من قبل المعنيين pipettes.The التحقيق قوة ثابتة لهم من RBC تورم والمرفقة: الرقم 2. حبة الحاملة يجند. وتحمل مستقبلاتهي التي شنت T-الخلية (الهدف) إلى piezotranslator الانحياز مقابل التحقيق. يشار إلى ROI باللون الأخضر. يشار إلى تعقب حافة في الخط الأزرق. إدراج يصور يجند (PMHC، جنبا حبة) ومستقبلات (TCR، جنبا T-الخلية) الزوج على اثنين من السطوح معارضة في منطقة تتميز باللون البرتقالي. (B) وملف كثافة من حافة حبة في (A). يتم رسم المنطقة ROI في x -direction كما س -axis (في عدد بكسل) وشدة الضوء (في قيمة مقياس الرمادية) التي تراوحت بحسب binning 30 بكسل على طول -direction ذ. (C) وانحراف لRBC وموقف حبة والهدف (T-الخلية) في دورة اختبار القوة المشبك الفحص. الخطوط المتقطعة الرأسي والأفقي تشير إلى موقف صفر قوة للقمة RBC وبالطبع الوقت، على التوالي. يظهر تعقب خط حافة تشوه RBC باللون الأزرق في كل لوحة. واعتمدت نفس الخطوات بعد أقل في وتيرة التصاقفحص (التي تفتقر إلى خطوات "المشبك" و "فصل") والحرارية تقلب فحص (التي تفتقر إلى خطوة "فصل").
- على البرنامج، في إطار مجال الرؤية استخدام الأدوات في برنامج لقياس نصف قطر كل منها من micropipette التحقيق (R ع)، وRBC (R 0)، منطقة الاتصال دائرية بين RBC والتحقيق حبة (R ج) ، والذي يسمح تقدير ثابت ربيع RBC (ك) من خلال المعادلة التالية 17،30،
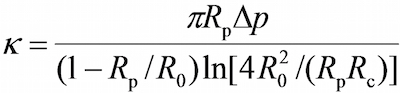
حيث Δ ص هو الضغط الطموح في تحقيق ماصة.
ملاحظة: ويلي من قانون هوك أن القوة الملزمة، F، يمكن كميا من قبل المنتج من ثابت الربيع وتشريد حبة مسبار (د)، أي F = د (الشكل 2C). - أدخل المطلوب RBC الربيع ثابت في برنامج (يرجى الرجوع إلى بروتوكول القسم 6.6. عادة ما يتم تعيين ثابت الربيع عند 0.25 أو 0.3 السندات الإذنية / نانومتر لفحص قوة المشبك والتصاق تردد فحص و 0.1 السندات الإذنية / نانومتر لتذبذب الفحص الحراري) ، الذي سيعود ضغط الطموح المطلوبة في وحدة سنتيمتر من الماء. ضبط ارتفاع خزان المياه التي تربط ماصة لجنة التحقيق حتى يتم الوصول إلى ضغط الشفط المطلوبة.
- رسم خط أفقي عبر قمة RBC، والتي سوف تسفر عن المنحنى في النافذة المجاورة مما يدل على سطوع (قيمة مقياس الرمادية) لكل بكسل على طول هذا الخط. اسحب خط العتبة لتكون على ما يقرب من نصف عمق منحنى (الشكل 2A، B).
ملاحظة: النقطة الدنيا على منحنى سطوع تحت خط عتبة يشير إلى موضع الحدود حبة، مما يسمح الحد الأدنى محلي واحد فقط. إذا كان اثنان أو أكثر الدنيا المحلية في الوقت الحاضر، فإنهيشير إلى صورة ليست المثلى (على الأرجح بسبب الصورة كونها من التركيز، أو محاذاة الفقيرة بين حبة التحقيق وRBC). - تحديد وضع التجربة المطلوب: الحرارية تقلب الفحص، التصاق تردد فحص أو قوة المشبك الفحص. تعيين المعلمات النحو المرغوب فيه (على سبيل المثال، قوة الإصطدام = 15 السندات الإذنية، تحميل معدل = 1000 السندات الإذنية / ثانية، وقت الاتصال = 1 ثانية، وتحامل القوة = 20 السندات الإذنية (للقوة المشبك فحص)، وما إلى ذلك).
- انقر على زر "ابدأ"، والذي يسمح البرنامج لنقل ماصة الهدف ودفع الهدف والخروج من الاتصال مع لجنة التحقيق (انظر القسم ممثل النتائج للحصول على التفاصيل). سيتم تنفيذ جمع البيانات في موازاة ذلك، الذي يسجل موقف حبة التحقيق في الوقت الحقيقي. توقف البرنامج عن طريق النقر على زر "إيقاف التجربة"، في الوقت الذي نافذة سوف تخرج للسماح إنقاذ البيانات التي حصل عليها.
7. الإسفار BFP (fBFP) التجربة
- استخدام fluoreوظيفة مسرح الحادث لنظام حزب الحرية، بدوره على مصدر ضوء الإثارة (الجدول 1) والكاميرا مضان (الجدول 1)، والتي يتم التحكم فيها بواسطة برنامج منفصل (الجدول 1). على البرنامج، واختيار المعلمات للتصوير مضان، بما في ذلك تحقيق مكاسب، والتعرض، وقنوات الإثارة (في هذه الحالة، 340 نانومتر و 380 نانومتر الخفيفة)، وما إلى ذلك. اتبع كافة الاستعدادات في بروتوكول التجربة BFP، بما في ذلك التوفيق بين التحقيق والهدف، الأمر الذي سيتيح لرؤية الخلية المستهدفة صورة الفلورسنت الحية ولع 340 نانومتر أو 380 نانومتر ضوء الإثارة.
- استخدام أداة باجتزاء إلى ما يقرب من قسم المساحة داخل الخلية التي ستبقى خلال فترة التسجيل بأكملها.
ملاحظة: نظرا لاستخدام دورة نهج الاتصال والتراجع، والخلية أن تتحرك إلى الأمام والخلف بشكل متكرر، وبالتالي فإن منطقة مقطوع هو أكبر بكثير من الخلية نفسها. - انقر على "سجل" للسماح ل340 نانومترد 380 ضوء نانومتر لإثارة بالتناوب مضان صبغ الخلايا (Fura2)، وزوج من الصور مضان المقابلة ستسجل بالتناوب عن مرة واحدة كل ثانية. انقر في وقت واحد على "ابدأ" في برنامج لبدء التجربة BFP للتفاعل الجزيئي التحليل والتجربة التصوير مضان لمراقبة إشارات الكالسيوم داخل الخلايا. سيقوم النظام ينتج ملف البيانات الخام لربط مستقبلات يجند (انظر الشكل أدناه 6A) وسلسلة من الصور الفلورسنت في تنسيق .tiff للإشارات الكالسيوم.
تحليل 8. البيانات
- تحليل BFP البيانات
- تحليل البيانات للتردد التصاق مقايسة
- بالتتابع تفتيش "القوة مقابل الوقت" إشارة كل دورة ومجرد تسجيل والتي تحتوي على دورات حدث التصاق والتي لم تفعل ذلك، وتلخيص لتسفر عن متوسط التردد التصاق.
- جمع قوة تمزق كل حدث التصاق، الذيهي قيمة ذروة القوة رفعت خطيا قبل تمزق السندات. بعد جمع كمية كافية من القوات تمزق في مجموعة من معدلات المنحدر، اشتقاق توزيع قوة تمزق في كل معدل المنحدر من الذي يشتق من خارج معدل مستقبلات يجند التفكك التي تعتمد على القوة باستخدام قوة ديناميكية التحليل الطيفي 18،31.
- تحليل البيانات من أجل الحراري تذبذب فحص
- بالتتابع تفقد إشارة مرحلة لقط كل دورة، والذي يحتوي على الأرجح متعددة جمعية السندات والتفكك الأحداث. استخدام المرحلة لقط مستوى التذبذب الحراري (متوسط الانحراف المعياري للفترة من 70 نقطة انزلاق الوقت متتابعة من موقف حبة) في "القوة مقابل الوقت" إشارة كدليل للتمييز بين جمعية السندات والتفكك الأحداث، لأن السندات تشكيل يتوافق مع انخفاض في التقلبات الحرارية.
- تعيين الفاصل الزمني من حظة من التفكك السندات (عندما ذرالقانون النموذجي للتحكيم تذبذب يستأنف إلى المستوى العادي) إلى لحظة تشكيل السندات القادم من الوقت والانتظار، وتعيين مدة السندات من ارتباطه إلى التفكك كما عمر السندات، وكلاهما تم جمعها خلال عملية التفتيش البيانات. حساب متوسط وقت الانتظار ومتوسط عمر السندات، والتي تعكس على التوالي مقلوب سعر الفائدة على وأن معدل بعيدة تحت الصفر قوة 16،30.
- تحليل البيانات لقوة المشبك فحص
- المعلمات بسجل لجميع الأحداث مدى الحياة بما في ذلك متوسط القوة وعمر السندات مع الرقم المتسلسل وكذلك وقت البدء ووقت النهاية، والتي سوف تسمح لأحد لرسم منحنى العمر التراكمي (على سبيل المثال، الشكل 6C، ومنحنى الصفراء).
- جمع كمية كافية من أحداث الحياة في ظل مجموعة من القوات. مجموعة منهم إلى صناديق قوة مختلفة، والتي سوف تنتج متوسط العمر في كل قوة بن، وتحقق تماما "متوسط عمر مباراة. قوة "منحنى (الشكل 4).
- تحليل البيانات للتردد التصاق مقايسة
- مضان الكالسيوم تحليل البيانات التصوير
- ضبط عتبة كثافة حتى تظهر الصور مضان كفاف واضح للخلية في كل 340 نانومتر و 380 نانومتر القنوات دون ضجيج الخلفية (الشكل 5A، B). قم بمراجعة الكالسيوم داخل الخلايا 2+ إطار إشارة من جانب الإطار مع شبه لون يدل على مستوى كثافة (الشكل 6B)، وهي مشتقة على أساس نسبة كثافة 340 نانومتر / 380 نانومتر، لتوليد "تطبيع الكالسيوم 2+ كثافة مقابل . الوقت منحنى "(الشكل 6C). استخدام الصور الزائفة اللون مضان لإنتاج الفيلم الذي يعرض ثاني مستوى مضان بثانية.
النتائج
كان رائدا في تقنية BFP من قبل المختبر ايفانز في عام 1995 (17). وقد استخدمت هذه الأداة picoforce على نطاق واسع لقياس تفاعلات البروتينات ثبتوا على السطوح، وذلك لتحليل حركية ثنائي الأبعاد للجزيئات الالتصاق التفاعل مع بروابط بهم 16،19،20، 30، لقياس مرونة الجزيئية 21،29،
Discussion
تجربة ناجحة fBFP ينطوي على بعض الاعتبارات الهامة. أولا، لحساب القوة لتكون موثوقة، وmicropipette، وRBC، وحبة التحقيق يجب أن تكون محاذاة أقرب إلى محوري وقت ممكن. يجب أن يكون الإسقاط من RBC داخل ماصة حوالي واحد قطره التحقيق ماصة بحيث الاحتكاك بين RBC وماصة لا يكاد يذكر. لRBC البشري نم?...
Disclosures
The authors have nothing to disclose.
Acknowledgements
Research related to this paper and the development of the fBFP technology in the Zhu lab were supported by NIH grants AI044902, AI077343, AI038282, HL093723, HL091020, GM096187, and TW008753. We thank Evan Evans for inventing this empowering experimental tool, and members of the Evans lab, Andrew Leung, Koji Kinoshita, Wesley Wong, and Ken Halvorsen, for helping us to build the BFP. We also thank other Zhu lab members, Fang Kong, Chenghao Ge and Kaitao Li, for their helps in the instrumentation development.
Materials
| Name | Company | Catalog Number | Comments |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4 • H2O) | Sigma-Aldrich | S9638 | Phosphate buffer preparation |
| Anhy. Sodium Phosphate Dibasic (Na2HPO4) | Sigma-Aldrich | S7907 | Phosphate buffer preparation |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation |
| Sodium chloride (NaCl) | Sigma-Aldrich | S7653 | N2-5% buffer preparation |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | N2-5% buffer preparation |
| Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P5655 | N2-5% buffer preparation |
| Sucrose | Sigma-Aldrich | S0389 | N2-5% buffer preparation |
| MAL-PEG3500-NHS | JenKem | A5002-1 | Bead functionalization |
| Biotin-PEG3500-NHS | JenKem | A5026-1 | RBC biotinylation |
| Nystatin | Sigma-Aldrich | N6261 | RBC osmolarity adjustment |
| Ammonium Hydroxide (NH4OH) | Sigma-Aldrich | A-6899 | Glass bead silanization |
| Methanol | BDH | 67-56-1 | Glass bead silanization |
| 30% Hydrogen Peroxide (H2O2) | J. T. Barker | Jan-86 | Glass bead silanization |
| Acetic Acid (Glacial) | Sigma-Aldrich | ARK2183 | Glass bead silanization |
| 3-Mercaptopropyltrimethoxysilane (MPTMS) | Uct Specialties, llc | 4420-74-0 | Glass bead functionalization |
| Borosilicate Glass beads | Distrilab Particle Technology | 9002 | Glass bead functionalization |
| Streptavidin−Maleimide | Sigma-Aldrich | S9415 | Glass bead functionalization |
| BSA | Sigma-Aldrich | A0336 | Ligand functionalizing |
| Fura2-AM | Life Technologies | F-1201 | Intracellular calcium fluorescence dye loading |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | Intracellular calcium fluorescence dye loading |
| Quantibrite PE Beads | BD Biosciences | 340495 | Density quantification |
| Flow Cytometer | BD Biosciences | BD LSR II | Density quantification |
| Capillary Tube 0.7-1.0 mm x 30 inches | Kimble Chase | 46485-1 | Micropipette making |
| Flaming/Brown Micropipette Puller | sutter instrument | P-97 | Micropipette making |
| Pipette microforce | Narishige | MF-900 | Micropipette making |
| Mineral Oil | Fisher Scientific | BP2629-1 | Chamber assembly |
| Microscope Cover Glass | Fisher Scientific | 12-544-G | Chamber assembly |
| Micro-injector | World Precision Instruments | MF34G-5 | Chamber assembly |
| 1 ml syringe | BD | 309602 | chamber assembly |
| Micropipette holder | Narishige | HI-7 | Chamber assembly |
| Home-designed mechanical parts and adaptors fabrications using CNC machining. | Biophysics Instrument | All parts are customized according to the CAD designs. | BFP system |
| Microscope (TiE inverted) | Nikon | MEA53100 | BFP system |
| Objective CFI Plan Fluor 40x (NA 0.75, WD 0.72 mm, Spg) | Nikon | MRH00401 | BFP system |
| Camera, GE680, 640 x 480, GigE, 1/3" CCD, mono | Graftek Imaging | 02-2020C | BFP system |
| Prosilica GC1290 - ICX445, 1/3", C-Mount, 1280 x 960, Mono., CCD, 12 Bit ADC | Graftek Imaging | 02-2185A | BFP system |
| Manual submicron probehead with high resolution remote control | Karl Suss | PH400 | BFP system |
| Anti-vibration table (5’ x 3’) | TMC | 77049089 | BFP system |
| 3D manual translational stage | Newport | 462-XYZ-M | |
| SolidWorks 3D CAD software | SOLIDWORKS Corp. | Version 2012 SP5 | BFP system |
| LabVIEW software | National Instruments | Version 2009 | BFP system, BFP program |
| 3D piezo translational stage | Physik Instrumente | M-105.3P | BFP system |
| Linear piezo accuator | Physik Instrumente | P-753.1CD | BFP system |
| Micromanager software | Version 1.4 | fBFP system, fluorescence imaging program | |
| Dual Cam (DC-2) | Photometrics | 77054724 | fBFP system |
| Dual Cam emission filter (T565LPXR) | Photometrics | 77054725 | fBFP system |
| Fluorescence Camera | Hamamatsu | ORCA-R2 C10600-10B | fBFP system |
| Plastic paraffin film (Parafilm) | Bemis Company, Inc | PM996 | bottle sealing |
| Carbonate/bicarbonate buffer (pH 8.5) | 8.4 g/L sodium carbonate (Na2CO3), 10.6 g/L sodium bicarbonate (NaHCO3) | ||
| Phosphate buffer (pH 6.5-6.8) | 27.6 g/L NaPhosphate monobasic (NaH2PO4 • H2O), 28.4 g/L Anhy. NaPhosphate dibasic (Na2HPO4) | ||
| N2-5% buffer (pH 7.2) | 20.77 g/L potassium chloride (KCl), 2.38 g/L sodium chloride (NaCl), 0.13 g/L potassium phosphate monobasic (KH2PO4), 0.71 g/L anhy. sodium phosphate dibasic (Na2HPO4), 9.70 g/L sucrose |
References
- Aplin, A. E., Howe, A., Alahari, S. K., Juliano, R. L. Signal transduction and signal modulation by cell adhesion receptors: the role of integrins, cadherins, immunoglobulin-cell adhesion molecules, and selectins. Pharmacological reviews. 50, 197-263 (1998).
- Davis, M. M., Bjorkman, P. J. T-cell antigen receptor genes and T-cell recognition. Nature. 334, 395-402 (1988).
- Dado, D., Sagi, M., Levenberg, S., Zemel, A. Mechanical control of stem cell differentiation. Regenerative medicine. 7, 101-116 (2012).
- Edwards, L. J., Zarnitsyna, V. I., Hood, J. D., Evavold, B. D., Zhu, C. Insights into T cell recognition of antigen: significance of two-dimensional kinetic parameters. Frontiers in immunology. 3, 86 (2012).
- Zhu, C., Jiang, N., Huang, J., Zarnitsyna, V. I., Evavold, B. D. Insights from in situ analysis of TCR-pMHC recognition: response of an interaction network. Immunological reviews. 251, 49-64 (2013).
- Huang, J., Meyer, C., Zhu, C. T. T cell antigen recognition at the cell membrane. Molecular immunology. 52, 155-164 (2012).
- Zarnitsyna, V., Zhu, C. T. T cell triggering: insights from 2D kinetics analysis of molecular interactions. Physical biology. 9, 045005 (2012).
- Binnig, G., Quate, C. F., Gerber, C. Atomic Force Microscope. Physical Review Letters. 56, 930-933 (1986).
- Marshall, B. T., et al. Direct observation of catch bonds involving cell-adhesion molecules. Nature. 423, 190-193 (2003).
- Kong, F., Garcia, A. J., Mould, A. P., Humphries, M. J., Zhu, C. Demonstration of catch bonds between an integrin and its ligand. The Journal of cell biology. 185, 1275-1284 (2009).
- Yago, T., et al. Catch bonds govern adhesion through L-selectin at threshold shear. The Journal of cell biology. 166, 913-923 (2004).
- Yago, T., et al. Platelet glycoprotein Ibalpha forms catch bonds with human WT vWF but not with type 2B von Willebrand disease vWF. The Journal of clinical investigation. 118, 3195-3207 (2008).
- Chesla, S. E., Selvaraj, P., Zhu, C. Measuring two-dimensional receptor-ligand binding kinetics by micropipette. Biophysical journal. 75, 1553-1572 (1998).
- Huang, J., et al. The kinetics of two-dimensional TCR and pMHC interactions determine T-cell responsiveness. Nature. 464, 932-936 (2010).
- Heinrich, V., Wong, W. P., Halvorsen, K., Evans, E. Imaging biomolecular interactions by fast three-dimensional tracking of laser-confined carrier particles. Langmuir : the ACS journal of surfaces and colloids. 24, 1194-1203 (2008).
- Chen, W., Evans, E. A., McEver, R. P., Zhu, C. Monitoring receptor-ligand interactions between surfaces by thermal fluctuations. Biophysical journal. 94, 694-701 (2008).
- Evans, E., Ritchie, K., Merkel, R. Sensitive force technique to probe molecular adhesion and structural linkages at biological interfaces. Biophysical. 68, 2580-2587 (1995).
- Evans, E., Leung, A., Heinrich, V., Zhu, C. Mechanical switching and coupling between two dissociation pathways in a P-selectin adhesion bond. Proceedings of the National Academy of Sciences of the United States of America. 101, 11281-11286 (2004).
- Ju, L., Dong, J. -. f., Cruz, M. A., Zhu, C. The N-terminal Flanking Region of the A1 Domain Regulates the Force-dependent Binding of von Willebrand Factor to Platelet Glycoprotein Ib. Journal of Biological Chemistry. 288, (2013).
- Chen, W., Lou, J., Zhu, C. Forcing switch from short- to intermediate- and long-lived states of the alphaA domain generates LFA-1/ICAM-1 catch bonds. The Journal of biological chemistry. 285, 35967-35978 (2010).
- Chen, W., Lou, J., Evans, E. A., Zhu, C. Observing force-regulated conformational changes and ligand dissociation from a single integrin on cells. The Journal of cell biology. 199, 497-512 (2012).
- Judokusumo, E., Tabdanov, E., Kumari, S., Dustin, M. L., Kam, L. C. Mechanosensing in T lymphocyte activation. Biophysical journal. 102, L5-L7 (2012).
- Bashour, K. T., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences of the United States of America. 111, 2241-2246 (2014).
- Nesbitt, W. S., et al. Distinct glycoprotein Ib/V/IX and integrin alpha IIbbeta 3-dependent calcium signals cooperatively regulate platelet adhesion under flow. The Journal of biological chemistry. 277, 2965-2972 (2002).
- Mazzucato, M., Pradella, P., Cozzi, M. R., De Marco, L., Ruggeri, Z. M. Sequential cytoplasmic calcium signals in a 2-stage platelet activation process induced by the glycoprotein Ibalpha mechanoreceptor. Blood. 100, 2793-2800 (2002).
- Lefort, C. T., Ley, K. Neutrophil arrest by LFA-1 activation. Frontiers in immunology. 3, 157 (2012).
- Liu, B., Chen, W., Evavold, B. D., Zhu, C. Accumulation of dynamic catch bonds between TCR and agonist peptide-MHC triggers T cell signaling. Cell. 157, 357-368 (2014).
- Lou, J., et al. Flow-enhanced adhesion regulated by a selectin interdomain hinge. The Journal of cell biology. 174, 1107-1117 (2006).
- Fiore, V. F., Ju, L., Chen, Y., Zhu, C., Barker, T. H. Dynamic catch of a Thy-1-alpha5beta1+syndecan-4 trimolecular complex. Nature communications. 5, 4886 (2014).
- Chen, W., Zarnitsyna, V. I., Sarangapani, K. K., Huang, J., Zhu, C. Measuring Receptor-Ligand Binding Kinetics on Cell Surfaces: From Adhesion Frequency to Thermal Fluctuation Methods. Cellular and molecular bioengineering. 1, 276-288 (2008).
- Marshall, B. T., Sarangapani, K. K., Lou, J., McEver, R. P., Zhu, C. Force history dependence of receptor-ligand dissociation. Biophysical. 88, 1458-1466 (2005).
- Xiang, X., et al. Structural basis and kinetics of force-induced conformational changes of an alphaA domain-containing integrin. PloS one. 6, e27946 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved