Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Флуоресценции зонда биомембрана Сила: Параллельное Количественное рецептор-лиганд кинетики и привязка вызванной внутриклеточной сигнализации на одну ячейку
* Эти авторы внесли равный вклад
В этой статье
Резюме
We describe a technique for concurrently measuring force-regulated single receptor-ligand binding kinetics and real-time imaging of calcium signaling in a single T lymphocyte.
Аннотация
Рецептор-лиганд Мембранные опосредуют многие клеточные функции. Переплет кинетика и вниз по течению сигнализации вызвано этих молекулярных взаимодействий, вероятно, зависит от механической среды, в которой обязательными и сигнализации состоится. Недавнее исследование показало, что механическая сила может регулировать признание антигена и запуск Т-клеточного рецептора (TCR). Это стало возможным благодаря новой технологии мы разработали и называется флуоресценции зонда биомембрана силы (fBFP), который сочетает в себе одной молекулы силовой спектроскопии с флуоресцентной микроскопии. Использование ультра-мягкой эритроцит человека как чувствительный датчик силы, высокоскоростной камеры и в режиме реального времени методы отслеживания изображения, fBFP имеет ~ 1 PN (10 -12 Н), ~ 3 нм и ~ 0,5 мсек сила, пространственное и временное разрешение. С fBFP, можно точно измерить отдельные рецептор-лиганд кинетики связывания под регулирования силы и одновременно изображение связывание-срабатывает внутриклеточный калбилирубина сигнализации на одном живой клетке. Эта новая технология может быть использована для изучения другой рецептор-лиганд и мембраны сигналов в других ячейках, при механическом регулировании.
Введение
Клетка-клетка и клетка-к-внеклеточного матрикса (ЕСМ) адгезия опосредуется связыванием между рецепторами клеточной поверхности, ECM белков, и / или липидов 1. Связывание позволяет клеткам с образованием функциональных структур 1, а также признать, общаться и реагировать на окружающую среду 1-3. В отличие растворимых белков (например, цитокины и факторы роста), которые связывают с трехмерной (3D) жидкой фазы на рецепторы клеточной поверхности, адгезии клеток рецепторы образовывать связи с их лигандами через узкий зазор соединительного по преодолению две противоположные поверхности, которые ограничивают молекулярную диффузии в размерном интерфейса 4-7 двух (2D). В отличие от 3D кинетики, которые обычно измеряется с помощью традиционных анализов связывания (например, поверхностного плазмонного резонанса или SPR), 2D кинетики должны быть количественно специализированных методов, таких как атомно-силовой микроскопии (АСМ) 8-10 камеру 11,12 течь, микропипетка 13,14, оптическийпинцет 15 и биомембрана силы зонд (ДЦ) 16-21.
Больше, чем просто обеспечение физической связи для сотовых сплоченности, молекулы адгезии являются основным компонентом техники сигнализации для ячейки, чтобы общаться с его окружением. Там было все больший интерес в понимании того, как лиганд взаимодействие молекул адгезии инициирует внутриклеточную передачу сигнала и, как начальный сигнал трансдуцированных внутри клетки. Интуитивно, свойства рецептор-лиганд связывания может повлиять сигналы, которые он индуцирует. Тем не менее, трудно анализировать механистические отношения между внеклеточной взаимодействия и внутриклеточных сигнальных событий с использованием традиционного ансамбль биохимических анализов из-за своих многочисленных ограничений, например, бедной временным разрешением и полным отсутствием пространственным разрешением. Существующие методы, которые позволяют как биофизический (2D рецептор-лиганд кинетики связывания) и биохимические (сигнализации) замечания по живойклетки включают субстраты перестраиваемой жесткости 22, резина столба массивов 23 и проточная камера / микрожидкостных устройства включены с флуоресцентной способности 24-26. Тем не менее, показания сигнализации и рецептор-лиганд связывания должны быть получены отдельно (чаще различными методами), что делает его трудно анализировать временные и пространственные соотношения характеристик связь с сигнальных событий.
Обычные ДЦ является сверхчувствительного силовая спектроскопия с высоким пространственно-временным разрешением 17. Он использует гибкую эритроцит (РБК) в качестве датчика силы, что позволяет измерять одной молекулы 2D кинетики, механических свойств и конформационных изменений 14,16,19-21,27-29. На основе люминесцентных изображений ДЦ (fBFP) коррелирует рецептор-лиганд кинетики связывания с обязательной-клеточной сигнализации срабатывает при масштабе одной молекулы. С этой установкой, деятельности сигнальных Ситу клеток в в контексте поверхностных mechaniкал стимуляции наблюдалось в Т-клетках 27. FBFP является универсальным и может быть использован для изучения адгезии и клеточной сигнализации, опосредованные другими молекулами в других клетках.
протокол
Этот протокол следует рекомендациям и был одобрен комитетом по этике человека в Технологическом институте Джорджии.
1. Человек эритроциты Изоляция, Биотинилирование и Осмолярность Регулировка
Примечание: Шаг 1.1 должна быть выполнена квалифицированным медицинским профессиональной, таких как медсестра, с Наблюдательный совет утвердил протокол Институциональная.
- Получение 8-10 мкл (одну каплю) крови из прокола пальца и добавить к 1 мл карбоната / бикарбоната буфера (табл.1 и 2). Аккуратно вихрь или пипетки на смесь и центрифугируют в течение 1 мин при 900 х г. Удалите супернатант и мыть еще раз.
- В небольшой химический стакан, вес 3,5-4 мг биотина-PEG3500-NHS линкер (Таблица 1). Растворите его в карбонат / бикарбонатного буфера, чтобы сделать конечной концентрации 3 мг / мл.
- Смешайте 171 мкл карбонатного буфера / бикарбоната, 10 мкл РБК пакет и 1049 мклБиотин-PEG3500-NHS раствора линкер и инкубируют при комнатной температуре в течение 30 мин. Промыть RBC один раз карбонат / бикарбонатного буфера, а затем дважды N2-5% буфера (таблица 1 и 2).
- Между тем, поместить компоновщика бутылку с ослабленным крышкой в вакуумном эксикаторе стекла, заполненную влагопоглотителем в нижней и вакуума в течение 5 мин, и заполнить эксикаторе с аргоном. Затянуть крышку и взять бутылку из. Печать бутылку с пластиковой парафиновой пленки (таблица 1), поместите его в емкость с осушителем на дне и в магазине -20 ° C.
Примечание: шаги, которые предусматривают использование Биотин-PEG3500-NHS линкера, в том числе 1,2-1,4 (для инкубации, кроме и мыть в 1.3), должны быть выполнены как можно быстрее. - Развести нистатин в N2-5% буфера, чтобы получить конечную концентрацию 40 мкг / мл. Смешайте 5 мкл биотинилированного эритроцитов с 71,4 мкл нистатин (Таблица 1) раствор и инкубируют в течение 1 ч при 0 &# 176; С. Дважды промывали N2-5% буфера и хранят при N2-5% буфера + 0,5% BSA (таблица 1) в холодильнике (4 ° С).
2. бисер силанизация
- Очистка поверхности шарика
- Взвешивают 50 мг стеклянных шариков порошка и повторно приостанавливать их в 500 мкл деионизированной воды.
- Смешайте 0,5 мл 30% H 2 O 2 (таблица 1) с 9,5 мл дистиллированной воды в химическом стакане на 50 мл, затем добавляют 2 мл концентрированной NH 4 OH (таблица 1) и довести это решение в котел на горячей плите ,
- Добавить стеклянные шарики в кипящий раствор и продолжают варить еще 5 мин. Аккуратно водоворот раствор каждые мин.
- После кипячения, трансфер ~ 5 мл этой горячей борта суспензии в 15 мл микро-центрифуги трубы и долить дистиллированной водой РТ. Центрифуга при 3500 мкг в течение 5 мин, снимите и выбросьте супернатант.
- Перевести еще 5 мл горячей суспензии шарик и добавить к промытым бисера, Долейте дистиллированной воды, хорошо перемешать и центрифуги снова. Повторите эту процедуру до тех пор около 50 мл дистиллированной воды не используется, который будет в общей сложности от 4 до 5 раз мытья.
- Передача шарик суспензии в флаконе 1 мл. Повторите промывание шарики с метанолом (таблица 1) путем центрифугирования при 17000 х г в течение 5 мин 3 раза, и, наконец, вновь приостановить бисером в 1 мл 100% метанола.
- Бисера поверхности Тиолирование
- К 50 мл центрифужную пробирку добавляют 45,6 мл метанола, 0,4 мл уксусной кислоты (таблица 1), 1,85 мл деионизированной воды, 1,15 мл 3-меркаптопропилтриметоксисилан (MPTMS) (Таблица 1) и 1 мл суспензии, приготовленной бусин в 2,1, затем инкубируют при комнатной температуре в течение 3 ч.
- После реакции удаления всех реагентов путем однократной промывки свежим метанолом и вновь приостановить шарики в 500 мкл метанола. Равномерно разделить эту концентрированную стеклянная бусина подвеска в наборе 20 сухих и чистых стеклянных флаконах сколпачки. Выпаривают метанол при помощи струи сухого аргона и медленно вращать флаконы так, чтобы тонкий слой сухих бусин на сторонах каждого флакона.
- Поместите флаконов гранул, в предварительно нагретую сушильную печь при 120 ° С в течение 5 мин, а затем вынуть и быстро разместить крышку (ы) на свободно. Поместите флаконы в вакуумном эксикаторе стекла, заполненную влагопоглотителем в нижней части и вакуум эксикаторе с помощью вакуумного насоса до охлаждения.
- Выпустите пылесосом эксикаторе с сухим аргоном, чтобы принести эксикаторе нормального атмосферного давления. Снимите крышку эксикаторе и быстро подтянуть крышку (ы) на флаконе. Уплотнение флаконы с пластиковой пленкой парафина и хранить их при комнатной температуре в сухом боксе темно хранения.
- После немедленному использованию, принять один флакон сухих бусин и мыть один раз фосфатным буфером (таблицы 1 и 2), повторно приостанавливать в 50 мкл фосфатного буфера и хранят при температуре 4 ° С. Этот концентрированный препарат шарик будет упоминатьсякак "MPTMS бисером" в следующих шагах.
Примечание: При правильном хранении, MPTMS шарики могут оставаться функциональным до трех месяцев.
3. бисера Функционализация
- Ковалентно Покрытие Белки на шариках
- Возьмем определенный объем (например, 2,5 мкл) белка складе и смешать с равным объемом карбонат / бикарбонатного буфера, чтобы сделать раствор 1.
Примечание: Объем зависит от концентрации запасов и желаемой конечной плотности сайте белка на поверхности бусины. - В небольшой химический стакан, вес 2-3 мг MAL-PEG3500-NHS линкер (Таблица 1) и растворить его в карбонат / бикарбонатного буфера, чтобы достичь конечной концентрации 0,231 мг / мл.
- Смешайте раствор 1 с равным объемом раствора, приготовленного линкера в разделе 3.1.2. Выдержите смесь при комнатной температуре в течение 30 мин, чтобы сделать Решение 2.
- Между тем, место компоновщика бутылку с ослабленным крышкой в стеклянной вакуумной эксикаторе Fыть убитым с осушителем в нижней и вакуума в течение 5 мин, и заполнить эксикаторе с аргоном. Затянуть крышку и взять бутылку из. Печать бутылку с пластиковой парафиновой пленки, положите его в емкость с осушителем на дне и в магазине -20 ° C.
Примечание: шаги, которые предусматривают использование MAL-PEG3500-NHS линкера, в том числе 3.1.2-3.1.4 (для инкубации в 3.1.3, за исключением), должны быть выполнены как можно быстрее. - Смешайте 5 мкл из бисера MPTMS раствором 2 и добавить фосфатный буфер (таблица 1), чтобы сделать окончательный объем 250 мкл.
- Инкубируйте бусины в течение ночи при комнатной температуре, промыть 3 раза фосфатным буфером, и повторно приостанавливать в 100 мкл фосфатного буфера и хранят при температуре 4 ° С.
- Возьмем определенный объем (например, 2,5 мкл) белка складе и смешать с равным объемом карбонат / бикарбонатного буфера, чтобы сделать раствор 1.
- Подготовка белка / Бусы Стрептавидин (SA), с покрытием
- Следуйте протокол 3.1.1-3.1.4.
- Смешайте 5 мкл бусин MPTMS раствором 2 и 5 мкл 4 мг / мл стрептавидин-малеимид (SA-MAL) (Таблица 1), А затем раствор добавляют фосфатный буфер, чтобы конечный объем 250 мкл.
- Инкубируйте бусины в течение ночи при комнатной температуре, промыть 3 раза фосфатным буфером, и, наконец, вновь приостановить в 100 мкл фосфатного буфера и хранят при температуре 4 ° С.
- Покрытие Стрептавидин на стеклянных бус
- Смешайте 5 мкл бусин MPTMS 5 мкл раствора 4 мг / мл А. и добавить 140 мкл фосфатного буфера.
- Инкубируйте бусины в течение ночи при комнатной температуре, промыть 3 раза фосфатным буфером, и повторно приостанавливать в 50 мкл фосфатного буфера и хранят при температуре 4 ° С.
- Покрытие SA покрытые гранулы с белком Биотинилированный
- Смешайте 5 мкл из бисера С.А., покрытых белком (объем в зависимости от желаемой плотности покрытия) и добавить фосфатный буфер, чтобы сделать окончательный объем в 100 мкл.
- Выдержите смесь в течение ночи при 4 ° С или в течение 3 ч при комнатной температуре, промыть 3 раза фосфатным буфером, и повторно приостанавливать в 50 мкл рНosphate буфер и хранят при температуре 4 ° С.
4. Подготовка сотовый
Примечание: Для очистки клеток, следуют стандартные протоколы очистки клеток, соответствующих типу клеток в использовании, например, Т-клетки 27 или определенных клеточных линиях 21,29.
- Для fBFP экспериментов, когда получали суспензию клеток, добавить фура2-AM (таблица 1), растворенного в ДМСО в клеточной суспензии до конечной концентрации 2 мкМ, инкубировали в течение 30 мин при комнатной температуре и затем промывают один раз. Держите этот флуоресцентно загружалась клеточной суспензии в темноте до использования.
5. Подготовка к Дозаторы и сотовый палата
- Подготовка Микропипетки
- Вырезать стеклянные трубки длиной капиллярные (Таблица 1) с стеклорез в коротких кусков около 3 дюймов в длину. Гора одна часть на микропипетки съемник (таблица 1), нажмите "Pull", нот, так что средний капилляра будет нагреваться на машине и капиллярной потянется на двух концах, чтобы сделать два капилляры с острыми наконечниками (сырье) Микропипетки.
Примечание: Следуя руководство продукта, желательно морфология сырья пипетки имеет 6-8 мм конус и 0,1-0,5 мкм наконечник. - Установите сырое пипетки на держатель пипетки микропипетки горна (Таблица 1). Тепло для расплавления стеклянный шар на кузнице. Вставьте кончик сырой пипетки внутри стеклянной сферы. Охладить стеклянную сферу и тянуть сырое пипетки, чтобы разбить его снаружи и оставить его наконечник внутри сферы. Повторите эту процедуру до тех пор, пока не будет получено желаемое отверстие наконечника.
Примечание: Примеры внутренним диаметром микропипетка Совет: 2,0-2,4 мкм для РБК, ~ 1,5 мкм для бисера, ~ 2-4 мкм для Т-клетки и -7 мкм для клеток гибридомы.
- Вырезать стеклянные трубки длиной капиллярные (Таблица 1) с стеклорез в коротких кусков около 3 дюймов в длину. Гора одна часть на микропипетки съемник (таблица 1), нажмите "Pull", нот, так что средний капилляра будет нагреваться на машине и капиллярной потянется на двух концах, чтобы сделать два капилляры с острыми наконечниками (сырье) Микропипетки.
- Построение Cell палату
Примечание: ячейка камера построена на основе домашнего умае камеры держатель, который состоит из двух частей металлических квадратов (медь / алюминий) и ручкой, которая связывает их вместе (рис 1D). - Вырезать 40 мм х 22 мм х 0,2 мм покровное резаком стекла в двух 40 мм х 11 мм х 0,2 мм кусочки (покровное 1 и 2). Клей покровное 1 смазкой на верхней стороне держателя камеры в образом, что она соединяет два металлических квадратов, а так же клей покровное 2 на нижней стороне, которая образует камеру параллельно-покровное клеток (рис 1D).
- Используйте пипетку, чтобы впрыснуть 200 мкл экспериментального буфера между двумя покровные. Убедитесь, что буфер придает обоим покровные. Осторожно поверните и встряхнуть камеру, чтобы буфер коснуться обоих концов камеры.
- Осторожно ввести минеральное масло в обеих сторонах камеры фланкирующей экспериментальную буферную зону, тем самым герметизации буфер из открытом воздухе. Вводите суспензий зонда бисера (например, ПКИКЖ покрытием бисер), эритроциты и задачи(например, Т-клетки), в верхнем, среднем и нижнем районах буферной зоны соответственно.
6. ДЦ эксперимент
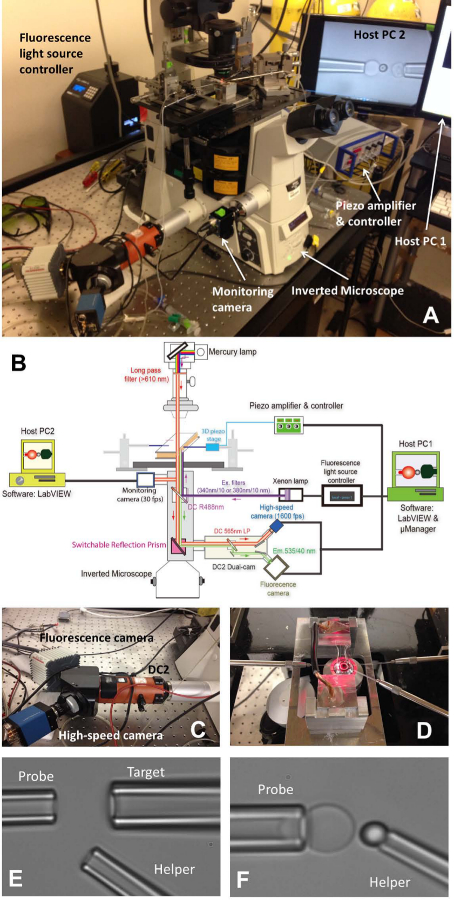
Рисунок 1: fBFP в сборе () Обзор картина аппаратной системы fBFP.. (B), схематический чертеж аппаратной системе fBFP. (С) система двойного камерой "DC2" (оранжевый), на которые высокоскоростная камера (синий) и камера флуоресценции (белый) были установлены. (D), столик микроскопа, который адаптируется эксперимент камеру и три системы микропипетка манипуляции. (Е и F) Микрофотографии обстановке ДЦ в экспериментальной камере. (Е) Дозаторы сборки, показывающий пипетки зонда (слева), целевой пипетки (вверху справа) и помощник пипетки (нижняя гIGHT). (F) Зонд размещение шарик. Зонд шарик манипулировали помощника пипетки и прикреплен к вершине РБК сформировать силы зонд. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Включите микроскоп (таблица 1) и источником света. Поместите камеру на главную столике микроскопа (фиг.1А, Б).
- Установите все три микропипетки из ДЦ (рис 1D Left:. Зонда, чтобы захватить РБК, справа: цель, чтобы захватить клетки или шарик, внизу справа: помощник, чтобы захватить шарик).
- Использование микро-инжектор (таблица 1), чтобы заделать микропипетки с экспериментальной буфера. Снимите держатель пипетки (таблица 1) и удерживайте ее в нижнем месте, чтобы вода капала от кончика. Быстро вставьте микропипетку в наконечник держателя и убедитесь, что нет пузырьков воздуха не попадает в микропипеткойво время вставки. Затянуть винт держателя.
- Установите каждый держатель пипетки на соответствующей микро-манипулятором. Нажмите микропипетку к камере так, чтобы их концы ввести буферную зону камеры. Отрегулируйте положение микропипеткой и найти их в поле зрения микроскопа.
- Перемещение по сцене держателя камеры, чтобы найти колонии трех элементов (БС, цели и зонд бусы) один за одним. Отрегулируйте положение соответствующего микропипеткой поворотом ручки из манипуляторов, чтобы кончик микропипетки подходе клеток / шарик. Аспирируйте клетки / гранулы путем регулирования давления внутри соответствующего микропипетки. Все три микропипетки будет захватить их соответствующие элементы.
- Перемещение по сцене держателя камеры, чтобы найти открытое пространство от колоний вводимых элементов, где будут выполняться эксперимент. Включите микроскоп визуальный режим для визуализации изображения на компеПрограмма Uter на экране компьютера. Переместить все элементы на три наконечники пипеток в поле зрения программы.
- Совместите шарик зонда и РБК, и тщательно маневрировать зонд борта к вершине РБК, кратко посягают шарик на РБК и аккуратно убирается. Отрегулируйте давление вспомогательного микропипеткой мягко дуть шарик далеко, так, что он будет слева приклеивается РБК вершине (рис 1F). Отойдите вспомогательный микропипетку и выровнять цель и шарик щупа (рис 2А).
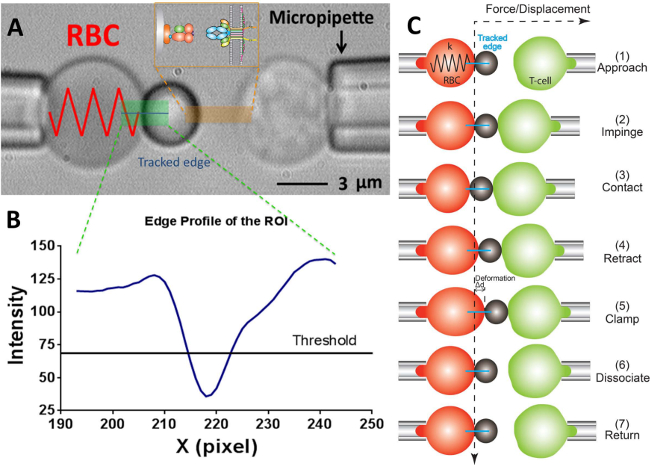
Рисунок 2:. Схема ДЦ и его цикл испытаний () Видео-микрофотография, изображающая сила зонд (слева) и целевой Т-клеток (справа) атмосферный их соответствующим pipettes.The стационарной силовой зонд состоит из опухшие РБК и прилагается лиганд-несущих шарик. Рецептор-подшипникаТ-клеток (целевой) крепится к piezotranslator выровнены напротив зонда. ROI, обозначается зеленым цветом. Край трекер указано в синей линии. Вставка изображает лиганд (ПКИКЖ, сторона шарик) и рецептор (TCR, сторона Т-клеток) пара на двух противоположных поверхностях в области отмечено оранжевым цветом. (B) профиль интенсивности на краю борта в (А). Область ROI в х -направлении графике как оси х (в количестве пикселей) и интенсивности света (в сером значения) в среднем по биннинга 30 пикселей по у -направлении. (С) Отклонение RBC и положение буртика и целевой (Т-клеток) в испытательном цикле сила зажима анализа. Вертикальные и горизонтальные пунктирные линии показывают положение нулевой силы на вершине RBC и время хода, соответственно. Линия края трекер деформации РБК показаны синим цветом в каждой панели. Те же пока меньше шаги будут приняты в частоте адгезиианализ (которой не хватает шаги "зажима" и "диссоциации") и термофлуктуационного анализа (который отсутствует шаг "отмежеваться").
- О программе, в окне поля зрения использовать инструменты программы для измерения соответствующего радиусы микропипеткой зонда (R P), РБК (R 0), круговая зона контакта между РБК и зонд борта (R C) , который позволяет оценить жесткости пружины в RBC (к) с помощью следующего уравнения 17,30,
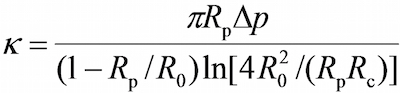
где Δ р давление на стремление зонд пипетки.
Примечание: Как следует из закона Гука, что сила связи, F, может быть определена количественно с помощью продукта жесткости пружины и перемещения шарика зонда (г), т.е. F = г (Рис 2С). - Введите желаемое РБК жесткости пружины в программу (Пожалуйста, обратитесь к протоколу разделе 6.6. Постоянная пружины обычно устанавливается на уровне 0,25 или 0,3 PN / нм для силы зажима анализа и адгезии частоты анализа и 0,1 PN / нм для флуктуаций тепловой анализа) , который будет возвращать требуемое давление аспирации в блоке сантиметр воды. Отрегулируйте высоту емкости для воды, который связан с пипеткой зонда до необходимости аспирационных давление не достигнуто.
- Нарисуйте горизонтальную линию через вершину РБК, который даст кривую в соседнем окне с указанием яркости (серый значения) каждого пикселя вдоль этой линии. Drag пороговую линию, чтобы быть в пределах половины глубины кривой (Фигура 2А, В).
Примечание: минимальная точка на кривой яркости ниже пороговой линией указывает положение борта границы, таким образом, только один локальный минимум разрешено. Если два или более локальных минимумов в настоящее время, этоуказывает образ не является оптимальным (вероятно, из-за изображения вне фокуса, или плохой согласованности между бортом зонда и РБК). - Выберите нужный режим эксперимента: тепловая флуктуация анализа, адгезия частоты анализа или сила зажима анализа. Установите параметры, как требуется (например, покушение сила = 15 PN, скорость загрузки = 1000 PN / с, время контакта = 1 сек, усилие зажима = 20 PN (для силы зажима анализа), и т.д.).
- Нажмите кнопку "Пуск", которая позволяет программу для перемещения целевой пипетки и управлять цель в и из контакта с зондом (см репрезентативные результаты раздел для деталей). Сбор данных будет выполняться параллельно, которая фиксирует положение борта зонда в режиме реального времени. Остановите программу, нажав на кнопку "Стоп", эксперимента, в котором время появится окно, чтобы позволить сохранение полученных данных.
7. флуоресценции ДЦ (fBFP) эксперимент
- Для использования fluoreScence функция системы BFP, включить источник света возбуждения (таблица 1) и камеры флуоресценции (таблица 1), которые управляются с помощью отдельной программы (таблица 1). О программе, выберите параметры для флуоресцентной визуализации, в том числе усиления, экспозиции, каналов возбуждения (в данном случае, 340 нм и 380 нм) света, и др. Соблюдайте все препараты в протоколе эксперимента ДЦ, в том числе приведение зонда и цель, которая позволит для визуализации живой флуоресцентного изображения клетки-мишени при возбуждении 340 нм или 380 нм возбуждающего света.
- Используйте инструмент секционирования примерно до раздела область, в которой ячейка будет оставаться в течение всего периода записи.
Примечание: В связи с использованием цикла подход контакт-отвода, клетка будет двигаться вперед и назад повторно, тем самым срезы площадь намного больше, чем самой клетке. - Нажмите на кнопку "Record", чтобы позволить 340 нм апd 380 нм свет поочередно возбуждают внутриклеточный флуоресценции красителя (фура2), и пару соответствующих флуоресцентные изображения будут поочередно записываются примерно раз в секунду. Одновременно нажмите на кнопку "Пуск" в программе, чтобы начать эксперимент BFP для анализа молекулярного взаимодействия и эксперимента флуоресцентной томографии для контроля внутриклеточной сигнализации кальция. Система будет производить сырье файл данных для рецептор-лиганд связывания (рис 6A ниже) и ряд люминесцентных изображений в формате .tiff для сигналов кальция.
Анализ 8. Данные
- Анализ данных ДЦ
- Анализ данных для частотного анализа адгезии
- Последовательно проверить "силы от времени" сигнал каждого цикла и просто записывать какие циклы содержат событие адгезии, а какие нет, и суммировать с получением среднюю частоту адгезии.
- Соберите разрыв силу каждого события адгезии, которыеэто пиковое значение линейно наклонной силу до разрыва связи. После сбора достаточного количества разрывных сил в диапазоне скорости изменения, получают распределение разрыв усилие на каждой скорости нагрева, из которых сила-зависит от скорости-рецептор-лиганд диссоциации производится с использованием динамической силы Спектроскопическими 18,31.
- Анализ данных для анализа термофлуктуационного
- Последовательно проверьте зажимной фазы сигнала каждого цикла, что, вероятно, содержит несколько ассоциативных связей и диссоциации события. Используйте зажим фазы уровень тепловой флуктуации (средний стандартное отклонение скользящего интервала 70 последовательных временных точках в положении шарик) в силу "от времени" сигнала в качестве руководства, чтобы отличить Ассоциации облигаций и диссоциации события, так как облигации Образование соответствует уменьшению тепловой флуктуации.
- Назначить интервал от момента диссоциации связи (при термомал колебания возобновляет до нормального уровня) до момента следующего формирования облигаций как время ожидания, и назначить продолжительность облигации от своего объединения к диссоциации в жизни облигаций, которые оба, собранной в ходе инспекции данных. Рассчитайте среднее время ожидания и среднее время жизни облигаций, которые, соответственно, отражают обратную по-ставки и, что в выключенном ставки по нулевой силы 16,30.
- Анализ данных для анализа силы зажима
- Параметры записи всех событий, включая пожизненных средней силы и жизни облигаций с порядковым номером, а также время начала и время окончания, которые позволят один нарисовать кумулятивной кривой пожизненную (например, 6С, желтая кривая).
- Соберите достаточное количество пожизненных событий в диапазоне сил. Группа их в различных бункеров сила, которая будет производить среднюю продолжительность жизни в каждом силовом корзину, и вообще дают «средний срок службы против, сила "кривая (Рисунок 4).
- Анализ данных для частотного анализа адгезии
- Флуоресценции кальция Анализ изображений данных
- Регулировка пороговой интенсивности, пока флуоресцентные изображения не показывают четкого контура клетки в обоих 340 нм и 380 нм каналах без фонового шума (5А, В). Затем рассмотреть внутриклеточного Ca 2+ сигнала кадр за кадром с псевдо-цвета, указывающего уровень интенсивности (фиг.6В), который выводится на основании отношения интенсивностей 340 нм / 380 нм, чтобы генерировать "нормированной интенсивности Са 2+ против . "кривая времени (6С). Используйте псевдо-цвет флуоресцентные изображения для получения фильм, который показывает уровень флюоресценции секундой.
Результаты
Методика BFP был впервые лаборатории Evans в 1995 17. Этот инструмент picoforce широко используются для измерения взаимодействия белков, иммобилизованных на поверхности, таким образом, чтобы проанализировать двумерные кинетики молекул адгезии, взаимодействуя с их лигандами 16,19,20, 30, д...
Обсуждение
Успешный эксперимент fBFP влечет за собой несколько важных соображений. Во-первых, для расчета силы, чтобы быть надежным, микропипетка, РБК, и зонд шарик должен быть выровнен как можно ближе к коаксиальному как это возможно. Проекция RBC внутри пипетки должны быть примерно одного диаметра ?...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Research related to this paper and the development of the fBFP technology in the Zhu lab were supported by NIH grants AI044902, AI077343, AI038282, HL093723, HL091020, GM096187, and TW008753. We thank Evan Evans for inventing this empowering experimental tool, and members of the Evans lab, Andrew Leung, Koji Kinoshita, Wesley Wong, and Ken Halvorsen, for helping us to build the BFP. We also thank other Zhu lab members, Fang Kong, Chenghao Ge and Kaitao Li, for their helps in the instrumentation development.
Материалы
| Name | Company | Catalog Number | Comments |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4 • H2O) | Sigma-Aldrich | S9638 | Phosphate buffer preparation |
| Anhy. Sodium Phosphate Dibasic (Na2HPO4) | Sigma-Aldrich | S7907 | Phosphate buffer preparation |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation |
| Sodium chloride (NaCl) | Sigma-Aldrich | S7653 | N2-5% buffer preparation |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | N2-5% buffer preparation |
| Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P5655 | N2-5% buffer preparation |
| Sucrose | Sigma-Aldrich | S0389 | N2-5% buffer preparation |
| MAL-PEG3500-NHS | JenKem | A5002-1 | Bead functionalization |
| Biotin-PEG3500-NHS | JenKem | A5026-1 | RBC biotinylation |
| Nystatin | Sigma-Aldrich | N6261 | RBC osmolarity adjustment |
| Ammonium Hydroxide (NH4OH) | Sigma-Aldrich | A-6899 | Glass bead silanization |
| Methanol | BDH | 67-56-1 | Glass bead silanization |
| 30% Hydrogen Peroxide (H2O2) | J. T. Barker | Jan-86 | Glass bead silanization |
| Acetic Acid (Glacial) | Sigma-Aldrich | ARK2183 | Glass bead silanization |
| 3-Mercaptopropyltrimethoxysilane (MPTMS) | Uct Specialties, llc | 4420-74-0 | Glass bead functionalization |
| Borosilicate Glass beads | Distrilab Particle Technology | 9002 | Glass bead functionalization |
| Streptavidin−Maleimide | Sigma-Aldrich | S9415 | Glass bead functionalization |
| BSA | Sigma-Aldrich | A0336 | Ligand functionalizing |
| Fura2-AM | Life Technologies | F-1201 | Intracellular calcium fluorescence dye loading |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | Intracellular calcium fluorescence dye loading |
| Quantibrite PE Beads | BD Biosciences | 340495 | Density quantification |
| Flow Cytometer | BD Biosciences | BD LSR II | Density quantification |
| Capillary Tube 0.7-1.0 mm x 30 inches | Kimble Chase | 46485-1 | Micropipette making |
| Flaming/Brown Micropipette Puller | sutter instrument | P-97 | Micropipette making |
| Pipette microforce | Narishige | MF-900 | Micropipette making |
| Mineral Oil | Fisher Scientific | BP2629-1 | Chamber assembly |
| Microscope Cover Glass | Fisher Scientific | 12-544-G | Chamber assembly |
| Micro-injector | World Precision Instruments | MF34G-5 | Chamber assembly |
| 1 ml syringe | BD | 309602 | chamber assembly |
| Micropipette holder | Narishige | HI-7 | Chamber assembly |
| Home-designed mechanical parts and adaptors fabrications using CNC machining. | Biophysics Instrument | All parts are customized according to the CAD designs. | BFP system |
| Microscope (TiE inverted) | Nikon | MEA53100 | BFP system |
| Objective CFI Plan Fluor 40x (NA 0.75, WD 0.72 mm, Spg) | Nikon | MRH00401 | BFP system |
| Camera, GE680, 640 x 480, GigE, 1/3" CCD, mono | Graftek Imaging | 02-2020C | BFP system |
| Prosilica GC1290 - ICX445, 1/3", C-Mount, 1280 x 960, Mono., CCD, 12 Bit ADC | Graftek Imaging | 02-2185A | BFP system |
| Manual submicron probehead with high resolution remote control | Karl Suss | PH400 | BFP system |
| Anti-vibration table (5’ x 3’) | TMC | 77049089 | BFP system |
| 3D manual translational stage | Newport | 462-XYZ-M | |
| SolidWorks 3D CAD software | SOLIDWORKS Corp. | Version 2012 SP5 | BFP system |
| LabVIEW software | National Instruments | Version 2009 | BFP system, BFP program |
| 3D piezo translational stage | Physik Instrumente | M-105.3P | BFP system |
| Linear piezo accuator | Physik Instrumente | P-753.1CD | BFP system |
| Micromanager software | Version 1.4 | fBFP system, fluorescence imaging program | |
| Dual Cam (DC-2) | Photometrics | 77054724 | fBFP system |
| Dual Cam emission filter (T565LPXR) | Photometrics | 77054725 | fBFP system |
| Fluorescence Camera | Hamamatsu | ORCA-R2 C10600-10B | fBFP system |
| Plastic paraffin film (Parafilm) | Bemis Company, Inc | PM996 | bottle sealing |
| Carbonate/bicarbonate buffer (pH 8.5) | 8.4 g/L sodium carbonate (Na2CO3), 10.6 g/L sodium bicarbonate (NaHCO3) | ||
| Phosphate buffer (pH 6.5-6.8) | 27.6 g/L NaPhosphate monobasic (NaH2PO4 • H2O), 28.4 g/L Anhy. NaPhosphate dibasic (Na2HPO4) | ||
| N2-5% buffer (pH 7.2) | 20.77 g/L potassium chloride (KCl), 2.38 g/L sodium chloride (NaCl), 0.13 g/L potassium phosphate monobasic (KH2PO4), 0.71 g/L anhy. sodium phosphate dibasic (Na2HPO4), 9.70 g/L sucrose |
Ссылки
- Aplin, A. E., Howe, A., Alahari, S. K., Juliano, R. L. Signal transduction and signal modulation by cell adhesion receptors: the role of integrins, cadherins, immunoglobulin-cell adhesion molecules, and selectins. Pharmacological reviews. 50, 197-263 (1998).
- Davis, M. M., Bjorkman, P. J. T-cell antigen receptor genes and T-cell recognition. Nature. 334, 395-402 (1988).
- Dado, D., Sagi, M., Levenberg, S., Zemel, A. Mechanical control of stem cell differentiation. Regenerative medicine. 7, 101-116 (2012).
- Edwards, L. J., Zarnitsyna, V. I., Hood, J. D., Evavold, B. D., Zhu, C. Insights into T cell recognition of antigen: significance of two-dimensional kinetic parameters. Frontiers in immunology. 3, 86 (2012).
- Zhu, C., Jiang, N., Huang, J., Zarnitsyna, V. I., Evavold, B. D. Insights from in situ analysis of TCR-pMHC recognition: response of an interaction network. Immunological reviews. 251, 49-64 (2013).
- Huang, J., Meyer, C., Zhu, C. T. T cell antigen recognition at the cell membrane. Molecular immunology. 52, 155-164 (2012).
- Zarnitsyna, V., Zhu, C. T. T cell triggering: insights from 2D kinetics analysis of molecular interactions. Physical biology. 9, 045005 (2012).
- Binnig, G., Quate, C. F., Gerber, C. Atomic Force Microscope. Physical Review Letters. 56, 930-933 (1986).
- Marshall, B. T., et al. Direct observation of catch bonds involving cell-adhesion molecules. Nature. 423, 190-193 (2003).
- Kong, F., Garcia, A. J., Mould, A. P., Humphries, M. J., Zhu, C. Demonstration of catch bonds between an integrin and its ligand. The Journal of cell biology. 185, 1275-1284 (2009).
- Yago, T., et al. Catch bonds govern adhesion through L-selectin at threshold shear. The Journal of cell biology. 166, 913-923 (2004).
- Yago, T., et al. Platelet glycoprotein Ibalpha forms catch bonds with human WT vWF but not with type 2B von Willebrand disease vWF. The Journal of clinical investigation. 118, 3195-3207 (2008).
- Chesla, S. E., Selvaraj, P., Zhu, C. Measuring two-dimensional receptor-ligand binding kinetics by micropipette. Biophysical journal. 75, 1553-1572 (1998).
- Huang, J., et al. The kinetics of two-dimensional TCR and pMHC interactions determine T-cell responsiveness. Nature. 464, 932-936 (2010).
- Heinrich, V., Wong, W. P., Halvorsen, K., Evans, E. Imaging biomolecular interactions by fast three-dimensional tracking of laser-confined carrier particles. Langmuir : the ACS journal of surfaces and colloids. 24, 1194-1203 (2008).
- Chen, W., Evans, E. A., McEver, R. P., Zhu, C. Monitoring receptor-ligand interactions between surfaces by thermal fluctuations. Biophysical journal. 94, 694-701 (2008).
- Evans, E., Ritchie, K., Merkel, R. Sensitive force technique to probe molecular adhesion and structural linkages at biological interfaces. Biophysical. 68, 2580-2587 (1995).
- Evans, E., Leung, A., Heinrich, V., Zhu, C. Mechanical switching and coupling between two dissociation pathways in a P-selectin adhesion bond. Proceedings of the National Academy of Sciences of the United States of America. 101, 11281-11286 (2004).
- Ju, L., Dong, J. -. f., Cruz, M. A., Zhu, C. The N-terminal Flanking Region of the A1 Domain Regulates the Force-dependent Binding of von Willebrand Factor to Platelet Glycoprotein Ib. Journal of Biological Chemistry. 288, (2013).
- Chen, W., Lou, J., Zhu, C. Forcing switch from short- to intermediate- and long-lived states of the alphaA domain generates LFA-1/ICAM-1 catch bonds. The Journal of biological chemistry. 285, 35967-35978 (2010).
- Chen, W., Lou, J., Evans, E. A., Zhu, C. Observing force-regulated conformational changes and ligand dissociation from a single integrin on cells. The Journal of cell biology. 199, 497-512 (2012).
- Judokusumo, E., Tabdanov, E., Kumari, S., Dustin, M. L., Kam, L. C. Mechanosensing in T lymphocyte activation. Biophysical journal. 102, L5-L7 (2012).
- Bashour, K. T., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences of the United States of America. 111, 2241-2246 (2014).
- Nesbitt, W. S., et al. Distinct glycoprotein Ib/V/IX and integrin alpha IIbbeta 3-dependent calcium signals cooperatively regulate platelet adhesion under flow. The Journal of biological chemistry. 277, 2965-2972 (2002).
- Mazzucato, M., Pradella, P., Cozzi, M. R., De Marco, L., Ruggeri, Z. M. Sequential cytoplasmic calcium signals in a 2-stage platelet activation process induced by the glycoprotein Ibalpha mechanoreceptor. Blood. 100, 2793-2800 (2002).
- Lefort, C. T., Ley, K. Neutrophil arrest by LFA-1 activation. Frontiers in immunology. 3, 157 (2012).
- Liu, B., Chen, W., Evavold, B. D., Zhu, C. Accumulation of dynamic catch bonds between TCR and agonist peptide-MHC triggers T cell signaling. Cell. 157, 357-368 (2014).
- Lou, J., et al. Flow-enhanced adhesion regulated by a selectin interdomain hinge. The Journal of cell biology. 174, 1107-1117 (2006).
- Fiore, V. F., Ju, L., Chen, Y., Zhu, C., Barker, T. H. Dynamic catch of a Thy-1-alpha5beta1+syndecan-4 trimolecular complex. Nature communications. 5, 4886 (2014).
- Chen, W., Zarnitsyna, V. I., Sarangapani, K. K., Huang, J., Zhu, C. Measuring Receptor-Ligand Binding Kinetics on Cell Surfaces: From Adhesion Frequency to Thermal Fluctuation Methods. Cellular and molecular bioengineering. 1, 276-288 (2008).
- Marshall, B. T., Sarangapani, K. K., Lou, J., McEver, R. P., Zhu, C. Force history dependence of receptor-ligand dissociation. Biophysical. 88, 1458-1466 (2005).
- Xiang, X., et al. Structural basis and kinetics of force-induced conformational changes of an alphaA domain-containing integrin. PloS one. 6, e27946 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены