需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
生物膜荧光探针力:受体 - 配体动力学并行和定量结合诱导细胞内信号作用于单细胞
* 这些作者具有相同的贡献
摘要
We describe a technique for concurrently measuring force-regulated single receptor-ligand binding kinetics and real-time imaging of calcium signaling in a single T lymphocyte.
摘要
膜受体 - 配体相互作用介导许多细胞功能。结合动力学和由这些分子之间的相互作用引起的下游信号很可能受到机械环境中结合和信号发生。最近的一项研究表明,机械力可以调节抗原识别由与触发T细胞受体(TCR)的。这成为可能,我们开发了一种新技术,荧光地称为生物膜力探针(fBFP),它结合了单分子力谱荧光显微镜。使用超软人类红细胞作为敏感的力传感器,一个高速摄像机和实时成像跟踪技术,该fBFP是〜1 PN(10 -12 N)〜3纳米和〜0.5毫秒力,空间和时间分辨率。随着fBFP,可以精确地测量力下单调节受体 - 配体结合动力学,同时结合图像触发细胞内的CALcium信令在单个活细胞。这种新技术可以用来研究其他膜受体 - 配体相互作用和信号下机械调节的其它细胞。
引言
细胞-细胞和细胞-细胞外基质(ECM)的粘附是由细胞表面受体,细胞外基质蛋白和/或脂 质1之间的结合介导的。结合允许细胞以形成功能结构1,以及认识,沟通,并做出反应的环境1-3。不像可溶性蛋白( 例如 ,细胞因子和生长因子)从一个三维(3D),其结合流体相到细胞表面受体,细胞粘附受体形成具有跨越窄交界间隙及其配体桥接两个相对的表面,限制分子键扩散在二维(2D)接口4-7。与此相反,以三维动力学是由传统的结合分析( 例如 ,表面等离子体共振或SPR)常用的测量,2D动力学已与诸如原子力显微镜(AFM)8-10专门技术来量化,流室11,12,微管13,14,光镊子15和生物膜力探针(BFP)16-21。
以上仅仅提供物理连锁蜂窝内聚力,粘附分子是信令机械为细胞与其周围环境进行通信的主要组成部分。出现了在理解越来越大的兴趣如何粘附分子的配体接合启动细胞内信号传导,以及如何在初始信号被转导的细胞内。直观地,受体 - 配体的性质的结合可影响它诱导的信号。然而,很难使用,因为它们的许多限制, 例如 ,一个差时间分辨率和完全缺乏空间分辨率的生物化学分析的传统合奏解剖外相互作用和细胞内信号事件之间的机械关系。现有的方法,使生物物理(2D受体 - 配体结合动力学)和生化(信令)观察活细胞包括可调刚性22的荧光能力24-26掺入底物,弹性体柱阵列23和流动室/微流体装置。然而,信令和受体 - 配体结合的读数必须(通过不同的方法最多)分别求出,从而难以解剖的粘结性能与信号事件的时间和空间关系。
传统的BFP是一个超灵敏光谱力高时空分辨率17。它使用一个挠性红细胞(RBC),为力传感器,可实现单分子2D动力学,机械性能和构象变化14,16,19-21,27-29的测量。荧光成像基于BFP(fBFP)相关与结合触发的细胞信号在单分子尺度的受体 - 配体的结合动力学。采用这种设置, 原位细胞信号活动表面mechani的上下文卡尔刺激中观察到的T细胞27。该fBFP是通用的,可以用于细胞粘附和信号传导由在其他小区的其他分子介导的研究。
研究方案
该协议遵循的指导方针,并已获得由佐治亚理工学院的人类研究伦理委员会。
1.人类红细胞分离,生物素和渗透压调节
注:步骤1.1应该由受过训练的医疗专业人员如护士进行,与机构审查委员会批准的协议。
- 得到的血液8-10微升(一滴)从手指刺,并添加至1ml的碳酸盐/碳酸氢盐缓冲液( 表1和2)。轻轻涡旋或吸取的混合物离心1分钟,在900×g下。弃上清,洗一次。
- 在小烧杯称量3.5-4毫克生物素- PEG3500-NHS接头( 表1)。将其溶解在碳酸盐/碳酸氢盐缓冲液,使最终浓度为3毫克/毫升。
- 混合171微升的碳酸盐/碳酸氢盐缓冲液,10微升RBC包和1049微升生物素 - PEG3500-NHS交联剂溶液和在室温下孵育30分钟。用碳酸盐/碳酸氢盐缓冲液洗一次红细胞,然后两次用N2-5%缓冲液( 见表1和2)。
- 同时,将连接器瓶在玻璃真空干燥器填充在底部和真空5分钟干燥剂瓶盖松动,并填写氩气干燥器。拧紧瓶盖,并采取了瓶子。密封该瓶用塑料石蜡膜( 表1),将其放入一个容器中填充有在-20℃的底部,并存储干燥剂。
注意:涉及使用生物素 - PEG3500-NHS接头的步骤,包括1.2-1.4(除了保温和洗涤在1.3),需要尽可能快进行越好。 - 稀制霉菌素到N2-5%缓冲液,使40微克/毫升的最终浓度。混合5微升生物素化的红细胞与71.4微升制霉菌素( 表1)溶液孵育1小时,在0 °℃。与N2-5%缓冲和存储与N2-5%缓冲液+ 0.5%BSA中( 表1)在冰箱(4℃)洗涤两次。
2.玻璃珠硅烷化
- 珠面清洗
- 称取50毫克玻璃珠粉和500微升去离子水重新挂起他们。
- 混合0.5毫升30%的H 2 O 2( 表1)与9.5 DI水毫升,在50毫升烧杯中,然后浓NH 4 OH( 表1)的加入2 ml和将这一溶液到锅炉的热板上。
- 添加玻璃珠的沸腾溶液,继续煮沸另外的5分钟。轻轻摇动解决方案的每分钟。
- 煮沸后,转移〜5个毫升该热珠悬浮液入15ml微型离心管中并顶与室温去离子水。离心3500 XG 5分钟,捞出弃去上清液。
- 传送另外5毫升热珠悬浮液,并加入到洗过的小珠,再补足更多的去离子水,拌匀,和离心机。重复此过程直至约50毫升去离子水的情况下,这将是一个总的洗涤的4至5倍。
- 转移珠悬浮液进入1毫升的小瓶。重复洗涤用甲醇( 表1)通过离心珠在17000×g离心5分钟进行3次,最后重新悬浮在1ml的100%甲醇中的珠子。
- 珠面硫醇化
- 到50ml离心管中添加45.6毫升甲醇,0.4毫升乙酸( 表1),1.85毫升去离子水,1.15毫升的三巯基(MPTMS)( 表1)和1ml珠粒的悬浮液制备2.1,然后在室温下孵育3小时。
- 反应后,除去所有的反应物通过用新鲜甲醇洗涤一次,并重新悬浮珠子入500微升甲醇中。平均分这浓缩的玻璃珠悬挂成一组20干燥和干净的玻璃小瓶螺丝帽。蒸发掉甲醇用干燥的氩气射流,缓慢旋转小瓶,从而使一薄层干珠在每个小瓶的侧面。
- 放置的珠的小瓶进入预加热的干燥炉中在120℃下进行5分钟,然后取出,并迅速将帽(多个)松弛地上。将小瓶中的玻璃真空干燥器填充有干燥剂,在底部和用真空泵真空干燥器中,直到冷却。
- 吹扫真空干燥器用干燥氩气使干燥器正常大气压力。取下盖子干燥器并迅速重新拧紧瓶帽(S)。轴封采用塑料薄膜石蜡的小瓶,在室温下存放在干燥避光贮存箱。
- 在立即使用,采取干珠一小瓶并用磷酸盐缓冲液( 表1和2),再悬浮成50μl的磷酸盐缓冲液并储存在4℃下洗一次。该浓缩珠制剂将被称为如在下面的步骤"MPTMS珠"。
注意:使用适当的储存,MPTMS珠可以保持工作长达三个月。
3.珠功能化
- 共价蛋白质涂层珠上
- 取该蛋白质的库存的一定体积( 例如 ,2.5微升)和用碳酸盐/碳酸氢盐缓冲液等体积使溶液1混合。
注意:体积取决于原料浓度和在珠子上表面上的蛋白质的期望的最终位点密度。 - 在小烧杯称量2-3毫克MAL-PEG3500-NHS接头( 表1)中,用碳酸盐/碳酸氢盐缓冲液溶解,以达到0.231毫克/毫升的最终浓度。
- 混合溶液1与3.1.2中制备的交联剂溶液的等体积。在室温下孵育该混合物30分钟,使溶液2。
- 同时,将连接器瓶瓶盖松动在玻璃真空干燥器˚Filled在底部和真空5分钟干燥剂,并填写氩气干燥器。拧紧瓶盖,并采取了瓶子。密封该瓶用塑料石蜡膜,将其放入一个容器中填充有在-20℃的底部,并存储干燥剂。
注意:这涉及使用MAL-PEG3500-NHS连接的步骤,包括3.1.2-3.1.4(除3.1.3孵化),需尽可能快地完成。 - 混合5微升MPTMS珠溶液2,并添加磷酸盐缓冲液( 见表1),使250微升的最终体积。
- 孵育珠粒过夜在RT,洗3次,用磷酸盐缓冲液,并重新悬浮在100微升磷酸盐缓冲液并储存在4℃。
- 取该蛋白质的库存的一定体积( 例如 ,2.5微升)和用碳酸盐/碳酸氢盐缓冲液等体积使溶液1混合。
- 准备蛋白/链亲和素(SA)包被的珠子
- 按照协议3.1.1-3.1.4。
- 混合5微升MPTMS珠溶液2和5微升4毫克/毫升链霉亲和马来酰亚胺(SA-MAL)( 表1)溶液,然后添加磷酸缓冲液,使250微升的最终体积。
- 孵育珠粒过夜在RT,洗3次,用磷酸盐缓冲液,最后重新悬浮在100微升磷酸盐缓冲液并储存在4℃。
- 涂层链霉到玻璃珠
- 混合5微升MPTMS珠5微升4毫克/毫升的SA溶液,并添加140微升磷酸盐缓冲液中。
- 孵育珠粒过夜在RT,洗3次,用磷酸盐缓冲液,并重新悬浮于50微升磷酸盐缓冲液并储存在4℃。
- 涂覆的SA包被的珠子用生物素化蛋白
- 混合5微升的SA包被的珠与蛋白质(体积取决于期望的涂层密度),并添加磷酸盐缓冲液,使终体积为100微升。
- 孵育混合物过夜,在4℃或3小时,在室温洗3次,用磷酸盐缓冲液,并重新悬浮于50微升pH值osphate缓冲并存储于4℃。
4.细胞的制备
注意:为了纯化的细胞,按照对应于细胞中使用的类型的标准细胞纯化方案,例如T细胞27或某些细胞系21,29。
- 对于fBFP实验,一旦细胞悬浮液制备中,添加Fura2-AM( 表1)溶解于DMSO至细胞悬浮液,以达到2μM的终浓度温育30分钟,在RT,然后洗一次。保持这种荧光装细胞悬浮液在黑暗中,直到使用。
5.准备微量移液器和细胞室
- 准备微量移液器
- 切长毛细玻璃管( 表1)用玻璃刀成短节约3英寸长。安装一块到微量拉马( 表1),单击"拉",但吨,使得毛细管的中间将由机器加热和毛细将被拉上的两端进行两次毛细管具有尖锐尖端(原始微量)。
注意:通过遵循产品准则,原始吸管的所需形态有6-8毫米的锥度和0.1-0.5微米小费。 - 安装原始吸管到微量锻造( 表1)的吸管持有人。热量融化在伪造的玻璃球。插入玻璃球内的原始吸管尖。冷静下来的玻璃球和拉生吸管从外部打破它,离开它的尖端领域内。直到获得所需的尖端孔重复此过程。
注意:一个微量移液器尖端内径的实例:2.0-2.4微米的红细胞,〜1.5微米的珠,〜2-4微米为T细胞和-7微米为杂交瘤细胞。
- 切长毛细玻璃管( 表1)用玻璃刀成短节约3英寸长。安装一块到微量拉马( 表1),单击"拉",但吨,使得毛细管的中间将由机器加热和毛细将被拉上的两端进行两次毛细管具有尖锐尖端(原始微量)。
- 构建一个细胞室
注:电池室建起了家庭狂的基础上,Ë室支架,它由两片金属平方(铜/铝),以及它们链接起来的手柄( 图1D)。 - 切使用玻璃切割器40毫米×22毫米×0.2毫米盖玻片成两个40毫米×11毫米×0.2毫米件(盖玻片1和2)。胶盖玻片1由润滑脂腔室夹持器,它桥接两个金属平方方式的顶侧,并且类似胶盖玻片2向底侧,这将形成一平行盖玻片池室( 图1D)。
- 使用移液管注入200微升试验缓冲液在两个盖玻片之间。确保缓冲连接到两个盖玻片。轻轻旋转和摇动所述室让缓冲碰触腔室的两端。
- 仔细矿物油注入室侧翼实验缓冲区从而密封从露天缓冲器的两侧。注入的探针珠悬浮液(例如,的pMHC包被的珠子),RBC和目标在缓冲区的分别的上部,中部和下部区域(例如,T细胞)。
6. BFP实验
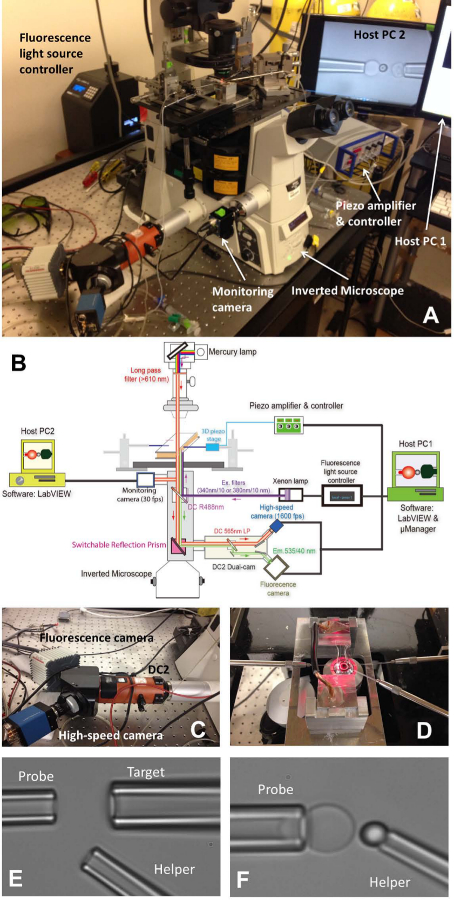
图1:fBFP总成 ( 一 )fBFP硬件系统的总览画面。 (B)中的fBFP硬件系统的示意图。 (C)在其上的高速照相机(蓝色)和一个荧光照相机(白色)被安装的双凸轮系统"DC2"(橙色)。 (D)中的显微镜载物台,能够适应一个实验室和三个微量操纵系统。 (E和F)的BFP设置在试验室中显微照片。 (E) -微量移液器组件示出探针移液器( 左 ),目标吸管( 右上 )和辅助移液器( 右下飞行)。 (F)探头放置珠。探针珠被操纵的辅助吸管,并连接到一个顶点红细胞形成的力量探头。 请点击此处查看该图的放大版本。
- 打开显微镜( 表1)和光源。放置室到主显微镜阶段( 图1A中的D)。
- 安装BFP的所有三个微量( 图1D左:探头,抢RBC,右:目标,抓住一个细胞或珠,右下:帮手,抢珠)。
- 使用微注射器( 见表1)回填与实验缓冲液中的微量。取下吸管持有人( 表1),并保持在一个较低的位置,让滴水尖。快速插入微管插入支架顶端,并确保无气泡进入微管在插入。拧紧支架螺丝。
- 每个吸管架安装到其相应的微型机器人。推微量朝向腔室,使得它们的尖端进入腔室的缓冲区域。调整微量的位置,并找到他们下视显微镜领域。
- 左右移动的腔室保持台找到的三个要素的菌落(红细胞,靶和探针珠)一个接一个。通过转动操纵器的旋钮让微量办法一个小区/珠的前端调整相应微量的位置。通过调整相应的微量内的压力吸出细胞/珠。所有这三个微量将捕获其相应的元素。
- 左右移动的腔室保持台找到一个开放的空间距离,其中该实验将执行的注射元件的菌落。切换显微镜可视化模式,以可视化图像上的补偿uter程序在电脑屏幕上。继续前行枪头所有三个元素融入到节目的视野。
- 对准探针珠和RBC,并小心地操纵探针珠红细胞的顶点,珠简要撞击到红细胞和轻轻缩回。调整辅助微量的压力轻轻吹珠远,因此,它会留下粘到红细胞顶点( 图1F)。搬开帮手微量并对准目标和探针珠( 图2A)。
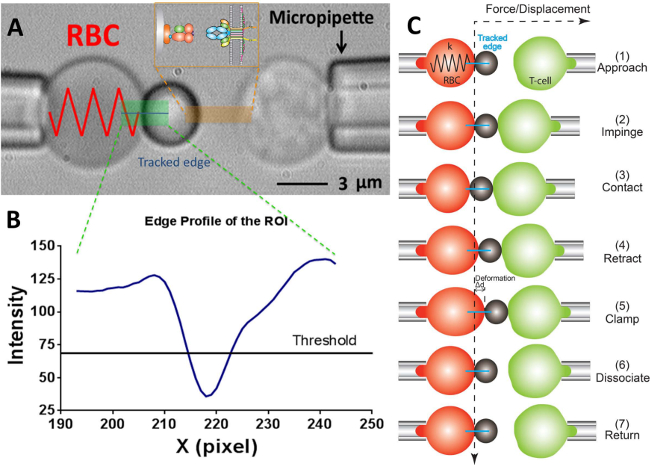
图2:BFP方案及其测试周期 (A) 的视频显微照片描绘的力探针( 左 )和靶的T细胞( 右 )由各自pipettes.The固定力探头抽吸由肿红细胞和一个附加的配体轴承珠。受体轴承T细胞(目标)被安装到对面对准到探针piezotranslator。投资回报率显示在绿色。边缘跟踪显示在一个蓝线。插入描绘了配体(的pMHC, 焊道侧 )和受体标记在橙色区域的两个相对的表面上(TCR,T细胞侧 )对。 (B)中的珠缘(A)中的强度分布。在x -方向的ROI区域被绘 制为x轴(在像素数)和光强度(灰度值)由分箱30个像素,沿y -方向平均。 (C)的红细胞的偏转和胎圈的位置,并在力钳测定的试验循环的靶(T细胞)。垂直和水平虚线指示红细胞顶点和时间过程的零力位置,分别。红细胞变形的线边缘跟踪器以蓝色显示在每个面板。粘附频率采用相同但更少的步骤试验(缺少的步骤"钳"和"分离")和热波动分析(缺少的"游离"的步骤)。
- 上节目,在视野窗口中使用工具程序来测量探针微量(R P)的半径分别为,红细胞(R 0),红细胞和探头珠(R C)之间的圆形接触面积,这使得RBC(k)的弹簧常数的估计由下式17,30,
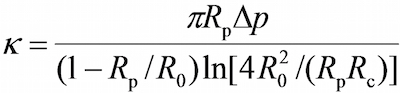
其中Δp是在探头枪头抽吸压力。
注意:它遵循从胡克定律的结合力,F可以通过弹簧常数和探针珠(四)的位移, 即,F = D的产物来定量( 图2C)。 - 输入所需的RBC弹簧常数到程序(请参见协议6.6节的弹簧常数通常设定在0.25或0.3 PN /纳米为动力钳测定和粘附频率测定和0.1 PN /纳米的热波动分析) ,这将返回在水厘米的单元所需的抽吸压力。调节水箱链接到探针的移液管,直到所需的抽吸压力达到的高度。
- 画一条横线穿过红细胞顶点,这将产生一个曲线在相邻的窗口,指示沿着这条线的每个像素的亮度(灰度值)。拖动阈值线是在曲线( 图2A,B)的大约一半的深度。
注意:下面的阈值线的亮度曲线上的最低点表示胎圈的边界的位置,因此只有一个局部最小值是允许的。如果两个或多个局部最小值是在目前,它表示图像不是最佳(可能是由于图像是离焦,或探针珠和红细胞之间的差的对准)。 - 选择所需的实验方式:热波动分析,附着力测定频率或武力钳测定。根据需要( 例如 ,冲击力= 15 PN,加载速率= 1000 PN /秒,接触时间= 1秒,锁模力= 20 PN(对于力钳测定)等)设置参数。
- 单击"开始",它允许程序移动目标吸管和推动的目标,并用探针接触(见代表结果的细节部分)。数据收集将并联,其中记录实时的探针珠的位置来执行。通过点击按钮"停止试验",此时会弹出一个窗口出来,以便保存所采集的数据停止程序。
7.荧光BFP(fBFP)实验
- 使用荧光的BFP系统刘哲民功能,打开激励光源( 表1)和荧光照相机( 表1),这是由一个独立的程序( 表1)来控制。上的程序中,选择参数的荧光成像,包括增益,曝光,激发通道(在这种情况下,340纳米和380纳米的光) 等 。按照在BFP实验协议的所有准备工作,包括对准的探针和目标,这将允许通过340纳米或380纳米的激发光激发的靶细胞活荧光图像的可视化。
- 使用切片工具大致部的区域内该单元将在整个记录期间停留。
注意:由于使用的方法接触回缩周期中,细胞将向前和向后重复,因而剖面积小于单元本身大得多。 - 点击"记录",让340纳米ð380纳米的光交替激发的细胞内荧光染料(Fura2),以及一对相应的荧光图像将被交替地记录大约每秒一次。在节目中同时单击"开始",开始BFP实验分析的分子相互作用和荧光成像实验监测细胞内钙信号。系统将产生对受体-配体结合的原始数据文件(参见下面的图6A)等一系列的荧光图像中.tiff文件格式的钙信号。
8.数据分析
- BFP数据分析
- 附着力测定频率分析数据
- 依次检查每个周期的"力量与时间"信号,并简单地记录其周期含有粘合事件,哪些没有,和总结,产生平均附着力频率。
- 收集各附着力事件的破裂力,这是线性斜坡力的债券破裂前的峰值。收集的范围内的升温速率的破裂力足够量后,求出断裂力分布在从该力依赖离速率的受体-配体的解离使用动态力光谱分析18,31导出每个斜坡率。
- 对于热波动化验数据分析
- 依次检查每个周期,这可能包含多个键结合和离解事件的夹紧相位信号。使用在夹紧阶段热波动水平(的珠位置70连续时间点的区间滑动的平均标准偏差)"力量与时间"的信号为导向,以区分债券结合和解离事件,因为债券形成对应于热起伏的降低。
- 从债券分离的瞬间指定的时间间隔(当疗法发作波动恢复到正常水平)到下一个键形成作为等待时间的瞬间,并从其关联到解离为粘合寿命,它是在数据检查期间都采集指定键的持续时间。计算的平均轮候时间及平均寿命的债券,分别反映在零力16,30对利率的偏离率的倒数和。
- 对于力钳测定数据分析
- 所有寿命事件,包括平均力和粘结寿命与序列号以及开始时间和结束时间,这将允许一个绘制终生累积曲线的记录参数(例如, 图6C中 ,黄色曲线)。
- 根据收集各种力量的寿命事件有足够量。它们分成不同的力箱,这将产生一个平均寿命在各部队仓,干脆和产生一个"平均寿命VS。力"曲线( 图4)。
- 附着力测定频率分析数据
- 钙荧光成像数据分析
- 调整强度阈值,直到荧光图像显示在两个340纳米和380纳米通道的细胞的清晰轮廓没有背景噪声( 图5A,B)。然后检查由帧用伪彩色显示的亮度水平( 图6B),这是基于为340nm / 380nm处的强度比导出的细胞内Ca 2+信号帧,以产生"归一化的Ca 2+强度VS 。时间"曲线( 图6C)。使用伪彩色荧光图像以产生一个电影,由第二显示荧光水平第二。
结果
的BFP技术是在1995年17率先由埃文斯实验室,这picoforce工具已被广泛用来测量固定化在表面上的蛋白质的相互作用,从而分析二维粘附分子动力学与它们的配体16,19,20相互作用, 30,测量分子的弹性21,29,并确定蛋白的构象变化21。对于fBFP,一组额外的与相应的软件系统( 表1)加落射荧光关联装置( 图1A - C)。
讨论
一个成功的实验fBFP限嗣继承了一些关键的考虑因素。首先,对于力计算是可靠的,微量,红细胞,和探针珠应该对齐接近同轴越好。红细胞的吸移管内的投影应约一个探针移液器直径,使得红细胞和吸管之间的摩擦是微不足道的。对于一个典型的人RBC,最优吸管直径为2.0-2.4微米,这将产生等式1 17,30的最佳拟合。第二,以确保在力钳测定及热波动分析测量大多为单键,也可以保持在20%以...
披露声明
The authors have nothing to disclose.
致谢
Research related to this paper and the development of the fBFP technology in the Zhu lab were supported by NIH grants AI044902, AI077343, AI038282, HL093723, HL091020, GM096187, and TW008753. We thank Evan Evans for inventing this empowering experimental tool, and members of the Evans lab, Andrew Leung, Koji Kinoshita, Wesley Wong, and Ken Halvorsen, for helping us to build the BFP. We also thank other Zhu lab members, Fang Kong, Chenghao Ge and Kaitao Li, for their helps in the instrumentation development.
材料
| Name | Company | Catalog Number | Comments |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4 • H2O) | Sigma-Aldrich | S9638 | Phosphate buffer preparation |
| Anhy. Sodium Phosphate Dibasic (Na2HPO4) | Sigma-Aldrich | S7907 | Phosphate buffer preparation |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation |
| Sodium chloride (NaCl) | Sigma-Aldrich | S7653 | N2-5% buffer preparation |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | N2-5% buffer preparation |
| Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P5655 | N2-5% buffer preparation |
| Sucrose | Sigma-Aldrich | S0389 | N2-5% buffer preparation |
| MAL-PEG3500-NHS | JenKem | A5002-1 | Bead functionalization |
| Biotin-PEG3500-NHS | JenKem | A5026-1 | RBC biotinylation |
| Nystatin | Sigma-Aldrich | N6261 | RBC osmolarity adjustment |
| Ammonium Hydroxide (NH4OH) | Sigma-Aldrich | A-6899 | Glass bead silanization |
| Methanol | BDH | 67-56-1 | Glass bead silanization |
| 30% Hydrogen Peroxide (H2O2) | J. T. Barker | Jan-86 | Glass bead silanization |
| Acetic Acid (Glacial) | Sigma-Aldrich | ARK2183 | Glass bead silanization |
| 3-Mercaptopropyltrimethoxysilane (MPTMS) | Uct Specialties, llc | 4420-74-0 | Glass bead functionalization |
| Borosilicate Glass beads | Distrilab Particle Technology | 9002 | Glass bead functionalization |
| Streptavidin−Maleimide | Sigma-Aldrich | S9415 | Glass bead functionalization |
| BSA | Sigma-Aldrich | A0336 | Ligand functionalizing |
| Fura2-AM | Life Technologies | F-1201 | Intracellular calcium fluorescence dye loading |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | Intracellular calcium fluorescence dye loading |
| Quantibrite PE Beads | BD Biosciences | 340495 | Density quantification |
| Flow Cytometer | BD Biosciences | BD LSR II | Density quantification |
| Capillary Tube 0.7-1.0 mm x 30 inches | Kimble Chase | 46485-1 | Micropipette making |
| Flaming/Brown Micropipette Puller | sutter instrument | P-97 | Micropipette making |
| Pipette microforce | Narishige | MF-900 | Micropipette making |
| Mineral Oil | Fisher Scientific | BP2629-1 | Chamber assembly |
| Microscope Cover Glass | Fisher Scientific | 12-544-G | Chamber assembly |
| Micro-injector | World Precision Instruments | MF34G-5 | Chamber assembly |
| 1 ml syringe | BD | 309602 | chamber assembly |
| Micropipette holder | Narishige | HI-7 | Chamber assembly |
| Home-designed mechanical parts and adaptors fabrications using CNC machining. | Biophysics Instrument | All parts are customized according to the CAD designs. | BFP system |
| Microscope (TiE inverted) | Nikon | MEA53100 | BFP system |
| Objective CFI Plan Fluor 40x (NA 0.75, WD 0.72 mm, Spg) | Nikon | MRH00401 | BFP system |
| Camera, GE680, 640 x 480, GigE, 1/3" CCD, mono | Graftek Imaging | 02-2020C | BFP system |
| Prosilica GC1290 - ICX445, 1/3", C-Mount, 1280 x 960, Mono., CCD, 12 Bit ADC | Graftek Imaging | 02-2185A | BFP system |
| Manual submicron probehead with high resolution remote control | Karl Suss | PH400 | BFP system |
| Anti-vibration table (5’ x 3’) | TMC | 77049089 | BFP system |
| 3D manual translational stage | Newport | 462-XYZ-M | |
| SolidWorks 3D CAD software | SOLIDWORKS Corp. | Version 2012 SP5 | BFP system |
| LabVIEW software | National Instruments | Version 2009 | BFP system, BFP program |
| 3D piezo translational stage | Physik Instrumente | M-105.3P | BFP system |
| Linear piezo accuator | Physik Instrumente | P-753.1CD | BFP system |
| Micromanager software | Version 1.4 | fBFP system, fluorescence imaging program | |
| Dual Cam (DC-2) | Photometrics | 77054724 | fBFP system |
| Dual Cam emission filter (T565LPXR) | Photometrics | 77054725 | fBFP system |
| Fluorescence Camera | Hamamatsu | ORCA-R2 C10600-10B | fBFP system |
| Plastic paraffin film (Parafilm) | Bemis Company, Inc | PM996 | bottle sealing |
| Carbonate/bicarbonate buffer (pH 8.5) | 8.4 g/L sodium carbonate (Na2CO3), 10.6 g/L sodium bicarbonate (NaHCO3) | ||
| Phosphate buffer (pH 6.5-6.8) | 27.6 g/L NaPhosphate monobasic (NaH2PO4 • H2O), 28.4 g/L Anhy. NaPhosphate dibasic (Na2HPO4) | ||
| N2-5% buffer (pH 7.2) | 20.77 g/L potassium chloride (KCl), 2.38 g/L sodium chloride (NaCl), 0.13 g/L potassium phosphate monobasic (KH2PO4), 0.71 g/L anhy. sodium phosphate dibasic (Na2HPO4), 9.70 g/L sucrose |
参考文献
- Aplin, A. E., Howe, A., Alahari, S. K., Juliano, R. L. Signal transduction and signal modulation by cell adhesion receptors: the role of integrins, cadherins, immunoglobulin-cell adhesion molecules, and selectins. Pharmacological reviews. 50, 197-263 (1998).
- Davis, M. M., Bjorkman, P. J. T-cell antigen receptor genes and T-cell recognition. Nature. 334, 395-402 (1988).
- Dado, D., Sagi, M., Levenberg, S., Zemel, A. Mechanical control of stem cell differentiation. Regenerative medicine. 7, 101-116 (2012).
- Edwards, L. J., Zarnitsyna, V. I., Hood, J. D., Evavold, B. D., Zhu, C. Insights into T cell recognition of antigen: significance of two-dimensional kinetic parameters. Frontiers in immunology. 3, 86 (2012).
- Zhu, C., Jiang, N., Huang, J., Zarnitsyna, V. I., Evavold, B. D. Insights from in situ analysis of TCR-pMHC recognition: response of an interaction network. Immunological reviews. 251, 49-64 (2013).
- Huang, J., Meyer, C., Zhu, C. T. T cell antigen recognition at the cell membrane. Molecular immunology. 52, 155-164 (2012).
- Zarnitsyna, V., Zhu, C. T. T cell triggering: insights from 2D kinetics analysis of molecular interactions. Physical biology. 9, 045005 (2012).
- Binnig, G., Quate, C. F., Gerber, C. Atomic Force Microscope. Physical Review Letters. 56, 930-933 (1986).
- Marshall, B. T., et al. Direct observation of catch bonds involving cell-adhesion molecules. Nature. 423, 190-193 (2003).
- Kong, F., Garcia, A. J., Mould, A. P., Humphries, M. J., Zhu, C. Demonstration of catch bonds between an integrin and its ligand. The Journal of cell biology. 185, 1275-1284 (2009).
- Yago, T., et al. Catch bonds govern adhesion through L-selectin at threshold shear. The Journal of cell biology. 166, 913-923 (2004).
- Yago, T., et al. Platelet glycoprotein Ibalpha forms catch bonds with human WT vWF but not with type 2B von Willebrand disease vWF. The Journal of clinical investigation. 118, 3195-3207 (2008).
- Chesla, S. E., Selvaraj, P., Zhu, C. Measuring two-dimensional receptor-ligand binding kinetics by micropipette. Biophysical journal. 75, 1553-1572 (1998).
- Huang, J., et al. The kinetics of two-dimensional TCR and pMHC interactions determine T-cell responsiveness. Nature. 464, 932-936 (2010).
- Heinrich, V., Wong, W. P., Halvorsen, K., Evans, E. Imaging biomolecular interactions by fast three-dimensional tracking of laser-confined carrier particles. Langmuir : the ACS journal of surfaces and colloids. 24, 1194-1203 (2008).
- Chen, W., Evans, E. A., McEver, R. P., Zhu, C. Monitoring receptor-ligand interactions between surfaces by thermal fluctuations. Biophysical journal. 94, 694-701 (2008).
- Evans, E., Ritchie, K., Merkel, R. Sensitive force technique to probe molecular adhesion and structural linkages at biological interfaces. Biophysical. 68, 2580-2587 (1995).
- Evans, E., Leung, A., Heinrich, V., Zhu, C. Mechanical switching and coupling between two dissociation pathways in a P-selectin adhesion bond. Proceedings of the National Academy of Sciences of the United States of America. 101, 11281-11286 (2004).
- Ju, L., Dong, J. -. f., Cruz, M. A., Zhu, C. The N-terminal Flanking Region of the A1 Domain Regulates the Force-dependent Binding of von Willebrand Factor to Platelet Glycoprotein Ib. Journal of Biological Chemistry. 288, (2013).
- Chen, W., Lou, J., Zhu, C. Forcing switch from short- to intermediate- and long-lived states of the alphaA domain generates LFA-1/ICAM-1 catch bonds. The Journal of biological chemistry. 285, 35967-35978 (2010).
- Chen, W., Lou, J., Evans, E. A., Zhu, C. Observing force-regulated conformational changes and ligand dissociation from a single integrin on cells. The Journal of cell biology. 199, 497-512 (2012).
- Judokusumo, E., Tabdanov, E., Kumari, S., Dustin, M. L., Kam, L. C. Mechanosensing in T lymphocyte activation. Biophysical journal. 102, L5-L7 (2012).
- Bashour, K. T., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences of the United States of America. 111, 2241-2246 (2014).
- Nesbitt, W. S., et al. Distinct glycoprotein Ib/V/IX and integrin alpha IIbbeta 3-dependent calcium signals cooperatively regulate platelet adhesion under flow. The Journal of biological chemistry. 277, 2965-2972 (2002).
- Mazzucato, M., Pradella, P., Cozzi, M. R., De Marco, L., Ruggeri, Z. M. Sequential cytoplasmic calcium signals in a 2-stage platelet activation process induced by the glycoprotein Ibalpha mechanoreceptor. Blood. 100, 2793-2800 (2002).
- Lefort, C. T., Ley, K. Neutrophil arrest by LFA-1 activation. Frontiers in immunology. 3, 157 (2012).
- Liu, B., Chen, W., Evavold, B. D., Zhu, C. Accumulation of dynamic catch bonds between TCR and agonist peptide-MHC triggers T cell signaling. Cell. 157, 357-368 (2014).
- Lou, J., et al. Flow-enhanced adhesion regulated by a selectin interdomain hinge. The Journal of cell biology. 174, 1107-1117 (2006).
- Fiore, V. F., Ju, L., Chen, Y., Zhu, C., Barker, T. H. Dynamic catch of a Thy-1-alpha5beta1+syndecan-4 trimolecular complex. Nature communications. 5, 4886 (2014).
- Chen, W., Zarnitsyna, V. I., Sarangapani, K. K., Huang, J., Zhu, C. Measuring Receptor-Ligand Binding Kinetics on Cell Surfaces: From Adhesion Frequency to Thermal Fluctuation Methods. Cellular and molecular bioengineering. 1, 276-288 (2008).
- Marshall, B. T., Sarangapani, K. K., Lou, J., McEver, R. P., Zhu, C. Force history dependence of receptor-ligand dissociation. Biophysical. 88, 1458-1466 (2005).
- Xiang, X., et al. Structural basis and kinetics of force-induced conformational changes of an alphaA domain-containing integrin. PloS one. 6, e27946 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。