Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Floresan biyomembran Kuvvet Probe: Tek Hücre üzerinde Reseptör-ligand Kinetiklerinin Eşzamanlı kantitasyonu ve Bağlama kaynaklı Hücre içi Sinyal
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
We describe a technique for concurrently measuring force-regulated single receptor-ligand binding kinetics and real-time imaging of calcium signaling in a single T lymphocyte.
Özet
Membran reseptör-ligand etkileşimleri, birçok hücresel fonksiyona aracılık eder. Bağlama kinetik ve bu moleküler etkileşimler tarafından tetiklenen aşağı sinyal muhtemelen mekanik ortamda bağlayıcı ve sinyal almak yeri etkilenir. Yeni bir çalışmada, mekanik kuvvet ile, antijen tanıma düzenleyen ve T-hücre reseptör (TCR) tetiklenmesi göstermiştir. Bu floresan mikroskobu ile tek-molekül kuvvet spektroskopisi birleştiren yeni geliştirdiğimiz teknoloji ve Vadeli floresan biyomembran kuvvet probu (fBFP), ile mümkün olmuştur. Hassas kuvvet sensörü gibi yüksek hızlı kamera ve gerçek zamanlı görüntüleme izleme teknikleri ultra yumuşak insan kırmızı kan hücresi kullanılarak, fBFP ~ 1 pN (10 -12 N), ~ 3 nm ve ~ 0.5 milisaniye içinde kuvvet, uzaysal ve zamansal çözünürlük. FBFP ile bir tam kuvvet yönetmelik kapsamında tek reseptör-ligand bağlanma kinetiği ve aynı zamanda görüntü tetiklenen bağlayıcı hücre içi cal ölçebilirsinizkalsiyum içeren tek bir canlı hücre sinyal. Bu yeni teknoloji, mekanik düzenleme altında, diğer hücrelerde diğer membran reseptörü-ligand etkileşimini ve sinyal incelemek için kullanılabilir.
Giriş
Hücre-hücre ve hücre-hücre dışı matris (ECM) yapışma, hücre yüzeyi reseptörleri, ECM proteinleri ve / veya lipidler 1 arasındaki bağlanma aracılık etmektedir. Bağlanma hücreler fonksiyonel yapıları 1 oluşturmak, hem de tanır iletişim ve çevre 1-3 tepki verir. Çözünür proteinler (örneğin, sitokinler ve büyüme faktörleri), bir üç boyutlu (3D) için bağlanan hücre yüzeyi reseptörleri üzerine sıvı faz farklı olarak, hücre yapışma reseptörlerinin moleküler sınırlamak iki karşıt yüzey arasında köprü dar bir kavşak boşluk boyunca kendi ligandları ile bağlar oluşturabilir iki boyutlu (2D) arayüzü 4-7 difüzyon. Genel olarak, geleneksel bağlanma deneyleri (örneğin, yüzey plasmon rezonans ya da SPR) ile ölçülür 3D kinetiği aksine, bölme 11,12 akış, atomik kuvvet mikroskopisi (AFM) 8-10 gibi özel teknikler ile ölçülebilir 2D kinetiği adres Mikropipet 13,14 optikcımbız 15 ve biyomembran kuvveti prob (BFP) 16-21.
Sadece hücresel uyum için fiziksel bağlantı sağlayarak daha fazla, yapışma molekülleri çevresi ile iletişim kurmak için hücre için sinyal makine önemli bir bileşenidir. Yapışma moleküllerinin ligand birleşmesi hücre içi sinyalizasyon ve nasıl ilk sinyal hücrenin içinde transdüse olduğunu başlatır nasıl anlayış giderek artan ilgi olmuştur. Sezgisel olarak, reseptör-ligand özellikleri bu indükler sinyalleri etkileyebilir bağlanması. Ancak, bunun nedeni, örneğin onların birçok sınırlamalar, yoksul bir zamansal çözünürlük ve uzaysal çözünürlüğü eksikliği tamamlamak biyokimyasal tahlillerin geleneksel topluluk kullanılarak hücre dışı etkileşim ve hücre içi sinyal olaylar arasındaki ilişkileri incelemek mekanik güçtür. Canlı hem biyofizik (kinetik bağlayıcı 2B reseptör ligand) izin yöntemleri ve biyokimyasal (sinyalizasyon) gözlem MevcutHücreler floresan özelliği 24-26 ile dahil ayarlanabilir sertlik 22 substratlar, 23 elastomer ayağı dizileri ve akış odası / mikroakışkan cihazları bulunmaktadır. Ancak, sinyalizasyon ve bağlayıcı reseptör-ligand Okunan zor sinyal olayları ile bağ özelliklerinin zamansal ve mekansal ilişkilerin incelemek için yapım (farklı yöntemler en sık) ayrı ayrı elde edilmelidir.
Konvansiyonel BFP yüksek uzaysal çözünürlüğü 17 ile ultrasensitif kuvvet spektroskopisi olduğunu. Tek moleküllü 2D kinetiği, mekanik özellikler ve yapısal değişikliklerin 14,16,19-21,27-29 ölçümünü sağlayan bir kuvvet sensörü gibi esnek bir kırmızı kan hücresi (RBC) kullanır. Bir flüoresan görüntüleme göre BFP (fBFP) tek bir molekül ölçeğinde bağlama tetiklenen hücre sinyal reseptör-ligandı bağlanma kinetiklerini ilişkilendirir. Yüzey mekanik işlemlerden bağlamında in situ hücre sinyal faaliyetlerinde Böyle bir düzenle,CAL uyarımı T-hücrelerinin 27 gözlendi. fBFP çok yönlüdür ve diğer hücrelere başka moleküller aracılık ettiği hücre yapışması ve sinyali çalışmaları için kullanılabilir.
Protokol
Bu protokol kuralları takip ve Georgia Institute of Technology insan araştırma etik komitesi tarafından onaylanmıştır.
1. İnsan eritrosit İzolasyonu, Biyotinilasyonu ve Osmolarite Ayarı
Not: Bir Kurumsal Değerlendirme Kurulu protokolü onayladı ile Adım 1.1, eğitimli tıbbi profesyonel gibi bir hemşire tarafından yapılmalıdır.
- Parmak dikmek kan 8-10 ul (bir damla) elde edilir ve karbonat / bikarbonat tamponu, 1 ml ekle (Tablo 1 ve 2). Yavaşça g girdap veya 900 x 1 dakika için karışımın ve santrifüj pipetle. Süpernatantı atın ve bir kez daha yıkayın.
- Küçük bir beher içinde Biotin-PEG3500-NHS bağlayıcı (Tablo 1) 3.5-4 mg ağırlığında. Nihai konsantrasyon, 3 mg / ml yapmak için karbonat / bikarbonat tamponu içinde çözülür.
- Karbonat / bikarbonat tamponu içinde 171 ul, RBC paketin 10 ul ve 1049 ul karıştırınBiotin-PEG3500-NHS bağlayıcı çözeltisi ve 30 dakika boyunca oda sıcaklığında inkübe edilir. Karbonat / bikarbonat tamponu ile bir kez RBC yıkayın ve daha sonra iki kez N2-5% tamponu (Tablo 1 ve 2).
- Bununla birlikte, 5 dakika boyunca alt ve vakumla kurutucu ile dolu bir cam vakum desikatörde gevşek kapaklı bağlayıcı şişe yerleştirin ve argon ile desikatörde doldurun. Kapağı sıkın ve şişeyi çıkar. Plastik parafın filmin (Tablo 1) ile bir şişe Seal, -20 ° C altındaki ve deposunda kurutucu ile dolu bir kap içine koyun.
Not: 1,2-1,4 olmak üzere Biotin-PEG3500-NHS bağlayıcı kullanımı dahil adımları (inkübasyon hariç ve 1.3 yıkama), mümkün olduğunca hızlı yapılması gerekir. - 40 ug / ml nihai konsantrasyona yapmak için N2-5% tamponuna nistatin seyreltilir. Nistatin 71.4 ul (Tablo 1) çözeltisi ile biyotinile RBC'nin 5 ul karıştırın ve 0 ° C'de 1 saat süre ile inkübe &# 176; C. Buzdolabında +% 0.5 BSA,% N2-5 tamponu (Tablo 1) (4 ° C) N2-5% tamponu ve mağaza ile iki kez yıkanır.
2. Cam Boncuk Silanizasyon
- Boncuk Yüzey Temizleme
- Cam boncuklar tozu ve 50 mg ağırlığında DI suyun 500 ul bunları yeniden askıya.
- 50 ml'lik bir beher içinde Dİ su içinde 9.5 mL 0.5 ml% 30 H2O 2 (Tablo 1) karıştırın, daha sonra konsantre edildi NH4OH (Tablo 1) 2 ml ilave edilir ve sıcak bir plaka üzerinde, bir kazana bu çözüm getirmek .
- Kaynayan bir çözeltisine, cam boncuk ilave edin ve 5 dakika daha kaynatmaya devam edin. Yavaşça çözüme her dakika girdap.
- Kaynatıldıktan sonra RT DI su ile 15 ml mikro santrifüj tüpü ve en fazla içine ~ Bu sıcak bir boncuk süspansiyonu 5 ml aktarın. , 5 dakika boyunca 3.500 xg'de santrifüjleyin çıkarın ve supernatant atın.
- Yıkanan boncuklara sıcak bir boncuk süspansiyonu başka bir 5 ml aktarın ve eklemeYine, daha DI su ile kontör iyice karıştırın ve santrifüj. DI suyun yaklaşık 50 mi kullanılıncaya kadar yıkama 4-5 kez olmak üzere toplam olacak, bu prosedürü yineleyin.
- 1 ml şişe içine boncuk süspansiyonu aktarın. Son olarak 3 kez 5 dakika boyunca 17,000 x g'de santrifüj ile metanol (Tablo 1) ile boncukların yıkanması ve tekrar% 100 metanol ve 1 ml boncuk askıya tekrar.
- Boncuk Yüzey thiolation
- 50 ml'lik bir santrifüj tüpüne, süspansiyon 2.1 hazırlanan 1.15 ml 3-merkaptopropiltrimetoksisilan (MPTMS) (Tablo 1) ve 1 ml boncuk asetik asit, metanol içinde 45.6 mi, 0.4 mi (Tablo 1), DI su 1.85 ml, ekleme daha sonra 3 saat boyunca oda sıcaklığında inkübe edilir.
- Reaksiyondan sonra, taze metanol ile bir kez yıkayarak bütün reaktantları kaldırmak ve metanol 500 ul içine boncuk yeniden askıya. Eşit 20 Kuru ve temiz bir cam şişe, bir dizi halinde bu konsantre cam boncuk süspansiyonu bölmekvidalı kapakları. Kuru bir argon jeti kullanarak metanol buharlaştırılır ve her şişenin tarafta kuru boncuk ince katman yapmak için yavaşça şişeleri döndürün.
- Gevşek kapağını (lar) yer hızlı bir şekilde 5 dakika için 120 ° C'de önceden ısıtılmış bir kurutma fırını içine boncuk şişeleri yerleştirin ve daha sonra almak. Alt kurutucu ile dolu bir cam vakum desikatörde şişeleri yerleştirin ve soğutulan kadar bir vakum pompası ile desikatörde vakum.
- Normal atmosfer basıncında desikatörde getirmek için, kuru argon ile vakumlu desikatörde temizleyin. Şişenin kapağını (ler) yeniden sıkın hızla desiccator kapağını kaldırın ve. Plastik parafin film ile şişeleri Seal ve kuru karanlık saklama kutusunda oda sıcaklığında saklayın.
- Acil kullanım üzerine, kuru boncuk bir vial almak ve fosfat tampon maddesi (Tablo 1 ve 2), 4 ° C'de fosfat tamponu ve mağaza 50 ul içinde yeniden askıya ile bir kez yıkanır. Bu konsantre, boncuk preparatı ifade edilecektirAşağıdaki adımlarda "MPTMS boncuklar" olarak.
Not: Uygun depolama ile, MPTMS boncuklar üç aya kadar işlevsel kalabilir.
3. Boncuk Functionalization
- Kovalent Boncuk üzerinde Proteinler Kaplama
- Protein stokunun belli bir hacmi (örneğin, 2.5 ul) almak ve çözelti 1 yapmak için karbonat / bikarbonat tamponu, eşit hacmi ile karıştırılır.
Not: hacim stok konsantrasyonu ve boncuk yüzeyi üzerinde protein arzu edilen nihai Alanı yoğunluğuna bağlıdır. - Küçük bir beher içinde MAL-PEG3500-NHS bağlayıcı (Tablo 1) 2-3 mg ağırlığında olup, 0.231 mg / ml bir nihai konsantrasyon elde etmek karbonat / bikarbonat tamponu ile çözülür.
- 3.1.2 hazırlanan bağlayıcı çözeltisi eşit hacimde Çözüm 1 karıştırın. Çözüm 2 yapmak için 30 dakika boyunca oda sıcaklığında inkübe karışımı.
- Bu arada, bir cam vakum kurutucu f gevşek kapaklı şişe yerleştirin bağlayıcı5 dakika boyunca alt ve vakumla kurutucu ile illed ve argon ile desikatörde doldurun. Kapağı sıkın ve şişeyi çıkar. Plastik parafin film ile şişeyi Seal -20 ° C alt ve deposunda kurutucu ile dolu bir kap içine koyun.
Not: (3.1.3 inkübasyon hariç) 3.1.2-3.1.4 içeren MAL-PEG3500-NHS bağlayıcı kullanılmasını içerir adımları, mümkün olduğunca hızlı bir şekilde yerine getirilmesi gerekir. - Çözüm 2 MPTMS boncuk 5 ul karıştırın ve 250 ul'lik bir son hacim yapmak için, fosfat tamponu (Tablo 1) ekleyin.
- , Oda sıcaklığında gece boyunca boncuk inkübe fosfat tamponu ile 3 kez yıkanır ve 4 ° C'de fosfat tamponu ve mağaza 100 ul içinde yeniden askıya.
- Protein stokunun belli bir hacmi (örneğin, 2.5 ul) almak ve çözelti 1 yapmak için karbonat / bikarbonat tamponu, eşit hacmi ile karıştırılır.
- Hazırlama Protein / Streptavidin (SA) Kaplamalı Boncuk
- Protokol 3.1.1-3.1.4 izleyin.
- Çözüm 2 MPTMS boncuk 5 ul 4 mg / ml streptavidin-maleimid (SA-MAL) (Tablo 1, 5 ul karıştırın) Çözeltisi ve daha sonra, 250 ul'lik bir son hacim yapmak için, fosfat tamponu ilave edin.
- 4 ° C'de fosfat tamponu ve mağaza 100 ul içinde yeniden askıya son olarak, bir gece boyunca oda sıcaklığında inkübe boncuk fosfat tamponu ile 3 kez yıkanır ve.
- Cam Boncuk üzerine Streptavidin Kaplama
- 4 mg / ml SA çözeltisi 5 ul MPTMS boncuk 5 ul karıştırın ve fosfat tampon 140 ul ilave edin.
- , Oda sıcaklığında gece boyunca boncuk inkübe fosfat tamponu ile 3 kez yıkanır ve 4 ° C'de fosfat tamponu ve mağaza 50 ul içinde yeniden askıya.
- Biyotinlenmiş Protein SA kaplı tanelerin kaplanması
- (Hacim istenilen kaplama yoğunluğuna bağlı olarak) protein ile SA kaplı boncuk 5 ul karıştırın ve son hacim 100 ul olmak yapmak için fosfat tamponu ekleyin.
- Gece boyunca 4 ° C'de ya da oda sıcaklığında 3 saat süreyle inkübe karışımı fosfat tamponu ile 3 kez yıkanır ve 50 ul ph içine yeniden askıyaosphate tamponu ve 4 ° C'de depolayın.
4. Hücre Hazırlanması
Not: Örneğin, T hücreleri, 27 ya da bazı hücre çizgileri 21,29, hücrelerin saflaştırılması Kullanılan hücre tipine karşılık gelen standart hücre saflaştırma protokolleri takip edin.
- FBFP deneyler için, hücre süspansiyonu hazırlanır, bir kez Fura2-AM, 2 uM'lik bir son konsantrasyon elde oda sıcaklığında 30 dakika inkübe edilir ve daha sonra bir kez yıkamak için hücre süspansiyonu içine DMSO içinde çözülmüş (Tablo 1) ekleyin. Karanlıkta kullanılana kadar bu floresan yüklenen hücre süspansiyonu tutun.
5. Mikropipetler hazırlık ve Cep Odası
- Mikropipetler hazırlanması
- Uzunluğu yaklaşık 3 inç kısa parçalar halinde, bir cam kesici ile kesilen uzun kapiler cam tüp (Tablo 1). Mikropipet çektirmesi (Tablo 1), "Pull" tıklayın üzerine Dağı tek parça amaton böylece kılcal orta makine tarafından ısıtılır ve kılcal keskin uçları (ham mikropipetler) ile iki kılcal yapmak için iki ucunda çekilecektir.
Not: Ürün kılavuz takip ederek, çiğ pipet istenilen morfolojisi 6-8 mm konik ve 0.1-0.5 mikron ucu vardır. - Mikropipet forge (Tablo 1) pipet tutucu üzerine çiğ pipet monte edin. Isı forge cam küreyi eritmek için. Cam kürenin içinde ham pipet ucu yerleştirin. Cam küre soğutun ve dışarıdan kırmak ve kürenin içinde onun ipucu bırakmak ham pipet çekin. İstediğiniz ucu delik elde edilene kadar bu işlemi tekrarlayın.
Mikropipet ucu iç çapı: Örnekler: Not RBC için 2.0-2.4 um bir boncuk için ~ 1.5 um ~ T-hücre için 2-4 um ve bir hibridoma hücre için -7 um.
- Uzunluğu yaklaşık 3 inç kısa parçalar halinde, bir cam kesici ile kesilen uzun kapiler cam tüp (Tablo 1). Mikropipet çektirmesi (Tablo 1), "Pull" tıklayın üzerine Dağı tek parça amaton böylece kılcal orta makine tarafından ısıtılır ve kılcal keskin uçları (ham mikropipetler) ile iki kılcal yapmak için iki ucunda çekilecektir.
- Hücre Odası Bina
Not: Hücre bölmesi bir ev-deli temelinde inşa edilmiştiriki metal kareler parçaları (bakır / alüminyum) ve bunları birbirine bağlayan bir sap (Şekil 1D) oluşur, e haznesi tutucusu. - Iki 40 mm x 11 mm x 0.2 mm parçalar halinde, bir cam kesici kullanılarak, bir 40 mm x 22 mm x 0.2 mm lamel Cut (1 lamel ve 2). Tutkal iki metal kareler köprü bu şekilde odacık tutucunun üst tarafına gres lamel 1, ve bir paralel-lamel hücresi odası (Şekil 1D) oluşturacak alt yüzüne benzer tutkal lamel 2.
- İki lamelleri arasında deneysel tamponu 200 ul enjekte etmek için bir pipet kullanın. Tampon her iki lamelleri verdiği emin olun. Yavaşça döndürmek ve tampon odasının iki ucunu dokunmasına izin için odasına sallayın.
- Dikkatle böylece açık hava tampon sızdırmazlık deneysel tampon bölge sınırdaş odasının her iki tarafında içine mineral yağ enjekte edilir. (Örneğin, pMHC kaplı boncuklar) probu, boncuk süspansiyonlar, RBC ve hedefleri enjekteSırasıyla, ara bölgenin, üst, orta ve alt bölümlerinde (örneğin, T hücreleri).
6. BFP deneyi
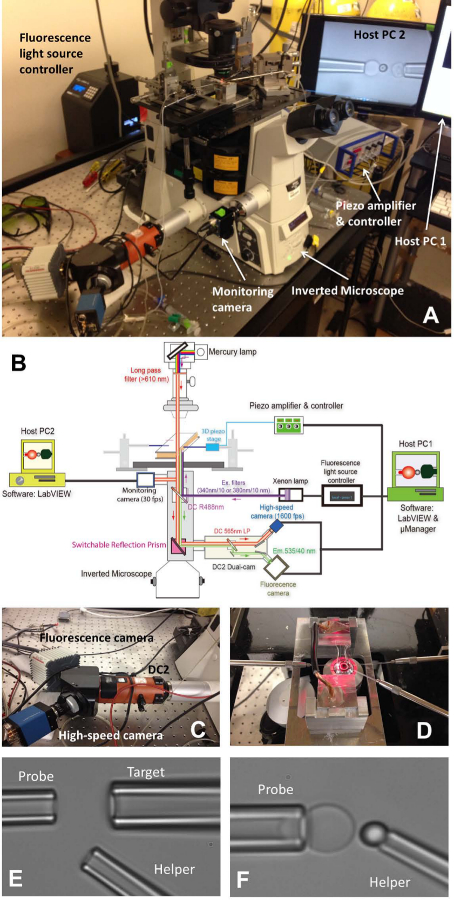
Şekil 1: fBFP düzeneği (A) fBFP donanım sisteminin bir bakış resim.. (B) fBFP donanım sisteminin şematik bir çizimi. (C), yüksek hızlı kamera (mavi) ve bir floresan kamera (beyaz) monte edildiği üzerine çift kam sistemi "DC2" (turuncu). (D) bir deney odası ve üç mikropipet manipülasyon sistemlerini adapte mikroskop sahne. (E ve F) bir deney odası içinde BFP ayarının Mikrografikleridir. (E) Mikropipetler montaj prob pipet (solda), hedef pipet (sağ üst) ve yardımcı pipet gösteren (düşük right). (F) Sonda boncuk yerleştirme. Bir prob boncuk bir kuvvet probu oluşturmak üzere bir RBC apeks için bir yardımcı pipet tarafından manipüle ve bağlıydı. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Mikroskobu (Tablo 1) ve ışık kaynağına açın. Ana mikroskop sahnede (Şekil 1A, D) üzerine odasına yerleştirin.
- (Hedef bir hücre veya boncuk, sağ alt kapmak için: a RBC, sağ kapmak, sonda bir boncuk kapmak için, yardımcı. Şekil 1D Sol) BFP her üç mikropipetler yükleyin.
- Deney tampon maddesi ile bir mikropipet doldurmak için bir mikro-enjektörü (Tablo 1) kullanın. Pipet tutucu (Tablo 1) çıkartın ve bahşiş damlayan su sağlamak için daha düşük bir yerde tutun. Hızla tutucu ucu içine mikropipet yerleştirin ve hiçbir hava kabarcığı mikropipet içine alır emin olunsokma esnasında. Tutucu vidasını sıkın.
- Karşılık gelen mikro-manipülatör üzerine her pipet tutucu monte edin. Onların ipuçları kamara tampon alana girmek böylece odasına doğru mikropipet itin. Mikropipet konumunu ayarlayın ve bakış mikroskop alanının altında onları bulmak.
- Tek-birer üç unsurdan koloniler (eritrositlerde, hedefler ve prob boncuk) bulmak için bölme tutucu sahne etrafında hareket ettirin. Mikropipet yaklaşımı bir hücre / boncuk ucu izin manipülatörlerin düğmeleri çevirerek gelen mikropipet konumunu ayarlayın. İlgili Mikropipet içindeki basıncı ayarlayarak hücre / boncuğu aspire. Her üç mikropipetler bunlara karşılık gelen elemanları yakalayacaktır.
- Uzak deneme yapılacaktır enjekte elementlerin kolonilerden açık bir yer bulmak için kamara tutucu sahne etrafında hareket ettirin. Comp görüntüyü görselleştirmek için mikroskop görsel moduna geçişbilgisayar ekranında uter programı. Programın vizyonu alanına pipet uçları tüm üç unsur taşıyın.
- Kısaca geri yavaşça RBC üzerine boncuk çarpacak ve prob boncuk ve RBC aynı hizaya getirin ve dikkatle RBC apeks prob boncuk manevra. Bu RBC apeks (Şekil 1F) yapıştırılmış sol olacak ki, nazikçe uzak boncuk darbe yardımcı mikropipet basıncını ayarlayın. Yardımcı mikropipet uzaklaşmak ve hedef ve prob boncuk (Şekil 2A) hizalayın.
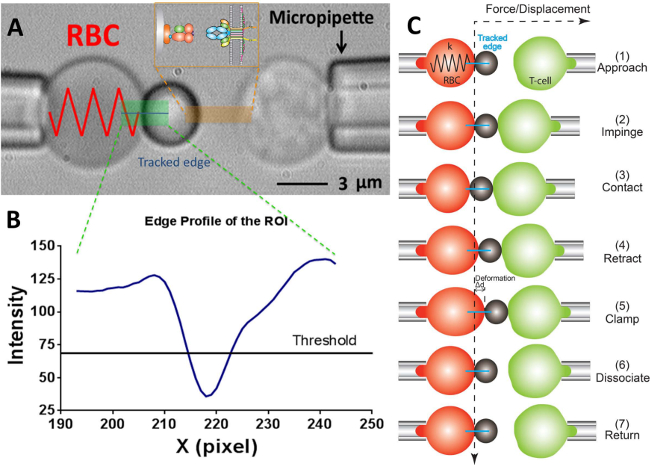
Şekil 2:. BFP şeması ve test çevrimi (A) kuvvet probu (solda) ve kendi pipettes.The sabit kuvvet probu ile aspire hedef T-hücresi (sağ) tasvir Video mikrograf şişmiş eritrosit ve ekli oluşur Ligand taşıyan boncuk. reseptör taşıyanT-hücresi (hedef) sondaya tam karşısına yerleştirilen bir piezotranslator monte edilir. ROI yeşil gösterilir. Kenar izci mavi çizgi gösterilir. uç turuncu işaretlenmiş bölgede iki karşılıklı yüzeyler üzerinde ligand (pMHC, boncuk tarafı) ve reseptörü (TCR, T-hücresi tarafı) çifti göstermektedir. (B) (A) 'daki boncuk kenarının yoğunluğu profili. X yönü ROI bölgesi x -Axis (piksel sayısı) ve (gri skala değeri) ışık şiddeti y yönü boyunca 30 piksel binning ile ortalama olarak çizilir. (C) RBC saptırma ve boncuk pozisyon ve kuvvet kelepçe testinin test döngüsünde hedefi (T-hücresi). Dikey ve yatay kesikli çizgiler sırasıyla RBC apeks ve zaman tabii sıfır kuvvet konumunu gösterir. RBC deformasyon çizgi kenar izci, her panelde mavi gösterilmiştir. Aynı henüz az adımlar yapışma frekansı kabul edilir("ayırmak" adımını yoksun) ve termal dalgalanma deneyi ("kelepçe" ve "ayırmak" adımlarını yoksun) deneyi.
- Programda, görme alanı penceresinde prob mikropipet (R p) ilgili yarıçap ölçmek için programda araçlarını kullanın, RBC (R 0), RBC ve sonda boncuk (R c) arasındaki dairesel temas alanı aşağıdaki denklemle 17,30 tarafından RBC (k) yay sabiti tahmin edilebilir olan,
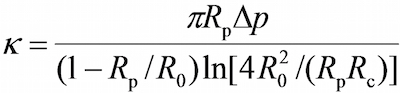
nerede Δ p prob pipet ucunda aspirasyon basıncıdır.
Not: bağlanma kuvveti, F, yay sabiti ve prob boncuk (d) yer değiştirmesi, yani, K = D ürünü ile belirlenebilir olduğu Hook kanununa izler (Şekil 2C). - (Protokol bölümüne 6.6 bakınız. Yay sabiti genellikle kuvvet kelepçe tahlil ve yapışma frekans tahlil için 0.25 veya 0.3 pN / nm ve termal dalgalanma deneyi için 0.1 pN / nm'de ayarlanır) programına istenen RBC yay sabiti girin hangi su santimetre biriminde gerekli aspirasyon basıncını dönecektir. Gerekli aspirasyon basınca ulaşılana kadar sondanın pipet bağlanan su tankı yüksekliğini ayarlayın.
- Bu hat boyunca her pikselin parlaklık (gri skala değeri) gösteren bitişik pencerede bir eğri verecektir RBC apeks boyunca yatay bir çizgi çizin. Eğri (Şekil 2A, B) yaklaşık yarısı derinlikte olması için eşik çizgisini sürükleyin.
Not: Eşik sınırının altında parlaklık eğrisinde minimum nokta boncuk sınır konumunu, böylece sadece bir yerel minimum izin gösterir. İki veya daha fazla yerel minimum şu anda ise, onuGörüntü (nedeniyle odak dışında olmak imajı ya da prob boncuk ve RBC arasında zayıf bir uyum olasılığı) uygun olmadığını gösterir. - Termal dalgalanma deneyi, yapışma frekans tahlil ya da kuvvet kelepçe deneyi: İstediğiniz deney modunu seçin. (Kuvvet kelepçe tahlil için kuvvet = 20 PN (sıkma, örneğin, sıkışma kuvveti = 15 pN, yükleme oranı = 1,000 pN / s, temas süresi = 1 sn), vb) istediğiniz gibi parametreleri ayarlayın.
- Ve prob ile temas dışında (ayrıntılar için Temsilcisi Sonuçlar bölümüne bakınız) hedef pipet hareket ve hedef sürücü programı sağlayan "Başlat", tıklayın. Veri toplama gerçek zamanlı olarak prob boncuk konumunu kaydeder paralel olarak yapılacaktır. Bir pencere edinilen verilerin kaydedilmesi izin dışarı çıkacaktır hangi zaman düğme "Dur deney" üzerine tıklayarak programı durdurun.
7. Floresans BFP (fBFP) deneyi
- Fluore kullanmak içinBFP sisteminin scence fonksiyonu, ayrı bir program (Tablo 1) tarafından kontrol edilen uyarım ışık kaynağı (Tablo 1) ve floresan kamera (Tablo 1), açın. Programda, vs kazanç, pozlama, uyarım kanalları (bu durumda, 340 nm ve 380 nm ışık), dahil olmak üzere, floresan görüntüleme için parametre seçilir. 340 nm veya 380 nm uyarma ışık tarafından heyecan hedef hücre canlı floresan görüntü görselleştirme için izin verecektir prob ve hedef, hizalama dahil BFP deney protokolünde tüm hazırlıklarını izleyin.
- Kabaca kesit alanı, içinde hücre tüm kayıt döneminde kalacak için kesit aracını kullanın.
Not: nedeniyle yaklaşım temaslı-geri çekilme döngüsünün kullanımı, hücre böylece kesitli alan hücrenin kendisinden çok daha büyük, arka arkaya ileriye ve geriye doğru hareket olacaktır. - 340 nm An izin vermek için "Record" tıklayınD 380 nm ışık alternatif olarak dönüşümlü bir kez her iki kaydedilecektir hücre içi floresan boya (Fura2), ve floresan görüntü karşılık gelen bir çift tahrik için. Aynı anda analizi, moleküler etkileşim ve hücre içi kalsiyum sinyalini izlemek için floresan görüntüleme deney için BFP denemeyi başlatmak için programda "Başlat" a tıklayın. Sistem bağlanması reseptör-ligandı için bir ham veri dosyası (aşağıda Şekil 6A) ve kalsiyum sinyalleri için tiff biçimde flüoresan görüntüleri bir dizi üretecektir.
8. Veri Analizi
- BFP Veri Analizi
- Yapışma deneyi için frekans Veri analizi
- Sırayla her döngünün "kuvvet zamanında vs" sinyali incelemek ve sadece döngüleri yapamaz bir yapışma olayı içeren ve hangi kayıt ve ortalama yapışma frekansı elde etmek özetlemek.
- Her yapışma olayı kopma kuvveti toplayın hangitahvil rüptürü önce doğrusal rampalı kuvvet tepe değeridir. Rampa oranları aralığında yırtılma kuvvetlerinin yeterli miktarda toplanmasından sonra, kuvvet-bağımlı-oranda reseptör-ligand ayrışma dinamik kuvvet spektroskopisi analizi 18,31 kullanılarak elde edildiği bir şekilde her rampa oranında kopma kuvveti dağılımı elde.
- Termal dalgalanma deneyi için Veri analizi
- Sıralı olasılıkla çoklu bağ birleşme ve ayrılma olayları içeren her döngüsü, kıstırma faz sinyalini kontrol edin. Bir bağ beri, tahvil birleşme ve ayrılma olayları ayırt etmek için bir kılavuz olarak sinyal "zamana karşı kuvvet" in sıkıştırma aşaması termal dalgalanma seviyesi (boncuk pozisyonu 70 ardışık zaman noktalarında bir kayma aralığının ortalama standart sapma) kullanın oluşumu, termal bir dalgalanma bir azalmaya karşılık gelir.
- Ne zaman ther (bağ ayrışma anında gelen aralığını belirleyinmal dalgalanma bekleme süresi sonraki bağ oluşumu anına) normal seviyeye devam eder ve her iki veri denetim sırasında toplanan tahvil ömrü olarak ayrışması onun dernek, gelen bağın süresini belirler. Sırasıyla sıfır kuvvet 16,30 altında-oranı üzerinde oranının devrik ve yansıtan, ortalama bekleme süresi ve ortalama bağ ömrünü hesaplayın.
- Kuvvet kelepçe deneyi için Veri analizi
- Biri bir toplu yaşam boyu eğri çizmek sağlayacak sıra numarası yanı sıra başlangıç zamanı ve bitiş zamanı ortalama kuvvet ve tahvil ömrü dahil olmak üzere tüm yaşam boyu etkinlikler, kayıt parametreleri (örneğin, Şekil 6C, sarı eğri).
- Kuvvetler aralığı altında kullanım süresi etkinlikleri yeterli miktarda toplayın. Her kuvvet bin ortalama ömür üretmek ve tamamen bir "ortalama ömür vs verecektir farklı kuvvet bidonları içine Grubu onları,. kuvvet "eğrisi (Şekil 4).
- Yapışma deneyi için frekans Veri analizi
- Kalsiyum floresan Görüntüleme Veri Analizi
- Floresan görüntüleri arka plan gürültüsü olmadan hem 340 nm ve 380 nm kanallarında hücrenin net bir kontur göstermek kadar yoğunluk eşiği ayarlayın (Şekil 5A, B). Daha sonra 340 nm / 380 nm yoğunluk oranı göre türetilir yoğunluk seviyesini (Şekil 6B) gösteren bir sözde-renk ile çerçeve ile hücre içi Ca2 + sinyali çerçeve yorumlayan, vs "normalize Ca 2+ yoğunluğu üretmek için . Zaman "eğrisi (Şekil 6C). İkinci ile floresan seviyesi ikinci görüntüleyen bir film üretmek için sözde renkli floresan görüntüleri kullanın.
Sonuçlar
BFP tekniği 1995 17 Evans laboratuarı tarafından öncüleridir. Bu picoforce aracı yoğun, bağlayıcıları 16,19,20 ile etkileşen adhezyon molekülleri arasında iki boyutlu kinetiği analiz şekilde, yüzeyler üzerinde hareketsiz protein etkileşimlerini ölçmek için kullanılmıştır 30 moleküler esneklik 21,29 ölçmek ve protein şekilsel 21 değişiklikleri belirlemek için. Için, bir fBFP ilave edilir, karşılık gelen yazılım sistem...
Tartışmalar
Başarılı bir fBFP deneyi birkaç kritik hususlar gerektirir. Kuvvet hesaplama güvenilir olması için Birincisi, mikropipet, RBC ve prob boncuk mümkün olduğunca eş eksenli yakın olarak aynı hizada olmalıdır. RBC ve pipet arasındaki sürtünme ihmal edilebilir, böylece pipet içine RBC izdüşümü yaklaşık bir prob pipet çapı olması gerekir. Tipik bir insan RBC için en uygun pipet çapı Denklem 1 17,30 bir en uygun verimleri 2.0-2.4 mikron olduğunu. İkincisi, kuvvet kelepçe tahlil ve t...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
Research related to this paper and the development of the fBFP technology in the Zhu lab were supported by NIH grants AI044902, AI077343, AI038282, HL093723, HL091020, GM096187, and TW008753. We thank Evan Evans for inventing this empowering experimental tool, and members of the Evans lab, Andrew Leung, Koji Kinoshita, Wesley Wong, and Ken Halvorsen, for helping us to build the BFP. We also thank other Zhu lab members, Fang Kong, Chenghao Ge and Kaitao Li, for their helps in the instrumentation development.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4 • H2O) | Sigma-Aldrich | S9638 | Phosphate buffer preparation |
| Anhy. Sodium Phosphate Dibasic (Na2HPO4) | Sigma-Aldrich | S7907 | Phosphate buffer preparation |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation |
| Sodium chloride (NaCl) | Sigma-Aldrich | S7653 | N2-5% buffer preparation |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | N2-5% buffer preparation |
| Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P5655 | N2-5% buffer preparation |
| Sucrose | Sigma-Aldrich | S0389 | N2-5% buffer preparation |
| MAL-PEG3500-NHS | JenKem | A5002-1 | Bead functionalization |
| Biotin-PEG3500-NHS | JenKem | A5026-1 | RBC biotinylation |
| Nystatin | Sigma-Aldrich | N6261 | RBC osmolarity adjustment |
| Ammonium Hydroxide (NH4OH) | Sigma-Aldrich | A-6899 | Glass bead silanization |
| Methanol | BDH | 67-56-1 | Glass bead silanization |
| 30% Hydrogen Peroxide (H2O2) | J. T. Barker | Jan-86 | Glass bead silanization |
| Acetic Acid (Glacial) | Sigma-Aldrich | ARK2183 | Glass bead silanization |
| 3-Mercaptopropyltrimethoxysilane (MPTMS) | Uct Specialties, llc | 4420-74-0 | Glass bead functionalization |
| Borosilicate Glass beads | Distrilab Particle Technology | 9002 | Glass bead functionalization |
| Streptavidin−Maleimide | Sigma-Aldrich | S9415 | Glass bead functionalization |
| BSA | Sigma-Aldrich | A0336 | Ligand functionalizing |
| Fura2-AM | Life Technologies | F-1201 | Intracellular calcium fluorescence dye loading |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | Intracellular calcium fluorescence dye loading |
| Quantibrite PE Beads | BD Biosciences | 340495 | Density quantification |
| Flow Cytometer | BD Biosciences | BD LSR II | Density quantification |
| Capillary Tube 0.7-1.0 mm x 30 inches | Kimble Chase | 46485-1 | Micropipette making |
| Flaming/Brown Micropipette Puller | sutter instrument | P-97 | Micropipette making |
| Pipette microforce | Narishige | MF-900 | Micropipette making |
| Mineral Oil | Fisher Scientific | BP2629-1 | Chamber assembly |
| Microscope Cover Glass | Fisher Scientific | 12-544-G | Chamber assembly |
| Micro-injector | World Precision Instruments | MF34G-5 | Chamber assembly |
| 1 ml syringe | BD | 309602 | chamber assembly |
| Micropipette holder | Narishige | HI-7 | Chamber assembly |
| Home-designed mechanical parts and adaptors fabrications using CNC machining. | Biophysics Instrument | All parts are customized according to the CAD designs. | BFP system |
| Microscope (TiE inverted) | Nikon | MEA53100 | BFP system |
| Objective CFI Plan Fluor 40x (NA 0.75, WD 0.72 mm, Spg) | Nikon | MRH00401 | BFP system |
| Camera, GE680, 640 x 480, GigE, 1/3" CCD, mono | Graftek Imaging | 02-2020C | BFP system |
| Prosilica GC1290 - ICX445, 1/3", C-Mount, 1280 x 960, Mono., CCD, 12 Bit ADC | Graftek Imaging | 02-2185A | BFP system |
| Manual submicron probehead with high resolution remote control | Karl Suss | PH400 | BFP system |
| Anti-vibration table (5’ x 3’) | TMC | 77049089 | BFP system |
| 3D manual translational stage | Newport | 462-XYZ-M | |
| SolidWorks 3D CAD software | SOLIDWORKS Corp. | Version 2012 SP5 | BFP system |
| LabVIEW software | National Instruments | Version 2009 | BFP system, BFP program |
| 3D piezo translational stage | Physik Instrumente | M-105.3P | BFP system |
| Linear piezo accuator | Physik Instrumente | P-753.1CD | BFP system |
| Micromanager software | Version 1.4 | fBFP system, fluorescence imaging program | |
| Dual Cam (DC-2) | Photometrics | 77054724 | fBFP system |
| Dual Cam emission filter (T565LPXR) | Photometrics | 77054725 | fBFP system |
| Fluorescence Camera | Hamamatsu | ORCA-R2 C10600-10B | fBFP system |
| Plastic paraffin film (Parafilm) | Bemis Company, Inc | PM996 | bottle sealing |
| Carbonate/bicarbonate buffer (pH 8.5) | 8.4 g/L sodium carbonate (Na2CO3), 10.6 g/L sodium bicarbonate (NaHCO3) | ||
| Phosphate buffer (pH 6.5-6.8) | 27.6 g/L NaPhosphate monobasic (NaH2PO4 • H2O), 28.4 g/L Anhy. NaPhosphate dibasic (Na2HPO4) | ||
| N2-5% buffer (pH 7.2) | 20.77 g/L potassium chloride (KCl), 2.38 g/L sodium chloride (NaCl), 0.13 g/L potassium phosphate monobasic (KH2PO4), 0.71 g/L anhy. sodium phosphate dibasic (Na2HPO4), 9.70 g/L sucrose |
Referanslar
- Aplin, A. E., Howe, A., Alahari, S. K., Juliano, R. L. Signal transduction and signal modulation by cell adhesion receptors: the role of integrins, cadherins, immunoglobulin-cell adhesion molecules, and selectins. Pharmacological reviews. 50, 197-263 (1998).
- Davis, M. M., Bjorkman, P. J. T-cell antigen receptor genes and T-cell recognition. Nature. 334, 395-402 (1988).
- Dado, D., Sagi, M., Levenberg, S., Zemel, A. Mechanical control of stem cell differentiation. Regenerative medicine. 7, 101-116 (2012).
- Edwards, L. J., Zarnitsyna, V. I., Hood, J. D., Evavold, B. D., Zhu, C. Insights into T cell recognition of antigen: significance of two-dimensional kinetic parameters. Frontiers in immunology. 3, 86 (2012).
- Zhu, C., Jiang, N., Huang, J., Zarnitsyna, V. I., Evavold, B. D. Insights from in situ analysis of TCR-pMHC recognition: response of an interaction network. Immunological reviews. 251, 49-64 (2013).
- Huang, J., Meyer, C., Zhu, C. T. T cell antigen recognition at the cell membrane. Molecular immunology. 52, 155-164 (2012).
- Zarnitsyna, V., Zhu, C. T. T cell triggering: insights from 2D kinetics analysis of molecular interactions. Physical biology. 9, 045005 (2012).
- Binnig, G., Quate, C. F., Gerber, C. Atomic Force Microscope. Physical Review Letters. 56, 930-933 (1986).
- Marshall, B. T., et al. Direct observation of catch bonds involving cell-adhesion molecules. Nature. 423, 190-193 (2003).
- Kong, F., Garcia, A. J., Mould, A. P., Humphries, M. J., Zhu, C. Demonstration of catch bonds between an integrin and its ligand. The Journal of cell biology. 185, 1275-1284 (2009).
- Yago, T., et al. Catch bonds govern adhesion through L-selectin at threshold shear. The Journal of cell biology. 166, 913-923 (2004).
- Yago, T., et al. Platelet glycoprotein Ibalpha forms catch bonds with human WT vWF but not with type 2B von Willebrand disease vWF. The Journal of clinical investigation. 118, 3195-3207 (2008).
- Chesla, S. E., Selvaraj, P., Zhu, C. Measuring two-dimensional receptor-ligand binding kinetics by micropipette. Biophysical journal. 75, 1553-1572 (1998).
- Huang, J., et al. The kinetics of two-dimensional TCR and pMHC interactions determine T-cell responsiveness. Nature. 464, 932-936 (2010).
- Heinrich, V., Wong, W. P., Halvorsen, K., Evans, E. Imaging biomolecular interactions by fast three-dimensional tracking of laser-confined carrier particles. Langmuir : the ACS journal of surfaces and colloids. 24, 1194-1203 (2008).
- Chen, W., Evans, E. A., McEver, R. P., Zhu, C. Monitoring receptor-ligand interactions between surfaces by thermal fluctuations. Biophysical journal. 94, 694-701 (2008).
- Evans, E., Ritchie, K., Merkel, R. Sensitive force technique to probe molecular adhesion and structural linkages at biological interfaces. Biophysical. 68, 2580-2587 (1995).
- Evans, E., Leung, A., Heinrich, V., Zhu, C. Mechanical switching and coupling between two dissociation pathways in a P-selectin adhesion bond. Proceedings of the National Academy of Sciences of the United States of America. 101, 11281-11286 (2004).
- Ju, L., Dong, J. -. f., Cruz, M. A., Zhu, C. The N-terminal Flanking Region of the A1 Domain Regulates the Force-dependent Binding of von Willebrand Factor to Platelet Glycoprotein Ib. Journal of Biological Chemistry. 288, (2013).
- Chen, W., Lou, J., Zhu, C. Forcing switch from short- to intermediate- and long-lived states of the alphaA domain generates LFA-1/ICAM-1 catch bonds. The Journal of biological chemistry. 285, 35967-35978 (2010).
- Chen, W., Lou, J., Evans, E. A., Zhu, C. Observing force-regulated conformational changes and ligand dissociation from a single integrin on cells. The Journal of cell biology. 199, 497-512 (2012).
- Judokusumo, E., Tabdanov, E., Kumari, S., Dustin, M. L., Kam, L. C. Mechanosensing in T lymphocyte activation. Biophysical journal. 102, L5-L7 (2012).
- Bashour, K. T., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences of the United States of America. 111, 2241-2246 (2014).
- Nesbitt, W. S., et al. Distinct glycoprotein Ib/V/IX and integrin alpha IIbbeta 3-dependent calcium signals cooperatively regulate platelet adhesion under flow. The Journal of biological chemistry. 277, 2965-2972 (2002).
- Mazzucato, M., Pradella, P., Cozzi, M. R., De Marco, L., Ruggeri, Z. M. Sequential cytoplasmic calcium signals in a 2-stage platelet activation process induced by the glycoprotein Ibalpha mechanoreceptor. Blood. 100, 2793-2800 (2002).
- Lefort, C. T., Ley, K. Neutrophil arrest by LFA-1 activation. Frontiers in immunology. 3, 157 (2012).
- Liu, B., Chen, W., Evavold, B. D., Zhu, C. Accumulation of dynamic catch bonds between TCR and agonist peptide-MHC triggers T cell signaling. Cell. 157, 357-368 (2014).
- Lou, J., et al. Flow-enhanced adhesion regulated by a selectin interdomain hinge. The Journal of cell biology. 174, 1107-1117 (2006).
- Fiore, V. F., Ju, L., Chen, Y., Zhu, C., Barker, T. H. Dynamic catch of a Thy-1-alpha5beta1+syndecan-4 trimolecular complex. Nature communications. 5, 4886 (2014).
- Chen, W., Zarnitsyna, V. I., Sarangapani, K. K., Huang, J., Zhu, C. Measuring Receptor-Ligand Binding Kinetics on Cell Surfaces: From Adhesion Frequency to Thermal Fluctuation Methods. Cellular and molecular bioengineering. 1, 276-288 (2008).
- Marshall, B. T., Sarangapani, K. K., Lou, J., McEver, R. P., Zhu, C. Force history dependence of receptor-ligand dissociation. Biophysical. 88, 1458-1466 (2005).
- Xiang, X., et al. Structural basis and kinetics of force-induced conformational changes of an alphaA domain-containing integrin. PloS one. 6, e27946 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır