このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
蛍光生体膜フォースプローブ:単一細胞上の受容体 - リガンド速度論の同時定量との結合によって誘導される細胞内シグナル伝達
* これらの著者は同等に貢献しました
要約
We describe a technique for concurrently measuring force-regulated single receptor-ligand binding kinetics and real-time imaging of calcium signaling in a single T lymphocyte.
要約
膜受容体 - リガンド相互作用は、多くの細胞機能を媒介します。これらの分子の相互作用によって引き起こさ結合動態および下流のシグナル伝達は、おそらく結合し、場所を取るシグナル伝達する機械的な環境の影響を受けています。最近の研究では、機械的な力により、抗原認識を調節し、T細胞受容体(TCR)をトリガすることができることを実証しました。これは、我々が開発した新技術によって可能になったし、蛍光顕微鏡で単一分子力分光法を組み合わせた蛍光生体膜力プローブ(fBFPを)、と呼ばれました。敏感な力センサー、高速度カメラとリアルタイムイメージング追跡技術として、超ソフトヒト赤血球を用いて、fBFPは約3 nmおよび〜0.5秒で約1 PN(10 -12 N)であります力、空間的および時間的分解能。 fBFPで、1は正確に力調節の下で単一の受容体 - リガンド結合反応速度と同時に、画像結合トリガー細胞内CALを測定することができます単一の生細胞上でシグナリングcium。この新技術は、機械的な規制の下に他のセルにおける他の膜受容体 - リガンド相互作用およびシグナル伝達を研究するために使用することができます。
概要
細胞-細胞及び細胞-細胞外マトリックス(ECM)接着は、細胞表面受容体、ECMタンパク質、および/ または脂質の1との間の結合によって媒介されます。結合は、細胞が機能構造1を形成し、同様に認識し、通信し、環境1-3に対応することができます。可溶性タンパク質( 例えば 、サイトカインおよび成長因子)、3次元(3D)から結合する細胞表面受容体への液相とは異なり、細胞接着受容体は、分子拘束二つの対向面をブリッジする狭い接合ギャップを横切るそのリガンドとの結合を形成します2次元(2D)インターフェース4-7の拡散。一般的に、伝統的な結合アッセイ( 例えば 、表面プラズモン共鳴またはSPR)によって測定された3次元動態とは対照的に、2D速度は、原子間力顕微鏡(AFM)8-10のような特殊な技術を用いて定量化されなければならない、チャンバ11,12を流れ、マイクロピペット13,14、光ピンセット15と生体膜力プローブ(BFP)16-21。
単に携帯凝集のための物理的結合を提供するよりも、接着分子は、その周囲と通信するセルのシグナル伝達機構の主要な構成要素です。接着分子のリガンド係合は、細胞内シグナル伝達とどのように初期信号が細胞内に伝達されるがどのように開始するかを理解する上で関心が高まっています。直感的には、受容体 - リガンド結合の性質は、それが誘導信号に影響を与えることができます。しかし、それがために、例えば 、それらの多くの制限、貧しい時間分解能と空間分解能の完全な欠如の生化学的ア ッセイの伝統的なアンサンブルを使用して外の相互作用および細胞内シグナル伝達事象の間の機械的な関係を分析することは困難です。両方の生物物理学的(2D受容体 - リガンド結合反応速度)を可能にする既存の方法とライブの生化学(シグナリング)の観察細胞は、調整可能な剛性22、エラストマーピラーアレイ23と蛍光能力24〜26を組み込んだフローチャンバー/マイクロ流体デバイスの基材が挙げられます。しかし、シグナル伝達および受容体 - リガンド結合の読み出しは、それが困難なシグナル伝達事象との結合特性の時間的、空間的な関係を分析すること、(異なる方法によって、ほとんどの場合)別途入手する必要があります。
従来のBFPは、高時空間分解能17と超力分光法です。これは、単一分子の2D速度、機械的特性およびコンフォメーション変化14,16,19-21,27-29の測定を可能にする、力センサのような可撓性赤血球(RBC)を使用します。 BFP(fBFP)系蛍光イメージングは、単一分子スケールでのシグナリング結合誘発される細胞での受容体 - リガンド結合反応速度を相関させます。この設定では、 その場での細胞内の表面mechaniのコンテキストでの活動に信号を送ります的刺激は、T-27細胞で観察されました。 fBFPは用途が広く、他のセル内の他の分子によって媒介される細胞接着およびシグナル伝達の研究のために使用することができます。
プロトコル
このプロトコルは、のガイドラインに従っており、ジョージア工科大学の人間研究倫理委員会によって承認されています。
1.ヒト赤血球の分離、ビオチン化および浸透圧の調整
注:治験審査委員会は、プロトコルを承認したとステップ1.1は、訓練を受けた医療専門家のような看護師が行ってください。
- 指穿刺から血液の8-10μL(1滴)を入手し、炭酸/重炭酸塩緩衝液1mlに追加( 表1及び2)。ゆっくり900 X gで1分間混合し、遠心分離をボルテックスまたはピペット。上清を捨て、もう一度洗浄します。
- 小さ なビーカーにビオチンPEG3500-NHSリンカー( 表1)の3.5-4 mgの重量を量ります。最終濃度を3mg / mlとするために、炭酸/重炭酸塩緩衝液中に溶解します。
- 炭酸/重炭酸塩緩衝液の171μlを、RBCパックを10μlとの1049μLをミックスビオチン-PEG3500-NHSリンカー溶液と室温で30分間インキュベートします。炭酸塩/重炭酸塩緩衝液で1回RBCを洗浄し、2回N2-5%緩衝液( 表1および2)を有します。
- 一方、5分間の底部と真空中で乾燥剤を充填したガラス製の真空デシケーター中で緩めキャップでリンカーボトルを置き、アルゴンでデシケーターを埋めます。キャップを締め、ボトルを取り出します。 -20°Cの底や店舗の乾燥剤を充填した容器にそれを置き、プラスチックパラフィンフィルム( 表1)を用いてボトルを密封します。
(インキュベーションを除くと1.3で洗う)1.2〜1.4を含むビオチンPEG3500-NHSリンカーの使用を含む手順を実行し、可能な限り高速に実行する必要があります注意してください。 - を40μg/ mlの最終濃度を作るためにN2-5%バッファにナイスタチンを希釈します。ナイスタチンの71.4μL( 表1)溶液を用いて、ビオチン化RBCの5μLを混合し、0で1時間インキュベート ° C。冷蔵庫(4℃)でN2-5%緩衝液+ 0.5%BSA( 表1)でN2-5%緩衝液および保存で二回洗浄します。
2.ガラスビーズシラン化
- ビーズ表面のクリーニング
- ガラスビーズ粉末50mgを秤量し、脱イオン水500μlの再懸濁それら。
- 50mLのビーカー中で脱イオン水9.5 mlの30%H 2 O 2( 表1)を0.5mlを混合し、次いで、濃縮NH 4 OH( 表1)を2mlを添加し、ホットプレート上でボイラにこの解決策をもたらします。
- 沸騰溶液にガラスビーズを追加し、さらに5分間沸騰を続けています。ゆっくりソリューションごとに分を渦巻きます。
- 煮沸した後、RT DI水で15ミリリットルマイクロ遠心チューブとトップアップへ〜このホットビーズ懸濁液5mlのを転送します。 5分間3,500×gで遠心し、上清を除去し、廃棄します。
- ホットビーズ懸濁液の別の5ミリリットルを転送し、洗浄したビーズに追加、再び、より多くのDI水でトップアップよく混ぜ、遠心操作します。約50mlのDI水が使用されるまで、洗浄の4〜5倍の合計となる、この手順を繰り返します。
- 1ミリリットルバイアルにビーズ懸濁液を転送します。繰り返し3回の洗浄のために5分間17000×gで遠心分離することによって、メタノール( 表1)を有するビーズ、最終的に100%のメタノール1mlで再懸濁ビーズ。
- ビーズ表面チオール化
- 50mLの遠心分離管に、懸濁液を2.1に調製した1.15ミリリットル3-メルカプトプロピルトリメトキシシラン(MPTMS)( 表1)、1mlのビーズの酢酸のメタノール45.6 mlの0.4ミリリットル( 表1)、脱イオン水1.85 mlで、追加その後、室温で3時間インキュベートします。
- 反応後、新鮮なメタノールで1回洗浄して、すべての反応物を除去し、メタノール500μlの中にビーズを再懸濁します。均等で20乾いた清潔なガラスバイアルのセットにこの濃縮ガラスビーズ懸濁液を分割スクリューキャップ。乾燥アルゴンのジェットを使用して、メタノールを蒸発し、各バイアルの側面に乾燥ビーズの薄層になるようにゆっくりとバイアルを回転させます。
- 5分間、120℃で予熱した乾燥炉にビーズのバイアルを置き、その後取り出して、すぐに緩くキャップ(複数可)を配置します。底部に乾燥剤を充填したガラス製の真空デシケーター中でバイアルを置き、冷却されるまで、真空ポンプでデシケータを真空。
- 通常の大気圧にデシケーターをもたらすために、乾燥アルゴンで真空デシケーターをパージします。デシケーターの蓋を外し、すぐにバイアルの再締めキャップ(複数可)。プラスチックパラフィンフィルムでバイアルを密封し、乾燥した暗所保存ボックスに室温で保管してください。
- すぐに使用する時には、乾燥ビーズの1つのバイアルを取り、リン酸緩衝液( 表1、表2)、4℃のリン酸緩衝液と店舗を50μlに再懸濁して1回洗浄。この濃縮ビーズ製剤は、参照されます以下の手順で「MPTMSビーズ」など。
注:適切なストレージでは、MPTMSビーズは、最大3ヶ月間機能している可能性があります。
3.ビーズ機能化
- 共有結合的にビーズ上のタンパク質をコーティング
- タンパク質株式の一定量( 例えば 、2.5μl)を取り出し、溶液1を作るために重炭酸塩/炭酸塩緩衝液の等量混合します。
注:ボリュームはストック濃度とビーズ表面上のタンパク質の所望の最終部位密度に依存します。 - 小ビーカーにMAL-PEG3500-NHSリンカー( 表1)の2-3ミリグラムを秤量し、0.231 mg / mlの最終濃度に達するように炭酸塩/重炭酸塩緩衝液とそれを溶解します。
- 3.1.2で調製したリンカー溶液を同量の溶液1を混ぜます。溶液2を製造するために室温で30分間混合物をインキュベートします。
- 一方、ガラス真空デシケーターFに緩めたキャップでリンカーボトルを置きます5分間の底部と真空中で乾燥剤でilledし、アルゴンでデシケーターを埋めます。キャップを締め、ボトルを取り出します。プラスチックパラフィンフィルムでボトルをシール、-20°Cの底や店舗の乾燥剤を充填した容器に入れてください。
(3.1.3でのインキュベーションを除く)3.1.2-3.1.4含むMAL-PEG3500-NHSリンカーの使用を含む手順を、できるだけ速く達成する必要があります注意してください。 - 解決策2でMPTMSビーズ5μLを混合し、250μlの最終容量を作るためにリン酸緩衝液( 表1)を追加します。
- 一晩室温でビーズをインキュベートし、リン酸緩衝液で3回洗浄し、4℃でリン酸緩衝液および保存液100μlに再懸濁します。
- タンパク質株式の一定量( 例えば 、2.5μl)を取り出し、溶液1を作るために重炭酸塩/炭酸塩緩衝液の等量混合します。
- タンパク質/ストレプトアビジン(SA)コーティングされたビーズの準備
- プロトコル3.1.1-3.1.4に従ってください。
- 4 mg / mlのストレプトアビジン-マレイミド(SA-MAL)( 表1の溶液2と5μlのMPTMSビーズ5μLを混ぜます)溶液、次いで250μlの最終容量を作成するためにリン酸緩衝液を加えます。
- 、RTで一晩インキュベートし、ビーズをリン酸緩衝液で3回洗浄し、最後に4℃のリン酸緩衝液および保存液100μlに再懸濁します。
- ガラスビーズ上にストレプトアビジンをコーティング
- 4 mg / mlのSA溶液5μlのMPTMSビーズ5μLを混合し、リン酸緩衝液140μlを添加します。
- 一晩室温でビーズをインキュベートし、リン酸緩衝液で3回洗浄し、4℃でリン酸緩衝液および保存液50μlに再懸濁します。
- ビオチン化タンパク質とSAコーティングしたビーズをコーティング
- タンパク質(所望のコーティング密度に応じて容量)でSAコーティングされたビーズの5μLを混合し、最終容量を100μlとすることを可能にするために、リン酸緩衝液を追加します。
- 50μlのpHをにリン酸緩衝液で3回洗浄し、再懸濁、4℃または室温で3時間、混合物を一晩インキュベートしますosphateバッファ、4℃で保存します。
4.細胞調製
注:細胞を精製するために、使用中の細胞の種類に応じた標準的な細胞精製プロトコールに従って、例えばT細胞27または特定の細胞株21,29。
- fBFP実験のために、細胞懸濁液を調製した後、FURA2-AM、2μMの最終濃度に達するRTで30分間インキュベートした後、1回洗浄する細胞懸濁液にDMSOに溶解した( 表1)を加えます。使用するまで暗所でこの蛍光ロードされた細胞懸濁液を保管してください。
5.マイクロピペットの準備及びセル室
- マイクロピペットの準備
- 長さ約3インチの短い小片にガラスカッターで切断長いキャピラリーガラスチューブ( 表1)。マイクロピペットプラー( 表1)の上にマウントワンピース、「プル」をクリックしますが、トン毛細管の中央には、機械によって加熱され、毛細管は、鋭い先端(生マイクロピペット)を有する2つの毛管を作るために2つの端部に引っ張られることになります。
注:製品のガイドラインに従うことで、生のピペットの所望の形態6〜8ミリのテーパーと0.1〜0.5μmの先端を有します。 - マイクロピペットフォージ( 表1)のピペットホルダーに生ピペットをマウントします。鍛造のガラス球を溶融するための熱。ガラス球内部の生のピペットの先端を挿入します。ガラス球を冷却し、外部からそれを破ると、球の内部にその先端を残すために、生のピペットを引き出します。希望の先端開口部が得られるまで、この手順を繰り返します。
注:マイクロピペットチップの内径の例:ビーズのためのRBC、〜1.5ミクロンのための2.0〜2.4μmであり、ハイブリドーマ細胞のためのT細胞および-7μmのための〜2-4ミクロン。
- 長さ約3インチの短い小片にガラスカッターで切断長いキャピラリーガラスチューブ( 表1)。マイクロピペットプラー( 表1)の上にマウントワンピース、「プル」をクリックしますが、トン毛細管の中央には、機械によって加熱され、毛細管は、鋭い先端(生マイクロピペット)を有する2つの毛管を作るために2つの端部に引っ張られることになります。
- セル室の構築
注:セル室は、家庭気違いに基づいて構築されています二つの金属の正方形片(銅/アルミニウム)と一緒にリンクし、ハンドル( 図1D)からなるEチャンバホルダー。 - ×11ミリメートル×0.2ミリメートル片(カバーガラス1と2)は、2つの40ミリメートルにガラスカッターを使用して40ミリメートル×22ミリメートル×0.2ミリメートルのカバーガラスをカットします。接着剤、2つの金属の正方形を橋渡しする方法で、チャンバホルダーの上面にグリスによってカバースリップ1、パラレル·カバースリップセル室( 図1D)を形成する底部側にも同様に接着剤カバーガラス2、。
- 2カバーガラスの間に実験的な緩衝液200μlを注入するために、ピペットを使用してください。バッファは、両方のカバーガラスに付着していることを確認します。静かに回転させ、バッファは、チャンバの両端に触れるようにするチャンバを振ります。
- 慎重に、それによって外気からバッファを密封実験緩衝地帯に隣接する室の両側にミネラルオイルを注入します。 (例えば、のpMHC被覆ビーズ)、赤血球およびターゲットプローブビーズの懸濁液を注入それぞれのバッファゾーンの上部中央と下の領域において(例えば、T細胞)。
6. BFP実験
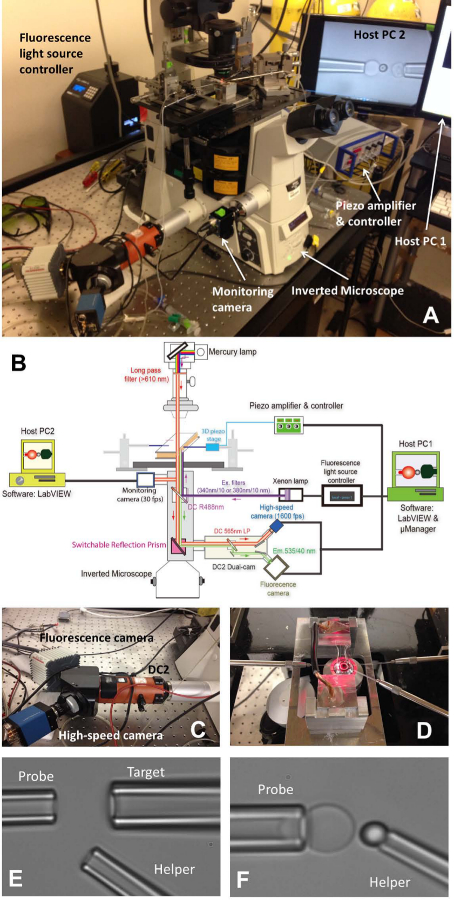
図1:fBFPアセンブリ(A)fBFPハードウェアシステムの概要絵。 (B)fBFPハードウェアシステムの概略図。 (C)ハイスピードカメラ(青)と蛍光カメラ(白)を装着し、その上にデュアルカムシステム「DC2」(オレンジ)。 (D)実験室三マイクロピペット操作システムを適応させる顕微鏡ステージ。 (EおよびF)は、実験室でのBFP設定の顕微鏡写真。 (E)マイクロピペットアセンブリピペット( 右上 )とヘルパーピペット( 低いRをターゲットに 、( 左 )プローブピペットを示しますIGHT)。 (F)プローブビーズの配置。プローブビーズをヘルパーピペットによって操作力プローブを形成するために、RBCの頂点に取り付けた。 この図の拡大版を表示するには、こちらをクリックしてください。
- 顕微鏡( 表1)および光源をオンにします。主顕微鏡ステージ( 図1A、D)に室を配置します。
- (標的細胞またはビーズ、右下つかむために:::RBC、右をつかむために、プローブビーズをつかむために、ヘルパーを。 図1D左)BFPのすべての3つのマイクロピペットをインストールします。
- 実験緩衝液でマイクロピペットを埋め戻すために、マイクロインジェクター( 表1)を使用します。ピペットホルダー( 表1)を外し、先端からの水の滴下を可能にするために、より低い場所でそれを保持します。迅速ホルダー先端にマイクロピペットを挿入し、空気の泡がマイクロピペットに入っていないことを確認してください挿入時。ホルダーのネジを締めます。
- それに対応するマイクロマニピュレータに各ピペットホルダーをマウントします。その先端は、チャンババッファ領域に入るように、チャンバーに向けてマイクロピペットを押してください。マイクロピペットの位置を調整し、顕微鏡の視野の下でそれらを見つけます。
- 三つの要素(赤血球、ターゲットとプローブビーズ)一つ一つのコロニーを見つけるために、チャンバホルダーステージの周囲に移動します。マイクロピペットのアプローチ一つの細胞/ビーズの先端をできるようにマニピュレータのノブを回すことにより、対応するマイクロピペットの位置を調整します。対応するマイクロピペット内の圧力を調整することによって、細胞/ビーズを吸引。すべての3つのマイクロピペットは、それらの対応する要素をキャプチャします。
- 離れて実験が行われる注入要素のコロニーからのオープンスペースを見つけるために、チャンバホルダーステージの周囲に移動します。 COMPに画像を可視化するために、顕微鏡ビジュアルモードを切り替えますコンピュータ画面上uterプログラム。プログラムの視野の中にピペットチップ上のすべての3つの要素を移動します。
- プローブビーズとRBCを合わせ、慎重にRBCの頂点にプローブビーズを操縦、簡単にRBCにビーズに衝突し、静かに後退。それはRBCの頂点( 図1F)に接着残されるように、静かにビーズを吹くためのヘルパーマイクロピペットの圧力を調整します。ヘルパーマイクロピペットを離れて移動し、ターゲットとプローブビーズ( 図2A)を合わせます。
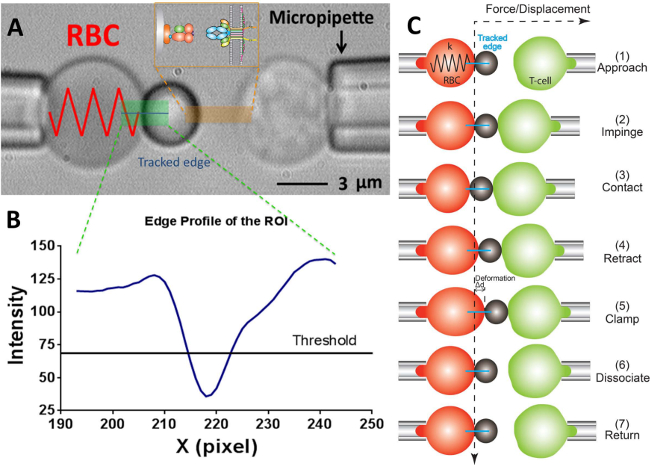
図2:それぞれpipettes.The固定力プローブにより吸引BFP方式及びそのテストサイクル(A)ビデオ顕微鏡描写力プローブ( 左 )と、標的T細胞( 右 )腫れRBCで構成され、添付しますリガンドベアリングビーズ。受容体を有しますT細胞(標的)は、プローブと反対に整列piezotranslatorに取り付けられています。 ROIは緑色で示されています。エッジトラッカーは、青色の線で表示されます。インサートはオレンジ色でマークされた領域内の2つの対向する表面上のリガンド(のpMHC、 ビード側 )と受容体(TCR、T細胞側 )の対を示しています。 (B)(A)でビーズエッジの強度プロフィール。 Xの -方向におけるROI領域はx軸(画素数)と(グレースケール値の)光強度のY -方向に沿って30ピクセルをビニングによって平均としてプロットされています。 (C)RBCのたわみやビーズの位置と力クランプアッセイの試験サイクルにおけるターゲット(T細胞)。垂直および水平の破線は、それぞれ、RBCの頂点と時間経過の零力位置を示します。 RBC変形のラインエッジトラッカーが各パネルに青色で示されています。同じまだ少ないステップは、接着周波数で採用されています(「解離」の手順を欠く)と、熱揺らぎアッセイ(「クランプ」と「解離」の手順を欠いている)アッセイ。
- プログラムでは、RBCとプローブビーズとの間の円形の接触領域(R c) が 、視野ウィンドウは、RBC(R 0)、プローブマイクロピペット(R p)のそれぞれの半径を測定するためのプログラムのツールを使用で以下の式17,30によってRBC(k)のバネ定数の推定を可能にします、
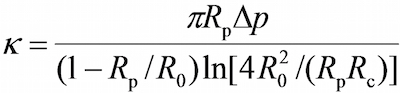
ここで、Δpはプローブのピペット先端の吸引圧力です。
注意:これは、結合力、Fは 、バネ定数とプローブビーズ(D)の変位、 すなわち、Fは= Dの積によって定量化することができるフックの法則から、以下の( 図2C)。 - プログラムに所望のRBCのバネ定数を入力します(プロトコルセクション6.6を参照してください。バネ定数は、典型的には力クランプアッセイおよび接着周波数アッセイおよび熱揺らぎアッセイのための0.1 PN / nmの0.25または0.3 PN / nmに設定されています) 、これは、水のセンチメートル単位で必要な吸引圧が返されます。必要な吸引圧力に達するまで、プローブのピペットにリンク水槽の高さを調整します。
- この線に沿って、各画素の輝度(グレースケール値)を示す隣接する窓の曲線が得られるRBCの頂点を横切る水平線を描きます。曲線( 図2A、B)の約半分の深さになるように閾値ラインをドラッグします。
注:閾値ライン下の輝度曲線上の最小点は、このように一つだけ極小値が許可され、ビーズ境界の位置を示しています。二つ以上の極小が存在する場合に、それを画像は(原因焦点外れている画像、またはプローブビーズとRBC間のアライメント不良の可能性が高い)、最適ではないことを示します。 - 熱揺らぎアッセイ、接着周波数アッセイまたは力クランプアッセイ:目的の実験モードを選択します。 (力クランプアッセイのために力= 20 pNのを(クランプ例えば 、衝突力= 15 PN、ロード率=千のPN /秒、接触時間= 1秒)、など)を必要に応じて、パラメータを設定します。
- とプローブとの接触のうち(詳細については、代表的な結果のセクションを参照)で、目標ピペットを移動させ、ターゲットを駆動するためのプログラムを可能にする「スタート」をクリックします。データ収集は、リアルタイムでプローブビーズの位置を記録する、並列に実行されます。ウィンドウは、取得したデータを保存できるように飛び出しますその時にボタン「停止実験」、をクリックしてプログラムを停止します。
7.蛍光BFP(fBFP)実験
- fluoreを使用するにはBFPシステムのscence機能は、別のプログラム( 表1)によって制御される励起光源( 表1)及び蛍光カメラ( 表1)をオンにします。プログラムでは、 などのゲイン、露出、励起チャンネル(この場合は、340 nmおよび380 nmの光)を含む蛍光イメージングのためのパラメータを、選択します。 340 nm以下380 nmの励起光により励起された標的細胞のライブの蛍光画像の可視化を可能にするプローブと標的を揃えるなど、BFP実験プロトコル内のすべての準備を、従ってください。
- おおよそ部領域は、その中の細胞は、全記録期間中に滞在するために切片化ツールを使用します。
注:により接近接触後退サイクルの使用、細胞は、このように区分領域が細胞自体よりもはるかに大きい、繰り返し前後に移動するであろう。 - 340 nmのANを可能にするために、「録音」をクリックしますD 380 nmの交互に細胞内蛍光色素(FURA2)を励起する光、および対応する蛍光画像のペアが交互に約1秒ごとに記録されます。同時に分析分子間相互作用および細胞内カルシウムシグナル伝達を監視するための蛍光イメージング実験のためBFP実験を開始したプログラムで、「スタート」をクリックしてください。システムは、受容体-リガンド結合のための生データファイル(以下の図6Aを参照)、カルシウム信号の.TIFFフォーマットにおける蛍光一連の画像を生成します。
8.データ解析
- BFPデータ解析
- 接着周波数アッセイのためのデータ分析
- 順次、各サイクルの「力対時間」信号を検査し、単に接着イベントを含有するサイクルとそうでない記録し、平均接着周波数を得るためにまとめたものです。
- 各接着イベントの破壊力を収集し、そのボンド破裂する前に直線的に傾斜した力のピーク値があります。ランプ速度の範囲内で破断力の十分な量を収集した後、力依存オフ速度受容体-リガンドの解離は、動的力分光分析18,31を用いて導出されたそれぞれのランプ速度で破断力配分を導出します。
- 熱揺らぎアッセイのためのデータ分析
- 順次可能性多重結合の会合および解離事象を含む各サイクルのクランプ位相信号を検査します。結合するので、結合の会合および解離事象を区別するためのガイドとして「力対時間」信号にクランプ相熱揺らぎレベル(ビード位置の70シーケンシャル時点のスライド区間の平均値、標準偏差)を使用します形成は、熱揺らぎの減少に対応しています。
- 結合解離の瞬間から間隔を指定します(ときTHERMAL変動は時間を待っているように、次の結合形成の瞬間に)正常レベルに再開し、両方のデータ検査の間に収集された結合寿命などの解離への関連付けから債券の期間を指定します。それぞれゼロ力16,30の下でオフ速度のオン率の逆数とそれを反映する、平均待ち時間と平均結合寿命を計算します。
- 力クランプアッセイのためのデータ分析
- 一つは、累積寿命曲線を描くことができますシーケンス番号だけでなく、開始時刻と終了時刻との平均力と結合寿命を含むすべての生涯のイベントのレコード·パラメータ(例えば、 図6(c)、黄色の曲線)。
- 力の範囲の下で生涯のイベントの十分な量を収集します。各力のビンの平均寿命を生産し、完全に「平均寿命対が得られる別の力ビンにグループ化し、。力」曲線( 図4)。
- 接着周波数アッセイのためのデータ分析
- カルシウム蛍光イメージングデータ解析
- 蛍光画像は、バックグラウンドノイズなしの両方の340nmおよび380nmのチャネルでセルの明確な輪郭を示すまで、強度閾値を調整する( 図5A、B)。次に、対「正規化のCa 2+強度を生成するために、340nmの/ 380 nmでの強度比に基づいて導出された輝度レベル( 図6B)を示す擬似カラーでフレームによって細胞内Ca 2+シグナルのフレームを確認。時間」曲線( 図6C)。秒単位での蛍光レベルの第二を表示するムービーを生成するために疑似カラー蛍光画像を使用してください。
結果
BFP技術は1995 17エバンス研究所によって開発された。このpicoforceツールは広く、そのリガンド16,19,20と相互作用する接着分子の二次元の動態を解析するように、表面上に固定化されたタンパク質の相互作用を測定するために使用されています30、分子21,29弾性を測定するため、およびタンパク質コンホメーション変化21を決定します。 fBF...
ディスカッション
成功fBFP実験は、いくつかの重要な考慮事項を必要とします。まず、力計算のために、マイクロピペット、RBC信頼性があるとし、プローブビーズはできるだけ同軸の近くに位置合わせされるべきです。 RBCとピペットとの間の摩擦が無視できるように、ピペット内のRBCの突起は、約1プローブピペット径でなければなりません。典型的なヒトRBCのために、最適なピペットの直径は、式1 17,30
開示事項
The authors have nothing to disclose.
謝辞
Research related to this paper and the development of the fBFP technology in the Zhu lab were supported by NIH grants AI044902, AI077343, AI038282, HL093723, HL091020, GM096187, and TW008753. We thank Evan Evans for inventing this empowering experimental tool, and members of the Evans lab, Andrew Leung, Koji Kinoshita, Wesley Wong, and Ken Halvorsen, for helping us to build the BFP. We also thank other Zhu lab members, Fang Kong, Chenghao Ge and Kaitao Li, for their helps in the instrumentation development.
資料
| Name | Company | Catalog Number | Comments |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4 • H2O) | Sigma-Aldrich | S9638 | Phosphate buffer preparation |
| Anhy. Sodium Phosphate Dibasic (Na2HPO4) | Sigma-Aldrich | S7907 | Phosphate buffer preparation |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation |
| Sodium chloride (NaCl) | Sigma-Aldrich | S7653 | N2-5% buffer preparation |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | N2-5% buffer preparation |
| Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P5655 | N2-5% buffer preparation |
| Sucrose | Sigma-Aldrich | S0389 | N2-5% buffer preparation |
| MAL-PEG3500-NHS | JenKem | A5002-1 | Bead functionalization |
| Biotin-PEG3500-NHS | JenKem | A5026-1 | RBC biotinylation |
| Nystatin | Sigma-Aldrich | N6261 | RBC osmolarity adjustment |
| Ammonium Hydroxide (NH4OH) | Sigma-Aldrich | A-6899 | Glass bead silanization |
| Methanol | BDH | 67-56-1 | Glass bead silanization |
| 30% Hydrogen Peroxide (H2O2) | J. T. Barker | Jan-86 | Glass bead silanization |
| Acetic Acid (Glacial) | Sigma-Aldrich | ARK2183 | Glass bead silanization |
| 3-Mercaptopropyltrimethoxysilane (MPTMS) | Uct Specialties, llc | 4420-74-0 | Glass bead functionalization |
| Borosilicate Glass beads | Distrilab Particle Technology | 9002 | Glass bead functionalization |
| Streptavidin−Maleimide | Sigma-Aldrich | S9415 | Glass bead functionalization |
| BSA | Sigma-Aldrich | A0336 | Ligand functionalizing |
| Fura2-AM | Life Technologies | F-1201 | Intracellular calcium fluorescence dye loading |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | Intracellular calcium fluorescence dye loading |
| Quantibrite PE Beads | BD Biosciences | 340495 | Density quantification |
| Flow Cytometer | BD Biosciences | BD LSR II | Density quantification |
| Capillary Tube 0.7-1.0 mm x 30 inches | Kimble Chase | 46485-1 | Micropipette making |
| Flaming/Brown Micropipette Puller | sutter instrument | P-97 | Micropipette making |
| Pipette microforce | Narishige | MF-900 | Micropipette making |
| Mineral Oil | Fisher Scientific | BP2629-1 | Chamber assembly |
| Microscope Cover Glass | Fisher Scientific | 12-544-G | Chamber assembly |
| Micro-injector | World Precision Instruments | MF34G-5 | Chamber assembly |
| 1 ml syringe | BD | 309602 | chamber assembly |
| Micropipette holder | Narishige | HI-7 | Chamber assembly |
| Home-designed mechanical parts and adaptors fabrications using CNC machining. | Biophysics Instrument | All parts are customized according to the CAD designs. | BFP system |
| Microscope (TiE inverted) | Nikon | MEA53100 | BFP system |
| Objective CFI Plan Fluor 40x (NA 0.75, WD 0.72 mm, Spg) | Nikon | MRH00401 | BFP system |
| Camera, GE680, 640 x 480, GigE, 1/3" CCD, mono | Graftek Imaging | 02-2020C | BFP system |
| Prosilica GC1290 - ICX445, 1/3", C-Mount, 1280 x 960, Mono., CCD, 12 Bit ADC | Graftek Imaging | 02-2185A | BFP system |
| Manual submicron probehead with high resolution remote control | Karl Suss | PH400 | BFP system |
| Anti-vibration table (5’ x 3’) | TMC | 77049089 | BFP system |
| 3D manual translational stage | Newport | 462-XYZ-M | |
| SolidWorks 3D CAD software | SOLIDWORKS Corp. | Version 2012 SP5 | BFP system |
| LabVIEW software | National Instruments | Version 2009 | BFP system, BFP program |
| 3D piezo translational stage | Physik Instrumente | M-105.3P | BFP system |
| Linear piezo accuator | Physik Instrumente | P-753.1CD | BFP system |
| Micromanager software | Version 1.4 | fBFP system, fluorescence imaging program | |
| Dual Cam (DC-2) | Photometrics | 77054724 | fBFP system |
| Dual Cam emission filter (T565LPXR) | Photometrics | 77054725 | fBFP system |
| Fluorescence Camera | Hamamatsu | ORCA-R2 C10600-10B | fBFP system |
| Plastic paraffin film (Parafilm) | Bemis Company, Inc | PM996 | bottle sealing |
| Carbonate/bicarbonate buffer (pH 8.5) | 8.4 g/L sodium carbonate (Na2CO3), 10.6 g/L sodium bicarbonate (NaHCO3) | ||
| Phosphate buffer (pH 6.5-6.8) | 27.6 g/L NaPhosphate monobasic (NaH2PO4 • H2O), 28.4 g/L Anhy. NaPhosphate dibasic (Na2HPO4) | ||
| N2-5% buffer (pH 7.2) | 20.77 g/L potassium chloride (KCl), 2.38 g/L sodium chloride (NaCl), 0.13 g/L potassium phosphate monobasic (KH2PO4), 0.71 g/L anhy. sodium phosphate dibasic (Na2HPO4), 9.70 g/L sucrose |
参考文献
- Aplin, A. E., Howe, A., Alahari, S. K., Juliano, R. L. Signal transduction and signal modulation by cell adhesion receptors: the role of integrins, cadherins, immunoglobulin-cell adhesion molecules, and selectins. Pharmacological reviews. 50, 197-263 (1998).
- Davis, M. M., Bjorkman, P. J. T-cell antigen receptor genes and T-cell recognition. Nature. 334, 395-402 (1988).
- Dado, D., Sagi, M., Levenberg, S., Zemel, A. Mechanical control of stem cell differentiation. Regenerative medicine. 7, 101-116 (2012).
- Edwards, L. J., Zarnitsyna, V. I., Hood, J. D., Evavold, B. D., Zhu, C. Insights into T cell recognition of antigen: significance of two-dimensional kinetic parameters. Frontiers in immunology. 3, 86 (2012).
- Zhu, C., Jiang, N., Huang, J., Zarnitsyna, V. I., Evavold, B. D. Insights from in situ analysis of TCR-pMHC recognition: response of an interaction network. Immunological reviews. 251, 49-64 (2013).
- Huang, J., Meyer, C., Zhu, C. T. T cell antigen recognition at the cell membrane. Molecular immunology. 52, 155-164 (2012).
- Zarnitsyna, V., Zhu, C. T. T cell triggering: insights from 2D kinetics analysis of molecular interactions. Physical biology. 9, 045005 (2012).
- Binnig, G., Quate, C. F., Gerber, C. Atomic Force Microscope. Physical Review Letters. 56, 930-933 (1986).
- Marshall, B. T., et al. Direct observation of catch bonds involving cell-adhesion molecules. Nature. 423, 190-193 (2003).
- Kong, F., Garcia, A. J., Mould, A. P., Humphries, M. J., Zhu, C. Demonstration of catch bonds between an integrin and its ligand. The Journal of cell biology. 185, 1275-1284 (2009).
- Yago, T., et al. Catch bonds govern adhesion through L-selectin at threshold shear. The Journal of cell biology. 166, 913-923 (2004).
- Yago, T., et al. Platelet glycoprotein Ibalpha forms catch bonds with human WT vWF but not with type 2B von Willebrand disease vWF. The Journal of clinical investigation. 118, 3195-3207 (2008).
- Chesla, S. E., Selvaraj, P., Zhu, C. Measuring two-dimensional receptor-ligand binding kinetics by micropipette. Biophysical journal. 75, 1553-1572 (1998).
- Huang, J., et al. The kinetics of two-dimensional TCR and pMHC interactions determine T-cell responsiveness. Nature. 464, 932-936 (2010).
- Heinrich, V., Wong, W. P., Halvorsen, K., Evans, E. Imaging biomolecular interactions by fast three-dimensional tracking of laser-confined carrier particles. Langmuir : the ACS journal of surfaces and colloids. 24, 1194-1203 (2008).
- Chen, W., Evans, E. A., McEver, R. P., Zhu, C. Monitoring receptor-ligand interactions between surfaces by thermal fluctuations. Biophysical journal. 94, 694-701 (2008).
- Evans, E., Ritchie, K., Merkel, R. Sensitive force technique to probe molecular adhesion and structural linkages at biological interfaces. Biophysical. 68, 2580-2587 (1995).
- Evans, E., Leung, A., Heinrich, V., Zhu, C. Mechanical switching and coupling between two dissociation pathways in a P-selectin adhesion bond. Proceedings of the National Academy of Sciences of the United States of America. 101, 11281-11286 (2004).
- Ju, L., Dong, J. -. f., Cruz, M. A., Zhu, C. The N-terminal Flanking Region of the A1 Domain Regulates the Force-dependent Binding of von Willebrand Factor to Platelet Glycoprotein Ib. Journal of Biological Chemistry. 288, (2013).
- Chen, W., Lou, J., Zhu, C. Forcing switch from short- to intermediate- and long-lived states of the alphaA domain generates LFA-1/ICAM-1 catch bonds. The Journal of biological chemistry. 285, 35967-35978 (2010).
- Chen, W., Lou, J., Evans, E. A., Zhu, C. Observing force-regulated conformational changes and ligand dissociation from a single integrin on cells. The Journal of cell biology. 199, 497-512 (2012).
- Judokusumo, E., Tabdanov, E., Kumari, S., Dustin, M. L., Kam, L. C. Mechanosensing in T lymphocyte activation. Biophysical journal. 102, L5-L7 (2012).
- Bashour, K. T., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences of the United States of America. 111, 2241-2246 (2014).
- Nesbitt, W. S., et al. Distinct glycoprotein Ib/V/IX and integrin alpha IIbbeta 3-dependent calcium signals cooperatively regulate platelet adhesion under flow. The Journal of biological chemistry. 277, 2965-2972 (2002).
- Mazzucato, M., Pradella, P., Cozzi, M. R., De Marco, L., Ruggeri, Z. M. Sequential cytoplasmic calcium signals in a 2-stage platelet activation process induced by the glycoprotein Ibalpha mechanoreceptor. Blood. 100, 2793-2800 (2002).
- Lefort, C. T., Ley, K. Neutrophil arrest by LFA-1 activation. Frontiers in immunology. 3, 157 (2012).
- Liu, B., Chen, W., Evavold, B. D., Zhu, C. Accumulation of dynamic catch bonds between TCR and agonist peptide-MHC triggers T cell signaling. Cell. 157, 357-368 (2014).
- Lou, J., et al. Flow-enhanced adhesion regulated by a selectin interdomain hinge. The Journal of cell biology. 174, 1107-1117 (2006).
- Fiore, V. F., Ju, L., Chen, Y., Zhu, C., Barker, T. H. Dynamic catch of a Thy-1-alpha5beta1+syndecan-4 trimolecular complex. Nature communications. 5, 4886 (2014).
- Chen, W., Zarnitsyna, V. I., Sarangapani, K. K., Huang, J., Zhu, C. Measuring Receptor-Ligand Binding Kinetics on Cell Surfaces: From Adhesion Frequency to Thermal Fluctuation Methods. Cellular and molecular bioengineering. 1, 276-288 (2008).
- Marshall, B. T., Sarangapani, K. K., Lou, J., McEver, R. P., Zhu, C. Force history dependence of receptor-ligand dissociation. Biophysical. 88, 1458-1466 (2005).
- Xiang, X., et al. Structural basis and kinetics of force-induced conformational changes of an alphaA domain-containing integrin. PloS one. 6, e27946 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved