A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام رامزي الفحص لقياس إفراز السوائل وايون الجريان الاسعار في
In This Article
Summary
يصف هذا البروتوكول استخدام فحص رامزي لقياس معدلات إفراز السوائل من معزولة مالبيغي (الكلى) الأنابيب من ذبابة الفاكهة السوداء البطن. وبالإضافة إلى ذلك، فإن استخدام أقطاب أيون محددة لقياس تركيزات الصوديوم والبوتاسيوم في السائل يفرز، مما يتيح حساب تدفق بطريق الظهارة أيون، يوصف.
Abstract
تعديل الكلوي النقل أيون الظهارية يسمح الكائنات الحية للحفاظ على التوازن الأيوني والاسموزي في مواجهة الظروف الخارجية متفاوتة. يقدم ذبابة الفاكهة السوداء البطن مالبيغي (الكلى) أنبوب صغير فرصة لا مثيل لها لدراسة الآليات الجزيئية لنقل أيون الظهارية، وذلك بسبب الوراثة قوية من هذا الحي وسهولة الحصول على الأنابيب في الكلى لدراسة فسيولوجية. هنا، نحن تصف استخدام فحص رامزي لقياس معدلات إفراز السوائل من ذبابة معزولة الأنابيب الكلوية، مع استخدام أقطاب أيون محددة لقياس تركيزات الصوديوم والبوتاسيوم في السائل المفرز. يسمح هذا الاختبار دراسة السوائل بطريق الظهارة والأيونات تدفقات ~ 20 الأنابيب في كل مرة، دون الحاجة لنقل السوائل تفرز لجهاز منفصل لقياس تركيزات أيون. وراثيا الأنابيب متميزة يمكن تحليلها لتقييم دور جينات معينة في عمليات النقل. بالإضافة إلى ذلك، بيمكن تعديل athing المالحة لدراسة آثار خصائصه الكيميائية، أو المخدرات أو الهرمونات المضافة. باختصار، هذه التقنية تسمح للالتوصيف الجزيئي من الآليات الأساسية للنقل الظهارية أيون في أنبوب صغير ذبابة الفاكهة، فضلا عن تنظيم آليات النقل هذه.
Introduction
الكلوي النقل أيون الظهارية راء iono- العضوي، التنظيم الاسموزي. يقدم ذبابة الفاكهة السوداء البطن مالبيغي (الكلى) أنبوب صغير فرصة لا مثيل لها لدراسة الآليات الجزيئية لنقل أيون الظهارية. ويرجع ذلك إلى مزيج من الوراثة قوية من ذبابة الفاكهة، وإرفاقها مع إمكانية الوصول إلى الأنابيب الكلوية لها لدراسة فسيولوجية هذا. فحص رامزي، الذي سمي على اسم المحقق الذي كان رائدا في تقنية 1، يقيس معدلات إفراز السوائل من الأنابيب مالبيغي معزولة، وتأسست في ذبابة الفاكهة في عام 1994 من قبل شركة داو وزملاؤه 2. هذا مهد الطريق لمزيد من الدراسات باستخدام ذبابة الفاكهة الأدوات الوراثية، مثل نظام GAL4-UAS 3،4، لتحديد مسارات الإشارات خلية محددة تنظم إفراز السوائل. ويشمل على سبيل المثال يشير الكالسيوم في استجابة لهرمون الببتيد 5، وغيرها الكثير 6،7.
وقد أظهرت ve_content "> مزيج من التقنيات الوراثية ودراسة فسيولوجية الكلاسيكية التي الجيل البول في حدوث الطاير من خلال إفراز البوتاسيوم كلوريد الغنية السوائل من الجزء الرئيسي من أنبوب صغير. وهذا يحدث من خلال إفراز بطريق الظهارة مواز من الكاتيونات، في المقام الأول K + ولكن أيضا نا +، من خلال الخلية الأساسية، والكلورين - إفراز من خلال الخلايا النجمية 8-12 القدرة على قياس حدة بطريق الظهارة K + والصوديوم + تدفقات يسمح توصيف أكثر تفصيلا لآليات النقل من قياس إفراز السوائل وحده. على سبيل المثال، في الأنابيب ذبابة الفاكهة unstimulated، نا + / K + إطعام الفئران المانع ابائين ليس له تأثير على إفراز السوائل 2، حتى عندما يتم تثبيط امتصاص حيز الخلايا الرئيسية التي العضوية نقل أنيون المانع توروكولات 13. ومع ذلك، لينتون و أظهر أودونيل أن ابائين depolarizesإمكانات غشاء basolateral، ويزيد نا + تدفق 9. كما هو مبين في ممثل النتائج، ونحن تكرار هذه النتائج، وأظهرت أن K + تدفق هو انخفضت بصورة متزامنة 14؛ زيادة نا + التمويه وانخفض K + تدفق لها آثار معارضة على إفراز السوائل، مما أدى إلى عدم التغير الصافي في إفراز. وبالتالي، هناك قرارين ل"مفارقة ابائين"، أي مراقبة الأولية التي ابائين له أي تأثير على إفراز السائل في أنبوب صغير ذبابة الفاكهة: أولا، في الأنابيب حفز، وتأثير ابائين على إفراز السوائل غير واضح نظرا ل امتصاص من قبل الناقل أنيون العضوية 13؛ وثانيا، في الأنابيب unstimulated، ابائين ومعارضة الآثار على بطريق الظهارة نا + K + والتمويه، مما أدى إلى عدم التغير الصافي في إفراز السائل (انظر ممثل النتائج والمرجع 9). ولذلك، فإن الدور الرئيسي للنا + / K + -ATPبورصة عمان في الأنابيب unstimulated هو خفض داخل الخلايا نا + تركيز لتوليد التدرج تركيز مواتية لنا + -coupled عمليات النقل عبر الغشاء basolateral. في الواقع، عن طريق قياس حدة نا + وK + التدفقات، أثبتنا أن الأنابيب التي تفتقر إلى cotransporter ذبابة الصوديوم والبوتاسيوم-2-كلوريد (NKCC) قد انخفضت K بطريق الظهارة + التمويه، مع عدم وجود مزيد من الانخفاض بعد ابائين بالإضافة إلى ذلك، وأي تغيير في بطريق الظهارة غ + تدفق 14. وأيدت هذه النتائج استنتاجنا أن نا + دخول الخلية من خلال NKCC يتم إعادة تدويرها من خلال نا + / K + إطعام الفئران. وفي مثال آخر، Ianowski وآخرون. لاحظ أن خفض حمام K + تركيز من 10 ملم إلى 6 ملم انخفض بطريق الظهارة K + تدفق وزيادة بطريق الظهارة نا + تدفق في الأنابيب من الرادنة prolixus، مع عدم وجود صافي التغير في إفراز السوائل 15. كما لوحظت آثار تفاضلية على نا + التمويه وK + تدفق عبر الأنابيب اليرقات في الأنابيب ذبابة الفاكهة ردا على متفاوتة حمية الملح 16 و في نوعين من أنواع البعوض ردا على تربية ملوحة 17.التحدي الأكبر في قياس تدفق بطريق الظهارة أيون في إعداد مقايسة رامزي هو تحديد تركيزات الأيونات داخل السائل المفرز. وقد اجتمع هذا التحدي مع حلول مختلفة، بما في ذلك اللهب photometery 18، واستخدام أيونات المشعة 19، والإلكترون التحقيق الطول الموجي التحليل الطيفي والتشتت 20. هذه التقنيات تتطلب نقل قطرة السائل يفرز إلى أداة لقياس تركيزات أيون. منذ حجم السوائل التي يفرزها ذبابة الفاكهة أنبوب صغير unstimulated صغيرة، وعادة ~ 0.5 NL / دقيقة، وهذا يشكل تحديا تقنيا وأيضا يقدم الخطأ إذا كان بعض من السائل يفرز هوفقدت عند نقله. في المقابل، فإن استخدام أقطاب أيون محددة يسمح بقياس نشاط أيون (من الذي يمكن حساب تركيز أيون) في الموقع. تم تعديل البروتوكول الحالي من تلك المستخدمة من قبل Maddrell والزملاء لقياس بطريق الظهارة K + تدفق عبر أنبوب صغير الرادنة باستخدام valinomycin باسم K + حامل الأيون 21، ويصف أيضا استخدام -butylcalix 4- ثالثي [4]، دآرين tetraacetic حمض رابع إيثيل نا القائم على استر + -specific القطب أيون محددة تتميز Messerli وآخرون. آل 22. كما تم استخدام أقطاب أيون محددة لقياس تركيزات الأيونات في السوائل التي يفرزها الأنابيب مالبيغي في فحص رامزي في الكبار 9،23 واليرقات 16 ذبابة الفاكهة السوداء البطن، ونيوزيلندا جبال الألب يتا (Hemideina الماوري) 24 و 17 في البعوض.
هنا، نحن تصف بالتفصيل استخدام رامزي كماأقول لقياس معدلات إفراز السوائل في الأنابيب مالبيغي من ذبابة الفاكهة، فضلا عن استخدام أقطاب أيون محددة لتحديد تركيزات K + و + نا داخل السائل المفرز وبالتالي احتساب التدفقات بطريق الظهارة أيون. وتقدم لمحة عامة عن الفحص في الشكل 1.

الشكل 1. تخطيطي لمالبيغي الأنابيب الصغيرة والفحص رامزي مع استخدام ايون محددة أقطاب لقياس تركيزات الأيونات. ويوضح هذا الرقم الإعداد لفحص رامزي. (A) كل ذبابة أربعة الأنابيب، وزوج من الأنابيب الأمامية وزوج من الأنابيب الخلفية، التي تطفو في تجويف البطن وتحيط بها الدملمف. في كل زوج، والأنابيب اثنين من الانضمام في الحالب، والتي ثم يفرغ البول عند تقاطع المعي المتوسط وhindguت. الأنابيب عمياء العضوية. يتم إنشاء البول عن طريق القطاع الرئيسي إفراز السائل (كما هو موضح باللون الأحمر)، ويتدفق نحو الحالب والخروج إلى الأمعاء. بعد تشريح، وفصل الزوج أنبوب صغير من الأمعاء عن طريق transecting الحالب. (B) ثم يتم نقل زوج من الأنابيب إلى قطرة من الاستحمام المالحة داخل بئر للطبق الفحص. واحدة من الأنابيب اثنين، المشار إليها هنا باسم "مرساة أنبوبية،" هو التفاف حول مسمار معدني وغير خامل. نبيب الآخر هو أنبوب صغير إفراز. يبقى الجزء الأول (الذي لا تفرز السائل) والجزء الرئيسي من أنبوب صغير إفراز داخل قطرة من الاستحمام المالحة. الأيونات وتحرك المياه المالحة من الاستحمام وداخل تجويف أنبوب صغير من الجزء الرئيسي، ومن ثم تتحرك نحو الحالب، كما يمكن أن تحدث في الجسم الحي. الجزء السفلي (الأزرق) هو خارج المالحة الاستحمام، وبالتالي خاملة. منذ يتم قطع الحالب، السائل يفرز كما يظهر قطرات من نهاية قطع من الحالب. تانه يفرز السائل قطرات يوسع على مر الزمن مع استمرار إفراز، ويتم قياس قطرها باستخدام ميكرومتر بصري. هناك طبقة من الزيت المعدني يمنع تبخر السوائل تفرز. الأقطاب محددة المرجعية وأيون قياس تركيز أيون السائل المفرز. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. إعداد تشريح والمعايرة والفحص أطباق
ملاحظة: في هذه الخطوة، تم إعداد ثلاثة أطباق بتري البلاستيكية اصطف مع سيليكون المطاط الصناعي: واحد للتشريح، واحدة لأداء الفحص رامزي ("طبق فحص")، واحد لأداء المعايرة. وهذه الأطباق إعادة استخدامها من تجربة إلى تجربة، وبالتالي هذه الخطوة يحتاج فقط إلى أن تتكرر إذا فواصل الطبق. ويظهر صورة لطبق فحص في الشكل 2.
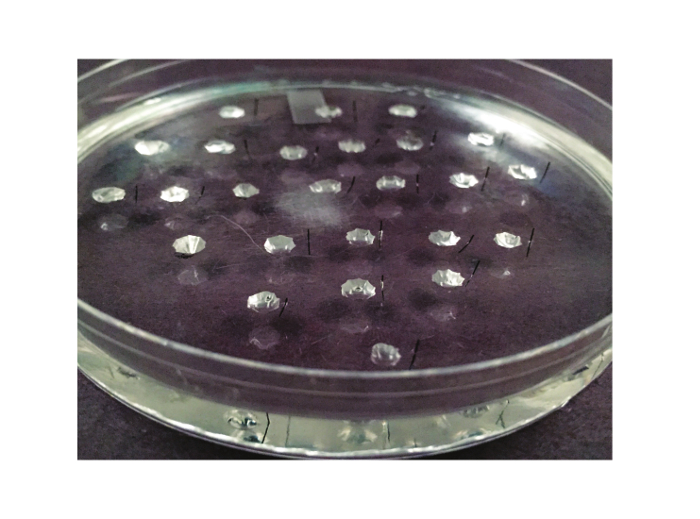
الشكل 2. طبق الفحص. ويرد الطبق المستخدمة في فحص رامزي هنا. فمن طبق بتري 10 سم الذي اصطف مع سيليكون المطاط الصناعي. نحتت بين 20 و 25 بئرا من المطاط الصناعي. A مسمار معدني Minutien، وقطع في نصف، يتم وضعها على يمين كل بئر (أو إلى اليسار، وإذا أعسر مجرب).TPS: //www.jove.com/files/ftp_upload/53144/53144fig2large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- استخدام قفازات، صب ~ 80 ز سيليكون قاعدة المطاط الصناعي في دورق زجاجي. إضافة 1/10 الوزن (8 ز) سيليكون المطاط الصناعي علاج. اثارة مع النمام المعدنية. وضع على شاكر المداري مع كبار شقة بسرعة لطيف، على سبيل المثال 100 دورة في الدقيقة، لعدة ساعات حتى يتم إزالة جميع الفقاعات.
- صب المطاط الصناعي السيليكون في أطباق بتري بلاستيكية نظيفة: 100 مم × 15 مم أطباق للتشريح وفحص الأطباق، و 35 × 10 مم للطبق المعايرة. يجب أن يكون سمك طبقة المطاط الصناعي ~ 6-7 ملم للاطباق 100 ملم، و~ 5 مم لل35 مم طبق.
- وضع الأطباق على مقاعد البدلاء في درجة حرارة الغرفة (RT) لعلاج (تصلب)، ~ 24-48 ساعة.
- مرة واحدة وقد شفي الطبق الفحص، وإعداد دفعة صغيرة من السيليكون والمطاط الصناعي كما في الخطوة 1.1، على سبيل المثال، 10 غرام سيليكون قاعدة المطاط الصناعي مع 1 غرام علاج. هزة على المدارشاكر كما في الخطوة 1.1 حتى فقاعات الهواء لم تعد موجودة. وسوف تستخدم هذه المطاط الصناعي في الخطوة 1.5.4 وينبغي عدم السماح لتتصلب قبل هذه الخطوة.
- باستخدام مشرط جراحي والاحتياطات القياسية الأدوات الحادة، وجعل الآبار في واحدة من 100 ملم أطباق بتري المغلفة المطاط الصناعي من السيليكون. وسوف يكون هذا الطبق الفحص.
- جعل الآبار ~ 1 سم، وبصرف النظر بقطر ~ 3-4 ملم. يمكن 25 بئرا تناسب بسهولة في طبق فحص 100 ملم. آبار ينبغي أن يكون لا يقل عن 6 مم إزالتها من على جدران صحن الشكل 2 يوضح التباعد من الآبار. وسيتضمن كل بئر واحدة أنبوب صغير إفراز السوائل أثناء التجربة. وبالتالي، فإن صحن يحتوي على 25 بئرا تسمح 25 الأنابيب ليتم تحليلها.
- استخدام علامة دائمة بمناسبة موقف الآبار إذا لزم الأمر.
- جعل جدران البئر بأكبر قدر من السلاسة من خلال وضع مشرط في المطاط الصناعي، ومن ثم استخدام الجانب المعاكس لتدوير الطبق 360 درجة.
- ثم، وذلك باستخدام شاء القياسية RPS الاحتياطات، وتراجع 30 G الإبرة في المطاط الصناعي غير صلابة من الخطوة 1.4 و وضع قطرة صغيرة في الجزء السفلي من كل بئر. هذا متجانسة من أسفل البئر. السماح لعلاج (تصلب) × 24-48 ساعة.
- إعداد دبابيس Minutien.
- ضع 0.15 ملم أسود بأكسيد دبابيس Minutien في صف واحد على قطعة من 1 بوصة مختبر القياسية الشريط وضع العلامات. وينبغي أن يكون محور دبابيس "الطويل متعامد على محور الشريط الطويل. قص الشريط على طوله من أجل قطع كل طرف إلى نصفين متساويين تقريبا (الشكل 3). استخدام نصف دبوس لكل بئر.

الشكل 3. قص الدبابيس Minutien. تصطف دبابيس حتى على قطعة من الشريط وضع العلامات في نفس الوقت. ثم، يتم استخدام مقص لقطع من المسامير في النصف.ge.jpg مرحبا "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- إدراج كل دبوس نصف في المطاط الصناعي السيليكون حوالي 1 ملم إلى حق كل بئر (إذا كان اليد اليمنى؛ وإذا أعسر، إدراج دبوس إلى اليسار من كل جانب). ويتم ذلك بسهولة أكثر عندما تصور الآبار في انخفاض القوة تحت stereomicroscope تشريح وبمساعدة من استخدام الملقط حادة الشكل 2 يوضح المواقع من الدبابيس.
2. إعداد الجميلة زجاج قضبان
ملاحظة: في هذه الخطوة، يتم إعداد قضيب الزجاج التي سيتم استخدامها لنقل الأنابيب من الطبق تشريح في انخفاض الاستحمام. إعادة استخدامها قضيب الزجاج من تجربة إلى تجربة، حتى يتم تنفيذ هذه الخطوة مرة واحدة فقط ما لم يلزم فواصل قضيب واحدة جديدة.
- الحصول على ورقة من 3 مم (1/8 بوصة) الزجاج الأسود الملون سميكة من متجر هواية والزجاج المناسبالقطع المعدنية المعدات، مثل قطع الزجاج وكماشة. استخدام معدات السلامة المناسبة (قفازات سميكة، نظارات).
- قطع الزجاج إلى شرائح ~ 6 مم × 10 سنتيمترا
- عقد قطاع الزجاج في كل يد. تنعيم نهاية قصيرة من كل قطاع على شعلة الموقد بنسن، وذلك باستخدام احتياطات السلامة المناسبة. ثم، ودفع نهايات شرائط اثنين معا ومزق في الحركة السلسة لخلق قضيب الزجاج على ما يرام مع مقبض.
3. إعداد فسيولوجيا
ملاحظة: في هذه الخطوة، المجهر، يتم تعيين الدائرة الكهربية والكهربائية يصل. بخلاف الدوري إعادة chloriding (الخطوة 3.2) من أسلاك الفضة وإعادة معايرة للالكهربية (الخطوة 3.8)، يتم تنفيذ هذه الخطوة مرة واحدة فقط. الشكل 4 يوضح الإعداد.

الرقم 4. إعداد علم وظائف الأعضاء. هو صورة الإعداد علم وظائف الأعضاء هنا. (A) نظرة عامة حول الإعداد. يتم وضع stereomicroscope داخل قفص فاراداي مع micromanipulators على أي من الجانبين. هي الخيوط والألياف البصرية ضوء من خلال ثقب في جانب من قفص فاراداي. يتم وضع الكهربية خارج قفص فاراداي. (B) إلى كلوريد معطف الأسلاك الفضة، هي مغمورة السلك في التبييض. (C) عن قرب من الإعداد. صاحب مسرى مكروي على التوالي، كما هو موضح في هذه الصورة على اليسار، ومترابطة على التحقيق من الكهربية. وبعد ذلك يتم الخيوط القطب أيون محددة عبر السلك من الفضة في حامل الكهربائي. على اليمين، والخيوط القطب الإشارة عبر السلك الفضي لصاحب مسرى مكروي 45 درجة. ثم يجب أن تقوم على أساس الدائرة بشكل مناسب. ويرد الطبق الفحص كما سيتم وضعه عند إجراء القياسات. الرجاءانقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
- وضع stereomicrosope مع ميكرومتر العين داخل قفص فاراداي. الأرض إلى المناطق الداخلية من قفص فاراداي، وهو بعد ذلك على الارض على الارض الشاسيه من الكهربية. وضع micromanipulators على جانبي المجهر (الشكل 4A).
- كلوريد اثنين من الأسلاك الفضة عن طريق غمر في التبييض لا يقل عن 1 ساعة. تمديد بين عشية وضحاها (O / N) إذا لزم الأمر (الشكل 4B). كرر هذه الخطوة كلما تحتاج إلى أسلاك الفضة إلى إعادة chlorided، على سبيل المثال إذا كانت الرمادي في المظهر بدلا من الأسود.
- موضوع واحد chlorided أسلاك الفضة في كل من أصحاب مسرى مكروي.
- إنشاء الدائرة الكهربائية مع التأريض المناسب. على سبيل المثال، ضع تنفيس، حامل مسرى مكروي على التوالي، والتي ستعقد القطب ايون معين (ISE)، على التحقيق الكهربية، والتي تم تأمينها على micromanipulator (الشكل 4C).
- تأمين تنفيس، 45 ° حامل مسرى مكروي، التي ستعقد القطب إشارة، على micromanipulator الأخرى (الشكل 4C). ثم الأرض إلى الأرض الدائرة على الكهربية.
- تأريض "AB من" الناتج BNC للالكهربية على الأرض الشاسيه من الكهربية.
- وضع مصدر ضوء الألياف البصرية خارج قفص فاراداي، مع أنابيب معقوفة مترابطة من خلال ثقب في قفص فاراداي (الشكل 4A).
- إعداد ومعايرة الكهربية وفقا لتعليمات الشركة الصانعة. إعادة معايرة الكهربية على أساس منتظم (كل 1-2 أسابيع). مرة واحدة كاملة، وبين القياسات، وترك الكهربية في وضع "الاستعداد" مع تبديل موقف لتعيين "IN،" مجموعة المدخلات متر إلى "A" ومجموعة لتعيين "200 فولت".
4. إعداد تشريح وحمام حلول
- إعداد ذبابة الفاكهة المالحة كما هو مفصل في الجدول 1. لاستخدامها في التجارب، صب ~ 40 مل إلى 50 مل أنبوب مخروطي الشكل والحفاظ على RT. تجاهل إذا كان هناك دليل على نمو البكتيريا أو الفطريات.
- لإعداد معيار الاستحمام المتوسطة (SBM)، مزيج ذبابة الفاكهة المالحة 1: 1 مع المتوسط شنايدر، ويمر عبر فلتر حقنة 0.22 ميكرون. إعداد في قسامات صغيرة (~ 10-15 مل)، وتخزين عند 4 درجات مئوية، وتجاهل إذا كان هناك دليل على نمو البكتيريا أو الفطريات. يتم سرد مكونات المتوسطة شنايدر في الجدول 2.
5. جعل القطب الأيوني المحدد: Silanizing Pipets
ملاحظة: في هذه الخطوة، يتم استخدام dichlorodimethylsilane على محمل الجد "silanize" القطب أيون محددة. وهذا يضيف طبقة مسعور الى الداخل من القطب التي تتيح لها الإبقاء على حامل الأيون مسعور. يتم تجنب silanization المفرطة لمنع امتصاص الزيوت المعدنية عند اتخاذ مeasurements في قطرات تحت النفط. أقطاب Silanized جيدة لعدة أسابيع. لذلك، يتم تنفيذ هذه الخطوة كل بضعة أسابيع.
- لهب تلميع نهايات 5-6 أنابيب unfilamented الزجاج البورسليكات الشعرية (القطر الخارجي 1.2 ملم، القطر الداخلي 0.69 ملم، وطول 10 سم) على نار هادئة، وذلك باستخدام احتياطات السلامة المناسبة.
- وضع الأنابيب الشعرية في الجزء السفلي من الزجاج 1 L الكأس.
- في غطاء محرك السيارة واستخدام معدات الوقاية الشخصية المناسبة، صب حامض النيتريك 70٪ (تنبيه: قابل للاشتعال وتآكل، راجع ورقة بيانات سلامة المواد لتخزين آمن والتعليمات المناولة) خلال الأنابيب الشعرية وينقع لمدة 5 دقائق.
- صب حامض النيتريك مرة أخرى إلى الزجاجة. إعادة استخدامها لاحقا غسل حمض النيتريك.
- إضافة ~ 200 مل من منزوع الأيونات H 2 O إلى الدورق. النفايات فارغة في زجاجة مخصصة للنفايات حمض النتريك. كرر مع 200 مل إضافية من H 2 O. منزوع الأيونات اتباع المبادئ التوجيهية المؤسسية لعشرالبريد التخلص الآمن من النفايات الحمضية.
- هل يغسل ثلاث إضافية مع كميات كبيرة من الماء منزوع الأيونات. تفريغ في الحوض.
- في غطاء محرك السيارة، ووضع الأنابيب الشعرية على طبق ساخن مع مجموعة كبار السيراميك إلى 200 ° C وجافة لمدة لا تقل عن 20 دقيقة، على النحو الأمثل 1 ساعة. ويمكن أيضا أن تترك لفترات أطول من الوقت.
- على مجتذب الماصة (الشكل 5A)، وسحب pipets ليبلغ قطرها غيض من ~ 1-2 ميكرومتر.
- وضع pipets انسحبت على موقد، مع الحرص على عدم كسر نصائح، لمدة 10 دقيقة على الأقل، على النحو الأمثل 30 دقيقة ولكن يمكن أن تترك لفترة أطول.
- إضافة 20 ميكرولتر من dichlorodimethylsilane (تنبيه: القابلة للاشتعال، أكالة، السمية الحادة، راجع ورقة بيانات سلامة المواد لتخزين آمن والتعليمات المناولة) إلى 15 سم طبق بتري زجاجي وعكس طبق على pipets على صفيحة ساخنة (الشكل 5B). ترك في مكان لمدة 20 دقيقة على الأقل، على النحو الأمثل 2 ساعة. يمكن نفس طبق بتري إعادة استخدامها في تجارب لاحقة.
- تحديد عمو الإقليم الشمالي من dichlorodimethylsilane أضاف عن طريق التجربة والخطأ. بعد إضافة حامل الأيون (الخطوة 8.4)، تأكد من أن واجهة بين حامل الأيون والحل الردم مسطحة (الشكل 5C). إذا واجهة مقعرة، وهذا يدل على مدى silanization، وينبغي أن تستخدم أقل سيلاني. إذا واجهة محدبة، وهذا يدل تحت silanization، وينبغي أن تستخدم أكثر سيلاني.
ملاحظة: dichlorodimethylsilane يميل إلى "إيقاف" مع مرور الوقت، أي يتحقق silanization أقل فعالية مع نفس الحجم من سيلاني. في هذه المرحلة، يمكن أن يؤمر إما سيلاني جديد، أو مقدار تعديلها لتحقيق silanization ما يعادلها.
- تحديد عمو الإقليم الشمالي من dichlorodimethylsilane أضاف عن طريق التجربة والخطأ. بعد إضافة حامل الأيون (الخطوة 8.4)، تأكد من أن واجهة بين حامل الأيون والحل الردم مسطحة (الشكل 5C). إذا واجهة مقعرة، وهذا يدل على مدى silanization، وينبغي أن تستخدم أقل سيلاني. إذا واجهة محدبة، وهذا يدل تحت silanization، وينبغي أن تستخدم أكثر سيلاني.
- إيقاف طبق ساخن ويترك ليبرد. إزالة الزجاج طبق بتري ونقل pipets إلى جرة التخزين التي تحتوي على هلام السيليكا، التي تحافظ على جفاف. التعامل مع pipets بعناية (ملقط مفيدة) لمنع كسر طرف.
5 "SRC =" / ملفات / ftp_upload / 53144 / 53144fig5.jpg "/>
الرقم 5. Silanizing Pipets. (A) مثال الماصة مجتذب. (B) صورة pipets سحبت على طبق ساخن. تم مقلوب طبق زجاجية تحتوي على قطرة من dichlorodimethylsilane على pipets انسحبت. (C) تخطيطي يوضح التفاعل بين كوكتيل حامل الأيون والحل الردم. واجهة مسطحة تشير silanization الأمثل. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
6. إعداد شفط جهاز سلبي
ملاحظة: في هذه الخطوة، يتم إعداد جهاز شفط سلبي بسيط (الشكل 6) التي سيتم استخدامها لملء القطب أيون محددة. يتم تنفيذ هذه الخطوة مرة واحدة فقط.
- نعلق حقنة 3 مل إلى محبس 3 الطريقة مع قفل بالتركيبة. فيعلى الطرف الآخر من الديوك، وتحتوي على طوق الدورية والحراسة، والمسمار في الموصل قفل بالتركيبة أنثوية نهاية الشائكة. ثم، ونعلق أنابيب السيليكون، 1/16 بوصة قطرها الداخلي مع 1/8 بوصة قطرها الخارجي، إلى نهاية الشائكة من الموصل. ثم، تضاف الأنابيب البلاستيكية مع 1/32 بوصة قطرها الداخلي و3/32 بوصة قطرها الخارجي
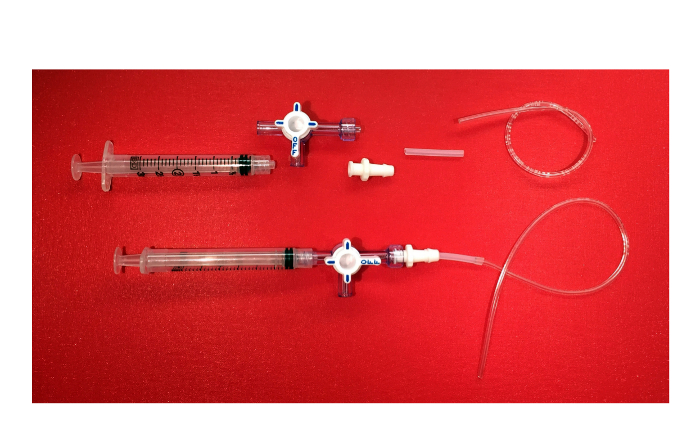
الرقم 6. شفط جهاز سلبية. صورة لمكونات جهاز شفط سلبي (3 مل المحاقن مع قفل بالتركيبة، 3 في اتجاه ومحبس بالتناوب مع ذوي الياقات البيضاء والحراسة، بالتركيبة الإناث قفل موصل مع نهاية الشائكة، وأنابيب السيليكون، وأنابيب من البلاستيك) و المنتج النهائي. الرجاء النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
7. الذباب وجمع للتشريح < / P>
- استخدام التقنيات القياسية تربية الذبابة 25 لاقامة الصلبان ذبابة وتعديل حسب الحاجة. على سبيل المثال، تستخدم لزيادة درجة الحرارة (مثل 28 ° C) في التجارب حيث هو المطلوب زيادة النشاط GAL4.
ملاحظة: من المهم أن الذباب لا تربى في ظروف مزدحمة أكثر من اللازم. ينبغي تخفيض أعداد الآباء الذكور والإناث في هذه الحالة. إذا تم استخدام الأنماط الجينية المختلفة، ينبغي تعديل أعداد الذكور والإناث أولياء الأمور للحصول على عدد مماثل تقريبا من النسل. - جمع الذباب لتشريح (الخطوة 11) باستخدام تقنيات تربية ذبابة القياسية 25 ضمن 1-2 أيام من eclosion. يتم تشريح أكثر سهولة الأنابيب من الذباب الإناث، ولكن يمكن أيضا الأنابيب من الذباب الذكور استخدامها إذا لزم الأمر أو المطلوب. مكان الذباب إلى قارورة تحتوي على ذبابة الغذاء. ضع قارورة في درجة الحرارة المطلوبة ل3-5 أيام قبل تشريح.
8. سد الكهربائي ايون محددة (ISE)
e_content "> ملاحظة: في هذه الخطوة، وردم وISE بمحلول الملح ثم يتم إدخال حامل الأيون في تلميح وISE يمكن إعادة استخدامها من يوم لآخر طالما أنها تعمل بشكل جيد لذلك، هذه الخطوة يقوم كل بضعة أيام حسب الحاجة.- لجعل K + القطب -specific، الردم الماصة silanized مع 0.5 M بوكل باستخدام حقنة 1 مل وخييط (microfilaments إعادة استخدامها من تجربة إلى تجربة). ضمان أن الحل الردم يملأ إلى الحافة جدا من الماصة - لا الهواء في طرف. إذا غير مؤكد، تصور تحت المجهر المركب. طرد فقاعات الهواء عن طريق التحريك بلطف الماصة.
- لالقطب -specific نا +، الردم مع 150 ملي كلوريد الصوديوم.
- إدراج نهاية الجزء الخلفي من ISE في أنابيب بلاستيكية للجهاز شفط سلبي أعدت في الخطوة 6. في غطاء محرك السيارة، ضع ISE على أحد البلاستيك 3.5 سم طبق بتري المقلوب مع قطعة من الصلصال لتأمين في المكان.
- توليد ص سلبيressure باستخدام جهاز الشفط. التراجع على حقنة مع "قبالة" من مقبض محبس لافتا نحو ميناء الجانب. مقدار الرسم مرة أخرى سوف تختلف ولكن عادة ما يكون في نطاق 0،6-0،7 مل. ثم تتحول مقبض محبس بالتالي فإن "قبالة" يشير نحو الأنبوب.
- في غطاء محرك السيارة واستخدام معدات الوقاية الشخصية المناسبة، وتراجع 1-10 ميكرولتر طرف الماصة في حل حامل الأيون (تنبيه: سمية انظر ورقة بيانات السلامة المواد لتخزين آمن والتعليمات المناولة.). طرد قطرة صغيرة عن طريق وضع إصبع القفاز خلال افتتاح أكبر من طرف الماصة. ثم، المس قطرة من حامل الأيون إلى غيض من ISE، دون لمس طرف ISE مع طرف الماصة لتجنب كسر غيض ISE.
- استخدام حامل الأيون البوتاسيوم المدرجة في جدول المواد "كما هي". لتحضير حامل الأيون الصوديوم، وجعل حل (في٪ ث / ث) 10٪ 4- ثالثي -butylcalix [4]، دآرين tetraacetic حمض tetraethylester، 890.75٪ الأثير nitrophenyl الأوكتيل، و 0.25٪ tetraphenyl بورات الصوديوم (تنبيه: سمية رؤية ورقة بيانات السلامة المواد لتخزين آمن والتعليمات المناولة). متجر في قارورة زجاجية ملفوفة في احباط لحمايتها من الضوء.
- دراسة ISE تحت 40X التكبير باستخدام المجهر المركب لتحديد ما إذا كانت حامل الأيون كان "تناول" في تلميح ISE وعما إذا كانت واجهة حل حامل الأيون / الردم مسطحة (راجع الخطوة 5.10.1 والشكل 5C).
- إذا لم يتخذ أي حامل الأيون يصل، وزيادة كمية الضغط السلبي التي تم إنشاؤها بواسطة جهاز الشفط. إذا لم يكن هذا بنجاح، القطب قد تم silanized غير الكافية. كرر الخطوة 5 استخدام كمية أكبر من dichlorodimethylsilane.
- وضع ISE، تلميح إلى أسفل، على جدار دورق مملوء جزئيا مع 150 ملي بوكل. تأمين ISE عن طريق وضع الصلصال على جانب الكأس. غيض يكمن في 150 ملي بوكل. الاستمرار في استخدام اوف ISEإيه عدة أيام طالما أنها تعمل بشكل جيد (راجع الخطوة 10.6).
- لنا + ISE، تخزين الكهربائي في 150 ملي كلوريد الصوديوم.
9. إعداد مرجع الكهربائي
ملاحظة: خطوات 9،1-9،3 يمكن أن يؤديها في وقت مبكر. خطوات 9.4 - 9.6 تتم كل يوم التجريبية.
- لهب تلميع نهايات الأنابيب 10 الخيطية الزجاج البورسليكات الشعرية (القطر الخارجي 1.2 ملم، القطر الداخلي 0.69 ملم، وطول 10 سم) على نار هادئة، وذلك باستخدام احتياطات السلامة.
- على مجتذب الماصة، وسحب pipets ليبلغ قطرها غيض من ~ 1-2 ميكرومتر.
- متجر pipets في جرة تخزين الماصة حتى الاستخدام. Pipets يمكن تخزينها لأجل غير مسمى.
- في يوم من التجربة، وذلك باستخدام خييط والمحاقن، وملء طرف وساق من الماصة مع خلات 1 M الصوديوم. ضمان عدم وجود فقاعات الهواء وهذا الحل يذهب إلى الحافة. نفض الغبار بلطف الماصة في حالة وجود فقاعات الهواء.
- باستخدام الثانيةخييط والمحاقن، وإعادة تعبئة الماصة مع 3 M بوكل. مرة أخرى، تأكد من فقاعات الهواء ليست موجودة.
- تخزين القطب المرجع في دورق يحتوي على 150 ملي بوكل (راجع الخطوة 8.6).
10. معايرة ISE
ملاحظة: يتم تنفيذ هذه الخطوة ثلاث مرات في اليوم التجربة: في وقت مبكر من اليوم للتأكد من يعمل ISE، ثم قبل وبعد قياسات 20-25 قطرات السوائل تفرز (الجدول 3).
- لمعايرة ISE البوتاسيوم، ووضع اثنين من 0.6 ميكرولتر يسقط كل من تركيزات الأربعة التالية من بوكل على سيليكون المغلفة المطاط الصناعي 3.5 سم طبق بتري (المعد في الخطوة 1): 15 ملم، 75 ملم، 150 ملم و 200 ملم. طبقة بعناية 2 مل من الزيوت المعدنية على قطرات.
- لالصوديوم ISE، استخدام قطرات معايرة 15 ملي و 150 ملي كلوريد الصوديوم.
- وضع طبق المعايرة على مرحلة من مراحل stereomicroscope في قفص فاراداي وإلقاء الضوء.
- ثلاث، الإعلان على ISE والمرجعية الكهربائي على أسلاك الفضة وربط إلى أصحاب مسرى مكروي.
- باستخدام micromanipulators، دفع ISE وأقطاب المرجعية في انخفاض 15 ملي بوكل.
- تبديل الكهربية إلى "تشغيل" واسطة. السماح القراءة لتسوية.
- قراءة سجل في دفتر الملاحظات. كرر مع 75 مم، 150 مم يسقط و 200 ملم. حساب المنحدر لتحديد ما إذا ISE تعمل بشكل جيد (راجع الخطوة 13.1 والجدول 3). إن لم يكن، وإعداد ISE الجديد.
ملاحظة: لافتات أن ISE لا تعمل بشكل جيد: الفشل في الحصول على القراءة؛ بطيئة لكي تتوازن (عدة ثوان أو أكثر)؛ قراءة غير مستقرة. منحدر <49 فولت تغيير / العشيري في K + أو + نا التركيز. - بين المعايرة الأولى من اليوم والقياسات التي أجريت في الخطوة 12، أي أثناء أداء الخطوة 11 (تشريح أنبوب صغير)، وتخزين ISE وأقطاب المرجعية في 150 ملي بوكل (كما هو موضح في الخطوة 8.6).
> 11. أنبوب صغير تشريح
ملاحظة: يتم تنفيذ هذه الخطوة في يوم التجربة.
- قسامة من كمية صغيرة (~ 500-600 ميكرولتر) من معيار المتوسطة الاستحمام (SBM)، أعدت في الخطوة 4.2، لاستخدامها في يوم التجربة والسماح لنستريح لRT. وينبغي أن يتم هذا على الأقل 30 دقيقة قبل تشريح ولكن يمكن أيضا أن يتم ذلك في وقت سابق. أيضا، لديها لا يقل عن 20 مل من RT ذبابة الفاكهة المالحة (الخطوة 4.1) متوفرة قبل البدء في تشريح.
- مباشرة قبل بدء تشريح: عرض طبق فحص على التكبير 10x تحت stereomicroscope وإضافة SBM ما يكفي لملء تقريبا كل بئر في طبق الفحص، عادة ما بين 10 و 30 ميكرولتر. إذا المخدرات أو الببتيد تسير تضاف إلى SBM منتصف التجربة، تقديم مذكرة من حجم الدقيق SBM تضاف إلى كل بئر. تجنب الإفراط في ملء كذلك هذا يمكن أن يؤدي إلى أنبوب صغير العائمة بعيدا أثناء التجربة.
- طبقة بعناية ~ 12-13 مل من الزيوت المعدنية على رأس بحيث الآبار لإعادة تغطيتها. وهذا يمنع تبخر قطرات السوائل تفرز أثناء التجربة.
- مكان الذباب إلى أن تشريح على CO 2 وسادة.
- التقاط ذبابة عبر الساق، أو الجناح مع ملقط ومكان على ظهرها (بطني حتى الجانب) على طبق تشريح المغلفة المطاط الصناعي سيليكون أعدت في الخطوة 1. أسعد الصدر مع دبوس Minutien لتأمين الطاير في المكان.
- إضافة قطرة من RT ذبابة الفاكهة المالحة (الخطوة 4.1) لتزج الطاير في المياه المالحة.
- اختياري: مقطع من الأجنحة والساقين. في الواقع، هذا ليس من الضروري عادة.
- استخدام ملقط جهة غير المهيمنة على "عقد" بطن الذبابة عند تقاطع-الصدري في البطن. استخدام ملقط اليد المهيمنة لقشر بشرة البطن بعيدا، بدءا من تقاطع الصدري البطن والتحرك نحو ذيل الطاير. القناة الهضمية، مع الأنابيب مالبيغي المرفقة، يجب أن تتعرض مع هذه المناورة.
- دون لمس الأنابيب، تشريح مجانا المعي المتوسط /المعى المؤخر والأنابيب المرفقة. عقد القناة الهضمية في ملقط جهة غير المهيمنة واستخدام إبرة 30 G لقطع الحالب من الأمعاء، فصل الأنابيب من الأمعاء وخالية من fly.It الضروري أن لا دموع أو الإيجارات إدخالها في أنبوب صغير، بخلاف في الحالب.
ملاحظة: يتم تشريح الزوج الأمامي من الأنابيب أكثر سهولة، ولكن يمكن استخدام الأنابيب الخلفي كذلك. - باستخدام قضيب الزجاج الفاخر (الخطوة 2)، والتقاط زوج أنبوب صغير ونقل في بئر للطبق الفحص.
- على الفور بعد أن تم نقل الزوج أنبوب صغير في البئر، والتقاط نهاية واحدة من الأنابيب مع قضيب الزجاج، والانسحاب من انخفاض الاستحمام حتى نهاية قطع من الحالب هو في منتصف الطريق بين دبوس وانخفاض الاستحمام، والتفاف نهاية أنبوب صغير حول دبوس باستخدام قضيب الزجاج. في نهاية هذه المناورة، لا يزال أنبوب صغير واحد في انخفاض الاستحمام المالحة وسوف تفرز السوائل من نهاية قطع من الحالب، كما هو موضح في الشكل رقم 1 قوي>. نبيب آخرين، وصفت "مرساة أنبوب صغير" في الشكل 1، ملفوفة حول دبوس. ذلك تكريسا لأنبوب صغير إفراز في المكان، تحيط به النفط، ولا تفرز السائل.
- مباشرة بعد الخطوة 11.11، كتابة جيدا (على سبيل المثال، A، B، C)، أنبوبية تحديد المعلومات (على سبيل المثال، نمط وراثي أو شرط)، والوقت (وهذا هو وقت البدء عندما يبدأ السائل أن يفرز من قبل نبيب في قطرة من الاستحمام المالحة).
- المضي قدما في تشريح المقبل. مرة واحدة المجرب هو المهرة في هذه التقنية، فإنه عادة ما يستغرق 3-4 دقيقة لتشريح زوج من الأنابيب، ونقل لهم المالحة الاستحمام، والتفاف أنبوب صغير مرساة حول دبوس. لذا، 20 - يمكن تعيين 25 الأنابيب تصل في فحص رامزي خلال 1.5 ساعة. وبالتالي فإن الوقت بداية كل أنبوب صغير يكون عن 3-4 دقيقة بعد وقت بدء نبيب السابق.
12. إجراء القياسات
> ملاحظة: يتم تنفيذ هذه الخطوة في يوم التجربة.
- معايرة ISE (الخطوة 10) حوالي 20 دقيقة قبل القياس الأول. وهذا ما يسمح الوقت لإجراء ISE جديدة إذا لزم الأمر.
ملاحظة: في الوقت المطلوب، على سبيل المثال بعد 2 ساعة من إفراز، وانخفاض السائل يفرز من كل أنبوب صغير جاهز للقياس. - تسجيل وقت القياس. قياس قطره قطرة السائل يفرز باستخدام ميكرومتر بصري وسجل. لاحظ التكبير، على سبيل المثال، 50X.
- دفع ISE والقطب إشارة إلى انخفاض السوائل. تبديل الكهربية إلى "العمل." السماح القراءة لتحقيق الاستقرار. تسجيل القيمة.
- أكرر للهبوط المقبل.
- في نهاية التجربة، كرر معايرة (الخطوة 10).
13. الحسابات
ملاحظة: هذه الخطوة لا يمكن أن يؤديها إما في نهاية المطاف تجربة، أو في وقت لاحق.
- حساب متوسطمنحدر / تغيير العشيري في تركيز البوتاسيوم. انظر الجدول 3 على سبيل المثال.
ملاحظة: للحصول على الصوديوم، وسوف تكون القيم للفرق بين ملي 15 و 150 القياسات ملي كلوريد الصوديوم. - تحديد قيمة متوسط القياسين (قبل وبعد) من 200 ملي بوكل (أو 150 ملي كلوريد الصوديوم).
- حساب حجم كل قطيرة. V = πd 3/6، حيث d هو قطر الحبرية قياس مع ميكرومتر العين في خطوة 12.2.
- حساب معدل إفراز = V / الساعة (NL / دقيقة / أنبوب صغير)، حيث V هو حجم القطيرات تحديدها في الخطوة 13.3، والوقت هو طول الوقت السائل أنبوب صغير يفرز (= وقت القياس - وقت سحب الحالب من الاستحمام قطرة).
- حساب تركيز أيون باستخدام الصيغة [K] = 10E (Δv / S) * 200 أو [نا] = 10E (Δv / S) * 150، حيث = Δv الفرق (في السيارات) بين إمكانية قياس السائل يفرز قطرة، واحتمال انخفاض معايرة 200 ملي (وأو البوتاسيوم. 150 ملي لانخفاض الصوديوم). S = المنحدر تحديدها في الخطوة 13.1.
- حساب ايون تدفق = [أيون] س معدل إفراز السائل. لالأنابيب ذبابة الفاكهة، وسيكون هذا بمول / دقيقة / أنبوب صغير.
14. تنظيف
ملاحظة: يتم تنفيذ هذه الخطوة في نهاية المطاف تجربة.
- تنظيف شامل للآبار ضروري لضمان أن بلورات الملح المتبقية لا يبقى في الآبار، تغيير تركيز أيون والأسمولية في التجارب المستقبلية.
- السماح للالزيوت المعدنية لتصريف.
- شطف الآبار للطبق الفحص. A 200 ميكرولتر طرف الماصة يمكن أن تستخدم لكشط بلطف المتبقية الكريستال الملح. باستخدام الأنابيب البلاستيكية التي تعلق على صنبور، ضغط الأنبوب لإنشاء طائرة الضغط العالي من الماء الساخن لشطف تماما من كل بئر.
- السماح ليجف O / N. بدلا من ذلك، يمكن استخدام مجفف ضربة لتجف الآبار.
- شطف ملقط مع منزوع الأيونات H 2 O ونقع في الإيثانول لمدة 15 دقيقة إلى عدة ساعات.
- استنزاف النفط قبالة طبق المعايرة ويغسل بالماء الساخن. استخدام الصابون وكذلك دامت تشطف جيدا تشغيله. أداء شطف النهائي مع المقطر H 2 O.
- microfilaments دافق والمحاقن مع H 2 O. المقطر
النتائج
أرقام 7 و 8 إثبات أن استخدام فحص رامزي مع أقطاب أيون محددة لقياس تركيزات K + ونا + يمكن أن تميز وراثيا ومتميزة دواء K + وتدفقات نا +، المعلومات التي لم يتم التقاطها بواسطة قياس معدلات إفراز السوائل وحدها. الشكل 7 عروض إنخفاضا إفراز...
Discussion
استخدام فحص رامزي، جنبا إلى جنب مع أقطاب أيون محددة، يسمح للقياس معدلات إفراز السوائل وتدفقات ايون في الحشرات معزولة مالبيغي (الكلى) الأنابيب. يمكن أن يعاير عشرين أو أكثر من الأنابيب في وقت واحد، مما يتيح أعلى إنتاجية مقارنة مقايسة من فرد في المختبر microperfused الأن?...
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Name | Company | Catalog Number | Comments |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30 G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionophore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
References
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O'Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O'Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O'Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O'Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O'Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O'Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O'Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O'Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved