このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
で液分泌とイオンフラックス速度を測定するためのラムゼイアッセイの使用
要約
このプロトコルは、 キイロショウジョウバエから単離しマルピーギ(腎)細管からの流体分泌速度を測定するためのラムゼイアッセイの使用を記載しています。また、イオン特異的電極の使用は、経上皮イオンフラックスの計算を可能にする、分泌液中のナトリウム及びカリウムの濃度を測定するために、記載されています。
要約
腎上皮イオン輸送の調節は、生物が外部条件の変化の顔にイオン性および浸透圧の恒常性を維持することができます。 キイロショウジョウバエマルピーギ(腎臓)細管が原因でこの生物の強力な遺伝学と生理学的研究への尿細管のアクセスに、上皮のイオン輸送の分子メカニズムを研究するための比類のない機会を提供しています。ここで、我々は、分泌液中のナトリウム及びカリウムの濃度を測定するために、イオン特異的電極を使用して、単離されたフライ尿細管からの流体の分泌速度を測定するためラムゼイアッセイの使用を記載しています。このアッセイは、イオン濃度を測定するための別の装置に分泌液を転送する必要なく、一度に20〜細管の上皮の流体及びイオンフラックスの研究を可能にします。遺伝的に異なる細管は、輸送プロセスにおける特定の遺伝子の役割を評価するために分析することができます。また、Bathing生理食塩水を添加し、その化学的性質、または薬物またはホルモンの影響を調べるために改変することができます。要約すると、この技術は、基本的なショウジョウバエの細管上皮イオン輸送機構、ならびにこれらの輸送メカニズムの規制の分子特徴づけを可能にします。
概要
腎上皮イオン輸送は、生物のiono-と浸透圧調節の下にあります。 キイロショウジョウバエマルピーギ(腎臓)細管上皮イオン輸送の分子メカニズムを研究するための比類のない機会を提供しています。これは、生理的な研究への尿細管のアクセスとペアにショウジョウバエの強力な遺伝学の組み合わせに起因するものです。技術1を開拓し 、研究者の名にちなんで名付けラムゼイアッセイは、孤立したマルピーギ細管から流体分泌速度を測定し、ダウと同僚2で 1994年にショウジョウバエに設立されました。これは、流体の分泌を調節する細胞特異的なシグナル伝達経路を定義するには、そのようなGAL4-UASシステム3,4 ショウジョウバエ遺伝的ツールを使用して、さらなる研究のために道を開きました。例は、他の多くの中で6,7-ペプチドホルモン5に対する応答におけるカルシウムシグナル伝達を含みます。
ハエは、尿細管の主なセグメントからの塩化カリウムに富む流体の分泌を介して起こるでve_content ">遺伝子技術と古典的な生理学的研究の組み合わせは、その尿の生成を示している。これは主に、陽イオンの並列経上皮分泌を介して行われKは+だけでなく、 の Na + は 、主細胞、およびClを通して- 。星細胞8-12を通じて分泌別途経上皮の K +およびNa +フラックスを測定する能力は、流体分泌の測定よりも輸送メカニズムのより詳細な特性評価を可能にします単独で、例えば、非刺激ショウジョウバエ細管ではNa + / K + -ATPアーゼ阻害剤ウアバインは、主細胞への取り込みは、有機アニオントランスポーター阻害剤タウロコール酸13によって阻害された場合でも、体液分泌2には影響を与えないが、リントンとオドネルは、ウアバインが脱分極することを示しました側底膜電位、およびNa +フラックス9を上昇させます 。代表的な結果に示すように、我々はこれらの結果をレプリケートし、K +フラックス14を同時に減少させることが示されました。増加の Na + フラックスおよび K +フラックスを減少させた分泌の正味の変化が生じ、流体分泌に対する反対の効果を持っています。 。このように、「ウアバインパラドックス」、すなわちへの2つの解像度があり、 ショウジョウバエの細管内の流体の分泌に影響を与えませんウアバイン初期観察は:まず、刺激細管に、流体分泌に対するウアバインの効果は明らかではないが原因有機アニオントランスポーター13によるその取り込み。そして第二に、非刺激細管に、ウアバインは(代表的な結果とrefを参照してください。9)液分泌の純変化なしで、その結果、上皮の Na + および K +フラックスへの影響に反対しています。 Na + / K + -ATPのため、主な役割非刺激細管にアーゼ基底膜を越えて輸送プロセスを共役型のNa +のための有利な濃度勾配を生成するために、細胞内のNa +濃度を低下させることです。確かに、別々 の Na + および K +フラックスを測定することにより、我々は、フライナトリウム-カリウム-2-塩化共輸送体(NKCC)を欠いている細管をさらにウアバイン添加後減少し、経上皮に変化がないがないと、経上皮K +フラックスが低下していることを実証しましたNa +が14フラックス 。これらの知見は、NKCCを通じてセルに入るの Na + をNa + / K + -ATPアーゼを介してリサイクルされ、私たちの結論を支持しました。別の例では、Ianowski ら 6mmの10 mMのからバスK +濃度の低下は、流体分泌の純変化なしで、経上皮K +フラックスとRhodniusのprolixusから尿細管における増加した上皮の Na + 流入を減少することが観察され 15。幼虫細管全体での Na + フラックスおよび K +フラックスの差動効果も塩分17を飼育することに応答して変動する塩食16に二蚊の種に応じて、 ショウジョウバエの細管において観察されています。ラムゼイアッセイ調製物における経上皮イオンフラックスの測定における最大の課題は、分泌された流体内のイオン濃度の決意です。この課題は、難photometery 18、放射性イオン19を使用すると、電子プローブ波長分散分光法20を含む様々なソリューションと満たされています。これらの技術は、イオン濃度を測定するための機器に分泌液滴の移動を必要とします。非刺激ショウジョウバエ細管により分泌される流体の体積が小さいため、通常は0.5〜NL /分で、これは技術的な課題を提起し、分泌された流体の一部である場合、エラーが導入され転送時に失わ。対照的に、イオン特異的電極の使用は、 その場での (イオン濃度を算出することが可能な)イオン活性の測定を可能にします。現在のプロトコルは、K +イオノフォア21としてバリノマイシン使用してRhodnius細管全体の経上皮K +フラックスを測定するためにMaddrellらによって使用されるものから適合し、また、4- ターシャの -butylcalix [4]アレーン四酢酸の使用が記載されましたテトラエチルエステル系NaがMesserli らによって特徴づけられる特異的イオン固有の電極を+。アル。22。イオン特定電極はまた、大人の9,23および幼虫16 キイロショウジョウバエでラムゼイアッセイにおいてマルピーギ細管により分泌液中のイオン濃度を測定するために使用されてきた、ニュージーランドアルパインウェタ(Hemideinaマオリ )24と蚊17インチ
ここでは、詳細にラムゼイとしての使用を記載ショウジョウバエからマルピーギ細管流体分泌速度を測定するだけでなく、分泌液、したがって、経上皮イオンフラックスの計算内の K +およびNa +の濃度を決定するために、イオン固有の電極を使用すると言います。アッセイの概要を図1に提供されます。

マルピーギ細管の図1の回路図とイオン濃度を測定するためのイオン特定電極の使用とラムゼイアッセイ 。この図は、ラムゼイアッセイのためのセットアップを示しています。 (A)各フライは、4つの細管、前方細管一対の後部細管のペア、血リンパに囲まれた腹腔内のそのフロートを持っています。各ペアでは、二つの細管はその後、中腸とhindguの接合部に尿を空に尿管、に参加しますトン。細管は、ブラインド・エンドです。尿は(赤で示した)は、流体分泌メインセグメントによって生成され、消化管に尿管に向かって内外に流れます。解剖後、細管のペアは、尿管を横断することにより、腸から解離します。 (B)は、尿細管のペアは、その後、アッセイ皿のウェル内入浴食塩水の液滴に移しました。 2細管の一つは、「アンカー細管は、「金属ピンの周りを包み、不活性であるとしてここでいいます。他の細管は、分泌細管です。 (液体を分泌しない)最初のセグメントと分泌細管の主なセグメントは、入浴の生理食塩水の液滴内に残ります。その後、イオンと水の移動入浴生理食塩水から、主要セグメントの尿細管内腔へ、および生体内で起こるように、尿管に向かって移動します。下部セグメント(青)が入浴生理食塩水、したがって不活性外です。尿管が切断されるので、分泌液が尿管の切断端からの液滴として現れます。 T彼は、分泌が続くように、流体液滴が時間とともに拡大し、分泌され、その直径は、接眼マイクロメータを用いて測定されます。ミネラルオイルの層は、分泌液の蒸発を防止します。リファレンスとイオン特定電極が分泌液のイオン濃度を測定する。 この図の拡大版をご覧になるにはこちらをクリックしてください。
プロトコル
1.準備解剖、キャリブレーションおよびアッセイ料理
注:このステップでは、シリコーンエラストマーと並ぶ3プラスチック製のペトリ皿を調製する:解剖のための1つ、ラムゼイアッセイを行うための1つの(「アッセイ皿」)、およびキャリブレーションを実行するための1。これらの料理は実験する実験から再利用され、したがって、このステップは唯一の皿が破損した場合は繰り返す必要があります。アッセイ皿の写真を図2に示されています。
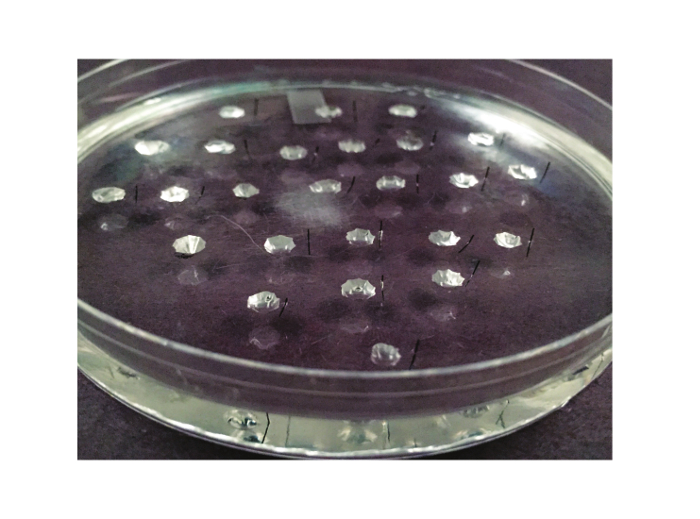
図2.アッセイディッシュは。ラムゼイアッセイに使用一品がここに表示されます。これは、シリコーンエラストマーで裏打ちされた10cmのペトリ皿です。 20〜25ウェルは、エラストマーのうち刻まれています。 (実験者が左利きである場合、または左に)半分にカットMinutien金属ピンは、各ウェルの右側に配置されます。TPS://www.jove.com/files/ftp_upload/53144/53144fig2large.jpg「ターゲット= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。
- 手袋を使用して、ガラスビーカーに〜80gのシリコーンエラストマーベースを注ぎます。 1/10重量(8グラム)シリコーンエラストマー硬化を追加します。金属スターラーで攪拌します。すべての気泡が削除されるまで数時間、例えば100回転数のため、緩やかな速度でフラットトップでオービタルシェーカー上に置きます。
- 100ミリメートル×15ミリメートル解剖およびアッセイ料理用食器、およびキャリブレーション皿のための35×10ミリメートル:きれいなプラスチック製のペトリ皿にシリコーンエラストマーを注ぎます。 100mmの皿のための7ミリメートル、35 mmディッシュのために〜5ミリメートル - エラストマー層の厚さは〜6でなければなりません。
- (硬化)硬化させるために室温(RT)でベンチに皿を置き、〜24から48時間。
- アッセイ皿が硬化した後は、ステップ1.1、1グラム硬化と例えば 、10gのシリコーンエラストマーベースのようなシリコーンエラストマーの小さいバッチを準備します。軌道に振りますステップ1.1のようにシェーカーは気泡がもはや存在しなくなるまで。このエラストマーは、ステップ1.5.4で使用され、その前のステップに硬化させてはなりません。
- 手術用メスと標準鋭利物対策を使用して、100ミリメートルシリコーンエラストマーでコーティングされたペトリ皿のいずれかに井戸を作ります。これは、アッセイ皿になります。
- 4ミリメートル - 離れてと〜3の直径でウェル〜1cmにしてください。 25ウェルは簡単に100ミリメートルアッセイ皿に合うことができます。ウェルズは、皿の壁から離れた少なくとも6ミリメートルであるべきである。 図2は 、ウェルの間隔を示しています。各ウェルは、実験中に一つの流体分泌細管が含まれています。従って、25ウェルを含む皿25細管を分析することが可能になります。
- 必要に応じて、井戸の位置をマークするために永久的なマーカーを使用してください。
- エラストマー中にメスを入れる、その後、シャーレ360°回転する反対側の手を使用することにより可能と同様に滑らかな壁を作ります。
- 次に、標準のSHAを使用してステップ1.4から非硬化エラストマーに30 G針を浸すと、各ウェルの底部に小滴を配置し、予防措置をRPS。これは、ウェルの底部を平滑化します。 (硬化)を硬化することを許可する24時間365 - 48時間。
- Minutienピンを準備します。
- 1インチの標準ラボラベリングテープ片に行の0.15ミリメートルアルマイトブラックMinutienピンを配置します。ピンの長軸は、テープの長軸に直交する必要があります。ほぼ等しい2つの半分( 図3)に各ピンを切断するために、その長さに沿ってテープをカットします。各ウェルについての半分ピンを使用してください。

Minutienピンを切断3.図。ピンを並列にラベリングテープ片に並んでいます。その後、ハサミ半分にピンを切断するために使用されます。ge.jpg「ターゲット= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。
- (右利きの場合は、左利きの場合は、各ウェルの左側にピンを挿入する)を各ウェルの右側に約1mmのシリコーンエラストマーに各半ピンを挿入します。解剖実体顕微鏡下で、低消費電力でウェルを視覚化し、鈍鉗子の使用によって支援されたときにこれが最も簡単に行われている。 図2は、ピンの位置を示しています。
ファインガラスロッドの準備2
注:このステップでは、ガラスロッドは、入浴降下に解剖皿から細管を転送するために使用されることが調製されます。ガラス棒は、実験間から再利用されるので、このステップは、ロッドが破断しない限り、一度だけ実行され、新しいものが必要とされます。
- 趣味の店、適切なガラスから3ミリメートル(1/8インチ)の厚さのステンド黒ガラスのシートを取得このようなガラスカッターやペンチのように、機器を-cutting。適切な安全装置(厚手の手袋、ゴーグル)を使用します。
- 〜6ミリメートル幅×長さ10cmの短冊状にガラスをカット
- それぞれの手でガラス片を保持します。適切な安全対策を使用して、ブンゼンバーナーの炎の上に各ストリップの短い方の端を柔らかくします。その後、一緒に2つのストリップの端を押して、ハンドルを持つ細いガラス棒を作成するために、スムーズな動きで引き離します。
3.生理学のセットアップ
注:このステップでは、顕微鏡は、電位計と電気回路が設定されています。銀線と電位(ステップ3.8)の再キャリブレーションの定期的な再塩化物化(ステップ3.2)以外にも、この手順は一度だけ実行されます。4セットアップを示しています。

4.生理学のセットアップ図。 生理学のセットアップは、ここで描かれています。 (A)セットアップの概要。実体顕微鏡は、どちらかの側にマイクロマニピュレーターでファラデーケージ内に配置されます。光ファイバー光はファラデーケージの側面の穴に通されています。電位計は、ファラデー箱の外側に配置されています。被膜に銀ワイヤを塩化(B)は 、ワイヤは、漂白剤に浸漬されます。 (C)セットアップのクローズアップ。左側にこの写真のようにまっすぐな微小電極ホルダーは、電位計のプローブにねじ込まれています。イオン固有の電極は、その後、電極ホルダーに銀線の上に通されます。右側には、基準電極は、45°の微小電極ホルダーの銀線の上にねじ込まれます。回路は、その後、適切に接地する必要があります。測定を行うとき、それが配置されるようにアッセイ皿が示されている。 くださいこの図の拡大版をご覧になるにはこちらをクリックしてください。
- ファラデーケージの中に接眼マイクロメーターでstereomicrosopeを置きます。その後、電位のシャーシグラウンドに接地されたファラデーケージの内部にグラウンド。顕微鏡( 図4A)のいずれかの側にマイクロマニピュレーターを配置します。
- 少なくとも1時間漂白剤に浸漬することにより塩化物2銀のワイヤ。一晩(O / N)必要に応じて( 図4B)を拡張します。銀ワイヤが、彼らは外観が灰色ではなく黒である場合など、再塩素化する必要があるたびに、この手順を繰り返します。
- スレッド1は、微小電極ホルダーのそれぞれに銀線を塩素化。
- 適切な接地と電気回路を確立します。例えば、マイクロマニピュレーター( 図4C)上に固定された電位計プローブ、に、イオン特定電極(ISE)を保持する通気、ストレート微小電極ホルダーを配置。
- 他のマイクロマニピュレーター( 図4C)に、基準電極を保持する通気、45°の微小電極ホルダーを、固定します。そして、電位計の回路のグランドに接地してください。
- グラウンド「ABアウト」出力電位のBNC電位のシャーシグラウンドへ。
- ファラデーケージ( 図4A)に穴に通しグースネック管を、ファラデーケージの外の光ファイバ光源を配置します。
- セットアップし、製造元の指示に従って電位を調整します。 ( - 2週間毎に1)定期的に電位を再キャリブレーションを行います。完了すると、測定の間に "IN"メーター "A"に設定された入力との設定範囲設定された位置の切り替えで「スタンバイ」モードで電位を残す」200 mVの。」
4.解剖、バースソリューションを準備します
- 準備<表1に詳述するようにem>のショウジョウバエの生理食塩水。実験に使用するために、50mlコニカルチューブに〜40ミリリットルを注ぎ、室温で保管してください。細菌または真菌の増殖の証拠がある場合は廃棄してください。
- シュナイダーの培地で1、および0.22μmのシリンジフィルターを通過:標準入浴媒体(SBM)を調製するために、 ショウジョウバエの生理食塩水1を混ぜます。 4℃で、店舗および細菌または真菌の増殖の証拠がある場合に捨てる - 小アリコート(15ミリリットル〜10)で準備します。シュナイダーの培地の成分を表2に記載されています。
シラン化ピペット:5.イオン固有の電極を作ります
注:このステップでは、ジクロロジメチルシランを「silanize「イオン特異的電極を軽くするために使用されます。これは、疎水性のイオノフォアを保持することを可能にする電極の内側に疎水性のコートを追加します。 Mの際、過剰なシラン化は、鉱物油の取り込みを防止するために回避されます油滴下でeasurements。シラン化電極は、数週間のために良いです。したがって、この工程は、数週間ごとに行われます。
- 適切な安全対策を使用して、弱火の上に6 unfilamentedホウケイ酸ガラス製の毛細管(外径1.2ミリメートル、内径0.69ミリメートル、長さ10センチメートル)、 - 難ポリッシュ5の両端。
- 1リットルのガラスビーカーの底に毛細管を配置します。
- フードでは、適切な個人用保護具を使用して、(注意:可燃性および腐食性、安全な保管と取り扱い方法については、製品安全データシートを参照してください)70%の硝酸を注ぐ毛細管上で、5分間浸します。
- 背面ガラスボトルに硝酸を注ぎます。その後の硝酸洗浄に再利用。
- ビーカーに、脱イオンH 2 Oの〜200ミリリットルを追加します。硝酸廃棄物専用のガラス瓶に空の廃棄物。脱イオンH 2 Oの追加の200mlで繰り返し目のための制度ガイドラインに従ってください。酸廃棄物の電子安全な処分。
- 脱イオン水の大容量ボリュームを持つ3つの追加の洗浄を行います。シンクに空にします。
- フードでは、20分、最適に1時間の最低セラミックトップ200℃に設定し、乾燥して、ホットプレート上にキャピラリーチューブを配置します。また、長時間放置することができます。
- 2ミクロン-ピペットプラー( 図5A)で、〜1の先端径にピペットを引き出します。
- 30分最適に、少なくとも10分間、ヒントを割らないように注意しながら、バックホットプレートの上に引っ張っピペットを置き、より長いのために残すことができます。
- 15cmのガラスシャーレに、ホットプレート( 図5B)にピペットの上に皿を反転:ジクロロジメチル20μlの(可燃性、腐食性、急性毒性、安全に保管するための製品安全データシートを参照し、指示に取り扱い注意)を追加します。 、少なくとも20分間の場所に最適な2時間のままにしておきます。同一のシャーレは、その後の実験に再利用することができます。
- amouを決定ジクロロジメチルシランのNTは、試行錯誤によって追加されました。イオノフォアは、(ステップ8.4)を添加した後、イオノフォア及び埋め戻し液との界面が( 図5C)平坦であることを確認してください。インターフェースが凹面である場合、これは、過剰シラン化を示し、以下のシランが使用されるべきです。インターフェースが凸状である場合、これはアンダーシラン化を示し、さらにシランを使用すべきです。
注:ジクロロジメチルシラン、すなわち、あまり有効シラン化シランの同じボリュームで達成され、時間をかけて「オフ」に行く傾向にあります。この時点で、いずれかの新たなシランを注文することができ、または量は、同等のシラン化を達成するように調整しました。
- amouを決定ジクロロジメチルシランのNTは、試行錯誤によって追加されました。イオノフォアは、(ステップ8.4)を添加した後、イオノフォア及び埋め戻し液との界面が( 図5C)平坦であることを確認してください。インターフェースが凹面である場合、これは、過剰シラン化を示し、以下のシランが使用されるべきです。インターフェースが凸状である場合、これはアンダーシラン化を示し、さらにシランを使用すべきです。
- ホットプレートの電源をオフにして、冷却します。ガラスシャーレを取り外し、乾燥を維持するシリカゲルを含む保存瓶にピペットを転送します。破壊先端を防ぐために慎重に(鉗子役立つ)ピペットを処理します。
5 "SRC =" /ファイル/ ftp_upload / 53144 / 53144fig5.jpg "/>
図5.シラン化ピペット。ピペットプラーの(A)の例。 (B)ホットプレート上に引っ張らピペットの写真。ジクロロジメチルシランの低下を含むガラス皿を引っ張っピペットの上に反転されています。 (C)は概略イオノフォアカクテル及びバックフィル溶液との間のインタフェースを示します。平坦な界面が最適なシラン化を示している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
6.負の吸引デバイスの準備
注:このステップでは、単純な負の吸引装置を用意する( 図6)イオン特異的電極を埋めるために使用されること。この手順は一度だけ実行されます。
- ルアーロックで3方コックに3 mlシリンジを取り付けます。でコックの反対側の端部は、回転カラーガードを含む、バーブエンドの女性ロックルアーコネクタにねじ込みます。次に、コネクタのとげ最後に、シリコンチューブ、1/8インチ外径1/16インチ内径を添付してください。次に、1/32インチ内径3/32インチの外径を有するプラスチックチューブを挿入します
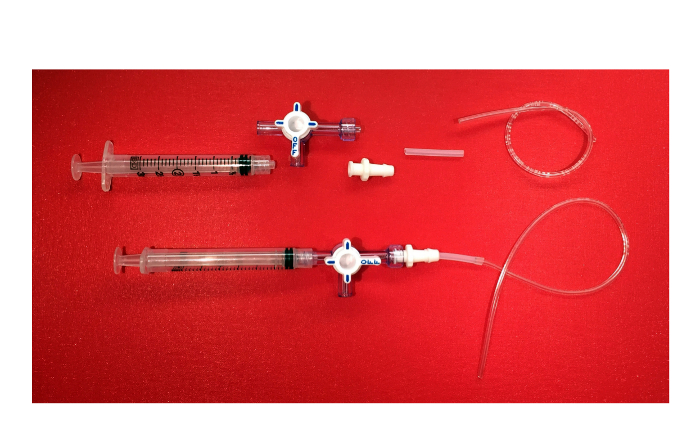
負の吸引装置の構成部品の図6.負の吸引装置。ピクチャー(ルアーロックで3 mlシリンジ、回転カラーガード、バーブ端と雌ルアーロックコネクター、シリコンチューブ、プラスチックチューブで3方活栓)と最終製品。 この図の拡大版をご覧になるにはこちらをクリックしてください。
7.解剖のためのハエを収集< / P>
- フライ十字架を設定し、必要に応じて変更するために、標準的なハエの飼育技術25を使用してください 。例えば、増加したGAL4活性が所望される実験で(例えば28℃など)上昇した温度を使用しています。
注:これは、ハエが過度に混雑した条件で飼育されていないことが重要です。男性と女性の親の数は、この場合には減少させるべきです。異なる遺伝子型が使用される場合、男性と女性の親の数は、子孫のほぼ同じ数を得るように調整されるべきです。 - 羽化の2日- 25 1内の標準フライ飼育技術を使用して解剖する(ステップ11)のためのハエを収集します。雌ハエから細管をより容易に切開されているが、必要または所望であれば、雄ハエから細管を使用することもできます。場所は、フライ食品を含むバイアルに飛びます。前解剖5日 - 3用の所望の温度でバイアルを置きます。
8.イオン特定電極(ISE)を充填
e_content ">注:このステップでは、ISEは、塩溶液で充填され、次いで、イオノフォアは、チップ内に導入されるISEのであれば十分に機能しているように一日から一日に再使用することができるので、この工程です。必要に応じて、数日おきに行きました。- K +固有の電極を作製するために、(実験する実験から再利用のミクロフィラメント)1mlシリンジとマイクロフィラメントを使用して、0.5MのKClとシラン化ピペットをバックフィル。チップ内に空気 - 埋め戻しソリューションはピペットの非常に先端に埋めていることを確認してください。不確かな場合は、複合顕微鏡下で可視化します。穏やかにピペットをフリックすることにより気泡を取り除きます。
- Na +固有の電極については、150 mMのNaClで埋め戻します。
- フードは、ステップ6で製造された負吸引装置のプラスチック管の中に、ISEのバックエンドを挿入し、所定の位置に固定するためのモデリング粘土の作品と反転プラスチック3.5センチメートルペトリ皿にISEを配置します。
- 負のPを生成します吸引装置を用いてressure。サイドポートに向いコックハンドルの「オフ」に注射器に戻って描画します。背面描画の量は様々であるが、0.6の範囲であるだろう - 0.7ミリリットル。 「オフ」は、チューブに向かって指しているように、そして、ストップコックハンドルを回します。
- フードでは、適切な個人用保護具を使用して、1ディップ - イオノフォア溶液に10μlのピペットチップを(注意:有毒安全な保管と取り扱い説明書のための材料安全データシートを参照してください。)。ピペットチップの大きな開口部の上に手袋をはめた指を置くことによって、小滴を追放。その後、ISEの先端を壊す避けるために、ピペットチップとISEの先端に触れることなく、ISEの先端にイオノフォアの低下をタッチします。
- 「そのまま。「材料表に記載されているカリウムイオノフォアを使用して、ナトリウムイオノフォアを調製するためには、10%の4- ターシャの -butylcalix [4]アレーン四酢酸のtetraethylester(w / wの%で)の溶液を作成、890.75パーセントニトロフェニルオクチルエーテル、および0.25%ナトリウムテトラフェニルホウ酸(注意:毒性は、安全な保管と取り扱い説明書用の材料安全データシートを参照してください)。光から遮蔽するためにホイルで包んだガラスバイアルに保管してください。
- イオノフォアは(ステップ5.10.1および図5Cを参照)、ISE先端にとイオノフォア/バックフィル溶液界面が平坦であるかどうかを「取り上げ」されたかどうかを決定するために化合物の顕微鏡を用いて40倍の倍率でISEを調べます。
- 何のイオノフォアは取り上げなかった場合は、吸引装置によって発生する負圧の量を増加させます。これが成功しない場合、電極は、不十分シラン化されていてもよいです。ジクロロジメチルシランをより多く使用して手順5を繰り返します。
- ISEを配置し、部分的に150mMのKClで満たしたビーカーの壁に、先端を下に。ビーカーの側に粘土を配置することにより、ISEを固定します。先端部は、150mMのKClの内にあります。 ISE OVを継続して使用しますそれがうまく機能している限り、複数の日ER(ステップ10.6を参照)。
- Na + ISEは、150mMのNaCl中の電極を格納します。
9.参照電極を準備します
注:ステップ9.1 - 9.3を事前に行うことができます。 9.4手順 - 9.6は、各実験日に行われます。
- 難ポリッシュ安全注意事項を使用して弱火で10 filamentedホウケイ酸ガラス製の毛細管(外径1.2ミリメートル、内径0.69ミリメートル、長さ10センチ)の端部。
- 2ミクロン - ピペットプラーで、〜1の先端径にピペットを引き出します。
- 使用するまでピペット保存瓶でピペットを保管してください。ピペットは、無期限に保存することができます。
- 実験の日に、マイクロフィラメント、およびシリンジを用いて、1 M酢酸ナトリウムでピペットの先端およびシャンクを埋めます。そこには気泡がされていないと、そのソリューションは、先端に行くことを確認してください。気泡が存在する場合、静かにピペットをフリック。
- 第二の使い方マイクロフィラメントと注射器は、3 M KClでピペットを埋め戻します。ここでも、気泡が存在しないことを確認します。
- 150mMのKClを含むビーカー内の参照電極を格納し(ステップ8.6を参照)。
ISEの10キャリブレーション
注意:必ずISEが動作されていることを確認するために朝早く、その後、20の測定の前と後- 25分泌液滴( 表3):このステップは、実験の日に3回行われます。
- 15 mMの、75 mMの、150ミリ、200 MM:カリウムISEのキャリブレーションのために、2つの0.6μL(ステップ1で調製)シリコーンエラストマーでコーティングされた3.5センチメートルペトリ皿にKClを以下の4つの濃度のそれぞれをドロップを配置します。注意深く滴上鉱油2mlのレイヤ。
- ナトリウムISEの場合、15ミリ、150mMのNaClの校正ドロップを使用しています。
- ファラデーケージに実体顕微鏡のステージに校正皿を置き、照らします。
- THRE銀線の上に広告ISEと参照電極と微小電極ホルダーに固定します。
- マイクロマニピュレータを用いて、15mMのKClを低下にISE及び参照電極を進めます。
- モードを「動作」する電位を切り替えます。解決するために読んでできるようにします。
- ノートに読んで記録します。 75 mMの、150ミリ、200 mMの低下を繰り返します。 (ステップ13.1および表3を参照 )、ISEがうまく機能しているかどうかを判断するためにスロープを計算します。ない場合は、新しいISEを準備します。
注意:ISEがうまく機能していないことの印:読書を取得するために失敗し、 (数秒以上)を平衡化するのが遅いです。不安定な読書;スロープ+、Na +の濃度が49 MV /十分位変化。 - (ステップ8.6で説明したように)その日の最初の校正と、ステップ11の実行中に、すなわちステップ12で実行される測定(尿細管解剖)との間では、150のKCl中のISEおよび参照電極を格納します。
11。細管解剖
注:このステップは、実験日に行われます。
- 小分けアウト少量 - 標準入浴媒体(SBM)の(〜500 600μl)を、実験の日に使用するために、ステップ4.2で調製し、室温に加温したが。これは、従来の解剖に少なくとも30分に行われるべきであるだけでなく、それ以前に行うことができます。また、RT ショウジョウバエの生理食塩水(ステップ4.1)解剖を開始する前に利用できるの少なくとも20ミリリットルを持っています。
- 解剖を開始する直前に:実体顕微鏡下で10倍の倍率でアッセイ皿を表示し、10と30μlの間で一般的に、ほとんどのアッセイ皿に各ウェルを満たすのに十分なSBMを追加します。薬剤またはペプチドはSBM半ば実験に追加しようとしている場合は、SBMの正確な量のノートが各ウェルに添加してください。過充填避けるだけでなく、これは実験中に離れて浮動小管につながることができます。
- 慎重〜12層 - 上にミネラルオイルの13ミリリットルをするように井戸再覆われました。これは、実験中に分泌液滴の蒸発を防ぐことができます。
- 場所は、CO 2パッド上に解剖することが飛びます。
- ステップ1で調製したシリコーンエラストマーで被覆された解剖皿に背(腹側を上)に鉗子と場所との足や翼を経由してフライをピックアップ場所にフライを確保するためにMinutienピンと胸部を突き立てます。
- 生理食塩水でハエを浸漬するRT ショウジョウバエの生理食塩水(ステップ4.1)のドロップを追加します。
- オプション:翼と足をオフにクリップ。実際には、これは通常必要ではありません。
- 胸腹部の接合部でハエの腹部を「保持」するために、非利き手の鉗子を使用してください。胸腹部の接合部で始まり、フライのテールエンドに向かって移動し、離れて腹部キューティクルを剥離する利き手の鉗子を使用してください。腸は、添付のマルピーギ細管で、この手技を用いて露光する必要があります。
- 細管に触れることなく、自由な解剖中腸/後腸および添付の細管。 、涙や賃料が細管内に導入されないことが不可欠であるfly.Itから腸や無料の細管を取り外し、非利き手の鉗子で腸を持ち、腸から尿管を切断するために30 G針を使用尿管以外で。
注:細管の前方対は、最も容易に解剖され、ただし、後方細管を用いてもよいです。 - 細いガラス棒(ステップ2)を使用して、細管のペアをピックアップし、アッセイ皿のウェルに移します。
- 尿細管のペアがウェルに転送された直後に、ガラス棒で細管のうちの1つの端部を拾う尿管の切断端がピンと入浴ドロップ、およびラップの中間になるまで入浴ドロップから撤退ガラス棒を使用してピンの周りの細管の終わり。 図1に示すように、この操作の最後に、ある細管は入浴食塩液滴に残り、尿管の切断端から流体を分泌します。他の細管は、 図1の 「アンカー細管を」と表示された、ピンの周囲に巻かれています。これは、油に囲まれて、流体を分泌しない、場所に分泌細管を固定します。
- すぐにステップ11.11の後、これは、流体が細管により分泌されると開始され、開始時刻である(ウェル( 例えば 、A、B、C)、細管の識別情報( 例えば 、遺伝子型または条件)、および時間を書き留めます入浴の生理食塩水の液滴で)。
- 次の解剖に進みます。 、細管のペアを分析入浴生理食塩水に転送し、ピンの周りにアンカー細管をラップするために4分 - 実験者は、この技術に熟練していると、それは典型的には3を取ります。したがって、20から25の細管は、1.5時間以内にラムゼイアッセイで設定することができます。前の細管の開始時間後に4分 - 各細管の開始時間は、したがって、約3となります。
12.メイキング測定
注:このステップは、実験の日に実行されます。
- ISE(ステップ10)最初の測定の前に約20分を調整します。これは、必要に応じて新たなISEをする時間を可能にします。
注:希望する時に、分泌の2時間後に、たとえば、各細管の分泌液滴が測定のための準備ができています。 - 測定の時間を記録します。接眼マイクロメータとレコードを使用して、分泌液滴の直径を測定します。 例えば 、50倍の倍率に注意してください。
- 流体滴にISEと基準電極を進めます。 「動作。 "への読み取りを安定させる電位を切り替えます。値を記録します。
- 次の降下を繰り返します。
- 実験の終了時に、キャリブレーション測定(ステップ10)を繰り返します。
13.計算
注:このステップでは、実験の一日の終わりに、または後の時点でのいずれかで行うことができます。
- 平均値を計算しますカリウム濃度のスロープ/十分位変化。例えば、表3を参照してください。
注:ナトリウムの場合、値は15ミリ、150mMのNaClの測定値の差のためになります。 - (前と後)の200mMのKCl(または150mMのNaCl)の2回の測定の平均値を決定します。
- 各液滴の体積を計算します。 dはステップ12.2で接眼マイクロメータを用いて測定した液滴の直径であり、V =πD3月6日 、。
- Vはステップ13.3で決定される液滴の体積で分泌速度= V /時間(NL /分/細管)を計算し、時間が時間尿細管分泌液(=測定の時間の長さである - 引っ張って尿管の時間)入浴液滴のうち。
- 式を用いたイオン濃度を計算し、分泌液の測定電位との間のΔVが(mV単位)の差を= [K] = 10E(ΔV/ S)* 200または[ナ] = 10E(ΔV/ S)* 150、ドロップ、および200mMのキャリブレーションの低下の可能性(Fまたはカリウム; 150 mM)を、ナトリウムのためにドロップします。 Sはステップ13.1で決定された傾きを=。
- イオンフラックス= [イオン]×流体分泌速度を計算します。 ショウジョウバエの尿細管では、これはピコモル/分/細管になります。
14.クリーンアップ
注:この手順は、実験日の終わりに行われています。
- 井戸の徹底洗浄は、残留塩の結晶は、将来の実験中のイオン濃度と浸透圧を変化させること、ウェル中に残っていないことを確実にするために不可欠です。
- 鉱物油は切るようにします。
- アッセイ皿のウェルを洗浄します。 200μlのピペットチップを穏やかに残留塩結晶を掻き取るために使用することができます。蛇口に取り付けられたプラスチック製のチューブを使用して、徹底的に各ウェルを洗浄するために、熱水の高圧ジェットを作成するために、チューブを絞ります。
- O / Nを乾燥することができます。あるいは、ブロードライヤー、ウェルを乾燥するために使用することができます。
- 脱イオンH 2 Oで鉗子を洗い流すと、数時間に15分間エタノールに浸します。
- 校正皿のオフに油を排出し、お湯で洗います。限り、それは完全に洗い流しているだけでなく、石鹸を使用してください。蒸留H 2 Oで最終すすぎを行います
- 蒸留H 2 Oでフラッシュマイクロフィラメントおよびシリンジ
結果
図7、図8、K +およびNa +濃度を測定するために、イオン特定電極とラムゼイアッセイの使用を示す遺伝的および薬理学的に異なるK +およびNa +フラックス 、単独の流体分泌速度を測定することにより、捕捉されない情報を区別することができます。 図 Na +フラックスが( 図7B)に変更されていない間NKCCにおけるホ?...
ディスカッション
一緒にイオン固有の電極を有するラムゼイアッセイの使用は、孤立した昆虫マルピーギ(腎)細管内の流体分泌速度とイオンフラックスの測定を可能にします。 20以上の細管は 、インビトロmicroperfused細管内の個々のアッセイと比較してより高いスループットを可能にする、一度にアッセイすることができます。また、イオン特異電極は、第2の装置への流体の少量の移動に導入?...
開示事項
The authors have nothing to disclose.
謝辞
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
資料
| Name | Company | Catalog Number | Comments |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30 G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionophore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
参考文献
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O'Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O'Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O'Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O'Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O'Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O'Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O'Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O'Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved