JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
램지 분석의 사용은 유체 분비 및 이온 플럭스 요금을 측정하는
요약
이 프로토콜은 초파리에서 격리 Malpighian (신장) 세관에서 유체 분비 속도를 측정 할 수있는 램지 분석의 사용을 설명합니다. 또한, 이온 전극의 특정 사용 transepithelial 이온 플럭스의 계산을 가능하게 분비 유체 나트륨 및 칼륨 농도를 측정하기 위해, 설명한다.
초록
신장 상피 이온 수송의 변조는 생물체가 외부 환경 변화에 직면 이온과 삼투압 항상성을 유지할 수 있습니다. 초파리 melanogaster의 Malpighian (신장) 가느 다란 관으로 인해이 생물 및 생리 학적 연구에의 신장 세뇨관의 접근성의 강력한 유전학, 상피 이온 수송의 분자 메커니즘을 연구 할 수있는 최고의 기회를 제공합니다. 여기서는 유체 분비 나트륨 및 칼륨 농도를 측정하는 이온 고유의 전극을 이용하여, 절연 플라이 신 세뇨관에서 유체 분비 속도를 측정하기 램지 분석의 사용을 기술한다. 이 분석은 이온 농도를 측정하는 별도의 장치에 분비 된 유체를 전송할 필요없이, 20 시간에 세관의 transepithelial 유체와 이온 플럭스 ~ 연구를 허용한다. 유전자는 별개의 세뇨관 수송 공정에서 특정 유전자의 역할을 평가하기 위해 분석 될 수있다. 또한, Bathing 식염수 첨가 화학적 특성, 또는 약물 또는 호르몬의 효과를 조사하기 위해 수정 될 수있다. 요약하면,이 기술은 이러한 반송기구의 상피 이온 초파리 세뇨관 운송뿐만 아니라, 규정의 기본 메커니즘의 분자 특성화를 허용한다.
서문
신장 상피 이온 수송은 유기체의 iono- 및 삼투의 기초가. 초파리 melanogaster의 Malpighian (신장) 세관 상피 이온 수송의 분자 메커니즘을 연구 할 수있는 최고의 기회를 제공합니다. 이것은 생리 학적 연구에의 신장 세뇨관의 접근성과 짝을 초파리의 강력한 유전학의 조합 때문이다. 기술 1을 개척 연구자의 이름을 따서 명명 램지 분석, 격리 Malpighian 세관에서 유체 분비 속도를 측정하고, 다우와 동료 2에 의해 1994 년에 초파리 년에 설립되었습니다. 이것은 유체 분비 조절 셀 고유 신호 전달 경로를 정의하는, 초파리 등을 GAL4-UAS 시스템 3,4- 유전 도구를 사용하여 추가 연구를위한 기반을 마련. 예는 많은 다른 6,7 사이에 펩티드 호르몬 (5)에 응답하여 칼슘 신호를 포함한다.
비행 세뇨관의 주요 부분에서 염화칼륨이 풍부한 액체의 분비를 통해 발생에 ve_content "> 유전자 기술 및 고전 생리 학적 연구의 조합 뇨 생성을 도시하고있다.이 주로 양이온 평행 transepithelial 분비 통해 이루어 K는 +뿐만 아니라 나트륨 +는 주체 세포, 및 CL를 통해 -. 성상 세포 8-12 내지 분비 별도로 transepithelial K + 및 나트륨 + 플럭스를 측정하는 능력은 유체 분비의 측정보다 반송기구의 상세한 특성화를 허용 홀로. 예를 들어, 자극되지 초파리 세뇨관에서, 나 +가 / K + -ATPase 억제제 인 ouabain 유체 분비 2에 영향을주지 주체 세포 내로의 흡수량은 유기 음이온 수송 체 억제제 타우로 콜산 (13)에 의해 억제 된 경우에도. 그러나, 린톤 및 오도넬은 ouabain과는 탈분극 것을 보여 주었다기저 막 잠재력, 그리고 나 + 플럭스 (9)을 증가시킨다. 대표 결과에 도시 된 바와 같이, 우리는 이러한 발견을 복제하고, 14 병용 감소 K + 플럭스가 있음을 보여 주었다; 증가 나 + 플럭스 및 K 감소 + 플럭스 분비없는 순 변화의 결과로 유체 분비에 반대하는 효과를 가지고있다. . 따라서, "ouabain과 모순", 즉 두 가지 해결책이 존재하며, 초파리 세뇨관 유체 분비에 영향을주지 ouabain과 초기 관찰 : 제 자극 세뇨관에서 유체 분비 ouabain과 효과는 명백하지 않다 인한 유기 음이온 수송 (13)에 의해 그 흡수; 둘째, 자극되지 세관에서, ouabain과는 (대표 결과와 심판을 참조하십시오. 9) 유체 분비없는 순 변화의 결과로, transepithelial 나 +와 K + 플럭스에 영향을 반대하고있다. 따라서, 나 +의 주요 역할 / K + -ATP비자극 세뇨관에서 ASE는 나트륨 +는 기저 외측 막에 걸쳐 전송 프로세스 -coupled위한 유리한 농도 기울기를 생성하는 세포 나 + 농도를 낮출 수있다. 실제로, 별도로 나 +와 K + 플럭스를 측정하여, 우리는 세관이 비행 나트륨 - 칼륨 - 2 - 염화 송체 (NKCC)를 부족하지 ouabain과 첨가 한 후 더 이상의 감소, transepithelial K + 플럭스 감소했으며, transepithelial의 변화가 있음을 보여 주었다 나 + 14 플럭스. 이러한 연구 결과는 NKCC를 통해 세포를 입력 나 +가 나 + / K + -ATPase를 통해 재활용 우리의 결론을지지했다. 다른 예에서, Ianowski는 외. mM의 10 mM 내지 6 욕 K + 농도를 낮추면 유체 분비없는 순 변화와 Rhodnius의 prolixus에서 세뇨관에서 transepithelial의 K + 플럭스 증가 transepithelial 나 + 플럭스 감소 관찰 15. 애벌레 세관에서 나 + 플럭스 및 K + 플럭스에 차등 효과는 염분 (17) 양육에 대한 응답으로 다양한 소금 다이어트 (16)와 두 모기 종에 대한 응답으로 초파리 세관에서 관찰되었다.램지 분석 준비 transepithelial 이온 플럭스의 측정에서 가장 큰 도전은 분비 된 유체 내 이온 농도의 판정이다. 이 문제는 불꽃 photometery (18), 방사성 이온 (19)의 사용, 전자 프로브 파장 분산 분광기 (20)를 포함하여 다양한 솔루션을 만났다되었습니다. 이러한 기술은 이온 농도의 측정을위한 도구로 분비되는 액체 방울의 전송을 필요로한다. 비자극 초파리 세뇨관 분비 유체의 부피가 작기 때문에, 일반적으로 ~ 0.5 NL / 분, 이것은 기술적 도전을 제기하고 분비 된 유체의 일부가 오류가있는 경우에도 소개이전에 잃었다. 대조적으로, 특정 이온 전극의 사용은 인 시츄 (이온 농도가 계산 될 수있는) 이온 활성의 측정을 허용한다. 현재 프로토콜은 K + 이온 운반체 (21)로 발리 노마 이신 (Valinomycin) 사용 Rhodnius의 세뇨관 걸쳐 transepithelial의 K + 플럭스를 측정하도록 Maddrell 동료가 사용하는 각색 및 또한 4- 급의 -butylcalix [4] 아렌 - 테트라 아세트산의 사용을 설명했다 테트라 에틸 에스테르 계 나은 등 Messerli 특징으로 특이 이온 특정 전극을 +. 등. (22). 이온 특정 전극 성인 9,23과 애벌레 (16) 초파리에서 램지 분석에 Malpighian 세관에 의해 분비되는 유체의 이온 농도를 측정하는 데 사용 된, 뉴질랜드 알파인 웨타 (Hemideina 마오리어) (24) 모기 (17).
여기서는 상세히 램지의 사용 등을 서술유체 분비 초파리 melanogaster의 발 Malpighian 세뇨관의 속도뿐만 아니라 분비 유체 내 K + 및 나트륨 +의 농도를 결정하는 이온 고유의 전극을 사용하므로 transepithelial 이온 플럭스의 계산을 측정하기 말한다. 분석의 개요는도 1에 제공된다.

Malpighian 세관의 그림 1. 도식과 이온 농도를 측정하기 위해 이온 특정 전극의 사용과 램지 분석. 이 그림은 램지 분석에 대한 설정을 보여줍니다. (A) 각 플라이는 네 세뇨관, 전방 세뇨관의 쌍 및 후방 세뇨관의 쌍에 의해 둘러싸인 체액 복강 그 플로트있다. 각 쌍에서 두 세관은 중장 hindgu과의 교차점에 뇨를 비운다 요관에서 합류티. 세관은 블라인드 종료됩니다. 소변 (빨간색으로 표시) 유체 분비 주요 세그먼트에 의해 발생하고, 장에 요관으로 밖으로 흐른다. 절개 후 세관 쌍 요관을 직감에 병행하여 해리된다. (B)은 세뇨관의 쌍은 분석 접시의 웰 내에서 입욕 식염수 방울로 전달된다. 여기에 언급 된 두 세뇨관의 일 "앵커 세관은,"금속 핀 감싸 불활성이다. 다른 세관은 분비의 가느 다란 관이다. 초기 세그먼트 (유체 분비하지 않는)과 분비 세관의 주요 부분은 목욕 식염수의 액적 내에 남아있다. 생체 내에서 발생하는 것에 이온과 목욕 식염수에서 주 세그먼트의 세관 루멘에 물 이동, 그리고, 요관으로 이동합니다. 낮은 세그먼트 (파란색) 목욕 식염수 때문에 불활성 밖에 있습니다. 요관이 절단되기 때문에, 유체는 분비 요관의 절단 단부로부터 액적으로 나온다. 티그 분비는 계속 유체 액적 시간 경과 확대 분비, 그 직경은 접안 마이크로 미터를 사용하여 측정된다. 미네랄 오일 층은 분비 된 유체의 증발을 방지한다. 참조 및 이온 특정 전극이 분비 유체의 이온 농도를 측정한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 준비 해부, 교정 및 분석 요리
참고 :이 단계에서, 실리콘 엘라스토머 늘어선 세 개의 플라스틱 페트리 접시를 준비한다 : 램지 분석 ( "분석 요리")을 수행하기위한 해부 용 하나, 하나, 교정을 수행하기위한 하나를. 이 요리는 실험 실험에서 다시 사용된다, 따라서이 단계는 접시가 깨진 경우 반복 될 필요가있다. 분석 접시의 그림은 그림 2에 표시됩니다.
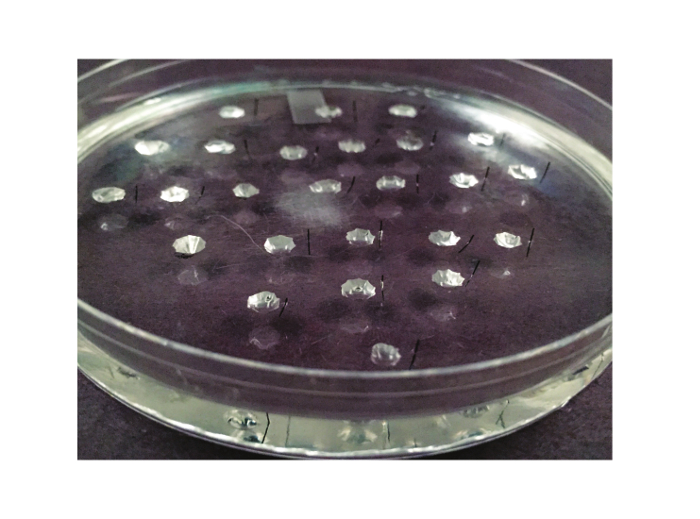
그림 2. 분석 요리. 램지 분석에 사용되는 요리는 여기에 표시됩니다. 그것은 실리콘 엘라스토머 늘어서 10cm 페트리 접시입니다. 20 ~ 25 우물은 엘라스토머에서 새겨 져 있습니다. (실험자가 왼손잡이 경우, 또는 왼쪽에) 반으로 Minutien 금속 핀, 각 웰의 오른쪽에 배치된다.TPS : //www.jove.com/files/ftp_upload/53144/53144fig2large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 장갑을 사용하여, 유리 비이커에 ~ 80g의 실리콘 엘라스토머 기재를 붓는다. 1/10 무게 (8g) 실리콘 엘라스토머 치료를 추가합니다. 금속 교반기 교반한다. 모든 거품이 제거 될 때까지 몇 시간 동안, 예를 들어 100 rpm으로 들어 완만 한 속도로 평면 상단 궤도 통에 넣습니다.
- 깨끗한 플라스틱 페트리 접시에 실리콘 엘라스토머를 부어 : 해부 및 분석 요리 100mm X 15mm 요리 및 교정 요리 35 × 10 mm의. 35mm 요리에 대한 100mm 요리 7 MM, 그리고 ~ 5mm - 엘라스토머 층의 두께는 6 ~해야한다.
- 48 시간 - ~ 24 일 (경화)을 치료하기 위해 실내 온도 (RT)에서 벤치에 요리를 놓습니다.
- 분석 접시가 치료되면, 단계 1.1, 1g의 치료와 예., 10g 실리콘 엘라스토머 자료로 실리콘 엘라스토머의 작은 배치를 준비합니다. 궤도에 흔들단계 1.1에서와 같은 통 기포는 더 이상 존재하지 않을 때까지. 이 엘라스토머 단계 1.5.4에서 사용되며 그 이전 단계로 강화하도록 허용해서는 안된다.
- 수술 용 메스와 표준 날카로운주의 사항을 사용하여 100mm 실리콘 엘라스토머 코팅 된 배양 접시의 한 우물을합니다. 이 분석 접시 될 것입니다.
- 4 MM - 떨어져와 ~ (3)의 직경 우물 ~ 1cm를 확인합니다. 25 웰 용이 100mm 분석 접시에 적합 할 수있다. 웰스. 요리의 벽에서 제거 최소 6 mm 이상이어야 2는 우물의 간격을 보여 그림한다. 각각의 잘은 실험 기간 동안 하나의 유체 분비 세관이 포함됩니다. 따라서, 우물 (25)를 포함하는 접시는 세관 (25)이 분석 될 수있게한다.
- 필요한 경우 우물의 위치를 표시하기 위해 영구 마커를 사용합니다.
- 엘라스토머에 메스를 배치하고 접시를 360 ° 회전 시키도록 반대 손을 사용하여 가능한 한 매끄러운 아니라 벽을 만든다.
- 그런 다음, 표준 샤을 사용하여 주의 사항을 RPS, 단계 1.4에서 비 강화 된 탄성 중합체로 30 G 바늘을 찍어 잘 각각의 하단에 작은 방울을 배치합니다. 이 웰의 바닥을 매끄럽게. 48 시간 - 치료 할 수 있도록 허용 (강화)는 24 X.
- Minutien 핀을 준비합니다.
- 1 인치 표준 실험실 라벨 테이프의 조각에 연속으로 0.15 mm의 블랙 산화 피막 처리 Minutien 핀을 놓습니다. 핀 '긴 축이 테이프의 긴 축에 직각이어야한다. 두 개의 거의 동일한 반쪽 (그림 3)에 각각의 핀을 절단하기 위해 길이를 따라 테이프를 잘라. 각 웰에 대해 절반 핀을 사용합니다.

그림 3. Minutien 핀 절단은. 핀 병렬 라벨 테이프의 조각에 줄 지어있다. 그런 다음, 가위 반으로 핀을 절단하는 데 사용됩니다.ge.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 실리콘 엘라스토머 아니라 각각의 오른쪽에 약 1mm로 각 반 핀을 삽입 (오른 손잡이의 경우, 왼손잡이, 각 웰의 왼쪽에 핀을 삽입하는 경우). 해부 실체 현미경 하에서 낮은 전력에서 우물을 시각화하고 무딘 집게를 사용하여 도움을 될 때 가장 쉽게 이루어집니다. (2) 핀의 위치를 보여줍니다.
정밀 유리 막대를 준비 (2)
주 :이 단계에서 유리로드가 입욕 강하로 해부 접시에서 세관을 전송하기 위해 사용된다는 것을 준비한다. 유리로드는 실험 실험에서 재사용되고, 그래서이 단계는 한번만로드 끊고 새로운 하나가 필요하지 않으면 수행된다.
- 취미 저장소와 적절한 유리 3mm (1/8 인치) 두께의 스테인드 검은 유리 시트를 구합니다이러한 유리 절단기와 펜치로, 장비를 -cutting. 적절한 안전 장비 (두꺼운 장갑, 고글)를 사용합니다.
- ~ 6mm x 세로 10cm 긴 스트립에 유리를 잘라
- 각 손에 유리 스트립을 잡습니다. 적절한 안전 조치를 사용하여, 분젠 버너의 불꽃을 통해 각 스트립의 짧은 끝을 부드럽게. 그런 다음, 함께 두 스트립의 끝을 밀어 손잡이와 미세한 유리 막대를 생성하기 위해 부드러운 움직임에서 떨어져 당깁니다.
3. 생리학 설정
주 :이 단계에서는, 현미경, 전위계 및 전기 회로가 설정된다. 실버 전선 및 전위계 (단계 3.8)의 재 교정의 주기적 재 chloriding (단계 3.2) 이외에,이 단계는 한번만 수행된다. (4)가 설치를 도시한다.

4. 생리학 설정 그림. 생리 설정은 여기에 묘사되어있다. 설정의 (A) 개요. 실체는 양쪽에있는 미세 조작기에 패러데이 케이지 내부에 배치됩니다. 광섬유 광 패러데이 케이지 측에 구멍을 통해 나사 결합된다. 전위계는 패러데이 케이지 외부에 배치된다. 코트에게 실버 와이어 클로라이드 (B)는, 와이어 표백제에 침지된다. (C) 설정의 확대합니다. 왼쪽에있는이 그림과 같이 직선 미세 전극 홀더는, 전위계의 프로브에 나사된다. 특정 이온 전극이어서 전극 홀더에 은선 위에 나사한다. 오른쪽에서, 기준 전극은 45 ° 미세 전극 홀더의 은선 위에 나사산. 회로는 적절하게 접지해야합니다. 측정을 수행 할 때이 위치되는 바와 같이 분석 접시 나타낸다. 주세요이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 패러데이 케이지 안에 안구 마이크로 미터와 stereomicrosope를 놓습니다. 다음 전위계의 섀시 접지에 접지 패러데이 케이지의 내부에 접지. 현미경 (그림 4A)의 양쪽에있는 미세 조작기를 놓습니다.
- 적어도 1 시간 동안 표백제에 담가 염화 두 개의 은색 선. 필요한 경우 (O / N) 하룻밤 (그림 4B)을 확장합니다. 실버 와이어가 외관에 회색이 아닌 검정색 일 경우, 예를 들어, 다시 염화물해야 할 때마다이 단계를 반복합니다.
- 나사 하나가 미세 전극 홀더의 각에 실버 와이어를 염화물.
- 적절한 접지와 전기 회로를 설정합니다. 예를 들어, 미세 조작기 (그림 4C)에 고정되어 전위계 프로브에, 이온 고유의 전극 (ISE)를 개최한다 배출, 직선 미세 전극 홀더를 배치합니다.
- 다른 미세 조작기 (그림 4C)에, 기준 전극을 개최한다 배출, 45 ° 미세 전극 홀더를 고정합니다. 이어서 전위계에 회로 접지에 접지.
- 전위계의 섀시 접지에 전위계의 "AB OUT"출력 BNC의 정전기를 제거하십시오.
- 패러데이 케이지 (그림 4A)에 구멍을 통해 스레드 구즈넥 파이프, 패러데이 케이지의 외부 광섬유 광원을 배치합니다.
- 설정하고 제조자의 지시에 따라 교정 전위계. 재 교정 정기적를 전위계 (매 1-2주). 완료되면, 및 측정 사이 "인이"미터 입력 설정 설정 위치 전환으로 "대기"모드에서 전위계를 떠나 설정 "A"와 범위에 "200 MV."
4. 해부 및 목욕 솔루션을 준비
- 준비 표 1과 자세한 초파리 식염수가. 실험에 사용하기 위해 50 ML 원뿔 튜브에 ~ 40 ml에 부어 실온에서 보관하십시오. 세균 또는 곰팡이 성장의 증거가있는 경우 폐기하십시오.
- 슈나이더의 매체 (1), 및 0.22 μm의 주사기 필터를 통과 : 표준 목욕 매체 (SBM)을 준비하려면, 초파리 식염수 (1)을 섞는다. 4 ° C에서 저장하고 세균이나 곰팡이 성장의 증거가있는 경우 폐기 - 작은 분취 량 (15 ml를 ~ 10)에서 준비합니다. 슈나이더의 매체의 구성 요소는 표 2에 나열되어 있습니다.
5. 이온 고유의 전극을 만들기 : Silanizing 피펫
참고 :이 단계에서, dichlorodimethylsilane 가볍게 "silanization합니다"이온 고유의 전극에 사용된다. 이는 소수성 이온 운반체를 유지할 수 있도록 전극의 내부에 소수성 코팅을 추가한다. 실란 화는 과도 m을 할 때의 미네랄 오일 흡수를 방지하기 위해 회피석유에서 드랍 easurements. 실란 화 된 전극은 몇 주에 좋다. 따라서,이 단계는 몇 주 간격으로 수행된다.
- 화염 폴란드어 5의 끝 - 적절한 안전 조치를 사용하여 낮은 불꽃을 통해 6 unfilamented 붕규산 유리 모세관 튜브 (외경 1.2 mm, 내경 0.69 mm, 길이 10cm).
- 1 L의 유리 비이커의 바닥에 모세관을 놓는다.
- 후드 및 적절한 개인 보호 장비를 사용하여, 70 % 질산 부어 : 모세관 튜브를 통해 (주 가연성 및 부식성을, 안전한 저장 방법 및주의 사항에 대한 물질 안전 보건 자료 (MSDS)를 참조) 5 분 동안 담가.
- 다시 유리 병에 질산을 붓는다. 다음 질산 세척 재사용.
- 비커에 탈는 H 2 O를 ~ 200 ML을 추가합니다. 질산 폐기물 전용 유리 병에 빈 쓰레기. 탈 H 2 O의 추가적인 200 ml의 반복 일에 대한 제도적 지침을 따르십시오산 폐기물의 전자 안전한 폐기.
- 탈 이온수 많은 양의 세 추가 세척 작업을 수행합니다. 싱크대에 비 웁니다.
- 후드에서 20 분, 최적으로 1 시간의 최소 세라믹 최고 200 ° C로 설정하고 건조와 핫 플레이트에 모세관 튜브를 배치합니다. 또한 오랜 기간 동안 남아있을 수 있습니다.
- 2 μm의 - 피펫 풀러 (그림 5A)에서 ~ 1의 팁 직경에 피펫을 잡아 당깁니다.
- 적어도 10 분 동안, 조언을 깰 않도록주의하면서, 다시 핫 플레이트에 최적으로 30 분을 뽑아 피펫을 배치하지만, 더 오래 남아있을 수 있습니다.
- 20 dichlorodimethylsilane의 μL 추가 : 15cm 유리 페트리 접시에 (주의 인화성, 부식성, 급성 독성, 안전한 저장 방법 및주의 사항에 대한 물질 안전 보건 자료 (MSDS)를 참조), 핫 플레이트 (그림 5B)에 피펫을 통해 요리를 반전. 적어도 20 분 동안 장소에 최적으로 2 시간을 둡니다. 같은 배양 접시 후속 실험에 다시 사용할 수 있습니다.
- 아모 결정 dichlorodimethylsilane의 NT는 시행 착오에 의해 추가. 이온 운반체 (단계 8.4)를 첨가 한 후, 이온 운반체 및 백필 용액 사이의 계면은 (도 5C) 평면인지 확인. 인터페이스가 오목 인 경우,이 오버 실란 화 나타내며, 이하 실란이 사용되어야한다. 인터페이스가 볼록 인 경우이 언더 실란 화 나타내고, 더욱 실란이 사용되어야한다.
주 :. dichlorodimethylsilane 즉, 덜 효과적 실란 화 실란 동량으로 달성되며, 시간이 지남에 따라 "OFF"로 이동하는 경향이있다. 이 시점에서, 하나의 새로운 실란 순서화 될 수 있거나, 실란 화 동등한 양을 달성하도록 조절.
- 아모 결정 dichlorodimethylsilane의 NT는 시행 착오에 의해 추가. 이온 운반체 (단계 8.4)를 첨가 한 후, 이온 운반체 및 백필 용액 사이의 계면은 (도 5C) 평면인지 확인. 인터페이스가 오목 인 경우,이 오버 실란 화 나타내며, 이하 실란이 사용되어야한다. 인터페이스가 볼록 인 경우이 언더 실란 화 나타내고, 더욱 실란이 사용되어야한다.
- 핫 플레이트를 끄고 냉각 할 수 있습니다. 유리 페트리 접시를 제거하고 탈수를 유지 실리카 겔을 포함하는 저장소 항아리에 피펫을 전송합니다. 신중하게 깨는 팁을 방지하기 위해 (도움이 집게를) 피펫을 처리합니다.
5 "SRC ="/ 파일 / ftp_upload / 53144 / 53144fig5.jpg "/>
그림 5. Silanizing 피펫. (A) 피펫 풀러의 예. 핫 플레이트에 뽑아 피펫의 (B) 사진. dichlorodimethylsilane 방울을 함유하는 유리 접시 위에 피펫 뽑아 반전되었다. (C) 도식 이온 운반체 칵테일 및 백필 용액 사이의 인터페이스를 도시. 평면 인터페이스는 최적의 실란 화를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 부정적인 흡입 장치를 준비
주 :이 단계에서는, 단순한 음 흡인 장치를 준비한다 (도 6) 이온 특정 전극을 채우기 위해 사용되도록. 이 단계는 한번만 수행된다.
- 루어 잠금 3 방향 스톱 콕에 3 ML의 주사기를 연결합니다. 에서꼭지의 반대쪽 끝은, 회전 칼라와 경비를 포함, 가시 끝이 여성 잠금 루어 커넥터 나사. 그리고, 커넥터의 미늘 단부에, 실리콘 튜브, 1/8 인치 외부 직경 1/16 인치의 내경을 첨부. 이어서, 1/32 인치 내경 및 3/32 인치 외경 플라스틱 배관을 삽입
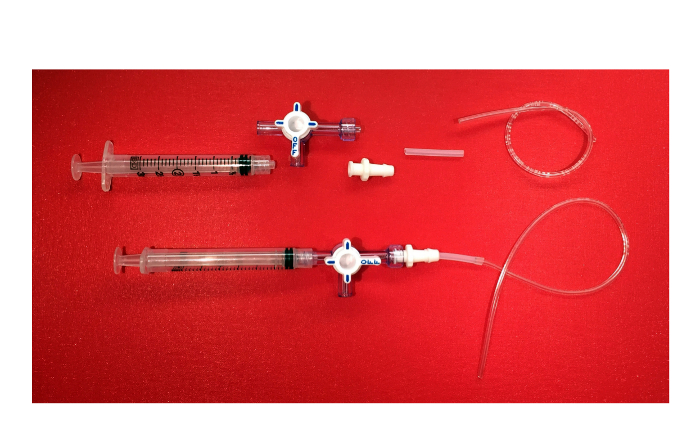
부정적인 흡입 장치의 구성 요소 그림 6. 부정적인 흡입 장치. 사진 (루어 잠금 3 ML의 주사기, 회전 칼라와 가드, 가시 끝이 여성 루어 잠금 커넥터, 실리콘 튜브, 플라스틱 튜브 3 방향 스톱 콕) 및 최종 제품은. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
해부 <7. 수집 파리 / P>
- 플라이 십자가를 설정하고 필요에 따라 수정하는 표준 플라이 축산 기술 (25)를 사용합니다. 예를 들어, 증가 된 GAL4 활성이 요구되는 실험에서의 온도 (예컨대 28 ° C)를 사용 확대 등을들 수있다.
참고 : 파리가 지나치게 붐비는 조건에서 사육되지 않는 것이 중요합니다; 암수 부모의 번호는이 경우에 감소한다. 다른 유전자형을 사용하는 경우, 남성 및 여성의 부모 번호 자손 대략 유사한 번호를 획득하기 위해 조정되어야한다. - 우화의 1-2일 내에서 해부 (11 단계)를 사용하여 표준 플라이 축산 기술 25 파리를 수집합니다. 여성 파리에서 세뇨관보다 쉽게 해부되지만 필요한 경우 또는 원하는 남성 파리에서 세관이 또한 사용될 수있다. 장소 플라이 음식을 포함하는 유리 병에 파리. 이전 해부에 3~5일에 대해 원하는 온도에서 튜브를 놓습니다.
8. 이온 특정 전극 필링 (ISE)
e_content "> 주 :..이 단계에서, ISE는 염 용액을 채워서 한 후 이온 운반체가 팁에 도입이 잘 작동으로 ISE가 긴 날마다 재사용 될 수있다 따라서,이 단계는 필요에 따라 며칠마다 수행.- K + - 특정 전극을하려면 (실험 실험에서 재사용 미사) 1 ML의 주사기와 미사를 사용하여 0.5 M KCl을 가진 실란 피펫을 백필. 팁없이 공기 - 백필 솔루션은 피펫의 매우 끝에 채우고 있는지 확인합니다. 불확실한 경우, 복합 현미경 시각화. 부드럽게 피펫을 쓸어 넘겨 공기 방울을 제거.
- 나 + - 특정 전극의 경우, 150 mM의 NaCl로 백필.
- 후드에서 6 단계에서 제조 된 부정적인 흡입 장치의 플라스틱 튜브에 ISE의 뒤쪽 끝을 삽입 위치에 고정하는 모델링 점토 조각으로 반전 플라스틱 3.5 cm 배양 접시에 ISE를 놓습니다.
- 부정적인 페이지를 생성흡인 장치를 이용 ressure. 측면 포트 향하고 꼭지 핸들의 "오프"로 다시 주사기에 그립니다. 0.7 ml의 - 그러나 달라질 다시 도면의 양은 0.6의 범위이다. "OFF"가 튜브 쪽을 가리 키도록 다음 꼭지 핸들을 돌립니다.
- (. : 독성 안전한 저장 방법 및주의 사항에 대한 물질 안전 데이터 시트를 참조하십시오주의) 이온 운반체 용액에 10 μL 피펫 팁 - 적절한 개인 보호 장비를 사용하여 후드와, 1을 찍어. 피펫 팁의 큰 입구에 장갑을 낀 손가락을 배치하여 작은 방울을 추방. 그런 다음, ISE 팁을 깨는 피하기 위해 피펫 팁과 ISE 팁을 건드리지 않고, ISE의 팁에 이온 운반체의 드롭을 터치합니다.
- "있는 그대로."자료 표에 나와있는 칼륨 이온 운반체를 사용하여 나트륨 이온 운반체를 준비하려면, 10 % 4- 급의 -butylcalix [4] 아렌 - 테트라 아세트산의 tetraethylester (W / w %에서)의 용액을, 890.75 % 니트로 페닐 옥틸 에테르, 0.25 % 나트륨 페닐 붕산 (주의 :. 독성 안전한 저장 방법 및주의 사항에 대한 물질 안전 데이터 시트를 참조하십시오). 호일에 싸여 유리 병에 보관은 빛으로부터 보호합니다.
- 이온 운반체가 ISE 팁에와 이온 운반체 / 백필 솔루션 인터페이스 (단계 5.10.1 그림 5C 참조) 평면인지 "채택"되었는지 여부를 결정하기 위해 복합 현미경을 사용하여 40X 배율에서 ISE를 검사합니다.
- 더 이온 운반체가 용해되지 않은 경우, 흡인 장치에 의해 생성 된 부압의 양을 증가시킨다. 이것이 성공적이지 않을 경우, 전극은 부적절 실란 화되고 있습니다. dichlorodimethylsilane 더 많은 양을 사용하여 5 단계를 반복합니다.
- 부분적으로 150 mM의 KCl을 가득 비커의 벽에, 아래 팁, ISE를 놓습니다. 비커의 측면에 점토를 배치하여 ISE를 고정합니다. 팁은 150 밀리미터의 KCl 내에 자리 잡고 있습니다. ISE의 오븐을 계속 사용어 여러 날짜는 그것이 잘 작동 될 때 (단계 10.6 참조).
- 나 + ISE를 들어, 150 mM의 염화나트륨의 전극을 저장합니다.
9. 참조 전극을 준비
주의 : 단계 9.1 - 9.3이 미리 수행 될 수있다. 9.4 단계 - 9.6 각 실험 하루에 수행됩니다.
- 화염 폴란드어 안전주의 사항을 사용하여 낮은 불꽃을 통해 10 filamented 붕규산 유리 모세관 튜브 (외경 1.2 mm, 내경 0.69 mm, 길이 10cm)의 끝.
- 2 μm의 - 피펫 풀러에서 ~ 1의 팁 직경에 피펫을 잡아 당깁니다.
- 사용할 때까지 피펫 저장 항아리에 보관 피펫. 피펫 무한정 저장할 수 있습니다.
- 실험 날에, 미사 및 주사기를 사용하여, 1 M 소듐 아세테이트로 피펫의 팁과 섕크를 채운다. 이 확인 기포가없는 그 용액 팁 간다. 기포가있는 경우 조심스럽게 피펫을 가볍게.
- 두 번째 사용미사와 주사기, 3 M의 KCl과 피펫을 백필. 다시 말하지만, 기포가없는 보장합니다.
- 150 mM의 KCl을 함유하는 비이커에 기준 전극을 저장한다 (단계 8.6 참조).
ISE 10. 교정
참고 :이 단계는 실험 하루에 세 번 수행됩니다 초기에 하루에 ISE 전과 (20)의 측정 후 다음 작업하고 있는지 확인 - 25 분비 된 액체 방울 (표 3).
- 15 mm의 75 mm의 150 mM 내지 200 mM의 : 칼륨 ISE의 교정을위한, 두 개의 0.6 μL (단계 1에서 제조) 실리콘 엘라스토머 코팅 3.5 cm 페트리 접시에의 KCl 다음 네 가지 농도의 각각의 방울을 놓는다. 조심스럽게 방울을 통해 미네랄 오일 2 ㎖ 레이어.
- 나트륨 ISE를 들어, 15 밀리미터, 150 밀리미터의 NaCl의 교정 방울을 사용합니다.
- 패러데이 케이지의 실체 현미경의 무대에 교정 접시를 놓고 조명.
- THRE광고 ISE와 기준은 와이어를 통해 전극 및 미세 전극 홀더에 고정합니다.
- 미세 조작기를 사용하여, 15 mM의 KCl을 드롭으로 ISE 및 기준 전극을 전진.
- 모드 "작동"하는 전위계를 전환합니다. 정착 읽기 허용합니다.
- 노트북에 기록 읽기. 75 mm의 반복, 150 밀리미터, 200 밀리미터가 떨어진다. ISE가 잘 작동하는지 확인하기 위해 경사를 계산한다 (13.1 표 3 단계 참조). 그렇지 않은 경우, 새로운 ISE를 준비합니다.
참고 : ISE가 잘 작동하지 않는 증상 : 독서를 얻기 위해 실패; (몇 초 이상) 평형 느린; 불안정한 읽기; 기울기 + 또는 나 + 농도 49 MV / 분위 변화. - (단계 8.6에 설명 된대로) 11 단계 (가느 다란 관 해부)의 성능 동안 즉, 하루의 첫 번째 보정 및 12 단계에서 수행 된 측정, 사이, 150 밀리미터의 KCl의 ISE 및 참조 전극을 저장합니다.
11. 세관 해부
주의 :이 단계는 실험 날에 행해진 다.
- 나누어지는 밖으로 소량 - 표준 목욕 매체 (SBM)의 (500 ~ 600 μL), 실험의 날에 사용하기 위해, 단계 4.2에서 준비하고 실온으로 따뜻하게 할 수 있습니다. 이것은 이전의 해부에 적어도 30 분을 수행해야하지만 이전 할 수 있습니다. 또한, RT 초파리 식염수 (단계 4.1) 해부을 시작하기 전에 가능한 적어도 20 ㎖있다.
- 해부를 시작하기 직전에 : 실체 현미경 하에서 10 배 배율에서 분석 접시를보고 10, 30 μL 사이에 일반적으로, 거의 분석 접시에 잘 각을 채우기에 충분한 SBM을 추가합니다. 약물이나 펩타이드 중순 실험을 SBM에 추가 될하려는 경우, SBM의 정확한 양의 메모는 각 웰에 첨가합니다. 과다 충전 실험 기간 동안 멀리 떠있는 가느 다란 관으로 이어질 수있는이 같은 우물을 피하십시오.
- 조심스럽게 ~ 12 층 - 상단에 미네랄 오일 13 ml에 있도록 우물다시 덮여. 이것은 실험 기간 동안 분비 된 액체 방울의 증발을 방지한다.
- 장소는 CO 2 패드를 해부한다 (으)로 운항하는 항공사.
- 장소에 비행을 확보하기 위해 Minutien 핀 가슴을 찌른다 1 단계에서 제조 된 실리콘 엘라스토머 코팅 해부 접시는 다시 (복부 측면까지)에 집게와 장소의 다리 또는 날개를 통해 비행을 선택합니다.
- 식염수의 비행 젖어 RT 초파리 식염수 (4.1 단계) 한 방울을 추가합니다.
- 옵션 : 날개와 다리를 클립. 실제로, 이것은 일반적으로 필요하지 않다.
- 흉 복부 접합부에서 파리의 복부」를 개최 "하는 비 지배적 인 손의 집게를 사용합니다. 흉 복부 접합부에서 시작하여 파리의 꼬리 끝으로 이동, 멀리 복부 표피를 벗겨 지배적 인 손 집게를 사용합니다. 첨부 Malpighian tubules와 창자는,이 기동에 노출되어야한다.
- 세관을 건드리지 않고, 무료 해부 중장 /hindgut 및 장착 된 세관. , 눈물 또는 임대료가 세관에 포함되지 것이 필수적이다 fly.It에서 장 무료에서 세관을 분리, 비 지배적 인 손의 집게에 창자를 잡고 장에서 요관을 절단하기 위해 30 G 바늘을 사용 요관에서 이외.
주 : 세관 전방 쌍 쉽게 그러나 후방 세뇨관가 또한 사용될 수 있으며, 해부된다. - 미세 유리로드 (2 단계)를 사용하여, 세관 쌍을 선택하고 분석 접시의 우물에 전송합니다.
- 세관 쌍의 웰 내로 이송 된 후 즉시, 유리로드와 세뇨관의 하나의 단부를 픽업 요관의 절단 단부가 핀과 입욕 강하 및 포장의 중간 때까지 입욕 강하 탈퇴 유리 막대를 이용하여 핀 주위 세뇨관의 끝. 도 1에 도시 된 바와 같이,이 기동의 끝에서 하나의 세관에는 입욕 식염수 강하 유지 및 요관의 절단 단부로부터 유체 분비 것 . 그림 1에서 "앵커 가느 다란 관을"이라는 다른 세관은, 핀 주위에 싸여있다. 이 곳에서 분비 세관은, 기름에 둘러싸여 앵커, 유체를 분비하지 않습니다.
- 즉시 단계 11.11 후, 이것은 유체가 세뇨관 분비되기 시작한다 시작 시간이다 (도 (예, A, B, C), 세뇨관 식별 정보 (예., 유전자형 또는 상태), 및 시간 적어 입욕 식염수 액적).
- 다음 해부를 진행합니다. , 세관의 쌍을 해부 목욕 식염수로 전송하고, 핀 주변의 앵커 가느 다란 관을 포장 4 분 - 실험은이 기술에 숙련되면, 그것은 일반적으로 3 걸립니다. 따라서, 20-25 세관은 1.5 시간 이내에 램지 분석에서 설정할 수 있습니다. 이전 세뇨관의 시작 시간 후 4 분 - 각 세관의 시작 시간은 따라서 약 3 일 것이다.
(12) 측정 수행
주 :이 단계는 실험 날에 행해진 다.
- ISE (10 단계) 첫 번째 측정하기 전에 약 20 분을 보정합니다. 이 필요한 경우 새로운 ISE를 할 시간을 허용한다.
참고 : 원하는 시간에, 분비의 2 시간 후, 예를 들어, 각 세관의 분비 유체 강하가 측정을위한 준비가되어 있습니다. - 측정 시간을 기록한다. 접안 마이크로 미터를 사용하여 기록 및 분비 된 액체 방울의 직경을 측정한다. 예를 들어, 50X를 배율을합니다.
- 유체 드롭으로 ISE과 기준 전극을 진행합니다. ". 운영"하는 전위계 스위치 독서가 안정 될 수 있도록. 값을 기록한다.
- 다음 강하를 반복합니다.
- 실험의 끝에, 캘리브레이션 측정한다 (단계 10)를 반복한다.
13. 계산
주 :이 단계는 실험 하루의 끝에서 수행하거나, 또는 이후에 될 수있다.
- 평균을 계산칼륨 농도 경사 / 분위 변화. 예를 들어 표 3을 참조하십시오.
주 : 나트륨 들어, 값은 15 mM 내지 150 mM의 NaCl을 측정 간의 차이가 될 것이다. - 200 밀리미터의 KCl (또는 150 mM의 염화나트륨)의 두 측정 (전후)의 평균값을 결정한다.
- 각각의 액 적의 부피를 계산. D 단계 12.2 마이크로 미터로 측정 안구 액 적의 직경 V = πd 6분의 3.
- V는 단계 133에서 결정된 액 적의 체적 인 분비 속도 = V / 시간 (거리 nL / 분 / 세뇨관)을 계산하고, 시간은 시간 세뇨관 분비 유체 (= 측정 시간의 길이 - 당기는 요관의 시간 ) 목욕 방울 중.
- 분비 된 유체의 측정 전위 사이 ΔV가 (MV에) 차이 = 화학식 [K] = 10E (ΔV / S) * 200 [나] = 10E (ΔV / S) * 150을 이용하여 이온의 농도를 계산할 드롭 및 200 mM의 교정 강하의 전위 (F또는 칼륨; 나트륨 150 mM의 드롭). S는 단계 13.1에서 결정된 기울기 =.
- 이온 플럭스 = [이온] × 유체 분비 속도를 계산합니다. 초파리 세뇨관, 이것은 pmol의 / 분 / 세뇨관 것이다.
14. 정리
주의 :이 단계는 실험 하루의 끝에서 수행된다.
- 웰의 완전한 세척은 잔류 염 결정 미래 실험에서의 이온 농도 및 삼투압을 변경, 웰에 잔류하지 않도록 보장하는 것이 필수적이다.
- 미네랄 오일이 떨어져 배출 허용합니다.
- 분석 접시의 우물을 씻어. 200 μL 피펫 팁 부드럽게 잔류 염을 긁어 결정하는데 사용될 수있다. 수도꼭지에 부착 된 플라스틱 배관을 사용하여, 완전히 각 웰을 씻어 온수 고압 제트를 만들 튜브 짠다.
- O / N을 건조하도록 허용합니다. 대안 적으로, 블로우 드라이어 웰을 건조 할 수있다.
- 탈의 H와 집게를 씻어 2 O 및몇 시간에 15 분 동안 에탄올에 담가.
- 교정 접시 오프 오일을 배출하고 뜨거운 물로 씻는다. 뿐만 아니라 그것이 철저하게 씻어 될 때 비누를 사용합니다. 증류 H 2 O로 최종 헹굼을 수행
- 증류수 H 2 O와 세척 미사와 주사기
결과
도 7 및도 8은 유전 학적 및 약리학 적으로 별개의 K + 및 나트륨 + 플럭스만으로는 유체 분비 속도를 측정함으로써 캡쳐되지 않은 정보를 구분할 수있는 K + 및 나트륨 + 농도를 측정하기 위하여 이온 - 특정 전극 램지 분석의 사용을 보여준다.도를 나트륨 + 플럭스 (도 7b)이 변경되지 않은 상태 NKCC에서 동형 널 돌연변이...
토론
함께 특정한 이온 전극 램지 분석의 사용은, 절연 곤충 Malpighian (신장)에서 유체 세뇨관 분비 속도 및 이온 플럭스를 측정 할 수있다. 스물 이상의 세관은 체외 microperfused 세뇨관에서 개별의 분석법에 비해 더 높은 처리량을 가능하게 한 번에 분석 될 수있다. 또한, 이온 전극을 특정 제 2 장치로의 유체의 소량의 전사에 도입 될 수있는 오류를 제한 시츄 분비 유체 내 이온 농도?...
공개
The authors have nothing to disclose.
감사의 말
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
자료
| Name | Company | Catalog Number | Comments |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30 G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionophore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
참고문헌
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O'Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O'Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O'Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O'Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O'Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O'Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O'Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O'Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유