Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование Рамсей анализе измерить жидкости секреции и поток ионов ставки в
В этой статье
Резюме
Этот протокол описывает использование анализа Ramsay для измерения скорости жидкости секреции изолированных мальпигиев (почечная) канальцев из дрозофилы. Кроме того, использование ион-специфических электродов для измерения концентрации натрия и калия в секретируемого жидкости, что позволяет рассчитать потока ионов трансэпителиальная, описан.
Аннотация
Модуляция почечной транспорта ионов эпителиальной позволяет организмы для поддержания ионной и осмотическое гомеостаз в условиях различной внешних условий. Дрозофилы мальпигиев (почечная) трубочка предлагает уникальную возможность для изучения молекулярных механизмов транспорта ионов эпителия, из-за мощных генетики этого организма и доступности ее почечных канальцах физиологического исследования. Здесь мы описываем использование анализа Ramsay для измерения скорости жидкости секреции изолированные мух почечных канальцев, с использованием ион-специфических электродов для измерения концентрации натрия и калия в секретируемого жидкости. Этот анализ позволяет изучение трансэпителиальная жидкости и ионных потоков ~ 20 трубочек в то время, без необходимости переноса секретируемый жидкости в отдельном устройстве для измерения концентрации ионов. Генетически различные трубочки могут быть проанализированы, чтобы оценить роль специфических генов в процессах переноса. Кроме того, бathing солевой могут быть изменены с целью изучения воздействия своих химических характеристик, или наркотиков или гормонов добавил. Таким образом, эта методика позволяет молекулярной характеристики основных механизмов транспорта ионов в эпителиальной канальца Drosophila, а также регулирование этих транспортных механизмов.
Введение
Почечная транспорт эпителиальных ионов лежит в основе организменном ионосферы и осморегуляции. Дрозофилы мальпигиев (почечная) трубочка предлагает уникальную возможность для изучения молекулярных механизмов транспорта ионов эпителия. Это связано с комбинацией мощных генетики дрозофилы, в паре с доступностью его почечных канальцев к физиологическому изучению. Рамсей анализ, названный в честь исследователя, который впервые технику 1, измеряет жидкость цены секреции из изолированных мальпигиевых канальцев, и была создана в 1994 году дрозофилы в Доу и коллег 2. Это проложило путь для дальнейших исследований с использованием генетических Drosophila инструменты, такие как системы GAL4-UAS 3,4, чтобы определить соты сигнальные пути, регулирующие секрецию жидкости. Пример включает в себя сигнализацию кальция в ответ на это пептидный гормон, 5 среди многих других 6,7.
ve_content "> Сочетание генетических методов и классического физиологического исследования показали, что поколение мочи в лету происходит через секреции хлорида богатых жидкости калия из основного сегмента канальцев. Это происходит через трансэпителиального секреции параллельно катионов, прежде всего, К +, но и Na +, через основной камере, и Cl -. секреции через звездчатого клетки 8-12 Способность отдельно измерить трансэпителиальная потоков К + и Na + позволяет более подробную характеристику транспортных механизмов, чем измерение секреции жидкости в покое. Например, в нестимулированных канальцев Drosophila, Nа + / К + -АТФазы ингибитор оуабаин не имеет никакого эффекта на секрецию 2 жидкости, даже когда его поглощение в основных клетках ингибируется органический анион транспортер ингибитора таурохолата 13. Тем не менее, Линтон и О'Доннелл показал, что уабаин деполяризуетбазолатеральный мембранный потенциал, и увеличивает поток Na + 9. Как показано в представительных результатов, мы воспроизвели эти результаты и показали, что поток К + одновременно снизился 14; увеличение потока Na + и K + снизился поток имеет противоположные эффекты на секрецию жидкости, в результате чего не чистого изменения в секреции. Таким образом, есть две резолюции к "уабаина парадокса", т.е., начальное наблюдение, что уабаина не имеет никакого эффекта на секрецию жидкости в канальцах Drosophila:. Во-первых, в стимулированных канальцев, эффект уабаина на секрецию жидкости не является очевидным из-за его поглощение в органический анион транспортер 13; во-вторых, в нестимулированных канальцев, оуабаин имеет противоположные эффекты на трансэпителиальная Na + и К + потока, что приводит к отсутствию изменений в чистой секреции жидкости (см Представитель Результаты и Ref. 9). Таким образом, основная роль Na + / K + -АТФазы в стимулированных канальцев снизить концентрацию внутриклеточного Na + для создания благоприятного градиента концентрации для Na +, -coupled транспортных процессов по базолатеральной мембране. Действительно, отдельно измерения Na + и K + потоки, мы показали, что канальцы не хватает на лету натрия калия-2-хлорида котранспортера (NKCC) снизились трансэпителиальный K + поток, без дальнейшего снижения после уабаина того, и никаких изменений в трансэпителиального Na +, поток 14. Эти данные поддержал наш вывод, что Na +, введя ячейку через NKCC возвращают через Na + / K + -АТФазы. В другом примере, Ianowski и др. Наблюдали, что снижение ванны концентрации К + от 10 мм до 6 мм уменьшилось трансэпителиальный K + поток и увеличение трансэпителиальный Na +, в канальцах поток от Rhodnius prolixus, без чистого изменения в секреции жидкости 15. Дифференциальные воздействие на поток и K + Na + поток через личиночной канальцев наблюдали также в Drosophila канальцев в ответ на разной соли диеты 16 и в двух видов комаров в ответ на выращивании соленость 17.Самой большой проблемой в измерении потока ионов трансэпителиальная в подготовке Рамсей анализа является определение концентраций ионов внутри секретируется жидкости. Эта задача была выполнена с различной решений, в том числе фотометрию пламени 18, применение радиоактивных ионов 19, и волны зонда электронного дисперсионные спектроскопии 20. Эти методы требуют передачи секретируемого капли жидкости на прибор для измерения концентрации ионов. Поскольку объем жидкости, секретируемый нестимулированных Drosophila трубочку мала, обычно ~ 0,5 нл / мин, это создает техническую проблему, а также вносит ошибку, если некоторые из секретируемого жидкостипотеряли при передаче. В противоположность этому, использование ион-специфических электродов позволяет измерять активности ионов (из которой концентрация ионов может быть рассчитано) на месте. Текущий протокол был адаптирован от используемого Maddrell и коллегами для измерения трансэпителиальный K + поток через трубочку Rhodnius в использовании валиномицина как K + ионофор 21, а также описывает использование 4-трет--butylcalix [4] арена-этилендиаминтетрауксусной кислоты тетраэтилсвинец на основе сложного эфира Na + Определённые ионный конкретных электрод характеризуется Messerli др. др. 22. Ион-специфичные электроды были также использованы для измерения концентрации ионов в жидкости, выделяемой мальпигиевых канальцев в анализе Рамсей во взрослой 9,23 и личинок дрозофилы 16, Новой Зеландии Горные Weta (Hemideina маори) 24 и в 17 комаров.
Здесь мы подробно использование Рамсей какговорят, чтобы измерить жидкости цены секреции в канальцах мальпигиевых из дрозофилы, а также использование ион-специфических электродов для определения концентрации K + и Na + в секретируемого жидкости и, таким образом расчет трансэпителиальная ионных потоков. Обзор анализа обеспечивается на фиг.1.

Рисунок 1. Схема мальпигиевых и Рамсей Анализ с использованием ион-специфических электродов измерить концентрации ионов. Эта цифра показывает установку для анализа Рамсей. (А) Каждый муха имеет четыре трубочки, пару передних канальцев и пару задних канальцев, которые плавают в брюшной полости, окруженной гемолимфы. В каждой паре, две трубочки соединяются в мочеточнике, который затем впадает мочи на стыке кишки и hindguт. Трубки слепы состава. Моча образуется в жидкости, секретирующие основной сегмент (показан красным), и течет к мочеточника и вышел в кишечнике. После вскрытия, пара трубочка диссоциирует из кишечника по пересекающих мочеточник. (B) пара канальцев затем переносили в капле физиологического раствора купания в лунку анализа блюдо. Один из двух трубочек, называют здесь как "якоря трубочку," обернут вокруг металлический штырь и инертен. Другой трубочка является секрецию канальцев. Начальный участок (который не секретирует жидкость) и основной сегмент, секретирующих трубочку оставаться в капле физиологического раствора купания. Ионы и вода переход от купания и солевом растворе в просвете канальцев основной сегмент, а затем перейти к мочеточника, как это происходит в естественных условиях. Нижний сегмент (синий) находится за пределами купания физиологического раствора, и поэтому инертны. Поскольку мочеточник вырезать, секретируемый жидкости возникает как капли от срез мочеточника. ТОн секретируется капель жидкости увеличивает течением времени, как секреции продолжается, и его диаметр измеряется с помощью окулярного микрометра. Слой минерального масла предотвращает испарение жидкости секретируемого. Конкретные ссылки и ионов электроды измерения концентрации ионов секретируемого жидкости. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
протокол
1. Подготовка рассечение, калибровка и Пробирной Блюда
Примечание: На этом этапе, три пластиковые чашки Петри выложены силиконового эластомера получают: один для вскрытия, один для выполнения Ramsay анализа ("Анализ блюдо"), и один для проведения калибровки. Эти блюда используются повторно от эксперимента к эксперименту, и, таким образом этот шаг необходим только повторить, если блюдо перерывов. Изображение для анализа блюдо показано на фиг.2.
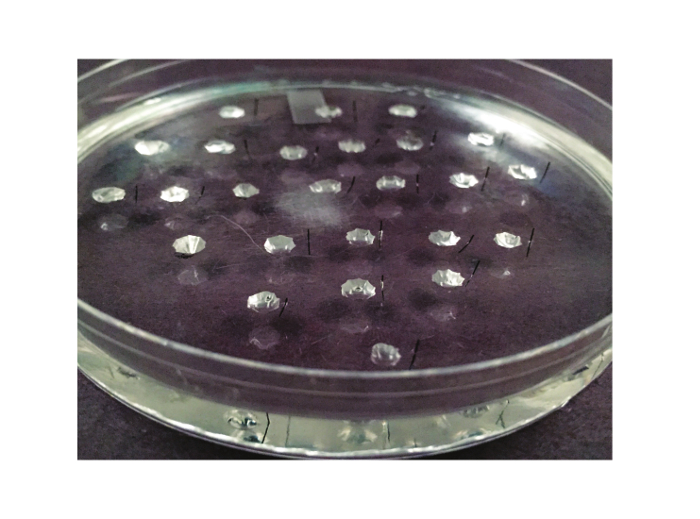
Рисунок 2. Анализ блюдо. Блюдо для анализа Рамсей показано здесь. Он находится в 10 см чашку Петри, которая выстлана силиконового эластомера. Между 20 и 25 скважин, вырезанные из эластомера. Minutien металлический штырь, разрезать пополам, находится справа от каждой скважины (или влево, если экспериментатор левша).TPS: //www.jove.com/files/ftp_upload/53144/53144fig2large.jpg "целевых =" _blank "> Нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Использование перчатки, залить ~ 80 г силиконового эластомера базу в стеклянном стакане. Добавить 1/10 веса (8 г) силиконовой эластомерной лекарство. Перемешать с металлической мешалкой. Поместите на орбитальном шейкере с плоской вершиной на пологом скорости, например, 100 оборотов в минуту, в течение нескольких часов, пока все пузырьки не будут удалены.
- Вылейте силиконового эластомера в чистоте пластиковые чашки Петри: 100 мм х 15 мм блюда для вскрытия и анализа блюд и 35 х 10 мм для калибровки блюдо. Толщина слоя эластомера должно быть ~ 6 - 7 мм для мм чашки 100 и ~ 5 мм для 35 мм чашку.
- Поместите посуду на скамейке при комнатной температуре (RT), чтобы вылечить (твердеют), ~ 24 - 48 ч.
- После того, как анализ блюдо вылечить, подготовить меньшую партию силиконового эластомера, как в шаге 1.1., Например, 10 г силиконовой базе эластомера с 1 г лечения. Встряхнуть на орбитальнойне шейкер, как и в шаге 1.1 до пузырьки воздуха больше не присутствует. Это эластомер быть использован на стадии 1.5.4 и не должны затвердеть до этого шага.
- Использование хирургического скальпеля и стандартные меры предосторожности острых предметов, сделать скважин в одном из 100 мм силиконового эластомера покрытием чашки Петри. Это будет тест блюдо.
- Сделать скважин ~ 1 см друг от друга и с диаметром ~ 3 - 4 мм. 25 скважин может легко поместиться в 100 мм анализа блюдо. Скважины должны быть не менее 6 мм, удаленные от стенок тарелки. Рисунок 2 иллюстрирует расстояния между скважинами. Каждый хорошо будет содержать одну жидкости секретирующих трубочку во время эксперимента. Таким образом, блюдо, содержащее 25 скважин позволит 25 канальцы, которые будут проанализированы.
- Используйте постоянный маркер, чтобы отметить положение скважин при необходимости.
- Сделать стены хорошо так гладко, как это возможно путем размещения скальпель в эластомера, а затем с помощью противоположной стороны, чтобы повернуть блюдо на 360 °.
- Затем, используя стандартную ша RPS меры предосторожности, окуните 30 G иглу в Неотвердевший эластомера с шага 1.4 и поместите небольшое падение на дно каждой лунки. Это сглаживает дно колодца. Разрешить вылечить (затвердевают) х 24 - 48 ч.
- Подготовьте штифты Minutien.
- Поместите 0,15 мм черный анодированный Minutien булавки в ряд на куске 1 дюйм стандарт маркировки лабораторного ленты. Длинная ось булавки "должны быть ортогональны продольной оси ленты в. Разрежьте ленту вдоль его длины для того, чтобы разорвать каждый штифт на две приблизительно равные половины (рисунок 3). Используйте одну половину-контактный для каждой скважины.

Рисунок 3. Резка Minutien Pins. Штифты выстроились на части маркировки ленты параллельно. Затем, ножницы используются для резки контакты в половине.ge.jpg "целевых =" _blank "> Нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Вставьте каждую половину-штифт в силиконового эластомера примерно 1 мм вправо каждой скважины (если правша, если левша, вставьте штифт слева от каждой скважины). Это легко делается при визуализации скважин на малой мощности при вскрытии стереомикроскопом и автоматизированного с помощью тупого пинцета. Рисунок 2 иллюстрирует позиционирование булавки.
2. Подготовка Изысканные стеклянные палочки
Примечание: На этом этапе, стеклянный стержень получают, что будет использоваться для передачи канальцев из рассекает блюдо в каплю купания. Стеклянный стержень используется повторно от эксперимента к эксперименту, поэтому этот шаг выполняется только один раз, если стержень ломается и новый не требуется.
- Получить листов 3 мм (1/8 дюйма) окрашивали черного стекла с хобби магазин и соответствующей стекла-cutting оборудование, такое как стеклорез и плоскогубцы. Используйте соответствующее оборудование безопасности (толстые перчатки, защитные очки).
- Вырезать стекло на полоски длинных ~ 6 мм в ширину х 10 см
- Держите полоску стекла в каждой руке. Смягчить короткий конец каждой полоски над пламенем горелки Бунзена, используя соответствующие меры предосторожности. Затем нажмите концы двух полос вместе и растащить в плавное движение, чтобы создать прекрасный стеклянный стержень с ручкой.
3. Физиология установки
Примечание: На этом этапе, микроскоп, электрометр и электрическая цепь установки. Кроме периодической повторной хлорирующим (шаг 3.2) серебряных проводов и повторной калибровки электрометра (шаг 3.8), этот шаг выполняется только один раз. Рисунок 4 иллюстрирует настройку.

Рисунок 4. Физиология установки. Настройка физиология фото здесь. (А) Обзор установки. Стереомикроскопом находится внутри клетки Фарадея с микроманипуляторами по обе стороны. Волоконно-оптический свет продет через отверстие в стороне клетки Фарадея. Электрометр находится вне клетки Фарадея. (B), хлорид пальто серебряные провода, проволока погружается в отбеливатель. (С) Крупным планом установки. Прямой держатель микроэлектрод, как показано на рисунке слева, с резьбой на зонд электрометра. Ионный конкретных электрод будет иметь резьбу на серебряной проволоки в держатель электрода. Справа, электрод имеет резьбу на серебряной проволоки держателя микроэлектродов 45 °. Схема затем должны быть соответствующим образом заземлен. Анализ блюдо показано, как он будет установлен при выполнении измерений. Пожалуйста,Нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Поместите stereomicrosope с окулярного микрометра внутри клетки Фарадея. Первый в интерьере клетки Фарадея, которая затем заземленной на шасси земли электрометра. Поместите микроманипуляторами по обе стороны микроскопа (фиг.4А).
- Хлорид две серебряные провода при погружении в хлорной извести в течение, по крайней мере 1 час. Продлить ночь (O / N), при необходимости (рис 4B). Повторите этот шаг, когда серебряные провода должны быть повторно хлорированном, например, если они окрашены в серый внешний вид, а не черный.
- Автор одной хлорированном серебряной проволоки в каждый из держателей микроэлектродов.
- Установите электрическую цепь с соответствующим заземлением. Например, разместить вентилируемый, прямой держатель микроэлектрода, который будет содержать ион-специфических электродов (ISE), на электрометра зонда, который закреплен на микроманипулятором (фиг.4С).
- Закрепите вентилируемый, 45 ° держатель микроэлектродного, который будет держать электрод сравнения, на другой микроманипулятора (рис 4C). Тогда земля с печатной земли на электрометра.
- Заземление "AB" из вывода BNC электрометра на шасси земли электрометра.
- Поместите оптический источник света за пределами клетки Фарадея, с моноблочной трубы резьбового через отверстие в клетке Фарадея (рис 4а).
- Настройка и калибровка электрометр в соответствии с инструкциями изготовителя. Re-калибровку электрометра на регулярной основе (каждые 1 - 2 недели). После завершения, а между измерениями, оставьте электрометр в режиме "Standby" с позиции переключателя установлен на "В", вход метр установлен в "А" и ряд установлен в "200 мВ".
4. Подготовьте решения рассекает и баня
- Подготовка дрозофилы физиологического раствора как указано в таблице 1. Для использования в экспериментах, залить ~ 40 мл в 50 мл коническую трубку и держать при комнатной температуре. Откажитесь, если есть доказательства бактериальной или грибковой роста.
- Для приготовления стандартного купальный среду (SBM), смешать Drosophila солевой раствор 1: 1 со средой Шнайдера, и проходят через фильтр в шприце 0,22 мкм. Подготовьте небольшими аликвотами (~ 10 - 15 мл), хранят при температуре 4 ° С и отбросить, если имеются данные о бактериальной или грибковой роста. Компоненты среды Шнайдера приведены в таблице 2.
5. Создание ион-специфических электродов: Silanizing Пипец
Примечание: На этом этапе, дихлордиметилсиланом используется, чтобы слегка "silanize" ион-специфических электродов. Это добавляет гидрофобный слой на внутренней стороне электрода, что позволяет ему сохранить гидрофобный ионофор. Чрезмерное силанизация избежать, чтобы предотвратить поглощение минерального масла при изготовлении мeasurements в каплях под масла. Силанизированные электроды хорошо в течение нескольких недель. Таким образом, этот этап выполняется каждые несколько недель.
- Пламя-польский концы 5 - 6 unfilamented труб из боросиликатного стекла капиллярных (внешний диаметр 1,2 мм, внутренний диаметр 0,69 мм, длина 10 см) на слабом огне, используя соответствующие меры предосторожности.
- Поместите капилляры в нижней части 1 л стеклянном стакане.
- В капюшоне и с помощью соответствующих средств индивидуальной защиты, залить 70% азотную кислоту (ВНИМАНИЕ: легковоспламеняющиеся и коррозионные см Паспорт безопасности для безопасного хранения и обработки инструкций) по капилляров и выдержите в течение 5 мин.
- Налейте азотную кислоту обратно в стеклянную колбу. Повторное использование для последующей промывкой азотной кислоты.
- Добавить ~ 200 мл деионизированной H 2 O в стакан. Пусто отходов в специальную стеклянную бутылку для отходов азотной кислоты. Повторите с дополнительными 200 мл деионизированной H 2 O. Следуйте институциональные рекомендации по гое безопасное удаление кислотных отходов.
- У трех дополнительных промывок с большими объемами деионизированной воды. Слейте в раковине.
- В капот, разместить капиллярных трубок на горячей плите с керамической верхней набора до 200 ° С и сухой в течение как минимум 20 мин, оптимально 1 часа. Он также может быть оставлен на более длительные периоды времени.
- На пипетки съемник (рис 5А), потяните пипец диаметром кончика ~ 1 - 2 мкм.
- Поместите вытащил пипец обратно на плиту, стараясь не сломать советы, по крайней мере, 10 мин, 30 мин оптимально, но можно оставить на дольше.
- Добавьте 20 мкл дихлордиметилсилана (ВНИМАНИЕ: легковоспламеняющиеся, коррозионные, острой токсичности, см Паспорт безопасности для безопасного хранения и обработки инструкций) в 15 см стекло Петри и инвертировать блюдо в течение пипец на горячей плите (рис 5B). Оставьте на месте в течение по крайней мере 20 мин, оптимально 2 ч. То же самое Петри могут быть повторно использованы в последующих экспериментах.
- Определить Amou нт дихлордиметилсиланом добавлен методом проб и ошибок. После ионофор добавляется (этап 8.4), убедитесь, что интерфейс между ионофора и засыпки раствора плоская (5С). Если интерфейс является вогнутой, то это указывает чрезмерно силанизацией, и менее силан должен быть использован. Если интерфейс является выпуклым, то это указывает под силанизацией и более силан должен быть использован.
Примечание: дихлордиметилсиланом имеет тенденцию к "выключено" в течение долгого времени, то есть, менее эффективны силанизация достигается с таким же объемом силана.. В этот момент, как новых, силан можно заказать, или количество доводили до достижения эквивалентной силанизация.
- Определить Amou нт дихлордиметилсиланом добавлен методом проб и ошибок. После ионофор добавляется (этап 8.4), убедитесь, что интерфейс между ионофора и засыпки раствора плоская (5С). Если интерфейс является вогнутой, то это указывает чрезмерно силанизацией, и менее силан должен быть использован. Если интерфейс является выпуклым, то это указывает под силанизацией и более силан должен быть использован.
- Выключите плитку и дайте ему остыть. Удалить стеклянную чашку Петри и передачи пипетки с хранения сосуд, содержащий силикагель, которая поддерживает высыхание. Осторожно обращайтесь пипец (щипцы полезно), чтобы предотвратить нарушение чаевые.
5 "SRC =" / файлы / ftp_upload / 53144 / 53144fig5.jpg "/>
Рисунок 5. Silanizing Пипец. (A) Пример пипетки съемника. (Б) Изображение выдернутыми пипец на горячей плите. Стекло блюдо, содержащее каплю дихлордиметилсилана была перевернутой над вытащил пипец. (С) схему, иллюстрирующую взаимосвязь между коктейля ионофором и засыпки раствора. Плоский интерфейс показывает оптимальную силанизация. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
6. Подготовка отрицательный всасывающего устройства
Примечание: На этом этапе, простой отрицательной всасывающее устройство подготовлено (рисунок 6), который будет использоваться для заполнения ион-специфических электродов. Этот этап выполняется только один раз.
- Прикрепите 3 мл шприц с 3 ходовой кран с люэровского. Впротивоположный конец кран, содержащий вращающуюся воротник и охранник, винт в охватывающий соединитель Люэра замок с колючей конце. Затем прикрепите силиконовые трубки, 1/16 дюйма внутренний диаметр 1/8 дюйма с внешним диаметром, с колючей конце разъем. Затем вставьте пластиковые трубы с 1/32 дюйма внутреннего диаметра и 3/32 дюйма внешний диаметр
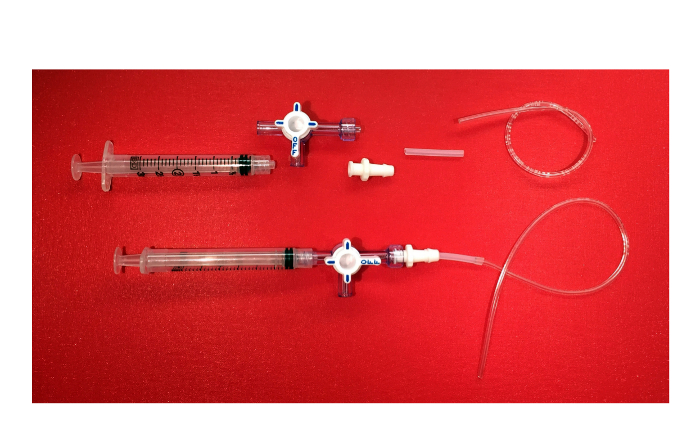
Рисунок 6. Отрицательный всасывания устройств. Изображение компонентов отрицательного всасывающего устройства (3 мл шприц с Луер замок, 3-полосная кран с вращающимся воротником и гвардии, женской Луер блокировки разъема с колючей конце, силиконовой трубки, пластиковые трубы) и конечный продукт. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
7. Соберите Мухи для вскрытия < / P>
- Используйте стандартные методы животноводства лету 25 настроить летать кресты и изменять по мере необходимости. Например, можно использовать повышение температуры (например, 28 ° C) в экспериментах, где увеличена GAL4 желательна его активность.
Примечание: Важно, чтобы мухи не воспитал в чрезмерно стесненных условиях; число мужчин и женщин, родителей должен быть уменьшен в этом случае. Если разные генотипы используются, число мужчин и женщин, родителей должны быть скорректированы, чтобы получить примерно одинаковое количество потомства. - Соберите мух для вскрытия (шаг 11) с использованием методов стандартной летать животноводства 25 в течение 1 - 2 дней Eclosion. Трубочки из женских мух легче рассеченные, но канальцев самцов мух также может быть использован, если это необходимо или желательно. Место летит в пробирку, содержащую летучую пищу. Поместите флаконов при желаемой температуре в течение 3 - 5 дней до вскрытия.
8. Заполнение Ion-специфический электрод (ISE)
e_content "> Примечание:.. На этом этапе, ИНО засыпается раствором соли, а затем ионофор вводится в наконечник ИНО может быть повторно использован изо дня в день, пока он работает хорошо Таким образом, этот шаг выполняется каждые несколько дней по мере необходимости.- Чтобы сделать K + Определённые электрод, засыпки в Силанизированные пипетки с 0,5 М KCl с помощью шприца 1 мл и микрофиламентов (повторного использования микрофиламентов от эксперимента к эксперименту). Убедитесь, что засыпка решение заполняет до самого кончика пипетки - без воздуха в наконечник. Если неизвестно, визуализировать под микроскопом соединение. Выбить пузырьки воздуха, осторожно стряхивая пипетки.
- Для Na + -специфический электрода, засыпки 150 мМ NaCl.
- Вставьте заднюю часть ISE в пластиковой трубки отрицательного всасывающего устройства, полученного на стадии 6. В капотом, разместить ISE на перевернутой пластмассовой 3.5 см чашки Петри с куском пластилина, чтобы обеспечить на месте.
- Создание негативного рия с помощью всасывающего устройства. Нарисуйте назад на шприц с "OFF" на кран ручки указывая в сторону боковой порт. Количество отступая будет варьироваться, но обычно находится в диапазоне от 0,6 - 0,7 мл. Затем поверните ручку краном так "от" направлен в сторону трубки.
- В капюшоне и с помощью соответствующих средств индивидуальной защиты, опустите 1 - 10 мкл пипетки наконечник в ионофором раствора (ВНИМАНИЕ: токсичные См ПАСПОРТ БЕЗОПАСНОСТИ для безопасного хранения и обработки инструкций.). Выгнать небольшую каплю путем размещения палец в перчатке над большим открытием наконечника пипетки. Затем коснитесь капли ионофора к оконечности ISE, без касания кончиком ISE с наконечником пипетки, чтобы избежать нарушения кончик ISE.
- Используйте ионофор калия, перечисленных в таблице материалов "как есть". Чтобы подготовить ионофор натрия, чтобы решение (в% вес / вес) 10% 4-трет -butylcalix [4] арена-тетрауксусной тетраэтиловый кислоты, 89.75% Нитрофенил октил эфира и 0,25% натрия борат тетрафенилборат (ВНИМАНИЕ:. Токсичен См ПАСПОРТ БЕЗОПАСНОСТИ для безопасного хранения и обработки инструкций). Хранить в стеклянном флаконе, завернутые в фольгу, чтобы оградить от света.
- Изучить ISE под 40-кратном увеличении с использованием сложного микроскопа, чтобы определить, является ли ионофор был "рассмотрен" в наконечник и ISE ли интерфейс ионофор / засыпки решение является плоской (см шаг 5.10.1 и 5С).
- Если нет ионофор не был рассмотрен, увеличить количество отрицательного давления, создаваемого всасывающим устройством. Если это не удается, электрод может быть недостаточно силанизированы. Повторите шаг 5, используя большее количество дихлордиметилсилана.
- Поместите ISE, чаевые вниз, на стене стакане, частично заполненной 150 мМ KCl. Закрепить ISE, помещая моделирования глины на стороне стакана. Наконечник находится в пределах 150 мМ KCl. Продолжайте использовать ISE овэр несколько дней, пока он работает хорошо (см шаг 10,6).
- Для Na + ISE, хранить электрод в 150 мМ NaCl.
9. Подготовьте электрод сравнения
Примечание: Шаги 9,1 - 9,3 могут быть выполнены заранее. Шаги 9.4 - 9.6 выполняются каждая экспериментальная день.
- Пламя-польский концы труб 10 филаментированных боросиликатного стекла капиллярных (внешний диаметр 1,2 мм, внутренний диаметр 0,69 мм, длина 10 см) на слабом огне, используя меры предосторожности.
- На пипетки съемник, потяните пипец диаметром кончика ~ 1 - 2 мкм.
- Храните пипец в памяти пипетки банку до использования. Пипец можно хранить неопределенно долго.
- В день эксперимента, используя шприц и микрофиламентов, заполнить наконечник и хвостовик пипетки с ацетатом натрия 1 М. Убедитесь, нет пузырьков воздуха и это решение идет в конце. Аккуратно вылить пипетки, если пузырьки воздуха присутствуют.
- С помощью второгомикрофиламентных и шприцев, засыпки пипетки с 3 М KCl. Опять же, обеспечить воздушные пузырьки не присутствуют.
- Хранить электрод в химический стакан, содержащий 150 мМ KCl (см шаг 8,6).
10. Калибровка ISE
Примечание: Этот шаг выполняется три раза в день эксперимента: в начале дня, чтобы убедиться, что ИНО работает, а затем до и после измерений 20 - 25 капель жидкости секретируемых (таблица 3).
- Для калибровки калия ISE, поместите два 0,6 мкл капли каждого из следующих четырех концентрациях KCl на силиконового эластомера покрытием 3,5 см чашку Петри (полученного на стадии 1): 15 мм, 75 мм, 150 мм и 200 мм. Тщательно слой 2 мл минерального масла в течение капель.
- Для натрия ISE, использовать калибровочные капель 15 и 150 мм NaCl.
- Поместите калибровочный блюдо на стадии стереомикроскопом в клетке Фарадея и осветить.
- АвтошоуОбъявление ИНО и электрод сравнения в течение серебряных проводов и закрепите в держатели микроэлектродов.
- Использование микроманипуляторами, продвигать ISE и электродов сравнения в каплю 15 мМ KCl.
- Включите электрометр, чтобы "работать" режим. Разрешить чтение, чтобы обосноваться.
- Запись чтение в блокнот. Повторите с 75 мм, 150 мм и 200 мМ падает. Рассчитать наклон, чтобы определить, является ли ISE работает хорошо (см шаг 13.1 и таблицу 3). Если нет, подготовить новый ISE.
Примечание: Знаки, что ISE не работает хорошо: отказ получить чтение; медленно, чтобы уравновесить (несколько секунд или больше); нестабильная чтение; Наклон <49 мВ / изменение децильная в K + или Na + концентрации. - Между первой калибровки дня и измерений, выполненных на этапе 12, то есть во время выполнения шага 11 (канальцев вскрытия), хранить ISE и электродов сравнения в 150 мМ KCl (как описано в шаге 8.6).
11. Вскрытие канальцев
Примечание: Этот этап выполняется в день эксперимента.
- Аликвоты из небольшого количества (~ 500 - 600 мкл) стандарт ванны среды (SBM), полученного на стадии 4.2, для использования в день эксперимента, и позволяют нагреваться до комнатной температуры. Это должно быть сделано по крайней мере, за 30 мин до вскрытия, но также может быть сделано ранее. Кроме того, по крайней мере, 20 мл физиологического раствора РТ Drosophila (шаг 4.1) доступны перед началом вскрытия.
- Непосредственно перед началом вскрытия: смотреть анализа блюдо в 10-кратным увеличением при помощи стереомикроскопа и добавить достаточно SBM почти заполнить каждую лунку в аналитическом блюдо, как правило, между 10 и 30 мкл. Если наркотики или пептид будет добавлен в SBM середине эксперимента, сделать замечание о точном объеме SBM добавляли в каждую лунку. Избегайте чрезмерного заполнения скважины, так как это может привести к трубочку уплывает в ходе эксперимента.
- Тщательно слой ~ 12 - 13 мл минерального масла на вершине, так что скважинахвновь закрыты. Это позволит предотвратить испарение капель жидкости секретируемых в ходе эксперимента.
- Место летит разрезать на СО 2 подушки.
- Возьмите муху через его ногу или крыло с пинцетом и место на спине (вентральной стороной вверх) на силиконовый эластомер покрытием рассекает блюдо, полученного на стадии 1. Прокалывание грудную клетку с булавкой Minutien обеспечить муху на месте.
- Добавить каплю РТ Drosophila физиологического раствора (шаг 4.1), чтобы погрузиться муху в физиологическом растворе.
- Дополнительно: обрезать крылья и ноги. На практике это обычно не требуется.
- Используйте не доминантной рукой пинцет, чтобы "держать" живот мухи на торакоабдоминальной перехода. Используйте доминирующую руку пинцет, чтобы очистить брюшную кутикулы прочь, начиная с торако-абдоминальной перехода и движется в направлении задней части лету. Кишка, с прикрепленными мальпигиевых канальцев, должны подвергаться с этого маневра.
- Не касаясь канальцы, рассекают бесплатно средняя кишка /задняя кишка и прикрепленные трубочки. Держите кишки в не доминантной рукой пинцетом и использовать 30 G иглу, чтобы разъединить мочеточник из кишечника, снятие канальцев из кишечника и бесплатно от fly.It важно, что без слез или арендная плата не будет введена в трубочку, кроме как по мочеточнику.
Примечание: Передняя пара канальцев наиболее легко рассекали, однако задние канальцы могут быть также использованы. - Использование тонкой стеклянной палочкой (шаг 2), подобрать пару канальцев и передачи в лунку анализа блюдо.
- Сразу же после пара трубочка была передана в колодец, подобрать конец одного из канальцев с стеклянной палочкой, отказаться от падения купальный пока срез мочеточника не находится на полпути между штифтом и падения купания, и обертки конец трубочки вокруг штифта с помощью стеклянной палочки. В конце этого маневра, один канальцев остается в капле ванны соли и секретируют жидкость из обрезанный конец мочеточника, как показано на рисунке 1 . Другой трубочка, назвал "якорь трубочку" на рисунке 1, обернута вокруг пальца. Это закрепляет секрецию канальцев на месте, в окружении нефти, и не выделяют жидкость.
- Сразу после шага 11.11, запишите хорошо (например, А, В, С), трубочка идентификации информации (например,., Генотип или состояние), и время (это время начала, когда жидкость начнет быть секретируется трубочку в капле физиологического раствора для купания).
- Переходите к следующей вскрытия. После того, как экспериментатор специалистам в этой технике, это обычно занимает 3 - 4 минут, чтобы рассекать пару трубочек, передавать их для купания физиологическим раствором, и оберните якорный трубочку вокруг пальца. Таким образом, 20 - 25 канальцы могут быть установлены в анализе Ramsay течение 1,5 ч. Поэтому время начала каждого канальца будет около 3 - 4 мин после начала времени предыдущего трубочку.
12. Проведение измерений
Примечание: Этот этап выполняется в день эксперимента.
- Калибровка ISE (шаг 10) примерно 20 мин до первого измерения. Это позволяет время, чтобы сделать новую ISE, если необходимо.
Примечание: в заданное время, например, после 2 часов секреции, секретируемый падение жидкости каждого канальца готов к измерению. - Запишите время измерения. Измерить диаметр секретируемого капли жидкости с помощью окулярного микрометра и запись. Обратите внимание на увеличение, например, 50X.
- Продвигайте ISE и электрод сравнения в капле жидкости. Включите электрометр, чтобы "работать". Позвольте стабилизации показаний. Запишите значение.
- Повторите для следующего падения.
- В конце эксперимента, повторить измерения калибровки (шаг 10).
13. Расчеты
Примечание: Этот шаг может быть выполнен либо в конце дня эксперимента, или в более позднее время.
- Рассчитать среднееНаклон / изменение децильная концентрации калия. Таблицу 3 в качестве примера.
Примечание: Для натрия, значения будут разницу между 150 измерений мМ NaCl в 15 мМ и. - Определить среднее значение двух измерений (до и после) 200 мм KCl (или 150 мМ NaCl).
- Рассчитайте объем каждой капли. V = πd 3/6, где d представляет собой диаметр капли измеренного с окулярного микрометра на шаге 12.2.
- Рассчитать скорость секреции = V / время (Нл / мин / канальцев), где V является объем капли, определенной в шаге 13,3, а время длина время трубочка секретируется жидкости (= время измерения - время, потянув мочеточника из купания капли).
- Рассчитать концентрацию ионов по формуле [K] = 10e (Dgr; v / S) * 200 или [Na] = 10е (Dgr; v / S) * 150, где Av = разность (в мВ) между потенциалом измеряемой секретируемого жидкости падение, и потенциал падения 200 мм калибровки (Fили калия; 150 мМ падение для натрия). S = наклон определено на этапе 13.1.
- Рассчитать потока ионов = [] ионный х жидкости скорость секреции. Для Drosophila канальцев, это будет пмоль / мин / канальцев.
14. Очистка
Примечание: Этот этап выполняется в конце дня эксперимента.
- Тщательная очистка колодцев необходимо для того, чтобы остаточные кристаллы соли не остаются в скважинах, изменяя концентрацию ионов и осмолярность в будущих экспериментах.
- Разрешить минеральное масло для отвода.
- Промыть лунки анализа блюдо. Пипетки наконечник 200 мкл могут быть использованы, чтобы аккуратно соскрести остаточный кристаллов соли. Использование пластиковых труб, прикрепленный к крану, выжать трубки, чтобы создать самолет высокого давления горячей воды, чтобы тщательно промыть каждую лунку.
- Дайте высохнуть O / N. В качестве альтернативы, сушилка удара могут быть использованы для высыхают колодцы.
- Смойте щипцы деионизированной H 2 O изамочить в этаноле в течение 15 мин до нескольких часов.
- Слейте масло от калибровки блюдо и мыть горячей водой. Используйте мыло, а также пор, пока она тщательно смыть. Выполните окончательную промыть дистиллированной H 2 O.
- Флеш микрофиламенты и шприцы с дистиллированной H 2 O.
Результаты
7 и 8 показывают, что применение анализа Ramsay с ион-специфических электродов для измерения концентрации К + и Na + можно выделить генетически и фармакологически отличный K + и флюсы Na +, информацию, которая не захвачен измерения плавные частоты секреции в пок?...
Обсуждение
Применение анализа Ramsay вместе с ион-специфических электродов, позволяет измерять жидкости ставок секреции и ионных потоков в изолированных насекомых мальпигиевых (почечных канальцев). Двадцать и более канальцы могут быть проанализированы в то время, позволяя более высокую пропускну?...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Материалы
| Name | Company | Catalog Number | Comments |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30 G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionophore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
Ссылки
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O'Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O'Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O'Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O'Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O'Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O'Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O'Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O'Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены