A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل بصيلات الشعر الخلايا الجذعية والخلايا الكيراتينية البشرة من الجلد الظهرية ماوس
In This Article
Summary
An ideal model for studying adult stem cell biology is the mouse hair follicle. Here we present a protocol for isolating different populations of hair follicles stem cells and epidermal keratinocytes, employing enzymatic digestion of mouse dorsal skin followed by FACS analysis.
Abstract
The hair follicle (HF) is an ideal system for studying the biology and regulation of adult stem cells (SCs). This dynamic mini organ is replenished by distinct pools of SCs, which are located in the permanent portion of the HF, a region known as the bulge. These multipotent bulge SCs were initially identified as slow cycling label retaining cells; however, their isolation has been made feasible after identification of specific cell markers, such as CD34 and keratin 15 (K15). Here, we describe a robust method for isolating bulge SCs and epidermal keratinocytes from mouse HFs utilizing fluorescence activated cell-sorting (FACS) technology. Isolated hair follicle SCs (HFSCs) can be utilized in various in vivo grafting models and are a valuable in vitro model for studying the mechanisms that govern multipotency, quiescence and activation.
Introduction
الخلايا الجذعية البالغة (المنبوذة) ضرورية للحفاظ على توازن الأنسجة عن طريق استبدال الخلايا الميتة وإصلاح الأنسجة التالفة على الاصابة. وتعرف هذه المنبوذة من خلال قدرتها على الخضوع المستمر تجديد الذات والتمايز إلى مختلف الأنساب الخلية 1-3. وتشمل أنظمة أفضل درس، التي تعتمد على المنبوذة الكبار للتجديد، ونظام المكونة للدم، والأمعاء والجلد 1،2،4.
خلال مرحلة التطور الجنيني، ويبدأ الجلد وطبقة واحدة من خلايا البشرة. التشكل من بصيلات الشعر (HF) يبدأ عندما إلى ملء خلايا اللحمة المتوسطة الجلد وتشكل الأدمة الكولاجينية الكامنة 5. المتخصصة خلايا اللحمة المتوسطة، التي تشكل في وقت لاحق حليمة الجلد (DP)، وتنظيم مباشرة تحت طبقة البشرة وتحفيز ظهارة لتشكيل اللوحاءات الشعر التي تبدأ في النمو إلى أسفل 6. المتكاثرة غاية خلايا المصفوفة، وتقع في الجزء السفلي من HF،المغلف هذه الخلايا الوسيطة وتشكيل لمبة الشعر، في حين تبدأ الطبقة الداخلية على التمايز إلى اسطوانات متحدة المركز لتشكيل عمود الشعر (HS) والمحيطة غمد الجذر الداخلية (IRS) 2،3.
في الحياة بعد الولادة وتتألف البشرة البشرة من ثلاث مقصورات: البشرة البيني (IFE)، والغدد الدهنية (SG) وHF. وعلى النقيض من IFE وسان جرمان والتي هي في حالة دائمة من التوازن، وHF هي عملية ديناميكية مصغرة الجهاز الذي يخضع لدورات مستمرة من النمو (طور التنامي) وتدمير (فترة التراجع) وبقية (تساقط الشعر) 4،7. الخلايا الجذعية بصيلات الشعر (HFSCs) التي تغذي هذه الدورة الدائبة، يقيمون في محراب متخصصة داخل HF المعروفة باسم انتفاخ 4. خلال التنامي في HFSCs الخروج من انتفاخ، في أعقاب إشارات التنشيط من موانئ دبي، تبدأ المتكاثرة وتنحدر إلى الأسفل وبالتالي خلق درب خطي طويل من الخلايا المعروفة باسم غمد الجذر الخارجي (ORS) 8-10. خلايا المصفوفة، التيتحيط موانئ دبي في قاعدة HF، دورة بسرعة ويتجه للأعلى تمر التمايز محطة بالتالي توليد HS ومصلحة الضرائب 10 (الشكل 1). مدة طور التنامي يحدد طول الشعر وتعتمد على قدرة التكاثري وتمايز الخلايا مصفوفة 6. عندما يدخل HF فترة التراجع، وخلايا مصفوفة العبور تضخيم في وقف لمبة لتتكاثر، الخضوع لموت الخلايا المبرمج وتتراجع تماما في حين سحب موانئ دبي إلى أعلى حتى يصل إلى جزء غير ركوب الدراجات للHF 8،11. خلال هذا التراجع في HF تشكل بنية مؤقتة تعرف حبلا طلائي، الذي هو سمة من فترة التراجع، ويحتوي على العديد من الخلايا أفكارك. في الفئران، فترة التراجع يدوم بين 3-4 أيام وتتم مزامنة للغاية في دورة الشعر الأولى. عندما تصل إلى HF تساقط الشعر كل HFSCs تصبح هادئة. وتتميز مراحل متميزة من دورة HF أيضا بالتغيرات التي تطرأ على لون الجلد الماوس، نظرا إلى mإنتاج elanin. التغيرات الجلدية من الأسود خلال طور التنامي إلى الرمادي الداكن خلال فترة التراجع إلى الوردي أثناء تساقط الشعر 6،7،12،13.
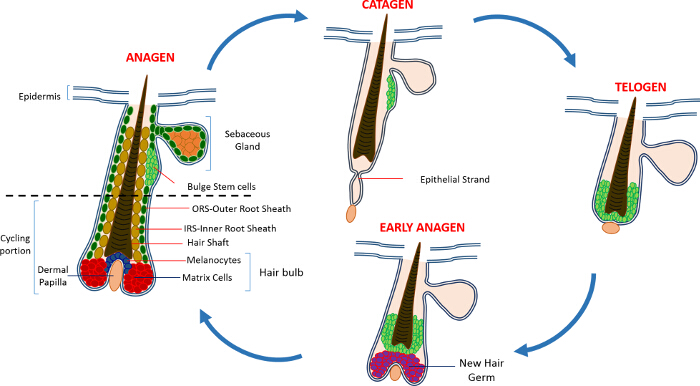
الشكل 1: دورة الشعر المسام. يتكون HF من الجزء العلوي دائم وإعادة عرض أقل باستمرار، وركوب الدراجات الجزء الذي يخضع لدورات مستمرة من النمو السريع (طور التنامي) وتدمير (فترة التراجع) ومرحلة هدوء نسبي أو الراحة (في طور الراحة). الرجاء النقر هنا لعرض أكبر نسخة من هذا الرقم.
وقد تم التعرف على المنبوذة الحفاظ على HF في البداية باستخدام التجارب مطاردة، مع الثيميدين معالج بالتريتيوم، كشفت عن وجود سكان بطيئة الدراجات التسمية خلايا الاحتفاظ (LRC) أن يقيمون في منطقة الدائمة للHF أقل بقليل من سان جرمان 14. التقدم في HFSCكشفت توصيف عدد قليل من علامات التي يمكن استخدامها لتحديد وعزل المنبوذة محددة من مكانة HF 15. ولعل أفضل علامة للحصول على إثراء HFSCs هي CD34، علامة سطح الخلية التي تم تحديدها أيضا كعلامة SC المكونة للدم في البشر 16. وفي هذا CD34 + الشعبين السكان متميزة كما تم عزل استنادا α6 إنتغرين التعبير 2. علامة أخرى هي الكيراتين 15 (K15) وهو ما يعبر عنه بشكل كبير في المنطقة انتفاخ، وشارك في يموضع مع التعبير CD34، ويستخدم مروج K15 لاستهداف وعزل HFSCs في الحيوانات المعدلة وراثيا 15،17-19. في العقد الماضي، كما تم الإبلاغ عن العديد من السكان متميزة أخرى من HFSCs والخلايا الاصلية في الإقامة داخل HF 17،20-27.
ميزة مثيرة إضافية من HFSCs هي مساهمتها في ترميم الجلد. في ظل ظروف طبيعية HFSCs تجديد HF ولا يشاركون في IFE التوازن. هاوالاصدار، ردا على إصابة هذه الخلايا خروج المتخصصة SC والمساعدات في إعادة إسكانها في IFE 9. لقد أثبتت مؤخرا أن الفئران حذفها لعرض Sept4 / الفنون الجينات الموالية لأفكارك زيادة عدد CD34، K15 وSox9 + HFSCs، التي تدل على مقاومة الخلايا. تم عزل HFSCs من Sept4 / فنون - / - جلود الظهرية باستخدام مضان خلية تنشيط الفرز (FACS)، وكان هناك أكثر من اثنين أضعاف في عدد من CD34 + وK15 + HFSCs. هذه Sept4 / فنون - / - تم توسيع HFSCs في المختبر وليس فقط أعطى ستؤدي إلى مزيد من المستعمرات ولكن كانت أيضا قادرة على تحمل الظروف أقسى مقارنة بمجموعة التحكم 28.
نتيجة وجود عدد متزايد من HFSCs، Sept4 / فنون - / - تلتئم الفئران بشكل أسرع في الاستجابة إلى وقوع إصابات استئصال الجلد. لافت للنظر، Sept4 / فنون - / - الفئران displayeدا عدد كبير من اسر مجدد من السرير الجرح، وندوب أصغر بكثير. وعلاوة على ذلك، أظهرت الفئران المحذوفة لXIAP (العاشر مرتبطة المانع من موت الخلايا المبرمج)، والهدف الكيمياء الحيوية من الفنون، وتضميد الجراح ضعف 28.
وقد أظهرت نتائجنا والعمل المنجز في غيرها من المختبرات التي HFSCs بمثابة نموذج مثالي لدراسة علم الأحياء وظيفة المنبوذة الكبار. هنا، نحن تصف منهجية لتخصيب اليورانيوم وعزل HFSCs والخلايا الكيراتينية البشرة على أساس التعبير عن أربع علامات: α6 إنتغرين. β1 إنتغرين. هيئة السلع التموينية 1 (أ علامة للحصول على الخلايا الكيراتينية البشرة) وCD34. العزلة مماثلة K15 + HFSCs كما يمكن تنفيذها باستخدام K15-GFP مراسل الماوس 19.
Protocol
وقد أجريت هذه الدراسة بما يتفق بدقة مع التوصيات الواردة في دليل لرعاية واستخدام الحيوانات المختبرية وزارة اسرائيل من الصحة. تم التعامل مع كل من الحيوانات وفقا لوافقت على بروتوكول رعاية الحيوان المؤسسية IL-02302-2015 معهد التخنيون إسرائيل للتكنولوجيا.
1. إعداد التجريبية
- إعداد بالكلاب مصل بقري جنيني
ملاحظة: الخلايا الظهارية حساسة جدا للكالسيوم لذا فمن الأهمية بمكان للسيطرة على التعرض لهذه الخلايا إلى الكالسيوم. من أجل ضمان أن الخلايا لا يتعرض إلى الكالسيوم أثناء عملية إزالة معدن ثقيل عملية العزل يستخدم لإزالة أي الكالسيوم المتبقية من مصل بقري جنيني المستخدمة في إعداد وعازلة تلطيخ 29. بروتوكول التالية يستعد حوالي 1 لتر من خالية من الكالسيوم مصل بقري جنيني اللازمة لإعداد عازلة تلطيخ FACS.- إضافة 400 غرام من مادة مخلبية الجافة، على سبيل المثال.، Chelex، في كوب 4 لتر وإضافة المقطر H 2 O إلى الحجم الكلي 4 L. الغلاف ويقلب باستمرار باستخدام محرك مغناطيسي.
- ضبط درجة الحموضة إلى 7.4 باستخدام 10 N حل حمض الهيدروكلوريك مع التحريك. يستمر التحريك لمدة 20 دقيقة، وإعادة ضبط درجة الحموضة حسب الحاجة حتى تبقى درجة الحموضة مستقرة لأكثر من 20 دقيقة.
- احتضان الكأس في 4 درجات مئوية خلال الليل للسماح للمادة مخلبية لتشكيل بيليه المضغوط. بعناية نضح H 2 O وإضافة H جديدة المقطر 2 O إلى الحجم الكلي من 4 ل.
- تكرار ضبط الأس الهيدروجيني كما في الخطوة 1.1.2.
- ضع الكأس في 4 درجة مئوية لمدة 1 ساعة للسماح للمادة مخلبية لتشكيل بيليه المضغوط. بعناية نضح H 2 O.
- ببطء إضافة 500 مل اثنين من زجاجات من المصل البقري الجنين لمادة مخلبية. يحرك ببطء في 4 درجات مئوية لمدة 1 ساعة ضمان سرعة الإعداد لا تنتج فقاعات.
- ضع الكأس في 4 درجة مئوية لمدة 1 ساعة للسماح للمادة مخلبية لتشكيل شركاتالعمل بيليه.
- نقل بعناية المصل في زجاجة 1 لتر وتصفية من خلال تصفية زجاجة أعلى تحت ظروف معقمة. تخزين المصل بالكلاب في -20 درجة مئوية أو استخدامها على الفور.
- إعداد تلطيخ العازلة
- إعداد 100 مل من 3٪ بالكلاب FBS في برنامج تلفزيوني بدون الكالسيوم والمغنيسيوم 2+ 2+ والحفاظ على الجليد.
2. عزل بصيلات الشعر من البشرة الكبار
- تخدير الفئران باستخدام 5٪ الأيزوفلورين باستخدام مربع الاستقراء. تم تحسين بروتوكول صفها هنا باستخدام 50-80 يوم الفئران القديمة التي هي في مرحلة تساقط الشعر من دورة HF.
- الموت ببطء الفئران وفقا للإجراءات المختبر القياسية. هنا، الموت ببطء الفئران باستخدام ثاني أكسيد الكربون 2 جرعة زائدة في غرفة القتل الرحيم.
- يحلق كل الشعر من الجلد الظهري استخدام كليبرز الكهربائية. تجنب الرأس والأطراف. الحفاظ على لوس انجليس كليبرز في أقرب وقت ممكن على الجلد. تجنب إتلاف الجلد وطبقة تحت الجلد.
- عندما تتم إزالة كل الشعر، واستخدام الايثانول 70٪ لإزالة أي بقايا الشعر وتطهير الجلد الظهرية.
- ضع الماوس على وسادة تشريح، واستخدام ملقط سحب ما يصل الجلد بالقرب من الذيل وجعل شق صغير باستخدام المقص. قطع الجلد ظهري كله في اتجاه الخلفي الأمامي عن طريق قطع بعناية بعيدا عن الجلد ويفصلها عن لفافة. تجنب إتلاف الطبقة العميقة من الجلد.
- وضع الجلد على حصيرة تشريح، جنبا الشعر لأسفل، وماهيتها اثنين من حواف المجاورة من الجلد لإصلاح في المكان. كشط بلطف من الدهون، وذلك باستخدام مشرط حادة حتى الأدمة واضحة ومرتبة.
ملاحظة: عندما كشط الدهون، واستخدام الملقط منحنية لتطبيق ضغط لطيف على الجلد. الضغط على الجلد باستخدام الجانب المنحني من الملقط. هذا سوف يمنع البشرة من تمزق. - وضع البشرة، الأدمة الجانب السلبي، في 100 مم طبق ثقافة عقيمة، وتصويب الجلد للتأكد من عدم وجود طيات. إضافة 10 مل من برنامج تلفزيوني من دون كا 2+ والمغنيسيوم 2+ (PBS -) لالطبق الثقافة وتصويب الجلد إذا لزم الأمر.
- نضح في برنامج تلفزيوني وإضافة 10 مل من 0.25٪ التربسين. تأكد من أن الجلد هو تكشفت ويتحرك بحرية. احتضان قطعة واحدة من الجلد لكل 10 مل من 0.25٪ التربسين.
- احتضان العينات عند 37 درجة مئوية لمدة 30-120 دقيقة أو عند 4 درجات مئوية خلال الليل.
3. إعداد تعليق خلية واحدة من بصيلات الشعر
- كشط كل الشعر من الجلد باستخدام ملقط المنحنية ومشرط، في سابقة لالاتجاه الخلفي. عقد الجلد في مكانها باستخدام الجانب المنحني من الملقط واستخدام مشرط لتتخلص من الشعر.
ملاحظة: كشط الشعر في حل التربسين وأضاف في الخطوة 2.8. تبدأ في الذيل واتبع اتجاه نمو الشعر. وكشط ضد اتجاه نمو الشعر يؤدي إلى خسارة كبيرة للاسر وانخفاض في العائد الخلية. حفص تميل إلى التمسك كل معا وتشكيل كتل صغيرة. من أجل الحد من عشرحجم البريد من كتل HF محاولة لكشط قبالة منطقة صغيرة في وقت واحد. - نقل الجلد أصلع إلى طبق ثقافة جديدة وإضافة 10 مل من برنامج تلفزيوني - لمنعها من الجفاف. تفقد الجلد وكشط أي الشعر المتبقية.
- كسر حفص باستخدام مشرط وملقط حتى يتم الحصول على تعليق HF واحد. يسحن بقوة تعليق HF باستخدام 10 ماصة مل لبضع دقائق لتفريق جميع كتل الشعر.
ملاحظة: إجراء كافة الخطوات التالية على الجليد. - نقل تعليق HF في المسمى قبل أنبوب 50 مل.
- نضح في برنامج تلفزيوني - من الجلد واستخدامه لشطف الطبق الثقافة الخلية التي تحتوي على تعليق HF. نقل إلى أنبوب 50 مل.
- غسل
- تصفية تعليق عن طريق تمرير من خلال مصفاة الخلية 70 ميكرومتر تركيبها في أنبوب 50 مل. غسل الأولي أنبوب 50 مل ومصفاة مع 10 مل من العازلة تلطيخ (PBS - مع 3٪ بالكلاب FBS).
- تصفية التعليق من المارةخلال 40 ميكرومتر مصفاة الخلية تركيبها في أنبوب 50 مل. غسل أنبوب مع 5-10 مل من العازلة تلطيخ للتأكد من أن كل الخلايا التي تم نقلها إلى أنبوب جديد. حافظ على تعليق على الجليد حتى يتم معالجة كافة الحيوانات.
- أجهزة الطرد المركزي لمدة 15 دقيقة في 300 x ج في 4 درجات مئوية. طاف نضح بعناية من دون إزعاج بيليه و resuspend بيليه في 5 مل من العازلة تلطيخ.
- أجهزة الطرد المركزي لمدة 5 دقائق 300 x ج في 4 درجات مئوية. نضح بعناية طاف و resuspend بيليه الخلية في 800 ميكرولتر من العازلة تلطيخ.
ملاحظة: وحدات التخزين المحددة أعلاه تكفي لتلطيخ الخلايا المشتقة من اثنين من الفئران الكبار.
- تعليق نقل إلى أنابيب FACS المسمى قبل.
- لأنابيب الضوابط، واتخاذ 25-50 ميكرولتر من تعليق خلية (أو أي اليسار المتبقي من التعليق الخلية)، وجعل ما يصل الى الحجم الكلي 300 ميكرولتر مع العازلة تلطيخ.
ملاحظة: إعداد أنابيب التحكم (إجمالي حجم 300 ميكرولتر) لغير ملوثين (أي الأجسام المضادةولا دابي)؛ دابي فقط؛ إنتغرين β1. إنتغرين α6. هيئة السلع التموينية، 1؛ CD34.
- لأنابيب الضوابط، واتخاذ 25-50 ميكرولتر من تعليق خلية (أو أي اليسار المتبقي من التعليق الخلية)، وجعل ما يصل الى الحجم الكلي 300 ميكرولتر مع العازلة تلطيخ.
- إضافة الأجسام المضادة الأولية ودابي (انظر المواد الطاولة لالتخفيفات المناسبة) في تركيزات المطلوب إلى أنبوب المناسب. نفض الغبار بلطف أنابيب لخلط تعليق خلية. العائد على الجليد ويغطى بورق الألومنيوم للحماية من الضوء.
- احتضان لمدة 30 دقيقة على الجليد ونفض الغبار أنابيب كل 10 دقيقة لضمان إبقاء الخلايا في تعليق بلطف.
- غسل الخلايا عن طريق ملء كل أنبوب FACS العازلة مع تلطيخ (حوالي 4 مل في أنبوب)؛ أجهزة الطرد المركزي لمدة 5 دقائق في 300 x ج في 4 درجات مئوية.
- نضح بعناية طاف و resuspend بيليه الخلية في 800 ميكرولتر من العازلة تلطيخ.
- نقل تعليق الخلية في أنبوب FACS مع قبعات مصفاة الخلية لضمان تعليق خلية واحدة.
4. تحليل التدفق الخلوي
- انتقل إلى الخلية فرز فورا باستخدام تدفق عداد الكريات مع مرشحات مناسبة لالاشاراتكشف ل. استخدام 405 نانومتر البنفسجي (لقياس دابي)، 488 نانومتر الأزرق (لقياس FSC، SSC، PE، PE-Cy7 وFITC) و 633 نانومتر أشعة الليزر الحمراء (لإثارة APC)
ملاحظة: تأكد من أن الصك هو تسجيل من أجهزة الكشف عن جميع القنوات الفلورسنت الثلاثة. - بوابات تعيين مضان على أساس عينات غير ملوثين والتعويض عن التداخل الطيفي باستخدام عناصر تحكم الملون واحدة.
ملاحظة: استخدم عناصر التحكم الملون واحدة لتعديل التعويض بين القنوات من أجل القضاء على أي تداخل في الإشارات الفلورسنت. وتعديل التعويض يعتمد على فارز FACS المستخدمة. - انشاء بوابات الابتدائية على أساس دابي لاستبعاد الخلايا الميتة.
- ضبط مؤامرة مبعثر (SSC-A مقابل FSC-A) لتحديد للأحداث القميص.
- انشاء منتدى التعاون الأمني وارتفاع SSC والمعلمات العرض للقضاء على الحلل وتميز للأحداث القميص.
- خلايا البوابة مع α6 عالية والتعبير β1 ومن هذه الفئة من السكان خلايا بوابة إما CD34 التعبير عالية أو Sca1 التعبير عالية.
- خلايا النوع في أنبوب FACS قبل المسمى.
ملاحظة: اثنان من السكان عام من الخلايا يمكن أن تكون معزولة. α6 + / β1 + / CD34 + / هيئة السلع التموينية-1 - وα6 + / + β1 / هيئة السلع التموينية-1 + / CD34 -. يجب أن تبقى الخلايا مرتبة على الجليد في جميع الأوقات حتى يتم استخدامها في تطبيقات ذات مثل زراعة الخلايا أو عزل الحمض النووي الريبي
النتائج
يصف هذا البروتوكول بالتفصيل تخصيب اليورانيوم وعزل نوعين من السكان: انتفاخ المنبوذة والخلايا الكيراتينية البشرة الشكل 2 يوضح الخطوات الرئيسية للبروتوكول. استخدام الجلد إزالتها من الظهرية الخلفي من 8 أسابيع الفئران القديمة، ونحن المخصب ال?...
Discussion
بروتوكول الموصوفة هنا راسخة لعزل HFSCs من الجلد الظهري للفئران بالغة ولكن يمكن أن تطبق بالتساوي لعزل السكان الآخرين داخل بنية HF، استنادا إلى التحديد من علامات 2،16،23،28،29. هذا الأسلوب هو خصوصا مفيد أكثر من غيرها من أساليب عزل الخلايا، مثل التفكك الأنسجة، في أن نوع ?...
Disclosures
The authors have nothing to declare
Acknowledgements
This work was supported in part by NIH grant RO1GM60124 (to H.S.). H.S. is an Investigator with the Howard Hughes Medical Institute. Y.F. is supported by the Deloro Career Advancement Chair and The German Israeli Foundation (I-2381-412.13/2015). D.S. is supported by the Coleman-Cohen post-doctoral fellowship.
Materials
| Name | Company | Catalog Number | Comments |
| Isoflurane | Primal Critical Care | 66794-017-10 | |
| Carbon dioxide | - | - | |
| Electro Shaver | Oster | Golden A5 | Shaver from any other company could be used |
| 70% ethanol | Gadot Lab | 830000051 | 96% ehtanol diluted with distilled water |
| Dissection mat | Dissection tools from any provider can be used | ||
| Forceps | Dumont | 11251-10 | Foreceps from any other company could be used |
| Scissors | Dumont | 14094-11 | Scissors from any other company could be used |
| Needles/Pins | - | - | |
| Scalpel | Albion | 10 | Ensure that the scalpel has a blunt end |
| Tissue culture dish 60mm x 15mm | Sigma-Aldrich | CLS430166 | |
| PBS | - | In-house PBS without Calcium and Magnesium | |
| 0.25% Trypsin/EDTA | Biological Industries | 03-050-1A | Trypsin obtained from a different company might have a different activity and duration of the trypsin digest has to be adjusted accordingly |
| Pipettes 10ml | Sigma-Aldrich | Corning, 4488 | |
| Ice | - | - | |
| 50 ml sterie centrifuge tubes | Minplast Ein-shemer | 35050-43 | |
| 70µM Cell strainer | Fisher | 22362548 | |
| 40µM Cell strainer | Fisher | 22362549 | |
| Staining buffer | - | ||
| Centrifuge | Eppendorf 5804 R | 5805 000.017 | |
| FACS tubes with Cell strainer caps | Falcon | 352235 | |
| FACS tubes | Falcon | 352063 | |
| Integrin β1 | eBioscience | 25-0291 | 1:400 |
| Integrin α6 | eBioscience | 15-0495 | 1:600 |
| Sca I | eBioscience | 11-5981 | 1:200 |
| CD34 | eBioscience | 9011-0349 | 1:300 |
| DAPI | Sigma-Aldrich | D9542 | 50ng/ml |
| Dry Chelex | BioRad | 142-2842 | |
| Beaker | Pyrex | - | |
| Distilled H2O | - | - | |
| Stir bar | - | - | |
| NHCl | BioLab | 1903059 | |
| Fetal bovine serum (FBS) | Beit Haemek Biological Industries | 400718 | FBS obtained from a different company can be used |
| 1L glass bottle | Ilmabor | Boro 3.3 | |
| Bottle top filter | Autofil | 1102-RLS |
References
- Wagers, A. J., Weissman, I. L. Plasticity of adult stem cells. Cell. 116, 639-648 (2004).
- Blanpain, C., Lowry, W. E., Geoghegan, A., Polak, L., Fuchs, E. Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell. 118, 635-648 (2004).
- Fuchs, E. Scratching the surface of skin development. Nature. 445, 834-842 (2007).
- Hsu, Y. C., Fuchs, E. A family business: stem cell progeny join the niche to regulate homeostasis. Nat Rev Mol Cell Biol. 13, 103-114 (2012).
- Blanpain, C., Fuchs, E. Epidermal homeostasis: a balancing act of stem cells in the skin. Nat Rev Mol Cell Biol. 10, 207-217 (2009).
- Alonso, L., Fuchs, E. The hair cycle. J Cell Sci. 119, 391-393 (2006).
- Muller-Rover, S., et al. A comprehensive guide for the accurate classification of murine hair follicles in distinct hair cycle stages. J Invest Dermatol. 117, 3-15 (2001).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5, 267-278 (2009).
- Ito, M., et al. Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis. Nat Med. 11, 1351-1354 (2005).
- Hsu, Y. C., Pasolli, H. A., Fuchs, E. Dynamics between stem cells, niche, and progeny in the hair follicle. Cell. 144, 92-105 (2011).
- Fuchs, E. The tortoise and the hair: slow-cycling cells in the stem cell race. Cell. 137, 811-819 (2009).
- Plikus, M. V., Chuong, C. M. Complex hair cycle domain patterns and regenerative hair waves in living rodents. J Invest Dermatol. 128, 1071-1080 (2008).
- Ito, M., Kizawa, K., Hamada, K., Cotsarelis, G. Hair follicle stem cells in the lower bulge form the secondary germ, a biochemically distinct but functionally equivalent progenitor cell population, at the termination of catagen. Differentiation. 72, 548-557 (2004).
- Cotsarelis, G., Sun, T. T., Lavker, R. M. Label-retaining cells reside in the bulge area of pilosebaceous unit: implications for follicular stem cells, hair cycle, and skin carcinogenesis. Cell. 61, 1329-1337 (1990).
- Cotsarelis, G. Epithelial stem cells: a folliculocentric view. J Invest Dermatol. 126, 1459-1468 (2006).
- Trempus, C. S., et al. Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34. J Invest Dermatol. 120, 501-511 (2003).
- Morris, R. J., et al. Capturing and profiling adult hair follicle stem cells. Nat Biotechnol. 22, 411-417 (2004).
- Lyle, S., et al. The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells. J Cell Sci. 111 (Pt 21), 3179-3188 (1998).
- Liu, Y., Lyle, S., Yang, Z., Cotsarelis, G. Keratin 15 promoter targets putative epithelial stem cells in the hair follicle bulge. J Invest Dermatol. 121, 963-968 (2003).
- Vidal, V. P., et al. Sox9 is essential for outer root sheath differentiation and the formation of the hair stem cell compartment. Curr Biol. 15, 1340-1351 (2005).
- Snippert, H. J., et al. Lgr6 marks stem cells in the hair follicle that generate all cell lineages of the skin. Science. 327, 1385-1389 (2010).
- Nijhof, J. G., et al. The cell-surface marker MTS24 identifies a novel population of follicular keratinocytes with characteristics of progenitor cells. Development. 133, 3027-3037 (2006).
- Jensen, U. B., et al. A distinct population of clonogenic and multipotent murine follicular keratinocytes residing in the upper isthmus. J Cell Sci. 121, 609-617 (2008).
- Jensen, K. B., et al. Lrig1 expression defines a distinct multipotent stem cell population in mammalian epidermis. Cell Stem Cell. 4, 427-439 (2009).
- Jaks, V., et al. Lgr5 marks cycling, yet long-lived, hair follicle stem cells. Nat Genet. 40, 1291-1299 (2008).
- Horsley, V., et al. Blimp1 defines a progenitor population that governs cellular input to the sebaceous gland. Cell. 126, 597-609 (2006).
- Goldstein, J., Horsley, V. Home sweet home: skin stem cell niches. Cell Mol Life Sci. 69, 2573-2582 (2012).
- Fuchs, Y., et al. Sept4/ARTS regulates stem cell apoptosis and skin regeneration. Science. 341, 286-289 (2013).
- Nowak, J. A., Fuchs, E. Isolation and culture of epithelial stem cells. Methods Mol Biol. 482, 215-232 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved