É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolando células-tronco do folículo piloso e epidérmico queratinócitos da Dorsal rato Pele
Neste Artigo
Resumo
An ideal model for studying adult stem cell biology is the mouse hair follicle. Here we present a protocol for isolating different populations of hair follicles stem cells and epidermal keratinocytes, employing enzymatic digestion of mouse dorsal skin followed by FACS analysis.
Resumo
The hair follicle (HF) is an ideal system for studying the biology and regulation of adult stem cells (SCs). This dynamic mini organ is replenished by distinct pools of SCs, which are located in the permanent portion of the HF, a region known as the bulge. These multipotent bulge SCs were initially identified as slow cycling label retaining cells; however, their isolation has been made feasible after identification of specific cell markers, such as CD34 and keratin 15 (K15). Here, we describe a robust method for isolating bulge SCs and epidermal keratinocytes from mouse HFs utilizing fluorescence activated cell-sorting (FACS) technology. Isolated hair follicle SCs (HFSCs) can be utilized in various in vivo grafting models and are a valuable in vitro model for studying the mechanisms that govern multipotency, quiescence and activation.
Introdução
As células estaminais adultas (SCS) são essenciais para a manutenção da homeostase do tecido, substituindo células que morrem e reparar tecidos danificados após a lesão. Estes SCs são definidas pela sua capacidade para sofrer auto-renovação contínua e de se diferenciar em linhagens celulares diferentes 1-3. Os sistemas mais bem estudados, as quais são dependentes de SCs adultos para a sua reposição, incluem o sistema hematopoiético, o intestino e o 1,2,4 pele.
Durante a embriogénese, a pele começa como uma única camada de células epidérmicas. Morfogênese do folículo piloso (HF) começa quando as células mesenquimais preencher a pele e formam uma subjacentes derme colágenas 5. Especializada células mesenquimais, que mais tarde constituem a papila dérmica (DP), organizam diretamente abaixo da camada epidérmica e estimulam o epitélio para formar placodes cabelo que começam a crescer para baixo 6. Altamente proliferação de células da matriz, situados na parte inferior do HF,envelope estas células mesenquimais e formar o bulbo capilar, enquanto que a camada interna começa a diferenciar-se em cilindros concêntricos de modo a formar o eixo do cabelo (HS) e a bainha envolvente interior raiz (IRS) 2,3.
Na vida pós-natal a epiderme da pele é composta de três compartimentos: a epiderme interfoliculares (IFE), a glândula sebácea (SG) e o HF. Em contraste com o IFE e SG, que estão em constante estado de homeostase, o HF é um mini-órgão dinâmico que sofre ciclos contínuos de crescimento (anágena), destruição (catágena) e repouso (telógena) 4,7. As células-tronco do folículo piloso (HFSCs) que o combustível este ciclo perpétuo, residir em um nicho especializado dentro do HF conhecido como o bojo 4. Durante anágena os HFSCs sair do bojo, seguindo sinais de ativação do DP, começam a proliferar e descer para baixo, criando assim uma trilha linear longo de células conhecidas como a bainha externa da raiz (ORS) 8-10. As células da matriz, quecercar o DP na base de HF, rapidamente ciclo e migrar para cima passando por diferenciação terminal gerando assim o HS e o IRS 10 (Figura 1). A duração do anágeno determina o comprimento do cabelo e é dependente da capacidade proliferativa e de diferenciação das células da matriz 6. Quando o HF entra catágena, as células da matriz-amplificação de trânsito na cessar lâmpada a proliferar, sofrem apoptose e regridem completamente enquanto puxa o DP para cima até que ele atinja a parte não-ciclismo do HF 8,11. Durante esta retracção, o HF forma uma estrutura temporário conhecida como a cadeia epitelial, que é característica de catágena e contém muitas células apoptóticas. Em ratinhos, catágena dura entre 3-4 dias e é altamente sincronizadas no primeiro ciclo do cabelo. Quando o HF atinge todos os telógena HFSCs se tornar quiescente. As diferentes etapas do ciclo de IC também são caracterizadas por alterações na cor da pele do rato devido a mprodução elanin. As alterações na pele de preto durante anágena ao cinza escuro durante catágena a rosa durante telógeno 6,7,12,13.
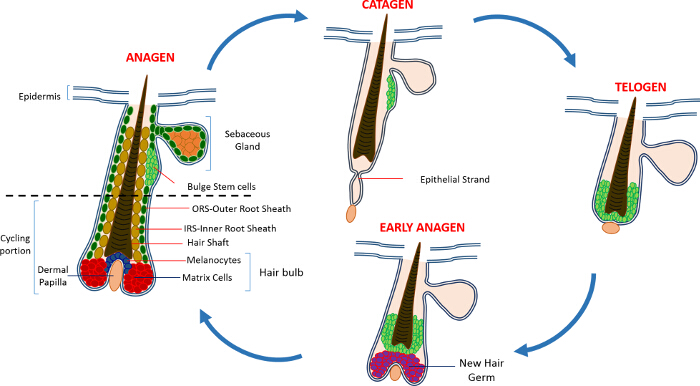
Figura 1: O ciclo de folículo piloso. O HF é composto por uma parte superior permanente e um menor em constante remodelação, a porção de ciclismo que sofre ciclos contínuos de crescimento rápido (anágena), destruição (catágena) e uma fase de quiescência parente ou repouso (telógena). Por favor clique aqui para ver uma maior versão desta figura.
Os SCs mantendo a HF foram inicialmente identificados utilizando experimentos de perseguição, com timidina tritiada, que revelaram uma população de células de retenção lenta etiqueta ciclismo (LRC) que residiam na região permanente do HF logo abaixo da SG 14. Avanços na HFSCCaracterização revelou um pequeno número de marcadores que podem ser utilizados para identificar e isolar SCs específicos do nicho da IC 15. Talvez o melhor marcador para o enriquecimento de células CD34 é HFSCs, um marcador de superfície celular também identificado como um marcador SC hematopoiéticas em seres humanos 16. Dentro deste CD34 + populações duas populações distintas também foram isoladas com base na expressão da integrina α6 2. Outro marcador é queratina 15 (K15), que é altamente expresso na região da protuberância, co-localiza com a expressão de CD34 e um promotor K15 é usado para o direccionamento e isolando HFSCs em animais transgénicos 15,17-19. Na década passada várias outras populações distintas de células progenitoras HFSCs e também têm sido relatados para residir dentro do IC 17,20-27.
Um recurso interessante adicional de HFSCs é a sua contribuição para a reparação da pele. Em condições normais HFSCs reabastecer o HF e não tomar parte em IFE homeostase. HoweVer, em resposta ao ferimento, estas células sair do seu nicho SC e ajuda na repovoamento a IFE 9. Nós demonstramos recentemente que os ratinhos excluído para a exibição do gene SEpt4 / ARTE pró-apoptótica um aumento do número de células CD34, K15 e Sox9 + HFSCs, que demonstram uma resistência à apoptose. HFSCs foram isolados a partir SEpt4 / ARTE - / - peles dorsal utilizando células activadas por fluorescência (FACS) e não havia mais do que um aumento de duas vezes no número de células CD34 + e + K15 HFSCs. Estes SEpt4 / ARTS - / - HFSCs foram expandidas in vitro e não só deu origem a mais colónias, mas também foram capazes de suportar as condições mais severas, em comparação com controles 28.
Como resultado de ter um maior número de HFSCs, SEpt4 ARTE / - / - ratos curados significativamente mais rapidamente em resposta a lesões excisão de pele. Surpreendentemente, SEpt4 / Artes - / - ratos displayeda grande número de HF regenerado a partir do leito da ferida, cicatrizes e significativamente menores. Além disso, os ratos excluídos para XIAP (inibidor ligada ao X de apoptose), o alvo bioquímico de ARTS, demonstrou prejudicou a cicatrização 28.
Os nossos resultados e trabalho realizado em outros laboratórios mostraram que HFSCs servir como um modelo ideal para o estudo da biologia e função de SCs adultos. Aqui, nós descrevemos a metodologia para o enriquecimento e isolamento de HFSCs e queratinócitos epidérmicos com base na expressão de quatro marcadores: α6 integrina; β1 integrina; Sca-1 (um marcador para queratinócitos epidérmicos) e CD34. Semelhante isolamento de K15 + HFSCs também pode ser realizada utilizando o rato K15 repórter GFP-19.
Protocolo
Este estudo foi realizado em estrita conformidade com as recomendações descritas no Guia para o Cuidado e Uso de Animais de Laboratório do Ministério da Saúde de Israel. Todos os animais foram tratados de acordo com o protocolo animais cuidado institucional aprovado IL-02302-2015 do Technion Israel Institute of Technology.
1. Preparação Experimental
- Preparação de Soro Fetal Bovino quelatado
Nota: As células epiteliais são muito sensíveis ao cálcio por isso é crucial para controlar a exposição dessas células ao cálcio. A fim de assegurar que as células não estão expostos ao cálcio durante o processo de isolamento de quelação é usado para remover qualquer cálcio residual do Soro Bovino Fetal utilizado para a preparação de tampão de coloração 29. O protocolo a seguir prepara-se aproximadamente 1 L de cálcio livre de Soro Fetal Bovino a necessária para a preparação tampão de coloração de FACS.- Adicionar 400 g de material seco quelante, por exemplo,., Chelex, em um 4 L copo e adicionar H2O destilada para um volume total de 4 L. tampa e mexa continuamente por meio de um agitador magnético.
- Ajustar o pH para 7,4 utilizando HCl 10 N solução enquanto se agitava. Continuar a agitação durante 20 min, e re-ajustar o pH conforme necessário até que o pH se mantém estável durante mais de 20 min.
- Incubar proveta a 4 ° C durante a noite para permitir que o material de quelação para formar um sedimento compacto. Cuidadosamente aspirado de H2O destilada e adicionar H 2 O fresco até um volume total de 4 L.
- Repetir o ajuste do pH como no passo 1.1.2.
- Colocar a proveta a 4 ° C durante 1 h para permitir que o material de quelação para formar um sedimento compacto. Aspirar cuidadosamente H 2 O.
- Lentamente, adicionar duas garrafas de 500 ml de soro fetal de bovino para o material quelante. Agita-se lentamente a 4 ° C durante 1 h garantia de que a configuração da velocidade não produz bolhas.
- Colocar a proveta a 4 ° C durante 1 h para permitir que o material de quelação para formar um compagir pellet.
- Transferir cuidadosamente o soro para um frasco de vidro G e filtrar através de um filtro de topo de garrafa, em condições estéreis. Armazenar o soro quelado a -20 ° C ou utilizar imediatamente.
- Preparação de Tampão de Coloração
- Preparação de 100 ml de 3% de FBS em PBS quelatado sem Ca 2+ e Mg 2+ e manter em gelo.
2. Isolamento dos folículos pilosos de adultos Epidermis
- Anestesiar ratos usando 5% de isoflurano usando uma caixa de indução. O protocolo aqui descrito foi optimizado utilizando ratinhos de idade 50-80 dias que se encontram na fase telogénica do ciclo de HF.
- Eutanásia ratos de acordo com procedimentos laboratoriais normalizados. Aqui, eutanásia ratos usando CO 2 overdose em uma câmara de eutanásia.
- Raspar todo o cabelo da pele dorsal usando cortadores elétricos. Evite cabeça e os membros. Mantenha a tesoura o mais próximo possível para a pele. Evitar danos à pele e subcutâneo.
- Quando todo o cabelo é removido, use 70% de etanol para remover qualquer resíduo de cabelo e para desinfectar a pele dorsal.
- Posicione o mouse sobre uma almofada de dissecação, e usando uma pinça puxe a pele perto da cauda e fazer uma pequena nick com uma tesoura. Cortar toda a pele dorsal em um sentido póstero-anterior com cuidado cortando a pele e separando-a da fáscia. Evite danificar a camada subcutânea.
- Coloque a pele em uma esteira de dissecação, a equipa de cabelo voltada para baixo e fixar para baixo duas bordas adjacentes da pele para fixar no lugar. Raspe fora da gordura, utilizando um bisturi sem corte até que a derme é claro e limpo.
Nota: Quando raspar a gordura, use uma pinça curva para aplicar pressão suave na pele. Aplicar pressão sobre a pele usando o lado curvo de uma pinça. Isso vai impedir que a pele rasgar. - Coloque a pele, derme lado de baixo, em 100 mm de prato de cultura estéril, e alisar a pele para assegurar que não existem pregas. Adicionar 10 ml de PBS sem Ca 2+ e Mg 2+ (PBS -) para a placa de cultura e endireitar a pele, se necessário.
- Aspirar o PBS e adicionar 10 ml de tripsina a 0,25%. Certifique-se de que a pele é desdobrado e está flutuando livremente. Incubar um pedaço de pele por 10 ml de 0,25% de tripsina.
- Incubar as amostras a 37 ° C durante 30-120 min ou a 4 ° C durante a noite.
3. Preparação de suspensão de células individuais partir de folículos pilosos
- Raspar todo o cabelo fora da pele usando uma pinça curva e um bisturi, num anterior à direção posterior. Segure a pele no local usando o lado curvo de fórceps e usar o bisturi para raspar o cabelo.
Nota: raspar o cabelo na solução de tripsina adicionada no passo 2.8. Comece na cauda e seguir a direção do crescimento do cabelo. Raspando contra a direção do crescimento do cabelo irá resultar em perda substancial de HF e redução no rendimento celular. HF tendem a aderir a cada conjunto e formam pequenos aglomerados; a fim de reduzir the tamanho dos aglomerados HF tentar raspar uma pequena área de cada vez. - Transferir a pele sem pêlos para a nova placa de cultura e adicione 10 ml de PBS - para evitar que a secagem. Inspecione a pele e raspar todo o cabelo restante.
- Quebrar HFS, utilizando um bisturi e pinças até que um único suspensão HF é obtido. Vigorosamente triturar a suspensão HF usando 10 ml pipeta por alguns minutos para quebrar todos os aglomerados de cabelo.
Nota: executar todos os passos seguintes em gelo. - Transferir a suspensão de HF na pré-rotulados 50 ml tubo.
- Aspirar o PBS - a partir da pele e usá-lo para lavar o prato de cultura celular que continha a suspensão HF; transferir para o tubo de 50 ml.
- Lavando
- Filtra-se a suspensão através da passagem por um filtro celular de 70 uM encaixada sobre um tubo de 50 ml. Lavar o tubo de 50 ml inicial e o filtro com 10 ml de tampão de coloração (PBS - com 3% de FBS quelado).
- Filtra-se a suspensão através da passagematravés de filtro de 40 | iM de células encaixada sobre um tubo de 50 ml. Lavar o tubo com 5-10 ml de tampão de coloração para assegurar que todas as células foram transferidas para o novo tubo. Manter a suspensão em gelo até que todos os animais tenham sido processadas.
- Centrifugar durante 15 minutos a 300 xg, a 4 ° C. sobrenadante cuidadosamente aspirado sem perturbar o sedimento e ressuspender o sedimento em 5 ml de tampão de coloração.
- Centrifugar durante 5 minutos a 300 xg, a 4 ° C. Aspirar cuidadosamente o sobrenadante e ressuspender o sedimento celular em 800 ul de tampão de coloração.
Nota: Os volumes indicados acima é suficiente para a coloração de células derivadas de dois ratos adultos.
- Transferência de suspensão em tubos de FACS pré-rotulados.
- Para tubos de controles, tome 25-50 mL de suspensão de células (ou qualquer esquerda residual da suspensão de células) e perfazer um volume total de 300 ul com tampão de coloração.
Nota: Preparar tubos de controlo (volume total de 300 ul) para imaculada (sem anticorpoe não DAPI); única DAPI; Integrina β1; Integrina α6; Sca-1; CD34.
- Para tubos de controles, tome 25-50 mL de suspensão de células (ou qualquer esquerda residual da suspensão de células) e perfazer um volume total de 300 ul com tampão de coloração.
- Adicionar os anticorpos primários e DAPI (ver tabela Materiais para as diluições adequadas) nas concentrações desejadas para o tubo adequado. Agite suavemente os tubos para misturar a suspensão de células. O retorno sobre o gelo e cobrir com folha de alumínio para proteger da luz.
- Incubar durante 30 min em gelo e agite suavemente os tubos a cada 10 minutos para garantir as células são mantidas em suspensão.
- Lave as células através do preenchimento de cada tubo FACS com tampão de coloração (cerca de 4 ml por tubo); centrifugar durante 5 minutos a 300 xg, a 4 ° C.
- Aspirar cuidadosamente o sobrenadante e ressuspender o sedimento celular em 800 ul de tampão de coloração.
- Transferir suspensão de células no tubo de FACS com tampas de filtro de células para assegurar suspensão única célula.
4. Análise por Citometria de Fluxo
- Prossiga para a separação de células imediatamente, usando um citômetro de fluxo com filtros adequados para signal detecção. Use 405 nm violeta (para medições de DAPI), 488 nm azul (para medições de FSC, SSC, PE, PE-Cy7 e FITC) e 633 lasers vermelhos nm (para excitação do APC)
Nota: Certifique-se de que o instrumento está a gravar a partir detectores para todos os três canais fluorescentes. - portões definir fluorescência com base em amostras não coradas e compensações para sobreposição espectral usando controles manchadas individuais.
Nota: Use os controles individuais coradas para ajustar a compensação entre canais, a fim de eliminar qualquer sobreposição nos sinais fluorescentes. ajuste de compensação dependerá do classificador FACS usado. - Configurar portas primários com base em DAPI para excluir as células mortas.
- Ajuste o gráfico de dispersão (SSC-A vs FSC-A) para selecionar para eventos singlet.
- Configurar FSC e altura SSC e os parâmetros de largura para eliminar para dobletes e discriminar para eventos singlet.
- células portão com alta α6 e expressão β1 e deste população de células de gaveta com qualquer CD34 elevada expressão ou expressão elevada Sca1.
- Ordenar células para um tubo de FACS pré-rotulados.
Nota: Duas populações de células gerais pode ser isolado; α6 + / β1 + / CD34 + / Sca-1 - e α6 + / + β1 / Sca-1 + / CD34 -. As células seleccionadas devem ser mantidos em gelo em todos os momentos, até que sejam utilizadas aplicações a jusante, tais como a cultura de células ou de isolamento de ARN
Resultados
Este protocolo descreve em pormenor o enriquecimento e isolamento de dois tipos de populações:. Protuberância SCs queratinócitos epidérmicos e A Figura 2 ilustra as principais etapas do protocolo. Utilizando a pele dorsal removida da parte de trás de ratinhos com 8 semanas, que enriquecido SCs protuberância usando o marcador CD34, que é expresso apenas em HFSCs; e Sca-1, que rotula queratinócitos epidérmicos. A Figura 3 mostra diferentes padrõ...
Discussão
O protocolo aqui descrito está bem estabelecida para isolamento de HFSCs da pele dorsal de ratos adultos, mas pode ser igualmente aplicado para o isolamento de outras populações no interior da estrutura de HF, baseado na selecção de marcadores 2,16,23,28,29. Este método é especialmente vantajosa em relação a outros métodos de isolamento de células, tais como a dissociação de tecidos, em que um tipo específico de célula pode ser seleccionada e colhida a partir de uma mistura de populações de c...
Divulgações
The authors have nothing to declare
Agradecimentos
This work was supported in part by NIH grant RO1GM60124 (to H.S.). H.S. is an Investigator with the Howard Hughes Medical Institute. Y.F. is supported by the Deloro Career Advancement Chair and The German Israeli Foundation (I-2381-412.13/2015). D.S. is supported by the Coleman-Cohen post-doctoral fellowship.
Materiais
| Name | Company | Catalog Number | Comments |
| Isoflurane | Primal Critical Care | 66794-017-10 | |
| Carbon dioxide | - | - | |
| Electro Shaver | Oster | Golden A5 | Shaver from any other company could be used |
| 70% ethanol | Gadot Lab | 830000051 | 96% ehtanol diluted with distilled water |
| Dissection mat | Dissection tools from any provider can be used | ||
| Forceps | Dumont | 11251-10 | Foreceps from any other company could be used |
| Scissors | Dumont | 14094-11 | Scissors from any other company could be used |
| Needles/Pins | - | - | |
| Scalpel | Albion | 10 | Ensure that the scalpel has a blunt end |
| Tissue culture dish 60mm x 15mm | Sigma-Aldrich | CLS430166 | |
| PBS | - | In-house PBS without Calcium and Magnesium | |
| 0.25% Trypsin/EDTA | Biological Industries | 03-050-1A | Trypsin obtained from a different company might have a different activity and duration of the trypsin digest has to be adjusted accordingly |
| Pipettes 10ml | Sigma-Aldrich | Corning, 4488 | |
| Ice | - | - | |
| 50 ml sterie centrifuge tubes | Minplast Ein-shemer | 35050-43 | |
| 70µM Cell strainer | Fisher | 22362548 | |
| 40µM Cell strainer | Fisher | 22362549 | |
| Staining buffer | - | ||
| Centrifuge | Eppendorf 5804 R | 5805 000.017 | |
| FACS tubes with Cell strainer caps | Falcon | 352235 | |
| FACS tubes | Falcon | 352063 | |
| Integrin β1 | eBioscience | 25-0291 | 1:400 |
| Integrin α6 | eBioscience | 15-0495 | 1:600 |
| Sca I | eBioscience | 11-5981 | 1:200 |
| CD34 | eBioscience | 9011-0349 | 1:300 |
| DAPI | Sigma-Aldrich | D9542 | 50ng/ml |
| Dry Chelex | BioRad | 142-2842 | |
| Beaker | Pyrex | - | |
| Distilled H2O | - | - | |
| Stir bar | - | - | |
| NHCl | BioLab | 1903059 | |
| Fetal bovine serum (FBS) | Beit Haemek Biological Industries | 400718 | FBS obtained from a different company can be used |
| 1L glass bottle | Ilmabor | Boro 3.3 | |
| Bottle top filter | Autofil | 1102-RLS |
Referências
- Wagers, A. J., Weissman, I. L. Plasticity of adult stem cells. Cell. 116, 639-648 (2004).
- Blanpain, C., Lowry, W. E., Geoghegan, A., Polak, L., Fuchs, E. Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell. 118, 635-648 (2004).
- Fuchs, E. Scratching the surface of skin development. Nature. 445, 834-842 (2007).
- Hsu, Y. C., Fuchs, E. A family business: stem cell progeny join the niche to regulate homeostasis. Nat Rev Mol Cell Biol. 13, 103-114 (2012).
- Blanpain, C., Fuchs, E. Epidermal homeostasis: a balancing act of stem cells in the skin. Nat Rev Mol Cell Biol. 10, 207-217 (2009).
- Alonso, L., Fuchs, E. The hair cycle. J Cell Sci. 119, 391-393 (2006).
- Muller-Rover, S., et al. A comprehensive guide for the accurate classification of murine hair follicles in distinct hair cycle stages. J Invest Dermatol. 117, 3-15 (2001).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5, 267-278 (2009).
- Ito, M., et al. Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis. Nat Med. 11, 1351-1354 (2005).
- Hsu, Y. C., Pasolli, H. A., Fuchs, E. Dynamics between stem cells, niche, and progeny in the hair follicle. Cell. 144, 92-105 (2011).
- Fuchs, E. The tortoise and the hair: slow-cycling cells in the stem cell race. Cell. 137, 811-819 (2009).
- Plikus, M. V., Chuong, C. M. Complex hair cycle domain patterns and regenerative hair waves in living rodents. J Invest Dermatol. 128, 1071-1080 (2008).
- Ito, M., Kizawa, K., Hamada, K., Cotsarelis, G. Hair follicle stem cells in the lower bulge form the secondary germ, a biochemically distinct but functionally equivalent progenitor cell population, at the termination of catagen. Differentiation. 72, 548-557 (2004).
- Cotsarelis, G., Sun, T. T., Lavker, R. M. Label-retaining cells reside in the bulge area of pilosebaceous unit: implications for follicular stem cells, hair cycle, and skin carcinogenesis. Cell. 61, 1329-1337 (1990).
- Cotsarelis, G. Epithelial stem cells: a folliculocentric view. J Invest Dermatol. 126, 1459-1468 (2006).
- Trempus, C. S., et al. Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34. J Invest Dermatol. 120, 501-511 (2003).
- Morris, R. J., et al. Capturing and profiling adult hair follicle stem cells. Nat Biotechnol. 22, 411-417 (2004).
- Lyle, S., et al. The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells. J Cell Sci. 111 (Pt 21), 3179-3188 (1998).
- Liu, Y., Lyle, S., Yang, Z., Cotsarelis, G. Keratin 15 promoter targets putative epithelial stem cells in the hair follicle bulge. J Invest Dermatol. 121, 963-968 (2003).
- Vidal, V. P., et al. Sox9 is essential for outer root sheath differentiation and the formation of the hair stem cell compartment. Curr Biol. 15, 1340-1351 (2005).
- Snippert, H. J., et al. Lgr6 marks stem cells in the hair follicle that generate all cell lineages of the skin. Science. 327, 1385-1389 (2010).
- Nijhof, J. G., et al. The cell-surface marker MTS24 identifies a novel population of follicular keratinocytes with characteristics of progenitor cells. Development. 133, 3027-3037 (2006).
- Jensen, U. B., et al. A distinct population of clonogenic and multipotent murine follicular keratinocytes residing in the upper isthmus. J Cell Sci. 121, 609-617 (2008).
- Jensen, K. B., et al. Lrig1 expression defines a distinct multipotent stem cell population in mammalian epidermis. Cell Stem Cell. 4, 427-439 (2009).
- Jaks, V., et al. Lgr5 marks cycling, yet long-lived, hair follicle stem cells. Nat Genet. 40, 1291-1299 (2008).
- Horsley, V., et al. Blimp1 defines a progenitor population that governs cellular input to the sebaceous gland. Cell. 126, 597-609 (2006).
- Goldstein, J., Horsley, V. Home sweet home: skin stem cell niches. Cell Mol Life Sci. 69, 2573-2582 (2012).
- Fuchs, Y., et al. Sept4/ARTS regulates stem cell apoptosis and skin regeneration. Science. 341, 286-289 (2013).
- Nowak, J. A., Fuchs, E. Isolation and culture of epithelial stem cells. Methods Mol Biol. 482, 215-232 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados