需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
从背小鼠皮肤分离毛囊干细胞和表皮角质形成细胞
摘要
An ideal model for studying adult stem cell biology is the mouse hair follicle. Here we present a protocol for isolating different populations of hair follicles stem cells and epidermal keratinocytes, employing enzymatic digestion of mouse dorsal skin followed by FACS analysis.
摘要
The hair follicle (HF) is an ideal system for studying the biology and regulation of adult stem cells (SCs). This dynamic mini organ is replenished by distinct pools of SCs, which are located in the permanent portion of the HF, a region known as the bulge. These multipotent bulge SCs were initially identified as slow cycling label retaining cells; however, their isolation has been made feasible after identification of specific cell markers, such as CD34 and keratin 15 (K15). Here, we describe a robust method for isolating bulge SCs and epidermal keratinocytes from mouse HFs utilizing fluorescence activated cell-sorting (FACS) technology. Isolated hair follicle SCs (HFSCs) can be utilized in various in vivo grafting models and are a valuable in vitro model for studying the mechanisms that govern multipotency, quiescence and activation.
引言
成体干细胞(SCS)是用于通过替换死亡细胞维持组织稳态和在损伤修复受损的组织是至关重要的。这些雪旺由它们经受持续自我更新和分化成各种细胞谱系1-3能力来定义。最好研究的系统,这取决于他们的补给成人的SC,包括造血系统,肠和皮肤1,2,4。
在胚胎发生期间,皮肤开始作为表皮细胞的一个单层。当间质细胞填充皮肤,形成一个基本的胶原真皮5毛囊(HF)的形态开始。专业间充质细胞,后来构成真皮乳头(DP),直接组织表皮层下方,刺激上皮以形成开始向下6长出头发placodes。高度增殖基质细胞,位于在HF的底部,信封这些间充质细胞,并形成毛球,而内层开始分化成同心圆柱体,以形成毛干(HS)及周边内根鞘(IRS)2,3。
在出生后皮肤的表皮是由三个室:所述滤泡表皮(IFE),皮脂腺(SG)和HF。与此相反的IFE和SG这是在稳态的恒定状态时,HF是一个动态的微型器官而经历生长的连续周期(生长期),破坏(退化期)和其余(休止期)4,7。毛囊干细胞(HFSCs),该燃料这个永久循环,驻留在HF内的一个专门利基称为凸起4。在从DP生长期的HFSCs退出隆起,下面的启动信号,开始增殖并下降向下从而形成称为外根鞘细胞的长直线步道(ORS)8-10。基质细胞,该包围的DP在HF,快速循环的基础和迁移向上进行从而产生在HS和IRS 10( 图1)终末分化。生长期的持续时间决定了头发的长度和依赖于基质细胞6的增殖和分化的能力。当高频进入退行期,在灯泡停止过境放大基质细胞增殖,凋亡和完全消退,而向上拉动DP直到它到达的高频8,11非循环部分。在此回缩HF形成被称为上皮链,这是退行期的特征的临时结构,并且包含许多凋亡细胞。在小鼠中,退行期持续天3-4之间,并在第一毛发周期高度同步。当HF到达休止所有HFSCs变得静止。高频周期的不同阶段的特征还在于,由于到m在小鼠的皮肤的颜色变化elanin生产。从黑退行期期间生长期为深灰色期间皮肤的变化休止期6,7,12,13时为粉红色。
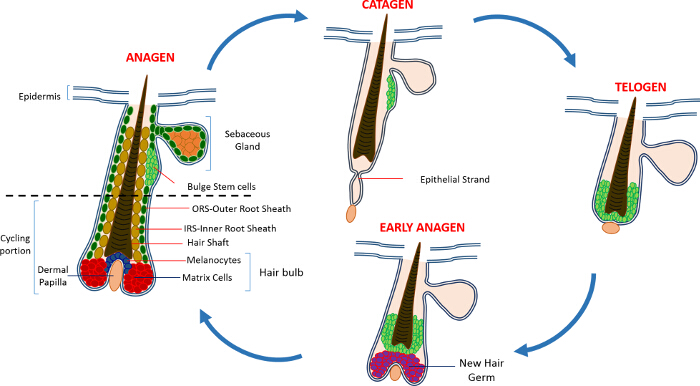
图1:毛囊周期 。在HF由永久上部,并且经历了快速增长(生长期),破坏(退行期)和相对静止阶段或休息(静止期)的连续周期不断降低重塑,单车部分。 请点击此处查看大图版本这个数字。
维持HF南海初步确定使用追踪实验,以氚化胸苷,即透露,在HF的永久居住区就在SG 14下方慢骑自行车的标签滞留细胞(LRC)的人口。在HFSC进展表征揭示少量可用于从HF利基15鉴定和分离特定的SC标记。也许HFSCs富集的最佳标记是CD34,细胞表面标记也被确定为在人16造血SC标记。在这个CD34 +人口两个不同的群体也被隔离的基础上整合α6表达式2。另一个标志物是角蛋白15(K15),其在所述凸出区域中高度表达,具有CD34的表达共定位和K15启动子被用于定位和在转基因动物15,17-19隔离HFSCs。在过去的十年中HFSCs和祖细胞的其它几个不同的种群也有报道驻留在HF 17,20-27内。
HFSCs的另一个令人兴奋的是他们的皮肤修复的贡献。在正常情况下HFSCs补充HF和不参加IFE平衡的一部分。豪版本,以应对伤人,这些细胞退出他们的SC利基,并有助于重新填充IFE 9。我们最近表明,删除小鼠促凋亡Sept4 /艺术基因显示CD34,K15和Sox9的+ HFSCs,这表明凋亡电阻的数量增加。 HFSCs从Sept4 /文理分离- / -利用背皮荧光激活细胞分选(FACS),并有在CD34 +和K15 + HFSCs的数目多于一个两倍。这些Sept4 /文理- / - HFSCs 体外扩增和不仅引起了更多的菌落,但也能够承受更苛刻的条件下与对照相比28。
作为具有HFSCs数目增加的结果,Sept4 /文理- / -小鼠显著更快响应于皮肤切除损伤愈合。引人注目的是,Sept4 /艺术- / -小鼠displayeDA大量从伤口床再生HFS和显著较小的疤痕。此外,对于XIAP(细胞凋亡的X连锁抑制 剂),的文理生化靶,缺失的小鼠表现出受损的愈合28。
我们的结果及其他实验室进行工作已经表明,HFSCs作为研究成人的SC的生物学和功能的理想模型。在这里,我们描述了用于浓缩和HFSCs并基于四种标志物的表达表皮角化细胞的分离方法:整合α6;整合β1;的Sca-1(对于表皮角化细胞的标记)和CD34。也可以使用K15-GFP报告鼠标19执行K15 + HFSCs的类似的隔离。
研究方案
本研究是在严格按照指南中列出了以色列卫生部实验动物的护理和使用的建议进行的。所有动物均按照批准的机构动物护理协议技术的以色列Technion工业研究所的IL-02302-2015处理。
1.实验准备
- 螯合胎牛血清的制备
注意:上皮细胞对钙非常敏感,所以关键是要控制这些细胞对钙的曝光。为了确保细胞不分离过程螯合期间暴露于钙被用来从胎牛血清用于制备染色缓冲液29的除去任何残留的钙。以下协议准备用于制备FACS染色缓冲需要大约1升无钙胎牛血清的。- 加入400克干螯合材料, 如中,CHELEX,成4升烧杯中,并加蒸馏水2 O至总体积为4L。封面和搅连续使用磁力搅拌器。
- 用10 1N HCl溶液,同时搅拌调节pH到7.4。继续搅拌20分钟,并根据需要,直到pH值超过20分钟保持稳定重新调节pH值。
- 在4℃过夜孵育烧杯以允许螯合材料,以形成一个紧凑的颗粒。小心吸H 2 O和补充新鲜蒸馏水2 O 4 L的总容积
- 重复pH调节如步骤1.1.2。
- 放置在4℃下将烧杯1小时,以允许螯合材料,以形成一个紧凑的颗粒。小心吸H 2 O.
- 慢慢胎牛血清两个500ml瓶中加入螯合材料。在4℃下缓慢搅拌1小时确保速度设定不产生气泡。
- 放置在4℃下将烧杯1小时,以允许螯合材料,以形成一个补偿行动沉淀。
- 小心地将血清转移到1升玻璃瓶中,并通过在无菌条件下一个瓶顶过滤器的过滤。存储螯合血清在-20°C或立即使用。
- 染色缓冲液制备
- 制备100ml的PBS螯合FBS 3%,无Ca2 +和Mg2 +和保持在冰上。
2.成人表皮毛囊的分离
- 使用麻醉使用感应盒5%异氟醚的小鼠。这里描述的方案,用50-80日龄的小鼠是在HF周期的休止期进行了优化。
- 根据标准实验室程序安乐死的小鼠。在这里,用安乐死的 CO 2过量的安乐死室老鼠。
- 刮胡子使用电动推剪背部皮肤所有的头发。避免头部和四肢。保持快船尽可能接近皮肤。避免损伤皮肤和皮下组织层。
- 当所有的头发被删除,使用70%的乙醇,以消除任何残留的头发和消毒背部皮肤。
- 放在解剖垫鼠标,然后使用镊子拉起靠近尾部的皮肤,用剪刀做一个小切口。通过仔细地切去皮肤和它从筋膜分离切成后 - 前方向的整个背部皮肤。避免损伤皮下组织层。
- 地方,头发面朝下放在解剖垫皮肤,牵制皮肤的两个相邻边缘的地方来解决。轻轻刮去油脂,用钝的刀,直到真皮清晰整洁。
注意:当刮去油脂,用弯钳适用于皮肤温和的压力。取适量涂抹于使用镊子的弯曲侧皮肤的压力。这将防止皮肤撕裂。 - 将皮肤,真皮侧倒,在100mM无菌培养皿中,并伸直的皮肤,以确保没有褶皱。加入10毫升的PBS不含Ca 2+ 和Mg 2+(PBS - )到培养皿,并在需要伸直皮肤。
- 吸出PBS和加入10 mL 0.25%胰蛋白酶。确保肌肤展开,并自由浮动。孵育一块每10ml 0.25%胰蛋白酶的皮肤。
- 在37℃孵育样品30-120分钟或在4℃下过夜。
3.从毛囊单细胞悬液的制备
- 用刮弯钳和手术刀所有的头发皮肤,在从前到后方向。使用镊子的弯曲侧保持在适当位置的皮肤,并使用手术刀刮去毛。
注:刮去毛到在步骤2.8加入胰蛋白酶溶液。开始在尾部,然后按照头发的生长方向。刮擦头发生长的方向将导致细胞产量HFS的显着损失和减少。 HFS倾向于粘附到每个在一起,形成小块;为了降低第HF团块E尺寸尝试一次刮去一小块地方。 - 转移无毛皮肤新的培养皿加入10毫升的PBS -防止其干燥。检查皮肤和刮去任何剩余毛发。
- 分解用手术刀和镊子直至获得单一的HF悬浮在HFS。大力磨碎用10毫升吸管几分钟,打破了所有的头发团块HF停牌。
注意:执行所有以下步骤在冰上。 - 在预标记的50ml管中传输的HF悬浮液。
- 吸出PBS -从皮肤并用它来 冲洗包含高频悬浮细胞培养皿;转移到50ml管中。
- 洗涤
- 通过穿过装配到50ml管70微米的细胞滤网过滤悬浮液。洗初始50ml管中,并用10毫升染色缓冲液的过滤器(PBS - 3%螯合FBS)。
- 通过使过滤悬浮液通过40微米的细胞滤网装配到50ml的管中。用5-10毫升染色缓冲液洗管,以确保所有细胞已被转移到新的管中。保持该悬浮液在冰上,直到所有的动物都被处理。
- 离心机在300 xg离心在4℃下15分钟。小心吸上清液没有在5毫升染色缓冲液的干扰颗粒和重新悬浮颗粒。
- 离心在4℃下5分钟300 XG。小心吸上清,悬浮细胞沉淀在800微升染色缓冲液。
注意:上面指定的量是足够的染色从两个成年小鼠的细胞。
- 转移到暂停标记预流式细胞仪管。
- 为对照管,取25-50微升细胞悬浮液(或从细胞悬浮液的任何残余左)和补到300微升用染色缓冲液的总体积。
注:准备对照管(总体积300微升)的未染色(无抗体无DAPI);仅DAPI; β1整合;整合α6;的Sca-1; CD34。
- 为对照管,取25-50微升细胞悬浮液(或从细胞悬浮液的任何残余左)和补到300微升用染色缓冲液的总体积。
- 添加第一抗体和DAPI(参见适当稀释材料表)在所需的浓度到合适的管中。轻轻一抖管混合的细胞悬液。回到冰上,用铝箔覆盖避光。
- 孵育在冰上30分钟,并轻轻振动小管,每10分钟,以确保细胞保持在悬浮液中。
- 通过用染色缓冲液(大约4毫升,每管)填满各个FACS管洗涤细胞;在4℃下300 XG离心5分钟。
- 小心吸上清,悬浮细胞沉淀在800微升染色缓冲液。
- 转移细胞悬液至FACS管中的细胞过滤帽,以确保单细胞悬液。
4.流式细胞仪分析
- 继续使用细胞流与Signa的适当的过滤器立即流式细胞分选升检测。使用405纳米紫光(对于DAPI测量),488纳米的蓝色(对FSC,SSC,PE,PE-Cy7的和FITC的测量)和633纳米的红色激光(APC的激励)
注意:确保仪器从探测器记录所有三个荧光通道。 - 基于未染色样品和补偿光谱重叠使用单一的彩色控制设置荧光门。
注意:使用单一染色控制用于调整信道间的补偿,以消除在荧光信号的任何重叠。薪酬调整将取决于所使用的流式细胞分选机。 - 基于DAPI设置主门以排除死细胞。
- 调整散点图(SSC-A对FSC-A),选择单事件。
- 建立FSC和SSC的高度和宽度参数来消除双峰和单事件的歧视。
- 门细胞具有高α6和β1的表达,并从这一人群在CD门细胞34高表达或SCA1高表达。
- 排序细胞进入预标记的FACS管。
注:细胞可以分离的两个普通人群; α6+ / +β1/ CD34 + /的Sca-1 -和α6+ / +β1/的Sca-1 + / CD34 - 。排序细胞应在任何时候都保持在冰上,直到它们被用于下游应用,如细胞培养或RNA分离
结果
该协议详细描述了充实和两类人群的隔离:隆起种姓和表皮角质形成图2说明了协议的主要步骤。利用皮肤从背垫层8周龄小鼠的去除,我们富集使用CD34标志物,这是只在HFSCs表示隆起旺;和的Sca-1,其标签表皮角化细胞。 图3示出了皮肤上皮细胞的α6+ /β1+群体内的CD34和的Sca-1的表达的不同的模式。细胞根据整合素α6的表达第一选通...
讨论
这里所描述的协议是公认的用于从成年小鼠的背部皮肤隔离HFSCs但可以同样地适用于高频结构内其他人群的隔离,基于标记2,16,23,28,29的选择。这种方法是在细胞分离的其他方法,如组织离解特别有利的,在一个特定的细胞类型,可以选择并从异质细胞群体的混合物收获。此外,这里所描述的方法是快速,可靠和可用于高达隔离到基于所使用的标记物的差异表达水平四个不同HFSC种群。?...
披露声明
The authors have nothing to declare
致谢
This work was supported in part by NIH grant RO1GM60124 (to H.S.). H.S. is an Investigator with the Howard Hughes Medical Institute. Y.F. is supported by the Deloro Career Advancement Chair and The German Israeli Foundation (I-2381-412.13/2015). D.S. is supported by the Coleman-Cohen post-doctoral fellowship.
材料
| Name | Company | Catalog Number | Comments |
| Isoflurane | Primal Critical Care | 66794-017-10 | |
| Carbon dioxide | - | - | |
| Electro Shaver | Oster | Golden A5 | Shaver from any other company could be used |
| 70% ethanol | Gadot Lab | 830000051 | 96% ehtanol diluted with distilled water |
| Dissection mat | Dissection tools from any provider can be used | ||
| Forceps | Dumont | 11251-10 | Foreceps from any other company could be used |
| Scissors | Dumont | 14094-11 | Scissors from any other company could be used |
| Needles/Pins | - | - | |
| Scalpel | Albion | 10 | Ensure that the scalpel has a blunt end |
| Tissue culture dish 60mm x 15mm | Sigma-Aldrich | CLS430166 | |
| PBS | - | In-house PBS without Calcium and Magnesium | |
| 0.25% Trypsin/EDTA | Biological Industries | 03-050-1A | Trypsin obtained from a different company might have a different activity and duration of the trypsin digest has to be adjusted accordingly |
| Pipettes 10ml | Sigma-Aldrich | Corning, 4488 | |
| Ice | - | - | |
| 50 ml sterie centrifuge tubes | Minplast Ein-shemer | 35050-43 | |
| 70µM Cell strainer | Fisher | 22362548 | |
| 40µM Cell strainer | Fisher | 22362549 | |
| Staining buffer | - | ||
| Centrifuge | Eppendorf 5804 R | 5805 000.017 | |
| FACS tubes with Cell strainer caps | Falcon | 352235 | |
| FACS tubes | Falcon | 352063 | |
| Integrin β1 | eBioscience | 25-0291 | 1:400 |
| Integrin α6 | eBioscience | 15-0495 | 1:600 |
| Sca I | eBioscience | 11-5981 | 1:200 |
| CD34 | eBioscience | 9011-0349 | 1:300 |
| DAPI | Sigma-Aldrich | D9542 | 50ng/ml |
| Dry Chelex | BioRad | 142-2842 | |
| Beaker | Pyrex | - | |
| Distilled H2O | - | - | |
| Stir bar | - | - | |
| NHCl | BioLab | 1903059 | |
| Fetal bovine serum (FBS) | Beit Haemek Biological Industries | 400718 | FBS obtained from a different company can be used |
| 1L glass bottle | Ilmabor | Boro 3.3 | |
| Bottle top filter | Autofil | 1102-RLS |
参考文献
- Wagers, A. J., Weissman, I. L. Plasticity of adult stem cells. Cell. 116, 639-648 (2004).
- Blanpain, C., Lowry, W. E., Geoghegan, A., Polak, L., Fuchs, E. Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell. 118, 635-648 (2004).
- Fuchs, E. Scratching the surface of skin development. Nature. 445, 834-842 (2007).
- Hsu, Y. C., Fuchs, E. A family business: stem cell progeny join the niche to regulate homeostasis. Nat Rev Mol Cell Biol. 13, 103-114 (2012).
- Blanpain, C., Fuchs, E. Epidermal homeostasis: a balancing act of stem cells in the skin. Nat Rev Mol Cell Biol. 10, 207-217 (2009).
- Alonso, L., Fuchs, E. The hair cycle. J Cell Sci. 119, 391-393 (2006).
- Muller-Rover, S., et al. A comprehensive guide for the accurate classification of murine hair follicles in distinct hair cycle stages. J Invest Dermatol. 117, 3-15 (2001).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5, 267-278 (2009).
- Ito, M., et al. Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis. Nat Med. 11, 1351-1354 (2005).
- Hsu, Y. C., Pasolli, H. A., Fuchs, E. Dynamics between stem cells, niche, and progeny in the hair follicle. Cell. 144, 92-105 (2011).
- Fuchs, E. The tortoise and the hair: slow-cycling cells in the stem cell race. Cell. 137, 811-819 (2009).
- Plikus, M. V., Chuong, C. M. Complex hair cycle domain patterns and regenerative hair waves in living rodents. J Invest Dermatol. 128, 1071-1080 (2008).
- Ito, M., Kizawa, K., Hamada, K., Cotsarelis, G. Hair follicle stem cells in the lower bulge form the secondary germ, a biochemically distinct but functionally equivalent progenitor cell population, at the termination of catagen. Differentiation. 72, 548-557 (2004).
- Cotsarelis, G., Sun, T. T., Lavker, R. M. Label-retaining cells reside in the bulge area of pilosebaceous unit: implications for follicular stem cells, hair cycle, and skin carcinogenesis. Cell. 61, 1329-1337 (1990).
- Cotsarelis, G. Epithelial stem cells: a folliculocentric view. J Invest Dermatol. 126, 1459-1468 (2006).
- Trempus, C. S., et al. Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34. J Invest Dermatol. 120, 501-511 (2003).
- Morris, R. J., et al. Capturing and profiling adult hair follicle stem cells. Nat Biotechnol. 22, 411-417 (2004).
- Lyle, S., et al. The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells. J Cell Sci. 111 (Pt 21), 3179-3188 (1998).
- Liu, Y., Lyle, S., Yang, Z., Cotsarelis, G. Keratin 15 promoter targets putative epithelial stem cells in the hair follicle bulge. J Invest Dermatol. 121, 963-968 (2003).
- Vidal, V. P., et al. Sox9 is essential for outer root sheath differentiation and the formation of the hair stem cell compartment. Curr Biol. 15, 1340-1351 (2005).
- Snippert, H. J., et al. Lgr6 marks stem cells in the hair follicle that generate all cell lineages of the skin. Science. 327, 1385-1389 (2010).
- Nijhof, J. G., et al. The cell-surface marker MTS24 identifies a novel population of follicular keratinocytes with characteristics of progenitor cells. Development. 133, 3027-3037 (2006).
- Jensen, U. B., et al. A distinct population of clonogenic and multipotent murine follicular keratinocytes residing in the upper isthmus. J Cell Sci. 121, 609-617 (2008).
- Jensen, K. B., et al. Lrig1 expression defines a distinct multipotent stem cell population in mammalian epidermis. Cell Stem Cell. 4, 427-439 (2009).
- Jaks, V., et al. Lgr5 marks cycling, yet long-lived, hair follicle stem cells. Nat Genet. 40, 1291-1299 (2008).
- Horsley, V., et al. Blimp1 defines a progenitor population that governs cellular input to the sebaceous gland. Cell. 126, 597-609 (2006).
- Goldstein, J., Horsley, V. Home sweet home: skin stem cell niches. Cell Mol Life Sci. 69, 2573-2582 (2012).
- Fuchs, Y., et al. Sept4/ARTS regulates stem cell apoptosis and skin regeneration. Science. 341, 286-289 (2013).
- Nowak, J. A., Fuchs, E. Isolation and culture of epithelial stem cells. Methods Mol Biol. 482, 215-232 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。