Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Разделительный волосяного фолликула стволовых клеток и кератиноцитов эпидермиса из кожи Спинной мыши
В этой статье
Резюме
An ideal model for studying adult stem cell biology is the mouse hair follicle. Here we present a protocol for isolating different populations of hair follicles stem cells and epidermal keratinocytes, employing enzymatic digestion of mouse dorsal skin followed by FACS analysis.
Аннотация
The hair follicle (HF) is an ideal system for studying the biology and regulation of adult stem cells (SCs). This dynamic mini organ is replenished by distinct pools of SCs, which are located in the permanent portion of the HF, a region known as the bulge. These multipotent bulge SCs were initially identified as slow cycling label retaining cells; however, their isolation has been made feasible after identification of specific cell markers, such as CD34 and keratin 15 (K15). Here, we describe a robust method for isolating bulge SCs and epidermal keratinocytes from mouse HFs utilizing fluorescence activated cell-sorting (FACS) technology. Isolated hair follicle SCs (HFSCs) can be utilized in various in vivo grafting models and are a valuable in vitro model for studying the mechanisms that govern multipotency, quiescence and activation.
Введение
Взрослые стволовые клетки (SCS) необходимы для поддержания гомеостаза тканей путем замены умирающие клетки и восстановления поврежденных тканей после повреждения. Эти Стволовые определяются их способности претерпевать постоянному самообновлению и дифференцироваться в различные клеточные клоны 1-3. Наиболее изучены системы, которые зависят от взрослых ГКС для их пополнения, включают в себя систему гемопоэза, кишечник и 1,2,4 кожи.
Во время эмбриогенеза, кожа начинает как один слой эпидермальных клеток. Морфогенез волосяного фолликула (HF) начинается , когда мезенхимальные клетки заселить кожу и образуют основные коллагеновые дермы 5. Специализированные мезенхимальные клетки, которые впоследствии составляют сосочков дермы (DP), упорядочивать непосредственно под эпидермальным слоем и стимулируют эпителий плакоды , чтобы сформировать волосы , которые начинают расти вниз 6. Высоко пролиферирующие матричные клетки, расположенные в нижней части ВЧ,конверт эти мезенхимные клетки и образуют луковицы, в то время как внутренний слой начинает дифференцироваться в концентрических цилиндров , чтобы сформировать волос вала (HS) и окружающий внутреннюю оболочки корня (IRS) 2,3.
В постнатальной жизни эпидермис кожи состоит из трех отделения: интерфолликулярной эпидермис (IFE), сальные железы (SG) и HF. В отличие от IFE и SG , которые находятся в постоянном состоянии гомеостаза, ВЧ представляет собой динамичный мини-орган , который претерпевает непрерывные циклы роста (анагена), уничтожение (катагена) и покоя (телоген) 4,7. Волосяной фолликул стволовые клетки (HFSCs) , что топливо , этот вечный цикл, постоянно находиться в специализированной нише в пределах HF , известной как выпуклость 4. Во время анагена в HFSCs выхода из выпуклость, следующие сигналы активации с DP, начинают пролиферировать и спускаемся вниз , таким образом , создавая длинный линейный след клеток , известных как внешней оболочки корня (ПРС) 8-10. Матричные клетки, которыеокружают DP на базе ВЧ, быстро цикла и мигрировать вверх проходит терминальной дифференцировки , таким образом , генерирующее HS и IRS 10 (рисунок 1). Продолжительность анагена определяет длину волос и зависит от пролиферативного и дифференциации мощности матричных ячеек 6. Когда HF входит катагена, транзитно-усилительных матричные клетки в колбы перестают размножаться, подвергаются апоптозу и регрессируют полностью, потянув DP вверх , пока он не достигнет , не задействуя часть ВЧ 8,11. Во время этого втягивания ВЧ образует временную структуру, известную как эпителиальный нить, которая характерна для катагена, и содержит много апоптозных клеток. У мышей, катаген длится от 3-4 дней и высокосинхронной в первом цикле волос. Когда HF достигает телоген все HFSCs становятся в состоянии покоя. Отличительными этапы цикла HF также характеризуются изменением цвета кожи мыши вследствие мelanin производство. Изменения кожи от черного во время анагена до темно - серого цвета во время катагена до розового во время телогене 6,7,12,13.
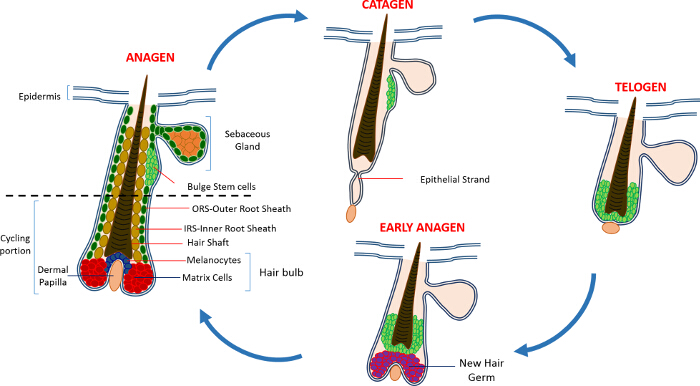
Рисунок 1: волосяной фолликул цикл. КВ состоит из постоянной верхней части и нижней постоянно ремоделирования, езда на велосипеде часть , которая претерпевает непрерывные циклы быстрого роста (анагена), уничтожение (катагена) и относительной фазы форсированном или покоя (телоген). Пожалуйста , нажмите здесь , чтобы увидеть увеличенную версия этой фигуры.
ГКС поддержание ВЧ первоначально были идентифицированы с использованием чейза экспериментов, с помощью меченного тритием тимидина, которые показали население медленно меток задействуя удерживающих клеток (LRC) , которые проживали в постоянной области HF чуть ниже SG 14. Достижения в HFSCхарактеристика выявлено небольшое количество маркеров , которые могут быть использованы для идентификации и выделения конкретных SCs из HF ниши 15. Возможно, лучший маркер для обогащения HFSCs является CD34, поверхностный маркер клеток также идентифицирован как кроветворной SC маркера в организме человека 16. В пределах этой популяции CD34 + две различные группы населения также были выделены основаны на α6 экспрессии интегринов 2. Другой маркер является кератин 15 (К15) , который экспрессируется на высоком уровне в области выпуклость, совместно локализуется с экспрессией CD34 и К15 промотор используется для ориентации и выделения HFSCs в трансгенных животных 15,17-19. В последнее десятилетие несколько других различных популяций HFSCs и клеток - предшественников также сообщалось проживать в пределах HF 17,20-27.
Еще интересной особенностью HFSCs является их вклад в ремонт кожи. При нормальных условиях HFSCs пополнения HF и не принимают участия в IFE гомеостаза. Хаувер, в ответ на язву эти клетки выйдут из SC ниши и помощь в заселив ФИИ 9. Недавно мы показали , что у мышей удалены для проапоптотического дисплея гена Sept4 / ARTS повышенное количество CD34, K15 и Sox9 + HFSCs, которые демонстрируют устойчивость к апоптозу. HFSCs были выделены из Sept4 / ИСКУССТВ - / - спинные шкуры с использованием флуоресценции активированной сортировки клеток (FACS) и там было больше , чем в два раза больше числа CD34 + и K15 + HFSCs. Эти Sept4 / ARTS - / - HFSCs были расширены в пробирке и не только привели к более колоний , но также способны выдерживать более жесткие условия по сравнению с контрольной группой 28.
В результате того , что повышенное количество HFSCs, Sept4 / ARTS - / - мышей значительно быстрее зажила в ответ на иссечение кожи травм. Поразительно, Sept4 / ARTS - / - мышей displayeда большое количество регенерированных HFs из раневого ложа, а также значительно меньшие шрамы. Кроме того, мыши , удаленные для XIAP (ингибитор Х-хромосомой апоптоза), биохимической мишени ИСКУССТВ, продемонстрировали ухудшение заживления 28.
Наши результаты и работы, выполненные в других лабораториях, показали, что HFSCs служат идеальной моделью для изучения биологии и функции взрослых SCS. Здесь мы описываем методологию для обогащения и выделения HFSCs и эпидермальных кератиноцитов на основе экспрессии четырех маркеров: интегрин а6; интегрин β1; Sca-1 (маркер для кератиноцитов эпидермиса) и CD34. Подобное выделение K15 + HFSCs также может быть выполнена с использованием K15-GFP - репортер мыши 19.
протокол
Это исследование было проведено в строгом соответствии с рекомендациями, изложенными в Руководстве по уходу и использованию лабораторных животных Министерства Израиля здравоохранения. Все животные были обработаны в соответствии с утвержденным протоколом институционального ухода за животными IL-02302-2015 Техниона Израильского технологического института.
1. Экспериментальная подготовка
- Приготовление хелатной фетальной бычьей сыворотки
Примечание: Эпителиальные клетки очень чувствительны к кальцию, так что очень важно, чтобы управлять экспозицией этих клеток по отношению к кальцию. Для того , чтобы гарантировать , что клетки не подвергаются воздействию кальция во время процесса выделения хелятации используется для удаления остатков кальция из фетальной бычьей сыворотки используют для приготовления окрашивающего буфера 29. Следующий протокол готовит приблизительно 1 л бескальциевой эмбриональной телячьей сыворотки, необходимое для приготовления FACS окрашивания буфера.- Добавьте 400 г сухого хелатообразующего материала, например ,., Chelex, в 4 л лабораторный стакан и добавить дистиллированную H 2 O до общего объема 4 L. Накройте и размешать непрерывно с использованием магнитной мешалки.
- Отрегулируйте рН до 7,4 с помощью 10 N раствора HCl при перемешивании. Продолжать перемешивание в течение 20 мин и повторно регулировать рН в случае необходимости до тех пор, пока рН не остается стабильным в течение более чем 20 мин.
- Выдержите в химический стакан при температуре 4 ° С в течение ночи, чтобы позволить хелатный материал с образованием компактной гранул. Тщательно аспирата H 2 O и добавляют свежий дистиллированная H 2 O до полного объема 4 L.
- Повторите регулировку рН, как на этапе 1.1.2.
- Стакан помещают при 4 ° С в течение 1 часа, чтобы дать хелатирующий материал с образованием компактной гранул. Тщательно аспирата H 2 O.
- Медленно добавить две 500 мл бутылки эмбриональной телячьей сыворотки с хелатирующим материала. Перемешать медленно при температуре 4 ° С в течение 1 ч, обеспечивая, что установка скорости не производит пузыри.
- Стакан помещают при 4 ° С в течение 1 часа, чтобы дать хелатирующий материал для формирования Компдействовать осадок.
- Аккуратно перенести сыворотку в 1 л стеклянную колбу и фильтруют ее через бутылку верхний фильтр в стерильных условиях. Хранить хелатного сыворотку при -20 ° С или использовать немедленно.
- Получение окрашивающего буфера
- Приготовьте 100 мл 3% хелатной FBS в PBS без Са 2+ и Mg 2+ и держать на льду.
2. Изоляция волосяные фолликулы от взрослых Эпидермиса
- Обезболить мышей, используя 5% изофлуран использованием индукционной коробку. Протокол, описанный здесь, был оптимизирован с использованием 50-80 день старых мышей, которые находятся в фазе телогена цикла HF.
- Эвтаназии мышей в соответствии со стандартными лабораторных процедур. Здесь, усыпить мышей с использованием передозировку CO 2 в эвтаназии камере.
- Бритье все волосы из кожи спины, используя электрические ножницы. Избегайте головы и конечностей. Держите машинки для стрижки как можно ближе к коже. Избегайте повреждения кожи и подкожный слой.
- Когда все волосы удалены, используйте 70% этанола, чтобы удалить остатки волос и дезинфицировать кожу спины.
- Поместите курсор на секционном площадку, и с помощью пинцета подтянуть кожу около хвоста и сделать небольшой ник с помощью ножниц. Вырезать всю кожу спины в задне-переднем направлении, осторожно срезая кожу и отделяя ее от фасции. Избегайте повреждения подкожного слоя.
- Поместите кожу на секционном коврик, боковые волосы вниз и придавить две соседние края кожи, чтобы зафиксировать на месте. Осторожно соскоблить жир, используя тупой скальпель, пока дермы не ясна и аккуратно.
Примечание: Когда соскабливания жир, использовать изогнутые щипцы, чтобы применить мягкое давление на кожу. Нанести давление на кожу с помощью изогнутой стороне щипцов. Это позволит предотвратить кожу от разрыва. - Поместите кожу, дерму стороной вниз, в 100 мм стерильной культуре блюдо и выровняйте кожу, чтобы убедиться, что нет никаких складок. Добавьте 10 мл PBS без Са 2+ и Mg 2+ (PBS , -) в чашку с культурой и выпрямить кожу , если это необходимо.
- Аспирируйте PBS и добавляют 10 мл 0,25% трипсина. Убедитесь в том, что кожа раскладывается и свободно плавающим. Выдержите один кусок кожи на 10 мл 0,25% трипсина.
- Инкубируйте образцы при температуре 37 ° С в течение 30-120 мин или при 4 ° С в течение ночи.
3. Получение суспензии отдельных клеток из волосяных луковиц
- Скрип все волосы с кожи с помощью изогнутых щипцов и скальпель, в качестве передней к задней направлении. Держите кожу в месте с помощью изогнутой стороне щипцов и использовать скальпель, чтобы соскрести волосы.
Примечание: Соскоблите волосы в трипсин раствор добавляют на стадии 2.8. Начало в хвост и следовать в направлении роста волос. Соскабливания против направления роста волос приведет к существенной потере ТФ и снижению выхода клеток. HFs склонны придерживаться каждый вместе и образуют небольшие сгустки; для того, чтобы уменьшить юе размер HF сгустки попытаться соскрести небольшую площадь на время. - Перенести голую кожу новой культуры блюдо и добавить 10 мл PBS - чтобы предотвратить его от высыхания. Осмотрите кожу и соскрести все оставшиеся волосы.
- Ломайте HFs с помощью скальпеля и пинцета до тех пор, пока не будет получено ни одного КВ подвески. Энергично растирают HF суспензии с помощью 10 мл пипетки в течение нескольких минут, чтобы разбить все комки волос.
Примечание: Выполните все следующие шаги на льду. - Передача HF суспензии в предварительно меченных 50 мл трубки.
- Аспирируйте PBS - от кожи и использовать его для промывки клеток культуры блюдо , которая содержала HF суспензии; передать в 50 мл пробирку.
- Мойка
- Суспензию фильтруют, пропуская через сито 70 мкм клетки устанавливают на 50 мл пробирку. Промыть первоначальный 50 мл трубки и сетчатый фильтр с 10 мл окрашивающего буфера (PBS - с 3% хелатные FBS).
- Суспензию фильтруют путем пропусканиячерез мкм клеточный фильтр 40 устанавливают на 50 мл пробирку. Промыть пробирку с 5-10 мл окрашивающего буфера, чтобы гарантировать, что все клетки были перенесены в новую пробирку. Хранить суспензии на льду, пока все животные не будут обработаны.
- Центрифуга в течение 15 мин при 300 мкг при 4 ° С. Тщательно аспирата супернатант, не нарушая гранул и ресуспендируют осадок в 5 мл окрашивающего буфера.
- Центрифуга в течение 5 мин 300 мкг при 4 ° С. Тщательно аспирата супернатант и ресуспендируют осадок клеток в 800 мкл буфера для окрашивания.
Примечание: объемы, указанные выше, достаточно для окрашивания клеток, полученных из двух взрослых мышей.
- Передача суспензии в предварительно меченных FACS труб.
- Для блоков управления труб, возьмите 25-50 мкл клеточной суспензии (или любого остаточного слева от клеточной суспензии) и составляют в общем объеме 300 мкл буфера для окрашивания.
Примечание: Подготовка контрольных трубок (общий объем 300 мкл) для неокрашенных (без антителнет и нет DAPI); только DAPI; Интегрин & beta; 1; ИНТЕГРИНОВ а6; Sca-1; CD34.
- Для блоков управления труб, возьмите 25-50 мкл клеточной суспензии (или любого остаточного слева от клеточной суспензии) и составляют в общем объеме 300 мкл буфера для окрашивания.
- Добавьте первичные антитела и DAPI (смотри таблицу Материалы для соответствующих разведений) в требуемых концентрациях в соответствующую пробирку. Аккуратно вылить пробирки для смешивания суспензии клеток. Возвращение на лед и накрыть алюминиевой фольгой для защиты от света.
- Инкубировать в течение 30 мин на льду и осторожно вылить в трубки через каждые 10 мин, чтобы обеспечить клетки удерживаются в суспензии.
- Вымойте клеток путем заполнения каждой пробирки FACS с окрашивающим буфером (приблизительно 4 мл на пробирку); центрифуге в течение 5 мин при 300 мкг при 4 ° С.
- Тщательно аспирата супернатант и ресуспендируют осадок клеток в 800 мкл буфера для окрашивания.
- Передача клеточной суспензии в FACS пробирку с крышками ячейки фильтра, чтобы обеспечить одноклеточной суспензии.
4. Анализ проточной цитометрией
- Перейдите к ячейке немедленно сортировки с использованием проточного цитометра с соответствующими фильтрами для Signaл обнаружения. Используйте 405 нм фиолетовый (для измерения DAPI), 488 нм (синий для измерения FSC, SSC, PE, PE-Cy7 и FITC) и 633 нм (красные лазеры для возбуждения APC)
Примечание: Убедитесь, что прибор находится в режиме записи от детекторов для всех трех флуоресцентных каналов. - Набор флуоресцентных ворота на основе неокрашенных образцов и компенсации спектрального перекрытия с использованием одиночных запятнанные управления.
Примечание: Используйте отдельные запятнанные средства управления для регулирования компенсации между каналами для того, чтобы устранить любое дублирование в флуоресцентных сигналов. Регулировка компенсации будет зависеть от сортировщика FACS используется. - Настройка первичные ворота, основанные на DAPI, чтобы исключить мертвые клетки.
- Отрегулируйте график рассеяния (SSC-A против FSC-A), чтобы выбрать для синглетных событий.
- Настройка FSC и SSC высоты и ширины параметров устранить для дублетов и дискриминационными для синглетных событий.
- Ворота клетки с высокой а6 и экспрессии & beta; 1 и из этой популяции клеток с затворов либо CD34 высокая экспрессия или высокая экспрессия СЦА1.
- Сортировка клеток в предварительно меченных FACS трубы.
Примечание: Два общих популяции клеток могут быть выделены; α6 + / β1 + / CD34 + / Sca-1 - и α6 + / β1 + / Sca-1 + / CD34 -. Отсортированные клетки должны храниться на льду во все времена, пока они не используются вниз по течению приложений, таких как культуры клеток или выделения РНК
Результаты
Этот протокол подробно описывает обогащение и выделение двух типов популяций:. Балджа SCs и кератиноцитов эпидермиса Рисунок 2 иллюстрирует основные этапы протокола. Использование кожи удаляется из спинного задней части 8-недельных мышей, мы обогатили выпира?...
Обсуждение
Протокол , описанный здесь , хорошо установлена для выделения HFSCs из кожи спины взрослых мышей , но может быть в равной степени применяется для выделения других групп населения в структуре ВЧ, на основе выбора маркеров 2,16,23,28,29. Этот метод особенно преимущественный по сравнению ?...
Раскрытие информации
The authors have nothing to declare
Благодарности
This work was supported in part by NIH grant RO1GM60124 (to H.S.). H.S. is an Investigator with the Howard Hughes Medical Institute. Y.F. is supported by the Deloro Career Advancement Chair and The German Israeli Foundation (I-2381-412.13/2015). D.S. is supported by the Coleman-Cohen post-doctoral fellowship.
Материалы
| Name | Company | Catalog Number | Comments |
| Isoflurane | Primal Critical Care | 66794-017-10 | |
| Carbon dioxide | - | - | |
| Electro Shaver | Oster | Golden A5 | Shaver from any other company could be used |
| 70% ethanol | Gadot Lab | 830000051 | 96% ehtanol diluted with distilled water |
| Dissection mat | Dissection tools from any provider can be used | ||
| Forceps | Dumont | 11251-10 | Foreceps from any other company could be used |
| Scissors | Dumont | 14094-11 | Scissors from any other company could be used |
| Needles/Pins | - | - | |
| Scalpel | Albion | 10 | Ensure that the scalpel has a blunt end |
| Tissue culture dish 60mm x 15mm | Sigma-Aldrich | CLS430166 | |
| PBS | - | In-house PBS without Calcium and Magnesium | |
| 0.25% Trypsin/EDTA | Biological Industries | 03-050-1A | Trypsin obtained from a different company might have a different activity and duration of the trypsin digest has to be adjusted accordingly |
| Pipettes 10ml | Sigma-Aldrich | Corning, 4488 | |
| Ice | - | - | |
| 50 ml sterie centrifuge tubes | Minplast Ein-shemer | 35050-43 | |
| 70µM Cell strainer | Fisher | 22362548 | |
| 40µM Cell strainer | Fisher | 22362549 | |
| Staining buffer | - | ||
| Centrifuge | Eppendorf 5804 R | 5805 000.017 | |
| FACS tubes with Cell strainer caps | Falcon | 352235 | |
| FACS tubes | Falcon | 352063 | |
| Integrin β1 | eBioscience | 25-0291 | 1:400 |
| Integrin α6 | eBioscience | 15-0495 | 1:600 |
| Sca I | eBioscience | 11-5981 | 1:200 |
| CD34 | eBioscience | 9011-0349 | 1:300 |
| DAPI | Sigma-Aldrich | D9542 | 50ng/ml |
| Dry Chelex | BioRad | 142-2842 | |
| Beaker | Pyrex | - | |
| Distilled H2O | - | - | |
| Stir bar | - | - | |
| NHCl | BioLab | 1903059 | |
| Fetal bovine serum (FBS) | Beit Haemek Biological Industries | 400718 | FBS obtained from a different company can be used |
| 1L glass bottle | Ilmabor | Boro 3.3 | |
| Bottle top filter | Autofil | 1102-RLS |
Ссылки
- Wagers, A. J., Weissman, I. L. Plasticity of adult stem cells. Cell. 116, 639-648 (2004).
- Blanpain, C., Lowry, W. E., Geoghegan, A., Polak, L., Fuchs, E. Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell. 118, 635-648 (2004).
- Fuchs, E. Scratching the surface of skin development. Nature. 445, 834-842 (2007).
- Hsu, Y. C., Fuchs, E. A family business: stem cell progeny join the niche to regulate homeostasis. Nat Rev Mol Cell Biol. 13, 103-114 (2012).
- Blanpain, C., Fuchs, E. Epidermal homeostasis: a balancing act of stem cells in the skin. Nat Rev Mol Cell Biol. 10, 207-217 (2009).
- Alonso, L., Fuchs, E. The hair cycle. J Cell Sci. 119, 391-393 (2006).
- Muller-Rover, S., et al. A comprehensive guide for the accurate classification of murine hair follicles in distinct hair cycle stages. J Invest Dermatol. 117, 3-15 (2001).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5, 267-278 (2009).
- Ito, M., et al. Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis. Nat Med. 11, 1351-1354 (2005).
- Hsu, Y. C., Pasolli, H. A., Fuchs, E. Dynamics between stem cells, niche, and progeny in the hair follicle. Cell. 144, 92-105 (2011).
- Fuchs, E. The tortoise and the hair: slow-cycling cells in the stem cell race. Cell. 137, 811-819 (2009).
- Plikus, M. V., Chuong, C. M. Complex hair cycle domain patterns and regenerative hair waves in living rodents. J Invest Dermatol. 128, 1071-1080 (2008).
- Ito, M., Kizawa, K., Hamada, K., Cotsarelis, G. Hair follicle stem cells in the lower bulge form the secondary germ, a biochemically distinct but functionally equivalent progenitor cell population, at the termination of catagen. Differentiation. 72, 548-557 (2004).
- Cotsarelis, G., Sun, T. T., Lavker, R. M. Label-retaining cells reside in the bulge area of pilosebaceous unit: implications for follicular stem cells, hair cycle, and skin carcinogenesis. Cell. 61, 1329-1337 (1990).
- Cotsarelis, G. Epithelial stem cells: a folliculocentric view. J Invest Dermatol. 126, 1459-1468 (2006).
- Trempus, C. S., et al. Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34. J Invest Dermatol. 120, 501-511 (2003).
- Morris, R. J., et al. Capturing and profiling adult hair follicle stem cells. Nat Biotechnol. 22, 411-417 (2004).
- Lyle, S., et al. The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells. J Cell Sci. 111 (Pt 21), 3179-3188 (1998).
- Liu, Y., Lyle, S., Yang, Z., Cotsarelis, G. Keratin 15 promoter targets putative epithelial stem cells in the hair follicle bulge. J Invest Dermatol. 121, 963-968 (2003).
- Vidal, V. P., et al. Sox9 is essential for outer root sheath differentiation and the formation of the hair stem cell compartment. Curr Biol. 15, 1340-1351 (2005).
- Snippert, H. J., et al. Lgr6 marks stem cells in the hair follicle that generate all cell lineages of the skin. Science. 327, 1385-1389 (2010).
- Nijhof, J. G., et al. The cell-surface marker MTS24 identifies a novel population of follicular keratinocytes with characteristics of progenitor cells. Development. 133, 3027-3037 (2006).
- Jensen, U. B., et al. A distinct population of clonogenic and multipotent murine follicular keratinocytes residing in the upper isthmus. J Cell Sci. 121, 609-617 (2008).
- Jensen, K. B., et al. Lrig1 expression defines a distinct multipotent stem cell population in mammalian epidermis. Cell Stem Cell. 4, 427-439 (2009).
- Jaks, V., et al. Lgr5 marks cycling, yet long-lived, hair follicle stem cells. Nat Genet. 40, 1291-1299 (2008).
- Horsley, V., et al. Blimp1 defines a progenitor population that governs cellular input to the sebaceous gland. Cell. 126, 597-609 (2006).
- Goldstein, J., Horsley, V. Home sweet home: skin stem cell niches. Cell Mol Life Sci. 69, 2573-2582 (2012).
- Fuchs, Y., et al. Sept4/ARTS regulates stem cell apoptosis and skin regeneration. Science. 341, 286-289 (2013).
- Nowak, J. A., Fuchs, E. Isolation and culture of epithelial stem cells. Methods Mol Biol. 482, 215-232 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены