È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolare le cellule staminali del follicolo pilifero e epidermico cheratinociti da pelle dorsale del mouse
In questo articolo
Riepilogo
An ideal model for studying adult stem cell biology is the mouse hair follicle. Here we present a protocol for isolating different populations of hair follicles stem cells and epidermal keratinocytes, employing enzymatic digestion of mouse dorsal skin followed by FACS analysis.
Abstract
The hair follicle (HF) is an ideal system for studying the biology and regulation of adult stem cells (SCs). This dynamic mini organ is replenished by distinct pools of SCs, which are located in the permanent portion of the HF, a region known as the bulge. These multipotent bulge SCs were initially identified as slow cycling label retaining cells; however, their isolation has been made feasible after identification of specific cell markers, such as CD34 and keratin 15 (K15). Here, we describe a robust method for isolating bulge SCs and epidermal keratinocytes from mouse HFs utilizing fluorescence activated cell-sorting (FACS) technology. Isolated hair follicle SCs (HFSCs) can be utilized in various in vivo grafting models and are a valuable in vitro model for studying the mechanisms that govern multipotency, quiescence and activation.
Introduzione
Le cellule staminali adulte (SCS) sono essenziali per mantenere l'omeostasi tissutale, sostituendo le cellule che muoiono e riparare tessuti danneggiati su lesioni. Questi SC sono definite dalla loro capacità di subire un continuo auto-rinnovamento e di differenziarsi in varie linee cellulari 1-3. I sistemi più studiati, che dipendono SCs adulti per il rifornimento, includono il sistema ematopoietico, l'intestino ed il 1,2,4 pelle.
Durante l'embriogenesi, la pelle inizia come un singolo strato di cellule epidermiche. Morfogenesi del follicolo pilifero (HF) inizia quando le cellule mesenchimali popolano la pelle e formano un sottostante derma collagene 5. Specializzato cellule mesenchimali, che poi costituiscono la papilla dermica (DP), organizzano direttamente sotto lo strato epidermico e stimolano l'epitelio di formare placodi capelli che iniziano a crescere verso il basso 6. Altamente cellule proliferanti della matrice, situato nella parte inferiore del HF,busta queste cellule mesenchimali e formare il bulbo pilifero, mentre lo strato interno comincia a differenziarsi in cilindri concentrici per formare il fusto del capello (HS) e nelle vicinanze della guaina interna della radice (IRS) 2,3.
Nella vita postnatale l'epidermide della pelle è composta da tre vani: l'epidermide interfollicolare (IFE), la ghiandola sebacea (SG) e l'HF. In contrasto con la IFE e SG che sono in un costante stato di omeostasi, l'HF è un mini-organo dinamico che subisce continui cicli di crescita (anagen), la distruzione (catagen) e di riposo (telogen) 4,7. Le cellule staminali del follicolo pilifero (HFSCs) che il carburante questo ciclo perpetuo, risiedono in una nicchia specializzata all'interno della HF conosciuto come il rigonfiamento 4. Durante anagen i HFSCs uscire dal rigonfiamento, a seguito di segnali di attivazione dal DP, iniziare proliferare e scendere verso il basso creando così una lunga scia lineare di cellule conosciute come la guaina esterna radice (ORS) 8-10. Le celle di matrice, checircondare il DP alla base della HF, rapidamente ciclo e migrare verso l'alto subire differenziazione terminale generando l'HS e l'IRS 10 (Figura 1). La durata di anagen determina la lunghezza dei capelli e dipende dalla capacità proliferativa e la differenziazione delle cellule della matrice 6. Quando l'HF entra catagen, le celle di matrice transito di amplificazione nel bulbo cessano di proliferare, apoptosi e regrediscono completamente tirando la DP verso l'alto fino a raggiungere la parte non bicicletta della HF 8,11. Durante questa retrazione HF forma una struttura temporanea noto come il filamento epiteliale, che è caratteristica di catagen, e contiene molte cellule apoptotiche. Nei topi, catagen dura tra 3-4 giorni ed è altamente sincronizzato nel primo ciclo del capello. Quando la HF raggiunge telogen tutti HFSCs diventano quiescenti. Le fasi distinte del ciclo HF sono inoltre caratterizzati da cambiamenti nel colore della pelle del topo causa mla produzione elanin. I cambiamenti della pelle dal nero durante anagen al grigio scuro durante catagen al rosa durante telogen 6,7,12,13.
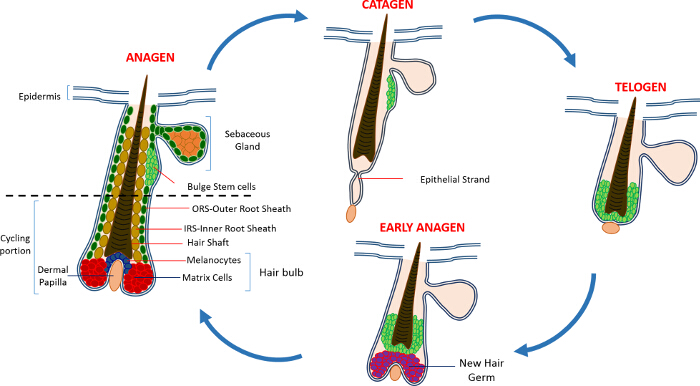
Figura 1: Il ciclo dei capelli follicolo. Il HF è composto da una parte superiore permanente e una porzione ciclismo inferiore costantemente rimodellamento che subisce continui cicli di rapida crescita (anagen), la distruzione (catagen) e una fase di quiescenza parente o di riposo (telogen). Clicca qui per visualizzare un più grande versione di questa figura.
SCS mantenendo la HF sono stati inizialmente identificati utilizzando esperimenti Chase, con timidina triziata, che ha rivelato una popolazione di cellule di sostegno etichette ciclismo lento (LRC) che risiedevano nella regione permanente del HF appena sotto la SG 14. I progressi nella HFSCCaratterizzazione rivelato un piccolo numero di marcatori che possono essere utilizzati per identificare e isolare SCs specifici dalla nicchia HF 15. Forse il miglior marcatore per l'arricchimento di HFSCs è CD34, un marker superficie cellulare anche identificato come un marcatore SC ematopoietiche negli esseri umani 16. All'interno di questo CD34 + popolazioni due distinte popolazioni sono stati anche isolati sulla base di espressione α6 integrina 2. Un altro indicatore è la cheratina 15 (K15), che è altamente espresso nella regione bulge, co-localizza con espressione CD34 e un promotore K15 viene utilizzato per il targeting e isolare HFSCs in animali transgenici 15,17-19. Negli ultimi dieci anni sono stati segnalati anche diversi altri distinte popolazioni di HFSCs e cellule progenitrici di risiedere all'interno del HF 17,20-27.
Una caratteristica interessante aggiuntiva di HFSCs è il loro contributo alla riparazione della pelle. In condizioni normali HFSCs ricostituire l'HF e non prendono parte a IFE omeostasi. However, in risposta a ferita, queste cellule uscire la loro nicchia SC e di aiuto nel ripopolare l'IFE 9. Abbiamo recentemente dimostrato che i topi cancellati per il display gene Sept4 / ARTS pro-apoptotica un aumento del numero di CD34, K15 e Sox9 + HFSCs, che dimostrano una resistenza all'apoptosi. HFSCs sono stati isolati da Sept4 / ARTS - / - pelli dorsali utilizzando la fluorescenza delle cellule attivate (FACS) e c'era più di due volte maggiore del numero di cellule CD34 + e K15 + HFSCs. Questi Sept4 / arte - / - HFSCs sono state espanse in vitro e non hanno dato luogo a solo più colonie, ma sono stati anche in grado di resistere a condizioni più severe rispetto ai controlli 28.
Come risultato di avere un maggior numero di HFSCs, Sept4 / arte - / - mice guarite significativamente più veloce in risposta alle lesioni asportazione della pelle. Sorprendentemente, Sept4 / arte - / - mice displayeda gran numero di HF rigenerate dal letto della ferita, e cicatrici significativamente più piccoli. Inoltre, i topi cancellati per XIAP (inibitore della X-linked di apoptosi), il target biochimico di ARTI, hanno dimostrato ridotta guarigione 28.
I nostri risultati e il lavoro svolto in altri laboratori hanno dimostrato che HFSCs servire come un modello ideale per lo studio della biologia e della funzione della SCS adulti. Qui, descriviamo la metodologia per l'arricchimento e l'isolamento di HFSCs e cheratinociti epidermici in base alla espressione di quattro marcatori: α6 integrina; β1 integrine; Sca-1 (un marker per cheratinociti epidermici) e CD34. Isolamento analogo di K15 + HFSCs può essere eseguita anche con il giornalista del mouse K15-GFP 19.
Protocollo
Questo studio è stato condotto in stretta conformità con le raccomandazioni delineate nella guida per la cura e l'uso di animali da laboratorio di Ministero della Salute di Israele. Tutti gli animali sono stati trattati secondo il protocollo approvato istituzionale cura degli animali IL-02.302-2015 del Technion Israel Institute of Technology.
1. Preparazione sperimentale
- Preparazione del chelato siero fetale bovino
Nota: Le cellule epiteliali sono molto sensibili al calcio quindi è fondamentale per controllare l'esposizione di queste cellule al calcio. Al fine di garantire che le cellule non sono esposti al calcio durante la chelazione processo di isolamento è utilizzato per rimuovere eventuali residui di calcio dal siero fetale bovino utilizzato per la preparazione di tampone colorazione 29. Il seguente protocollo prepara circa 1 L di calcio senza siero fetale bovino richiesto per il FACS buffer di colorazione preparazione.- Aggiungere 400 g di materiale chelante secca, es., Chelex, in un 4 L bicchiere e aggiungere acqua distillata H 2 O per un volume totale 4 L. coperchio e mescolare continuamente con un agitatore magnetico.
- Regolare il pH a 7,4 con 10 N soluzione di HCl mescolando. Continuare agitazione per 20 min e ri-regolare il pH se necessario fino a pH rimane stabile per più di 20 min.
- Incubare becher a 4 ° C per una notte per consentire al materiale chelante per formare un pellet compatta. Accuratamente aspirato H 2 O e aggiungere H fresca distillata 2 O ad un volume totale di 4 L.
- Ripetere la regolazione del pH come al punto 1.1.2.
- Porre il becher a 4 ° C per 1 ora per consentire al materiale chelante per formare un pellet compatta. Attentamente aspirato H 2 O.
- Aggiungere lentamente due bottiglie da 500 ml di siero fetale bovino al materiale chelante. Mescolare lentamente a 4 ° C per 1 ora in modo che la velocità non produce bolle.
- Porre il becher a 4 ° C per 1 ora per consentire al materiale chelante per formare bozzettoagire in pellet.
- trasferire con attenzione il siero in bottiglia di vetro da 1 L e filtrare attraverso un filtro bottiglia top in condizioni sterili. Conservare il siero chelato a -20 ° C o utilizzare immediatamente.
- Preparazione di colorazione tampone
- Preparare 100 ml di 3% chelato FBS in PBS senza Ca 2+ e Mg 2+ e tenere in ghiaccio.
2. Isolamento dei follicoli piliferi dall'epidermide adulti
- Anestetizzare topo, utilizzando 5% isoflurano utilizzando una scatola di induzione. Il protocollo qui descritto è stato ottimizzato con 50-80 giorni di età i topi che sono in fase telogen del ciclo HF.
- Euthanize topi secondo le procedure standard di laboratorio. Qui, eutanasia topi utilizzando CO 2 overdose in una camera di eutanasia.
- Radersi tutti i capelli dalla pelle dorsale usando tagliatori elettrici. Evitare di testa e gli arti. Mantenere il tagliaunghie più vicino possibile alla pelle. Evitare di danneggiare la pelle e lo strato sottocutaneo.
- Quando tutti i capelli viene rimosso, utilizzare il 70% di etanolo per rimuovere eventuali residui capelli e per disinfettare la pelle dorsale.
- Posizionare il mouse su un pad dissezione, e l'utilizzo di una pinza tirare la pelle vicino alla coda e fare una piccola scalfittura con le forbici. Tagliare l'intera pelle dorsale in direzione posteriore-anteriore con attenzione tagliando via la pelle separandola dalla fascia. Evitare di danneggiare lo strato sottocutaneo.
- Posizionare la pelle su una stuoia di dissezione, lato capelli rivolto verso il basso, e definire con precisione due bordi adiacenti della pelle per fissare in posizione. Delicatamente togliere il grasso, utilizzando un bisturi smussato fino a quando il derma è chiaro e pulito.
Nota: quando raschiando il grasso, utilizzare pinze curve di applicare una leggera pressione sulla pelle. Applicare una pressione sulla pelle con il lato curvo di pinze. Ciò impedirà la pelle da strappo. - Posizionare la pelle, derma lato verso il basso, in 100 mm piatto di coltura sterili, e raddrizzare la pelle per garantire che non vi siano pieghe. Aggiungere 10 ml di PBS senza Ca 2+ e Mg 2+ (PBS -) al piatto cultura e raddrizzare la pelle, se necessario.
- Aspirare il PBS e aggiungere 10 ml di 0,25% tripsina. Assicurarsi che la pelle è spiegato ed è liberamente fluttuante. Incubare un pezzo di pelle per 10 ml di 0,25% tripsina.
- Incubare i campioni a 37 ° C per 30-120 min o a 4 ° C durante la notte.
3. Preparazione della sospensione singola cella da follicoli piliferi
- Raschiare tutti i capelli fuori la pelle con pinze curve e un bisturi, in una anteriori alla direzione posteriore. Tenere la pelle al suo posto con il lato curvo di pinze e usare il bisturi per raschiare i capelli.
Nota: Raschiare i capelli nella soluzione tripsina aggiunto al punto 2.8. Inizia la coda e seguire la direzione di crescita dei capelli. Raschiando contro la direzione della crescita dei capelli si tradurrà in una perdita sostanziale di HFS e riduzione del rendimento delle cellule. HF tendono ad aderire ciascun insieme e formare piccoli grumi; per ridurre the dimensioni dei cespi HF cercare di raschiare una piccola area alla volta. - Trasferire la pelle glabra di nuovo piatto cultura e aggiungere 10 ml di PBS - per evitare che si secchi. Ispezionare la pelle e togliere tutti i capelli rimanenti.
- Abbattere le HF utilizzando un bisturi e pinze fino ad ottenere una sospensione singola HF. Vigorosamente triturare la sospensione HF utilizzando 10 ml pipetta per qualche minuto per rompere tutti i grumi di capelli.
Nota: eseguire tutti i seguenti passaggi su ghiaccio. - Trasferire la sospensione HF in tubo pre-etichettati 50 ml.
- Aspirare il PBS - dalla pelle e utilizzarla per lavare il piatto di coltura cellulare che conteneva la sospensione HF; trasferire al tubo 50 ml.
- Lavaggio
- Filtrare la sospensione passando attraverso un filtro cella 70 micron montata su un tubo da 50 ml. Lavare il tubo 50 ml iniziale e il filtro con 10 ml di tampone colorazione (PBS - con 3% chelato FBS).
- Filtrare la sospensione passandoa 40 micron colino cella montata su un tubo da 50 ml. Lavare il tubo con 5-10 ml di tampone colorazione per garantire che tutte le cellule sono state trasferite al nuovo tubo. Mantenere la sospensione in ghiaccio fino a quando tutti gli animali sono stati elaborati.
- Centrifugare per 15 min a 300 xg a 4 ° C. surnatante attentamente aspirare senza disturbare il pellet e risospendere pellet in 5 ml di tampone colorazione.
- Centrifugare per 5 minuti a 300 xg a 4 ° C. Con attenzione aspirare il surnatante e risospendere il pellet cellulare in 800 ml di buffer di colorazione.
Nota: I volumi di cui sopra è sufficiente per la colorazione cellule derivate da due topi adulti.
- Trasferimento sospensione in pre-etichettati FACS Tubes.
- Per i tubi controlli, prendere 25-50 ml di sospensione cellulare (o di qualsiasi residuo di sinistro dalla sospensione cellulare) e portare a un volume totale di 300 ml con tampone colorazione.
Nota: Preparare le provette di controllo (volume totale 300 ml) per la senza macchia (senza anticorpie non DAPI); solo DAPI; Integrina β1; Integrina α6; SCA-1; CD34.
- Per i tubi controlli, prendere 25-50 ml di sospensione cellulare (o di qualsiasi residuo di sinistro dalla sospensione cellulare) e portare a un volume totale di 300 ml con tampone colorazione.
- Aggiungere gli anticorpi primari e DAPI (vedi tabella Materiali per diluizioni appropriate) alle concentrazioni desiderate al tubo appropriato. flick delicatamente i tubi per miscelare la sospensione cellulare. Rientro sul ghiaccio e coprire con un foglio di alluminio per proteggerlo dalla luce.
- Incubare per 30 min in ghiaccio e delicatamente flick tubi ogni 10 minuti per garantire cellule sono tenuti in sospensione.
- Lavare le cellule compilando ogni tubo FACS con tampone colorazione (circa 4 ml per provetta); centrifugare per 5 min a 300 xg a 4 ° C.
- Con attenzione aspirare il surnatante e risospendere il pellet cellulare in 800 ml di buffer di colorazione.
- Trasferire sospensione di cellule nel tubo FACS con tappi colino cella per garantire la sospensione singola cella.
4. Flusso Analisi Citometria
- Procedere alla separazione delle cellule immediatamente utilizzando un citofluorimetro con filtri appropriati per signal rilevamento. Utilizzare 405 nm viola (per le misurazioni di DAPI), 488 nm blu (per le misure di FSC, SSC, PE, PE-Cy7 e FITC) e 633 nm laser rossi (per l'eccitazione di APC)
Nota: Assicurarsi che lo strumento sta registrando da rilevatori per tutti e tre i canali fluorescenti. - cancelli Situato fluorescenza sulla base di campioni non colorati e la compensazione per la sovrapposizione spettrale che utilizzano singoli controlli macchiato.
Nota: utilizzare i singoli controlli colorate per regolare la compensazione tra i canali in modo da eliminare qualsiasi sovrapposizione nei segnali fluorescenti. regolazione della compensazione dipende dal sorter FACS utilizzato. - Impostare porte principali sulla base di DAPI di escludere le cellule morte.
- Regolare il grafico a dispersione (SSC-A vs FSC-A) per selezionare gli eventi di singoletto.
- Impostare FSC e l'altezza SSC e parametri di larghezza per eliminare per doppiette e discriminare gli eventi di singoletto.
- cellule cancello con elevata α6 ed espressione β1 e da questa popolazione cellule cancello con entrambi i CD34 alta espressione o alta espressione Sca1.
- cellule ordinarli in tubo FACS pre-etichettati.
Nota: due popolazioni generali di cellule possono essere isolate; α6 + / β1 + / CD34 + / Sca-1 - e α6 + / + β1 / Sca-1 + / CD34 -. Cellule separate devono essere tenuti in ghiaccio in ogni momento fino a quando non vengono utilizzate applicazioni a valle come la cultura cellulare o l'isolamento di RNA
Risultati
Questo protocollo descrive in dettaglio l'arricchimento e l'isolamento di due tipi di popolazioni:. Rigonfiamento SC e cheratinociti epidermici Figura 2 illustra le principali fasi del protocollo. Utilizzando pelle rimossa dalla dorsale posteriore di 8 settimane di età topi, abbiamo arricchito SC rigonfiamento utilizzando il marcatore CD34, che si esprime solo in HFSCs; e Sca-1, che le etichette cheratinociti epidermici. La figura 3 mostra diver...
Discussione
Il protocollo qui descritto è ben consolidata per isolare HFSCs dalla pelle dorsale di topi adulti, ma può essere ugualmente applicata per l'isolamento di altre popolazioni all'interno della struttura HF, basato sulla selezione dei marcatori 2,16,23,28,29. Questo metodo è notevolmente vantaggioso rispetto ad altri metodi di isolamento cellulare, come la dissociazione dei tessuti, dal fatto che un tipo di cellula specifico può essere selezionato e raccolto da una miscela di popolazioni cellulari et...
Divulgazioni
The authors have nothing to declare
Riconoscimenti
This work was supported in part by NIH grant RO1GM60124 (to H.S.). H.S. is an Investigator with the Howard Hughes Medical Institute. Y.F. is supported by the Deloro Career Advancement Chair and The German Israeli Foundation (I-2381-412.13/2015). D.S. is supported by the Coleman-Cohen post-doctoral fellowship.
Materiali
| Name | Company | Catalog Number | Comments |
| Isoflurane | Primal Critical Care | 66794-017-10 | |
| Carbon dioxide | - | - | |
| Electro Shaver | Oster | Golden A5 | Shaver from any other company could be used |
| 70% ethanol | Gadot Lab | 830000051 | 96% ehtanol diluted with distilled water |
| Dissection mat | Dissection tools from any provider can be used | ||
| Forceps | Dumont | 11251-10 | Foreceps from any other company could be used |
| Scissors | Dumont | 14094-11 | Scissors from any other company could be used |
| Needles/Pins | - | - | |
| Scalpel | Albion | 10 | Ensure that the scalpel has a blunt end |
| Tissue culture dish 60mm x 15mm | Sigma-Aldrich | CLS430166 | |
| PBS | - | In-house PBS without Calcium and Magnesium | |
| 0.25% Trypsin/EDTA | Biological Industries | 03-050-1A | Trypsin obtained from a different company might have a different activity and duration of the trypsin digest has to be adjusted accordingly |
| Pipettes 10ml | Sigma-Aldrich | Corning, 4488 | |
| Ice | - | - | |
| 50 ml sterie centrifuge tubes | Minplast Ein-shemer | 35050-43 | |
| 70µM Cell strainer | Fisher | 22362548 | |
| 40µM Cell strainer | Fisher | 22362549 | |
| Staining buffer | - | ||
| Centrifuge | Eppendorf 5804 R | 5805 000.017 | |
| FACS tubes with Cell strainer caps | Falcon | 352235 | |
| FACS tubes | Falcon | 352063 | |
| Integrin β1 | eBioscience | 25-0291 | 1:400 |
| Integrin α6 | eBioscience | 15-0495 | 1:600 |
| Sca I | eBioscience | 11-5981 | 1:200 |
| CD34 | eBioscience | 9011-0349 | 1:300 |
| DAPI | Sigma-Aldrich | D9542 | 50ng/ml |
| Dry Chelex | BioRad | 142-2842 | |
| Beaker | Pyrex | - | |
| Distilled H2O | - | - | |
| Stir bar | - | - | |
| NHCl | BioLab | 1903059 | |
| Fetal bovine serum (FBS) | Beit Haemek Biological Industries | 400718 | FBS obtained from a different company can be used |
| 1L glass bottle | Ilmabor | Boro 3.3 | |
| Bottle top filter | Autofil | 1102-RLS |
Riferimenti
- Wagers, A. J., Weissman, I. L. Plasticity of adult stem cells. Cell. 116, 639-648 (2004).
- Blanpain, C., Lowry, W. E., Geoghegan, A., Polak, L., Fuchs, E. Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell. 118, 635-648 (2004).
- Fuchs, E. Scratching the surface of skin development. Nature. 445, 834-842 (2007).
- Hsu, Y. C., Fuchs, E. A family business: stem cell progeny join the niche to regulate homeostasis. Nat Rev Mol Cell Biol. 13, 103-114 (2012).
- Blanpain, C., Fuchs, E. Epidermal homeostasis: a balancing act of stem cells in the skin. Nat Rev Mol Cell Biol. 10, 207-217 (2009).
- Alonso, L., Fuchs, E. The hair cycle. J Cell Sci. 119, 391-393 (2006).
- Muller-Rover, S., et al. A comprehensive guide for the accurate classification of murine hair follicles in distinct hair cycle stages. J Invest Dermatol. 117, 3-15 (2001).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5, 267-278 (2009).
- Ito, M., et al. Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis. Nat Med. 11, 1351-1354 (2005).
- Hsu, Y. C., Pasolli, H. A., Fuchs, E. Dynamics between stem cells, niche, and progeny in the hair follicle. Cell. 144, 92-105 (2011).
- Fuchs, E. The tortoise and the hair: slow-cycling cells in the stem cell race. Cell. 137, 811-819 (2009).
- Plikus, M. V., Chuong, C. M. Complex hair cycle domain patterns and regenerative hair waves in living rodents. J Invest Dermatol. 128, 1071-1080 (2008).
- Ito, M., Kizawa, K., Hamada, K., Cotsarelis, G. Hair follicle stem cells in the lower bulge form the secondary germ, a biochemically distinct but functionally equivalent progenitor cell population, at the termination of catagen. Differentiation. 72, 548-557 (2004).
- Cotsarelis, G., Sun, T. T., Lavker, R. M. Label-retaining cells reside in the bulge area of pilosebaceous unit: implications for follicular stem cells, hair cycle, and skin carcinogenesis. Cell. 61, 1329-1337 (1990).
- Cotsarelis, G. Epithelial stem cells: a folliculocentric view. J Invest Dermatol. 126, 1459-1468 (2006).
- Trempus, C. S., et al. Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34. J Invest Dermatol. 120, 501-511 (2003).
- Morris, R. J., et al. Capturing and profiling adult hair follicle stem cells. Nat Biotechnol. 22, 411-417 (2004).
- Lyle, S., et al. The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells. J Cell Sci. 111 (Pt 21), 3179-3188 (1998).
- Liu, Y., Lyle, S., Yang, Z., Cotsarelis, G. Keratin 15 promoter targets putative epithelial stem cells in the hair follicle bulge. J Invest Dermatol. 121, 963-968 (2003).
- Vidal, V. P., et al. Sox9 is essential for outer root sheath differentiation and the formation of the hair stem cell compartment. Curr Biol. 15, 1340-1351 (2005).
- Snippert, H. J., et al. Lgr6 marks stem cells in the hair follicle that generate all cell lineages of the skin. Science. 327, 1385-1389 (2010).
- Nijhof, J. G., et al. The cell-surface marker MTS24 identifies a novel population of follicular keratinocytes with characteristics of progenitor cells. Development. 133, 3027-3037 (2006).
- Jensen, U. B., et al. A distinct population of clonogenic and multipotent murine follicular keratinocytes residing in the upper isthmus. J Cell Sci. 121, 609-617 (2008).
- Jensen, K. B., et al. Lrig1 expression defines a distinct multipotent stem cell population in mammalian epidermis. Cell Stem Cell. 4, 427-439 (2009).
- Jaks, V., et al. Lgr5 marks cycling, yet long-lived, hair follicle stem cells. Nat Genet. 40, 1291-1299 (2008).
- Horsley, V., et al. Blimp1 defines a progenitor population that governs cellular input to the sebaceous gland. Cell. 126, 597-609 (2006).
- Goldstein, J., Horsley, V. Home sweet home: skin stem cell niches. Cell Mol Life Sci. 69, 2573-2582 (2012).
- Fuchs, Y., et al. Sept4/ARTS regulates stem cell apoptosis and skin regeneration. Science. 341, 286-289 (2013).
- Nowak, J. A., Fuchs, E. Isolation and culture of epithelial stem cells. Methods Mol Biol. 482, 215-232 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon