Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolieren von Haarfollikelstammzellen und epidermalen Keratinozyten von Dorsal Mäusehaut
In diesem Artikel
Zusammenfassung
An ideal model for studying adult stem cell biology is the mouse hair follicle. Here we present a protocol for isolating different populations of hair follicles stem cells and epidermal keratinocytes, employing enzymatic digestion of mouse dorsal skin followed by FACS analysis.
Zusammenfassung
The hair follicle (HF) is an ideal system for studying the biology and regulation of adult stem cells (SCs). This dynamic mini organ is replenished by distinct pools of SCs, which are located in the permanent portion of the HF, a region known as the bulge. These multipotent bulge SCs were initially identified as slow cycling label retaining cells; however, their isolation has been made feasible after identification of specific cell markers, such as CD34 and keratin 15 (K15). Here, we describe a robust method for isolating bulge SCs and epidermal keratinocytes from mouse HFs utilizing fluorescence activated cell-sorting (FACS) technology. Isolated hair follicle SCs (HFSCs) can be utilized in various in vivo grafting models and are a valuable in vitro model for studying the mechanisms that govern multipotency, quiescence and activation.
Einleitung
Adulte Stammzellen (SCs) sind essentiell für die Aufrechterhaltung der Homöostase Gewebe durch sterbende Zellen zu ersetzen und beschädigten Gewebe auf Verletzungen zu reparieren. Diese SCs sind definiert durch ihre Fähigkeit , kontinuierliche Selbsterneuerung zu unterziehen und in verschiedene Zelllinien 1-3 zu unterscheiden. Die am besten untersuchten Systeme, die bei Erwachsenen SCs für ihre Nachschub abhängig sind, gehören das hämatopoetische System, den Darm und die Haut 1,2,4.
Während der Embryonalentwicklung, beginnt die Haut als eine einzelne Schicht von Epidermiszellen. Morphogenese des Haarfollikels (HF) beginnt , wenn mesenchymalen Zellen der Haut besiedeln und eine darunterliegende Dermis kollagenen 5 bilden. Specialized mesenchymalen Zellen, die später die Hautpapilla bilden (DP), organisieren direkt unter der Epidermis und stimulieren das Epithel Haar Plakoden zu bilden , die nach unten 6 zu wachsen beginnen. proliferierende hochMatrixZellen, am Boden des HF befindet,umhüllen diese mesenchymalen Zellen und bilden die Haarzwiebel, während die innere Schicht in konzentrische Zylinder zu unterscheiden beginnt den Haarschaft (HS) und dem umgebenden inneren Wurzelscheide (IRS) 2,3 zu bilden.
In der postnatalen Leben ist die Haut Epidermis aus drei Kammern besteht: die interfollikulären Epidermis (IFE), der Talgdrüse (SG) und dem HF. Im Gegensatz zu der IFE und SG , die in einem ständigen Zustand der Homöostase sind, ist der HF ein dynamischer Mini-Organ , das kontinuierliche Zyklen von Wachstum (Anagen) erfährt, Zerstörung (catagen) und Ruhe (Telogen) 4,7. Die Haarfollikel - Stammzellen (HFSCs) , dass der Kraftstoff dieser ewigen Kreislauf, befinden sich in einer Nische innerhalb der HF als Ausbuchtung bekannt 4. Während Anagen die HFSCs die Beule zu verlassen, nach der Aktivierung Signale von der DP, beginnen wuchernden und absteigen nach unten so einen langen linearen Spur von Zellen als die äußere Wurzelscheide bekannt zu schaffen (ORS) 8-10. Die Matrixzellen, dassumgeben das DP an der Basis des HF, schnell Zyklus und nach oben wandern terminalen Differenzierung erfährt somit die HS und der IRS - 10 (Abbildung 1) zu erzeugen. Die Dauer der Anagenphase bestimmt die Länge des Haares und ist abhängig von der proliferative und Differenzierungsfähigkeit der Matrixzellen 6. Wenn die HF Catagen kommt, die Durchfuhr verstärkenden Matrixzellen in der Birne nicht mehr vermehren, Apoptose und vollständig zurückbilden , während die DP nach oben ziehen , bis sie die nicht- teil Teil des 8,11 HF erreicht. Während dieses Zurückziehens bildet die HF eine temporäre Struktur wie der epithelialen Stranges bekannt, welche aus catagen charakteristisch ist, und enthält viele apoptotische Zellen. Bei Mäusen catagen dauert zwischen 3-4 Tagen und wird in der ersten Haarzyklus hoch synchronisiert. Wenn die HF Telogen alle HFSCs erreicht werden Ruhe. Die unterschiedlichen Stufen des HF-Zyklus werden auch durch Veränderungen in der Farbe der Maushaut durch m gekennzeichnetelanin Produktion. Die Haut von schwarz während Anagen bis dunkelgrau während catagen während Telogen 6,7,12,13 bis rosa.
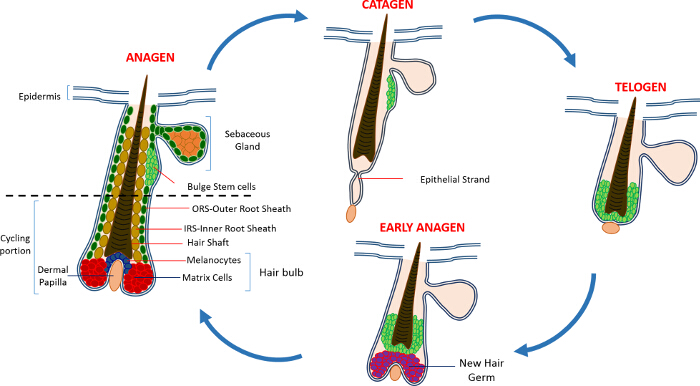
Abbildung 1: Haarfollikels Zyklus. Die HF besteht aus einem permanenten oberen Teil und einem unteren ständig Umbau, Radfahren Abschnitt, der kontinuierlichen Zyklen des schnellen Wachstums (Anagen) erfährt, Zerstörung (catagen) und einer relativen Ruhe Phase oder Ruhe (Telogen). Bitte klicken Sie hier ein , um zu vergrößern Version dieser Figur.
Die SCs die HF Aufrechterhaltung wurden zunächst mit Chase - Experimenten identifiziert, mit tritiiertem Thymidin, die eine Bevölkerung von langsamen Radfahren Etiketthaltezellen (LRC) ergab , dass 14 knapp unterhalb der SG in der permanenten Bereich der HF wohnhaft war . Die Fortschritte in der HFSCCharakterisierung ergab eine kleine Anzahl von Markern, die verwendet werden können , spezifische SCs von der HF Nische 15 zu identifizieren und zu isolieren. Vielleicht ist der beste Marker für die Anreicherung von HFSCs ist CD34, ein Zelloberflächenmarker auch als hämatopoetische SC Marker identifiziert beim Menschen 16. Innerhalb dieser CD34 + Populationen zwei unterschiedliche Populationen wurden auf α6 Integrinexpression 2 auch isoliert basiert. Ein weiterer Marker ist Keratin 15 (K15) , die stark in der bauchige Bereich ausgedrückt wird, co-lokalisiert mit CD34 - Expression und eine K15 - Promotor für das Targeting und die Isolierung HFSCs in transgenen Tieren 15,17-19 verwendet. In den letzten zehn Jahren haben mehrere andere unterschiedliche Populationen von HFSCs und Vorläuferzellen auch im HF wohnen 17,20-27 berichtet.
Eine weitere spannende Feature von HFSCs ist ihr Beitrag zur Haut zu reparieren. Unter normalen Bedingungen wieder aufzufüllen HFSCs die HF und nehmen nicht an IFE Homöostase. However, als Reaktion auf Verwundung, verlassen diese Zellen ihre SC Nische und die Hilfe bei der IFE 9 repopulating. Wir haben kürzlich gezeigt , dass Mäuse , die pro-apoptotische SEPT4 / ARTS Gen Anzeige eine erhöhte Anzahl von CD34, K15 und Sox9 + HFSCs, gelöscht , die eine Resistenz gegenüber Apoptose zeigen. HFSCs wurden aus SEPT4 / ARTS isoliert - / - dorsale Haut fluorescence activated cell Verwendung Sortierung (FACS) , und es war mehr als eine zweifache Zunahme in der Anzahl von CD34 + und K15 + HFSCs. Diese SEPT4 / ARTS - / - HFSCs wurden in vitro erweitert und nicht nur gab Anlass zu mehr Kolonien , sondern konnten auch härteren Bedingungen standhalten , im Vergleich zu den Kontrollen 28.
Als Folge einer erhöhten Anzahl von HFSCs aufweist, SEPT4 / ARTS - / - -Mäusen signifikant schneller als Reaktion auf Hautexzision Verletzungen geheilt. Auffallender, SEPT4 / ARTS - / - Mäuse displayeda große Anzahl von regenerierten HFs aus dem Wundbett und deutlich kleinere Narben. Weiterhin für XIAP (X-chromosomal - Inhibitor der Apoptose) gelöscht Mäuse, die biochemische Ziel von ARTS, zeigte beeinträchtigte Heilung 28.
Unsere Ergebnisse und die Arbeit in anderen Laboratorien haben gezeigt, dass HFSCs als ideales Modell für die Biologie und Funktion von Erwachsenen SCs zu studieren. Hier beschreiben wir die Methodik für die Anreicherung und Isolierung von HFSCs und epidermalen Keratinozyten auf der Grundlage der Expression von vier Marker: Integrin α6; Integrin β1; Sca-1 (ein Marker für den epidermalen Keratinozyten) und CD34. Ähnliche Isolierung von K15 + HFSCs können auch die K15-GFP reporter Maus 19 durchgeführt werden.
Protokoll
Diese Studie wurde in strikter Übereinstimmung mit den Empfehlungen im Leitfaden für die Pflege und Verwendung von Labortieren des israelischen Gesundheitsministerium skizziert durchgeführt. Alle Tiere wurden nach dem bewährten institutionellen Tierpflege Protokoll IL-02302-2015 des Technion Israel Institute of Technology behandelt.
1. Experimentelle Vorbereitung
- Herstellung von Chelat Fetal Bovine Serum
Anmerkung: Epitheliale Zellen sind sehr empfindlich gegen Calcium, so dass es entscheidend ist, die Exposition dieser Zellen zu Calcium zu steuern. Um sicherzustellen , dass die Zellen zu Calcium nicht während des Isolierungsprozesses Chelat ausgesetzt wird verwendet , die für die Zubereitung Fetal Bovine Serum verwendet Färbepuffer 29 jegliches restliches Calcium zu entfernen. Das folgende Protokoll bereitet etwa 1 l Calcium freien Fetal Bovine Serum, die für die Zubereitung FACS Färbepuffers.- In 400 g trockenem Chelat - Material, zB., Chelex, in einem 4 - Liter - Becher und H 2 O auf ein Gesamtvolumen 4 L. Abdeckung destilliert hinzufügen und kontinuierlich mit einem Magnetrührer rühren.
- PH-Einstellung auf 7,4 unter Verwendung von 10 N HCl-Lösung unter Rühren. Fahren Sie für 20 min gerührt und erneut den pH-Wert nach Bedarf, bis der pH für mehr als 20 min stabil bleibt.
- Inkubieren Becher bei 4 ° C über Nacht das chelatbildende Material erlauben eine kompakte Pellet zu bilden. Sorgfältig absaugen H 2 O und fügen Sie frisch destilliertem H 2 O auf ein Gesamtvolumen von 4 L.
- Wiederholen der pH-Einstellung, wie in Schritt 1.1.2.
- Das Becherglas bei 4 ° C für 1 Stunde die chelatbildende Material zu ermöglichen, einen kompakten Pellet zu bilden. Sorgfältig absaugen H 2 O.
- Langsam zwei 500-ml-Flaschen von Serum auf die Chelat-Material Rinderföten hinzufügen. Rühren langsam bei 4 ° C für 1 Stunde sicherstellt, dass die Geschwindigkeitseinstellung keine Blasen erzeugt.
- Das Becherglas bei 4 ° C für 1 Stunde die Chelat-Material zu ermöglichen, eine comp zu bildenhandeln Pellet.
- übertragen Sie vorsichtig das Serum in 1 l Glasflasche und filtern sie durch eine Flasche Top-Filter unter sterilen Bedingungen. Lagern Sie die Chelat-Serum bei -20 ° C oder sofort ab.
- Herstellung von Färbepuffer
- Bereiten Sie 100 ml 3% als Chelat FBS in PBS ohne Ca 2+ und Mg 2+ und auf Eis halten.
2. Isolierung von Haarfollikeln aus adulten Epidermis
- Anesthetize Mäuse unter Verwendung von 5% Isofluran ein Induktionsfeld an. Das hier beschriebene Protokoll wurde optimiert unter Verwendung von 50-80 Tage alten Mäusen, die in der Telogenphase des HF-Zyklus sind.
- Euthanize Mäuse nach Standard-Laborverfahren. Hier einschläfern Mäuse CO 2 Überdosis in einer Euthanasie Kammer verwendet wird .
- Shave alle Haare aus der Rückenhaut mit elektrischen Haarschneider. Vermeiden Sie Kopf und Gliedmaßen. Halten Sie die Clippers so nah wie möglich an der Haut. Vermeiden Sie die Haut und das Unterhautschicht zu beschädigen.
- Wenn alle Haare entfernt wird, verwenden 70% Ethanol keine Haarrückstände zu entfernen, und die dorsale Haut zu desinfizieren.
- Platzieren Sie die Maus auf einem Sezieren-Pad, und mit einer Pinzette ziehen die Haut in der Nähe der Schwanz und machen einen kleinen Einschnitt mit einer Schere. Schneiden Sie die gesamte Rückenhaut in einer posterior-anterior durch sorgfältig die Haut Wegschneiden und es von der Faszie zu trennen. Vermeiden Sie die subkutane Schicht zu beschädigen.
- Legen Sie die Haut auf einer Sezieren Matte, Haarseite nach unten, und festzunageln zwei benachbarte Kanten der Haut an Ort und Stelle zu fixieren. Ziehen Sie das Fett abkratzen, mit einem stumpfen Skalpell, bis die Dermis klar und ordentlich ist.
Hinweis: Wenn das Fett Abschaben, gebogenen Pinzette verwenden, um sanften Druck auf die Haut auftragen. Wenden Sie Druck auf die Haut der gekrümmten Seite der Pinzette. Dadurch wird die Haut vor dem Reißen zu verhindern. - Legen Sie die Haut, Dermis Seite nach unten, in 100 mm sterile Kulturschale und glätten die Haut, um sicherzustellen, dass es keine Falten. 10 ml PBS ohne Ca 2+ und Mg 2+ (PBS -) an der Kulturschale und die Haut glätten , wenn nötig.
- Saugen Sie das PBS und 10 ml 0,25% Trypsin hinzufügen. Stellen Sie sicher, dass die Haut entfaltet und schwimmt frei. Inkubieren einem Stück Haut pro 10 ml von 0,25% Trypsin.
- Inkubieren Proben bei 37 ° C für 30-120 min oder bei 4 ° C über Nacht.
3. Herstellung von Einzelzellsuspension von Haarfollikeln
- Scrape alle die Haare aus der Haut mit einer gebogenen Pinzette und Skalpell in einer von vorne nach hinten Richtung. Halten Sie die Haut anstelle der gekrümmten Seite der Pinzette und verwenden Sie das Skalpell das Haar abkratzen.
Hinweis: Kratzen Sie die Haare in die Trypsin-Lösung aus hinzugefügt in Schritt 2.8. Beginnen Sie am Schwanz und folgen der Richtung des Haarwachstums. Scraping gegen die Richtung des Haarwachstums wird in erheblichen Verlust an HFs und Reduzierung der Zellausbeute zur Folge haben. HFs neigen dazu, jede zusammen und bilden kleine Klumpen zu halten; um th zu reduzierene Größe von HF Klumpen versuchen, einen kleinen Bereich zu einer Zeit, abzukratzen. - Übertragen Sie die unbehaarte Haut auf neue Kulturschale und 10 ml PBS - zu verhindern , dass sie vor dem Austrocknen. Untersuchen Sie die Haut und kratzen alle verbleibenden Haare ab.
- Überwinden Sie die HFs mit einem Skalpell und Pinzette, bis ein einzelner HF Suspension erhalten wird. mit 10 ml Pipette für ein paar Minuten Energisch verreiben die HF Suspension alle Haare Klumpen aufzubrechen.
Hinweis: Führen Sie alle folgenden Schritte auf dem Eis. - Übertragen Sie die HF-Suspension in voretikettierten 50-ml-Tube.
- Saugen Sie das PBS - von der Haut und es verwenden , die Zellkulturschale zu spülen, die die HF - Suspension enthalten ist ; Transfer zum 50-ml-Tube.
- Waschen
- Filtern der Suspension durch Durchleiten durch eine 70 & mgr; m Zellsieb auf ein Rohr 50 ml ausgestattet. Waschen Sie die ersten 50 - ml - Tube und das Sieb mit 10 ml Färbepuffers (PBS - mit 3% als Chelat FBS).
- Filtern Sie die Suspension durch Einleitenbis 40 & mgr; m Zelle Sieb auf eine 50-ml-Röhrchen ausgestattet. Waschen des Röhrchens mit 5-10 ml Färbepuffer, um sicherzustellen, daß alle Zellen auf die neue Röhrchen überführt wurden. Halten Sie die Suspension auf Eis, bis alle Tiere verarbeitet wurden.
- Zentrifuge für 15 min bei 300 × g bei 4 ° C. Sorgfältig absaugen Überstand ohne in 5 ml Färbepuffer das Pellet und Pellet zu stören.
- Zentrifuge für 5 min 300 × g bei 4 ° C. vorsichtig absaugen Überstand und Zellpellet in 800 ul Färbepuffers.
Hinweis: Die Volumina oben angegebenen genug Zellen für die Färbung, die von zwei erwachsenen Mäusen.
- Transfer Suspension in voretikettierten FACS-Röhrchen.
- Für Kontrollen Rohre nehmen 25-50 ul Zellsuspension (oder jede Rest links aus der Zellsuspension) und bis zu einem Gesamtvolumen von 300 ul mit Färbepuffers bilden.
Hinweis: Bereiten Kontrollröhrchen (Gesamtvolumen 300 ul) für ungefärbte (keine Antikörperund kein DAPI); DAPI nur; Integrin β1; Integrin α6; Sca-1; CD34.
- Für Kontrollen Rohre nehmen 25-50 ul Zellsuspension (oder jede Rest links aus der Zellsuspension) und bis zu einem Gesamtvolumen von 300 ul mit Färbepuffers bilden.
- Fügen Sie die primären Antikörper und DAPI (siehe Materialien Tabelle für geeignete Verdünnungen) in den gewünschten Konzentrationen in den entsprechenden Röhrchen. Flick vorsichtig die Schläuche der Zellsuspension zu mischen. Die Rendite auf das Eis und mit Alufolie abdecken, um vor Licht zu schützen.
- Inkubieren für 30 Minuten auf Eis und sanft die Röhren alle 10 min schnippen, um sicherzustellen, Zellen in Suspension gehalten werden.
- Waschen Sie die Zellen durch jedes FACS-Röhrchen mit Färbepuffers Auffüllen (ca. 4 ml pro Röhrchen); Zentrifuge für 5 min bei 300 × g bei 4 ° C.
- vorsichtig absaugen Überstand und Zellpellet in 800 ul Färbepuffers.
- Übertragen Zellsuspension in FACS-Röhrchen mit Zellsieb caps Einzelzellsuspension zu gewährleisten.
4. Durchflusscytometrieanalyse
- Gehen Sie zu der Zelle sofort Sortieren einer Strömung mit Zytometer mit geeigneten Filtern für Signal Erkennung. Verwenden 405 nm violett (für Messungen von DAPI), 488 nm blau (für Messungen von FSC, SSC, PE, PE-Cy7 und FITC) und 633 nm rot-Laser (zur Anregung von APC)
Hinweis: Stellen Sie sicher, dass das Gerät von Detektoren für alle drei Fluoreszenzkanäle aufzeichnet. - Set Fluoreszenz-Gates basierend auf ungefärbten Proben und Kompensation für die spektrale Überlappung einzelnen gefärbten Kontrollen verwenden.
Hinweis: Verwenden Sie die einzelnen gefärbten Kontrollen zur Einstellung der Kompensation zwischen den Kanälen, um jegliche Überlappung der Fluoreszenzsignale zu eliminieren. Kompensationseinstellung hängt von der FACS-Sorter verwendet. - Richten Sie primäre Tore auf DAPI basierend auf tote Zellen auszuschließen.
- Stellen Sie die Streudiagramm (SSC-A gegen FSC-A) für Singulett-Ereignisse auszuwählen.
- Richten Sie FSC und SSC Höhe und Breite Parameter für Dubletten zu eliminieren und für Singulett-Ereignisse unterscheiden.
- Gate-Zellen mit hoher α6 und β1 Expression und aus dieser Population-Gate-Zellen entweder mit CD34 hohe Expression oder Sca1 hohe Expression.
- Sortier Zellen in vormarkiert FACS-Röhrchen.
Hinweis: Zwei allgemeine Populationen von Zellen isoliert werden können; α6 + / β1 + / CD34 + / Sca-1 - und α6 + / β1 + / Sca-1 + / CD34 -. Sortierte Zellen sollten zu jeder Zeit auf Eis gehalten werden, bis sie nachgelagerten Anwendungen wie Zellkultur oder RNA-Isolierung verwendet werden,
Ergebnisse
Dieses Protokoll beschreibt im Detail die Anreicherung und Isolierung von zwei Arten von Populationen. Ausbuchtung SCs und epidermalen Keratinozyten Abbildung 2 die wichtigsten Schritte des Protokolls darstellt. Unter Verwendung der Haut von der dorsalen entfernt wieder von 8 Wochen alten Mäusen, angereichert wir Ausbuchtung SCs die CD34 Marker, die nur in HFSCs exprimiert wird; und Sca-1, das epidermalen Keratinozyten Etiketten. 3 zeigt unterschiedlich...
Diskussion
Das hier beschriebene Protokoll ist gut etabliert für HFSCs aus der Rückenhaut von erwachsenen Mäusen isoliert , sondern kann ebenso für die Isolierung von anderen Populationen innerhalb der HF - Struktur angewendet werden, basierend auf der Auswahl von Markern 2,16,23,28,29. Dieses Verfahren ist insbesondere vorteilhaft gegenüber anderen Verfahren der Zellisolation, wie Gewebe Dissoziation, daß ein spezifischer Zelltyp kann aus einer Mischung aus heterogenen Zellpopulationen, ausgewählt und geerntet w...
Offenlegungen
The authors have nothing to declare
Danksagungen
This work was supported in part by NIH grant RO1GM60124 (to H.S.). H.S. is an Investigator with the Howard Hughes Medical Institute. Y.F. is supported by the Deloro Career Advancement Chair and The German Israeli Foundation (I-2381-412.13/2015). D.S. is supported by the Coleman-Cohen post-doctoral fellowship.
Materialien
| Name | Company | Catalog Number | Comments |
| Isoflurane | Primal Critical Care | 66794-017-10 | |
| Carbon dioxide | - | - | |
| Electro Shaver | Oster | Golden A5 | Shaver from any other company could be used |
| 70% ethanol | Gadot Lab | 830000051 | 96% ehtanol diluted with distilled water |
| Dissection mat | Dissection tools from any provider can be used | ||
| Forceps | Dumont | 11251-10 | Foreceps from any other company could be used |
| Scissors | Dumont | 14094-11 | Scissors from any other company could be used |
| Needles/Pins | - | - | |
| Scalpel | Albion | 10 | Ensure that the scalpel has a blunt end |
| Tissue culture dish 60mm x 15mm | Sigma-Aldrich | CLS430166 | |
| PBS | - | In-house PBS without Calcium and Magnesium | |
| 0.25% Trypsin/EDTA | Biological Industries | 03-050-1A | Trypsin obtained from a different company might have a different activity and duration of the trypsin digest has to be adjusted accordingly |
| Pipettes 10ml | Sigma-Aldrich | Corning, 4488 | |
| Ice | - | - | |
| 50 ml sterie centrifuge tubes | Minplast Ein-shemer | 35050-43 | |
| 70µM Cell strainer | Fisher | 22362548 | |
| 40µM Cell strainer | Fisher | 22362549 | |
| Staining buffer | - | ||
| Centrifuge | Eppendorf 5804 R | 5805 000.017 | |
| FACS tubes with Cell strainer caps | Falcon | 352235 | |
| FACS tubes | Falcon | 352063 | |
| Integrin β1 | eBioscience | 25-0291 | 1:400 |
| Integrin α6 | eBioscience | 15-0495 | 1:600 |
| Sca I | eBioscience | 11-5981 | 1:200 |
| CD34 | eBioscience | 9011-0349 | 1:300 |
| DAPI | Sigma-Aldrich | D9542 | 50ng/ml |
| Dry Chelex | BioRad | 142-2842 | |
| Beaker | Pyrex | - | |
| Distilled H2O | - | - | |
| Stir bar | - | - | |
| NHCl | BioLab | 1903059 | |
| Fetal bovine serum (FBS) | Beit Haemek Biological Industries | 400718 | FBS obtained from a different company can be used |
| 1L glass bottle | Ilmabor | Boro 3.3 | |
| Bottle top filter | Autofil | 1102-RLS |
Referenzen
- Wagers, A. J., Weissman, I. L. Plasticity of adult stem cells. Cell. 116, 639-648 (2004).
- Blanpain, C., Lowry, W. E., Geoghegan, A., Polak, L., Fuchs, E. Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell. 118, 635-648 (2004).
- Fuchs, E. Scratching the surface of skin development. Nature. 445, 834-842 (2007).
- Hsu, Y. C., Fuchs, E. A family business: stem cell progeny join the niche to regulate homeostasis. Nat Rev Mol Cell Biol. 13, 103-114 (2012).
- Blanpain, C., Fuchs, E. Epidermal homeostasis: a balancing act of stem cells in the skin. Nat Rev Mol Cell Biol. 10, 207-217 (2009).
- Alonso, L., Fuchs, E. The hair cycle. J Cell Sci. 119, 391-393 (2006).
- Muller-Rover, S., et al. A comprehensive guide for the accurate classification of murine hair follicles in distinct hair cycle stages. J Invest Dermatol. 117, 3-15 (2001).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5, 267-278 (2009).
- Ito, M., et al. Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis. Nat Med. 11, 1351-1354 (2005).
- Hsu, Y. C., Pasolli, H. A., Fuchs, E. Dynamics between stem cells, niche, and progeny in the hair follicle. Cell. 144, 92-105 (2011).
- Fuchs, E. The tortoise and the hair: slow-cycling cells in the stem cell race. Cell. 137, 811-819 (2009).
- Plikus, M. V., Chuong, C. M. Complex hair cycle domain patterns and regenerative hair waves in living rodents. J Invest Dermatol. 128, 1071-1080 (2008).
- Ito, M., Kizawa, K., Hamada, K., Cotsarelis, G. Hair follicle stem cells in the lower bulge form the secondary germ, a biochemically distinct but functionally equivalent progenitor cell population, at the termination of catagen. Differentiation. 72, 548-557 (2004).
- Cotsarelis, G., Sun, T. T., Lavker, R. M. Label-retaining cells reside in the bulge area of pilosebaceous unit: implications for follicular stem cells, hair cycle, and skin carcinogenesis. Cell. 61, 1329-1337 (1990).
- Cotsarelis, G. Epithelial stem cells: a folliculocentric view. J Invest Dermatol. 126, 1459-1468 (2006).
- Trempus, C. S., et al. Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34. J Invest Dermatol. 120, 501-511 (2003).
- Morris, R. J., et al. Capturing and profiling adult hair follicle stem cells. Nat Biotechnol. 22, 411-417 (2004).
- Lyle, S., et al. The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells. J Cell Sci. 111 (Pt 21), 3179-3188 (1998).
- Liu, Y., Lyle, S., Yang, Z., Cotsarelis, G. Keratin 15 promoter targets putative epithelial stem cells in the hair follicle bulge. J Invest Dermatol. 121, 963-968 (2003).
- Vidal, V. P., et al. Sox9 is essential for outer root sheath differentiation and the formation of the hair stem cell compartment. Curr Biol. 15, 1340-1351 (2005).
- Snippert, H. J., et al. Lgr6 marks stem cells in the hair follicle that generate all cell lineages of the skin. Science. 327, 1385-1389 (2010).
- Nijhof, J. G., et al. The cell-surface marker MTS24 identifies a novel population of follicular keratinocytes with characteristics of progenitor cells. Development. 133, 3027-3037 (2006).
- Jensen, U. B., et al. A distinct population of clonogenic and multipotent murine follicular keratinocytes residing in the upper isthmus. J Cell Sci. 121, 609-617 (2008).
- Jensen, K. B., et al. Lrig1 expression defines a distinct multipotent stem cell population in mammalian epidermis. Cell Stem Cell. 4, 427-439 (2009).
- Jaks, V., et al. Lgr5 marks cycling, yet long-lived, hair follicle stem cells. Nat Genet. 40, 1291-1299 (2008).
- Horsley, V., et al. Blimp1 defines a progenitor population that governs cellular input to the sebaceous gland. Cell. 126, 597-609 (2006).
- Goldstein, J., Horsley, V. Home sweet home: skin stem cell niches. Cell Mol Life Sci. 69, 2573-2582 (2012).
- Fuchs, Y., et al. Sept4/ARTS regulates stem cell apoptosis and skin regeneration. Science. 341, 286-289 (2013).
- Nowak, J. A., Fuchs, E. Isolation and culture of epithelial stem cells. Methods Mol Biol. 482, 215-232 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten