A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
بناء نماذج التنبؤ تدميري من مكونات المحتويات في العنب البري بواسطة التحليل الطيفي القريبة من الأشعة تحت الحمراء بناء على قياسات HPLC
In This Article
Summary
We present here a protocol to construct and validate models for nondestructive prediction of total sugar, total organic acid, and total anthocyanin content in individual blueberries by near-infrared spectroscopy.
Abstract
Nondestructive prediction of ingredient contents of farm products is useful to ship and sell the products with guaranteed qualities. Here, near-infrared spectroscopy is used to predict nondestructively total sugar, total organic acid, and total anthocyanin content in each blueberry. The technique is expected to enable the selection of only delicious blueberries from all harvested ones. The near-infrared absorption spectra of blueberries are measured with the diffuse reflectance mode at the positions not on the calyx. The ingredient contents of a blueberry determined by high-performance liquid chromatography are used to construct models to predict the ingredient contents from observed spectra. Partial least squares regression is used for the construction of the models. It is necessary to properly select the pretreatments for the observed spectra and the wavelength regions of the spectra used for analyses. Validations are necessary for the constructed models to confirm that the ingredient contents are predicted with practical accuracies. Here we present a protocol to construct and validate the models for nondestructive prediction of ingredient contents in blueberries by near-infrared spectroscopy.
Introduction
بالقرب من الأشعة تحت الحمراء يتم تطبيق (الجرد) الطيفي على نطاق واسع كأسلوب غير تدميري لتحليل محتويات الفواكه والخضروات بمختلف أنواعها. 1،2 غير تدميري يحلل نير الطيفي تمكين الشحن فقط ثمار لذيذة والخضروات مع صفات مضمونة. تم تطبيقه بالفعل الجرد الوطني الطيفي لالبرتقال والتفاح والبطيخ والكرز والكيوي والمانجو والبابايا والخوخ وهلم جرا لمعرفة بركس في أن يتوافق مع المحتوى الكلي السكر والحموضة، TSC (الجوامد الكلية)، وهلم جرا . في الآونة الأخيرة، وقد أبلغنا تطبيق الجرد الوطني الطيفي لتقييم جودة العنب البري. 3 نحن لا يقاس فقط المحتوى الكلي السكر والمحتوى الكلي لمجموع الأحماض العضوية الموافق الحموضة، ولكن أيضا إجمالي محتوى الأنثوسيان. الأنثوسيانين هو أحد مكونات النشطة بيولوجيا والتي يعتقد لتحسين صحة الإنسان. أنه لأمر مريح للمستهلكين اذا كان بامكانهم شراء العنب لذيذ مع ضمان محتوى السكر، وميلانidity، والمحتوى الأنثوسيان.
في قوائم الجرد الوطنية امتصاص الأطياف من الفواكه والخضار، ويلاحظ فقط عصابات امتصاص واسعة. فهي أساسا العصابات بسبب الألياف والرطوبة. على الرغم من أن العديد من الفرق الضعيفة بسبب المكونات المختلفة لهدف غير دمر لوحظ في وقت واحد، لا يمكن تعيين العصابات المرصودة لوسائط الذبذبات محددة من مكونات محددة من الهدف في معظم الحالات. ولذلك، فإن أسلوب تقليدي لتحديد محتوى عنصر معين باستخدام قانون لامبرت-البيرة ليست فعالة لقوائم الجرد الوطنية الأطياف. بدلا من ذلك، نماذج المعايرة للتنبؤ محتويات مكونات الهدف من الأطياف المرصودة هي التي شيدت باستخدام chemometrics من خلال دراسة العلاقة بين أطياف المرصود ومحتويات عنصر المقابلة لالأطياف. 4،5 هنا، على بروتوكول لبناء والتحقق من صحة نماذج للتنبؤ من إجمالي محتوى السكر، ومجموع محتوى حمض عضوي الموافق الحمضةويرد تاي، والمحتوى الكلي للالأنثوسيان التوت من نير الأطياف.
ويبين الشكل 1 الرسم البياني العام لبناء نماذج المعايرة متينة وموثوق بها. يتم جمع عينات من عدد كاف. وتستخدم بعض منهم لبناء نماذج في حين يتم استخدام الآخرين للتحقق من صحة نماذج بناؤها. لكل من العينات التي تم جمعها، ويتم قياس الطيف الجرد الوطني، ومن ثم يتم تحليل مكونات الهدف كميا مع طرق التحليل الكيميائي التقليدية المدمرة. هنا، يتم استخدام عالية الأداء اللوني السائل (HPLC) للتحاليل الكيميائية من السكريات والأحماض العضوية، والانثوسيانين. المربعات الصغرى الجزئية يستخدم (PLS) الانحدار لبناء نماذج المعايرة حيث يتم فحص العلاقة بين أطياف المرصود ومحتويات عنصر يحددها التحاليل الكيميائية. من أجل بناء نماذج قوية مع أفضل قدرة التنبؤ، والمعالجة المسبقة للobserيتم فحص أيضا فيد الأطياف والمناطق الطول الموجي استخدامها للتنبؤ. وأخيرا، يتم التحقق من صحة النماذج التي شيدت لتأكيد قدرة التنبؤ كافية لهم. في التحقق من الصحة، وتوقعت المحتويات من الطيف المرصود من قبل نموذج شيدت (القيم المتوقعة) وبالمقارنة مع محتويات يحددها التحاليل الكيميائية (القيم الملاحظة). إذا لا يمكن العثور على علاقة كافية بين القيم المتوقعة، ولاحظ، نموذج المعايرة يجب إعادة بناء، حتى يتم الحصول على علاقة كافية. على الرغم من أنه من الأفضل استخدام مجموعات مختلفة من العينات لبناء والتحقق من صحة النموذج كما هو موضح في هذا الرقم (التثبت من مصادر خارجية)، وتستخدم العينات في نفس المجموعة على حد سواء لبناء والتحقق من صحة (عبر التحقق من صحة) عندما يكون عدد عينات ليست كبيرة بما فيه الكفاية.
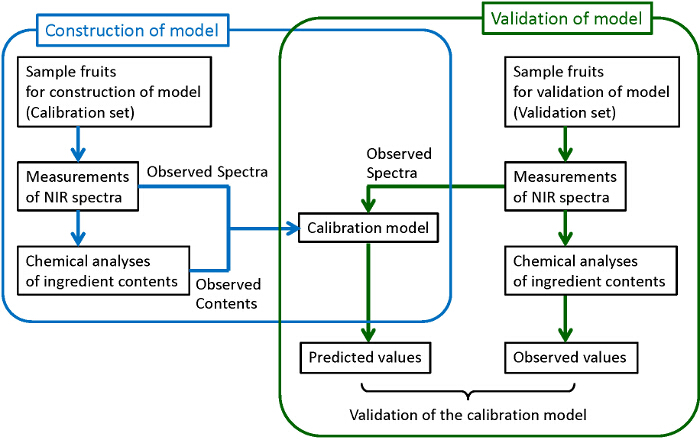
Figure 1. تدفق الرسم البياني لبناء والمصادقة على نموذج المعايرة، والإجراءات التي تحيط بها خطوط زرقاء وخضراء تتوافق على التوالي، إلى بناء نموذج المعايرة والتحقق من صحة لها. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. جمع العينات
- تقرر أي أصناف ستدرج في الهدف من نموذج المعايرة.
- جمع عدد كاف وأنواع مختلفة من العنب عينة من الأصناف المستهدفة.
- جمع ويفضل 100 التوت لبناء نموذج المعايرة، و 10 على الأقل في المصادقة على نموذج بناؤها. من أجل بناء نماذج قوية، وجمع عينات من أنواع مختلفة، أي مع مختلف الألوان والأحجام، وفي مختلف الظروف النضج.
- تزن كل توت. ملاحظة: يتم استخدام الأوزان قياسها في وقت لاحق لحساب محتوى في المئة من مكونات كل توت.
2. قياسات أطياف
- الاحماء معمل بما فيه الكفاية (أكثر من 1 ساعة) قبل القياسات للحصول على الأطياف موثوق بها.
- ضبط معمل. تأكد من أن الظروف ثابتة عن طريق القياسات. لوفيما يلي مثال على شروط نموذجية لقياس.
- تعيين مجموعة من القياسات ل12،500-3،600 سم -1.
- تعيين دقة الطيفي إلى 16 سم -1.
- تعيين تراكم 32 مرة.
- تحديد الانعكاس منتشر كوضع القياس.
- وضع العاكس القياسية على نافذة معمل لقياس الانعكاس منتشر. باستخدام "الخلفية قناة واحدة" القيادة، وقياس الطيف الخلفية التي تستخدم تلقائيا لحساب الأطياف الانعكاس النسبي من أطياف التوت عينة تقاس في وقت لاحق.
- وضع عينة توت في وسط النافذة من معمل لقياس الانعكاس منتشر. باستخدام "قناة واحدة عينة" القيادة، وقياس أطياف كل توت ويفضل أن يكون في عدة نقاط من الفاكهة.
ملاحظة: كما سيتم إجراء Kubelka-مونك التحول 6،7 السياراتmatically لاحظ الأطياف من العنب عينة إذا تم تعيين حالة من الاستحواذ الطيفي للقيام بذلك. Kubelka-مونك التحول يغير أطياف قياس في وضع الانعكاس منتشر إلى أطياف يعادل تلك التي تقاس في وضع الإرسال وهناك حاجة لتحليل الأطياف بدقة عالية. وتستخدم الأطياف في نطاق الامتصاصية للتحاليل. - حساب متوسط طيف من الأطياف من كل عينة باستخدام برنامج معالجة البيانات مثل MS Excel إذا تم قياس أطياف عينة توت في عدة نقاط. استخدام الطيف المتوسط للتحليلات.
3. المعالجة المسبقة لقياسات HPLC من والسكريات العضوية الأحماض 8
ملاحظة: استخراج السكريات والأحماض العضوية من كل عنبية، والتي هي قابلة للذوبان في الماء، مع الماء عالى النقاء على النحو التالي. يستخدم كل من كل عنبية للتحاليل.
- الحفاظ على التوت في الثلاجة دون -30 درجة مئوية استعداد FOتحاليل كيمائية ص إذا لم يتم تحليلها بعد القياسات الطيفية.
- قطع توت إلى عدة قطع بحيث يمكن بسهولة المتجانس في الخطوات التالية. قطع توت دون إزالة الجليد عندما يتم تجميده.
- وضع القطع في دورق 50 مل.
- إضافة كاليفورنيا. 10 مل من الماء عالى النقاء (الماء المقطر الذي هو أقل من 0.1 ميكرو ثانية / سم التوصيل الكهربائي) إلى الدورق.
- تسخين توت قطع في الماء عالى النقاء في فرن الميكروويف لمدة 20 ثانية لتنشيط الانزيمات التي يمكن أن تتحلل السكريات خلال التحليلات.
- إضافة كاليفورنيا 10 مل من الماء عالى النقاء إلى الدورق.
- تجانس الخليط لمدة 5 دقائق في 12000 دورة في الدقيقة مع الخالط مجهزة رمح القياسية والمولد.
- أجهزة الطرد المركزي الخليط المتجانس لمدة 10 دقيقة في 3000 دورة في الدقيقة (2000 × ز).
- جمع الرشاحة عن طريق الترشيح فراغ العينة طرد باستخدام ورق الترشيح 5B.
- كرر 3،6-3،9 الخطوات مرتين على الالبريد الترشيح بقايا لجمع كل السكريات والأحماض العضوية، والجمع بين كل الرواشح.
- قياس درجة الحموضة في الترشيح وتعديله إلى 7 مع حمض الهيدروكلوريك المخفف (0.1 و 0.01 مول L -1) وتمييع المحاليل المائية من هيدروكسيد الصوديوم (0.1 و 0.01 مول L -1).
- تمييع الترشيح إلى 50 مل مع الماء عالى النقاء.
- تقسيم العينة إلى مجموعتين. واحدة لتحليل السكريات والآخر لتحليل الأحماض العضوية.
- تمرير الحل الأول عينة من خلال أعمدة (اثنان C18، CM وهيئة متاحف قطر) في سلسلة متصلة إلى استبعاد المواد الملونة والكاتيونات والأنيونات. نرمي 1 مل الأولى من الحل عينة من الأعمدة. ثم استخدم محلول العينة من الأعمدة لتحليل السكريات بواسطة HPLC.
- تمرير محلول العينة الثانية من خلال الأعمدة (اثنان C18 وCM) في سلسلة متصلة إلى استبعاد أصباغ والكاتيونات. نرمي 1 مل الأولى من الحل عينة من الأعمدة. ثم استخدم محلول العينة من جolumns لتحليل الأحماض العضوية من قبل HPLC.
- أجهزة الطرد المركزي كل حل من الخطوات 3.14 و 3.15 في 6600 دورة في الدقيقة (5800 × ز) لمدة 10 دقيقة في microtube مجهزة 0.45 ميكرون فلتر مع جهاز طرد مركزي مصغرة قبل التحليل من قبل HPLC.
4. قياسات HPLC من السكريات
ملاحظة: في هذه الدراسة، يعتبر محتوى مبلغ من السكروز والجلوكوز والفركتوز من كل عنبية كما المحتوى الكلي السكر. لذلك، يتم الحصول على منحنى العمل لكل من ثلاثة سكريات أولا، ثم يتم الحصول على محتوى مجموع السكريات في كل توت. يتم الإبلاغ عن محتويات القياسية كما 0.3-0.4٪ بالوزن (السكروز)، 3،8-4،8٪ بالوزن (الجلوكوز)، و4،2-5،3٪ بالوزن (سكر الفواكه). 9
- قياس حوالي 200 ملغ من السكروز بدقة، وحله في 50 مل من الماء عالى النقاء لإعداد محلول قياسي. تمييع 5 مل من محلول إلى 50 مل مع الماء عالى النقاء لإعداد الحلول القياسية الثانية. إعداد بالمثل الموقف الثالثحل ARD من الحل المعيار الثاني.
- إعداد الحلول القياسية من الجلوكوز والفركتوز، وعلى نحو مماثل.
- ترتيب نظام HPLC على النحو التالي:
- استخدام عمود تغلغل الجل في الفرن العمود عند 40 درجة مئوية.
- استخدام الماء عالى النقاء نزع الغاز مع معدل تدفق 0.1 مل / دقيقة كما شطافة.
- استخدام جهاز الكشف عن معامل الانكسار.
- قياس الطيفية HPLC من الحلول القياسية عن طريق حقن قسامة 20 ميكرولتر لكل قياس. ملاحظة: وهنا يستخدم PAC الحل كبرنامج للقياس.
- الحصول على شدة المجال من عصابة من السكر على اللوني من كل حل القياسي بالنقر على "إعادة تحليل" مع الزر الأيمن من الفأرة.
- رسم شدة المجال أمام تركيزات المقابلة للحصول على منحنى العمل لكل السكر من الانحدار الخطي، حيث يتم الحصول على المعادلة التي تمثل العلاقة بين شدة المجال والتركيز FOص كل السكر.
- قياس الطيفية HPLC حلول عينة عن طريق حقن قسامة 20 ميكرولتر لكل قياس.
- الحصول على شدة المجال لعصابات من السكريات على اللوني من كل محلول العينة كما هو موضح سابقا في الخطوة 4.5.
- الحصول على تركيزات السكريات في الحلول باستخدام المعادلات المقابلة لمنحنيات العمل حصلت عليه في الخطوة 4.6.
- الحصول على كمية من كل السكر في كل عنبية من تركيزات محلول العينة التي تم الحصول عليها في الخطوة السابقة والحجم الكلي للمحلول العينة (50 مل، راجع الخطوة 3.12).
- الحصول على مجموع المبالغ السكر من كل فاكهة من خلال تلخيص محتويات ثلاثة سكريات.
- الحصول على المئة محتوى السكر الكلي لكل من العنبية باستخدام الوزن يقاس في الخطوة 1.3.
5. قياسات HPLC من الأحماض العضوية
ملاحظة: في هذه الدراسة، والمحتوى مجموع حمض الستريك وحمض الكينيك، الماليكتعتبر حامض، وحامض السكسينيك كما المحتوى الكلي لمجموع الأحماض العضوية. لذلك، يتم الحصول على منحنى العمل لكل من أربعة الأحماض العضوية أولا، ثم يتم قياس محتوى حمض عضوي في كل توت. يتم الإبلاغ عن محتويات القياسية كما 0،42-0،62٪ بالوزن (حمض الستريك)، 0-،15٪ بالوزن (حمض الكينيك)، 0،08-0،23٪ بالوزن (حمض الماليك)، و0،06-0،25٪ بالوزن (حمض السكسينيك). 9
- قياس حوالي 5 ملغ من حامض الستريك بدقة، وحله في 50 مل من الماء عالى النقاء لإعداد محلول قياسي. تمييع 5 مل من محلول إلى 50 مل مع الماء عالى النقاء لإعداد الحلول القياسية الثانية. إعداد بالمثل الحل القياسي الثالث من حل المعيار الثاني.
- إعداد الحلول القياسية من حمض الكينيك، حمض الماليك، وحمض السكسينيك، على نحو مماثل.
- ترتيب نظام HPLC على النحو التالي:
- استخدام عمودين أنيون الصرف في سلسلة متصلة في الفرن العمود عند 40 درجة مئوية.
- استخدام نزع الغاز محلول مائي 0.1٪ من الفوسفوريكحمض مع معدل التدفق من 0.02 مل / دقيقة كما شطافة.
- استخدام مجموعة كاشف الأشعة فوق البنفسجية مرئية في 210 نانومتر.
- قياس الطيفية HPLC من الحلول القياسية عن طريق حقن قسامة 20 ميكرولتر من محلول قياسي لكل قياس.
- الحصول على شدة المجال من عصابة من الأحماض العضوية على اللوني من كل حل القياسي بالنقر على "إعادة تحليل" مع الزر الأيمن من الفأرة.
- رسم شدة المجال أمام تركيزات المقابلة للحصول على منحنى العمل لكل الأحماض العضوية من قبل الانحدار الخطي، حيث يتم الحصول على المعادلة التي تمثل العلاقة بين شدة المجال والتركيز على كل الأحماض العضوية.
- قياس الطيفية HPLC حلول عينة عن طريق حقن قسامة 20 ميكرولتر من العينة لكل قياس.
- الحصول على شدة المجال لعصابات من الأحماض العضوية على اللوني من كل محلول العينة كما هو موضح سابقا في الخطوة 5.5.
- الحصول على تركيزات من الأحماض العضوية في الحلول باستخدام المعادلات المقابلة لمنحنيات العمل حصلت عليه في الخطوة 5.6.
- الحصول على كمية من كل الأحماض العضوية في كل عنبية من تركيزات محلول العينة التي تم الحصول عليها في الخطوة السابقة والحجم الكلي للمحلول العينة (50 مل، راجع الخطوة 3.12).
- الحصول على كمية من الحمض العضوي الكلي في كل عنبية من خلال تلخيص محتويات الأحماض العضوية الأربعة.
- الحصول على نسبة المحتوى من حمض عضوي الإجمالي لكل العنبية باستخدام الوزن يقاس في الخطوة 1.3.
6. المعالجة المسبقة لقياسات HPLC من الانثوسيانين
- الحفاظ على التوت في الثلاجة أقل من -80 ° C جاهزة للالتحاليل الكيميائية إذا لم يتم تحليلها بعد القياسات الطيفية.
- تجف كل الفاكهة المجمدة مع مجفاد فراغ لمدة 12 ساعة.
- استخراج الأنثوسيانين من العنبية المجففة في 1٪ من محلول الميثانول سو حمض trifluoroacetic [وزن العنبية (ز) / حجم محلول (مل) = 1/10] من خلال ترك الخليط في الثلاجة عند 4 درجة مئوية لمدة 12 ساعة.
- أجهزة الطرد المركزي في استخراج لمدة 15 دقيقة في microtube 2 مل باستخدام نابذة في -8 ° C و 15،000 دورة في الدقيقة (21،900 × ز).
- تصفية استخراج من خلال مرشح 0.45 ميكرون للحصول على عينة لقياسات HPLC.
7. قياسات HPLC من الانثوسيانين
ملاحظة: تم تضمينها حوالي 13 الانثوسيانين النوع في العنب البري. وبما أنه من الصعب الحصول على منحنيات العمل لجميع الانثوسيانين، منحنى العمل فقط سيانيدين-3- كلوريد يا -glucoside، واحدة من الانثوسيانين الأكثر شعبية في العنب البري، ويتم الحصول على. يتم تطبيق منحنى العمل من أجل التحديد الكمي التقريبية من الانثوسيانين أخرى.
- قياس حوالي 1.5 ملغ من سيانيدين-3- يا كلوريد -glucoside بدقة، وحله في 10 مل من محلول 1٪ الميثانول من حمض trifluoroacetic إلى العلاقات العامةepare حل القياسية. تمييع 5 مل من محلول إلى 10 مل مع 1٪ محلول الميثانول من حمض trifluoroacetic لإعداد الحلول القياسية الثانية. وبالمثل، وإعداد الثالث والحلول القياسية الرابع على التوالي.
- ترتيب نظام HPLC على النحو التالي:
- استخدام عمود عكس المرحلة C18 في فرن العمود عند 40 درجة مئوية.
- تطبيق طريقة التدرج باستخدام eluates من 0.1٪ حمض trifluoroacetic مائي (أزل أ) وحمض trifluoroacetic 0.5٪ في الأسيتونتريل (أزل ب) مع معدل تدفق 0.1 مل / دقيقة، حيث بلغت نسبة الزيادة أزل B من 8٪ إلى 15٪ خلال 0-50 دقائق بعد الحقن، ومن 15٪ إلى 75٪ خلال 50-60 دقيقة بعد الحقن.
- استخدام الضوئي مجموعة مراقبة للكشف على 520 نانومتر.
- قياس الطيفية HPLC من الحلول القياسية عن طريق حقن قسامة 10 ميكرولتر لكل قياس. يستخدم "الحل LC" كبرنامج للقياس.
- الحصول على شدة المجال من عصابة منسيانيدين-3- يا -glucoside كلوريد على اللوني من كل حل القياسي بالنقر على "إعادة تحليل" مع الزر الأيمن من الفأرة.
- رسم شدة المجال أمام تركيزات المقابلة للحصول على منحنى العمل لسيانيدين-3- كلوريد يا -glucoside من الانحدار الخطي، حيث يتم الحصول على المعادلة التي تمثل العلاقة بين شدة المجال والتركيز على سيانيدين-3- كلوريد يا -glucoside.
- قياس الطيفية HPLC حلول عينة عن طريق حقن قسامة 10 ميكرولتر لكل قياس.
- الحصول على شدة المجال من الفرقة من كل الأنثوسيانين على اللوني من كل محلول العينة كما هو موضح سابقا في الخطوة 7.4.
- الحصول على تركيزات من الانثوسيانين في الحلول باستخدام المعادلة المقابلة لمنحنى العمل حصلت عليه في الخطوة 7.5.
- الحصول على مبالغ من كل الأنثوسيانين في كل عنبية من تركيز حصلت في السابقخطوة والحجم الكلي للمحلول العينة المستخدمة في الخطوة 6.3.
- الحصول على المبلغ الإجمالي للالأنثوسيانين في كل عنبية من خلال تلخيص محتويات ثلاثة عشر الانثوسيانين.
- الحصول على المئة مضمون الأنثوسيانين الإجمالي لكل العنبية باستخدام الوزن يقاس في الخطوة 1.3.
8. بناء نماذج معايرة للتنبؤ مكونات المحتويات
ملاحظة: الثابتة والمتنقلة الانحدار، 4،5 والذي هو نوع من أسلوب الانحدار المتعدد باستخدام المتغيرات الكامنة، ويستخدم لبناء نماذج المعايرة لكل عنصر من احظ الأطياف ومحتويات عنصر يحددها التحاليل الكيميائية. PLS يتم تنفيذ الانحدار إما مع البرامج التجارية أو مع برامج محلية الصنع. انظر المراجع 5،10 لعمليات مفصلة لبناء نماذج.
- دراسة التي المعالجة المسبقة للالأطياف المرصودة هي الأكثر فعالية لدقيقة وتنبؤ قوي.
- بناء نماذج المعايرة من خلال تطبيق واحد أو اثنين من المعالجة المسبقة التالية: لجنة السلامة البحرية (المضاعف مبعثر تصحيح)، 1،2،5 ستارت (مستوى عادي VARIATE)، 1،2،5 MMN (مين ماكس التطبيع)، COE (ثابت إزاحة القضاء )، وأول أو حساب المشتقة الثانية من سان جرمان (Savitzky-غولي) الأسلوب. 1،2،5 التنبؤ محتويات المكون من التحقق من صحة تعيينها من أطيافها مع النماذج التي شيدت.
ملاحظة: في MMN، طائفة هو تطبيع بحيث الحد الأدنى والحد الأقصى للقيم تصبح 0 و 1 على التوالي. في COE، يتم إزاحة تنسيق لطيف بحيث يصبح الحد الأدنى لقيمة الصفر. - حساب معامل التحديد، R 2، والانحراف التنبؤي المتبقية، RPD، بين لوحظ وتوقع قيم التحقق من صحة المقرر أن دراسة التي المعالجة المسبقة للالأطياف المرصودة هي الأكثر فعالية. اختيار مزيج من المعالجة المسبقة إعطاء أكبرR 2 وRPD.
- بناء نماذج المعايرة من خلال تطبيق واحد أو اثنين من المعالجة المسبقة التالية: لجنة السلامة البحرية (المضاعف مبعثر تصحيح)، 1،2،5 ستارت (مستوى عادي VARIATE)، 1،2،5 MMN (مين ماكس التطبيع)، COE (ثابت إزاحة القضاء )، وأول أو حساب المشتقة الثانية من سان جرمان (Savitzky-غولي) الأسلوب. 1،2،5 التنبؤ محتويات المكون من التحقق من صحة تعيينها من أطيافها مع النماذج التي شيدت.
- فحص الذي المناطق متجه مموج موجه فعالة للتنبؤ الدقيق والقوي من خلال تطبيق، على سبيل المثال، والانتقال النوافذ PLS تقنية 11 للبحث في مناطق فعالة.
ملاحظة: الإجراء يتوافق مع إزالة المناطق متجه مموج موجه حيث تحتوي على أطياف أي معلومات فعالة للتنبؤات أو تحتوي على المعلومات التي تتعارض مع التوقعات.
9. التحقق من نماذج معايرة شيدت
ملاحظة: انظر المراجع 5،10 لعمليات مفصلة من صلاحية النماذج المبنية.
- التنبؤ محتويات المقومات من التحقق من صحة تعيينها من أطيافها مع نماذج المعايرة التي شيدت مع أفضل مزيج من المعالجة المسبقة وللمناطق متجه مموج موجه فعالة للتنبؤ. 5،10
- حساب R 2 وRPD بين الملحوظ والمتوقعقيم مجموعة التحقق من الصحة. 5،10
- دراسة ما إذا كانت المعايير العامة لأداء العملي لنماذج المعايرة، 12،13 R 2> 0.85 وRPD> 2.5، راضون. النظر في إعادة بناء نموذج إذا كانت معايير ليست راضية.
النتائج
ويوضح الشكل 2 كمثال مجموعة من قوائم الجرد الوطنية امتصاص الأطياف من العنب البري حيث يتم عرض أطياف من 70 التوت في وقت واحد. منذ لا يتم ملاحظة الفرق بالتأكيد احالة على السكريات والأحماض العضوية، أو الانثوسيانين في أطياف الجرد الوطني والقانون ?...
Discussion
وصفت بعض تعليقات إضافية على بروتوكول هنا. أولا، في خطوة 1.1، ذكر ذلك لتحديد الأصناف المدرجة في الهدف. على الرغم من أنه من الممكن لبناء نماذج تغطي العنب من العديد من أصناف أو دون تحديد الأصناف، ودقتها التنبؤ مع النماذج في بعض الأحيان أقل بكثير من أولئك الذين لديهم نماذج ...
Disclosures
We have nothing to disclose.
Acknowledgements
This work was partially supported by the project "A Scheme to Revitalize Agriculture and Fisheries in Disaster Area through Deploying Highly Advanced Technology" of Ministry of Agriculture, Forestry and Fisheries, Japan.
Materials
| Name | Company | Catalog Number | Comments |
| FT-NIR spectrophotometer | Bruker Optics GmbH | MPA | |
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45000-31, 228-45018-31 | For sugar analysis |
| 223-04500-31, 228-45010-31, 228-45095-31 | Refractive Index Detector | ||
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45003-31, 228-45000-31 | For organic acid analysis |
| 228-45018-31, 228-45010-31, 223-04500-31 | Ultraviolet-Visible Detector | ||
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45018-31, 228-45000-31 | For anthocyanin analysis |
| 228-45012-31, 228-45119-31, 228-45005-31 | Photodiode Array Detector | ||
| 228-45009-31 | |||
| pH meter | Mettler-Toledo | 30019028 | S220, Automatic temperature compensation |
| Ultra-pure water treatment equipment | ORGANO Corporation | ORG-ULXXXM1; PRA-0015-0V0 | PURELAB ultra; PURELITE |
| Biomedical Freezers | SANYO | 2-6780-01 | MDF-U338 |
| Ultra-Low Temperature Freezer | Panasonic healthcare Co.,Ltd. | KM-DU73Y1 | -80 °C |
| Vacuum lyophilizer | IWAKI GLASS Co.,Ltd | 119770 | DRC-3L; FRD-82M |
| Homoginizer | Microtec Co., Ltd. | Physcotron | |
| Ultracentrifuge | Hitachi Koki Co.,Ltd | S204567 | CF15RXII |
| Mini-centrifuge | LMS CO.,LTD. | KN3136572 | MCF-2360 |
| Centrifuge | Kokusan Co.,Ltd | 2-5534-01 | H-103N |
| Filter Paper | Advantec | 1521070 | 5B, Eqivalent to Whatman 40 |
| Sep-Pak C18 column | Waters Corporation Milford | WAT020515 | |
| Sep-Pak CM column | Waters Corporation Milford | WAT020550 | |
| Sep-Pak QMA column | Waters Corporation Milford | WAT020545 | |
| Centrifugal Filter Unit | Merck Millipore Corporation | R2SA18503 | PVDF, 0.45 μm |
| Microtube | As One Corporation | 1-1600-02 | PP, 2 ml |
| Syringe Filter | GE Healthcare CO.,LTD. | 6788-1304 | PP, 0.45 μm |
| Sucrose | Wako Pure Chemical Industries,Ltd | 194-00011 | Reagent-grade |
| Glucose | Wako Pure Chemical Industries,Ltd | 049-31165 | Reagent-grade |
| Fructose | Wako Pure Chemical Industries,Ltd | 123-02762 | Reagent-grade |
| Citric acid | Wako Pure Chemical Industries,Ltd | 036-05522 | Reagent-grade |
| Malic acid | Wako Pure Chemical Industries,Ltd | 355-17971 | Reagent-grade |
| Succinic acid | Wako Pure Chemical Industries,Ltd | 190-04332 | Reagent-grade |
| Quinic acid | Alfa Aesar, A Johnson Matthey Company | 10176328 | Reagent-grade |
| Phosphoric acid | Wako Pure Chemical Industries,Ltd | 162-20492 | HPLC-grade |
| Trifluoroacetic acid | Wako Pure Chemical Industries,Ltd | 208-02746 | Reagent-grade |
| Methanol | Wako Pure Chemical Industries,Ltd | 131-01826 | Reagent-grade |
| Acetonitrile | Wako Pure Chemical Industries,Ltd | 015-08633 | HPLC-grade |
| Grade cyanidin-3-O-glucoside chloride | Wako Pure Chemical Industries,Ltd | 306-37661 | HPLC-grade |
| Software for analyses | Bruker Optics GmbH | OPUS ver. 6.5 | |
| Softoware for preprocessing | Microsoft | Excel powered by Visual Basic for Applications | |
| Software for construction of models | Freemat 4.0 | http://freemat.sourceforge.net/ |
References
- Ozaki, Y., McClure, W. F., Christy, A. A. . Near-infrared Spectroscopy in Food Science and Technology. , (2007).
- Sun, D. W. . Infrared Spectroscopy for Food Quality Analysis and Control. , (2009).
- Bai, W., Yoshimura, N., Takayanagi, M. Quantitative analysis of ingredients of blueberry fruits by near infrared spectroscopy. J. Near Infrared Spectrosc. 22, 357-365 (2014).
- Hasegawa, T., Tasumi, M. . Chemometrics in infrared spectroscopic analysis. In: Introduction to Experimental Infrared Spectroscopy. , 97-113 (2015).
- Varmuza, K., Filzmoser, P. . Introduction to Multivariate Statistical Analysis in Chemometrics. , (2009).
- Kubelka, P. New contributions to the optics of intensely light-scattering materials. Part I. J. Opt. Soc. Am. 38, 448-457 (1948).
- Juang, R. H., Storey, D. E. Quantitative determination of the extent of neutralization of carboxylic acid functionality in carbopol 974P NF by diffuse reflectance fourier transform infrared spectrometry using Kubelka-Munk function. Pharm Res. 15, 1714-1720 (1998).
- Ogiwara, I., Ohtsuka, Y., Yoneda, Y., Sakurai, K., Hakoda, N., Shimura, I. Extraction method by water followed by microwave heating for analyzing sugars in strawberry fruits. J. Jpn. Soc. Hort. Sci. 68, 949-953 (1999).
- Che, J., Suzuki, S., Ishikawa, S., Koike, H., Ogiwara, I. Fruit ripening and quality profile of 64 cultivars in three species of blueberries grown in Tokyo. Hort. Res. (Japan). 8, 257-265 (2009).
- Pomerantsev, A. L. . Chemometrics in Excel. , (2014).
- Jiang, H. J., Berry, R. J., Siesler, H. W., Ozaki, Y. Wavelength Interval Selection in Multicomponent spectral analysis by moving window partial least-squares regression with applications to mid-infrared and near-infrared spectroscopic data. Anal. Chem. 74, 3555-3565 (2002).
- Edney, M. J., Morgan, J. E., Williams, P. C., Campbell, L. D. Analysis of feed barley by near infrared reflectance spectroscopy. J. Near-Infrared Spectrosc. 2, 33-41 (1994).
- Mathison, G. W., et al. Prediction of composition and ruminal degradability characteristics of barley straw by near infrared reflectance spectroscopy. Can. J. Anim. Sci. 79, 519-523 (1999).
- Chiara, F., et al. Analysis of anthocyanins in commercial fruit juices by using nano-liquid chromatography electrospray-mass spectrometry and high performance liquid chromatography with UV-vis detector. J. Separation Sci. 34, 150-159 (2011).
- Li, Q., et al. Antioxidant anthocyanins screening through spectrum-effect relationships and DPPH-HPLC-DAD analysis on nine cultivars of introduced rabbiteye blueberry in China. Food Chemistry. 132, 759-765 (2013).
- Sinelli, N. Evaluation of quality and nutraceutical content of blueberries (Vaccinium corymbosum L.) by near and mid-infrared spectroscopy. Postharvest Biol. Technol. 50, 31-36 (2008).
- Giusti, M. M., Wrolsted, R. E., Wrolstad, R. E., Schwartz, S. J. Anthocyanins: characterization and measurement with UV-visible spectroscopy. Current Protocols in Food Analytical Chemistry. , 1-13 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved