Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Construction de modèles de prédiction non destructive des matières Ingrédient en Blueberries par spectroscopie proche infrarouge basée sur des mesures de CLHP
Dans cet article
Résumé
We present here a protocol to construct and validate models for nondestructive prediction of total sugar, total organic acid, and total anthocyanin content in individual blueberries by near-infrared spectroscopy.
Résumé
Nondestructive prediction of ingredient contents of farm products is useful to ship and sell the products with guaranteed qualities. Here, near-infrared spectroscopy is used to predict nondestructively total sugar, total organic acid, and total anthocyanin content in each blueberry. The technique is expected to enable the selection of only delicious blueberries from all harvested ones. The near-infrared absorption spectra of blueberries are measured with the diffuse reflectance mode at the positions not on the calyx. The ingredient contents of a blueberry determined by high-performance liquid chromatography are used to construct models to predict the ingredient contents from observed spectra. Partial least squares regression is used for the construction of the models. It is necessary to properly select the pretreatments for the observed spectra and the wavelength regions of the spectra used for analyses. Validations are necessary for the constructed models to confirm that the ingredient contents are predicted with practical accuracies. Here we present a protocol to construct and validate the models for nondestructive prediction of ingredient contents in blueberries by near-infrared spectroscopy.
Introduction
Proche infrarouge (NIR) est largement appliquée comme une technique non destructive pour analyser le contenu de fruits et légumes de toutes sortes. 1,2 Nondestructive analyse par spectroscopie NIR permettre à l'expédition de seulement délicieux fruits et légumes avec des qualités garanties. La spectroscopie NIR a déjà été appliquée à l'orange, pomme, melon, cerise, kiwi, mangue, papaye, pêche et ainsi de suite pour connaître leur Brix qui correspond à la teneur totale en sucre, acidité, TSC (solides totaux contenus), et ainsi de suite . Récemment, nous avons signalé l'application de la spectroscopie NIR à l'évaluation de la qualité des bleuets. 3 Nous mesurée non seulement la teneur totale en sucre et la teneur totale en acide organique correspondant à l' acidité, mais aussi la teneur en anthocyanes totale. L'anthocyanine est un composant bioactif qui est censé améliorer la santé humaine. Il est commode pour les consommateurs s'ils peuvent acheter de délicieux bleuets avec une assurance de leur teneur en sucre, acidité et teneur en anthocyanes.
Dans les spectres d'absorption NIR de fruits et légumes, seules des bandes d'absorption larges sont observés. Ils sont principalement les bandes dues à la fibre et de l'humidité. Bien que de nombreuses bandes faibles en raison de divers ingrédients de la cible non-destructed sont observées en même temps, les bandes observées ne peuvent pas être attribués à des modes vibratoires spécifiques des composants spécifiques de la cible dans la plupart des cas. Par conséquent, la technique traditionnelle pour déterminer la teneur d'un composant spécifique en utilisant la loi de Beer-Lambert est pas efficace pour les spectres NIR. Au lieu de cela, des modèles d'étalonnage pour prédire la teneur des composants à partir des spectres observés cibles sont construits à l' aide de la chimiométrie , en examinant la corrélation entre les spectres observés et le contenu de l' ingrédient correspondant aux spectres 4,5. Ici, un protocole de construire et de valider les modèles pour la prédiction de la teneur totale en sucre, teneur totale en acide organique correspondant à Acidity, et la teneur en anthocyanes totale de bleuets de spectres NIR est présenté.
La figure 1 montre l'organigramme général pour construire des modèles d'étalonnage fiables et robustes. Des échantillons de nombre suffisant sont collectés. Certains d'entre eux sont utilisés pour la construction de modèles, tandis que les autres sont utilisés pour la validation des modèles construits. Pour chacun des échantillons prélevés, un spectre proche infrarouge est mesurée, et ensuite les composants cibles sont analysés quantitativement par des méthodes d'analyse chimique destructive traditionnelles. Ici, la chromatographie liquide à haute performance (HPLC) est utilisée pour les analyses chimiques des sucres, des acides organiques et des anthocyanines. Moindres carrés partiels (PLS) regression est utilisé pour la construction de modèles d'étalonnage, où la corrélation entre les spectres observés et les teneurs en ingrédients déterminée par des analyses chimiques est examinée. Afin de construire des modèles robustes avec la meilleure capacité de prédiction, les prétraitements de obserLes spectres vés et les régions de longueurs d'onde utilisées pour la prédiction sont également examinés. Enfin, les modèles construits sont validés pour confirmer leur capacité de prédiction suffisante. La validation, le contenu prédit à partir du spectre observé par le modèle de construction (valeurs prédites) sont comparées aux teneurs déterminées par les analyses chimiques (valeurs observées). Si la corrélation suffisante ne peut pas être trouvé entre les valeurs prédites et observées, le modèle d'étalonnage doit être à nouveau réalisée jusqu'à ce que la corrélation suffisante soit obtenue. Bien qu'il soit préférable d'utiliser différents groupes d'échantillons pour la construction et la validation d'un modèle, comme indiqué sur cette figure (de validation externe), les échantillons d'un même groupe sont utilisés aussi bien pour la construction et la validation (validation croisée) lorsque le nombre d' échantillons ne sont pas assez grand.
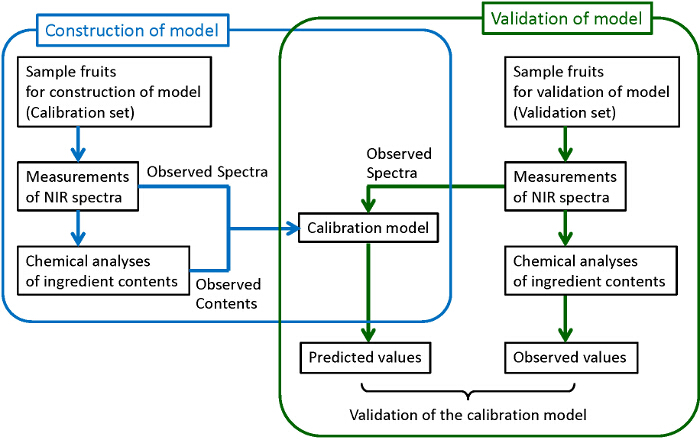
Figure 1. Diagramme pour la construction et la validation du modèle d'étalonnage. Les procédures entourées par des lignes bleues et vertes correspondent, respectivement, à la construction d'un modèle d'étalonnage et sa validation. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Protocole
1. Prélèvement des échantillons
- Décidez quels cultivars seront inclus dans la cible du modèle d'étalonnage.
- Collecter nombre suffisant et divers types de bleuets échantillons des cultivars cibles.
- Recueillir de préférence 100 bleuets pour la construction du modèle d'étalonnage, et au moins 10 pour la validation du modèle construit. Afin de construire des modèles robustes, prélever des échantillons de divers types, soit avec différentes couleurs, tailles, et à diverses conditions de maturation.
- Peser chaque bleuet. Remarque: les poids mesurés sont utilisés ultérieurement pour le calcul de la teneur pour cent des ingrédients de chaque bleuet.
2. Les mesures des spectres
- Warm-up spectrophotomètre suffisamment (plus de 1 h) avant que les mesures pour obtenir des spectres fiables.
- Réglez le spectrophotomètre. Assurez-vous que les conditions sont constantes tout au long des mesures. Unexemple de conditions typiques pour la mesure est donnée ci-dessous.
- Définissez la plage de mesures à 12,500-3,600 cm -1.
- Réglez la résolution spectrale de 16 cm -1.
- Réglez l'accumulation à 32 fois.
- Sélectionner réflectance diffuse comme mode de mesure.
- Placez le réflecteur standard sur la fenêtre du spectrophotomètre pour les mesures de réflectance diffuse. En utilisant le "canal unique de fond" de commande, mesurer le spectre de fond qui est automatiquement utilisé pour le calcul des spectres de réflectance par rapport à partir des spectres de bleuets de l'échantillon mesuré plus tard.
- Mettez un échantillon de bleuets dans le centre de la fenêtre du spectrophotomètre pour les mesures de réflectance diffuse. En utilisant la commande "canal échantillon unique», de mesurer les spectres de chaque myrtille de préférence à plusieurs points du fruit.
Remarque: Kubelka-Munk transformation 6,7 sera également effectuée automatiquement pour les spectres observés de bleuets de l'échantillon si la condition d'acquisition spectrale est définie pour le faire. la transformation de Kubelka-Munk modifie les spectres mesurés en mode de réflexion diffuse aux spectres équivalentes à celles mesurées dans le mode de transmission et qui est nécessaire pour l'analyse des spectres avec une grande précision. Spectra à l'échelle d'absorbance sont utilisés pour les analyses. - Calculer le spectre moyen du spectre de chaque échantillon à l'aide d'un programme de traitement de données tel que MS Excel si les spectres d'un échantillon de bleuet sont mesurées en plusieurs points. Utilisez le spectre en moyenne pour les analyses.
3. Prétraitement pour les mesures de CLHP de sucres et d' acides organiques 8
Remarque: extraire les sucres et les acides organiques de chaque bleuet, qui sont solubles dans l'eau, avec de l'eau ultra-pure de la manière suivante. L'ensemble de chaque bleuet est utilisé pour les analyses.
- Gardez les bleuets dans un congélateur en dessous de -30 ° C prêt foanalyse r chimique si elles ne sont pas analysées juste après les mesures spectrales.
- Couper un bleuet en plusieurs morceaux afin qu'il puisse être facilement homogénéisée dans les étapes suivantes. Couper la myrtille sans décongélation quand il est gelé.
- Mettez les morceaux dans un bêcher de 50 ml.
- Ajouter ca. 10 ml d'eau ultra-pure (eau distillée dont la conductivité électrique est inférieure à 0,1 pS / cm) dans le bêcher.
- Chauffer la myrtille de coupe dans l'eau ultrapure dans un four à micro-ondes pendant 20 secondes pour désactiver les enzymes qui pourraient décomposer les sucres pendant les analyses.
- Ajouter environ 10 ml d'eau ultra pure dans le bécher.
- Homogénéiser le mélange pendant 5 minutes à 12 000 tours par minute avec un homogénéisateur équipé d'un arbre standard et le générateur.
- Centrifuger le mélange homogénéisé pendant 10 minutes à 3000 tours par minute (2000 x g).
- Recueillir le filtrat par filtration sous vide de l'échantillon centrifugé en utilisant un filtre en papier 5B.
- Répétez les étapes 3.6-3.9 à deux reprises sur efiltration e résidu pour recueillir tous les sucres et les acides organiques, et de combiner tous les filtrats.
- Mesurer le pH du filtrat et de l' ajuster à 7 avec de l' acide chlorhydrique dilué (0,1 et 0,01 mol L -1) , et des solutions aqueuses diluées d'hydroxyde de sodium (0,1 et 0,01 mol L -1).
- On dilue le filtrat à 50 ml avec de l'eau ultrapure.
- Diviser l'échantillon en deux; une pour l'analyse des sucres et l'autre pour l'analyse des acides organiques.
- Passer la première solution d'échantillon à travers des colonnes (deux C18, CM, et AMQ) connectés en série afin d'exclure des pigments, des cations et des anions. Jeter les premiers 1 ml de la solution d'échantillon à partir des colonnes. Ensuite, utilisez la solution d'échantillon à partir des colonnes pour l'analyse des sucres par HPLC.
- Passer la seconde solution échantillon à travers des colonnes (deux CM) et C18 connectés en série pour éliminer les pigments et les cations. Jeter les premiers 1 ml de la solution d'échantillon à partir des colonnes. Ensuite, utilisez la solution de l'échantillon de la columns pour l'analyse des acides organiques par HPLC.
- Centrifuger chaque solution à partir des étapes 3,14 et 3,15 à 6.600 tours par minute (5,800 x g) pendant 10 min dans un micro-tube équipé d'un filtre de 0,45 pm avec une mini-centrifugeuse avant l'analyse par HPLC.
4. Les mesures HPLC des sucres
Remarque: Dans cette étude, la teneur en somme de saccharose, le glucose et le fructose de chaque myrtille est considérée comme la teneur totale en sucre. Par conséquent, la courbe de fonctionnement pour chacun des trois sucres est obtenu en premier, puis la teneur en somme des sucres dans chaque bleuet est obtenu. Le contenu standard sont rapportés comme 0,3 à 0,4% en poids (saccharose), 03.08 à 04.08% en poids (glucose) et 4,2 à 5,3% en poids (fructose). 9
- Mesurer environ 200 mg de saccharose avec précision, et le dissoudre dans 50 ml d'eau ultrapure pour préparer une solution standard. Diluer 5 ml de la solution à 50 ml avec de l'eau ultra pure pour préparer les solutions de deuxième standard. Préparer de manière similaire à la troisième positionsolution ard de la deuxième solution étalon.
- Préparer des solutions étalons de glucose et de fructose, de la même manière.
- Disposer le système HPLC comme suit:
- Utiliser une colonne de perméation de gel dans le four à colonne à 40 ° C.
- Utiliser de l'eau ultra pure dégazée avec le débit de 0,1 ml / min comme éluat d'écoulement.
- Utiliser un détecteur d'indice de réfraction.
- Mesurer les spectrogrammes CLHP des solutions étalons par injection d'une aliquote de 20 ul pour chaque mesure. Remarque: ici, le PAC est utilisée comme solution de logiciel pour la mesure.
- Obtenez l'intensité de la bande de sucre sur le chromatogramme de chaque solution standard de la zone en cliquant sur «ré-analyse» avec le bouton droit de la souris.
- Tracer les intensités de la zone contre les concentrations correspondantes pour obtenir la courbe de travail pour chaque sucre par la régression linéaire, où l'équation représentant la relation entre l'intensité de la zone et la concentration est obtenue for chaque sucre.
- Mesurer les spectrogrammes HPLC des solutions d'échantillon par injection d'une aliquote de 20 ul pour chaque mesure.
- Obtenir les intensités des bandes de sucres sur le chromatogramme de chaque solution d'échantillon de la zone, comme décrit précédemment à l'étape 4.5.
- Obtenir les concentrations des sucres dans les solutions en utilisant les équations correspondant aux courbes de fonctionnement obtenues à l'étape 4.6.
- Obtenir la quantité de chaque sucre dans chaque bleuet à partir des concentrations de la solution d'échantillon obtenue dans l'étape précédente, et le volume total de la solution d'échantillon (50 ml, voir l'étape 3.12).
- Obtenir les quantités totales de sucre de chaque fruit en additionnant le contenu des trois sucres.
- Obtenir le pour cent de la teneur en sucre totale de chaque bleuet en utilisant le poids mesuré à l'étape 1.3.
5. Mesures de CLHP d'acides organiques
Nota: Dans cette étude, la teneur en somme de l'acide citrique, l'acide quinique, l'acide maliquel'acide et l'acide succinique sont considérés comme la teneur totale en acide organique. Par conséquent, la courbe de travail pour chacun des quatre acides organiques, on obtient d'abord, puis la teneur en acide organique dans chaque myrtille est mesurée. Le contenu standard sont rapportés comme 0,42 à 0,62% en poids (acide citrique), de 0 à 0,15% en poids (acide quinique), 0,08 à 0,23% en poids (acide malique) et de 0,06-0,25% en poids (acide succinique). 9
- Mesurer environ 5 mg d'acide citrique avec précision, et le dissoudre dans 50 ml d'eau ultrapure pour préparer une solution standard. Diluer 5 ml de la solution à 50 ml avec de l'eau ultra pure pour préparer les solutions de deuxième standard. Préparer de même la troisième solution standard à partir de la deuxième solution étalon.
- Préparer les solutions étalons de l'acide quinique, l'acide malique et l'acide succinique, de la même manière.
- Disposer le système HPLC comme suit:
- Utiliser deux colonnes échangeuses d'anions connectés en série dans le four à colonne à 40 ° C.
- L'utilisation dégazé une solution aqueuse à 0,1% d'acide phosphoriqued'acide avec la vitesse de 0,02 ml / min comme éluat d'écoulement.
- Utilisez un détecteur de jeu ultraviolet-visible à 210 nm.
- Mesurer les spectrogrammes CLHP des solutions étalons par injection d'une aliquote de 20 ul de solution étalon pour chaque mesure.
- Obtenez l'intensité de la bande d'acide organique sur le chromatogramme de chaque solution standard de la zone en cliquant sur «ré-analyse» avec le bouton droit de la souris.
- Tracer les intensités de la zone par rapport aux concentrations correspondantes pour obtenir la courbe de travail pour chaque acide organique, par régression linéaire, lorsque l'équation représentant la relation entre l'intensité de la région, et la concentration est obtenue pour chaque acide organique.
- Mesurer les spectrogrammes HPLC des solutions d'échantillon par injection d'une aliquote de 20 ul de l'échantillon pour chaque mesure.
- Obtenir les intensités des bandes d'acides organiques sur le chromatogramme de chaque solution échantillon dans la région de la manière décrite précédemment dans l'étape 5.5.
- Obtenir les concentrations des acides organiques dans les solutions en utilisant les équations correspondant aux courbes de fonctionnement obtenues à l'étape 5.6.
- Obtenir la quantité de chaque acide organique dans chaque bleuet à partir des concentrations de la solution d'échantillon obtenue dans l'étape précédente, et le volume total de la solution d'échantillon (50 ml, voir l'étape 3.12).
- Obtenir la quantité d'acide organique total dans chaque bleuet en additionnant le contenu des quatre acides organiques.
- Obtenir le pour cent de teneur en acide organique total de chaque bleuet en utilisant le poids mesuré à l'étape 1.3.
6. Prétraitement pour les mesures de CLHP de anthocyanes
- Gardez les bleuets dans un congélateur en dessous de -80 ° C prêt pour analyses chimiques si elles ne sont pas analysées juste après les mesures spectrales.
- Sécher chaque fruit congelé avec un lyophilisateur sous vide pendant 12 heures.
- Extrait anthocyane du bleuet séché dans 1% de solution méthanolique of l'acide trifluoroacétique [en poids de myrtille (g) / volume de la solution (ml) = 10/01], en laissant le mélange dans un réfrigérateur à 4 ° C pendant 12 heures.
- Centrifuger l'extrait pendant 15 min dans un microtube de 2 ml en utilisant une ultracentrifugeuse à -8 ° C et 15 000 tpm (21.900 x g).
- Filtrez l'extrait à travers un filtre de 0,45 um pour obtenir l'échantillon pour les mesures de HPLC.
7. Mesures de CLHP de anthocyanes
Remarque: Environ 13 aimables anthocyanes sont inclus dans les bleuets. Comme il est difficile d'obtenir des courbes de travail pour tous les anthocyanines, une courbe de travail pour seulement cyanidine-3- chlorure O -glucoside, l' un des anthocyanines les plus populaires dans les bleuets, est obtenu. La courbe de travail est appliquée pour les quantifications approximatives d'autres anthocyanes.
- Mesurer environ 1,5 mg de cyanidine-3 - O -glucoside chlorure de précision, et le dissoudre dans 10 ml d' une solution de methanol à 1% d'acide trifluoroacétique à prepare une solution standard. Diluer 5 ml de la solution à 10 ml avec une solution de methanol à 1% d'acide trifluoroacétique pour préparer les secondes solutions standard. De même, préparer la troisième et de la quatrième solutions standard de manière séquentielle.
- Disposer le système HPLC comme suit:
- Utiliser une colonne en phase inverse C18 dans un four à colonne à 40 ° C.
- Appliquer la méthode du gradient en utilisant les éluats de 0,1% d'acide trifluoroacétique aqueux (éluent A) et de l'acide trifluoroacétique à 0,5% dans l'acétonitrile (éluent B) avec le débit d'écoulement de 0,1 ml / min, où le rapport de éluées B augmente de 8% à 15% pendant 0-50 minutes après l'injection, et de 15% à 75% pendant 50 à 60 minutes après l'injection.
- Utilisez un réseau de surveillance du détecteur de photodiode à 520 nm.
- Mesurer les spectrogrammes CLHP des solutions étalons par injection d'une aliquote de 10 ul pour chaque mesure. «Solution LC» est utilisé comme logiciel pour la mesure.
- Obtenez l'intensité de la bande de zonecyanidine-3- chlorure O -glucoside sur le chromatogramme de chaque solution standard en cliquant sur «re-analyse» avec le bouton droit de la souris.
- Tracer les intensités de la zone contre les concentrations correspondantes pour obtenir la courbe de travail pour cyanidine-3- chlorure O -glucoside par la régression linéaire, où l'équation représentant la relation entre l' intensité de la zone et la concentration est obtenue pour cyanidine-3- chlorure O -glucoside.
- Mesurer les spectrogrammes HPLC des solutions d'échantillon par injection d'une aliquote de 10 ul pour chaque mesure.
- Obtenez l'intensité de la bande de chaque anthocyane sur le chromatogramme de chaque solution d'échantillon de la zone comme décrit précédemment à l'étape 7.4.
- Obtenir les concentrations des anthocyanines dans les solutions à l'aide de l'équation correspondant à la courbe de travail obtenue à l'étape 7.5.
- Obtenir les quantités de chaque anthocyane dans chaque myrtille de la concentration obtenue dans la précédentel'étape et le volume total de la solution de l'échantillon utilisé dans l'étape 6.3.
- Obtenir le montant total des anthocyanes dans chaque bleuet en résumant le contenu des treize anthocyanes.
- Obtenir le pour cent de teneur en anthocyanine totale de chaque bleuet en utilisant le poids mesuré à l'étape 1.3.
8. Construction de modèles d'étalonnage pour la prévision des ingrédients Sommaire
Remarque: La régression PLS, le 4,5 qui est une sorte de technique de régression multiple en utilisant les variantes latentes, est utilisé pour la construction de modèles d'étalonnage pour chaque composant à partir des spectres observés et les teneurs des ingrédients déterminés par des analyses chimiques. La régression PLS est réalisée soit avec les programmes commerciaux ou avec les programmes faits maison. Voir les références 5,10 pour les processus détaillés de la construction de modèles.
- Examiner qui prétraitements pour les spectres observés sont les plus efficaces pour précis etprédiction robuste.
- Construire des modèles d'étalonnage en appliquant une ou deux des prétraitements suivants: MSC (multiplicatif Correction Scatter), 1,2,5 SNV (Standard normal Variate), 1,2,5 NMM (Min-Max Normaliser), COE (Constant élimination Offset ), et le premier ou le second calcul dérivé par SG méthode (Savitzky-Golay). 1,2,5 Prédire le contenu des ingrédients de la validation définir à partir de leurs spectres avec les modèles construits.
Note: Dans la NMM, un spectre est normalisée de telle sorte que les valeurs minimales et maximales seront 0 et 1, respectivement. Dans EOC, l'ordonnée d'un spectre est décalé de telle sorte que la valeur minimale devient égale à zéro. - Calculer le coefficient de détermination, R 2, et la déviation résiduelle prédictive, SPR, entre l'observé et les valeurs de l'ensemble de validation d'examiner quels prétraitements pour les spectres observés sont les plus efficaces prédit. Choisissez la combinaison de prétraitements donnant plusR 2 et SPR.
- Construire des modèles d'étalonnage en appliquant une ou deux des prétraitements suivants: MSC (multiplicatif Correction Scatter), 1,2,5 SNV (Standard normal Variate), 1,2,5 NMM (Min-Max Normaliser), COE (Constant élimination Offset ), et le premier ou le second calcul dérivé par SG méthode (Savitzky-Golay). 1,2,5 Prédire le contenu des ingrédients de la validation définir à partir de leurs spectres avec les modèles construits.
- Examiner quelles régions sont efficaces pour nombre d' onde la prédiction précise et robuste en appliquant, par exemple, se déplacent-fenêtres PLS technique 11 pour rechercher les régions efficaces.
Remarque: La procédure correspond à l'élimination des régions d'onde où les spectres ne contiennent pas d'information efficace pour les prévisions ou contiennent de l'information qui interfère avec les prédictions.
9. Validation des modèles d'étalonnage construits
Note: Voir les références 5,10 pour les processus détaillés de la validation des modèles construits.
- Prédire le contenu des ingrédients de la validation définir à partir de leurs spectres avec les modèles d'étalonnage construites avec la meilleure combinaison de prétraitements et pour les régions du nombre d'ondes efficaces pour la prédiction. 5,10
- Calculer R 2 et SPR entre l'observé et préditvaleurs de l'ensemble de validation. 5,10
- Examiner si les critères généraux pour l'exécution pratique des modèles d'étalonnage, 12,13 R 2> 0,85 et SPR> 2,5, sont satisfaits. Envisager la reconstruction du modèle si les critères ne sont pas satisfaits.
Résultats
La figure 2 montre à titre d'exemple un ensemble de spectres d'absorption NIR de bleuets où les spectres de 70 bleuets sont présentés simultanément. Depuis les bandes définitivement assignables à des sucres, des acides organiques, ou les anthocyanes ne sont pas observées dans les spectres NIR, la loi traditionnelle de Beer-Lambert est sans objet pour quantifier le contenu des ingrédients. Par conséquent, la construction de modèles pour la prédiction d...
Discussion
Quelques commentaires supplémentaires sur le protocole sont décrits ici. Tout d'abord, à l'étape 1.1, il est mentionné pour décider les cultivars inclus dans la cible. Bien qu'il soit possible de construire des modèles couvrant les bleuets de nombreux cultivars ou sans préciser les cultivars, les exactitudes de prédiction avec les modèles sont parfois bien inférieurs à ceux des modèles pour un seul cultivar et cultivars limités. Il convient également de noter que les modèles d'étalonnage...
Déclarations de divulgation
We have nothing to disclose.
Remerciements
This work was partially supported by the project "A Scheme to Revitalize Agriculture and Fisheries in Disaster Area through Deploying Highly Advanced Technology" of Ministry of Agriculture, Forestry and Fisheries, Japan.
matériels
| Name | Company | Catalog Number | Comments |
| FT-NIR spectrophotometer | Bruker Optics GmbH | MPA | |
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45000-31, 228-45018-31 | For sugar analysis |
| 223-04500-31, 228-45010-31, 228-45095-31 | Refractive Index Detector | ||
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45003-31, 228-45000-31 | For organic acid analysis |
| 228-45018-31, 228-45010-31, 223-04500-31 | Ultraviolet-Visible Detector | ||
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45018-31, 228-45000-31 | For anthocyanin analysis |
| 228-45012-31, 228-45119-31, 228-45005-31 | Photodiode Array Detector | ||
| 228-45009-31 | |||
| pH meter | Mettler-Toledo | 30019028 | S220, Automatic temperature compensation |
| Ultra-pure water treatment equipment | ORGANO Corporation | ORG-ULXXXM1; PRA-0015-0V0 | PURELAB ultra; PURELITE |
| Biomedical Freezers | SANYO | 2-6780-01 | MDF-U338 |
| Ultra-Low Temperature Freezer | Panasonic healthcare Co.,Ltd. | KM-DU73Y1 | -80 °C |
| Vacuum lyophilizer | IWAKI GLASS Co.,Ltd | 119770 | DRC-3L; FRD-82M |
| Homoginizer | Microtec Co., Ltd. | Physcotron | |
| Ultracentrifuge | Hitachi Koki Co.,Ltd | S204567 | CF15RXII |
| Mini-centrifuge | LMS CO.,LTD. | KN3136572 | MCF-2360 |
| Centrifuge | Kokusan Co.,Ltd | 2-5534-01 | H-103N |
| Filter Paper | Advantec | 1521070 | 5B, Eqivalent to Whatman 40 |
| Sep-Pak C18 column | Waters Corporation Milford | WAT020515 | |
| Sep-Pak CM column | Waters Corporation Milford | WAT020550 | |
| Sep-Pak QMA column | Waters Corporation Milford | WAT020545 | |
| Centrifugal Filter Unit | Merck Millipore Corporation | R2SA18503 | PVDF, 0.45 μm |
| Microtube | As One Corporation | 1-1600-02 | PP, 2 ml |
| Syringe Filter | GE Healthcare CO.,LTD. | 6788-1304 | PP, 0.45 μm |
| Sucrose | Wako Pure Chemical Industries,Ltd | 194-00011 | Reagent-grade |
| Glucose | Wako Pure Chemical Industries,Ltd | 049-31165 | Reagent-grade |
| Fructose | Wako Pure Chemical Industries,Ltd | 123-02762 | Reagent-grade |
| Citric acid | Wako Pure Chemical Industries,Ltd | 036-05522 | Reagent-grade |
| Malic acid | Wako Pure Chemical Industries,Ltd | 355-17971 | Reagent-grade |
| Succinic acid | Wako Pure Chemical Industries,Ltd | 190-04332 | Reagent-grade |
| Quinic acid | Alfa Aesar, A Johnson Matthey Company | 10176328 | Reagent-grade |
| Phosphoric acid | Wako Pure Chemical Industries,Ltd | 162-20492 | HPLC-grade |
| Trifluoroacetic acid | Wako Pure Chemical Industries,Ltd | 208-02746 | Reagent-grade |
| Methanol | Wako Pure Chemical Industries,Ltd | 131-01826 | Reagent-grade |
| Acetonitrile | Wako Pure Chemical Industries,Ltd | 015-08633 | HPLC-grade |
| Grade cyanidin-3-O-glucoside chloride | Wako Pure Chemical Industries,Ltd | 306-37661 | HPLC-grade |
| Software for analyses | Bruker Optics GmbH | OPUS ver. 6.5 | |
| Softoware for preprocessing | Microsoft | Excel powered by Visual Basic for Applications | |
| Software for construction of models | Freemat 4.0 | http://freemat.sourceforge.net/ |
Références
- Ozaki, Y., McClure, W. F., Christy, A. A. . Near-infrared Spectroscopy in Food Science and Technology. , (2007).
- Sun, D. W. . Infrared Spectroscopy for Food Quality Analysis and Control. , (2009).
- Bai, W., Yoshimura, N., Takayanagi, M. Quantitative analysis of ingredients of blueberry fruits by near infrared spectroscopy. J. Near Infrared Spectrosc. 22, 357-365 (2014).
- Hasegawa, T., Tasumi, M. . Chemometrics in infrared spectroscopic analysis. In: Introduction to Experimental Infrared Spectroscopy. , 97-113 (2015).
- Varmuza, K., Filzmoser, P. . Introduction to Multivariate Statistical Analysis in Chemometrics. , (2009).
- Kubelka, P. New contributions to the optics of intensely light-scattering materials. Part I. J. Opt. Soc. Am. 38, 448-457 (1948).
- Juang, R. H., Storey, D. E. Quantitative determination of the extent of neutralization of carboxylic acid functionality in carbopol 974P NF by diffuse reflectance fourier transform infrared spectrometry using Kubelka-Munk function. Pharm Res. 15, 1714-1720 (1998).
- Ogiwara, I., Ohtsuka, Y., Yoneda, Y., Sakurai, K., Hakoda, N., Shimura, I. Extraction method by water followed by microwave heating for analyzing sugars in strawberry fruits. J. Jpn. Soc. Hort. Sci. 68, 949-953 (1999).
- Che, J., Suzuki, S., Ishikawa, S., Koike, H., Ogiwara, I. Fruit ripening and quality profile of 64 cultivars in three species of blueberries grown in Tokyo. Hort. Res. (Japan). 8, 257-265 (2009).
- Pomerantsev, A. L. . Chemometrics in Excel. , (2014).
- Jiang, H. J., Berry, R. J., Siesler, H. W., Ozaki, Y. Wavelength Interval Selection in Multicomponent spectral analysis by moving window partial least-squares regression with applications to mid-infrared and near-infrared spectroscopic data. Anal. Chem. 74, 3555-3565 (2002).
- Edney, M. J., Morgan, J. E., Williams, P. C., Campbell, L. D. Analysis of feed barley by near infrared reflectance spectroscopy. J. Near-Infrared Spectrosc. 2, 33-41 (1994).
- Mathison, G. W., et al. Prediction of composition and ruminal degradability characteristics of barley straw by near infrared reflectance spectroscopy. Can. J. Anim. Sci. 79, 519-523 (1999).
- Chiara, F., et al. Analysis of anthocyanins in commercial fruit juices by using nano-liquid chromatography electrospray-mass spectrometry and high performance liquid chromatography with UV-vis detector. J. Separation Sci. 34, 150-159 (2011).
- Li, Q., et al. Antioxidant anthocyanins screening through spectrum-effect relationships and DPPH-HPLC-DAD analysis on nine cultivars of introduced rabbiteye blueberry in China. Food Chemistry. 132, 759-765 (2013).
- Sinelli, N. Evaluation of quality and nutraceutical content of blueberries (Vaccinium corymbosum L.) by near and mid-infrared spectroscopy. Postharvest Biol. Technol. 50, 31-36 (2008).
- Giusti, M. M., Wrolsted, R. E., Wrolstad, R. E., Schwartz, S. J. Anthocyanins: characterization and measurement with UV-visible spectroscopy. Current Protocols in Food Analytical Chemistry. , 1-13 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon