Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Der Bau der Modelle für die zerstörungsfreie Vorhersage von Ingredient Inhalt in Heidelbeeren durch Nahinfrarotspektroskopie Basierend auf HPLC-Messungen
In diesem Artikel
Zusammenfassung
We present here a protocol to construct and validate models for nondestructive prediction of total sugar, total organic acid, and total anthocyanin content in individual blueberries by near-infrared spectroscopy.
Zusammenfassung
Nondestructive prediction of ingredient contents of farm products is useful to ship and sell the products with guaranteed qualities. Here, near-infrared spectroscopy is used to predict nondestructively total sugar, total organic acid, and total anthocyanin content in each blueberry. The technique is expected to enable the selection of only delicious blueberries from all harvested ones. The near-infrared absorption spectra of blueberries are measured with the diffuse reflectance mode at the positions not on the calyx. The ingredient contents of a blueberry determined by high-performance liquid chromatography are used to construct models to predict the ingredient contents from observed spectra. Partial least squares regression is used for the construction of the models. It is necessary to properly select the pretreatments for the observed spectra and the wavelength regions of the spectra used for analyses. Validations are necessary for the constructed models to confirm that the ingredient contents are predicted with practical accuracies. Here we present a protocol to construct and validate the models for nondestructive prediction of ingredient contents in blueberries by near-infrared spectroscopy.
Einleitung
Nah-Infrarot (NIR) Spektroskopie ist weithin als eine nicht - destruktive Technik angewandt Inhalt von Obst und Gemüse verschiedener Art zu analysieren. 1,2 Zerstörungsfreie Analysen durch NIR - Spektroskopie , um die Lieferung von nur lecker Obst und Gemüse mit garantierten Eigenschaften ermöglichen. NIR-Spektroskopie wurde bereits nach orange angewendet wurde, Apfel, Melone, Kirsche, Kiwi, Mango, Papaya, Pfirsich und so auf ihrer Brix zu kennen, die auf den Gesamtzuckergehalt entspricht, Säure, TSC (Gesamtfeststoffgehalt), und so weiter . Vor kurzem haben wir die Anwendung der NIR - Spektroskopie zur Qualitätsbewertung von Heidelbeeren berichtet. 3 Wir messen nicht nur den Gesamtzuckergehalt und den Gesamtgehalt organischer Säure zu Säure entspricht, sondern auch die Gesamt Anthocyaningehalt. Anthocyan ist ein bioaktives Komponente, die geglaubt wird, die menschliche Gesundheit zu verbessern. Es ist bequemer für die Verbraucher, wenn sie leckeren Heidelbeeren mit der Versicherung ihrer Zuckergehalt kaufen können, acidity und Anthocyan-Gehalt.
In NIR-Absorptionsspektren von Obst und Gemüse, nur breite Absorptionsbanden beobachtet. Sie sind vor allem die Bänder aufgrund von Faser und Feuchtigkeit. Obwohl viele schwache Banden aufgrund verschiedener Bestandteile des nicht zerstörten Ziel gleichzeitig beobachtet werden, können die beobachteten Banden nicht auf bestimmte Schwingungsmoden bestimmter Komponenten des Ziels in den meisten Fällen zugewiesen werden. Daher ist die herkömmliche Technik, um den Gehalt einer bestimmten Komponente unter Verwendung des Lambert-Beer'schen Gesetz zu bestimmen, nicht für die NIR-Spektren wirksam. Stattdessen Kalibrationsmodelle die Inhalte der Zielkomponenten aus den beobachteten Spektren vorherzusagen , werden unter Verwendung der Chemometrie konstruiert , indem die Korrelation zwischen der beobachteten Spektren zu untersuchen und die Bestand Inhalt an den Spektren entsprechen. 4,5 Hier wird ein Protokoll zu erstellen und um die Modelle zu validieren für die Vorhersage des Gesamtzuckergehalts, entsprechende Gesamt Gehalt an organischer Säure zu aCIDIty und insgesamt Anthocyan-Gehalt von Heidelbeeren, die aus NIR-Spektren dargestellt.
Figur 1 zeigt das allgemeine Ablaufdiagramm , zuverlässige und robuste Kalibrierungsmodelle zu konstruieren. Proben von ausreichender Anzahl gesammelt werden. Einige von ihnen sind für die Konstruktion von Modellen verwendet, während die anderen für die Validierung der konstruierten Modelle verwendet werden. Für jedes der gesammelten Proben wird ein NIR-Spektrum gemessen, und dann werden die Zielkomponenten quantitativ mit traditionellen zerstörenden chemischen Analyseverfahren analysiert. Hier Hochleistungsflüssigkeits-Chromatographie (HPLC) für die chemische Analyse von Zuckern, organischen Säuren und Anthocyanine. Partial Least Squares (PLS) Regression wird für die Konstruktion von Kalibrierungsmodelle verwendet, in denen die Korrelation zwischen der beobachteten Spektren und den Bestandteil Inhalt durch chemische Analysen bestimmt untersucht wird. Um robuste Modelle mit der besten Prognose Fähigkeit, die Vorbehandlungen von Obser zu konstruierenved Spektren und die Wellenlängenbereiche für die Vorhersage verwendet werden ebenfalls untersucht. Schließlich werden die konstruierten Modelle validiert ihre ausreichende Vorhersagefähigkeit zu bestätigen. In der Validierung, prognostizierte der Inhalt aus dem beobachteten Spektrum von der konstruierten Modell (vorhergesagten Werte) sind im Vergleich zu den durch die chemischen Analysen ermittelten Gehalte (beobachtete Werte). Wenn eine ausreichende Korrelation kann nicht zwischen den vorhergesagten und beobachteten Werte gefunden werden, sollte die Kalibrierungsmodell neu aufgebaut werden, bis die ausreichende Korrelation erhalten wird. Obwohl es vorzuziehen ist, verschiedene Gruppen von Proben für die Konstruktion und Validierung des Modells zu verwenden, wie in dieser Figur (externen Validierung) gezeigt ist, Proben in einer gleichen Gruppe sind sowohl für den Bau und die Validierung (Kreuzvalidierung) verwendet, wenn die Anzahl der Proben nicht groß genug ist.
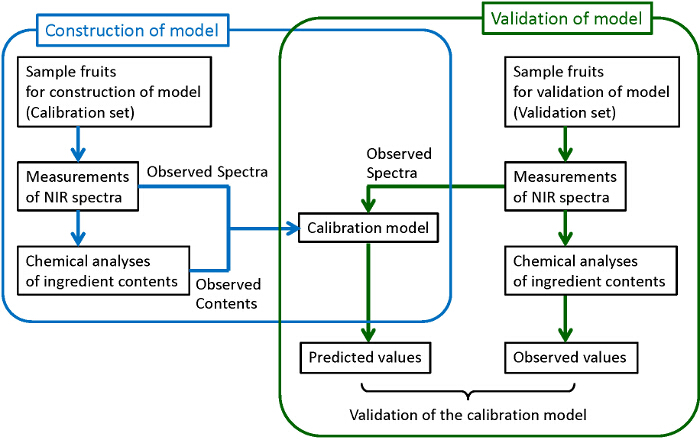
Fild 1. Flussdiagramm für die Konstruktion und Validierung des Kalibrierungsmodells. Die von blauen und grünen Linien umgeben Verfahren entsprechen, jeweils mit dem Bau eines Kalibrierungsmodells und dessen Validierung. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Protokoll
1. Sammlung von Proben
- Entscheiden Sie, welche Sorten in der Ziel des Kalibrierungsmodells einbezogen werden.
- Sammeln ausreichender Anzahl und verschiedene Arten von Proben Heidelbeeren der Zielorten.
- Sammeln Sie vorzugsweise 100 Heidelbeeren für den Bau des Kalibrierungsmodells und mindestens 10 für die Validierung des konstruierten Modells. Um robuste Modelle zu konstruieren, sammeln Proben von verschiedenen Arten, dh mit verschiedenen Farben, Größen und mit verschiedenen Reifebedingungen.
- Wiegen Sie jede Heidelbeere. Anmerkung: Die Gewichte gemessen werden später für die Berechnung der Gehalt Prozent der Bestandteile jeder Blueberry verwendet.
2. Messungen von Spektren
- Warm-up das Spektralphotometer ausreichend (mehr als 1 Stunde) vor den Messungen zuverlässig Spektren zu erhalten.
- Stellen Sie das Spektralphotometer. Stellen Sie sicher, dass die Bedingungen konstant alle durch die Messungen sind. EinBeispiel für typische Bedingungen für die Messung sind unten angegeben.
- Stellen Sie den Bereich der Messungen zu 12,500-3,600 cm -1.
- Stellen Sie die spektrale Auflösung bis 16 cm -1.
- Stellen Sie die Akkumulation zu 32 mal.
- Wählen diffuse Reflektanz als Modus der Messung.
- Setzen Sie den Standard-Reflektor, der auf dem Fenster des Spektrophotometers für diffuse Reflexionsmessungen. Durch die Verwendung des "Hintergrund Einkanal" Befehl, messen Sie die Hintergrundspektrum, die später für die Berechnung der relativen Reflexionsspektren aus den Spektren der Probe gemessen Heidelbeeren automatisch verwendet wird.
- Legen Sie eine Blaubeere Probe in der Mitte des Fensters des Spektrometers für diffuse Reflexionsmessungen. Durch die Verwendung der "Probe Einkanal" Befehl, messen Spektren jeder Heidelbeere vorzugsweise an mehreren Stellen der Frucht.
Hinweis: Kubelka-Munk - Transformation 6,7 wird auch automatisch durchgeführt werden ,matisch für die beobachteten Spektren von Probe Heidelbeeren, wenn die Bedingung der spektralen Erwerb gesetzt, dies zu tun. Kubelka-Munk-Transformation ändert die Spektren in der diffusen Reflexionsmodus in den äquivalenten gemessenen Spektren zu den im Transmissionsmodus gemessen und für die Analysen von Spektren mit hoher Genauigkeit erforderlich. Spectra in der Absorptionsskala für Analysen verwendet. - Berechnen des Durchschnittsspektrums der Spektren jeder Probe ein Datenverarbeitungsprogramm wie MS Excel, wenn die Spektren einer Heidelbeere Probe an mehreren Stellen gemessen werden. Verwenden Sie das gemittelte Spektrum für Analysen.
3. Vorbehandlung für die HPLC - Messungen von Zuckern und organischen Säuren 8
Hinweis: Extrahieren Zuckern und organischen Säuren jeder Heidelbeeren, die in Wasser löslich sind, mit Reinstwasser wie folgt. Die ganze jeder Blueberry ist für Analysen verwendet.
- Halten Sie die Heidelbeeren in einem Gefrierschrank unter -30 ° C bereit for chemische Analysen, wenn sie kurz nach der spektralen Messungen nicht analysiert werden.
- Schneiden Sie eine Blaubeere in mehrere Stücke, so kann es leicht in den folgenden Schritten homogenisiert werden. Schneiden Sie die Heidelbeere ohne Auftauen, wenn es gefroren ist.
- Setzen Sie die Stücke in einen 50-ml-Becher.
- In ca. 10 ml Reinstwasser (destilliertes Wasser, dessen elektrische Leitfähigkeit geringer ist als 0,1 & mgr; S / cm) in das Becherglas.
- Heizen Sie den Schnitt blueberry in Reinstwasser in einem Mikrowellenofen für 20 Sekunden um die Enzyme zu deaktivieren, die Zucker in den Analysen zersetzen könnten.
- In ca. 10 ml Reinstwasser in den Becher.
- Homogenisieren der Mischung für 5 min bei 12000 Upm mit einem Homogenisator mit einer Standardwelle und Generator ausgestattet.
- Zentrifugieren Sie die homogenisierte Mischung für 10 Minuten bei 3000 Umdrehungen pro Minute (2.000 × g).
- Sammeln Filtrat durch Vakuumfiltration der zentrifugierten Probe eine 5B Papierfilter.
- Wiederholen Sie die Schritte 3,6-3,9 zweimal auf the Filtrationsrückstand alle Zucker und organische Säuren, zu sammeln und alle Filtrate kombinieren.
- Messung des pH - Werts des Filtrats und einstellen auf 7 mit verdünnter Salzsäure (0,1 und 0,01 mol L -1) und verdünnte wässrige Lösungen von Natriumhydroxid (0,1 und 0,01 mol L -1).
- Man verdünnt das Filtrat auf 50 ml mit Reinstwasser.
- Teilen Sie die Probe in zwei; eine für die Analyse von Zuckern und die andere für die Analyse von organischen Säuren.
- Passieren die erste Probenlösung durch Säulen (zwei C18, CM und QMA) in Reihe geschaltet auszuschließen Pigmente, Kationen und Anionen. Werfen die ersten 1 ml der Probenlösung aus den Spalten entfernt. Dann nutzen Sie die Probenlösung aus den Spalten für die Analyse von Zuckern durch HPLC.
- Übergeben Sie die zweite Probenlösung durch Spalten (zwei C18 und CM) in Reihe geschaltet sind Pigmente und Kationen auszuschließen. Werfen die ersten 1 ml der Probenlösung aus den Spalten entfernt. Dann nutzen Sie die Probenlösung aus der columns zur Analyse von organischen Säuren durch HPLC.
- Zentrifuge jede Lösung aus den Schritten 3.14 und 3.15 bei 6,600 rpm (5.800 × g) für 10 min in einem Mikroröhrchen, ausgestattet mit einem 0,45 um-Filter mit einer Minizentrifuge vor der Analyse durch HPLC.
4. HPLC Measurements of Sugars
Hinweis: In dieser Studie Summe Anteil an Saccharose, Glucose und Fructose jeder Heidelbeere als Gesamtzuckergehalt angesehen wird. Daher wird die Arbeitskurve für jede der drei Zuckern erhalten zuerst, und dann sum Gehalt der Zucker in den einzelnen Blaubeere gewonnen wird. Die Standard - Inhalte werden als 0,3-0,4 Gew% (Saccharose) berichtet, 3,8-4,8 Gew% (Glucose) und 4,2-5,3 Gew% (Fructose). 9
- Messen Sie etwa 200 mg Saccharose genau, und lösen es in 50 ml Reinstwasser, um eine Standardlösung vorzubereiten. Verdünnen von 5 ml der Lösung auf 50 ml mit Reinstwasser, um die zweite Standardlösungen vorzubereiten. Bereiten Sie in ähnlicher Weise das dritte Standard Lösung aus der zweiten Standardlösung.
- Bereiten Sie die Standardlösungen von Glucose und Fructose, ähnlich.
- Ordnen Sie die HPLC-System wie folgt:
- Verwenden Sie eine Gelpermeationssäule im Säulenofen bei 40 ° C.
- Verwendung entgast Reinstwasser mit einer Fließgeschwindigkeit von 0,1 ml / min als Eluat.
- Verwenden Sie einen Brechungsindexdetektor.
- Messen Sie die HPLC-Spektrogramme von Standardlösungen von für jede Messung ein 20-ul-Aliquot injiziert wird. Anmerkung: Hier wird PAC-Lösung als Software für die Messung verwendet.
- Holen Sie sich das Gebiet Intensität der Bande von Zucker auf dem Chromatogramm jeder Standardlösung durch "Re-Analyse" mit der rechten Maustaste klicken.
- Plotten die Flächenintensitäten gegen die entsprechenden Konzentrationen, die durch die lineare Regression der Arbeitskurve für jeden Zucker zu erhalten, wobei die Gleichung, die die Beziehung zwischen dem Flächenintensität und der Konzentration darstellt, wird erhalten for jeden Zucker.
- Messen Sie die HPLC-Spektrogramme von Probenlösungen durch für jede Messung ein 20-ul-Aliquot injiziert wird.
- Rund um die Region Intensitäten der Banden von Zuckern auf dem Chromatogramm von jeder Probenlösung, wie zuvor in Schritt 4.5 beschrieben.
- Erhalten, die Konzentrationen der Zucker in den Lösungen der Gleichungen unter Verwendung der Arbeitskurven entsprechenden 4.6 in Schritt erhalten.
- Erhalten, die Menge jeder Zucker in jeder Heidelbeere aus den Konzentrationen der Probenlösung in dem vorhergehenden Schritt und das Gesamtvolumen der Probenlösung erhalten (50 ml, siehe Schritt 3.12).
- Besorgen Sie sich die Gesamtzucker Mengen jeder Frucht durch den Inhalt von drei Zucker zusammen.
- Erhalten Sie den Inhalt Prozent der gesamten Zucker jeder Heidelbeere, indem das Gewicht in Schritt 1.3 gemessen.
5. HPLC-Messungen von organischen Säuren
Hinweis: In dieser Studie Summengehalt von Citronensäure, Chinasäure, ÄpfelSäure und Bernsteinsäure werden als die gesamten organischen Säuregehalt berücksichtigt. Daher wird Arbeitskurve für jede der vier organischen Säuren erhalten zuerst und dann der Gehalt an organischer Säure in jedem Blueberry gemessen. Die Standardinhalte werden als 0,42-0,62 Gew% (Citronensäure) berichteten, 0-0,15 Gew% (Chinasäure), 0,08 bis 0,23 Gew% (Apfelsäure), und 0,06-0,25 Gew% (Bernsteinsäure). 9
- Messen Sie etwa 5 mg Zitronensäure genau, und lösen sie in 50 ml Reinstwasser, um eine Standardlösung vorzubereiten. Verdünnen von 5 ml der Lösung auf 50 ml mit Reinstwasser, um die zweite Standardlösungen vorzubereiten. Bereiten Sie in ähnlicher Weise die dritte Standardlösung aus der zweiten Standardlösung.
- Bereiten Sie die Standardlösungen von Chinasäure, Äpfelsäure und Bernsteinsäure, ähnlich.
- Ordnen Sie die HPLC-System wie folgt:
- Verwenden zwei Anionenaustausch-Säulen in Serie geschaltet im Säulenofen bei 40 ° C.
- Verwendung entgast 0,1% wässrige Lösung von PhosphorsäureSäure mit einer Fließgeschwindigkeit von 0,02 ml / min als Eluat.
- Verwenden Sie ein UV-VIS Detektor Satz bei 210 nm.
- Messen Sie die HPLC-Spektrogramme von Standardlösungen werden durch ein 20-ul-Aliquot von Standardlösung für jede Messung zu injizieren.
- Holen Sie sich das Gebiet Intensität der Bande der organischen Säure auf dem Chromatogramm jeder Standardlösung durch "Re-Analyse" mit der rechten Maustaste klicken.
- Plotten die Flächenintensitäten gegen die entsprechenden Konzentrationen der Arbeitskurve für jede organische Säure durch die lineare Regression zu erhalten, wobei die Gleichung, die die Beziehung zwischen dem Flächenintensität und der Konzentration darstellt, wird für jede organische Säure erhalten.
- Messen Sie die HPLC-Spektrogramme von Probenlösungen durch für jede Messung ein 20 ul Aliquot der Probe injiziert wird.
- Rund um die Region Intensitäten der Banden von organischen Säuren des Chromatogramms von jeder Probenlösung wie vorstehend beschrieben in Schritt 5.5.
- Erhalten, um die Konzentration der organischen Säuren in den Lösungen der Gleichungen unter Verwendung der Arbeitskurven entsprechenden 5.6 in Schritt erhalten.
- Erhalten, die Menge jeder organischen Säure in jeder Blueberry aus den Konzentrationen der Probenlösung in dem vorhergehenden Schritt und das Gesamtvolumen der Probenlösung erhalten (50 ml, siehe Schritt 3.12).
- Besorgen Sie sich die Menge des gesamten organischen Säure in jeder Heidelbeere, indem die Inhalte der vier organischen Säuren zusammen.
- Erhalten Sie den Inhalt Prozent des gesamten organischen Säure jeder Heidelbeere, indem das Gewicht in Schritt 1.3 gemessen.
6. Vorbehandlung für die HPLC-Messungen von Anthocyanen
- Halten Sie die Heidelbeeren in einem Gefrierschrank unter -80 ° C bereit für chemische Analysen, wenn sie kurz nach der spektralen Messungen nicht analysiert werden.
- Trocknen Sie jede gefrorene Früchte mit einem Vakuum-Gefriertrocknungsanlage für 12 Stunden.
- Auszug Anthocyan aus dem getrockneten Blaubeere in 1% Methanol-Lösung of Trifluoressigsäure [Gewicht von Heidelbeere (g) / Volumen der Lösung (ml) = 1/10], indem die Mischung in einem Kühlschrank bei 4 ° C für 12 h verlassen.
- Zentrifuge der Extrakt für 15 min in einem 2 ml Mikroröhrchen unter Verwendung einer Ultrazentrifuge bei -8 ° C und 15.000 rpm (21.900 × g).
- Filtern des Extrakts durch ein 0,45 um-Filter der Probe für die HPLC-Messungen zu erhalten.
7. HPLC-Messungen von Anthocyanen
Hinweis: Über 13 Art Anthocyane sind in Heidelbeeren enthalten. Da es schwierig ist , Arbeitskurven für alle Anthocyanen zu bekommen, für eine Arbeitskurve nur Cyanidin-3 - O - -glucoside Chlorid, einer der beliebtesten Anthocyane in Heidelbeeren, erhalten. Die Arbeitskurve ist für annähernd Quantifizierungen von anderen Anthocyanen angewendet.
- Messen etwa 1,5 mg Cyanidin-3 - O -glucoside Chlorid genau und löst ihn in 10 ml 1% -ige methanolische Lösung von Trifluoressigsäure zu prepare eine Standardlösung. Verdünne 5 ml der Lösung auf 10 ml mit 1% Methanol-Lösung von Trifluoressigsäure die zweite Standardlösungen herzustellen. In ähnlicher Weise bereiten die dritte und die vierte Standardlösungen der Reihe nach.
- Ordnen Sie die HPLC-System wie folgt:
- Verwenden, um eine C18-Umkehrphasensäule in einem Säulenofen bei 40 ° C.
- Gelten die Gradientenmethode Eluate von 0,1% iger wßriger Trifluoressigsäure (eluieren A) und 0,5% Trifluoressigsäure in Acetonitril (Eluat B) mit einer Fließgeschwindigkeit von 0,1 ml / min verwendet, wobei das Verhältnis von eluieren B steigt von 8% bis 15% während 0-50 min nach der Injektion, und von 15% bis 75% während 50-60 min nach der Injektion.
- Verwenden Sie ein Fotodiodenarray-Detektor-Überwachung bei 520 nm.
- Messen Sie die HPLC-Spektrogramme von Standardlösungen von für jede Messung ein 10-ul-Aliquot injiziert wird. "LC Solution" wird als die Software für die Messung verwendet.
- Holen Sie sich das Gebiet Intensität der Bande vonCyanidin-3 - O - -glucoside Chlorid auf dem Chromatogramm jeder Standardlösung durch "Re-Analyse" mit der rechten Maustaste klicken.
- Zeichnen Sie die Flächenintensitäten gegen die entsprechenden Konzentrationen der Arbeitskurve für Cyanidin-3 - O - -glucoside Chlorid durch die lineare Regression zu erhalten, wobei die Gleichung , die die Beziehung zwischen Flächenintensität und Konzentration für Cyanidin-3 - O - -glucoside Chlorid erhalten wird.
- Messen Sie die HPLC-Spektrogramme von Probenlösungen durch für jede Messung ein 10-ul-Aliquot injiziert wird.
- Rund um die Region Intensität der Bande jedes Anthocyanin auf dem Chromatogramm von jeder Probenlösung, wie zuvor in Schritt 7.4 beschrieben.
- Erhalten, um die Konzentration der Anthocyane in den Lösungen der Gleichung auf der Arbeitskurve entspricht 7.5 in Schritt erhalten.
- Besorgen Sie sich die Mengen jeder Anthocyan in jedem Blaubeere aus der Konzentration in der vorherigen erhaltenSchritt und das Gesamtvolumen der Probenlösung in der Stufe 6.3.
- Besorgen Sie sich die Gesamtmenge an Anthocyan in jedem Heidelbeere durch den Inhalt der dreizehn Anthocyane zusammen.
- Erhalten Sie den Inhalt Prozent des gesamten Anthocyan jeder Heidelbeere, indem das Gewicht in Schritt 1.3 gemessen.
8. Konstruktion von Kalibrierungsmodelle für die Vorhersage von Ingredient Inhalt
Hinweis: PLS - Regression, 4,5 , die eine Art multiple Regressionstechnik ist mit latent Varianten wird für den Bau von Kalibrierungsmodelle für jeden Inhaltsstoff aus der beobachteten Spektren und der Inhaltsstoffe Inhalt durch chemische Analysen bestimmt verwendet. PLS-Regression wird entweder mit den kommerziellen Programmen oder mit den hausgemachten Programme. Siehe Referenzen 5,10 für die detaillierten Prozesse der Konstruktion von Modellen.
- Überprüfen Sie, welche Vorbehandlungen für die beobachteten Spektren sind am effektivsten für eine genaue undrobust Vorhersage.
- Konstruieren Sie Kalibrationsmodelle durch einen oder zwei der folgenden Vorbehandlungen Anwendung: MSC (Multiplikativ Scatter Correction), 1,2,5 SNV (Standard Normale Variate), 1,2,5 MMN (Min-Max - Normalisierungs), COE (Constant Offset - Eliminierungs ), und die erste oder die zweite Ableitung Berechnung von SG (Savitzky-Golay) -Methode. 1,2,5 die Zutat Inhalt der Validierung von ihren Spektren mit den konstruierten Modelle setzen Predict.
Anmerkung: In MMN ein Spektrum normalisiert ist, so dass der Minimal- und Maximalwerte werden 0 bzw. 1 sind. In COE wird die Ordinate eines Spektrums verschoben, so dass der Minimalwert Null wird. - Berechnen Determinationskoeffizient, R 2, und Rest prädiktive Abweichung, RPD, zwischen den beobachteten und den vorhergesagten Werten der Validierung gesetzt zu untersuchen , welche Vorbehandlungen für die beobachteten Spektren am wirksamsten sind. Wählen Sie die Kombination von Vorbehandlungen geben größerR 2 und RPD.
- Konstruieren Sie Kalibrationsmodelle durch einen oder zwei der folgenden Vorbehandlungen Anwendung: MSC (Multiplikativ Scatter Correction), 1,2,5 SNV (Standard Normale Variate), 1,2,5 MMN (Min-Max - Normalisierungs), COE (Constant Offset - Eliminierungs ), und die erste oder die zweite Ableitung Berechnung von SG (Savitzky-Golay) -Methode. 1,2,5 die Zutat Inhalt der Validierung von ihren Spektren mit den konstruierten Modelle setzen Predict.
- Untersuchen Sie die Wellenzahlbereiche für die genaue und robuste Vorhersage wirksam sind , indem zum Beispiel bewegte Fenster PLS - Technik 11 die effektiven Regionen suchen.
Hinweis: Die Vorgehensweise entspricht die Wellenzahlbereiche zu entfernen, wo Spektren keine wirksame Informationen für Prognosen enthalten oder Informationen enthalten, die mit den Vorhersagen stört.
9. Die Validierung der Konstruiert Kalibrationsmodelle
Hinweis: Siehe Referenzen 5,10 für die detaillierten Prozesse der Validierung von konstruierten Modellen.
- Predict Zutat Inhalt der Validierung aus ihren Spektren mit den konstruierten Kalibrierungsmodelle mit der besten Kombination von Vorbehandlungen und für die Wellenzahl Regionen wirksam für die Vorhersage. 5,10
- Berechnen R 2 und RPD zwischen der beobachteten und vorhergesagtenWerte der Validierungssatz. 5,10
- Überprüfen Sie, ob die allgemeinen Kriterien für die praktische Durchführung von Kalibrierungsmodelle, 12,13 R 2> 0,85 und RPD> 2.5 erfüllt sind. Betrachten wir die Rekonstruktion des Modells, wenn die Kriterien nicht erfüllt sind.
Ergebnisse
Abbildung 2 zeigt als Beispiel eine Reihe von NIR - Absorptionsspektren von Heidelbeeren , wo Spektren von 70 Heidelbeeren gleichzeitig angezeigt werden. Da die Bänder definitiv zuordenbar Zucker, organische Säuren oder Anthocyane sind nicht im NIR-Spektren, traditionelle Lambert-Beer-Gesetz beobachtet wurde, ist nicht anwendbar, die Bestandteil Inhalte zu quantifizieren. Daher ist die Konstruktion von Modellen zur Vorhersage der Bestand Inhalte erforderlich.
Diskussion
Einige zusätzliche Bemerkungen zu dem Protokoll werden hier beschrieben. Zuerst wird in Schritt 1.1 wird erwähnt, die Sorten im Ziel enthalten, zu entscheiden. Obwohl es möglich ist, Modelle zu konstruieren Abdeckung Heidelbeeren, die aus vielen Sorten oder ohne Sorten spezifiziert, sind die Prognosegüten mit den Modellen manchmal viel niedriger als die mit den Modellen für eine einzige Sorte und für begrenzte Sorten. Es sollte auch beachtet werden , dass die Kalibrierungsmodelle für Blaubeeren von jeder Produkti...
Offenlegungen
We have nothing to disclose.
Danksagungen
This work was partially supported by the project "A Scheme to Revitalize Agriculture and Fisheries in Disaster Area through Deploying Highly Advanced Technology" of Ministry of Agriculture, Forestry and Fisheries, Japan.
Materialien
| Name | Company | Catalog Number | Comments |
| FT-NIR spectrophotometer | Bruker Optics GmbH | MPA | |
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45000-31, 228-45018-31, | For sugar analysis |
| 223-04500-31, 228-45010-31, 228-45095-31 | Refractive Index Detector | ||
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45003-31, 228-45000-31, | For organic acid analysis |
| 228-45018-31, 228-45010-31, 223-04500-31 | Ultraviolet-Visible Detector | ||
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45018-31, 228-45000-31, | For anthocyanin analysis |
| 228-45012-31, 228-45119-31, 228-45005-31, | Photodiode Array Detector | ||
| 228-45009-31 | |||
| pH meter | Mettler-Toledo | 30019028 | S220, Automatic temperature compensation |
| Ultra-pure water treatment equipment | ORGANO Corporation | ORG-ULXXXM1; PRA-0015-0V0 | PURELAB ultra; PURELITE |
| Biomedical Freezers | SANYO | 2-6780-01 | MDF-U338 |
| Ultra-Low Temperature Freezer | Panasonic healthcare Co.,Ltd. | KM-DU73Y1 | -80°C |
| Vacuum lyophilizer | IWAKI GLASS Co.,Ltd | 119770 | DRC-3L;FRD-82M |
| Homoginizer | Microtec Co., Ltd. | Physcotron | |
| Ultracentrifuge | Hitachi Koki Co.,Ltd | S204567 | CF15RXII |
| Mini-centrifuge | LMS CO.,LTD. | KN3136572 | MCF-2360 |
| Centrifuge | Kokusan Co.,Ltd | 2-5534-01 | H-103N |
| Filter Paper | Advantec | 1521070 | 5B, Eqivalent to Whatman 40 |
| Sep-Pak C18 column | Waters Corporation Milford | WAT020515 | |
| Sep-Pak CM column | Waters Corporation Milford | WAT020550 | |
| Sep-Pak QMA column | Waters Corporation Milford | WAT020545 | |
| Centrifugal Filter Unit | Merck Millipore Corporation | R2SA18503 | PVDF, 0.45 μm |
| Microtube | As One Corporation | 1-1600-02 | PP, 2 mL |
| Syringe Filter | GE Healthcare CO.,LTD. | 6788-1304 | PP, 0.45 μm |
| Sucrose | Wako Pure Chemical Industries,Ltd | 194-00011 | Reagent-grade |
| Glucose | Wako Pure Chemical Industries,Ltd | 049-31165 | Reagent-grade |
| Fructose | Wako Pure Chemical Industries,Ltd | 123-02762 | Reagent-grade |
| Citric acid | Wako Pure Chemical Industries,Ltd | 036-05522 | Reagent-grade |
| Malic acid | Wako Pure Chemical Industries,Ltd | 355-17971 | Reagent-grade |
| Succinic acid | Wako Pure Chemical Industries,Ltd | 190-04332 | Reagent-grade |
| Quinic acid | Alfa Aesar, A Johnson Matthey Company | 10176328 | Reagent-grade |
| Phosphoric acid | Wako Pure Chemical Industries,Ltd | 162-20492 | HPLC-grade |
| Trifluoroacetic acid | Wako Pure Chemical Industries,Ltd | 208-02746 | Reagent-grade |
| Methanol | Wako Pure Chemical Industries,Ltd | 131-01826 | Reagent-grade |
| Acetonitrile | Wako Pure Chemical Industries,Ltd | 015-08633 | HPLC-grade |
| Grade cyanidin-3-O-glucoside chloride | Wako Pure Chemical Industries,Ltd | 306-37661 | HPLC-grade |
| Software for analyses | Bruker Optics GmbH | OPUS ver. 6.5 | |
| Softoware for preprocessing | Microsoft | Excel powered by Visual Basic for Applications | |
| Software for construction of models | Freemat 4.0 | http://freemat.sourceforge.net/ |
Referenzen
- Ozaki, Y., McClure, W. F., Christy, A. A. . Near-infrared Spectroscopy in Food Science and Technology. , (2007).
- Sun, D. W. . Infrared Spectroscopy for Food Quality Analysis and Control. , (2009).
- Bai, W., Yoshimura, N., Takayanagi, M. Quantitative analysis of ingredients of blueberry fruits by near infrared spectroscopy. J. Near Infrared Spectrosc. 22, 357-365 (2014).
- Hasegawa, T., Tasumi, M. . Chemometrics in infrared spectroscopic analysis. In: Introduction to Experimental Infrared Spectroscopy. , 97-113 (2015).
- Varmuza, K., Filzmoser, P. . Introduction to Multivariate Statistical Analysis in Chemometrics. , (2009).
- Kubelka, P. New contributions to the optics of intensely light-scattering materials. Part I. J. Opt. Soc. Am. 38, 448-457 (1948).
- Juang, R. H., Storey, D. E. Quantitative determination of the extent of neutralization of carboxylic acid functionality in carbopol 974P NF by diffuse reflectance fourier transform infrared spectrometry using Kubelka-Munk function. Pharm Res. 15, 1714-1720 (1998).
- Ogiwara, I., Ohtsuka, Y., Yoneda, Y., Sakurai, K., Hakoda, N., Shimura, I. Extraction method by water followed by microwave heating for analyzing sugars in strawberry fruits. J. Jpn. Soc. Hort. Sci. 68, 949-953 (1999).
- Che, J., Suzuki, S., Ishikawa, S., Koike, H., Ogiwara, I. Fruit ripening and quality profile of 64 cultivars in three species of blueberries grown in Tokyo. Hort. Res. (Japan). 8, 257-265 (2009).
- Pomerantsev, A. L. . Chemometrics in Excel. , (2014).
- Jiang, H. J., Berry, R. J., Siesler, H. W., Ozaki, Y. Wavelength Interval Selection in Multicomponent spectral analysis by moving window partial least-squares regression with applications to mid-infrared and near-infrared spectroscopic data. Anal. Chem. 74, 3555-3565 (2002).
- Edney, M. J., Morgan, J. E., Williams, P. C., Campbell, L. D. Analysis of feed barley by near infrared reflectance spectroscopy. J. Near-Infrared Spectrosc. 2, 33-41 (1994).
- Mathison, G. W., et al. Prediction of composition and ruminal degradability characteristics of barley straw by near infrared reflectance spectroscopy. Can. J. Anim. Sci. 79, 519-523 (1999).
- Chiara, F., et al. Analysis of anthocyanins in commercial fruit juices by using nano-liquid chromatography electrospray-mass spectrometry and high performance liquid chromatography with UV-vis detector. J. Separation Sci. 34, 150-159 (2011).
- Li, Q., et al. Antioxidant anthocyanins screening through spectrum-effect relationships and DPPH-HPLC-DAD analysis on nine cultivars of introduced rabbiteye blueberry in China. Food Chemistry. 132, 759-765 (2013).
- Sinelli, N. Evaluation of quality and nutraceutical content of blueberries (Vaccinium corymbosum L.) by near and mid-infrared spectroscopy. Postharvest Biol. Technol. 50, 31-36 (2008).
- Giusti, M. M., Wrolsted, R. E., Wrolstad, R. E., Schwartz, S. J. Anthocyanins: characterization and measurement with UV-visible spectroscopy. Current Protocols in Food Analytical Chemistry. , 1-13 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten