Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Construcción de modelos para la predicción no destructiva de Contenidos ingrediente de arándanos por espectroscopia de infrarrojo cercano en base a mediciones de HPLC
En este artículo
Resumen
We present here a protocol to construct and validate models for nondestructive prediction of total sugar, total organic acid, and total anthocyanin content in individual blueberries by near-infrared spectroscopy.
Resumen
Nondestructive prediction of ingredient contents of farm products is useful to ship and sell the products with guaranteed qualities. Here, near-infrared spectroscopy is used to predict nondestructively total sugar, total organic acid, and total anthocyanin content in each blueberry. The technique is expected to enable the selection of only delicious blueberries from all harvested ones. The near-infrared absorption spectra of blueberries are measured with the diffuse reflectance mode at the positions not on the calyx. The ingredient contents of a blueberry determined by high-performance liquid chromatography are used to construct models to predict the ingredient contents from observed spectra. Partial least squares regression is used for the construction of the models. It is necessary to properly select the pretreatments for the observed spectra and the wavelength regions of the spectra used for analyses. Validations are necessary for the constructed models to confirm that the ingredient contents are predicted with practical accuracies. Here we present a protocol to construct and validate the models for nondestructive prediction of ingredient contents in blueberries by near-infrared spectroscopy.
Introducción
Infrarrojo cercano (NIR) se aplica ampliamente como una técnica no destructiva para analizar el contenido de frutas y verduras de diversos tipos. Analiza 1,2 no destructiva mediante espectroscopia NIR que el envío de sólo deliciosas frutas y verduras con cualidades garantizados. espectroscopia NIR ya se ha aplicado a la naranja, la manzana, el melón, cereza, kiwi, mango, papaya, melocotón y así sucesivamente para conocer su Brix que corresponde al contenido total de azúcar, acidez, TSC (contenido total de sólidos), y así sucesivamente . Recientemente, se ha informado de la aplicación de la espectroscopia NIR para la evaluación de la calidad de los arándanos. 3 Hemos medido no sólo el contenido total de azúcar y el contenido de ácido orgánico total correspondiente a la acidez, sino también el contenido de antocianinas totales. La antocianina es un componente bioactivo, que se cree que mejora la salud humana. Es conveniente para los consumidores si pueden comprar deliciosos arándanos con una garantía de su contenido de azúcar, acidity, y el contenido de antocianinas.
En los espectros de absorción NIR de frutas y verduras, sólo se observan bandas de absorción anchas. Son principalmente las bandas debido a la fibra y la humedad. Aunque muchas bandas débiles debido a los diversos ingredientes de la diana no Destructed se observan al mismo tiempo, las bandas observadas no se pueden asignar a los modos de vibración específicas de los componentes específicos de la diana en la mayoría de los casos. Por lo tanto, la técnica tradicional para determinar el contenido de un componente específico usando la ley de la de Lambert-Beer no es eficaz para los espectros de NIR. En cambio, los modelos de calibración para predecir el contenido de los componentes de destino a partir de los espectros observados son construidos usando quimiometría mediante el examen de la correlación entre los espectros observados y los contenidos de los ingredientes correspondientes a los espectros de 4,5. En este caso, un protocolo para construir y validar los modelos para la predicción del contenido total de azúcares, contenido total de ácido orgánico correspondiente a ACIDIdad, y el contenido total de antocianinas de arándanos de los espectros NIR se presenta.
La figura 1 muestra el diagrama de flujo general para la construcción de modelos de calibración fiables y sólidas. Se recogen muestras de número suficiente. Algunos de ellos se utilizan para la construcción de modelos, mientras que los otros se utilizan para la validación de los modelos construidos. Para cada una de las muestras recogidas, un espectro NIR se mide, y luego se analizan los componentes de destino cuantitativamente con los métodos tradicionales de análisis químicos destructivos. Aquí, la cromatografía líquida de alto rendimiento (HPLC) se utiliza para los análisis químicos de azúcares, ácidos orgánicos, y antocianinas. mínimos cuadrados parciales (PLS) de regresión se utiliza para la construcción de modelos de calibración donde los análisis se examina la correlación entre los espectros observados y los contenidos de ingrediente determinado por química. Con el fin de construir modelos robustos con la mejor capacidad de predicción, los pretratamientos de obserTambién se examinan los espectros ved y las regiones de longitud de onda utilizados para la predicción. Por último, los modelos construidos son validados para confirmar su capacidad de predicción suficiente. En la validación, el contenido predecirse a partir de la espectro observado por el modelo construido (valores predichos) se comparan con los contenidos determinados por los análisis químicos (valores observados). Si la correlación suficiente no se encuentra entre los valores predichos y observados, el modelo de calibración debe ser re-construye hasta que se obtiene la correlación suficiente. Aunque es preferible el uso de diferentes grupos de muestras para la construcción y validación de un modelo como se muestra en esta figura (validación externa), las muestras en un mismo grupo se utilizan tanto para la construcción y la validación (validación cruzada) cuando el número de las muestras no es lo suficientemente grande.
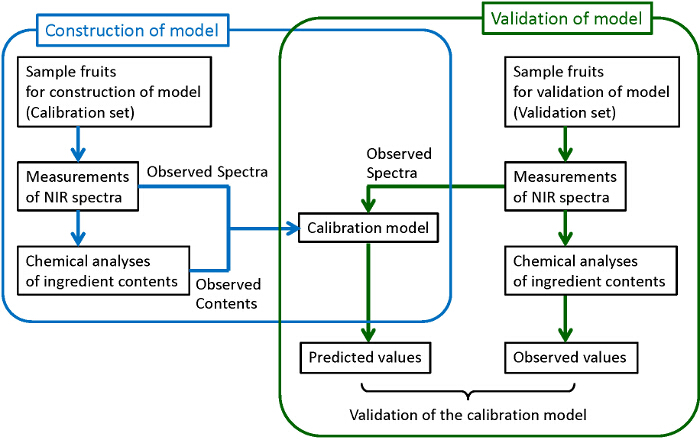
Figura 1. Diagrama de flujo para la construcción y validación del modelo de calibración. Los procedimientos rodeadas por líneas azules y verdes corresponden, respectivamente, a la construcción de un modelo de calibración y su validación. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Recolección de Muestras
- Decidir qué cultivares será incluida en el objetivo del modelo de calibración.
- Recoger número suficiente y varios tipos de arándanos de muestra de los cultivares de destino.
- Recoger preferiblemente 100 arándanos para la construcción del modelo de calibración, y al menos 10 para la validación del modelo construido. Con el fin de construir modelos robustos, recoger muestras de diferentes tipos, es decir, con diferentes colores, tamaños y en distintas condiciones de maduración.
- Pese cada arándanos. Nota: Los pesos medidos se utilizan más tarde para el cálculo del por ciento de contenido de ingredientes de cada arándanos.
2. Las mediciones de los espectros
- Calentamiento del espectrofotómetro suficiente (más de 1 hora) antes de las mediciones para obtener espectros fiable.
- Ajuste el espectrofotómetro. Asegúrese de que las condiciones son constantes a lo largo de las mediciones. Unejemplo de condiciones típicas para las mediciones es la siguiente.
- Ajuste el rango de mediciones de 12,500-3,600 cm -1.
- Ajuste la resolución espectral de 16 cm -1.
- Establecer la acumulación de 32 veces.
- Seleccionar reflectancia difusa como el modo de medición.
- Poner el reflector de serie en la ventana del espectrofotómetro para las mediciones de reflectancia difusa. Mediante el uso de la orden de "fondo solo canal", medir el espectro de fondo que se utiliza automáticamente para el cálculo de los espectros de reflectancia relativa de los espectros de arándanos muestra medida después.
- Poner una muestra de arándano en el centro de la ventana del espectrofotómetro para las mediciones de reflectancia difusa. Al utilizar el comando "muestra de un solo canal", medir los espectros de cada arándanos preferentemente en varios puntos de la fruta.
Nota: Kubelka-Munk transformación 6,7 también se lleva a cabo autocamente para los espectros observados de arándanos de la muestra si la condición de la adquisición de espectro está configurado para hacerlo. transformación Kubelka-Munk altera el espectro medido en el modo de reflectancia difusa a los espectros equivalente a los medidos en el modo de transmisión y es necesario para los análisis de los espectros con alta precisión. Los espectros de absorbancia de la escala se utilizó para los análisis. - Calcular el espectro medio de los espectros de cada muestra usando un programa de procesamiento de datos, tales como MS Excel si los espectros de una muestra de arándanos se miden en varios puntos. Hacer uso del espectro promediado para los análisis.
3. El tratamiento previo de las mediciones de HPLC de azúcares y ácidos orgánicos 8
Nota: Extracto de azúcares y ácidos orgánicos de cada uno de arándanos, que son solubles en agua, con agua ultrapura como sigue. La totalidad de cada arándano se utiliza para los análisis.
- Mantenga los arándanos en un congelador por debajo de -30 ° C listos for análisis químicos si no se analizan inmediatamente después de las mediciones espectrales.
- Cortar un arándano en varios trozos para que pueda ser fácilmente homogeneizada en los siguientes pasos. Cortar el arándano y sin descongelar cuando se congela.
- Poner las piezas en un vaso de 50 ml.
- Añadir ca. 10 ml de agua ultrapura (agua destilada cuya conductividad eléctrica es inferior a 0,1 mS / cm) al vaso de precipitados.
- Calentar el arándano corte en agua ultrapura en un horno de microondas durante 20 seg para desactivar las enzimas que pueden descomponer los azúcares durante los análisis.
- Añadir aproximadamente 10 ml de agua ultrapura al vaso de precipitados.
- Homogeneizar la mezcla durante 5 min a 12.000 rpm con un homogeneizador equipado con un eje estándar y el generador.
- Centrifugar la mezcla homogeneizada durante 10 min a 3000 rpm (2000 xg).
- Recoger filtrado por filtración al vacío de la muestra centrifugada usando un filtro de papel 5B.
- Repita el 3,6-3,9 pasos dos veces en el the residuo de filtración para recoger todos los azúcares y ácidos orgánicos, y combinar todos los filtrados.
- Medir el pH del filtrado y ajustarlo a 7 con ácido clorhídrico diluido (0,1 y 0,01 mol L -1) y diluir soluciones acuosas de hidróxido de sodio (0,1 y 0,01 mol L -1).
- Diluir el filtrado a 50 ml con agua ultrapura.
- Dividir la muestra en dos; uno para el análisis de los azúcares y la otra para el análisis de ácidos orgánicos.
- Pasar la primera solución de muestra a través de columnas (dos C18, CM y QMA) conectados en serie para excluir pigmentos, cationes y aniones. Deseche los primeros 1 ml de la solución de la muestra de las columnas. A continuación, utilice la solución de muestra de las columnas para el análisis de los azúcares por HPLC.
- Pasar la segunda solución de muestra a través de columnas (dos C18 y CM) conectadas en serie para excluir pigmentos y cationes. Deseche los primeros 1 ml de la solución de la muestra de las columnas. A continuación, utilice la solución de la muestra de la columns para el análisis de ácidos orgánicos por HPLC.
- Centrifugar cada solución de las etapas 3.14 y 3.15 a 6.600 rpm (5800 xg), durante 10 min en un microtubo equipado con un filtro de 0,45 micras con un mini-centrifugadora antes del análisis por HPLC.
4. Medidas de azúcares con HPLC
Nota: En este estudio, el contenido suma de sacarosa, glucosa y fructosa de cada arándano es considerado como el contenido total de azúcar. Por lo tanto, se obtiene la curva de trabajo para cada uno de tres azúcares primero, y luego se obtiene el contenido suma de los azúcares en cada arándanos. El contenido estándar se indican como 0,3-0,4% en peso (sacarosa), 3.8 a 4.8% en peso (glucosa), y 4.2 a 5.3% en peso (fructosa). 9
- Medir unos 200 mg de sacarosa con precisión, y se disuelven en 50 ml de agua ultrapura para preparar una solución estándar. Diluir 5 ml de la solución a 50 ml con agua ultrapura para preparar la segunda soluciones estándar. Preparar de manera similar la tercera soporteard solución de la segunda solución estándar.
- Preparar las soluciones estándar de glucosa y fructosa, de manera similar.
- Disponer el sistema de HPLC como sigue:
- Utilice una columna de permeación de gel en el horno de columna a 40 ° C.
- Use agua ultrapura desgasificada con la velocidad de flujo de 0,1 ml / min como el eluato.
- Utilice un detector de índice de refracción.
- Medir los espectrogramas de HPLC de soluciones estándar mediante la inyección de una parte alícuota de 20 l para cada medición. Nota: Aquí, PAC solución se utiliza como el software para la medición.
- Obtener la intensidad área de la banda del azúcar en el cromatograma de cada solución estándar haciendo clic en "re-análisis" con el botón derecho del ratón.
- Trazar las intensidades de área de las concentraciones correspondientes para obtener la curva de trabajo para cada azúcar por la regresión lineal, en donde se obtiene la ecuación que representa la relación entre la intensidad de área y la concentración for cada azúcar.
- Medir los espectrogramas de HPLC de soluciones de muestra mediante la inyección de una parte alícuota de 20 l para cada medición.
- Obtener las intensidades de área de las bandas de los azúcares en el cromatograma de cada solución de la muestra como se describe anteriormente en el paso 4.5.
- Obtener las concentraciones de los azúcares de las soluciones utilizando las ecuaciones correspondientes a las curvas de trabajo obtenidos en el paso 4.6.
- Obtener la cantidad de cada azúcar en cada arándano partir de las concentraciones de la solución de muestra obtenido en la etapa anterior y el volumen total de la solución de muestra (50 ml, véase el paso 3,12).
- Obtener las cantidades totales de azúcar de cada fruto mediante la suma de los contenidos de tres azúcares.
- Obtener el porcentaje de contenido de azúcar total de cada una de arándanos utilizando el peso medido en el paso 1.3.
5. Mediciones de HPLC de ácidos orgánicos
Nota: En este estudio, el contenido suma de ácido cítrico, ácido quínico, málicoácido, y el ácido succínico son considerados como el contenido de ácido orgánico total. Por lo tanto, se obtiene la curva de trabajo para cada uno de los cuatro ácidos orgánicos primero, y luego el contenido de ácido orgánico en cada arándano se mide. El contenido estándar se reportan como 0,42 a 0,62% en peso (ácido cítrico), 0 a 0,15% en peso (ácido quínico), 0,08 a 0,23% en peso (ácido málico), y 0,06 hasta 0,25% en peso (ácido succínico). 9
- Medir unos 5 mg de ácido cítrico con precisión, y se disuelven en 50 ml de agua ultrapura para preparar una solución estándar. Diluir 5 ml de la solución a 50 ml con agua ultrapura para preparar la segunda soluciones estándar. Preparar de manera similar la tercera solución estándar de la segunda solución estándar.
- Preparar las soluciones patrón de ácido quínico, ácido málico y ácido succínico, de manera similar.
- Disponer el sistema de HPLC como sigue:
- Use dos columnas de intercambio aniónico conectados en serie en el horno de columna a 40 ° C.
- Uso desgasifica solución acuosa 0,1% de fosfóricoácido con la velocidad de flujo de 0,02 ml / min como el eluato.
- Utilice un conjunto detector de ultravioleta-visible a 210 nm.
- Medir los espectrogramas de HPLC de soluciones estándar mediante la inyección de una parte alícuota de 20 l de solución de estándar para cada medición.
- Obtener la intensidad área de la banda de ácido orgánico en el cromatograma de cada solución estándar haciendo clic en "re-análisis" con el botón derecho del ratón.
- Trazar las intensidades de área de las concentraciones correspondientes para obtener la curva de trabajo para cada ácido orgánico por la regresión lineal, en donde se obtiene la ecuación que representa la relación entre la intensidad de área y la concentración de cada ácido orgánico.
- Medir los espectrogramas de HPLC de soluciones de muestra mediante la inyección de una parte alícuota de 20 l de la muestra para cada medición.
- Obtener las intensidades de área de las bandas de los ácidos orgánicos en el cromatograma de cada solución de la muestra como se describe anteriormente en el paso 5.5.
- Obtener las concentraciones de los ácidos orgánicos en las soluciones utilizando las ecuaciones correspondientes a las curvas de trabajo obtenidos en el paso 5.6.
- Obtener la cantidad de cada ácido orgánico en cada arándano partir de las concentraciones de la solución de muestra obtenido en la etapa anterior y el volumen total de la solución de muestra (50 ml, véase el paso 3,12).
- Obtener la cantidad de ácido orgánico total en cada arándano mediante la suma de los contenidos de los cuatro ácidos orgánicos.
- Obtener el porcentaje de contenido de ácido orgánico total de cada una de arándanos utilizando el peso medido en el paso 1.3.
6. El tratamiento previo de las mediciones de HPLC de antocianinas
- Mantener los arándanos en un congelador por debajo de -80 ° C listo para análisis químicos si no se analizan inmediatamente después de las mediciones espectrales.
- Secar cada fruta congelados con un liofilizador de vacío durante 12 hr.
- Extraer antocianinas del arándano seca en 1% o solución de metanolf ácido trifluoroacético [peso de arándano (g) / volumen de la solución (ml) = 1/10] dejando la mezcla en un refrigerador a 4 ° C durante 12 hr.
- Centrifugar la solución durante 15 min en un microtubo de 2 ml utilizando una ultracentrífuga a -8 ° C y 15.000 rpm (21.900 xg).
- Filtrar el extracto a través de un filtro de 0,45 micras para obtener la muestra para mediciones de HPLC.
7. Las mediciones de HPLC de antocianinas
Nota: Cerca de 13 antocianinas tipo están incluidas en los arándanos. Puesto que es difícil de obtener curvas de trabajo para todas las antocianinas, una curva de trabajo para el cloruro de O glucósido de cianidina-3- única, una de las antocianinas más populares de arándanos, se obtiene. La curva de trabajo se aplica para cuantificaciones aproximadas de otros antocianinas.
- Medir unos 1,5 mg de cianidina-3- O cloruro de glucósido con precisión, y se disuelven en 10 ml de solución en metanol 1% de ácido trifluoroacético a prepare una solución estándar. Diluir 5 ml de la solución a 10 ml con solución de metanol 1% de ácido trifluoroacético para preparar la segunda soluciones estándar. Del mismo modo, preparar la tercera y la cuarta soluciones estándar secuencialmente.
- Disponer el sistema de HPLC como sigue:
- Utilice una columna de fase inversa C18 en un horno de columna a 40 ° C.
- Aplicar el método del gradiente usando eluidos de 0,1% de ácido trifluoroacético acuoso (eluyen A) y ácido trifluoroacético 0,5% en acetonitrilo (elución B) con la velocidad de flujo de 0,1 ml / min, donde la relación de los aumentos de eluir B de 8% a 15% durante 0-50 min después de la inyección, y de 15% a 75% durante 50 a 60 min después de la inyección.
- Utilizar una matriz de monitoreo fotodiodo detector a 520 nm.
- Medir los espectrogramas de HPLC de soluciones estándar mediante la inyección de una parte alícuota de 10 l para cada medición. "Solución LC" se utiliza como el software para la medición.
- Obtener la intensidad área de la banda decloruro de O glucósido de cianidina-3- en el cromatograma de cada solución estándar haciendo clic en "re-análisis" con el botón derecho del ratón.
- Trazar las intensidades en la zona de las concentraciones correspondientes para obtener la curva de trabajo de cianidina-3- cloruro de O glucósido por la regresión lineal, donde se obtiene la ecuación que representa la relación entre la intensidad y la zona de concentración de cloruro de cianidina-3- O glucósido.
- Medir los espectrogramas de HPLC de soluciones de muestra mediante la inyección de una parte alícuota de 10 l para cada medición.
- Obtener la intensidad área de la banda de cada antocianina en el cromatograma de cada solución de la muestra como se describe anteriormente en el paso 7.4.
- Obtener las concentraciones de las antocianinas en las soluciones utilizando la ecuación correspondiente a la curva de trabajo obtenida en la etapa 7.5.
- Obtener las cantidades de cada antocianina en cada una de arándanos de la concentración obtenida en el anteriorpaso y el volumen total de la solución de muestra utilizado en el paso 6.3.
- Obtener la cantidad total de antocianinas en cada uno de arándano mediante la suma de los contenidos de los trece antocianinas.
- Obtener el porcentaje de contenido de la antocianina total de cada una de arándanos utilizando el peso medido en el paso 1.3.
8. Construcción de modelos de calibración para la Predicción de contenidos de ingrediente
Nota: regresión PLS, 4,5, que es un tipo de técnica de regresión múltiple utilizando variantes latentes, se utiliza para la construcción de modelos de calibración para cada ingrediente de los espectros observados y los contenidos de ingredientes determinados por los análisis químicos. PLS regresión se realiza ya sea con los programas comerciales o con los programas de fabricación casera. Véanse las referencias de 5,10 para los procesos detallados de la construcción de modelos.
- Examinan el que pretratamientos para los espectros observados son los más eficaces para la precisa ypredicción robusta.
- Construir modelos de calibración mediante la aplicación de uno o dos de los siguientes tratamientos previos: MSC (multiplicativo corrección de dispersión), 1,2,5 SNV (estándar normal variable aleatoria), 1,2,5 NMM (Min-Max Normalización), COE (desplazamiento constante eliminación ), y el primero o el segundo cálculo de la derivada por SG (Savitzky-Golay) método. 1,2,5 predecir el contenido de ingredientes de la validación fijar de sus espectros con los modelos construidos.
Nota: En MMN, un espectro se normaliza de modo que los valores máximo y mínimo y se vuelven 0 y 1, respectivamente. En COE, la ordenada de un espectro se desplaza de manera que el valor mínimo se convierte en cero. - Calcular el coeficiente de determinación, R 2, y la desviación residual de predicción, RPD, entre el observado y los valores del conjunto de validación para examinar que pretratamientos para los espectros observados son más eficaces predicho. Elija la combinación de tratamientos previos que dan mayorR2 y RPD.
- Construir modelos de calibración mediante la aplicación de uno o dos de los siguientes tratamientos previos: MSC (multiplicativo corrección de dispersión), 1,2,5 SNV (estándar normal variable aleatoria), 1,2,5 NMM (Min-Max Normalización), COE (desplazamiento constante eliminación ), y el primero o el segundo cálculo de la derivada por SG (Savitzky-Golay) método. 1,2,5 predecir el contenido de ingredientes de la validación fijar de sus espectros con los modelos construidos.
- Examinar qué regiones número de onda son eficaces para la predicción precisa y robusta mediante la aplicación, por ejemplo, en movimiento Escaparates PLS técnica 11 para buscar las regiones efectivas.
Nota: El procedimiento corresponde a la eliminación de las regiones de número de onda, donde los espectros no contienen información eficaz para las predicciones o que contienen información que interfiere con las predicciones.
9. La validación de los modelos de calibración construida
Nota: Véanse las referencias de 5,10 para los procesos detallados de la validación de los modelos construidos.
- Predecir el contenido de ingrediente del conjunto de validación de sus espectros con los modelos de calibración construidas con la mejor combinación de tratamientos previos y para las regiones número de onda eficaces para la predicción. 5,10
- Calcular R2 y RPD entre la observada y predichavalores del conjunto de validación. 5,10
- Examinar si los criterios generales para la realización práctica de los modelos de calibración, 12,13 R2> 0,85 y RPD> 2.5, están satisfechos. Considere la reconstrucción del modelo si los criterios no se cumplen.
Resultados
La figura 2 muestra como ejemplo un conjunto de espectros de absorción NIR de arándanos, donde los espectros de 70 arándanos se muestran simultáneamente. Dado que las bandas definitivamente asignables a los azúcares, ácidos orgánicos, o antocianinas no se observan en los espectros NIR, la ley de Beer-Lambert tradicional no es aplicable para cuantificar el contenido de ingredientes. Por lo tanto, la construcción de modelos para la predicción del contenido de ingr...
Discusión
Aquí se describen algunos comentarios adicionales sobre el protocolo. En primer lugar, en el paso 1.1, se menciona que decidir los cultivares incluidos en el objetivo. Aunque es posible construir modelos que cubren los arándanos de muchos cultivares o sin especificar cultivares, la precisión de predicción con los modelos son a veces mucho más bajos que aquellos con los modelos de un solo cultivar y para cultivares limitados. También hay que señalar que los modelos de calibración deben ser construidos para los ar...
Divulgaciones
We have nothing to disclose.
Agradecimientos
This work was partially supported by the project "A Scheme to Revitalize Agriculture and Fisheries in Disaster Area through Deploying Highly Advanced Technology" of Ministry of Agriculture, Forestry and Fisheries, Japan.
Materiales
| Name | Company | Catalog Number | Comments |
| FT-NIR spectrophotometer | Bruker Optics GmbH | MPA | |
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45000-31, 228-45018-31 | For sugar analysis |
| 223-04500-31, 228-45010-31, 228-45095-31 | Refractive Index Detector | ||
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45003-31, 228-45000-31 | For organic acid analysis |
| 228-45018-31, 228-45010-31, 223-04500-31 | Ultraviolet-Visible Detector | ||
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45018-31, 228-45000-31 | For anthocyanin analysis |
| 228-45012-31, 228-45119-31, 228-45005-31 | Photodiode Array Detector | ||
| 228-45009-31 | |||
| pH meter | Mettler-Toledo | 30019028 | S220, Automatic temperature compensation |
| Ultra-pure water treatment equipment | ORGANO Corporation | ORG-ULXXXM1; PRA-0015-0V0 | PURELAB ultra; PURELITE |
| Biomedical Freezers | SANYO | 2-6780-01 | MDF-U338 |
| Ultra-Low Temperature Freezer | Panasonic healthcare Co.,Ltd. | KM-DU73Y1 | -80 °C |
| Vacuum lyophilizer | IWAKI GLASS Co.,Ltd | 119770 | DRC-3L; FRD-82M |
| Homoginizer | Microtec Co., Ltd. | Physcotron | |
| Ultracentrifuge | Hitachi Koki Co.,Ltd | S204567 | CF15RXII |
| Mini-centrifuge | LMS CO.,LTD. | KN3136572 | MCF-2360 |
| Centrifuge | Kokusan Co.,Ltd | 2-5534-01 | H-103N |
| Filter Paper | Advantec | 1521070 | 5B, Eqivalent to Whatman 40 |
| Sep-Pak C18 column | Waters Corporation Milford | WAT020515 | |
| Sep-Pak CM column | Waters Corporation Milford | WAT020550 | |
| Sep-Pak QMA column | Waters Corporation Milford | WAT020545 | |
| Centrifugal Filter Unit | Merck Millipore Corporation | R2SA18503 | PVDF, 0.45 μm |
| Microtube | As One Corporation | 1-1600-02 | PP, 2 ml |
| Syringe Filter | GE Healthcare CO.,LTD. | 6788-1304 | PP, 0.45 μm |
| Sucrose | Wako Pure Chemical Industries,Ltd | 194-00011 | Reagent-grade |
| Glucose | Wako Pure Chemical Industries,Ltd | 049-31165 | Reagent-grade |
| Fructose | Wako Pure Chemical Industries,Ltd | 123-02762 | Reagent-grade |
| Citric acid | Wako Pure Chemical Industries,Ltd | 036-05522 | Reagent-grade |
| Malic acid | Wako Pure Chemical Industries,Ltd | 355-17971 | Reagent-grade |
| Succinic acid | Wako Pure Chemical Industries,Ltd | 190-04332 | Reagent-grade |
| Quinic acid | Alfa Aesar, A Johnson Matthey Company | 10176328 | Reagent-grade |
| Phosphoric acid | Wako Pure Chemical Industries,Ltd | 162-20492 | HPLC-grade |
| Trifluoroacetic acid | Wako Pure Chemical Industries,Ltd | 208-02746 | Reagent-grade |
| Methanol | Wako Pure Chemical Industries,Ltd | 131-01826 | Reagent-grade |
| Acetonitrile | Wako Pure Chemical Industries,Ltd | 015-08633 | HPLC-grade |
| Grade cyanidin-3-O-glucoside chloride | Wako Pure Chemical Industries,Ltd | 306-37661 | HPLC-grade |
| Software for analyses | Bruker Optics GmbH | OPUS ver. 6.5 | |
| Softoware for preprocessing | Microsoft | Excel powered by Visual Basic for Applications | |
| Software for construction of models | Freemat 4.0 | http://freemat.sourceforge.net/ |
Referencias
- Ozaki, Y., McClure, W. F., Christy, A. A. . Near-infrared Spectroscopy in Food Science and Technology. , (2007).
- Sun, D. W. . Infrared Spectroscopy for Food Quality Analysis and Control. , (2009).
- Bai, W., Yoshimura, N., Takayanagi, M. Quantitative analysis of ingredients of blueberry fruits by near infrared spectroscopy. J. Near Infrared Spectrosc. 22, 357-365 (2014).
- Hasegawa, T., Tasumi, M. . Chemometrics in infrared spectroscopic analysis. In: Introduction to Experimental Infrared Spectroscopy. , 97-113 (2015).
- Varmuza, K., Filzmoser, P. . Introduction to Multivariate Statistical Analysis in Chemometrics. , (2009).
- Kubelka, P. New contributions to the optics of intensely light-scattering materials. Part I. J. Opt. Soc. Am. 38, 448-457 (1948).
- Juang, R. H., Storey, D. E. Quantitative determination of the extent of neutralization of carboxylic acid functionality in carbopol 974P NF by diffuse reflectance fourier transform infrared spectrometry using Kubelka-Munk function. Pharm Res. 15, 1714-1720 (1998).
- Ogiwara, I., Ohtsuka, Y., Yoneda, Y., Sakurai, K., Hakoda, N., Shimura, I. Extraction method by water followed by microwave heating for analyzing sugars in strawberry fruits. J. Jpn. Soc. Hort. Sci. 68, 949-953 (1999).
- Che, J., Suzuki, S., Ishikawa, S., Koike, H., Ogiwara, I. Fruit ripening and quality profile of 64 cultivars in three species of blueberries grown in Tokyo. Hort. Res. (Japan). 8, 257-265 (2009).
- Pomerantsev, A. L. . Chemometrics in Excel. , (2014).
- Jiang, H. J., Berry, R. J., Siesler, H. W., Ozaki, Y. Wavelength Interval Selection in Multicomponent spectral analysis by moving window partial least-squares regression with applications to mid-infrared and near-infrared spectroscopic data. Anal. Chem. 74, 3555-3565 (2002).
- Edney, M. J., Morgan, J. E., Williams, P. C., Campbell, L. D. Analysis of feed barley by near infrared reflectance spectroscopy. J. Near-Infrared Spectrosc. 2, 33-41 (1994).
- Mathison, G. W., et al. Prediction of composition and ruminal degradability characteristics of barley straw by near infrared reflectance spectroscopy. Can. J. Anim. Sci. 79, 519-523 (1999).
- Chiara, F., et al. Analysis of anthocyanins in commercial fruit juices by using nano-liquid chromatography electrospray-mass spectrometry and high performance liquid chromatography with UV-vis detector. J. Separation Sci. 34, 150-159 (2011).
- Li, Q., et al. Antioxidant anthocyanins screening through spectrum-effect relationships and DPPH-HPLC-DAD analysis on nine cultivars of introduced rabbiteye blueberry in China. Food Chemistry. 132, 759-765 (2013).
- Sinelli, N. Evaluation of quality and nutraceutical content of blueberries (Vaccinium corymbosum L.) by near and mid-infrared spectroscopy. Postharvest Biol. Technol. 50, 31-36 (2008).
- Giusti, M. M., Wrolsted, R. E., Wrolstad, R. E., Schwartz, S. J. Anthocyanins: characterization and measurement with UV-visible spectroscopy. Current Protocols in Food Analytical Chemistry. , 1-13 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados