JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
HPLC 측정을 바탕으로 근적외선 분광법에 의한 블루 베리의 성분 내용의 비파괴 예측을위한 모델의 건설
요약
We present here a protocol to construct and validate models for nondestructive prediction of total sugar, total organic acid, and total anthocyanin content in individual blueberries by near-infrared spectroscopy.
초록
Nondestructive prediction of ingredient contents of farm products is useful to ship and sell the products with guaranteed qualities. Here, near-infrared spectroscopy is used to predict nondestructively total sugar, total organic acid, and total anthocyanin content in each blueberry. The technique is expected to enable the selection of only delicious blueberries from all harvested ones. The near-infrared absorption spectra of blueberries are measured with the diffuse reflectance mode at the positions not on the calyx. The ingredient contents of a blueberry determined by high-performance liquid chromatography are used to construct models to predict the ingredient contents from observed spectra. Partial least squares regression is used for the construction of the models. It is necessary to properly select the pretreatments for the observed spectra and the wavelength regions of the spectra used for analyses. Validations are necessary for the constructed models to confirm that the ingredient contents are predicted with practical accuracies. Here we present a protocol to construct and validate the models for nondestructive prediction of ingredient contents in blueberries by near-infrared spectroscopy.
서문
근적외선 (NIR) 분광 널리 다양한 종류의 과일의 내용과 야채를 분석하는 비파괴 기법으로 적용됩니다. 1, 2 비파괴은 보장 품질 만 맛있는 과일과 채소의 운송을 가능하게 NIR 분광법으로 분석한다. NIR 분광법 등 이미 오렌지, 사과, 멜론, 체리, 키위, 망고, 파파야, 복숭아에 적용된 등 총 당 함량에 대응하는 자신의 당도, 산도, TSC (총 고체 함량)를 알아야하고, . 최근에는. 베리의 품질 평가 NIR 스펙트럼의 적용을보고 3 우리는 전체 당도 및 산도에 대응하는 총 유기 산 함량뿐만 아니라 총 안토시아닌 함량뿐만 아니라 측정 하였다. 안토시아닌은 인간의 건강을 개선하기 위해 생각하는 생리 활성 구성 요소입니다. 그들이 당도, 교류의 확신 맛있는 블루 베리를 구입할 수 있다면 그것은 소비자를위한 편리가 상한 및 안토시아닌 함량.
과일과 야채의 근적외선 흡수 스펙트럼에서, 단지 넓은 흡수 밴드가 관찰된다. 그들은 주로 섬유와 수분에 의한 밴드입니다. 인해 비 이것을 파괴 대상의 여러 성분 많은 약한 밴드가 동시에 관찰되지만, 관찰 된 밴드는 대부분의 경우, 대상의 특정 구성 요소의 특정 진동 모드에 할당 될 수 없다. 따라서, 램버트 - 비어의 법칙을 이용하여 특정 성분의 함량을 측정하는 기존의 기술은 NIR 스펙트럼은 유효하지 않다. 대신, 캘리브레이션 모델은 관찰 된 스펙트럼과 스펙트럼에 대응하는 성분 함량 사이의 상관 관계를 검토하여 chemometrics를 이용하여 구성하는 관찰 된 스펙트럼에서 대상 부품의 내용을 예측할. 4,5 여기서, 프로토콜 구성 및 모델을 확인하는 총당의 예측 총 유기산 함유량 acidi 대응타이 및 NIR 스펙트럼에서 블루 베리의 총 안토시아닌 함량이 표시됩니다.
그림 1은 안정적이고 강력한 보정 모델을 구축 할 수있는 일반적인 흐름도를 보여줍니다. 충분한 수의 샘플을 수집됩니다. 다른 구성은 모델의 검증을 위해 사용되는 동안 그들의 일부는 모델의 구성에 사용된다. 수집 된 각각의 시료를 들어, NIR 스펙트럼을 측정하고, 다음 피 처리 성분이 파괴 전통적인 화학 분석법으로 정량한다. 여기서, 고속 액체 크로마토 그래피 (HPLC)는 당, 유기산 및 안토시아닌의 화학적 분석에 사용된다. 부분 최소 제곱은 (PLS) 회귀 분석 화학에 의해 결정되는 관찰 된 스펙트럼 성분과 함량 사이의 상관 관계가 조사 분석 캘리브레이션 모델의 구성에 사용된다. 강력한 최선의 예측 능력을 가진 모델, obser의 전처리를 구축하기 위해VED 스펙트럼 및 상기 예측에 이용되는 파장 영역은 또한 관찰된다. 마지막으로, 구성 모델들은 충분한 예측 능력을 확인하기 위해 확인됩니다. 검증에서, 내용이 화학 분석 (관측 값)에 따라 결정 내용을 비교 구성된 모델 (예측값)에 의해 관측 된 스펙트럼으로부터 예측. 충분한 상관 관계가 관찰 예측 값 사이에서 찾을 수 없으면, 충분한 상관이 얻어 질 때까지 상기 보정 모델을 재 구축한다. 이 도면 (외부 검증)에 나타낸 바와 같이이 모델의 구축 및 검증을위한 샘플들의 서로 다른 그룹을 사용하는 것이 바람직하지만, 동일한 그룹의 샘플 구성 및 검증 (교차 검증) 모두를 사용하는 경우의 수 샘플은 충분하지 않다.
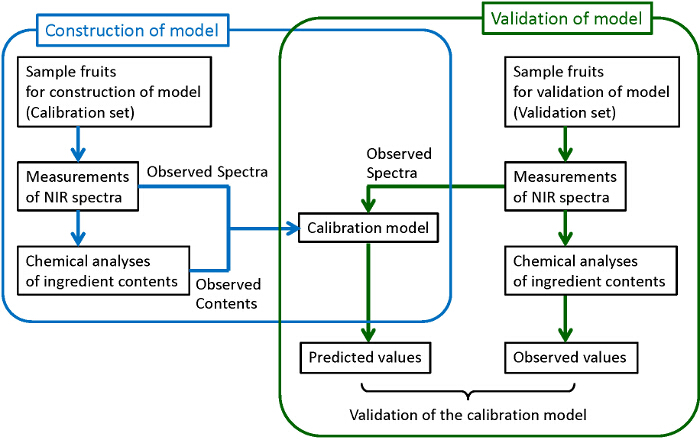
에프교정 모델의 건설 및 검증을위한 igure 1. 플로우 차트. 파란색과 녹색 선으로 둘러싸인 절차는 교정 모델과 그 검증의 건설에 각각 해당합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
샘플 1. 컬렉션
- 교정 모델의 대상에 포함되는 품종을 결정합니다.
- 충분한 수의 대상 품종의 샘플 블루 베리의 다양한 종류를 수집합니다.
- 구축 된 모델의 검증을 위해 바람직하게는 100 보정 모델의 건설을위한 블루 베리, 적어도 10를 수집합니다. 견고한 모델을 구축하기 위해, 다양한 색상, 크기 및 숙성의 다양한 조건, 즉 다양한 유형의 샘플을 수집한다.
- 각 블루 베리 무게. 주 : 측정 된 무게는 각각의 베리의 성분 함량 %의 계산을 위해 나중에 사용된다.
스펙트럼 2. 측정
- 워밍업 측정하기 전에 분광 광도계 충분히 (이상 1 시간)은 신뢰할 수있는 스펙트럼을 얻을 수 있습니다.
- 분광 광도계를 설정합니다. 조건이 모든 측정을 통해 일정 확인합니다.측정을위한 일반적인 조건의 예는 아래와 같습니다.
- 12,500-3,600 cm로 측정 범위를 설정 -1.
- 16cm에 스펙트럼 해상도를 설정 -1.
- 32 배에 축적를 설정합니다.
- 측정 모드로 확산 반사율을 선택합니다.
- 확산 반사율 측정을위한 분광 광도계의 창에 표준 반사판을 넣습니다. 은 "배경 단일 채널"명령을 사용하여 자동으로 측정 한 후 시료 베리의 스펙트럼에서 상대 반사율 스펙트럼을 계산에 사용되는 배경 스펙트럼을 측정한다.
- 확산 반사율을 측정하기위한 분광 윈도우의 중심에 베리 샘플을 넣어. "샘플 단일 채널"명령을 사용하여, 바람직하게는 과일의 여러 지점에서 각 베리의 스펙트럼을 측정한다.
참고 : Kubelka-Munk은 변환 6,7도 자동으로 수행됩니다샘플 블루 베리의 관찰 된 스펙트럼에 대한 matically은 스펙트럼 취득의 조건이 그렇게하도록 설정되어있는 경우. Kubelka-Munk은 변환은 송신 모드에서 측정 한 고정밀 스펙트럼 분석에 필요한 동등한 스펙트럼을 확산 반사율 모드로 측정 한 스펙트럼을 바꾼다. 흡광도 규모의 스펙트럼 분석에 사용된다. - 베리 샘플의 스펙트럼이 여러 지점에서 측정하는 경우와 같은 MS 엑셀과 같은 데이터 처리 프로그램을 사용하여 각 샘플의 스펙트럼의 평균 스펙트럼을 구한다. 분석에 대한 평균 스펙트럼을 사용합니다.
당류 및 유기산 (8)의 HPLC 측정 3. 전처리
주 : 다음 초순수 물에 가용성 인 당 및 각 베리의 유기산을 추출한다. 각 블루 베리의 전체를 분석하는 데 사용됩니다.
- FO 아래 -30 ° C 준비 냉동실에 블루 베리 유지그들은 단지 스펙트럼 측정 후 분석하지 않으면 R 화학 분석.
- 이 쉽게 다음 단계 균질화 될 수 있도록 여러 부분으로 베리 잘라. 이 동결 될 때 해동하지 않고 블루 베리를 잘라.
- 50 ml의 비이커에 조각을 넣어.
- 약 추가 초순수 비커에 (그 전기 전도도가 0.1 μS / cm이다 증류수) 10 ㎖.
- 분석 중에 당류를 분해 할 수있는 효소를 비활성화하기 위해 20 초 동안 전자 레인지에서 초순수에 절단 베리 가열한다.
- 비커에 약을 초순수 물 10ml를 추가합니다.
- 표준 축과 발전기를 구비 한 균질기로 12,000 rpm에서 5 분간 혼합 균일화.
- 3000 RPM (2000 × g에서)에서 10 분 동안 균질 혼합물을 원심 분리기.
- 5B 종이 필터를 사용하여 원심 분리 된 샘플을 진공 여과에 의해 여과 액을 모은다.
- 일에 두 번 단계 3.6-3.9를 반복즉 여과 잔사 모든 당 및 유기산을 수집하고, 여액 전부를 조합한다.
- 여액의 pH를 측정하고, 묽은 염산 (0.1 몰 및 0.01 L-1) 7로 조정하고 수산화 나트륨 (0.1 내지 0.01 몰 L-1)의 수용액을 희석.
- 초순수 50ml로 여과 액을 희석.
- 두에 샘플을 나누어; 당 분석 및 유기산의 분석을위한 다른 하나.
- 안료, 양이온과 음이온을 배제하기 위해 직렬로 접속 된 열을 통해 제 1 샘플 용액 (두 C18, CM 및 QMA)를 통과한다. 열에서 시료 용액의 제 1 ml에 버린다. 이어서 HPLC에 의한 당의 분석 컬럼에서 샘플 용액을 사용한다.
- 안료 및 양이온을 제외 직렬 접속 열 (두 C18 및 CM)을 통해 제 2 샘플 용액을 전달한다. 열에서 시료 용액의 제 1 ml에 버린다. 다음 C에서 샘플 솔루션을 사용HPLC에 의한 유기산의 분석 olumns.
- 원심 HPLC에 의한 분석 전에 소형 원심 분리기와 0.45 μm의 필터를 구비 한 마이크로 튜브에서 10 분 동안 6,600 RPM (5800 × g에서)에서의 각 단계에서 용액 3.14 및 3.15.
설탕 4. HPLC 측정
참고 : 본 연구에서, 수 크로스, 글루코스, 각 베리의 과당의 합계 함량이 총 당 함량으로 간주한다. 따라서, 세 당의 각 작업 곡선은 제 수득하고 각 베리의 당 합계 함유량이 얻어진다. 표준 내용은 0.3-0.4 중량 % (자당), 3.8-4.8 중량 % (포도당), 및 4.2-5.3 중량 % (과당)로보고됩니다. (9)
- 정확하게 자당 약 200 mg을 측정하고, 표준 용액을 제조 50ml의 초순수에 용해. 제 표준액을 조제 초순수 50ml로 용액 5 mL를 희석. 마찬가지로 세 번째 스탠드를 준비두 번째 표준 용액에서 ARD 솔루션입니다.
- 유사하게, 포도당과 과당의 표준 용액을 준비합니다.
- 다음과 같은 HPLC 시스템을 배열 :
- 40 ° C에서 열 오븐 겔 투과 컬럼을 사용한다.
- 용출액을 0.1 ml / 분의 유량으로 탈기 된 초순수를 사용한다.
- 굴절률 검출기를 사용합니다.
- 각 측정을위한 20 μL 나누어지는을 주입하여 표준 용액의 HPLC 스펙트로 그램을 측정합니다. 참고 : 여기에, PAC 솔루션은 측정을위한 소프트웨어로 사용됩니다.
- 마우스 오른쪽 버튼으로 '재 해석'을 클릭하여 각 표준 용액의 크로마토 그램에 설탕의 밴드의 면적 강도를 가져옵니다.
- 면적 강도와 농도의 관계를 나타내는 식을 구한다 fo를 선형 회귀 분석에 의해 각각의 설탕 작업 곡선을 얻기 위해 해당 농도 대 면적 강도를 플롯각 당 r에.
- 각 측정을위한 20 μL 나누어지는을 주입하여 시료 용액의 HPLC의 스펙트로 그램을 측정합니다.
- 이전 단계 4.5에 기재된 바와 같이, 각 샘플 용액의 크로마토 그램 당의 대역의 면적 강도를 얻을.
- 단계 4.6에서 얻어진 작업 곡선에 해당하는 방정식을 사용하여 솔루션에서 설탕의 농도를 얻습니다.
- 이전 단계 및 샘플 용액의 총 부피에서 얻어진 시료 용액의 농도로부터 각 베리 각 설탕의 양을 구하는 (단계 50 ㎖ 3.12 참조).
- 세 설탕의 내용을 합산하여 각 과일의 총 설탕의 양을 얻습니다.
- 단계 130에서 측정 된 무게를 이용하여 각 베리의 총 당 함량의 퍼센트를 얻었다.
유기산 5. HPLC 측정
참고 : 본 연구에서는, 시트르산, 퀴닌 산의 합계 함유량, 말산산 및 숙신산은 총 유기 산 함량으로 간주한다. 따라서, 네 유기산 각 작업 곡선은 제 수득하고 각 베리의 유기산 함유량을 측정한다. 표준 콘텐츠는 0.42-0.62 중량 % (구연산) 0-0.15 중량 % (닉산), 0.08-0.23 중량 % (말산) 및 0.06-0.25 중량 % (숙신산)로보고한다. (9)
- 정확하게 시트르산 5mg 정도를 측정하고, 표준 용액을 제조 50ml의 초순수로 용해. 제 표준액을 조제 초순수 50ml로 용액 5 mL를 희석. 마찬가지로 두 번째 표준 용액에서 세 번째 표준 용액을 준비합니다.
- 마찬가지로, 퀴닌 산, 말산, 숙신산의 표준 용액을 준비한다.
- 다음과 같은 HPLC 시스템을 배열 :
- 40 ° C의 열 오븐 내에서 직렬로 연결된 두 개의 음이온 교환 컬럼을 사용한다.
- 사용 인산의 0.1 % 수용액을 탈기용출액을 0.02 ㎖ / 분의 유속으로 산.
- 210 nm의 자외선 - 가시 광선 검출기 세트를 사용합니다.
- 각 측정을위한 표준 용액 20 μL 나누어지는을 주입하여 표준 용액의 HPLC 스펙트로 그램을 측정합니다.
- 마우스 오른쪽 버튼으로 '재 해석'을 클릭하여 각 표준 용액의 크로마토 그램에 유기산의 밴드의 면적 강도를 가져옵니다.
- 면적 강도와 농도의 관계를 나타내는 수학 식을 각각의 유기산에 대해 획득되는 선형 회귀 분석에 의해 각각의 유기산의 작업 곡선을 얻기 위해 해당 농도 대 면적 강도를 플롯.
- 각 측정 용 샘플의 20 μL 분취를 주입하여 시료 용액의 HPLC의 스펙트로 그램을 측정한다.
- 단계 5.5에서 상술 한 바와 같이, 각 샘플 용액의 크로마토 그램에 유기산의 밴드의 면적 강도를 얻을.
- 단계 5.6에서 얻어진 작업 곡선에 대응하는 방정식을 이용하여 용액에 유기산의 농도를 얻었다.
- 이전 단계 및 샘플 용액의 총 부피에서 얻어진 시료 용액의 농도로부터 각 베리 각 유기산의 양을 구하는 (단계 50 ㎖ 3.12 참조).
- 네 유기산의 내용을 합산함으로써 각 베리 총 유기산의 양을 얻었다.
- 단계 130에서 측정 된 무게를 이용하여 각 베리 총 유기산의 함량 백분율을 얻었다.
안토시아닌의 HPLC 측정 6. 전처리
- 그들은 단지 스펙트럼 측정 후 분석하지 않는 경우 화학 물질에 대한 아래 -80 ° C 준비 냉동실에 블루 베리를 계속 분석.
- 12 시간 동안 진공 동결 건조기 각 냉동 과일을 건조.
- 1 % 메탄올 용액 오에있는 말린 블루 베리의 안토시아닌을 추출F 트리 플루오로 아세트산 [베리 (g)의 중량이 용액의 / 부피 (㎖) = 1/10] 12 시간 동안 4 ℃의 냉장고에 두어 혼합물.
- 원심 분리기 C와 15,000 RPM (21,900 × g) ° 초 원심 분리기에서를 -8 사용하여 2 ml의 마이크로 튜브에 15 분의 추출물.
- HPLC 측정을위한 샘플을 얻기 위하여 0.45 μm의 필터로 추출 필터.
안토시아닌 7. HPLC 측정
참고 : 약 13 종류의 안토시아닌은 블루 베리에 포함되어 있습니다. 그것은 모든 안토시아닌 위해 작동 곡선을 얻는 것이 곤란하기 때문에, 단지 시아 -3- O의 -glucoside 클로라이드 작업 곡선, 블루에서 가장 인기 안토시아닌 중 하나가 얻어진다. 작업 곡선은 다른 안토시아닌의 대략적인 정량화 적용됩니다.
- PR 정확하게 시아 -3- O의 -glucoside 클로라이드 1.5 mg을 측정하고, 트리 플루오로 아세트산, 1 % 메탄올 용액을 10mL로 용해표준 용액 epare. 제 표준 용액을 제조 트리 플루오로 아세트산, 1 % 메탄올 용액 10 ml의 용액 5 ㎖를 희석. 이와 유사하게, 세 번째와 네 번째의 표준 용액을 순차적으로 준비한다.
- 다음과 같은 HPLC 시스템을 배열 :
- 40 ° C에서 열 오븐에서 C18 역상 컬럼을 사용합니다.
- 0.1 ㎖ / 분의 유량과 아세토 니트릴 (용출 B)을 0.1 % 수성 트리 플루오로 아세트산 (용출 A) 및 0.5 % 트리 플루오로 아세트산 용출액을 이용한 구배 법 적용되는 경우 8 % 내지 15 %로 용출 B 증가 비율 0-50 분 주입 후에, 상기 주입 후 50 ~ 60 분 동안 75 %에서 15 % 중.
- 520 nm에서 포토 다이오드 어레이 검출기 모니터링을 사용한다.
- 각 측정을위한 10 μL 나누어지는을 주입하여 표준 용액의 HPLC 스펙트로 그램을 측정합니다. "LC 용액의"측정 소프트웨어로서 사용된다.
- 대역의 면적 강도를 얻을 수마우스 오른쪽 버튼으로 '재 해석'을 클릭하여 각 표준 용액의 크로마토 그램에 시아 니딘 -3- O의 -glucoside 염화.
- 면적 강도와 농도의 관계를 나타내는 수학 식이 시아 -3- O의 -glucoside 클로라이드 수득 된 선형 회귀에 의해 시아 -3- O의 -glucoside 클로라이드 작업 곡선을 얻기 위해 해당 농도 대 면적 강도를 플롯.
- 각 측정을위한 10 μL 나누어지는을 주입하여 시료 용액의 HPLC의 스펙트로 그램을 측정합니다.
- 이전 단계 7.4에 기재된 바와 같이, 각 샘플 용액의 크로마토 그램의 각 안토시아닌 밴드의 면적 강도를 얻을.
- 단계 7.5에서 얻어진 작업 곡선에 대응하는 방정식을 사용하여 용액의 안토시아닌의 농도를 구합니다.
- 이전에 얻어진 농도에서 각 베리 각 안토시아닌의 양을 구하는단계 6.3 단계에 사용되는 시료 액의 총 부피.
- 열세 안토시아닌의 내용을 합산하여 각 블루 베리의 안토시아닌의 총량을 얻습니다.
- 단계 130에서 측정 된 무게를 이용하여 각 베리의 총 안토시아닌의 함량 백분율을 얻었다.
성분 내용의 예측에 대한 교정 모델 8. 건설
주 : PLS 회귀 잠상 변형하여 회귀 기법의 종류 4,5 관측 된 스펙트럼 및 화학 분석에 의해 결정되는 성분 함량의 각 성분에 대한 보정 모델의 구성에 사용된다. PLS 회귀는 상용 프로그램 또는 집에서 만든 프로그램 중 하나를 수행합니다. 모델의 건설의 세부 프로세스에 대한 참조의 5, 10을 참조하십시오.
- 관찰 된 스펙트럼에 대한 전처리 정확한을위한 가장 효과적인 검사 및강력한 예측.
- 다음 전처리 중 하나 또는 두 개의 적용하여 보정 모델을 구축 : MSC (곱하기 분산 보정), 1,2,5 SNV (표준 정규 변량), 1,2,5 MMN (최소 - 최대 정상화를) COE (상수는 제거 오프셋 ), 제 1 또는 SG에 의해 제 2 미분 연산 (Savitzky-골 레이) 방법. 1,2,5 구성된 모델들은 스펙트럼에서 설정할 검증의 성분의 콘텐츠를 예측한다.
주 : 최소 및 최대 값은 각각 0과 1이되도록 MMN에서, 스펙트럼 정규화된다. 최소 값이 0이되도록 COE에서, 스펙트럼의 종축이 시프트된다. - 관찰과 관찰 된 스펙트럼이 가장 효과적인위한 전처리하는 검사 설정 유효성 검사의 값을 예측 사이에 결정, R 2, 및 잔여 예측 편차, RPD의 계수를 계산합니다. 더주는 전처리의 조합을 선택R 2 및 RPD.
- 다음 전처리 중 하나 또는 두 개의 적용하여 보정 모델을 구축 : MSC (곱하기 분산 보정), 1,2,5 SNV (표준 정규 변량), 1,2,5 MMN (최소 - 최대 정상화를) COE (상수는 제거 오프셋 ), 제 1 또는 SG에 의해 제 2 미분 연산 (Savitzky-골 레이) 방법. 1,2,5 구성된 모델들은 스펙트럼에서 설정할 검증의 성분의 콘텐츠를 예측한다.
- 유효 영역을 검색, 파수 영역은 예를 들어, 적용하여 정확하고 강력한 예측을위한 효율적인있는 이동 - 창 PLS 기술 (11)를 검사합니다.
참고 :이 절차는 스펙트럼 예측에 대한 효과적인 정보를 포함하거나 예측을 방해하는 정보를 포함 파수 영역을 제거에 해당합니다.
구축 된 교정 모델의 9 검증
참고 : 구성 모델의 검증의 세부 프로세스에 대한 참조를 5, 10을 참조하십시오.
- 전처리 및 예측에 유효한 파수 영역에 대한 최적의 조합으로 구성된 교정 모델과 함께 자신의 스펙트럼에서 설정 한 검증의 성분 내용을 예측한다. 5, 10을
- 관측 및 예측과 R 2 및 RPD를 계산검증 세트의 값. 5, 10
- 교정 모델의 실제 성능, 12, 13 R의 일반 기준 2> 0.85 및 RPD> 2.5, 만족 여부를 검사합니다. 기준을 만족하지 않는 경우 모델의 재구성을 고려하십시오.
결과
예를 들어, 블루 베리 (70)의 스펙트럼을 동시에 나타낸다 베리의 근적외선 흡수 스펙트럼의 집합이 보여 도표. 당분, 유기산, 또는 안토시아닌에 확실히 할당 대역은 NIR 스펙트럼에서 관찰되지 않기 때문에, 기존의 램버트 - 비어의 법칙은 성분 함량을 정량화하기 위해 적용 할 수 없습니다. 따라서, 내용물의 성분 예측 모델의 구축이 필요하?...
토론
프로토콜에 대한 몇 가지 추가 의견은 여기에 설명되어 있습니다. 먼저, 단계 1.1, 대상에 포함 된 품종을 결정하는 언급된다. 이 많은 품종 또는 품종을 지정하지 않고 블루 베리를 포함하는 모델을 구축 할 수 있지만, 모델 예측 정확도는 때때로 단일 품종의 모델보다 제한된 품종 훨씬 낮다. 또한 캘리브레이션 모델은 상이한 생산 현장에서 수확 블루 베리, 예측 성능에 영향을 미치는 다른 특성?...
공개
We have nothing to disclose.
감사의 말
This work was partially supported by the project "A Scheme to Revitalize Agriculture and Fisheries in Disaster Area through Deploying Highly Advanced Technology" of Ministry of Agriculture, Forestry and Fisheries, Japan.
자료
| Name | Company | Catalog Number | Comments |
| FT-NIR spectrophotometer | Bruker Optics GmbH | MPA | |
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45000-31, 228-45018-31 | For sugar analysis |
| 223-04500-31, 228-45010-31, 228-45095-31 | Refractive Index Detector | ||
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45003-31, 228-45000-31 | For organic acid analysis |
| 228-45018-31, 228-45010-31, 223-04500-31 | Ultraviolet-Visible Detector | ||
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45018-31, 228-45000-31 | For anthocyanin analysis |
| 228-45012-31, 228-45119-31, 228-45005-31 | Photodiode Array Detector | ||
| 228-45009-31 | |||
| pH meter | Mettler-Toledo | 30019028 | S220, Automatic temperature compensation |
| Ultra-pure water treatment equipment | ORGANO Corporation | ORG-ULXXXM1; PRA-0015-0V0 | PURELAB ultra; PURELITE |
| Biomedical Freezers | SANYO | 2-6780-01 | MDF-U338 |
| Ultra-Low Temperature Freezer | Panasonic healthcare Co.,Ltd. | KM-DU73Y1 | -80 °C |
| Vacuum lyophilizer | IWAKI GLASS Co.,Ltd | 119770 | DRC-3L; FRD-82M |
| Homoginizer | Microtec Co., Ltd. | Physcotron | |
| Ultracentrifuge | Hitachi Koki Co.,Ltd | S204567 | CF15RXII |
| Mini-centrifuge | LMS CO.,LTD. | KN3136572 | MCF-2360 |
| Centrifuge | Kokusan Co.,Ltd | 2-5534-01 | H-103N |
| Filter Paper | Advantec | 1521070 | 5B, Eqivalent to Whatman 40 |
| Sep-Pak C18 column | Waters Corporation Milford | WAT020515 | |
| Sep-Pak CM column | Waters Corporation Milford | WAT020550 | |
| Sep-Pak QMA column | Waters Corporation Milford | WAT020545 | |
| Centrifugal Filter Unit | Merck Millipore Corporation | R2SA18503 | PVDF, 0.45 μm |
| Microtube | As One Corporation | 1-1600-02 | PP, 2 ml |
| Syringe Filter | GE Healthcare CO.,LTD. | 6788-1304 | PP, 0.45 μm |
| Sucrose | Wako Pure Chemical Industries,Ltd | 194-00011 | Reagent-grade |
| Glucose | Wako Pure Chemical Industries,Ltd | 049-31165 | Reagent-grade |
| Fructose | Wako Pure Chemical Industries,Ltd | 123-02762 | Reagent-grade |
| Citric acid | Wako Pure Chemical Industries,Ltd | 036-05522 | Reagent-grade |
| Malic acid | Wako Pure Chemical Industries,Ltd | 355-17971 | Reagent-grade |
| Succinic acid | Wako Pure Chemical Industries,Ltd | 190-04332 | Reagent-grade |
| Quinic acid | Alfa Aesar, A Johnson Matthey Company | 10176328 | Reagent-grade |
| Phosphoric acid | Wako Pure Chemical Industries,Ltd | 162-20492 | HPLC-grade |
| Trifluoroacetic acid | Wako Pure Chemical Industries,Ltd | 208-02746 | Reagent-grade |
| Methanol | Wako Pure Chemical Industries,Ltd | 131-01826 | Reagent-grade |
| Acetonitrile | Wako Pure Chemical Industries,Ltd | 015-08633 | HPLC-grade |
| Grade cyanidin-3-O-glucoside chloride | Wako Pure Chemical Industries,Ltd | 306-37661 | HPLC-grade |
| Software for analyses | Bruker Optics GmbH | OPUS ver. 6.5 | |
| Softoware for preprocessing | Microsoft | Excel powered by Visual Basic for Applications | |
| Software for construction of models | Freemat 4.0 | http://freemat.sourceforge.net/ |
참고문헌
- Ozaki, Y., McClure, W. F., Christy, A. A. . Near-infrared Spectroscopy in Food Science and Technology. , (2007).
- Sun, D. W. . Infrared Spectroscopy for Food Quality Analysis and Control. , (2009).
- Bai, W., Yoshimura, N., Takayanagi, M. Quantitative analysis of ingredients of blueberry fruits by near infrared spectroscopy. J. Near Infrared Spectrosc. 22, 357-365 (2014).
- Hasegawa, T., Tasumi, M. . Chemometrics in infrared spectroscopic analysis. In: Introduction to Experimental Infrared Spectroscopy. , 97-113 (2015).
- Varmuza, K., Filzmoser, P. . Introduction to Multivariate Statistical Analysis in Chemometrics. , (2009).
- Kubelka, P. New contributions to the optics of intensely light-scattering materials. Part I. J. Opt. Soc. Am. 38, 448-457 (1948).
- Juang, R. H., Storey, D. E. Quantitative determination of the extent of neutralization of carboxylic acid functionality in carbopol 974P NF by diffuse reflectance fourier transform infrared spectrometry using Kubelka-Munk function. Pharm Res. 15, 1714-1720 (1998).
- Ogiwara, I., Ohtsuka, Y., Yoneda, Y., Sakurai, K., Hakoda, N., Shimura, I. Extraction method by water followed by microwave heating for analyzing sugars in strawberry fruits. J. Jpn. Soc. Hort. Sci. 68, 949-953 (1999).
- Che, J., Suzuki, S., Ishikawa, S., Koike, H., Ogiwara, I. Fruit ripening and quality profile of 64 cultivars in three species of blueberries grown in Tokyo. Hort. Res. (Japan). 8, 257-265 (2009).
- Pomerantsev, A. L. . Chemometrics in Excel. , (2014).
- Jiang, H. J., Berry, R. J., Siesler, H. W., Ozaki, Y. Wavelength Interval Selection in Multicomponent spectral analysis by moving window partial least-squares regression with applications to mid-infrared and near-infrared spectroscopic data. Anal. Chem. 74, 3555-3565 (2002).
- Edney, M. J., Morgan, J. E., Williams, P. C., Campbell, L. D. Analysis of feed barley by near infrared reflectance spectroscopy. J. Near-Infrared Spectrosc. 2, 33-41 (1994).
- Mathison, G. W., et al. Prediction of composition and ruminal degradability characteristics of barley straw by near infrared reflectance spectroscopy. Can. J. Anim. Sci. 79, 519-523 (1999).
- Chiara, F., et al. Analysis of anthocyanins in commercial fruit juices by using nano-liquid chromatography electrospray-mass spectrometry and high performance liquid chromatography with UV-vis detector. J. Separation Sci. 34, 150-159 (2011).
- Li, Q., et al. Antioxidant anthocyanins screening through spectrum-effect relationships and DPPH-HPLC-DAD analysis on nine cultivars of introduced rabbiteye blueberry in China. Food Chemistry. 132, 759-765 (2013).
- Sinelli, N. Evaluation of quality and nutraceutical content of blueberries (Vaccinium corymbosum L.) by near and mid-infrared spectroscopy. Postharvest Biol. Technol. 50, 31-36 (2008).
- Giusti, M. M., Wrolsted, R. E., Wrolstad, R. E., Schwartz, S. J. Anthocyanins: characterization and measurement with UV-visible spectroscopy. Current Protocols in Food Analytical Chemistry. , 1-13 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유