É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Construção de Modelos de Previsão Nondestructive de Conteúdos ingrediente em mirtilos por espectroscopia no infravermelho próximo com base em medições de HPLC
Neste Artigo
Resumo
We present here a protocol to construct and validate models for nondestructive prediction of total sugar, total organic acid, and total anthocyanin content in individual blueberries by near-infrared spectroscopy.
Resumo
Nondestructive prediction of ingredient contents of farm products is useful to ship and sell the products with guaranteed qualities. Here, near-infrared spectroscopy is used to predict nondestructively total sugar, total organic acid, and total anthocyanin content in each blueberry. The technique is expected to enable the selection of only delicious blueberries from all harvested ones. The near-infrared absorption spectra of blueberries are measured with the diffuse reflectance mode at the positions not on the calyx. The ingredient contents of a blueberry determined by high-performance liquid chromatography are used to construct models to predict the ingredient contents from observed spectra. Partial least squares regression is used for the construction of the models. It is necessary to properly select the pretreatments for the observed spectra and the wavelength regions of the spectra used for analyses. Validations are necessary for the constructed models to confirm that the ingredient contents are predicted with practical accuracies. Here we present a protocol to construct and validate the models for nondestructive prediction of ingredient contents in blueberries by near-infrared spectroscopy.
Introdução
Infravermelho próximo (NIR) é amplamente aplicada como uma técnica não destrutiva para analisar o conteúdo de frutas e vegetais de vários tipos. Analisa 1,2 Nondestructive por espectroscopia NIR habilitar o envio de apenas deliciosas frutas e vegetais com qualidades garantidas. espectroscopia NIR já foi aplicada ao laranja, maçã, melancia, cereja, fruta de kiwi, manga, papaia, pêssego e assim por diante para saber o seu Brix que corresponde ao teor total de açúcar, acidez, TSC (teor de sólidos totais), e assim por diante . Recentemente, relatou a aplicação da espectroscopia NIR para a avaliação de mirtilos qualidade. 3 Medimos não só o teor de açúcares totais e o teor de ácido orgânico total correspondente à acidez, mas também o conteúdo de antocianina total. A antocianina é um componente bioactivo que se crê melhorar a saúde humana. É conveniente para os consumidores se eles podem comprar deliciosos blueberries com uma garantia de seu teor de açúcar, acidity e teor de antocianinas.
Em NIR espectro de absorção de frutas e legumes, apenas largas bandas de absorção são observados. Eles são principalmente as bandas devido à fibra e à humidade. Embora muitas bandas fracas devido a vários ingredientes de o alvo não-destruído são observados simultaneamente, as bandas observadas não podem ser atribuídos a modos de vibração específicos de componentes específicos do alvo, na maioria dos casos. Portanto, a técnica tradicional para determinar o teor de um componente específico utilizando a lei de Lambert-Beer não é eficaz para espectros NIR. Em vez disso, modelos de calibração para prever o conteúdo dos componentes alvo a partir dos espectros observados são construídos utilizando quimiometria por examinar a correlação entre o espectro observado e o conteúdo de ingrediente correspondentes aos espectros de 4,5. Aqui, um protocolo para a construção e validar os modelos para a previsão de teor de açúcares totais, teor de ácido orgânico total correspondente ao ACIDIty, e teores de antocianinas totais de mirtilos de espectros NIR é apresentado.
A Figura 1 mostra o fluxograma geral para a construção de modelos de calibração confiáveis e robustas. Amostras de número suficiente são coletados. Alguns deles são utilizados para a construção de modelos enquanto os outros são utilizados para a validação dos modelos construídos. Para cada uma das amostras recolhidas, um espectro de NIR é medida, e em seguida, os componentes alvo são analisados quantitativamente com os métodos de análise química destrutivas tradicionais. Aqui, cromatografia líquida de alta eficiência (HPLC) é utilizada para as análises químicas de açúcares, ácidos orgânicos, e antocianinas. mínimos quadrados parciais (PLS) A regressão é usada para a construção de modelos de calibração em que a correlação entre o espectro observado e o conteúdo de ingrediente determinado por análise química é examinada. A fim de construir modelos robustos com a melhor capacidade de previsão, os pré-tratamentos de observed espectros e os comprimentos de onda utilizados para a predição são também examinados. Por fim, os modelos construídos são validados para confirmar a sua capacidade de previsão suficiente. Na validação, o conteúdo previsto a partir do espectro observado pelo modelo construído (valores previstos) são comparados com o conteúdo determinado pelas análises químicos (valores observados). Se a correlação suficiente não pode ser encontrada entre os valores previstos e observados, o modelo de calibração deve ser re-construída até que seja obtida a correlação suficiente. Embora seja preferível utilizar diferentes grupos de amostras para a construção e a validação de um modelo, como mostrado nesta figura (validação externa), amostras em um mesmo grupo são usados tanto para a construção e a validação (validação cruzada) quando o número de amostras não é grande o suficiente.
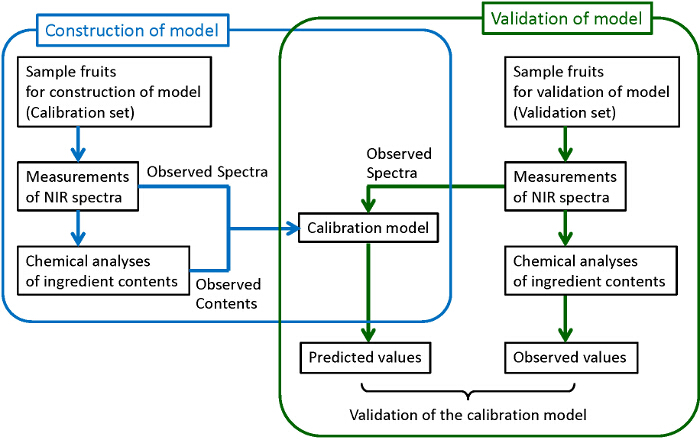
Figura 1. Fluxograma para a construção e validação do modelo de calibração. Os procedimentos cercado por linhas azuis e verdes correspondem, respectivamente, para a construção de um modelo de calibração e sua validação. Por favor clique aqui para ver uma versão maior desta figura.
Protocolo
1. Coleta de Amostras
- Decidir qual cultivares serão incluídos no alvo do modelo de calibração.
- Recolhe número suficiente e vários tipos de amoras de amostra dos cultivares alvo.
- Recolha de um modo preferido 100 mirtilos para a construção do modelo de calibração, e, pelo menos, 10 para a validação do modelo construído. A fim de construir modelos robustos, recolher amostras de vários tipos, ou seja, com várias cores, tamanhos e em diferentes condições de maturação.
- Pesar cada mirtilo. Nota: Os pesos medidos são utilizados mais tarde para o cálculo da percentagem de conteúdo de ingredientes de cada mirtilo.
2. As medições de espectros
- Warm-up o espectrofotômetro suficiente (mais de 1 hora) antes das medições para obter espectros de confiança.
- Ajuste o espectrofotômetro. Certifique-se de que as condições são constantes durante todo as medições. Aexemplo de condições típicas para as medições é dada abaixo.
- Definir a gama de medições para 12,500-3,600 cm -1.
- Defina a resolução espectral para 16 cm -1.
- Defina o acúmulo de até 32 vezes.
- Escolha reflectância difusa como o modo de medição.
- Coloque o refletor padrão na janela do espectrofotômetro para medidas de reflectância difusa. Ao usar o comando "fundo único canal", medir o espectro de fundo que é automaticamente usada para o cálculo dos espectros de reflectância relativa a partir dos espectros de mirtilos amostra medida mais tarde.
- Coloque uma amostra de mirtilo no centro da janela do espectrofotômetro para medidas de reflectância difusa. Ao usar o comando "amostra único canal", medir espectros de cada blueberry de preferência em vários pontos da fruta.
Nota: Kubelka-Munk 6,7 transformação também será realizada autocamente para a espectros observados de mirtilos amostra, se a condição de aquisição espectral é configurado para fazer isso. transformação de Kubelka-Munk altera o espectro medido no modo de reflectância difusa para os espectros equivalente àqueles medidos no modo de transmissão e é necessária para a análise dos espectros com alta precisão. Spectra na escala de absorção são usados para análises. - Calcula-se a média do espectro dos espectros de cada amostra utilizando um programa de processamento de dados, tais como o Microsoft Excel se os espectros de uma amostra de mirtilo são medidas em vários pontos. Utilizar o espectro em média para as análises.
3. Pré-tratamento para medições de HPLC de açúcares e ácidos orgânicos 8
Nota: Extracto açúcares e ácidos orgânicos de cada mirtilo, que são solúveis em água, com água ultrapura como se segue. A totalidade de cada blueberry é utilizado para análises.
- Mantenha os mirtilos em um congelador abaixo de -30 ° C pronto foanalisa r química se não forem analisados logo após as medidas espectrais.
- Cortar uma mirtilo em vários pedaços de modo que pode ser facilmente homogeneizado nos seguintes passos. Corte o blueberry sem descongelar quando ele está congelado.
- Coloque os pedaços em um copo de 50 ml.
- Adicionar ca. 10 ml de água ultrapura (água destilada cuja condutividade eléctrica é inferior a 0,1 mS / cm) para o copo.
- Aquece-se a mirtilo corte em água ultrapura num forno de microondas durante 20 seg para desactivar as enzimas que podem decompor-se açúcares durante as análises.
- Adicionar cerca de 10 ml de água ultrapura ao balão.
- Homogeneizar a mistura durante 5 minutos a 12.000 rpm com um homogeneizador equipado com um eixo padrão e gerador.
- Centrifugar a mistura homogeneizada durante 10 min a 3000 rpm (2000 x g).
- Recolhe filtrado por filtração sob vácuo da amostra centrifugada utilizando um filtro de papel 5B.
- Repetir a 3,6-3,9 passos duas vezes em the resíduo de filtração para recolher todos os açúcares e os ácidos orgânicos, e combinar todos os filtrados.
- Medir o pH do filtrado e ajustá-lo para 7 com ácido clorídrico diluído (0,1 e 0,01 mol L -1) e soluções aquosas diluídas de hidróxido de sódio (0,1 e 0,01 mol L -1).
- Dilui-se o filtrado até 50 ml com água ultrapura.
- Dividir a amostra em dois; uma para a análise de açúcares e a outra para a análise de ácidos orgânicos.
- Passar a primeira solução de amostra através de colunas (duas C18, CM e QMA) ligados em série, para excluir pigmentos, catiões e aniões. Jogue fora os primeiros 1 ml da solução da amostra a partir das colunas. Em seguida, utilizar a solução da amostra a partir das colunas para a análise de açúcares por HPLC.
- Passar a segunda solução de amostra através de colunas (duas C18 e CM) ligados em série para excluir pigmentos e catiões. Jogue fora os primeiros 1 ml da solução da amostra a partir das colunas. Em seguida, use a solução de amostra a partir da columns para a análise de ácidos orgânicos por HPLC.
- Centrifugar cada solução de passos 3.14 e 3.15 a 6600 rpm (5800 x g), durante 10 min num microtubo equipado com um filtro de 0,45 um, com um mini-centrífuga antes da análise por HPLC.
4. Medições de açúcares por HPLC
Nota: Neste estudo, o teor total de sacarose, glicose e frutose de cada mirtilo é considerado como o teor total de açúcar. Portanto, a curva de trabalho para cada um dos três açúcares é obtido em primeiro lugar, e, em seguida, o conteúdo é obtido soma dos açúcares em cada mirtilo. O conteúdo padrão são relatadas como 0,3-0,4% em peso de (sacarose), 3,8-4,8% em peso (glicose), e 4,2-5,3% em peso (frutose) 9.
- Medir cerca de 200 mg de sacarose com precisão, e dissolvê-lo em 50 ml de água ultrapura para preparar uma solução-padrão. Dilui-se 5 ml da solução para 50 ml com água ultrapura para preparar a segunda soluções-padrão. Prepare de forma semelhante a terceira posiçãoard solução a partir da segunda solução padrão.
- Preparar as soluções padrão de glucose e frutose, de forma semelhante.
- Dispor o sistema de HPLC como segue:
- Utilizar uma coluna de permeação em gel na coluna forno a 40 ° C.
- Use água ultrapura desgaseificada com a taxa de fluxo de 0,1 ml / min como o eluato.
- Usar um detector de índice de refracção.
- Medir os espectrogramas de HPLC de soluções padrão por injecção de uma alíquota de 20 uL para cada medição. Nota: Aqui, o PAC solução é utilizada como o software para a medição.
- Obter a intensidade da banda do açúcar no cromatograma de cada solução padrão área clicando 're-análise "com o botão direito do mouse.
- Traçar as intensidades área contra as concentrações correspondentes para obter a curva de trabalho para cada açúcar pela regressão linear, em que a equação que representa a relação entre a intensidade e a área de concentração é obtido for cada açúcar.
- Medir os espectrogramas de HPLC das soluções de amostra por injecção de uma alíquota de 20 uL para cada medição.
- Obter as intensidades das bandas de açúcares no cromatograma da solução de amostra a cada área, como descrito anteriormente no passo 4.5.
- Obter as concentrações dos açúcares nas soluções que utilizam as equações correspondentes para as curvas de trabalho obtidos no passo 4.6.
- Obter a quantidade de cada açúcar em cada mirtilo a partir das concentrações da solução de amostra obtida na etapa anterior e o volume total da solução da amostra (50 ml, ver passo 3.12).
- Obter as quantidades totais de açúcar de cada fruta somando-se o conteúdo de três açúcares.
- Obter a percentagem de conteúdo de açúcar total de cada blueberry usando o peso medido no passo 1.3.
5. As medições de HPLC dos ácidos orgânicos
Nota: Neste estudo, o teor total de ácido cítrico, ácido quínico, ácido málicoácido, e ácido succínico são considerados como o conteúdo de ácido orgânico total. Portanto, a curva de trabalho para cada um dos quatro ácidos orgânicos é obtido em primeiro lugar, e, em seguida, o conteúdo de ácido orgânico em cada mirtilo é medido. O conteúdo padrão são relatadas como 0,42-0,62% em peso (ácido cítrico), 0-0,15% em peso (ácido quínico), 0,08-0,23% em peso (ácido málico), e 0,06-0,25% em peso (ácido succínico) 9.
- Medir cerca de 5 mg de ácido cítrico com precisão, e dissolvê-lo em 50 ml de água ultrapura para preparar uma solução-padrão. Dilui-se 5 ml da solução para 50 ml com água ultrapura para preparar a segunda soluções-padrão. Prepare de forma semelhante a terceira solução padrão a partir da segunda solução padrão.
- Preparar as soluções padrão de ácido quínico, ácido málico, ácido succínico e, de forma semelhante.
- Dispor o sistema de HPLC como segue:
- Use duas colunas de permuta aniónica ligadas em série no forno de coluna a 40 ° C.
- Uso desgaseificada solução aquosa a 0,1% de fosfóricoácido com a taxa de fluxo de 0,02 ml / min como o eluato.
- Use um conjunto detector ultravioleta-visível a 210 nm.
- Medir os espectrogramas de HPLC de soluções padrão por injecção de uma alíquota de 20 ul da solução padrão de cada medição.
- Obter a intensidade da banda de ácido orgânico no cromatograma de cada solução padrão área clicando 're-análise "com o botão direito do mouse.
- Traçar as intensidades área contra as concentrações correspondentes para obter a curva de trabalho para cada ácido orgânico pela regressão linear, em que a equação que representa a relação entre a intensidade de área e a concentração é obtido para cada ácido orgânico.
- Medir os espectrogramas de HPLC das soluções de amostra por injecção de uma alíquota de 20 ul da amostra para cada medição.
- Obter as intensidades das bandas de ácidos orgânicos no cromatograma da solução de amostra a cada área, tal como descrito anteriormente no passo 5.5.
- Obter as concentrações dos ácidos orgânicos nas soluções que utilizam as equações correspondentes para as curvas de trabalho obtidos no passo 5.6.
- Obter a quantidade de cada ácido orgânico em cada mirtilo a partir das concentrações da solução de amostra obtida na etapa anterior e o volume total da solução da amostra (50 ml, ver passo 3.12).
- Obter a quantidade de ácido orgânico total em cada mirtilo pela soma-se os conteúdos dos quatro ácidos orgânicos.
- Obter a percentagem do conteúdo de ácido orgânico total de cada mirtilo usando o peso medido no passo 1.3.
6. Pré-tratamento para medições de HPLC de antocianinas
- Mantenha os mirtilos no congelador a menos de -80 ° C pronto para análises químicas, se eles não são analisados logo após as medidas espectrais.
- Seque cada fruta congelada com um liofilizador vácuo durante 12 h.
- Extrair antocianina do mirtilo secou-se em 1% de solução de metanol óácido trifluoroacético f [peso de mirtilo (g) / volume da solução (ml) = 10/01], deixando a mistura no frigorífico a 4 ° C durante 12 h.
- Centrifugar o extracto durante 15 min num microtubo de 2 ml usando uma ultracentrífuga a -8 ° C e 15.000 rpm (21.900 x g).
- Filtra-se o extracto através de um filtro de 0,45 um para obter a amostra para medições de HPLC.
7. As medições por HPLC de antocianinas
Nota: Cerca de 13 antocianinas tipo estão incluídas na mirtilos. Uma vez que é difícil obter curvas de trabalho para todas as antocianinas, a curva de trabalho para o cloreto O -glucoside única cianidina-3-, uma das antocianinas mais populares em blueberries, é obtido. A curva de trabalho é aplicado por quantificações aproximadas de outros antocianinas.
- Medir cerca de 1,5 mg de cloreto de -glucoside cianidina-3-O com precisão, e dissolvê-lo em 10 ml de solução de metanol a 1% de ácido trifluoroacético a Prepare uma solução padrão. Dilui-se 5 ml da solução para 10 ml com solução de metanol a 1% de ácido trif luoroacético para preparar a segunda soluções-padrão. Do mesmo modo, preparar o terceiro eo quarto soluções padrão sequencialmente.
- Dispor o sistema de HPLC como segue:
- Usar uma coluna de fase inversa C18 num forno de coluna a 40 ° C.
- Aplicar o método do gradiente utilizando eluatos de 0,1% de ácido trifluoroacético aquoso (eluir A) e 0,5% de ácido trifluoroacético em acetonitrilo (eluir B) com a taxa de fluxo de 0,1 ml / min, em que a razão de aumento eluir B de 8% a 15% durante 0-50 min após a injecção, e de 15% para 75% durante 50-60 minutos após a injecção.
- Use um fotodiodo matriz monitoramento detector a 520 nm.
- Medir os espectrogramas de HPLC de soluções padrão injectando uma alíquota de 10 uL para cada medição. "Solução LC" é utilizado como o software para a medição.
- Obter a intensidade da banda de áreacloreto de O -glucoside cianidina-3- no cromatograma de cada solução padrão, clicando em "re-análise" com o botão direito do mouse.
- Traçar as intensidades área contra as concentrações correspondentes para obter a curva de trabalho para cianidina-3- cloreto de o -glucoside pela regressão linear, em que a equação que representa a relação entre a intensidade e a área de concentração é obtido para cianidina-3- cloreto de o -glucoside.
- Medir os espectrogramas de HPLC das soluções de amostra por injecção de uma alíquota de 10 uL para cada medição.
- Obter a intensidade da banda de cada antocianina no cromatograma da solução de amostra a cada área, como descrito anteriormente no passo 7.4.
- Obter as concentrações das antocianinas nas soluções utilizando a equação correspondente à curva de trabalho, obtido no passo 7.5.
- Obter as quantidades de cada antocianina em cada mirtilo da concentração obtida na precedentepasso e o volume total da solução da amostra utilizada no passo 6.3.
- Obter a quantidade total de antocianina em cada blueberry somando-se os conteúdos dos treze antocianinas.
- Obter a percentagem do teor de antocianina total de cada mirtilo usando o peso medido no passo 1.3.
8. Construção de modelos de calibração para predição dos conteúdos Ingrediente
Nota: regressão PLS 4,5, que é um tipo de técnica de regressão múltipla usando variantes latentes, é usado para a construção de modelos de calibração para cada um dos ingredientes a partir dos espectros observados e o conteúdo de ingrediente determinada por análises químicas. PLS de regressão é realizada tanto com os programas comerciais ou com os programas caseiros. Ver referências 5,10 para os processos detalhados da construção de modelos.
- Analisará os pré-tratamentos para espectros observados são mais eficazes para precisas epredição robusta.
- Construir modelos de calibração através da aplicação de um ou dois dos seguintes pré-tratamentos: MSC (multiplicativo Scatter Correction), 1,2,5 SNV (Standard normal variate), 1,2,5 MMN (Min-Max Normalização), COE (Constant offset Eliminação ), e o primeiro ou o segundo cálculo derivado por SG (Savitzky-Golay) método. 1,2,5 Prever o conteúdo de ingrediente a validação definido a partir de seus espectros com os modelos construídos.
Nota: Em MMN, um espectro é normalizada de modo a que os valores máximos e mínimos e tornar-se 0 e 1, respectivamente. Em COE, a ordenada de um espectro é deslocado de modo a que o valor mínimo torna-se zero. - Calcular coeficiente de determinação, R2, e desvio de previsão residual, RPD, entre os valores observados e estimados de validação definido para examinar que pré-tratamentos para espectros observados são mais eficazes. Escolha a combinação de pré-tratamentos dando maiorR2 e RPD.
- Construir modelos de calibração através da aplicação de um ou dois dos seguintes pré-tratamentos: MSC (multiplicativo Scatter Correction), 1,2,5 SNV (Standard normal variate), 1,2,5 MMN (Min-Max Normalização), COE (Constant offset Eliminação ), e o primeiro ou o segundo cálculo derivado por SG (Savitzky-Golay) método. 1,2,5 Prever o conteúdo de ingrediente a validação definido a partir de seus espectros com os modelos construídos.
- Examinar quais regiões número de onda são eficazes para a previsão precisa e robusta, aplicando, por exemplo,-mover janelas PLS técnica de 11 para procurar as regiões eficazes.
Nota: O procedimento corresponde a remover as regiões número de onda, onde espectros não contêm nenhuma informação eficaz para previsões ou que contenham informações que interfere com as previsões.
9. validação dos modelos de calibração construída
Nota: Ver referências 5,10 para os processos detalhados da validação de modelos construídos.
- Prever conteúdo ingrediente da validação definido a partir de seus espectros com os modelos de calibração construídas com a melhor combinação de pré-tratamentos e para as regiões wavenumber eficazes para a predição 5,10.
- Calcular R 2 e RPD entre o observado e previstovalores do conjunto de validação 5,10.
- Examinar se os critérios gerais para a realização prática dos modelos de calibração, 12,13 R 2> 0,85 e RPD> 2,5, estão satisfeitos. Considere a reconstrução do modelo, se os critérios não são satisfeitos.
Resultados
A Figura 2 mostra como um exemplo de um conjunto de NIR espectro de absorção de mirtilos, onde os espectros de 70 blueberries são mostrados simultaneamente. Uma vez que as bandas definitivamente atribuíveis aos açúcares, ácidos orgânicos, ou antocianinas não são observados no espectro de NIR, a lei de Lambert-Beer tradicional não é aplicável para quantificar os teores de ingredientes. Portanto, a construção de modelos para a predição de conteúdo de ingr...
Discussão
Alguns comentários adicionais sobre o protocolo são descritos aqui. Em primeiro lugar, no passo 1.1, menciona-se para decidir as cultivares incluídos no alvo. Embora seja possível construir modelos que cobrem blueberries de muitos cultivares ou sem especificar cultivares, as precisões de previsão com os modelos são, por vezes, muito mais baixa do que aqueles com os modelos para um único cultivar e para as cultivares limitados. Deve também notar-se que os modelos de calibração deve ser construído para mirtilo...
Divulgações
We have nothing to disclose.
Agradecimentos
This work was partially supported by the project "A Scheme to Revitalize Agriculture and Fisheries in Disaster Area through Deploying Highly Advanced Technology" of Ministry of Agriculture, Forestry and Fisheries, Japan.
Materiais
| Name | Company | Catalog Number | Comments |
| FT-NIR spectrophotometer | Bruker Optics GmbH | MPA | |
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45000-31, 228-45018-31 | For sugar analysis |
| 223-04500-31, 228-45010-31, 228-45095-31 | Refractive Index Detector | ||
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45003-31, 228-45000-31 | For organic acid analysis |
| 228-45018-31, 228-45010-31, 223-04500-31 | Ultraviolet-Visible Detector | ||
| High-Performance Liquid Chromatography | Shimadzu Corporation | 228-45041-91, 228-45018-31, 228-45000-31 | For anthocyanin analysis |
| 228-45012-31, 228-45119-31, 228-45005-31 | Photodiode Array Detector | ||
| 228-45009-31 | |||
| pH meter | Mettler-Toledo | 30019028 | S220, Automatic temperature compensation |
| Ultra-pure water treatment equipment | ORGANO Corporation | ORG-ULXXXM1; PRA-0015-0V0 | PURELAB ultra; PURELITE |
| Biomedical Freezers | SANYO | 2-6780-01 | MDF-U338 |
| Ultra-Low Temperature Freezer | Panasonic healthcare Co.,Ltd. | KM-DU73Y1 | -80 °C |
| Vacuum lyophilizer | IWAKI GLASS Co.,Ltd | 119770 | DRC-3L; FRD-82M |
| Homoginizer | Microtec Co., Ltd. | Physcotron | |
| Ultracentrifuge | Hitachi Koki Co.,Ltd | S204567 | CF15RXII |
| Mini-centrifuge | LMS CO.,LTD. | KN3136572 | MCF-2360 |
| Centrifuge | Kokusan Co.,Ltd | 2-5534-01 | H-103N |
| Filter Paper | Advantec | 1521070 | 5B, Eqivalent to Whatman 40 |
| Sep-Pak C18 column | Waters Corporation Milford | WAT020515 | |
| Sep-Pak CM column | Waters Corporation Milford | WAT020550 | |
| Sep-Pak QMA column | Waters Corporation Milford | WAT020545 | |
| Centrifugal Filter Unit | Merck Millipore Corporation | R2SA18503 | PVDF, 0.45 μm |
| Microtube | As One Corporation | 1-1600-02 | PP, 2 ml |
| Syringe Filter | GE Healthcare CO.,LTD. | 6788-1304 | PP, 0.45 μm |
| Sucrose | Wako Pure Chemical Industries,Ltd | 194-00011 | Reagent-grade |
| Glucose | Wako Pure Chemical Industries,Ltd | 049-31165 | Reagent-grade |
| Fructose | Wako Pure Chemical Industries,Ltd | 123-02762 | Reagent-grade |
| Citric acid | Wako Pure Chemical Industries,Ltd | 036-05522 | Reagent-grade |
| Malic acid | Wako Pure Chemical Industries,Ltd | 355-17971 | Reagent-grade |
| Succinic acid | Wako Pure Chemical Industries,Ltd | 190-04332 | Reagent-grade |
| Quinic acid | Alfa Aesar, A Johnson Matthey Company | 10176328 | Reagent-grade |
| Phosphoric acid | Wako Pure Chemical Industries,Ltd | 162-20492 | HPLC-grade |
| Trifluoroacetic acid | Wako Pure Chemical Industries,Ltd | 208-02746 | Reagent-grade |
| Methanol | Wako Pure Chemical Industries,Ltd | 131-01826 | Reagent-grade |
| Acetonitrile | Wako Pure Chemical Industries,Ltd | 015-08633 | HPLC-grade |
| Grade cyanidin-3-O-glucoside chloride | Wako Pure Chemical Industries,Ltd | 306-37661 | HPLC-grade |
| Software for analyses | Bruker Optics GmbH | OPUS ver. 6.5 | |
| Softoware for preprocessing | Microsoft | Excel powered by Visual Basic for Applications | |
| Software for construction of models | Freemat 4.0 | http://freemat.sourceforge.net/ |
Referências
- Ozaki, Y., McClure, W. F., Christy, A. A. . Near-infrared Spectroscopy in Food Science and Technology. , (2007).
- Sun, D. W. . Infrared Spectroscopy for Food Quality Analysis and Control. , (2009).
- Bai, W., Yoshimura, N., Takayanagi, M. Quantitative analysis of ingredients of blueberry fruits by near infrared spectroscopy. J. Near Infrared Spectrosc. 22, 357-365 (2014).
- Hasegawa, T., Tasumi, M. . Chemometrics in infrared spectroscopic analysis. In: Introduction to Experimental Infrared Spectroscopy. , 97-113 (2015).
- Varmuza, K., Filzmoser, P. . Introduction to Multivariate Statistical Analysis in Chemometrics. , (2009).
- Kubelka, P. New contributions to the optics of intensely light-scattering materials. Part I. J. Opt. Soc. Am. 38, 448-457 (1948).
- Juang, R. H., Storey, D. E. Quantitative determination of the extent of neutralization of carboxylic acid functionality in carbopol 974P NF by diffuse reflectance fourier transform infrared spectrometry using Kubelka-Munk function. Pharm Res. 15, 1714-1720 (1998).
- Ogiwara, I., Ohtsuka, Y., Yoneda, Y., Sakurai, K., Hakoda, N., Shimura, I. Extraction method by water followed by microwave heating for analyzing sugars in strawberry fruits. J. Jpn. Soc. Hort. Sci. 68, 949-953 (1999).
- Che, J., Suzuki, S., Ishikawa, S., Koike, H., Ogiwara, I. Fruit ripening and quality profile of 64 cultivars in three species of blueberries grown in Tokyo. Hort. Res. (Japan). 8, 257-265 (2009).
- Pomerantsev, A. L. . Chemometrics in Excel. , (2014).
- Jiang, H. J., Berry, R. J., Siesler, H. W., Ozaki, Y. Wavelength Interval Selection in Multicomponent spectral analysis by moving window partial least-squares regression with applications to mid-infrared and near-infrared spectroscopic data. Anal. Chem. 74, 3555-3565 (2002).
- Edney, M. J., Morgan, J. E., Williams, P. C., Campbell, L. D. Analysis of feed barley by near infrared reflectance spectroscopy. J. Near-Infrared Spectrosc. 2, 33-41 (1994).
- Mathison, G. W., et al. Prediction of composition and ruminal degradability characteristics of barley straw by near infrared reflectance spectroscopy. Can. J. Anim. Sci. 79, 519-523 (1999).
- Chiara, F., et al. Analysis of anthocyanins in commercial fruit juices by using nano-liquid chromatography electrospray-mass spectrometry and high performance liquid chromatography with UV-vis detector. J. Separation Sci. 34, 150-159 (2011).
- Li, Q., et al. Antioxidant anthocyanins screening through spectrum-effect relationships and DPPH-HPLC-DAD analysis on nine cultivars of introduced rabbiteye blueberry in China. Food Chemistry. 132, 759-765 (2013).
- Sinelli, N. Evaluation of quality and nutraceutical content of blueberries (Vaccinium corymbosum L.) by near and mid-infrared spectroscopy. Postharvest Biol. Technol. 50, 31-36 (2008).
- Giusti, M. M., Wrolsted, R. E., Wrolstad, R. E., Schwartz, S. J. Anthocyanins: characterization and measurement with UV-visible spectroscopy. Current Protocols in Food Analytical Chemistry. , 1-13 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados