Method Article
الحمض النووي الريبي في وقت واحد استخراج من الرواسب الساحلية والكمي ل16S الجينات الريباسي والنصوص التي في الوقت الحقيقي PCR
In This Article
Summary
A protocol to quantify bacterial 16S rRNA genes and transcripts from coastal sediments via real-time PCR is provided. The methodology includes the co-extraction of DNA and RNA; preparation of DNA-free RNA; and 16S rRNA gene and transcript quantification via RT-q-PCR, including standard curve construction.
Abstract
في الوقت الحقيقي تفاعل البلمرة المتسلسل المعروف أيضا باسم PCR الكمي (ف-PCR) هو أداة تستخدم على نطاق واسع في البيئة الميكروبية لتحديد الكميات المتوفرة من الجينات في مجموعات تصنيفية وظيفية في العينات البيئية. تستخدم بالاقتران مع الناسخ رد الفعل العكسي (RT-ف-PCR)، فإنه يمكن أيضا أن تستخدم لتحديد النصوص الجينات. Q-PCR يجعل من استخدام حساسة للغاية كيمياء كشف الفلورسنت التي تسمح الكمي من amplicons PCR خلال المرحلة الأسية من رد الفعل. لذلك، يتم تجنب التحيز المرتبطة "نقطة النهاية" PCR في الكشف عن المرحلة هضبة تفاعل PCR. بروتوكول لقياس الجينات 16S الريباسي البكتيرية والنصوص من الرواسب الساحلية عبر في الوقت الحقيقي يتم توفير PCR. لأول مرة، وهي طريقة للرئيسين استخراج الحمض النووي والحمض النووي الريبي من الرواسب الساحلية، بما في ذلك الخطوات الإضافية اللازمة لإعداد رنا خالية من الحمض النووي، ويرد. ثانيا، دليل خطوة بخطوة لتقدير حجم الجينات 16S الريباسي والنقويرد anscripts من الأحماض النووية المستخرجة عبر Q-PCR و RT-ف-PCR. هذا يتضمن تفاصيل لبناء الحمض النووي والحمض النووي الريبي مستوى المنحنيات. تدرج الاعتبارات الأساسية لاستخدام فحوصات RT-ف-PCR في البيئة الميكروبية.
Introduction
الكائنات الدقيقة هي حجر الزاوية وظيفة المحيط الحيوي القيادة النظام البيئي. لا تزال غالبية الكائنات الحية الدقيقة جاهل 1. لذلك النهج الجزيئية أساس أساسية لتعميق فهمنا للتنوع وظيفة من الكائنات الحية الدقيقة في البيئة. الوسطى إلى هذه الأساليب هو استخراج الأحماض النووية من العينات البيئية والتضخيم لاحق من الجينات المستهدفة باستخدام تفاعل البلمرة المتسلسل (PCR).
وتهدف الخطوة الأولى لاستخراج DNA / RNA إلى ليز جدران الخلايا من الجراثيم الحاضر المجتمع، وإزالة جزيئات نوكليك حمض غير غير مرغوب فيها (المواد على سبيل المثال، العضوية وغير العضوية) والاحتفاظ DNA / RNA في حل لمزيد من التحليل المصب. من بين العديد من الخيارات المتاحة في الأدب 2،3،4،5، بما في ذلك مجموعة من مجموعات استخراج التجارية، وطريقة غريفيث 6 واستخدمت على نطاق واسع 7،8،9. فمن فعالة من حيث التكلفة والسلطة الفلسطينيةrticularly مناسبة تماما لالرواسب كما أنه يستخدم خطوة بفوزه على حبة لليز الخلايا ويتضمن خطوات للحد من شارك في استخراج مثبطات PCR، مثل الأحماض الدبالية، بينما يتعافى في وقت واحد DNA و RNA.
يستخدم الخطوة الثانية في تفاعل البلمرة المتسلسل (PCR) لتضخيم الجينات المستهدفة، مثل علامة التصنيفية 16S الريباسي، من الأحماض النووية المستخرجة. هذا النهج لديه ويستمر لتسهيل استكشاف uncharacterized الميكروبي 10،11 الصندوق الأسود. ومع ذلك، وأساليب نقطة النهاية PCR القائم تعاني من القيود المختلفة التي يمكن التحيز توصيف المجتمعات الميكروبية 12. لتحديد بدقة وفرة جين / نسخة، في الوقت الحقيقي PCR، المعروف أيضا باسم PCR الكمي (QPCR) يجب أن تستخدم. QPCR يستغل أنظمة صبغ مراسل الفلورسنت التي تتبع تراكم amplicon بعد كل دورة من PCR. وهذا أمر مهم لأنه يعني أنه يمكن أن يحدث الكمي خلال المرحلة الأسي في وقت مبكر، بدلامن نقطة النهاية، مرحلة رد الفعل PCR، عندما العائد amplicon لا يزال يتناسب طرديا مع وفرة الأولى من الجين المستهدف.
تستخدم نظامين مراسل عادة: والإقحام الحمض النووي وصمة عار 13 و 5 النشاط '3' نوكلياز خارجية من الحمض النووي بوليميريز 14. منذ النظام السابق مراسل يربط indistinctively لجميع الحمض النووي المزدوج تقطعت بهم السبل، فإنه قد يؤدي إلى المبالغة في تقدير تسلسل الهدف إذا amplicons غير محددة غير المرغوب فيها أو dimers التمهيدي من المنتجات تحدث. من أجل الالتفاف على هذا، قد تكون هناك حاجة تطويري مكثف من التضخيم. في النظام الأخير، يتم تعقب قالب التضخيم باستخدام مزيج من النشاط 5 "نوكلياز من البلمرة طق أن يشق على fluorophore من التحقيق الداخلي. هذه الميزة تزيد من خصوصية الفحص بسبب استخدام مسبار الفلورة الذي يربط فقط على التكميلية sequenc هدف محددالبريد بين الزوج التمهيدي. مع كل كيمياء يتحقق الكمي من خلال تحديد نقطة عبور (حزب المحافظين) حيث تراكم amplicons PCR، مقاسا زيادة في مضان، هو أعلى بكثير مضان الخلفية.
وقد استخدم QPCR نطاق واسع في البيئة الميكروبية لتحديد الكميات المتوفرة من الجينات في بيئات مختلفة 15. وعلاوة على ذلك، يتم الجمع بين النسخ العكسي من الحمض النووي الريبي إلى [كدنا مع QPCR وRT-QPCR لقياس التعبير الجيني. وبالتالي، QPCR وRT-QPCR تمثل وطرق سريعة فعالة لتقدير أعداد الجينات و / أو نص في العينات البيئية.
الكائنات الدقيقة في رسوبيات الساحلية بالسيارة عمليات النظم الإيكولوجية المختلفة، بما في ذلك تمعدن من المواد العضوية، وتدهور الملوثات والدراجات البيولوجية الكيميائية من المواد الغذائية الرئيسية مثل 16،17،18 النيتروجين. فهم شامل لهذه التحولات يتطلب محاسبات شاملر من المساهمة السكان الميكروبية، بما في ذلك البيانات الكمية عن الجين ونسخة فرة. ونقدم لك هنا مجموعة من البروتوكولات اختبارها بدقة، مبسطة وموحدة لتقدير حجم البكتيرية الجين ونسخة فرة 16S الريباسي في الرواسب الساحلية. يحدد البروتوكول جمع العينات، الحمض النووي في وقت واحد واستخراج الحمض النووي الريبي، وإعداد رنا خالية من الحمض النووي، وفحص الجودة من الأحماض النووية المستخرجة، وتوليد 16S الريباسي الحمض النووي والمعايير -RNA النوعي والكمي للعينات البيئية. وهناك حاجة إلى البيانات الكمية المستمدة من الأساليب المذكورة هنا لتسليط الضوء على المجتمعات الميكروبية القيادة النظم الإيكولوجية الساحلية.
Protocol
1. الحمض النووي واستخراج الحمض النووي الريبي من الرواسب البحرية الساحلية
- إعداد ريبونوكلياز (ريبونوكلياز) مادة خالية ومساحة العمل
- إعداد مياه خالية من ريبونوكلياز المقطر (DH 2 O) عن طريق التعامل مع 0.1٪ diethylpyrocarbonate (DEPC)، واحتضان عند 37 درجة CO / N. إزالة DEPC المتبقية من التعقيم درهم 2 O في درجة حرارة 121 مئوية لمدة 15 دقيقة. تعامل استخدام DEPC درهم 2 O لجعل كل الحلول.
- خبز جميع الأواني الزجاجية في 180 ° CO / N. إزالة الأغطية البلاستيكية والحافات، نقع في محلول هيدروكسيد الصوديوم 2 M O / N، وشطف لهم مع DEPC معاملة درهم 2 O قبل الاستخدام.
- إعداد محلول منظم CTAB-الفوسفات كما في الجدول 1.
- إعداد الحل هطول PEG-كلوريد الصوديوم كما في الجدول 2.
- تنظيف جميع أسطح العمل (أي مقاعد البدلاء، microcentrifuge ل، الدخان هود) وبال micropipettes باستخدام ريبونوكلياز-تطهير الحل قبل البدء. ارتداء القفازات أثناء الإجراء بأكمله.
- استخدام بلستيكور خالية من ريبونوكلياز جنبا إلى جنب مع نصائح مرشح micropipette لتجنب عينة انتقال التلوث.
- جمع العينات البيئية والتخزين
- جمع الرواسب الساحلية خلال المد والجزر المنخفضة باستخدام معقم 50 مل أنبوب الصقر من أعلى 2.5 سم. جمع حوالي 15-20 غرام من الرواسب. إغلاق الغطاء بعناية بعد جمع العينات. نقل على الفور إلى المختبر في برودة في 4 درجات مئوية لمعالجته فورا.
- تجانس العينة عن طريق خلط مع ملعقة معقمة وقسامة 0.5 غرام من الوزن الرطب الرواسب إلى 2 مل أنبوب حبة الضرب. قسامة مكررات إضافية، فلاش تجميد عن طريق وضع في النيتروجين السائل. مخزن aliquots في -80 درجة مئوية. الحذر: ارتداء قفازات واقية ونظارات السلامة عند التعامل مع النيتروجين السائل.
ملاحظة: إذا لم يقع في موقع حقل بالقرب من معمل، قسامة 0.5 غرام من الرواسب إلى 2 مل أنابيب microcentrifuge العقيمة في موقع الحقل. فلاش تجميد الأنابيب من خلال وضعها على الفور الى لىالنيتروجين مضغة والنقل إلى المختبر. عينات في مخزن -80 درجة مئوية حتى المعالجة.
- شارك في استخراج الحمض النووي والحمض النووي الريبي من الرواسب
ملاحظة: البروتوكول التالي هو نسخة معدلة من طريقة غريفيث 6.- إضافة 500 ميكرولتر عازلة CTAB فوسفات و 500 ميكرولتر الفينول: كلوروفورم: كحول أيزو أميلي (25: 24: 1) إلى 2 مل أنبوب الناشر حبة تحتوي على 0.5 غرام من الرواسب وعكس أنبوب 5-10 مرات لتجانس العينة.
الحذر: تنفيذ هذه الخطوة في الدخان غطاء محرك السيارة يرتدون ملابس واقية مناسبة (أي معطف المختبر، والقفازات ونظارات السلامة) في جميع الأوقات. - دوامة بأقصى سرعة لمدة 2.5 دقيقة. أجهزة الطرد المركزي في 16000 x ج لمدة 10 دقيقة على 4 درجات مئوية.
- في الدخان هود استخراج الطبقة العليا المائية ونقل إلى 1.5 مل أنبوب microcentrifuge العقيمة الجديد. حفظ العينات على الجليد، إضافة 500 ميكرولتر من كلوروفورم المثلج: الكحول أيزو أميلي (24: 1).
- عكس عدة مرات حتى مستحلب هو visibجنيه. أجهزة الطرد المركزي لمدة 10 دقيقة في 16000 x ج في 4 درجات مئوية.
- في الدخان هود استخراج الطبقة العليا المائية ووضعها في أنبوب 1.5 مل العقيمة الجديد. ترسيب الأحماض النووية عن طريق إضافة مجلدين من 30٪ من محلول كلوريد الصوديوم PEG- وتخلط جيدا.
- احتضان على الجليد لمدة 2 ساعة أو ترك العينات عند 4 درجات CO / N.
- في نهاية عينات الطرد المركزي حضانة في 16000 x ج لمدة 20 دقيقة على 4 درجات مئوية.
ملاحظة: بيليه قد تكون مرئية في الجزء السفلي من الأنبوب. - إزالة بلطف طاف باستخدام micropipette، للتأكد من عدم تعكير صفو بيليه. ترك حوالي 10 ميكرولتر من حل PEG في أنبوب وإضافة 1 مل من الجليد الباردة الايثانول 70٪.
- أجهزة الطرد المركزي لمدة 20 دقيقة في 16000 x ج في 4 درجات مئوية. ببطء إزالة الايثانول مع micropipette مع الحرص على عدم لمس بيليه.
- أجهزة الطرد المركزي لمدة 5 ثانية، وإزالة الايثانول المتبقية باستخدام micropipette. ترك بيليه الهواء الجاف لمدة 5 دقائق تقريبا.
- إعادة تعليق بيليه في 50 ميكرولتر DEPC المعالجةH 2 O. فحص الجودة والعائد من الحمض النووي / الحمض النووي الريبي الكهربائي للهلام الاغاروز تشغيل 5 ميكرولتر على هلام الاغاروز 1٪ 19. تقسيم الأحماض النووية إلى قسمين قسامات، 15 ميكرولتر الحمض النووي و 30 ميكرولتر عن الحمض النووي الريبي.
- تخزين الحمض النووي في -80 درجة مئوية لحين الحاجة إليها. عزل الحمض النووي الريبي على النحو المبين في القسم التالي.
- إضافة 500 ميكرولتر عازلة CTAB فوسفات و 500 ميكرولتر الفينول: كلوروفورم: كحول أيزو أميلي (25: 24: 1) إلى 2 مل أنبوب الناشر حبة تحتوي على 0.5 غرام من الرواسب وعكس أنبوب 5-10 مرات لتجانس العينة.
2. إعداد RNA وفحص الجودة من الحمض النووي الريبي خالية من الحمض النووي
- هضم الحمض النووي
- إضافة 3 ميكرولتر من الدناز أنا العازلة و 1.5 ميكرولتر من أنا الدناز إلى 30 حجم ميكرولتر من الأحماض النووية، واحتضان عند 37 درجة مئوية لمدة 30 دقيقة.
- خلط الكاشف الدناز التعطيل قبل vortexing لمدة 30 ثانية. إضافة 4.8 ميكرولتر من حل للعينة. في احتضان RT لمدة 5 دقائق، في بعض الأحيان الاستفادة من أسفل أنابيب لخلط الحل.
- أجهزة الطرد المركزي في 10000 x ج لمدة 90 ثانية على RT، ونقل طاف (RNA) في أنبوب جديد، مع الحرص على عدم نقل راسب التي يمكن أن تحول دون ردود فعل المصب.
- فحص الجودة RNA
- إضافة 2 ميكرولتر من الحمض النووي الريبي إلى 18 ميكرولتر من معقمة خالية من ريبونوكلياز درهم 2 O لتخفيف 01:10.
- في ردود الفعل PCR منفصلة، إضافة 1 ميكرولتر من تخفيف أنيق أو 1:10 من الحمض النووي الريبي إلى العقيمة 0.5 مل أنبوب PCR. إضافة مكونات تفاعل PCR لتضخيم الجينات 16S الريباسي حسب الجدول 3. وتشمل "ايجابية" (على سبيل المثال، الحمض النووي المستخرج من ثقافة البكتيرية نقية)، و "PCR المانع" السيطرة (أي 1 ميكرولتر من إيجابي الحمض النووي ثقافة نقية و 1 ميكرولتر من الحمض النووي الريبي المستخرج أنيق) والسيطرة "سلبية" من معقمة خالية من ريبونوكلياز درهم 2 O.
- تعيين thermocycler مع المعلمات التضخيم التالية: 95 ° C 5 دقائق، (95 درجة مئوية و 30 ثانية و 57 درجة مئوية و 30 ثانية، 72 ° C 1 دقيقة) × 35 دورات، 72 درجة مئوية مدة 10 دقيقة.
- تشغيل 10٪ من الناتج PCR على هلام الاغاروز 1٪ عند 85 V لمدة 40 دقيقة. تكرار العلاج الدناز أنا في حال تشكيله منتج PCR في RN البيئيوالعينات.
- إضافة 2 ميكرولتر من الحمض النووي الريبي إلى 18 ميكرولتر من معقمة خالية من ريبونوكلياز درهم 2 O لتخفيف 01:10.
3. توليد ستراند الأولى كدنا] من الحمض النووي الريبي
- إضافة الكواشف كما في الجدول رقم 4 إلى ريبونوكلياز / الدناز الحرة 0.2 مل PCR أنبوب.
- احتضان العينة على 65 درجة مئوية مدة 5 دقائق. وضع على الجليد لمدة 1 دقيقة على الأقل ثم احتضان عند 25 درجة مئوية لمدة 10 دقيقة.
- لنفس أنبوب إضافة الكواشف المدرجة في الجدول رقم 5.
- احتضان العينة على 55 درجة مئوية لمدة 50 دقيقة. تعطيل رد الفعل عند 72 درجة مئوية لمدة 10 دقيقة.
- متجر كدنا] في -20 درجة مئوية حتى الاستخدام.
4. الكمية PCR
- جيل من المعايير الحمض النووي لQPCR
- تضخيم البكتيرية تسلسل 16S الريباسي 20 (أو أي تسلسل الآخر من الفائدة) من الحمض النووي الجيني المستخرجة من ثقافة نقية مع الاشعال ف-PCR (1369F و1492R 21).
- تنقية المنتج PCR باستخدام طقم التجارية وفقا لتعليمات الشركة الصانعة.
- استنساخ PCR المنقىالمنتج إلى عبء 3'-T استنساخ نظام ناقل وفقا لتعليمات الشركة الصانعة.
- تحويل ناقلات تحتوي على PCR تضاف إلى كولاي الخلايا المختصة JM109 وفقا لتعليمات الشركة الصانعة.
- لوحة 50 ميكرولتر من التحول إلى الأمبيسلين (100 ميكروغرام / مل)، X-غال (20 ميكروغرام / مل)، وIPTG (0.5 ملم) لوريا Bertani أجار لوحات (تريبتون 10 جرام / لتر، مستخلصات الخميرة 5 جم / لتر، كلوريد الصوديوم 10 جم / L، آجار 15 جم / لتر). احتضان O / N عند 37 درجة مئوية.
- حدد المحولة الأبيض إيجابي واحد من لوحة. تحصين المحولة إيجابي في 50 مل مرق LB تحتوي على 100 ميكروغرام / مل الأمبيسلين واحتضان O / N تهتز في 250 دورة في الدقيقة عند 37 درجة مئوية.
- من يا ثقافة / N، عزل وتنقية البلازميد باستخدام طقم التجارية وفقا لتعليمات الشركة الصانعة.
- خطي البلازميد باستخدام انزيم تقييد المناسبة التي هي قادرة على قطع البلازميد مرة واحدة (على سبيل المثال، EcoRI). > تحليل نقاء البلازميد عن طريق قياس نسبة امتصاص 260/280 19. وإذا كانت النسبة أقل من 1.8، وإعادة استخراج البلازميد مع الفينول كلوروفورم 19. ملاحظة: الحمض النووي النقي لديه نسبة 1.8.
- تحديد تركيز الحمض النووي البلازميد التي الامتصاصية في 260 نانومتر باستخدام مطياف 19.
ملاحظة: بدلا من ذلك، فإن دقة القياس الكمي يمكن تحسينها من خلال استخدام صبغة الحمض النووي ملزم الفلورسنت استخدامها جنبا إلى جنب مع التألق. - تسلسل البلازميد إدراج للتأكد من حجم الهدف في القواعد. حساب كمية (أي نسبة مئوية) من الحمض النووي إدراج في البلازميد (على سبيل المثال، في ناقلات 3000 سنة مضت، وهو 123 نقطة أساس تفتيت الحمض النووي هو 3.9٪ من إجمالي DNA) واضربها في تركيز حصلت في 4.1.10، لتحديد تركيز الحمض النووي من الهدف (إدراج).
- استخدام المعادلة التالية لحساب نسخ من هدف في ميكرولتر:
تحميل / 54067 / 54067eq1.jpg "/> - حساب الوزن الجزيئي الهدف (TMW) عن طريق ضرب عدد من الأزواج الأساسية من الحمض النووي الهدف من متوسط الوزن الجزيئي المزدوج حبلا الحمض النووي (dsDNA، 660 دالتون لكل زوج قاعدة).
- تمييع DNA الهدف في مجموعة من 10 أكتوبر - 10 فبراير نسخ باستخدام 2 ميكرولتر من الحمض النووي و 18 ميكرولتر من درهم معقم 2 O. خلط كل بئر تخفيف وتدور باستمرار لفترة وجيزة قبل اتخاذ التخفيف المقبل.
- جيل من منحنى RNA معيار لQPCR
- من الخطوة 4.1.5، كشف عدد من المستعمرات البيضاء (حوالي 5) من مستعمرة PCR 19 باستخدام عكس التمهيدي الهدف (أي R1492) وإلى الأمام ناقلات البلازميد التمهيدي M13F.
ملاحظة: هذه مجموعة من بادئات تضخيم إدراج المستنسخة في الاتجاه الصحيح الشعور مع موقع المروج T7 المنبع. - تنقية المنتج PCR باستخدام طقم التجارية التالية تعليمات الشركة الصانعة. تحديد المطهرون PCR صroduct في 260 نانومتر باستخدام مطياف.
- إضافة 200 نانوغرام من الناتج PCR في الحجم النهائي من 20 ميكرولتر مع 7.5 ملم من كل ريبونوكليوتيد، رد فعل العازلة 1 T7 و1 T7 إنزيم البلمرة لفي المختبر رد فعل النسخ.
- احتضان رد فعل لمدة 4 ساعة على 37 درجة مئوية. إضافة 1 وحدة من ريبونوكلياز خالية الدناز الأول لهذا التفاعل، واحتضان لمدة 15 دقيقة عند 37 درجة مئوية لإزالة قالب الحمض النووي.
- استرداد كتب في المختبر الحمض النووي الريبي الإيثانول هطول الأمطار 19 وقياس عوائد RNA باستخدام مقياس التألق أو الامتصاصية في 260 نانومتر.
- حساب عدد نسخة لكل ميكرولتر من الحمض النووي الريبي. إضافة عدد من الأزواج الأساسية في الحمض النووي الريبي الهدف (على سبيل المثال، 123 قواعد) لطول المروج T7 (153 قواعد) وضرب من قبل متوسط الوزن الجزيئي من الحمض النووي الريبي، 340 دالتون لكل قاعدة.
- إضافة 500 نانوغرام من كميا RNA الهدف الى رد فعل الناسخ العكسي (RT) كما هو مبين في القسم 3. مخفف تسلسليا كدنا] كما هو مبين في 4.1.13 للاستخدامكما منحنى القياسية.
- من الخطوة 4.1.5، كشف عدد من المستعمرات البيضاء (حوالي 5) من مستعمرة PCR 19 باستخدام عكس التمهيدي الهدف (أي R1492) وإلى الأمام ناقلات البلازميد التمهيدي M13F.
- في الوقت الحقيقي PCR
- الحمض النووي البيئي ذوبان / عينات كدنا] والمعايير والكواشف QPCR على الجليد. حماية التحقيق الفلورة من الضوء.
- تخفيف معايير لمنحنى القياسية على النحو المبين في 4.1.14. جعل 01:10 التخفيفات من الحمض النووي البيئية / كدنا] من مرتبة إلى 10 -3 بإضافة 2 ميكرولتر من عينة إلى 18 ميكرولتر من درهم معقم 2 O.
- جعل رد فعل مزيج الرئيسي لعدد من ردود الفعل بالإضافة إلى 10٪ وفقا للجدول رقم 6 (التمهيدي والتحقيق) والجدول 7 (مزيج رد فعل). تخلط جيدا وأجهزة الطرد المركزي لفترة وجيزة.
- إضافة 19 ميكرولتر من مزيج الرئيسي و 1 ميكرولتر من القالب (قياسي، عينة بيئية أو المياه من أجل السيطرة السلبية) إلى كل بئر في لوحة QPCR 96-جيدا البصرية. تنفيذ كل رد فعل (المعايير والعينات البيئية وضوابط السلبية) في ثلاث نسخ.
- تغطية لوحة 96-جيدا مع غطاء بصري ف-PCR. أجهزة الطرد المركزي لوحة لفترة وجيزة. تحميللوحة في كتلة التدفئة الجهاز QPCR وإغلاق الغطاء.
- فتح مدير برنامج QPCR. انقر فوق علامة التبويب "بروتوكول"، انقر فوق "خلق فرص عمل جديدة"، إضافة للشروط التضخيم التالية: 3 دقائق و 95 درجة مئوية، (10 ثانية 95 درجة مئوية و 30 ثانية 60 درجة مئوية) × 40 دورة. ضبط حجم العينة إلى 20 ميكرولتر، انقر فوق "موافق" وإنقاذ البروتوكول.
- انقر على "لوحة" علامة التبويب. تحت عنوان "تحرير اختيار" فوق "تحديد fluorophore"، إضافة الصبغة تقرير لجنة التحقيق المناسب، على سبيل المثال، فلوريسئين. انقر على زر "موافق".
- تسليط الضوء على الآبار التي تحتوي على المعايير وتحديد "معايير" من القائمة "نوع العينة". انقر على "تكرار مسلسل" لتغيير "تكرار حجم" إلى 3، انقر فوق "تطبيق". انقر على "سلسلة التخفيف" لإضافة تركيز انطلاق المحسوب لمعيار 1، تشير إلى عامل التخفيف (10)، حدد "خفض" أو "زيادة" تبعا لترتيب وأضاف المنحنى القياسيلوحة. انقر على "تطبيق".
- تسليط الضوء على جانب المواقف التي تحتوي على عينات غير معروفة، حدد "المجهول" من نوع "عينة" القائمة المنسدلة. انقر على "تكرار مسلسل" وتغيير "تكرار حجم" إلى 3. انقر على "تطبيق". تعديل أسماء عينة تحت "اسم عينة". كرر الإجراء للا الضوابط قالب (NTC) بئرا.
- انقر على زر "موافق" على مربع تحرير لوحة وحفظ الملف. انقر على "بدء تشغيل".
- على الانتهاء من المدى، سيتم فتح نافذة تحليل البيانات. انقر فوق علامة التبويب "الكمي" لعرض المنحنى القياسي، واصفات القياسية منحنى (الجدول 8) والمؤامرات التضخيم.
- انقر على "البيانات الكمي" علامة تبويب القيم حزب المحافظين ومناظرة تبدأ كمية من الجينات (SQ) من العينات المجهولة. الجدول التصدير لبرنامج جداول البيانات إذا لزم الأمر.
- الكميات المتوفرة من الجينات مضاعفة من العينات المجهولة من قبل عامل التخفيف، وكمية من انتزاع الرواسبتيد من وإجمالي حجم الأحماض النووية ومزال في الحصول على نسخ الجينات في كل غرام من الوزن الرطب الرواسب.
ملاحظة: أزل الحمض النووي من 0.5 غرام من الرواسب في 50 ميكرولتر، وتمييع 1/10، إضافة 1 ميكرولتر كقالب الى رد فعل Q-PCR. حساب الجين نسخ ز -1 الرواسب بضرب: نسخ الجين ميكرولتر من الحمض النووي س تخفيف حجم س عامل شطف × 2.
النتائج
استخراج الحمض النووي ذات نوعية جيدة والحمض النووي الريبي من الرواسب هو الخطوة الأولى في تحديد كمية الجينات ونسخة فرة. والناجحة عائدات استخراج واضحة DNA و RNA العصابات كما هو مبين في الشكل رقم 1 لعينة AC، حيث حادة العصابات 23S و 16S الريباسي مرئية بالإضافة إلى الوزن الجزيئي الفرقة عالية الحمض النووي الجيني.
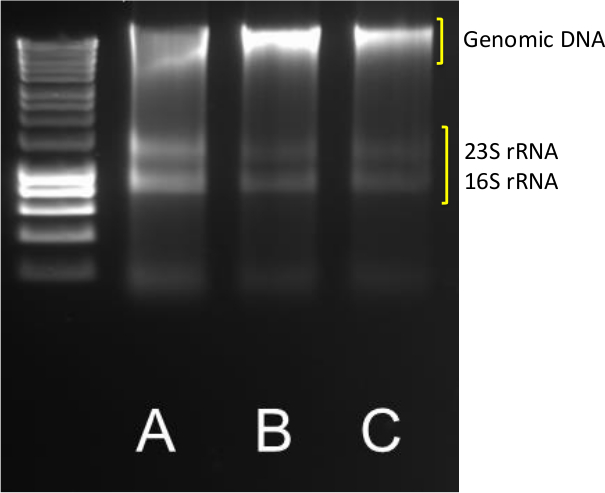
الشكل 1. الحمض النووي / استخراج الحمض النووي الريبي. النتائج النموذجية من استخراج الحمض النووي / الحمض النووي الريبي من ثلاث نسخ (ABC) 0.5 غرام الرواسب الساحلية. تم تشغيل 5 ميكرولتر من DNA / RNA على الاغاروز 1.4٪ إلى 85 V لمدة 40 دقيقة. تم استخدام الواسمات الجزيئية في نطاق 10،037-200 مضت. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
-together.within الصفحات = "1"> إعداد RNA، وهضم الحمض النووي المستخرج من شارك إلزامي. هذا يجب أن يتبعه 16S الريباسي نقطة النهاية PCR من الحمض النووي الريبي للتأكد من أن الحمض النووي قد أزيلت بنجاح. إذا كان الحمض النووي قد أزيلت تماما فقط لوحظ الفرقة في السيطرة الإيجابية. من المهم استخدام كل أنيق وتخفيف 1:10 من الحمض النووي الريبي لضمان مثبطات لا تمنع تشكيل المنتج PCR. يمكن RNA الآن تخضع رد فعل الناسخ العكسي لتحويلها إلى كدنا]. هذا لا يمكن أن يؤديها إما الاشعال الجينات المحددة أو hexamers عشوائي. عادة، ويتم التفاعل في جهاز PCR، وذلك لضمان درجة حرارة الأمثل. ويستخدم هذا كدنا] كقالب في رد فعل QPCR لاحق. وكميا الحمض النووي والحمض النووي الريبي لتحديد تركيز القالب المستخدم في كل رد فعل.
ووضع الخطوط العريضة لبروتوكول رد فعل QPCR تستهدف 16S الريباسي الحمض النووي. ل16S الريباسي النصوص استبدال مكعب قياسيRVE وقالب مع كدنا]. كما وكميا عينات غير معروفة ضد منحنى القياسية، لا بد من التأكد من أن المنحنى القياسي هو من نوعية جيدة الشكل 2 يوضح إعداد (A)، والمنحنيات القياسية والتخفيفات الحمض النووي البيئي، (ب)، والتضخيم من المنحنى القياسي والعينات البيئية (C) تحويل المنحنى القياسي لالانحدار الخطي وحساب الأرقام نسخة الجين. عندما مجموعة التخفيف 10 أضعاف على استعداد بشكل صحيح وتضخيم فرق 3.3 دورة بين كل تخفيف معيار ينظر (يستغرق 3.3 دورات لزيادة عشرة أضعاف في قالب 100٪ كفاءة التضخيم) (الشكل 2Bi). والمطلوب المنحنيات واصفات القياسية، بما في ذلك القيم R 2 من 0.99 والكفاءة PCR في نطاق بين 90 و 110٪ (الشكل 2C). من المهم أن يقدم القيم حزب المحافظين من أي سيطرة قالب (NTC) إذا كان موجودا. إذا حدث هذا الانقطاع حزب المحافظين لمعايير والعينات المجهولة 3.3 دورات (<م> أي أضعاف سجل) أعلى من القيمة حزب المحافظين من المجلس الوطني الانتقالي تفرض 20 (الشكل 2Cii). وكميا قالب غير معروف المستخرجة من الحمض النووي الرسوبيات من أنيق، 10 -1، 10 -2 و 10 -3 التخفيفات (B). لم العينة أنيق لا تضخيم، وكانت القيم حزب المحافظين من 10 -1 إلى 10 -3 التخفيفات 24.12، 26.02 و 28.40 على التوالي. وكان المجلس الوطني الانتقالي حزب المحافظين 30.5، وفرضت على قطع NCT من 27.2. تحويل الكميات المتوفرة من الجينات إلى ز -1 أدى الوزن الرطب الرواسب في 2.5 × 10 7 و 7.1 × 10 7 10 -1 و 10 -2 على التوالي لمجموعة التخفيف. وكان 10 -3 تخفيف حزب المحافظين تحت قطع المجلس الوطني الانتقالي، وبالتالي لم يتم استخدام. في هذه الحالة تم اختيار -2 10 كما في تخفيف القالب الأمثل.

الشكل 2. 16S الريباسي الجينات QPCR التضخيم من المعايير والحمض النووي البيئي المستخرجة من الرواسب الساحلية. إعداد (A) ط) مستوى الحمض النووي منحنى والثاني) التخفيفات الحمض النووي البيئي لQPCR التضخيم، (ب) QPCR التضخيم ط) منحنى مستوى الحمض النووي وب) العينات البيئية، مبينة حزب المحافظين لكل عينة. (C) ط) الانحدار الخطي للمنحنى القياسية مع واصفات منحنى القياسية؛ ب) حساب الكميات المتوفرة من الجينات من عينات بيئية. المجلس الوطني الانتقالي: سلبي تحكم قالب الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
| كاشف | كمية |
| CTAB | 5 ز |
| ك 2 هبو 4 x3H 2 O | 2.58 ز |
| KH 2 PO 4 | 0.1 غرام |
| كلوريد الصوديوم | 2.05 ز |
| O 2 درهم | ما يصل الى 100 مل |
الجدول 1. إعداد عازلة CTAB فوسفات.
| كاشف | كمية |
| PEG 6000 | 30 ز |
| كلوريد الصوديوم | 9.35 ز |
| O 2 درهم | ما يصل الى 100 مل |
| ملاحظة: إضافة PEG 6000 ببطء تحت التدفئة المعتدلة والتحريك من 50 مل من درهم 2 O. | |
ضمن الصفحات = "1"> الجدول 2. إعداد PEG-كلوريد الصوديوم حل هطول الأمطار.
| كاشف | كمية |
| RNA مخفف / 01:10 RNA المخفف | 1.0 ميكرولتر |
| 10X PCR العازلة | 5.0 ميكرولتر |
| dNTPs 10 ملي | 1.0 ميكرولتر |
| 63F التمهيدي إلى الأمام | 1.0 ميكرولتر |
| CAG دول مجلس التعاون الخليجي TAA CAC ATG الجهاز المركزي للمحاسبات GTC | |
| 518R التمهيدي العكسي | 1.0 ميكرولتر |
| ATT ACC GCG GCT GCT GG | |
| طق البلمرة | 0.4 ميكرولتر |
| خالية من ريبونوكلياز درهم 2 O | 40.6 ميكرولتر |
ه = "1"> الجدول 3. نوعية RNA مزيج الاختيار PCR سيد خالية من الحمض النووي.
| كاشف | كمية |
| RNA | 0،5-5 ميكروغرام |
| dNTPs 10 ملي | 1 ميكرولتر |
| التمهيدي عكسي 10 ميكرومتر / Hexamers عشوائية 50 ميكرومتر | 1 ميكرولتر |
| DEPC-H 2 O | ما يصل الى 13 ميكرولتر |
الجدول 4. [كدنا مزيج رد فعل التوليف أ.
| كاشف | كمية |
| عازلة 5X | 4 ميكرولتر |
| DTT | 1 ميكرولتر |
| ريبونوكلياز المانع | 1 ميكرولتر |
| الناسخ العكسي | 1 ميكرولتر |
الجدول 5. [كدنا مزيج رد فعل التوليف B.
| هدف | اسم التمهيدي | تسلسل | الصلب T (درجة مئوية) | مرجع |
| البكتيريا 16S الريباسي | Bact1369F | CGG TGA ATA CGT TCY CGG | 56 | سوزوكي وآخرون 2000 19 |
| Prok1492R | GGW TAC CTT GTT ACG ACT T | |||
| TM1389F (التحقيق) | CTT GTA CAC ACC دول مجلس التعاون الخليجي CGT C |
| كاشف | كمية |
| 2X ميكس ماستر | 10 ميكرولتر |
| التمهيدي إلى الأمام (10 ميكرومتر) | 0.8 ميكرولتر |
| التمهيدي العكسي (10 ميكرومتر) | 0.8 ميكرولتر |
| مسبار (10 ميكرومتر) | 0.4 ميكرولتر |
| ماء | 7.0 ميكرولتر |
| الحجم النهائي | 19 ميكرولتر |
الجدول 7. في الوقت الحقيقي مزيج تفاعل PCR.
| واصف | أهمية |
| معامل الارتباط (R 2) | مقياس الخطي من المنحنى القياسي. ومن الناحية المثالية ينبغي أن يكون R 2 = 1. قيمة R 2 = 0،98-0،99 مقبولة. |
| المنحدر (α) | مقياس لكفاءة التفاعل. ومن الناحية المثالية ينبغي أن يكون معادلا ل-3.32. قيمة في نطاق بين -3.58 و -3.1. |
| الكفاءة (= 10 (-1 / المنحدر) -1) | إذا هو 100٪، وقوالب الزوجي بعد كل دورة الحرارية خلال التضخيم الهائل. مجموعة كفاءة جيدة ما بين 90 و 110٪. |
| Y الإعتراض (β) | الحد النظري للكشف عن رد فعل. على الرغم من أن لا تستخدم لتحديد الحساسية رد فعل، فمن المهم عند مقارنة منحنيات مستوى مختلفة لنفس الهدف. |
الجدول 8. QPCR اصفات رد فعل.
Discussion
مزيج من الحمض النووي استخراج / RNA مع QPCR يوفر، طريقة فعالة نسبيا من حيث التكلفة سريعة ودقيقة لتقدير حساسية من الجين ونسخة فرة من مجموعة من العينات البيئية، مثل الرواسب الساحلية.
استخراج الحمض النووي الأولي هو خطوة حاسمة لضمان عرض تمثيلي من الجراثيم الحاضر المجتمع ويتحقق 22. تحتاج إلى النظر فيها لبروتوكول استخراج عدد من القيود: أ) تحقيق إجمالي تحلل الخلية، ب) المشارك استخراج المركبات المثبطة (على سبيل المثال، الأحماض الدبالية أو polyphenolics)، ج) تلويث الحمض النووي في جزء RNA، د) تدهور السريع في الأحماض النووية المستخرجة عند تخزينها. يجب اتخاذ الاحتياطات اللازمة من أجل الالتفاف على هذه القيود. على سبيل المثال، عناية خاصة لابد من اتخاذها لضمان استخلاص الأحماض النووية هو الأمثل لنوع العينة (على سبيل المثال، الرسوبيات والتربة ومياه الصرف الصحي، الخ). تحسينات كبيرة في العائد الحمض النووي والجودة لكل من الحمض النووي والحمض النووي الريبي لا يمكن أن يتحقق من خلال تنفيذ التجارب الأولية 23. للحد من تأثير المركبات المثبطة على التطبيقات القائمة على PCR-24، واختبار مجموعة من التخفيفات من الحمض النووي المستخرج والحمض النووي الريبي. للالتفاف على التدهور السريع في استخراج الحمض النووي / الحمض النووي الريبي من عدة دورات تجميد ذوبان الجليد وتجنب الخسارة المحتملة للمعلومات الوراثية، وتخزين متعددة قسامات صغيرة الحجم في -80 درجة مئوية.
عندما صممت بعناية، QPCR هو وسيلة قوية، تكرار للغاية وحساسة. والجدير بالذكر أن وسائل لتضخيم وبناء منحنى القياسية المبينة في هذا البروتوكول يمكن تكييفها لأي هدف الجينات في المصالح، بما في ذلك علامات أخرى النشوء والتطور (أي archaeal 16S الريباسي، الفطرية 18S الريباسي) أو الجينات المسؤولة عن وظائف مهمة في البيئة. قيود المعروفة في استخدام QPCR هي: أ) توليد استنساخه عالية الجودة الصورةمنحنى tandard لتقدير المطلق، ب) اختيار التمهيدي / تحقيقات وتعظيم الاستفادة من الظروف فحص ف-PCR، ج) استخدام منخفضة الجودة / المنفصمة الأحماض النووية، د) اختيار التخفيف عمل DNA / RNA لتجنب تثبيط . وعلاوة على ذلك، فإنه لابد من النظر أن QPCR تقنية توفر الكميات المتوفرة من الجينات / نسخة التي قد لا تساوي الخلية تهم: هذا هو الحال بصفة خاصة عندما يتم استهداف الجينات 16S و 18S الريباسي، والكائنات الحية الدقيقة ديها أعداد نسخة مختلفة من الجينات الريباسي في جيناتهم 25.
سوف الفقيرة منحنيات معايير الجودة يؤدي إلى تقدير دقيق من الجينات في المصالح. ومن الممارسات الجيدة لتخزين مخزون من معايير عالية التركيز في قسامات صغيرة يمكن من خلالها جعل منحنيات معيار جديدة. لا تخزن المنحنيات القياسية، ودائما التخفيفات جديدة من الأسهم إلى أعلى تركيز في كل مرة. لتقدير دقيق للعينات البيئية ضمان مجموعة من تركيزات ستانمنحنى المعيارية يمتد القيم حزب المحافظين المتوقعة من العينات غير معروف. عندما قياس النصوص، بناء منحنى قياسي من الحمض النووي الريبي لا مضاعفة الحمض النووي الذين تقطعت بهم السبل. عندما يكون ذلك ممكنا، يجب أن تكتمل الكمي للعينات لمقارنة مباشرة في فحص واحد لتجنب بين فحص التباين 20. قد لا يكون هذا ممكنا دائما. لذلك، لمقارنة الكميات المتوفرة من الجينات المولدة بين المقايسات فإنه من المستحسن أن يكون عشوائي مجموعة فرعية من عينات النسخ المتماثل بين المقايسات. تشكيلة واسعة من التمهيدي والتحقيق مجموعات متاحة للQPCR تستهدف الأنواع الميكروبية والمجموعات الوظيفية وهناك حاجة 15. دراسة متأنية عند اختيار هذه لضمان كل من التغطية القصوى وخصوصية للمجموعة المستهدفة حاليا. اذا كانت كفاءة رد فعل من فحص QPCR ليست مرضية، ويبدأ استكشاف الأخطاء وإصلاحها مع اختبار مختلف الظروف الدراجات الحرارية (كما زمنية الصلب و / أو درجة الحرارة) و / أو ظروف التفاعل، على سبيل المثال، تركيزات التمهيدي مسبار متفاوتة. Oالامتحانات التنافسية الوطنية هي الأمثل للمقايسة ورد فعل الظروف ف-PCR، دائما إجراء اختبار أولي لمجموعة من التخفيفات DNA / كدنا] لتحديد تركيز القالب المناسب. حدد نطاق التخفيف مما أدى إلى أكبر عدد نسخة في التخفيف القالب الأمثل لمزيد من الفحوص.
حاليا، تقنيات التسلسل الجيل المقبل من تسليط الضوء على كفاءة بنية المجتمع الميكروبي وظائف في عدد كبير من البيئات 26،27،28. ومع ذلك، غالبا ما تقوم هذه المجموعات على نقطة النهاية المكتبات amplicon PCR، وبالتالي لا توفر سوى تقديرات شبه الكمية من وفرة الأنواع معين. وبالتالي، فإن القدرة في الوقت الحقيقي تقنية PCR القائم لاستهداف علامات تصنيفية معينة (من مجال العالي وصولا الى مستوى سلالة) يسمح التحقق من صحة الفعال للنتائج التي حصل عليها الجيل المقبل من التسلسل. وعلاوة على ذلك، تم استخدام QPCR بنجاح في تركيبة مع البيئة الميكروبية أساليب أخرى الجزيئية مثل ايزو مستقرتوب التحقيق (SIP) أو المجهرية النشوء والتطور / وظيفية. جنبا إلى جنب مع أداة السابقة، QPCR يمكن استخدامها لقياس مجتمع نشط أيضي 29،30. عندما جنبا إلى جنب مع تحليل ميكروأري، يوفر QPCR التفسير الكمي الرئيسي من المسوح علامة والجينات الوظيفية النشوء والتطور من بيئات 31،32.
لذلك، سواء كان استخدامها وحدها أو بالاشتراك مع (غالبا على أساس عملية) التقييمات الأخرى من وظيفة النظام الإيكولوجي، الكمي PCR هو أداة أساسية لعلماء البيئة الميكروبية في استكشاف ارتباط بعيد المنال بين المجتمعات الميكروبية وظائف النظم الإيكولوجية.
Disclosures
The authors have nothing to disclose.
Acknowledgements
وقد انبثقت هذه النشرة من الأبحاث التي أجريت بدعم مالي من مجلس بحوث البيئة الطبيعية (NERC) تحت رقم منحة NERC NE / JO11959 / 1 و العلوم أيرلندا مؤسسة وللعمل COFUND ماري كوري تحت رقم جرانت 11 / SIRG / B2159awarded إلى CJS والأكاديمية اتحاد البحوث الشرقية (شرق ARC).
Materials
| Name | Company | Catalog Number | Comments |
| Diethylpyrocarbonate | Sigma | 40718 | Toxic, open under chemical hood |
| cetrimonium bromide (CTAB) | Sigma | 52365 | Irritant, open under chemical hood |
| potassium phosphate dibasic | Sigma | RES20765 | |
| potassium phosphate monobasic | Sigma | P9791 | |
| Phenol : Chloroform : Isoamylalcohol pH 8 | Sigma | P2069 | Equilibrate at pH 8 before using |
| Chloroform : Isoamylalcohol | Sigma | 25666 | |
| sodium chloride | VWR | 1.06404.0500 | |
| polyethylenglycol 6000 | VWR | 528877-100 | |
| Ethanol Molecular Grade | Sigma | E7148 | |
| Lysing Matrix E tubes | MP Biomedical | 116914050 | |
| Turbo DNAse | Ambion | AM1907 | |
| Taq polymerase | Sigma | D1806 | |
| dNTPs | Bioline | BIO-39028 | |
| SuperScript III | Life Technologies | 18080044 | |
| Rnase Inhibitor | Life Technologies | 10777019 | |
| RNAse/DNAse free 0.2 ml PCR tubes | Sarstedt | 72.985.002 | |
| SureCleanPlus | Bioline | BIO-37047 | |
| pGEM Easy T Vector | Promega | A1360 | |
| E. coli JM109 competent cells | Promega | L2005 | |
| Tryptone | Sigma | T7293 | |
| Yeast Extract | Sigma | 70161 | |
| Ampicillin | Sigma | 59349 | |
| X-Gal | Bioline | BIO-37035 | |
| IPTG | Bioline | BIO-37036 | |
| Agar | VWR | 20768.235 | |
| Plasmid Midi Kit | Qiagen | 12143 | |
| Qubit | Life Technologies | Q33216 | |
| Quant-IT DNA HS Assay | Life Technologies | Q-33120 | |
| Quant-IT RNA HS Assay | Life Technologies | Q32855 | |
| MEGAshortscript kit | Ambion | AM1354 | |
| TaqMan SensiFast Probe Lo-ROX kit | Bioline | BIO-84002 | |
| qPCR machine |
References
- Epstein, S. S. The phenomenon of microbial uncultivability. Curr. Opin. Microbiol. 16 (5), 636-642 (2013).
- Zhou, J., Bruns, M. A., Tiedje, J. M. DNA recovery from soils of diverse composition. Appl. Environ. Microbiol. 62, 316-322 (1996).
- Miller, D. N., Bryant, J. E., Madsen, E. L., Ghiorse, W. C. Evaluation and optimization of DNA extraction and purification procedures from soil and sediments samples. Appl. Environ. Microbiol. 65 (11), 4715-4724 (1999).
- Burgmann, H., Pesaro, M., Widmer, F., Zeyer, J. A strategy for optimizing quality and quantity of DNA extracted from soil. J. Microbiol. Methods. 45 (1), 7-20 (2001).
- Hurt, R. A., et al. Simultaneous recovery of RNA and DNA from soils and sediments. Appl. Environ. Microbiol. 67, 4495-4503 (2001).
- Griffiths, R. I., Whiteley, A. S., O'Donnell, A. G., Bailey, M. J. Rapid method for coextraction of DNA and RNA from natural environments for analysis of ribosomal DNA- and rRNA-based microbial community composition. Appl. Environ. Microbiol. 66 (12), 5488-5491 (2000).
- Martins, G., et al. Structure and activity of lacustrine sediment bacteria involved in nutrient and iron cycles. FEMS Microbiol. Ecol. 77 (3), 666-679 (2011).
- Kuffner, M., et al. Effects of season and experimental warming on the bacterial community in a temperate mountain forest soil assessed by 16S rRNA gene pyrosequencing. FEMS Microbiol. Ecol. 82 (3), 551-562 (2011).
- Tatti, E., et al. Influences of over winter conditions on denitrification and nitrous oxide-producing microorganism abundance and structure in an agricultural soil amended with different nitrogen sources. Agric. Ecosyst . Environ. 183, 47-59 (2014).
- Giovannoni, S. J., Britschgi, T. B., Moyer, C. L., Field, K. G. Genetic diversity in the Sargasso Sea bacterioplankton. Nature. 345, 60-62 (1990).
- Ward, D. W., Weller, R., Bateson, M. M. 16S rRNA sequences reveal numerous uncultured microorganisms a natural community. Nature. 345, 63-65 (1990).
- Suzuki, M. T., Giovannoni, S. J. Bias caused by template annealing in the amplification of mixture of 16S rRNA genes by PCR. Appl. Environ. Microbiol. 62, 625-630 (1996).
- Wittwer, C. T., Herrmann, M. G., Moss, A. A., Rasmussen, R. P. Continuous fluorescence monitoring of rapid cycle DNA amplification. Biotechniques. 22, 130-138 (1997).
- Holland, P. M., Abramson, R. D., Watson, R., Gelfand, D. H. Detection of Specific Polymerase Chain Reaction Product by Utilizing the 5' 3' Exonuclease Activity of Thermus aquaticus DNA Polymerase. PNAS. 88, 7276-7280 (1991).
- Smith, C. J., Osborn, A. M. Advantages and limitations of quantitative PCR (Q-PCR)-based approaches in microbial ecology. FEMS Microbiol. Ecol. 67, 2-20 (2009).
- Park, S. J., Park, B. J., Rhee, S. K. Comparative analysis of archaeal 16S rRNA and amoA genes to estimate the abundance and diversity of ammonia-oxidizing archaea in marine sediments. Extremphiles. 12 (4), (2008).
- Urakawa, H., Yoshida, T., Nishimura, M., Ohwada, K. Characterization of depth-related population variation in microbial communities of a coastal marine sediment using 16S rDNA-based approaches and quinone profiling. Environ. Microbiol. 2, 542-554 (2008).
- Smith, C. J., Dong, L. F., Wilson, J., Stott, A., Osborn, A. M., Nedwell, D. B. Seasonal variation in denitrification and dissimilatory nitrate reduction to ammonia process rates and corresponding key functional genes along an estuarine nitrate gradient. Front. Microbiol. 6, 542(2015).
- Sambrook, J., Russell, D. W. Molecular Cloning: a laboratory manual. , Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press. 205(2001).
- Smith, C. J., Nedwell, D. B., Dong, L. F., Osborn, A. M. Evaluation of Quantitative Polymerase Chain Reaction (Q-PCR) based approaches for determining gene copy and gene transcript numbers in environmental samples. Environ. Microbiol. 8 (5), 804-815 (2006).
- Suzuki, M. T., Taylor, L. T. DeLong E.F., Quantitative analysis of small-subunit rRNA genes in mixed microbial population via 5'-nuclease assays. Appl. Environ. Microbiol. 66, 4605-4614 (2000).
- Luna, G. M., Dell'Anno, A., Danovaro, R. DNA extraction procedure: a critical issue for bacterial diversity assessment in marine sediments. Environ. Microbiol. 8 (2), 308-320 (2005).
- Lever, M. A., Torti, A., Eickenbursch, P., Michaud, A. B., Šantl-Temkiv, T., Jørgensen, B. B. A modular method for the extraction of DNA and RNA, and the separation of DNA pools from diverse environmental sample types. Front. Microbiol. 6, 476(2015).
- Lloyd, K. G., MacGregor, B. J., Teske, A. Quantitative PCR methods for RNA and DNA in marine sediments: maximizing yield while overcoming inhibition. FEMS Microbol. Ecol. 72, 144-151 (2010).
- Klappenbach, J. A., Dumbar, J. M., Schmidt, T. M. rRNA Operon copy number reflects ecological strategies of bacteria. App. Environ. Microbiol. 66 (4), 1328-1333 (2000).
- Shi, Y., Tyson, G. W., Eppley, J. M., DeLong, E. F. Integrated metatrascriptomic and metagenomics analyses of stratified microbial assemblages in the open ocean. ISME J. 5, 999-1013 (2011).
- Howe, A. C., Jansson, J. K., Malfatti, S. A. Tringe S.G., Tiedje J.M., & Brown C.T. Tackling soil diversity with the assembly of large, complex metagenomes. PNAS. 111 (13), 4904-4909 (2014).
- Klaedtke, S., et al. Terroir is a key driver of seed-associated microbial assemblages. Environ. Microbiol. , (2015).
- Lueders, T., Wagner, B., Claus, P., Friedrich MW, Stable isotope probing of rRNA and DNA reveals a dynamic methylotroph community and trophic interactions with fungi and protozoa in oxic rice field soil). Environ. Microbiol. 6, 60-72 (2004).
- Kunapuli, U., Lueders, T., Meckenstock, R. U. The use of stable isotope probing to identify key iron-reducing microorganisms involved in anaerobic benzene degradation. ISME J. 1, 643-653 (2007).
- Bürgmann, H., et al. Transcriptional response of Silicibacter pomeroyi DSS-3 to dimethylsulfoniopropionate (DMSP). Environ. Microbiol. 9 (11), 2742-2755 (2007).
- He, J. Z., et al. Geochip: a comprehensive microarray for investigating biogeochemical ecological and environmental processes. ISME J. 1, 67-77 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved