Method Article
في نقل فيفو جين لخلايا شوان في العصب القوارض وركي من Electroporation لل
In This Article
Summary
Here, we present an in vivo technique for gene transfer to Schwann cells (SCs) in the rodent sciatic nerve. This simple technique is useful for investigating signaling mechanisms involved in the development and maintenance of myelinating SCs.
Abstract
The formation of the myelin sheath by Schwann cells (SCs) is essential for rapid conduction of nerve impulses along axons in the peripheral nervous system. SC-selective genetic manipulation in living animals is a powerful technique for studying the molecular and cellular mechanisms of SC myelination and demyelination in vivo. While knockout/knockin and transgenic mice are powerful tools for studying SC biology, these methods are costly and time consuming. Viral vector-mediated transgene introduction into the sciatic nerve is a simpler and less laborious method. However, viral methods have limitations, such as toxicity, transgene size constraints, and infectivity restricted to certain developmental stages. Here, we describe a new method that allows selective transfection of myelinating SCs in the rodent sciatic nerve using electroporation. By applying electric pulses to the sciatic nerve at the site of plasmid DNA injection, genes of interest can be easily silenced or overexpressed in SCs in both neonatal and more mature animals. Furthermore, this in vivo electroporation method allows for highly efficient simultaneous expression of multiple transgenes. Our novel technique should enable researchers to efficiently manipulate SC gene expression, and facilitate studies on SC development and function.
Introduction
The rapid transmission of sensory and motor information in the peripheral nervous system is permitted by the myelin sheath, which is formed by myelinating Schwann cells (SCs)1. Insulation of axons by the myelin sheath enables saltatory conduction, which increases the speed of nerve impulses. In disorders in which the development or maintenance of the myelin sheath is impaired, nerve conduction speed is reduced. This results in neuropathy involving motor and sensory dysfunction. Although there are many studies on the molecular mechanisms of myelination and demyelination in the peripheral nervous system, the roles of the numerous proteins involved in these processes remain unclear.
To study the molecular mechanisms of SC myelination/demyelination in vivo, genetic approaches have been used to modify gene expression in animals. A powerful approach is the use of knockout/knockin or transgenic animals. However, the generation of these animals is expensive and time consuming. For SC-specific gene manipulation, crossing floxed strains with Cre mice or other conditional gene expression methods are necessary. This again is laborious and time intensive. In recent years, a cutting-edge genetic technology, the CRISPR-Cas9 system, has made the generation of genetically modified mice much quicker (about 4 weeks)2,3, but this method is hindered by target sequence limitations, and suffers from off-target effects. As an alternative method, viral vector-mediated gene transfer is a faster and easier method of achieving gene transfer into SCs in vivo4-6. Indeed, the generation of viral vectors is less expensive, and takes a shorter time (within a few weeks), and gene manipulation of SCs can be achieved by simply injecting engineered viral vectors, such as adenoviral vectors, adeno-associated viral (AAV) vectors, and lentiviral vectors, into the sciatic nerve. Because these viral vectors have different characteristics, users have to choose the one best suited for their purpose. Adenoviral vectors infect axons and SCs in both young and mature sciatic nerves. In particular, adenoviral vectors have higher selectively for non-myelinating SCs than myelinating SCs. Adenoviruses can cause immune responses, and accordingly, immunodeficient strains should be used5. AAV vectors are currently the most widely used viral vectors, and allow in vivo gene transfer with lower toxicity7. AAV can transduce both axons and SCs by direct injection into the nerve fibers8,9. However, AAV-mediated protein expression usually requires 3 weeks or longer to reach maximum levels7,9. Therefore, it is difficult to analyze myelination, which actively progresses during the two week postnatal period. Lentiviral vectors have higher selectively for myelinating SCs than non-myelinating SCs, and do not have toxic effects on sciatic nerves. However, lentiviral vectors do not infect SCs in more mature nerves5, and therefore are unsuitable for analyzing events such as the demyelination process.
Electroporation is another faster and easier approach to achieve in vivo gene transfer. It has been reported that in vivo transfection of SCs can be achieved when electroporation is applied to transected rat sciatic nerves10. However, because this method requires nerve transection for gene delivery, the application is limited to the analysis of the damaged nerves. Here, we describe an alternative method that allows the delivery of transgenes into myelinating SCs in intact rat sciatic nerves using electroporation11. This method requires plasmid construction, which can usually be completed within a week. Then, by simply delivering electric pulses to the site on the sciatic nerve where the plasmid DNA was injected, highly selective transfection of myelinating SCs can be achieved in neonatal as well as in more mature animals. By electroporating multiple plasmids, simultaneous expression of a variety of genes can be easily achieved. The ability to simultaneous express multiple molecules, such as signaling proteins, short-hairpin RNAs (shRNAs) and functional probes, is crucial for investigating complex processes such as myelination and demyelination. The novel in vivo electroporation method described in this paper will be a powerful tool, allowing researchers to analyze the function of a multitude of molecules and their interactions in myelinating SCs.
Protocol
وكان استخدام الفئران للبحث في فقا للمبادئ التوجيهية التي وضعتها لجنة رعاية الحيوان في جامعة طوكيو.
1.Preparation DNA البلازميد
- توليد البلازميدات الحمض النووي في الجسم الحي Electroporation للعن طريق استنساخ فرعي [كدنا] أو تسلسل shRNA إلى التعبير البلازميد لخلايا الثدييات 12. استخدام الفيروس المضخم للخلايا فوري في وقت مبكر محسن والدجاج β-أكتين المروج الانصهار (CAG) يحركها المروج البلازميد 13 لأنه يسمح تعبير قوي ومستقر. للتعبير عن shRNAs تحت سيطرة أحد المروجين CAG، استخدام نظام الكاسيت shRNA القائم على mir30 لاستنساخ فرعي لshRNA 14.
- تنقية DNA البلازميد مع مجموعة ماكسي الإعدادية وفقا لتعليمات الشركة الصانعة، و resuspend الحمض النووي مع مخزنة المالحة HEPES (140 ملي مول كلوريد الصوديوم، 0.75 ملي نا 2 هبو 4، 25 ملي HEPES، ودرجة الحموضة 7.40). ضبط تركيز الحمض النووي ل≥4 ميكروغرام / ميكرولتر.
- إعداد الحل DNA البلازميد إلى تركيز من 4 ميكروغرام / ميكرولتر وإضافة كمية صغيرة من الصبغة الخضراء السريع (تركيز النهائي من 0.01٪) لتسمية موقع الحقن. عندما تكون هناك حاجة Electroporation للوقت واحد من البلازميدات متعددة، وضبط التركيز الكلي من الحل DNA البلازميد إلى 4 ميكروغرام / ميكرولتر.
ملاحظة: يجب تحديد تكوين الأمثل من السلطات الوطنية المعينة بلازميد وفقا للكفاءة ترنسفكأيشن من كل البلازميد.
2. تعقيم الأدوات الجراحية والمالحة
- الأدوات الجراحية الأوتوكلاف وحل كلوريد الصوديوم 0.9٪.
3. إعداد من micropipette الزجاج
- سحب الماصات الزجاج باستخدام مجتذب ماصة. قطع غيض من ماصة ليبلغ قطرها 30-50 ميكرون. استخدام المعلمات التالية: الحرارة، 600؛ سرعة، 50؛ الوقت، 75.
4. جراحة الحيوان، حقن الحمض النووي و Electroporation
ملاحظة: هناك أكثر منيوصف ضوء هذه الخطوة في الشكل 1. وعلى الرغم من وصف إجراءات الفئران الوليدة هنا، الأسلوب ينطبق أيضا على الحيوانات أكثر نضجا باستخدام نفس الإجراء.
- تخدير الفئران مع isoflurane في مربع الاستقراء حتى يصبح حيوان متحرك عن طريق ضبط تدفق الأوكسجين إلى 0.4 لتر / دقيقة وتركيز الأيزوفلورين إلى 4٪ (المجلد / المجلد). أداء أخمص القدمين معسر لتأكيد التخدير المناسب.
- وضع الفئران على أكثر دفئا مسخن تحت المجهر مجهر، والحفاظ على التخدير عن طريق إعطاء باستمرار الأيزوفلورين من خلال القناع عن وجهه. ضبط تدفق الأوكسجين إلى 0.2 لتر / دقيقة وتركيز الأيزوفلورين إلى 2٪ (المجلد / المجلد). استخدام قطرات العين لمنع جفاف العين إذا أعين الحيوان مفتوحة.
- إصلاح الساقين مع الشريط الجراحية.
- تنظيف الجلد على الفخذ الخلفي مع بوفيدون اليود، وإجراء شق مع مشرط.
ملاحظة: حلاقة المناطق الجراحية إذا تم تغطية المناطق الجراحية مع حالهواء. - فضح العصب الوركي عن طريق إنشاء الافتتاحية بين عضلات الفخذ الفخذية والعضلة ذات الرأسين الفخذية مع الإبر الخياطة.
- الرطب العصب مع 0.9٪ محلول كلوريد الصوديوم. تمتص الماء الزائد مع ورقة خالية من الوبر.
- إدراج قاعدة من micropipette الزجاج على أنابيب مرنة، وملء كمية كافية من محلول الحمض النووي (ميكروليتر واحد على الأقل) في micropipette بواسطة الشفط بلطف.
- رفع العصب تتعرض عن طريق سحب بلطف الجانب البعيد من العصب باستخدام إبرة.
ملاحظة: لا تطبيق التوتر في العصب لتقليل إجهاد ميكانيكي. - إدراج micropipette الزجاج في الموقع البعيد عن العصبية، وحقن محلول الحمض النووي عن طريق ممارسة الضغط (أي عن طريق النفخ في نهاية مفتوحة للأنبوب مرن). حقن محلول الحمض النووي حتى يظهر العصب الخضراء (1 ميكرولتر كحد أقصى). لأن الإدراج المتكرر من micropipette يمكن ان يسبب تلفا في العصب، لا إدراج micropipette أكثر من مرتين.
- وضع TWEعازر من نوع البلاتين الكهربائي حوالي 1-2 ملم بعيدا عن العصبية. سد الفجوة بين القطب والعصب مع 0.9٪ محلول كلوريد الصوديوم.
ملاحظة: لا تضع العصبية مع القطب لتجنب إجهاد على العصب. - تطبيق نبضات كهربائية إلى موقع الحقن باستخدام electroporator مع القطب. بعد مجموعة نبض الأولى، عكس القطب وتطبيق مجموعة نبض آخر. استخدام المعلمات التالية: الجهد، 50 V، مدة النبضة، 5 ميللي ثانية. فترة النبض، 100 مللي ثانية. عدد النبض، 4 مرات.
- تنظيف الموقع Electroporation للمع 0.9٪ محلول كلوريد الصوديوم.
- كرر الخطوات من 4،4-4،11 على العصب الوركي المقابل.
5. بعد Electroporation لل
- إغلاق الشقوق مع الغراء cyanoacrylate.
- بعد تجفيف الغراء، وتنظيف الجرح مع بوفيدون اليود.
- الافراج عن الجرو من قناع الوجه. تدفئة الجرو على دفئا على الأقل لمدة ساعة من أجل السماح لها أن يتعافى تماما من التخدير. دo لن يترك الجرو غير المراقب حتى استعاد وعيه كافية.
- بعد الشفاء من التخدير، والعودة الجرو على الفئران الأم. لا عودة الجرو حتى تعافى تماما.
6. ما بعد الجراحة
- بيت الفئران الوليدة في القفص حتى إجراء التجارب 11 (انظر الأمثلة في الشكل 3). إدارة كاربروفين (5 ملغ / كغ، والملكية الفكرية)، والأدوية غير الستيرويدية المضادة للالتهابات، أو البوبرينورفين (0.1 ملغم / كغم، SC)، وهو مسكن أفيوني، إذا لزم الأمر.
ملاحظة: إذا لم الجرو الفئران تنمو بشكل جيد أو لوحظ التهاب حول موقع الجراحة، واستبعاد الحيوان من التجارب.
النتائج
ويرد مثال على العصب الوركي transfected مع أحمر ببروتين (RFP) -expressing البلازميد في الشكل 2A. خلايا تظهر التشكل الثنائي القطب، وسمة من سمات المنبوذة، و transfected قليلة مع طلب تقديم العروض. تم الكشف عن أي مضان RFP في محاور عصبية. نجد عادة ~ 100 المنبوذة transfected في كل عصب. هذه الكفاءة ترنسفكأيشن يبدو مشابهة لفي الجسم الحي SC كفاءة العدوى باستخدام ناقلات lentiviral 4.
وأظهرت التجارب المناعية أن معظم (~ 96٪) خلايا طلب تقديم العروض الايجابية في P7 المشترك المسمى لS100، علامة SC (الشكل 2B)، و 91٪ من الخلايا طلب تقديم العروض الايجابية في P14 شارك المسمى لم ب ب، علامة myelinating SC (الشكل 2C)، مما يشير إلى أن نقل الجينات من Electroporation للانتقائية للغاية لmyelinating المنبوذة.
إدخال جينات متعددة في المنبوذة في الجسم الحي سيكون مفيدا للغاية للتحقيق في آليات تكون الميالين / إزالة الميالين. والميزة الرئيسية لفي الجسم الحي طريقة Electroporation للالموصوفة هنا هي القدرة على نقل جينات متعددة مع إجراء بسيط. ويبين الشكل 2D صورة تمثل العصب الوركي transfected مع خليط من GFP والبلازميدات، معربا عن طلب تقديم العروض باستخدام electroporation في الجسم الحي. وكانت حوالي 97٪ من الطوائف المنبوذة GFP وطلب تقديم العروض الايجابية مزدوجة، مما يشير إلى أن تسليم كفاءة عالية من جينات متعددة يمكن أن يتحقق ببساطة عن طريق electroporating خليط من البلازميدات متعددة.
في القوارض، تكون الميالين يبادر حول الولادة، وزيادة بشكل كبير خلال الأسبوعين الأولين بعد الولادة، ومن ثم يقلل تدريجيا. وهكذا، عن طريق التلاعب وراثيا المنبوذة خلال هذه النوافذ وقت التنموية، والآليات الكامنة وراء هذه المراحل المختلفة لتكون الميالين يمكن توضيحها. ناقلات lentiviral هي أداة جيدة لnalyzing تكون الميالين، وبخاصة لديهم الحد الأدنى من سمية، ولكن lentiviruses فقط تصيب الأطفال حديثي الولادة الأعصاب الوركي 5،6. في المقابل، نقل الجينات بوساطة Electroporation لليعمل بشكل جيد عندما يتم إجراء ترنسفكأيشن على P3 (الشكل 2E، أعلى) أو على P14 (الشكل 2E، أسفل).
وتوصف التطبيقات من الرواية في طريقة Electroporation للفيفو هنا. ويبين الشكل 3A الصور المجهرية الخفيفة من GFP، معربا عن المنبوذة myelinating في مراحل النمو المختلفة (P7، P14، P21 و P31). عن طريق التحليل المجهري للضوء، والتغيرات في المعايير الشكلية، مثل الطول والقطر، ويمكن تقييم. لاحظ أن هذه الثوابت والقيم مماثلة مقارنة الأعصاب الطرفية الفئران سليمة 15،16، مما يشير إلى أن الأعصاب electroporated تتطور دون آثار ضارة كبيرة. ويبين الشكل 3B الإلكترون صورة مجهرية من LacZ-expressing myelinating المنبوذة. في هذه الحالة، كان يستخدم LacZ باعتباره علامة التعبير. β غالاكتوزيداز تلطيخ باستخدام bluo غال، وهو الركيزة الإيثانول غير قابلة للذوبان، يمكن تحليل تكوين المايلين من المنبوذة transfected بواسطة المجهر الإلكتروني 11،17. في هذه التجارب، ودور الجزيئات يشير يمكن فحص من قبل إسكات أو زيادة التعبير عنها، مما يسمح للتحليل الخسارة من وظيفة أو آثار كسب من وظيفة. بالإضافة إلى تحليل الأنسجة الثابتة، ويمكن تطبيقها في الجسم الحي نقل الجينات بوساطة Electroporation للأيضا أن يعيش تجارب التصوير. على سبيل المثال، الشكل 3C يظهر SC myelinating المشترك، معربا عن G-GECO1.1 18، أخضر فلوري عصاري خلوي كا 2+ المؤشر، وR-GECO1mt 19، أحمر فلوري الميتوكوندريا الكالسيوم 2+ المؤشر. بالإعراب عن هذه المؤشرات، حددنا مسار الإشارات التي تسيطر عصاري خلوي والميتوكوندريا الكالسيوم 2+ التركيزات في myelinating المنبوذة . وبالتالي، يمكن استخدام الأسلوب الحالي لدراسة مجموعة متنوعة من آليات يشير، لا سيما عندما تكون تحقيقات الفلورسنت المشفرة وراثيا المتاحة للكشف عن الإشارات المثيرة للاهتمام.
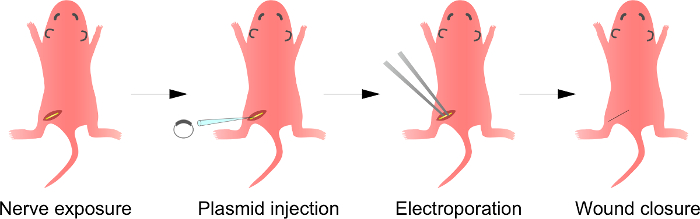
يتعرض التخطيطي للالجسم الحي Electroporation للطريقة الأولى، العصب الوركي من الفئران تخدير ط ن: الشكل 1. ثانيا، يتم حقن الحمض النووي البلازميد في العصب الوركي. يتم تسليم الثالثة، نبضات كهربائية إلى موقع الحقن من خلال القطب على شكل ملقط. وأخيرا، يتم إغلاق الجرح مع الغراء. ويمكن تكرار هذا الإجراء على العصب المقابل. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
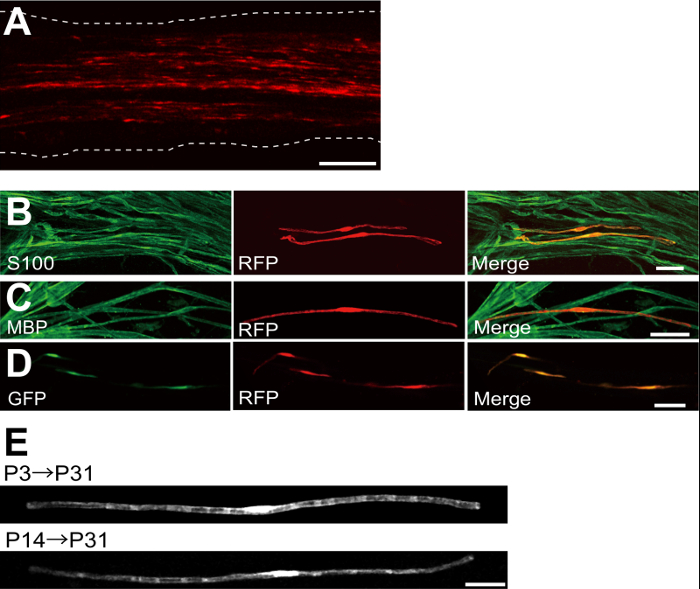
الشكل 2: ممثل النتائج على الأعصاب الوركي Transfected (A) صورة تمثيلية من العصب الوركي transfected. وقد transfected العصب مع البلازميد، معربا عن طلب تقديم العروض في P3، وثابتة في P7. (ب) صورة تمثيلية من خلية transfected طلب تقديم العروض في P7 تظهر colocalization مع S100، علامة SC. (C) صورة تمثيلية من العصب الوركي-transfected طلب تقديم العروض في P14 تظهر colocalization مع م ب ب، علامة myelinating SC. (D) صورة تمثيلية من العصب الوركي cotransfected مع GFP والبلازميدات، معربا عن طلب تقديم العروض. أعرب المنبوذة Transfected في وقت واحد GFP وطلب تقديم العروض. (E) صورة من myelinating المنبوذة في P31 transfected في P3، عندما يبدأ تكون الميالين (أعلى)، وصورة من المنبوذة myelinating في P31 P14 transfected في، عندما تصبح محاور معظم كبيرة العصبي (القاع)، مما يوحي بأن transfection من المنبوذة myelinating يمكن أن يتحقق ليس فقط في أعصاب الأطفال حديثي الولادة، ولكن أيضا في الأعصاب أكثر نضجا. الحانات النطاق = 200 ميكرون (A)؛ 50 ميكرون (BE). تم تعديل هذا الرقم من نشر رسائلنا السابقة (11). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
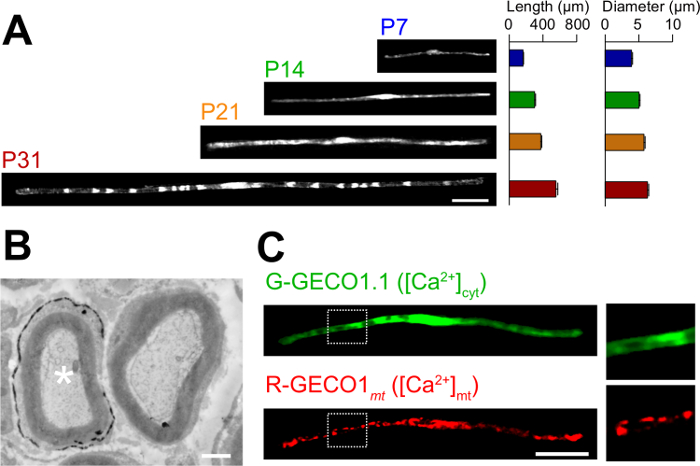
الشكل (3): تطبيق في الجسم الحي Electroporation لل(A) والتحليل المجهري ضوء تطور myelinating المنبوذة. تم electroporated الأعصاب الوركي مع البلازميد، معربا عن GFP في P3، وكانت ثابتة في مراحل النمو المختلفة (P7، P14، P21 و P31). وتظهر الصور التمثيلية للالمنبوذة GFP إيجابية على اليسار. وتتلخص متوسط الطول والقطر كما يعني ± SEM (ن = 30-47 من 3 الأعصاب) على اليمين. طول وقطر myelinating زيادات المنبوذة مع استمرار التطور. (ب) الإلكترون صورة مجهرية من العصب الوركي transfected مع LacZ ترميز البلازميد. وtransfected SC (النجمة البيضاء، اليسرى) وصفت بدقة مع رواسب من ناتج التفاعل β غالاكتوزيداز. (ج) صورة من SC cotransfected مع G-GECO1.1، أخضر فلوري عصاري خلوي كا 2+ المؤشر، وR-GECO1mt، أحمر فلوري الميتوكوندريا الكالسيوم 2+ المؤشر. وتظهر المناطق داخل المستطيلات منقط أبيض الموسع في لوحات على اليمين. الحانات النطاق = 50 ميكرون (A و C)؛ 1 ميكرون (B). تم تعديل هذا الرقم من نشر رسائلنا السابقة (11). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
In this paper, we describe a simple and efficient method that allows in vivo gene transfer to myelinating SCs in the rat sciatic nerve using electroporation. This method allows highly selective gene expression in myelinating SCs by simply applying electric pulses to the plasmid DNA-injected sciatic nerve. Because the molecular mechanisms of myelination and demyelination in the peripheral nervous system remain unclear, the present in vivo electroporation method will be a powerful tool to clarify the roles of multiple genes of interest in living animals.
A critical requirement of this method is to keep damage to the nerve during surgery to a minimal level. Should surgical damage cause excessive inflammation, the sciatic nerve may degenerate. To avoid this, one must conduct surgery with extreme care, so as to not damage the blood vessels around the nerve. Mechanical stress to the nerve during the surgery can also be a cause of nerve damage. To minimize mechanical stress, lifting the exposed nerve should be done as gently as possible, and the tweezer-type electrode should be placed close to the nerve without contact. Furthermore, electrical pulses that are too strong can cause undesirable large leg movement, which leads to mechanical stress, or can burn the nerve. If significant damages are observed in the nerves, we recommend reducing the electrical pulse intensities or placing the electrode further away from the nerve.
In our present protocol, CAG promoter-driven plasmids were used as expression vectors. CAG promoter-driven plasmids allow high levels of gene expression in myelinating SCs in vivo. We also have tried a CMV promoter, another widely used universal promoter for mammalian gene expression, but expression of the gene product was very weak. This is consistent with previous results, in which electroporation-mediated transfection was conducted in the embryonic brain20. Therefore, we recommend using CAG promoter-driven plasmids for the in vivo electroporation method.
Because axonal signaling is a key factor in myelination/demyelination21, gene modification in neurons is also important. However, delivery of transgenes using our in vivo electroporation method is limited to SCs. It has been reported that gene delivery into sciatic nerve axons can be achieved when in vivo electroporation is applied to dorsal root ganglion (DRG) neurons in adult rats22. This suggests that delivery of plasmid DNA to the cell body is likely to be critical for in vivo transfection of peripheral axons. Thus, to examine the involvement of axonal molecules in myelination/demyelination, researchers should use neuron-specific genetic methods such as genetically modified animals, neuron-specific viral vectors, or in vivo electroporation to DRG neurons.
Compared with current methods, such as the generation of genetically modified animal lines23 and delivery of transgenes by viral vectors4-6, gene modification of SCs by in vivo electroporation is simpler. This method only requires several days for plasmid DNA construction and one day for electroporation surgery. Plasmid DNA construction does not require a biohazard room that is usually essential for viral vector handling. In addition, one of the advantages of the electroporation method is the capacity for simultaneous expression of multiple gene products using a simple protocol. Our novel technique will be useful for analyzing the interaction of a variety of signaling molecules involved in myelination and demyelination. In particular, by permitting the cotransfection of a number of different intracellular fluorescent probes, our method should be a powerful tool for investigating intracellular signaling dynamics in SCs using live imaging experiments.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
This work was supported by grants from the Ministry of Education, Culture, Sports, Science and Technology to M.I. (21229004 and 25221304).
Materials
| Name | Company | Catalog Number | Comments |
| Genopure Plasmid Maxi Kit | Roche | 03 143 422 001 | Plasmid DNA purification kit |
| Fast Green CFC | WAKO | 069-00032 | Dye for DNA injection |
| GC 150T-10 | HARVARD APPARATUS | 30-0062 | Glass capillary |
| Suction tubing | Drummond | 05-2000-00 | Suction tubing for micro injection |
| MODEL P-97 | SUTTER INSTRUMENT CO. | Micropipette puller | |
| CUY21 Single Cell | BEX | Electroporator CUY21 Single Cell | Pulse generator |
| Electric warmer | KODEN | CAH-6A | Warmer during the surgery |
| Isofluolane | Mylan | 1119701G1076 | Anesthetic |
References
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annu Rev Cell Dev Biol. 30, 503-533 (2014).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., Wang, H., Jaenisch, R. Generating genetically modified mice using CRISPR/Cas-mediated genome engineering. Nat Protoc. 9, 1956-1968 (2014).
- Cotter, L., et al. Dlg1-PTEN interaction regulates myelin thickness to prevent damaging peripheral nerve overmyelination. Science. 328, 1415-1418 (2010).
- Gonzalez, S., Fernando, R. N., Perrin-Tricaud, C., Tricaud, N. In vivo introduction of transgenes into mouse sciatic nerve cells in situ using viral vectors. Nat Protoc. 9, 1160-1169 (2014).
- Ozcelik, M., et al. Pals1 is a major regulator of the epithelial-like polarization and the extension of the myelin sheath in peripheral nerves. J Neurosci. 30, 4120-4131 (2010).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21, 583-593 (2008).
- Glatzel, M., et al. Adenoviral and adeno-associated viral transfer of genes to the peripheral nervous system. Proc Natl Acad Sci U S A. 97, 442-447 (2000).
- Homs, J., et al. Schwann cell targeting via intrasciatic injection of AAV8 as gene therapy strategy for peripheral nerve regeneration. Gene Ther. 18, 622-630 (2011).
- Aspalter, M., et al. Modification of Schwann cell gene expression by electroporation in vivo. J Neurosci Methods. 176, 96-103 (2009).
- Ino, D., et al. Neuronal Regulation of Schwann Cell Mitochondrial Ca(2+) Signaling during Myelination. Cell Rep. 12, 1951-1959 (2015).
- Struhl, K. Chapter 3; Subcloning of DNA fragments. Curr Protoc Mol Biol. , Unit3 16 (2001).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient selection for high-expression transfectants with a novel eukaryotic vector. Gene. 108, 193-199 (1991).
- Chang, K., Elledge, S. J., Hannon, G. J. Lessons from Nature: microRNA-based shRNA libraries. Nat Methods. 3, 707-714 (2006).
- Schlaepfer, W. W., Myers, F. K. Relationship of myelin internode elongation and growth in the rat sural nerve. J Comp Neurol. 147, 255-266 (1973).
- Webster, H. D. The geometry of peripheral myelin sheaths during their formation and growth in rat sciatic nerves. J Cell Biol. 48, 348-367 (1971).
- Weis, J., Fine, S. M., David, C., Savarirayan, S., Sanes, J. R. Integration site-dependent expression of a transgene reveals specialized features of cells associated with neuromuscular junctions. J Cell Biol. 113, 1385-1397 (1991).
- Zhao, Y., et al. An expanded palette of genetically encoded Ca(2)(+) indicators. Science. 333 (2), 1888-1891 (2011).
- Suzuki, J., et al. Imaging intraorganellar Ca2+ at subcellular resolution using CEPIA. Nat Commun. 5, 4153 (2014).
- Tabata, H., Nakajima, K. Labeling embryonic mouse central nervous system cells by in utero electroporation. Dev Growth Differ. 50, 507-511 (2008).
- Taveggia, C., Feltri, M. L., Wrabetz, L. Signals to promote myelin formation and repair. Nat Rev Neurol. 6, 276-287 (2010).
- Saijilafu, E. M., Hur, F. Q., Zhou, Genetic dissection of axon regeneration via in vivo electroporation of adult mouse sensory neurons. Nat Commun. 2, 543 (2011).
- Tanaka, Y., Hirokawa, N. Mouse models of Charcot-Marie-Tooth disease. Trends Genet. 18, S39-S44 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved