Method Article
Electroporation에 의해 쥐 좌골 신경의 슈반 세포로 생체 내 유전자 전달에
요약
Here, we present an in vivo technique for gene transfer to Schwann cells (SCs) in the rodent sciatic nerve. This simple technique is useful for investigating signaling mechanisms involved in the development and maintenance of myelinating SCs.
초록
The formation of the myelin sheath by Schwann cells (SCs) is essential for rapid conduction of nerve impulses along axons in the peripheral nervous system. SC-selective genetic manipulation in living animals is a powerful technique for studying the molecular and cellular mechanisms of SC myelination and demyelination in vivo. While knockout/knockin and transgenic mice are powerful tools for studying SC biology, these methods are costly and time consuming. Viral vector-mediated transgene introduction into the sciatic nerve is a simpler and less laborious method. However, viral methods have limitations, such as toxicity, transgene size constraints, and infectivity restricted to certain developmental stages. Here, we describe a new method that allows selective transfection of myelinating SCs in the rodent sciatic nerve using electroporation. By applying electric pulses to the sciatic nerve at the site of plasmid DNA injection, genes of interest can be easily silenced or overexpressed in SCs in both neonatal and more mature animals. Furthermore, this in vivo electroporation method allows for highly efficient simultaneous expression of multiple transgenes. Our novel technique should enable researchers to efficiently manipulate SC gene expression, and facilitate studies on SC development and function.
서문
The rapid transmission of sensory and motor information in the peripheral nervous system is permitted by the myelin sheath, which is formed by myelinating Schwann cells (SCs)1. Insulation of axons by the myelin sheath enables saltatory conduction, which increases the speed of nerve impulses. In disorders in which the development or maintenance of the myelin sheath is impaired, nerve conduction speed is reduced. This results in neuropathy involving motor and sensory dysfunction. Although there are many studies on the molecular mechanisms of myelination and demyelination in the peripheral nervous system, the roles of the numerous proteins involved in these processes remain unclear.
To study the molecular mechanisms of SC myelination/demyelination in vivo, genetic approaches have been used to modify gene expression in animals. A powerful approach is the use of knockout/knockin or transgenic animals. However, the generation of these animals is expensive and time consuming. For SC-specific gene manipulation, crossing floxed strains with Cre mice or other conditional gene expression methods are necessary. This again is laborious and time intensive. In recent years, a cutting-edge genetic technology, the CRISPR-Cas9 system, has made the generation of genetically modified mice much quicker (about 4 weeks)2,3, but this method is hindered by target sequence limitations, and suffers from off-target effects. As an alternative method, viral vector-mediated gene transfer is a faster and easier method of achieving gene transfer into SCs in vivo4-6. Indeed, the generation of viral vectors is less expensive, and takes a shorter time (within a few weeks), and gene manipulation of SCs can be achieved by simply injecting engineered viral vectors, such as adenoviral vectors, adeno-associated viral (AAV) vectors, and lentiviral vectors, into the sciatic nerve. Because these viral vectors have different characteristics, users have to choose the one best suited for their purpose. Adenoviral vectors infect axons and SCs in both young and mature sciatic nerves. In particular, adenoviral vectors have higher selectively for non-myelinating SCs than myelinating SCs. Adenoviruses can cause immune responses, and accordingly, immunodeficient strains should be used5. AAV vectors are currently the most widely used viral vectors, and allow in vivo gene transfer with lower toxicity7. AAV can transduce both axons and SCs by direct injection into the nerve fibers8,9. However, AAV-mediated protein expression usually requires 3 weeks or longer to reach maximum levels7,9. Therefore, it is difficult to analyze myelination, which actively progresses during the two week postnatal period. Lentiviral vectors have higher selectively for myelinating SCs than non-myelinating SCs, and do not have toxic effects on sciatic nerves. However, lentiviral vectors do not infect SCs in more mature nerves5, and therefore are unsuitable for analyzing events such as the demyelination process.
Electroporation is another faster and easier approach to achieve in vivo gene transfer. It has been reported that in vivo transfection of SCs can be achieved when electroporation is applied to transected rat sciatic nerves10. However, because this method requires nerve transection for gene delivery, the application is limited to the analysis of the damaged nerves. Here, we describe an alternative method that allows the delivery of transgenes into myelinating SCs in intact rat sciatic nerves using electroporation11. This method requires plasmid construction, which can usually be completed within a week. Then, by simply delivering electric pulses to the site on the sciatic nerve where the plasmid DNA was injected, highly selective transfection of myelinating SCs can be achieved in neonatal as well as in more mature animals. By electroporating multiple plasmids, simultaneous expression of a variety of genes can be easily achieved. The ability to simultaneous express multiple molecules, such as signaling proteins, short-hairpin RNAs (shRNAs) and functional probes, is crucial for investigating complex processes such as myelination and demyelination. The novel in vivo electroporation method described in this paper will be a powerful tool, allowing researchers to analyze the function of a multitude of molecules and their interactions in myelinating SCs.
프로토콜
연구를위한 쥐의 사용은 도쿄 대학의 동물 복지위원회 설치 지침에 따라이었다.
플라스미드 DNA의 1. 준비
- 포유 동물 세포 (12)에 대한 발현 플라스미드로의 cDNA 또는 shRNA를 서열을 서브 클로닝에 의해 생체 전기에 대한 DNA 플라스미드를 생성합니다. 그것은 강력하고 안정적인 표현을 할 수 있기 때문에 사이토 메갈로 바이러스 즉시 초기 증강 및 닭 β - 액틴 프로모터 융합 (CAG) 발기인 중심의 플라스미드 (13)를 사용합니다. CAG 프로모터의 제어하에 발현 shRNA를 들어, shRNA를 14 서브 클로닝하는 mir30 기반 shRNA를 카세트 시스템을 사용한다.
- 제조업체의 지침에 따라 맥시 준비 키트와 플라스미드 DNA를 정화하고, HEPES 완충 식염수 (140 mM의 염화나트륨, 0.75 mM의 나 2 HPO 4, 25 mM의 HEPES, 산도 7.40)와 DNA를 재현 탁. μg의 / μl를 ≥4하는 DNA의 농도를 조정합니다.
- 4 μg의 / μL의 농도로 플라스미드 DNA 용액을 준비하고, 주사 부위에 라벨을 고속 녹색 염료의 최소량 (0.01 %의 최종 농도)을 추가한다. 여러 플라스미드를 동시에 전기가 필요한 경우, 4 μg의 / μL로 플라스미드 DNA 용액의 총 농도를 조정한다.
주 : 플라스미드 DNA의 최적 조성은 각 플라스미드의 형질 감염 효율에 따라 결정되어야한다.
수술 악기와 식염수 2. 살균
- 오토 클레이브 수술 도구와 0.9 % NaCl 용액.
글래스 마이크로 피펫 3. 준비
- 피펫 풀러를 사용하여 유리 피펫을 당기십시오. 30 ~ 50 ㎛의 직경 피펫의 끝을 잘라. 다음 매개 변수를 사용하여 열, 600; 속도, 50; 시간, 75.
4. 동물 외과, DNA 주입 및 Electroporation에
참고 : 이상을이 단계의 도면은도 1에서 설명한다. 래트 새끼 절차가 여기에 설명되어 있지만,이 방법도 동일한 방법을 사용하여 성숙한 동물에 적용 가능하다.
- 동물은 4 % (부피 / 부피) 내지 0.4 L / 분, 산소 흐름 및 이소 플루 란 농도를 조정하여 부동 될 때까지 유도 상자에 이소 플루 란 마취 래트. 적절한 마취를 확인하기 곤란 발가락을 수행합니다.
- 쌍안 현미경으로 데워진 따뜻한에 쥐를 넣고 계속 얼굴 마스크를 통해 이소 플루 란을 투여하여 마취를 유지한다. 2 % (부피 / 부피) 0.2 L / 분 산소 흐름과 이소 플루 란 농도를 조정합니다. 사용 눈은 동물의 눈이 열린 경우 눈의 건조를 방지하는 방울.
- 수술 테이프로 다리를 고정합니다.
- 포비돈 - 요오드와 후방 허벅지의 피부를 청소하고, 메스와 절개를합니다.
참고 : 외과 영역이 시간에 해당되는 경우 수술 영역을 면도공기. - 사두근 사이의 개방 근육 대퇴 이두근과는 바느질 바늘로 근육을 대퇴 작성하여 좌골 신경을 노출.
- 0.9 % NaCl 용액으로 신경 젖은. 보풀이없는 종이로 여분의 물을 흡수한다.
- 유연한 튜브에 유리 마이크로 피펫의 기초를 넣고 부드럽게 흡입하여 마이크로 피펫으로 DNA 용액 (하나 이상의 마이크로 리터)의 적절한 양을 입력합니다.
- 조심스럽게 바늘을 사용하여 신경의 말단면을 당겨 노출 된 신경를 들어 올립니다.
참고 : 기계적 스트레스를 최소화하기 위해 신경에 긴장을 적용하지 마십시오. - 신경의 말단 부위에 유리 마이크로 피펫을 삽입하고 적용 압력에 의해 DNA 용액을 주입 (플렉시블 튜브의 개방 단부에 불어 즉). 신경이 녹색 (1 μL의 최대)이 나타날 때까지 DNA 용액을 주입한다. 마이크로 피펫의 빈번한 삽입 신경에 손상을 줄 수 있기 때문에, 두 배 이상 마이크로 피펫 더 넣지 마십시오.
- TWE 배치에셀 형 약 1-2mm 떨어져 신경에서 백금 전극. 전극과 0.9 % NaCl 용액과 신경 사이의 간격을 입력합니다.
참고 : 신경에 기계적 스트레스를 피하기 위해 전극과 신경을 잡지 마십시오. - 전극과의 electroporator를 사용하여 주사 부위에 전기 펄스를 적용합니다. 첫 번째 펄스 설정 한 후, 전극을 반전하고 다른 펄스 설정을 적용합니다. 다음 매개 변수를 사용하여 전압이 50 V를; 펄스 지속 시간 5 밀리 초; 펄스 간격이 100 밀리 초; 펄스 수, 4 번.
- 0.9 % NaCl 용액으로 전기 사이트를 청소합니다.
- 반복 반대측 좌골 신경에 4.4-4.11 단계를 반복합니다.
5. 후 전기
- 시아 노 아크릴 레이트 접착제와 절개를 닫습니다.
- 접착제를 건조시킨 후, 포비돈 - 요오드 상처를 청소하십시오.
- 얼굴 마스크의 강아지를 놓습니다. 완전히 마취에서 회복 할 수 있도록하기 위해 시간 동안 적어도 따뜻한에서 강아지를 따뜻하게. 디충분한 의식을 회복 할 때까지 O를 강아지를 방치하지.
- 마취에서 회복 후, 어머니 쥐에 강아지를 반환합니다. 완전히 회복 될 때까지 강아지를 반환하지 않습니다.
6. 수술 후
- (그림 3의 예를 참조) 실험 (11)을 수행 할 때까지 케이지의 집은 쥐 새끼. 카프로 펜 투여 (5 ㎎ / ㎏을, IP), 비 - 스테로이드 계 소염 약물, 또는 프레 노르 핀 (0.1 밀리그램 / kg, SC) 아편 유사 진통제, 필요한 경우.
주 : 래트 새끼 잘 성장하지 않는 염증 수술 부위 주위에 관찰되는 경우, 실험 동물을 제외.
결과
플라스미드 발현 적색 형광 단백질 (RFP)로 형질 좌골 신경의 예는도 2a에 도시된다. 양극성 형태를 나타내는 세포의 특성으로 SC는, 띄엄 띄엄 RFP로 형질 감염시켰다. 어떤 RFP 형광은 축삭에서 검출되지 않았다. 우리는 일반적으로 ~ 모든 신경 100 형질으로 SC를 찾을 수 있습니다. 이 형질 전환 효율은 렌티 바이러스 벡터 (4)를 이용하여 생체 내 SC 감염 효율과 유사한 것으로 보인다.
면역 염색 실험은 보여 주었다 대부분 (~ 96 %) P7의 S100하는 SC 마커 (그림 2B)에 대한 공동 표지 및 P14의에서 RFP 양성 세포의 91 % MBP에 대한 공동 표시하는 myelinating의 SC 마커에서 RFP 양성 세포 (도 2c)은, 전기 천공에 의한 유전자 이동을 시사 SC와 myelinating에 매우 선택적이다.
희주에 여러 유전자의 소개 수초 / 탈수 초화의 메커니즘을 조사하기위한 매우 유용 할 것이다. 여기에 설명 된 생체 전기 천공 방법의 주요 장점은 간단한 방법으로 여러 유전자를 전달하는 능력이다. 도 2D는 생체 전기에 사용 GFP 및 RFP 발현 플라스미드의 혼합물로 형질 좌골 신경의 대표적인 이미지를 나타낸다. 희주의 약 97 %는 다수 유전자의 효율적인 전달이 단순히 여러 플라스미드 혼합물 electroporating함으로써 달성 될 수 있음을 시사 GFP RFP 이중 양성이었다.
설치류, 수초 극적 출생 처음 두 주 동안 증가 출생 주위 개시 후 서서히 감소한다. 따라서, 유전이 개발 시간 창 동안 희주를 조작하여, 수초의 서로 다른 단계의 기초가되는 메커니즘을 명확히 할 수있다. 렌티 바이러스 벡터는을위한 좋은 도구입니다그들은 최소한의 독성이 특히로서, 수초를 nalyzing하지만, 렌티 바이러스는 신생아 좌골 신경 5,6 감염. 형질이 (그림 2E, 아래) P3 (그림 2E, 상단) 또는 P14 실시 할 때 비교, 전기 매개 유전자 전달이 잘 작동합니다.
생체 전기 방식에서 소설의 응용 프로그램은 여기에 설명되어 있습니다. 그림 3a는 GFP 발현 다양한 발달 단계 (P7, P14, P21 및 P31)에서 myelinating SC와의 광학 현미경 이미지를 보여줍니다. 광학 현미경 분석에 의해, 같은 길이와 직경 등의 형태 학적 매개 변수의 변화, 평가 될 수있다. 이러한 매개 변수 일렉트릭 신경이 상당한 손상 효과없이 개발할 것을 제안, 그대로 쥐의 말초 신경 (15, 16)에 비해 비슷한 값을 가질 수 있습니다. 그림 3b는 LacZ를-expre의 전자 현미경 이미지를 보여줍니다ssing으로 SC를 myelinating. 이 경우는 LacZ를 발현 마커로서 사용 하였다. β - 갈 락토시다 bluo 갤런, 에탄올 불용 기판을 사용하여 염색 전자 현미경 (11, 17)에 의해 형질으로 SC의 미엘린 구조의 분석을 가능하게한다. 이 실험에서, 신호 분자의 역할을하여 손실 함수 또는 기능 획득 효과의 분석을 허용 침묵 또는 발현 증강에 의해 검사 될 수있다. 고정 된 조직의 분석뿐만 아니라, 생체 내 전기 천공 - 매개 된 유전자 전달은 이미징 실험 생활에 적용될 수있다. 예를 들어, 그림 3c는 G-GECO1.1 (18), 녹색 형광 세포질 칼슘 2 + 표시하고, R-GECO1mt (19), 적색 형광 미토콘드리아 칼슘 2 + 표시를 공동으로 표현하는 myelinating의 SC를 보여줍니다. 이러한 지표를 표현함으로써, 우리는 희주를 myelinating에서 세포질과 미토콘드리아 칼슘 농도를 제어하는 신호 전달 경로를 확인 . 따라서, 본 방법은 유전 학적으로 인코딩 된 형광 프로브는 관심있는 신호를 검출 할 수있는 경우, 특히, 신호 전달 메커니즘의 다양성을 연구하기 위해 이용 될 수있다.
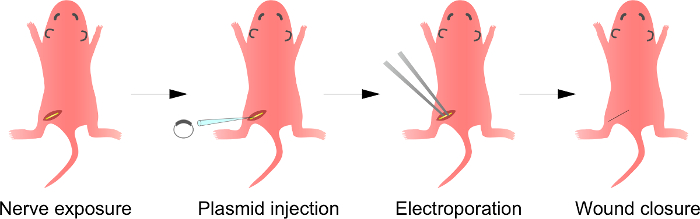
그림 1 :. 제 i n은 생체 내의 Electroporation 방법 첫째, 마취 된 쥐의 좌골 신경의 도식이 노출된다. 둘째, 플라스미드 DNA는 좌골 신경으로 주입된다. 셋째, 전기 펄스는 집게 형상 전극을 주사 부위로 전달된다. 마지막으로, 상처 접착제로 폐쇄된다. 이 절차는 반대측 신경에 반복 될 수있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
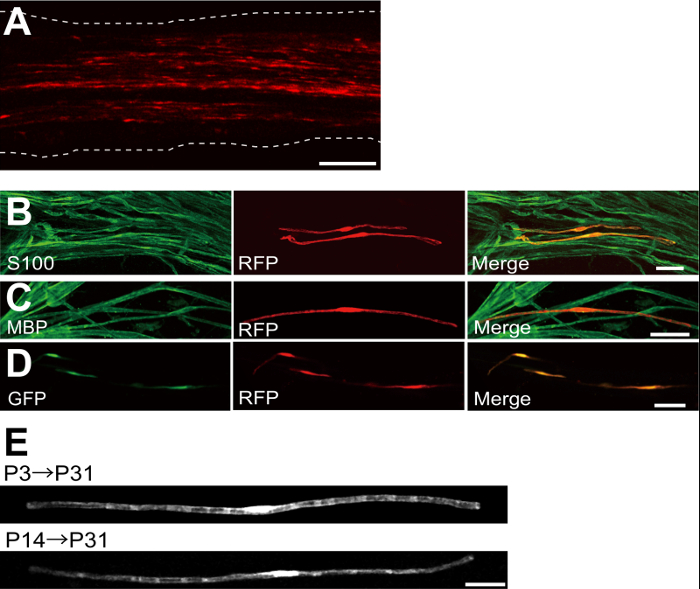
그림 2 : 감염된 좌골 신경에 대표 결과 (A)가 형질 전환 된 좌골 신경의 대표 이미지.. 신경은 P3에서 RFP 발현 플라스미드로 형질 및 P7에서 수정되었습니다. (B) S100하는 SC 마커와 colocalization을을 보여주는 P7에서 RFP 형질 세포의 대표 이미지입니다. MBP하는 myelinating 사우스 캐롤라이나 마커 colocalization을을 보여주는 P14에서 RFP 형질 좌골 신경의 (C) 대표 이미지입니다. (D) GFP 및 RFP 발현 플라스미드와 동시 형질 감염된 좌골 신경의 대표 이미지입니다. 형질 SCS는 동시에 GFP 및 RFP를 표명했다. (E) 수초가 시작 P3, (위)에 형질 전환 P31에서 희주를 myelinating의 이미지와 가장 큰 축삭이 (아래) 유수 될 P14에서 P31 형질에서 myelinating 희주의 이미지, 그 TRANSF 제안myelinating의 희주의 ection 신생아 신경에서뿐만 아니라, 더 성숙한 신경에서뿐만 아니라 달성 될 수있다. 스케일 바 = 200 μm의 (A); 50 μm의 (BE). 이 그림은 이전 간행물 (11) 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
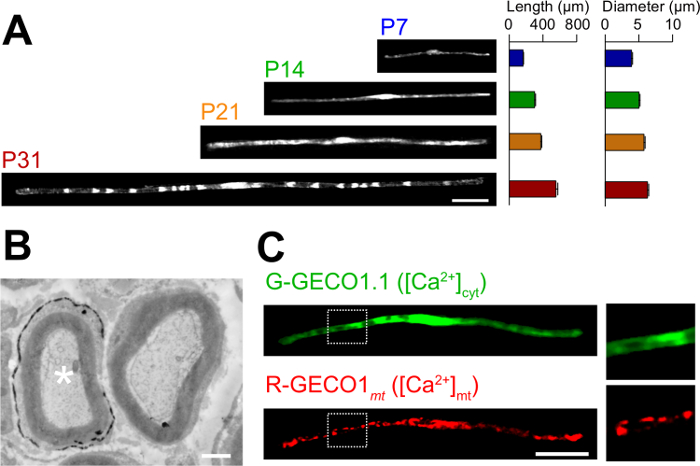
그림 3 :. 생체 내 Electroporation에 (A)으로 SC를 myelinating의 개발의 빛 현미경 분석의 응용 프로그램. 좌골 신경은 P3에서 GFP 발현 플라스미드로 전기 천공하고, 다양한 발달 단계 (P7, P14, P21 및 P31)에 고정되었다. GFP 양성 희주의 대표 이미지는 왼쪽에 표시됩니다. 평균 길이와 직경 (N = 3 SEM ± 평균으로 요약0 - 오른쪽에 3 신경) 47. 개발이 진행됨에 따라 희주의 증가를 myelinating의 길이와 직경. (B) 플라스미드 부호화 LacZ를 형질 좌골 신경의 전자 현미경 이미지. 형질 감염된 SC (좌측 화이트 별표) 미세 β - 갈 락토시다 아제 반응 생성물의 침전물로 표지 하였다. (C) G-GECO1.1, 녹색 형광 세포질 칼슘 2 + 표시하고, R-GECO1mt, 적색 형광 미토콘드리아 칼슘 2 + 표시와 함께 동시 형질 감염된 사우스 캐롤라이나의 이미지입니다. 흰색 점선 사각형 내의 영역은 오른쪽 패널에 확대 표시됩니다. 스케일 바 = 50 μm의 (A 및 C); 1 ㎛ (B). 이 그림은 이전 간행물 (11) 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
In this paper, we describe a simple and efficient method that allows in vivo gene transfer to myelinating SCs in the rat sciatic nerve using electroporation. This method allows highly selective gene expression in myelinating SCs by simply applying electric pulses to the plasmid DNA-injected sciatic nerve. Because the molecular mechanisms of myelination and demyelination in the peripheral nervous system remain unclear, the present in vivo electroporation method will be a powerful tool to clarify the roles of multiple genes of interest in living animals.
A critical requirement of this method is to keep damage to the nerve during surgery to a minimal level. Should surgical damage cause excessive inflammation, the sciatic nerve may degenerate. To avoid this, one must conduct surgery with extreme care, so as to not damage the blood vessels around the nerve. Mechanical stress to the nerve during the surgery can also be a cause of nerve damage. To minimize mechanical stress, lifting the exposed nerve should be done as gently as possible, and the tweezer-type electrode should be placed close to the nerve without contact. Furthermore, electrical pulses that are too strong can cause undesirable large leg movement, which leads to mechanical stress, or can burn the nerve. If significant damages are observed in the nerves, we recommend reducing the electrical pulse intensities or placing the electrode further away from the nerve.
In our present protocol, CAG promoter-driven plasmids were used as expression vectors. CAG promoter-driven plasmids allow high levels of gene expression in myelinating SCs in vivo. We also have tried a CMV promoter, another widely used universal promoter for mammalian gene expression, but expression of the gene product was very weak. This is consistent with previous results, in which electroporation-mediated transfection was conducted in the embryonic brain20. Therefore, we recommend using CAG promoter-driven plasmids for the in vivo electroporation method.
Because axonal signaling is a key factor in myelination/demyelination21, gene modification in neurons is also important. However, delivery of transgenes using our in vivo electroporation method is limited to SCs. It has been reported that gene delivery into sciatic nerve axons can be achieved when in vivo electroporation is applied to dorsal root ganglion (DRG) neurons in adult rats22. This suggests that delivery of plasmid DNA to the cell body is likely to be critical for in vivo transfection of peripheral axons. Thus, to examine the involvement of axonal molecules in myelination/demyelination, researchers should use neuron-specific genetic methods such as genetically modified animals, neuron-specific viral vectors, or in vivo electroporation to DRG neurons.
Compared with current methods, such as the generation of genetically modified animal lines23 and delivery of transgenes by viral vectors4-6, gene modification of SCs by in vivo electroporation is simpler. This method only requires several days for plasmid DNA construction and one day for electroporation surgery. Plasmid DNA construction does not require a biohazard room that is usually essential for viral vector handling. In addition, one of the advantages of the electroporation method is the capacity for simultaneous expression of multiple gene products using a simple protocol. Our novel technique will be useful for analyzing the interaction of a variety of signaling molecules involved in myelination and demyelination. In particular, by permitting the cotransfection of a number of different intracellular fluorescent probes, our method should be a powerful tool for investigating intracellular signaling dynamics in SCs using live imaging experiments.
공개
The authors declare that they have no competing financial interests.
감사의 말
This work was supported by grants from the Ministry of Education, Culture, Sports, Science and Technology to M.I. (21229004 and 25221304).
자료
| Name | Company | Catalog Number | Comments |
| Genopure Plasmid Maxi Kit | Roche | 03 143 422 001 | Plasmid DNA purification kit |
| Fast Green CFC | WAKO | 069-00032 | Dye for DNA injection |
| GC 150T-10 | HARVARD APPARATUS | 30-0062 | Glass capillary |
| Suction tubing | Drummond | 05-2000-00 | Suction tubing for micro injection |
| MODEL P-97 | SUTTER INSTRUMENT CO. | Micropipette puller | |
| CUY21 Single Cell | BEX | Electroporator CUY21 Single Cell | Pulse generator |
| Electric warmer | KODEN | CAH-6A | Warmer during the surgery |
| Isofluolane | Mylan | 1119701G1076 | Anesthetic |
참고문헌
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annu Rev Cell Dev Biol. 30, 503-533 (2014).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., Wang, H., Jaenisch, R. Generating genetically modified mice using CRISPR/Cas-mediated genome engineering. Nat Protoc. 9, 1956-1968 (2014).
- Cotter, L., et al. Dlg1-PTEN interaction regulates myelin thickness to prevent damaging peripheral nerve overmyelination. Science. 328, 1415-1418 (2010).
- Gonzalez, S., Fernando, R. N., Perrin-Tricaud, C., Tricaud, N. In vivo introduction of transgenes into mouse sciatic nerve cells in situ using viral vectors. Nat Protoc. 9, 1160-1169 (2014).
- Ozcelik, M., et al. Pals1 is a major regulator of the epithelial-like polarization and the extension of the myelin sheath in peripheral nerves. J Neurosci. 30, 4120-4131 (2010).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21, 583-593 (2008).
- Glatzel, M., et al. Adenoviral and adeno-associated viral transfer of genes to the peripheral nervous system. Proc Natl Acad Sci U S A. 97, 442-447 (2000).
- Homs, J., et al. Schwann cell targeting via intrasciatic injection of AAV8 as gene therapy strategy for peripheral nerve regeneration. Gene Ther. 18, 622-630 (2011).
- Aspalter, M., et al. Modification of Schwann cell gene expression by electroporation in vivo. J Neurosci Methods. 176, 96-103 (2009).
- Ino, D., et al. Neuronal Regulation of Schwann Cell Mitochondrial Ca(2+) Signaling during Myelination. Cell Rep. 12, 1951-1959 (2015).
- Struhl, K. Chapter 3; Subcloning of DNA fragments. Curr Protoc Mol Biol. , Unit3 16 (2001).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient selection for high-expression transfectants with a novel eukaryotic vector. Gene. 108, 193-199 (1991).
- Chang, K., Elledge, S. J., Hannon, G. J. Lessons from Nature: microRNA-based shRNA libraries. Nat Methods. 3, 707-714 (2006).
- Schlaepfer, W. W., Myers, F. K. Relationship of myelin internode elongation and growth in the rat sural nerve. J Comp Neurol. 147, 255-266 (1973).
- Webster, H. D. The geometry of peripheral myelin sheaths during their formation and growth in rat sciatic nerves. J Cell Biol. 48, 348-367 (1971).
- Weis, J., Fine, S. M., David, C., Savarirayan, S., Sanes, J. R. Integration site-dependent expression of a transgene reveals specialized features of cells associated with neuromuscular junctions. J Cell Biol. 113, 1385-1397 (1991).
- Zhao, Y., et al. An expanded palette of genetically encoded Ca(2)(+) indicators. Science. 333 (2), 1888-1891 (2011).
- Suzuki, J., et al. Imaging intraorganellar Ca2+ at subcellular resolution using CEPIA. Nat Commun. 5, 4153 (2014).
- Tabata, H., Nakajima, K. Labeling embryonic mouse central nervous system cells by in utero electroporation. Dev Growth Differ. 50, 507-511 (2008).
- Taveggia, C., Feltri, M. L., Wrabetz, L. Signals to promote myelin formation and repair. Nat Rev Neurol. 6, 276-287 (2010).
- Saijilafu, E. M., Hur, F. Q., Zhou, Genetic dissection of axon regeneration via in vivo electroporation of adult mouse sensory neurons. Nat Commun. 2, 543 (2011).
- Tanaka, Y., Hirokawa, N. Mouse models of Charcot-Marie-Tooth disease. Trends Genet. 18, S39-S44 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유