Method Article
Elektroporasyon tarafından Kemirgen Siyatik Sinir Schwann Hücreleri için Vivo Gen Transferi
Bu Makalede
Özet
Here, we present an in vivo technique for gene transfer to Schwann cells (SCs) in the rodent sciatic nerve. This simple technique is useful for investigating signaling mechanisms involved in the development and maintenance of myelinating SCs.
Özet
The formation of the myelin sheath by Schwann cells (SCs) is essential for rapid conduction of nerve impulses along axons in the peripheral nervous system. SC-selective genetic manipulation in living animals is a powerful technique for studying the molecular and cellular mechanisms of SC myelination and demyelination in vivo. While knockout/knockin and transgenic mice are powerful tools for studying SC biology, these methods are costly and time consuming. Viral vector-mediated transgene introduction into the sciatic nerve is a simpler and less laborious method. However, viral methods have limitations, such as toxicity, transgene size constraints, and infectivity restricted to certain developmental stages. Here, we describe a new method that allows selective transfection of myelinating SCs in the rodent sciatic nerve using electroporation. By applying electric pulses to the sciatic nerve at the site of plasmid DNA injection, genes of interest can be easily silenced or overexpressed in SCs in both neonatal and more mature animals. Furthermore, this in vivo electroporation method allows for highly efficient simultaneous expression of multiple transgenes. Our novel technique should enable researchers to efficiently manipulate SC gene expression, and facilitate studies on SC development and function.
Giriş
The rapid transmission of sensory and motor information in the peripheral nervous system is permitted by the myelin sheath, which is formed by myelinating Schwann cells (SCs)1. Insulation of axons by the myelin sheath enables saltatory conduction, which increases the speed of nerve impulses. In disorders in which the development or maintenance of the myelin sheath is impaired, nerve conduction speed is reduced. This results in neuropathy involving motor and sensory dysfunction. Although there are many studies on the molecular mechanisms of myelination and demyelination in the peripheral nervous system, the roles of the numerous proteins involved in these processes remain unclear.
To study the molecular mechanisms of SC myelination/demyelination in vivo, genetic approaches have been used to modify gene expression in animals. A powerful approach is the use of knockout/knockin or transgenic animals. However, the generation of these animals is expensive and time consuming. For SC-specific gene manipulation, crossing floxed strains with Cre mice or other conditional gene expression methods are necessary. This again is laborious and time intensive. In recent years, a cutting-edge genetic technology, the CRISPR-Cas9 system, has made the generation of genetically modified mice much quicker (about 4 weeks)2,3, but this method is hindered by target sequence limitations, and suffers from off-target effects. As an alternative method, viral vector-mediated gene transfer is a faster and easier method of achieving gene transfer into SCs in vivo4-6. Indeed, the generation of viral vectors is less expensive, and takes a shorter time (within a few weeks), and gene manipulation of SCs can be achieved by simply injecting engineered viral vectors, such as adenoviral vectors, adeno-associated viral (AAV) vectors, and lentiviral vectors, into the sciatic nerve. Because these viral vectors have different characteristics, users have to choose the one best suited for their purpose. Adenoviral vectors infect axons and SCs in both young and mature sciatic nerves. In particular, adenoviral vectors have higher selectively for non-myelinating SCs than myelinating SCs. Adenoviruses can cause immune responses, and accordingly, immunodeficient strains should be used5. AAV vectors are currently the most widely used viral vectors, and allow in vivo gene transfer with lower toxicity7. AAV can transduce both axons and SCs by direct injection into the nerve fibers8,9. However, AAV-mediated protein expression usually requires 3 weeks or longer to reach maximum levels7,9. Therefore, it is difficult to analyze myelination, which actively progresses during the two week postnatal period. Lentiviral vectors have higher selectively for myelinating SCs than non-myelinating SCs, and do not have toxic effects on sciatic nerves. However, lentiviral vectors do not infect SCs in more mature nerves5, and therefore are unsuitable for analyzing events such as the demyelination process.
Electroporation is another faster and easier approach to achieve in vivo gene transfer. It has been reported that in vivo transfection of SCs can be achieved when electroporation is applied to transected rat sciatic nerves10. However, because this method requires nerve transection for gene delivery, the application is limited to the analysis of the damaged nerves. Here, we describe an alternative method that allows the delivery of transgenes into myelinating SCs in intact rat sciatic nerves using electroporation11. This method requires plasmid construction, which can usually be completed within a week. Then, by simply delivering electric pulses to the site on the sciatic nerve where the plasmid DNA was injected, highly selective transfection of myelinating SCs can be achieved in neonatal as well as in more mature animals. By electroporating multiple plasmids, simultaneous expression of a variety of genes can be easily achieved. The ability to simultaneous express multiple molecules, such as signaling proteins, short-hairpin RNAs (shRNAs) and functional probes, is crucial for investigating complex processes such as myelination and demyelination. The novel in vivo electroporation method described in this paper will be a powerful tool, allowing researchers to analyze the function of a multitude of molecules and their interactions in myelinating SCs.
Protokol
Araştırma için sıçanların kullanılması Tokyo Üniversitesi Hayvan Refahı Komitesi tarafından oluşturulan kurallara uygun olarak yapıldı.
Plasmid DNA 1.Preparation
- Memeli hücreleri 12 için bir ifade plazması içine cDNA veya shRNA dizisi alt-klonlanmasıyla in vivo elektroporasyon için DNA plasmidleri oluşturur. Güçlü ve istikrarlı bir ifade sağlar çünkü bir sitomegalovirüs hemen erken arttırıcı ve tavuk β-aktin promotör füzyon (CAG) promotör-tahrikli plazmid 13 kullanın. CAG promotörün kontrolü altında shRNAs ekspresyonu için, shRNA 14 alt klonlama için mir30 tabanlı shRNA kaseti sistemini kullanır.
- Üreticinin talimatlarına göre bir maksi-hazırlık kiti ile plazmid DNA arındırın ve HEPES-tamponlu tuzlu su (140 mM NaCI, 0.75 mM Na 2 HPO 4, 25 mM HEPES, pH 7.40) ile DNA tekrar süspansiyon. ug / ul ≥ 4 DNA'nın konsantrasyonu ayarlayın.
- 4 ug / ul bir konsantrasyona kadar plazmit DNA çözeltisi hazırlayın ve enjeksiyon yeri etiketlemek için hızlı yeşil boya en az bir miktarda (% 0.01 nihai konsantrasyonu) ekleyin. Birden plazmid eşzamanlı elektroporasyon gerektiğinde, 4 ug / ul plazmit DNA çözeltisinin toplam konsantrasyonunu ayarlamak.
Not: Plazmid DNA'ların uygun bileşim olup, her plazmidin transfeksiyon verimliliğine göre belirlenmelidir.
Cerrahi Aletler ve Salin 2. Sterilizasyon
- Otoklav cerrahi aletler ve% 0.9 NaCl çözeltisi.
Cam mikropipet 3. hazırlanması
- Bir pipet çektirmenin kullanarak cam pipetler çekin. 30-50 um bir çapa pipet ucu kesilir. Aşağıdaki parametreleri kullanın: Isı, 600; Hız, 50; Zaman, 75.
4. Hayvan Cerrahisi, DNA Enjeksiyon ve Elektroporasyon
Not: Bir overBu adımın görünüşüdür, Şekil 1 'de tarif edilmektedir. sıçan yavrularından prosedürü burada açıklanmış olmakla birlikte, yöntem, aynı zamanda, aynı prosedür kullanılarak daha olgun hayvanlara uygulanabilir.
- Hayvan% 4 (hacim / hacim) 0.4 L / dak oksijen akışını ve izofluran konsantrasyonu ayarlanarak hareketsiz hale gelinceye kadar indüksiyon kutusunda izofluran ile sıçan anestezisi. Doğru anesthetization onaylamak için kısma ayak gerçekleştirin.
- binoküler mikroskop altında ısıtılmış sıcak sıçan koyun ve sürekli yüz maskesi ile izofluran verilerek anestezi korumak. % 2 (hacim / hacim) 0.2 L / dak oksijen akışını ve izofluran konsantrasyonu ayarlayın. Kullanım göz hayvanın gözleri açıksa gözlerin kurumasını önlemek için düşer.
- ameliyat bandı ile bacakları sabitleyin.
- povidon-iyot ile arka uyluk cilt temizlemek ve bir neşter ile bir kesi yapmak.
Not: Cerrahi alanlar h ile kaplıdır eğer cerrahi alanları Tıraşhava. - kuadriseps arasında bir açıklık femoris kasının ve pazı dikiş iğneleri ile kas femoris oluşturarak siyatik siniri Açığa.
- % 0.9 NaCl çözeltisi ile sinir ıslatın. havsız kağıt ile fazla suyu emer.
- Esnek boru üzerinde, bir cam mikropipet taban yerleştirin ve yavaşça aspire mikropipet DNA solüsyonuna (en az bir mikrolitre), yeterli miktarda dolgu.
- hafifçe iğne kullanarak sinirin distal tarafını çekerek maruz siniri kaldırın.
Not: mekanik stresi en aza indirmek için sinir gerginliği sürmeyin. - Sinirin distal site içine cam mikropipet takın ve uygulayarak basıncı ile DNA çözümü enjekte (esnek borunun açık ucuna üfleyerek yani). Sinir yeşil (1 ul maksimum) görünene kadar DNA çözümü enjekte edilir. Mikropipet sık ekleme sinirine zarar verir, çünkü iki katından fazla mikropipet fazla takmayın.
- Bir TWE yerleştirinezer tipi yaklaşık 1-2 mm aralıklı sinir platin elektrot. elektrot ve% 0.9 NaCl çözeltisi ile sinir arasındaki boşluğu doldurmaktadır.
Not: sinire mekanik stresten kaçınmak elektrot ile sinir tutmayın. - elektrotlu bir elektro kullanarak enjeksiyon yerinde elektrik darbeleri uygulayın. İlk darbe seti sonra, elektrot ters ve başka darbe seti uygulanır. Aşağıdaki parametreleri kullanın: gerilim, 50 V; darbe süresi, 5 ms; nabız aralığı, 100 msn; nabız sayısı, 4 kez.
- % 0.9 NaCl çözeltisi ile elektroporasyon sitesi temizleyin.
- Tekrarlayın kontralateral siyatik sinir üzerine 4,4-4,11 adımları.
5. Post-elektroporasyon
- siyanoakrilat yapıştırıcı ile kesiler kapatın.
- tutkal kurutulduktan sonra, povidon-iyot ile yarayı temizleyin.
- yüz maskesi gelen yavru bırakın. tamamen anestezi kurtarmak için izin vermek için bir saat en az bir sıcak yavru ısıtın. Dyeterli bilinci yerine kadar o yavru sahipsiz bırakmayın.
- anestezi kurtarma sonra, anne sıçan yavru dönün. Tamamen iyileşene kadar yavru iade etmeyin.
6. Post-cerrahi
- (Şekil 3 örneklere bakınız) deneyler 11 iletken kadar kafeste Ev sıçan yavruları. karprofen yönetme (5 mg / kg; ip), bir steroid olmayan anti-inflamatuar ilaç, ya da buprenorfinin (0.1 mg / kg, sc), bir opioid analjezik, gerekirse.
Not: Sıçan yavru iyi büyümek değil veya inflamasyon cerrahi site çevresinde görülürse, deneylerden hayvan hariç.
Sonuçlar
plazmid -expressing kırmızı flöresanlı protein (RFP) ile transfekte edilmiş bir siyatik sinirinin bir örneği, Şekil 2A'da gösterilmiştir. Bipolar morfoloji gösteren hücreler, AVM bir özelliği, seyrek RFP ile transfekte edildi. Hiçbir RFP floresan akson saptandı. Biz genellikle ~ Her sinirde 100 transfekte SC'ler bulabilirsiniz. Bu transfeksiyon verimliliği lentiviral vektörler 4 kullanılarak in vivo SC enfeksiyonu verimliliği benziyor.
Immün deneyler göstermiştir ki çoğu (~% 96) P7 S100, sc işaretleyici (Şekil 2B) eş-etiketli ve P14 RFP-pozitif hücre% 91 MBP için ko-etiketli bir Myelinating SC marker TTT-pozitif hücreler (Şekil 2C), elektroporasyon ile gen transferini göstermektedir SC'ler myelinating için son derece seçicidir.
AVM içine birden fazla genlerin tanıtımı miyelinasyon / demiyelinasyon mekanizmaları araştırmak için son derece yararlı olacaktır. Burada tarif edilen in vivo elektroporasyon yöntemin önemli bir avantajı, kolay bir prosedür ile birden fazla gen transferi kapasitesidir. Şekil 2B in vivo elektroporasyon kullanılarak GFP ve RFP eksprese eden plasmidlerin bir karışımı ile transfekte edilmiş bir siyatik sinirinin temsili bir görüntüsünü gösterir. SC'ler yaklaşık% 97, çok yönlü genlerin yüksek olarak etkili taşınmasında, sadece birden çok plasmidlerin karışımları electroporating elde edilebileceğini göstermektedir, GFP ve çift pozitif RFP edildi.
kemirgenlerde, miyelinasyon dramatik doğum sonrası ilk iki hafta boyunca artan doğum etrafında başlatır ve sonra yavaş yavaş azalır. Böylece, genetik bu gelişim zaman pencereleri sırasında SC'ler manipüle ederek, miyelinasyon bu farklı aşamalarını altında yatan mekanizmaları açıklığa kavuşturulması şarttır. Lentiviral vektörler için iyi bir araçtırminimal toksisiteye sahip olarak özellikle miyelinasyon nalyzing ama lentivirüsler yalnızca doğum siyatik sinirleri, 5,6 enfekte. Transfeksiyon (Şekil 2E, alt) P3 (Şekil 2E, yukarıda) ya da P14 ile gerçekleştirilen zaman karşılaştırıldığında, elektroporasyon aracılı gen transferi iyi çalışır.
Vivo elektroporasyon yöntemi romanın uygulamaları burada açıklanmıştır. Şekil 3A GFP-ifade eden çeşitli gelişim evreleri (P7, P14, P21 ve P31) de myelinating SC'ler ışık mikroskobik görüntüleri gösterir. ışık mikroskopik analizi ile, örneğin uzunluk ve çap olarak morfolojik parametrelerde değişiklikler değerlendirilebilir. Bu parametreler Electroporated sinirler önemli zararlı etkileri olmadan geliştirmek düşündüren, bozulmamış sıçan periferik sinirlerin 15,16 oranla benzer değerlere sahip olduğunu unutmayın. Şekil 3B LacZ-Expre bir elektron mikroskobik görüntü gösterirssing SC'ler myelinating. Bu durumda, LacZ bir ekspresyon belirteci olarak kullanıldı. β-galaktosidaz Bluo-gal, bir etanol çözülmeyen substrat kullanılarak boyama elektron mikroskobu 11,17 transfekte SC'ler miyelin yapısının analiz edilmesini sağlar. Bu deneylerde, sinyal moleküllerinin rolü ve böylece zarar fonksiyon-veya-kazanç fonksiyonu etkilerinin analizi sağlayan, susturulması veya ekspresyonunu arttırarak incelenebilir. Sabit doku analizine ek olarak, in vivo elektroporasyon aracılı gen transferi, aynı zamanda görüntüleme deneyleri canlı uygulanabilir. Örneğin, Şekil 3C, G-GECO1.1 18, yeşil floresan sitosolik Ca2 + gösterge, ve R-GECO1mt 19, kırmızı floresan mitokondriyal Ca 2 + göstergesi ko-eksprese eden bir Myelinating SC göstermektedir. Bu göstergeleri ifade ederek, SC'ler myelinating sitozolik ve mitokondriyal Ca 2 + konsantrasyonları kontrol eden bir sinyal yolunu tespit . Bu durumda, bu yöntem, genetik olarak kodlanmış floresan probları ilgi sinyalleri tespit etmek için kullanılabilir, özellikle sinyal çeşitli mekanizmalar çalışma için kullanılabilir.
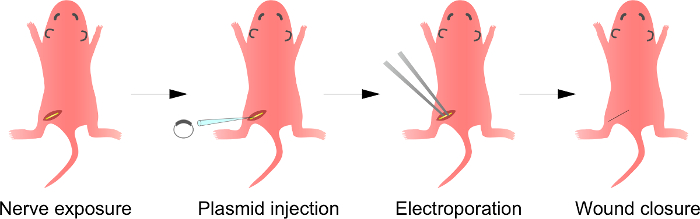
Şekil 1:. I n in vivo Elektroporasyon Yöntemi Birinci, anestezi sıçan siyatik sinirin şematik maruz kalmaktadır. İkinci olarak, plazmid DNA, siyatik sinir enjekte edilir. Üçüncü olarak, elektrikli bakliyat forseps şeklindeki elektrodun yoluyla enjeksiyon yerinde teslim edilir. Son olarak, yara yapıştırıcı ile kapatılır. Bu işlem karşı sinirin tekrar edilebilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
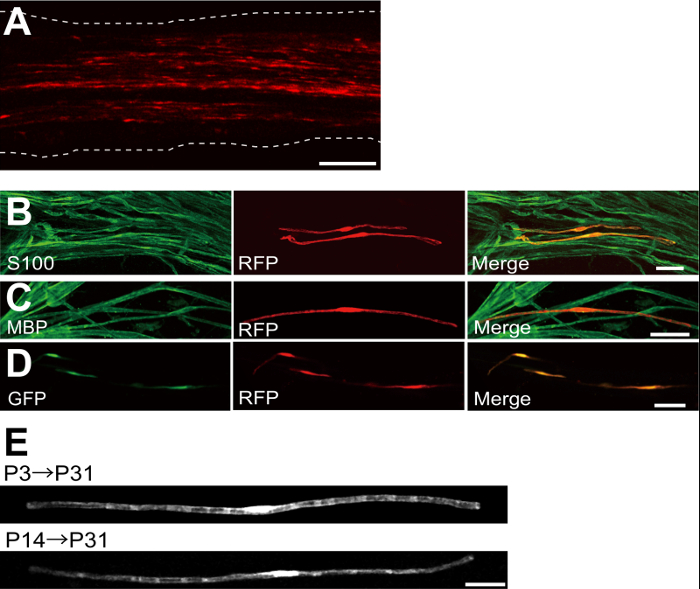
Şekil 2: Transfekte Siyatik Sinir üzerinde Temsilcisi Sonuçlar (A) transfekte siyatik sinirinin bir temsilcisi görüntü.. Sinir P3 TTT eksprese eden plazmid ile transfekte edilmiş ve P7 sabitlendi. (B) S100, bir SC işaretleyici ile ko gösteren P7 bir RFP transfekte hücrenin bir temsilcisi görüntü. MBP, bir Myelinating SC işaretleyici ile ko gösteren P14 bir RFP transfekte siyatik sinirinin (C) bir temsilci görüntü. (D), GFP ve RFP ifade eden plazmid ile transfekte siyatik sinirinin bir temsili görüntüsü. Transfekte SC'ler aynı anda GFP ve RFP ifade etti. (E) miyelinasyon başlar P3, (üst) transfekte P31 de SC'ler myelinating bir görüntü ve en büyük aksonlar (alt) miyelinli hale P14, P31 transfekte de myelinating AVM bir görüntü, bu transf düşündürenMyelinating SCS ection yenidoğan sinirlerdeki değil, aynı zamanda daha olgun sinirlerdeki sadece elde edilebilir. Ölçek çubukları = 200 um (A); 50 mikron (BE). Bu rakam önceki yayının 11 modifiye edildi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
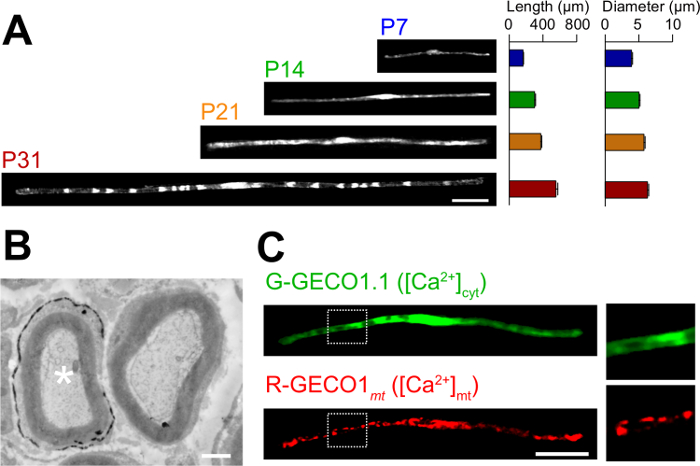
Şekil 3:., In vivo elektroporasyon (A) SCS myelinating gelişimi bir ışık mikroskopik analizi uygulaması. Siyatik sinirleri P3 GFP ifade plazmidi ile elektropore edildi ve çeşitli gelişim evrelerindeki (P7, P14, P21 ve P31) sabitlenmiştir. GFP-pozitif SC'ler temsili görüntüler solda gösterilmektedir. ortalama uzunluğu ve çapı (n = 3, ortalama ± SEM olarak sunulmuştur0 - sağda 3 sinirler) 47. geliştirme ilerledikçe SC'ler artar myelinating uzunluğu ve çapı. (B) kodlayan bir plazmit LacZ ile transfekte edilmiş bir siyatik sinirinin bir elektron mikroskopik görüntüsü. Transfekte SC (sol beyaz bir yıldız işareti), ince β-galaktosidaz reaksiyon ürünü çökelti ile işaretlenmiştir. (C) G-GECO1.1, bir yeşil floresan sitozolik Ca 2 + göstergesi, ve R-GECO1mt, bir kırmızı floresan mitokondriyal Ca 2 + göstergesi ile kotransfekte bir SC bir görüntü. beyaz noktalı dikdörtgenler içinde bölgeler sağdaki panellerin genişlemiş gösterilmiştir. Ölçek çubukları = 50 um (A ve C); 1 uM (B). Bu rakam önceki yayının 11 modifiye edildi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
In this paper, we describe a simple and efficient method that allows in vivo gene transfer to myelinating SCs in the rat sciatic nerve using electroporation. This method allows highly selective gene expression in myelinating SCs by simply applying electric pulses to the plasmid DNA-injected sciatic nerve. Because the molecular mechanisms of myelination and demyelination in the peripheral nervous system remain unclear, the present in vivo electroporation method will be a powerful tool to clarify the roles of multiple genes of interest in living animals.
A critical requirement of this method is to keep damage to the nerve during surgery to a minimal level. Should surgical damage cause excessive inflammation, the sciatic nerve may degenerate. To avoid this, one must conduct surgery with extreme care, so as to not damage the blood vessels around the nerve. Mechanical stress to the nerve during the surgery can also be a cause of nerve damage. To minimize mechanical stress, lifting the exposed nerve should be done as gently as possible, and the tweezer-type electrode should be placed close to the nerve without contact. Furthermore, electrical pulses that are too strong can cause undesirable large leg movement, which leads to mechanical stress, or can burn the nerve. If significant damages are observed in the nerves, we recommend reducing the electrical pulse intensities or placing the electrode further away from the nerve.
In our present protocol, CAG promoter-driven plasmids were used as expression vectors. CAG promoter-driven plasmids allow high levels of gene expression in myelinating SCs in vivo. We also have tried a CMV promoter, another widely used universal promoter for mammalian gene expression, but expression of the gene product was very weak. This is consistent with previous results, in which electroporation-mediated transfection was conducted in the embryonic brain20. Therefore, we recommend using CAG promoter-driven plasmids for the in vivo electroporation method.
Because axonal signaling is a key factor in myelination/demyelination21, gene modification in neurons is also important. However, delivery of transgenes using our in vivo electroporation method is limited to SCs. It has been reported that gene delivery into sciatic nerve axons can be achieved when in vivo electroporation is applied to dorsal root ganglion (DRG) neurons in adult rats22. This suggests that delivery of plasmid DNA to the cell body is likely to be critical for in vivo transfection of peripheral axons. Thus, to examine the involvement of axonal molecules in myelination/demyelination, researchers should use neuron-specific genetic methods such as genetically modified animals, neuron-specific viral vectors, or in vivo electroporation to DRG neurons.
Compared with current methods, such as the generation of genetically modified animal lines23 and delivery of transgenes by viral vectors4-6, gene modification of SCs by in vivo electroporation is simpler. This method only requires several days for plasmid DNA construction and one day for electroporation surgery. Plasmid DNA construction does not require a biohazard room that is usually essential for viral vector handling. In addition, one of the advantages of the electroporation method is the capacity for simultaneous expression of multiple gene products using a simple protocol. Our novel technique will be useful for analyzing the interaction of a variety of signaling molecules involved in myelination and demyelination. In particular, by permitting the cotransfection of a number of different intracellular fluorescent probes, our method should be a powerful tool for investigating intracellular signaling dynamics in SCs using live imaging experiments.
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
This work was supported by grants from the Ministry of Education, Culture, Sports, Science and Technology to M.I. (21229004 and 25221304).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Genopure Plasmid Maxi Kit | Roche | 03 143 422 001 | Plasmid DNA purification kit |
| Fast Green CFC | WAKO | 069-00032 | Dye for DNA injection |
| GC 150T-10 | HARVARD APPARATUS | 30-0062 | Glass capillary |
| Suction tubing | Drummond | 05-2000-00 | Suction tubing for micro injection |
| MODEL P-97 | SUTTER INSTRUMENT CO. | Micropipette puller | |
| CUY21 Single Cell | BEX | Electroporator CUY21 Single Cell | Pulse generator |
| Electric warmer | KODEN | CAH-6A | Warmer during the surgery |
| Isofluolane | Mylan | 1119701G1076 | Anesthetic |
Referanslar
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annu Rev Cell Dev Biol. 30, 503-533 (2014).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., Wang, H., Jaenisch, R. Generating genetically modified mice using CRISPR/Cas-mediated genome engineering. Nat Protoc. 9, 1956-1968 (2014).
- Cotter, L., et al. Dlg1-PTEN interaction regulates myelin thickness to prevent damaging peripheral nerve overmyelination. Science. 328, 1415-1418 (2010).
- Gonzalez, S., Fernando, R. N., Perrin-Tricaud, C., Tricaud, N. In vivo introduction of transgenes into mouse sciatic nerve cells in situ using viral vectors. Nat Protoc. 9, 1160-1169 (2014).
- Ozcelik, M., et al. Pals1 is a major regulator of the epithelial-like polarization and the extension of the myelin sheath in peripheral nerves. J Neurosci. 30, 4120-4131 (2010).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21, 583-593 (2008).
- Glatzel, M., et al. Adenoviral and adeno-associated viral transfer of genes to the peripheral nervous system. Proc Natl Acad Sci U S A. 97, 442-447 (2000).
- Homs, J., et al. Schwann cell targeting via intrasciatic injection of AAV8 as gene therapy strategy for peripheral nerve regeneration. Gene Ther. 18, 622-630 (2011).
- Aspalter, M., et al. Modification of Schwann cell gene expression by electroporation in vivo. J Neurosci Methods. 176, 96-103 (2009).
- Ino, D., et al. Neuronal Regulation of Schwann Cell Mitochondrial Ca(2+) Signaling during Myelination. Cell Rep. 12, 1951-1959 (2015).
- Struhl, K. Chapter 3; Subcloning of DNA fragments. Curr Protoc Mol Biol. , Unit3 16 (2001).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient selection for high-expression transfectants with a novel eukaryotic vector. Gene. 108, 193-199 (1991).
- Chang, K., Elledge, S. J., Hannon, G. J. Lessons from Nature: microRNA-based shRNA libraries. Nat Methods. 3, 707-714 (2006).
- Schlaepfer, W. W., Myers, F. K. Relationship of myelin internode elongation and growth in the rat sural nerve. J Comp Neurol. 147, 255-266 (1973).
- Webster, H. D. The geometry of peripheral myelin sheaths during their formation and growth in rat sciatic nerves. J Cell Biol. 48, 348-367 (1971).
- Weis, J., Fine, S. M., David, C., Savarirayan, S., Sanes, J. R. Integration site-dependent expression of a transgene reveals specialized features of cells associated with neuromuscular junctions. J Cell Biol. 113, 1385-1397 (1991).
- Zhao, Y., et al. An expanded palette of genetically encoded Ca(2)(+) indicators. Science. 333 (2), 1888-1891 (2011).
- Suzuki, J., et al. Imaging intraorganellar Ca2+ at subcellular resolution using CEPIA. Nat Commun. 5, 4153 (2014).
- Tabata, H., Nakajima, K. Labeling embryonic mouse central nervous system cells by in utero electroporation. Dev Growth Differ. 50, 507-511 (2008).
- Taveggia, C., Feltri, M. L., Wrabetz, L. Signals to promote myelin formation and repair. Nat Rev Neurol. 6, 276-287 (2010).
- Saijilafu, E. M., Hur, F. Q., Zhou, Genetic dissection of axon regeneration via in vivo electroporation of adult mouse sensory neurons. Nat Commun. 2, 543 (2011).
- Tanaka, Y., Hirokawa, N. Mouse models of Charcot-Marie-Tooth disease. Trends Genet. 18, S39-S44 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır