Method Article
In Vivo Transfert de gènes à des cellules de Schwann dans le nerf sciatique Rongeur par électroporation
Dans cet article
Résumé
Here, we present an in vivo technique for gene transfer to Schwann cells (SCs) in the rodent sciatic nerve. This simple technique is useful for investigating signaling mechanisms involved in the development and maintenance of myelinating SCs.
Résumé
The formation of the myelin sheath by Schwann cells (SCs) is essential for rapid conduction of nerve impulses along axons in the peripheral nervous system. SC-selective genetic manipulation in living animals is a powerful technique for studying the molecular and cellular mechanisms of SC myelination and demyelination in vivo. While knockout/knockin and transgenic mice are powerful tools for studying SC biology, these methods are costly and time consuming. Viral vector-mediated transgene introduction into the sciatic nerve is a simpler and less laborious method. However, viral methods have limitations, such as toxicity, transgene size constraints, and infectivity restricted to certain developmental stages. Here, we describe a new method that allows selective transfection of myelinating SCs in the rodent sciatic nerve using electroporation. By applying electric pulses to the sciatic nerve at the site of plasmid DNA injection, genes of interest can be easily silenced or overexpressed in SCs in both neonatal and more mature animals. Furthermore, this in vivo electroporation method allows for highly efficient simultaneous expression of multiple transgenes. Our novel technique should enable researchers to efficiently manipulate SC gene expression, and facilitate studies on SC development and function.
Introduction
The rapid transmission of sensory and motor information in the peripheral nervous system is permitted by the myelin sheath, which is formed by myelinating Schwann cells (SCs)1. Insulation of axons by the myelin sheath enables saltatory conduction, which increases the speed of nerve impulses. In disorders in which the development or maintenance of the myelin sheath is impaired, nerve conduction speed is reduced. This results in neuropathy involving motor and sensory dysfunction. Although there are many studies on the molecular mechanisms of myelination and demyelination in the peripheral nervous system, the roles of the numerous proteins involved in these processes remain unclear.
To study the molecular mechanisms of SC myelination/demyelination in vivo, genetic approaches have been used to modify gene expression in animals. A powerful approach is the use of knockout/knockin or transgenic animals. However, the generation of these animals is expensive and time consuming. For SC-specific gene manipulation, crossing floxed strains with Cre mice or other conditional gene expression methods are necessary. This again is laborious and time intensive. In recent years, a cutting-edge genetic technology, the CRISPR-Cas9 system, has made the generation of genetically modified mice much quicker (about 4 weeks)2,3, but this method is hindered by target sequence limitations, and suffers from off-target effects. As an alternative method, viral vector-mediated gene transfer is a faster and easier method of achieving gene transfer into SCs in vivo4-6. Indeed, the generation of viral vectors is less expensive, and takes a shorter time (within a few weeks), and gene manipulation of SCs can be achieved by simply injecting engineered viral vectors, such as adenoviral vectors, adeno-associated viral (AAV) vectors, and lentiviral vectors, into the sciatic nerve. Because these viral vectors have different characteristics, users have to choose the one best suited for their purpose. Adenoviral vectors infect axons and SCs in both young and mature sciatic nerves. In particular, adenoviral vectors have higher selectively for non-myelinating SCs than myelinating SCs. Adenoviruses can cause immune responses, and accordingly, immunodeficient strains should be used5. AAV vectors are currently the most widely used viral vectors, and allow in vivo gene transfer with lower toxicity7. AAV can transduce both axons and SCs by direct injection into the nerve fibers8,9. However, AAV-mediated protein expression usually requires 3 weeks or longer to reach maximum levels7,9. Therefore, it is difficult to analyze myelination, which actively progresses during the two week postnatal period. Lentiviral vectors have higher selectively for myelinating SCs than non-myelinating SCs, and do not have toxic effects on sciatic nerves. However, lentiviral vectors do not infect SCs in more mature nerves5, and therefore are unsuitable for analyzing events such as the demyelination process.
Electroporation is another faster and easier approach to achieve in vivo gene transfer. It has been reported that in vivo transfection of SCs can be achieved when electroporation is applied to transected rat sciatic nerves10. However, because this method requires nerve transection for gene delivery, the application is limited to the analysis of the damaged nerves. Here, we describe an alternative method that allows the delivery of transgenes into myelinating SCs in intact rat sciatic nerves using electroporation11. This method requires plasmid construction, which can usually be completed within a week. Then, by simply delivering electric pulses to the site on the sciatic nerve where the plasmid DNA was injected, highly selective transfection of myelinating SCs can be achieved in neonatal as well as in more mature animals. By electroporating multiple plasmids, simultaneous expression of a variety of genes can be easily achieved. The ability to simultaneous express multiple molecules, such as signaling proteins, short-hairpin RNAs (shRNAs) and functional probes, is crucial for investigating complex processes such as myelination and demyelination. The novel in vivo electroporation method described in this paper will be a powerful tool, allowing researchers to analyze the function of a multitude of molecules and their interactions in myelinating SCs.
Protocole
L'utilisation de rats pour la recherche était conforme aux lignes directrices établies par le Comité de protection des animaux de l'Université de Tokyo.
1. Préparation de l'ADN plasmidique
- Générer des plasmides d' ADN pour l' électroporation in vivo par sous - clonage de l'ADNc ou la séquence shRNA dans un plasmide d'expression pour des cellules de mammifère 12. Utilisez un cytomegalovirus précoce immédiat amplificatrices et poulet β-actine promoteur fusion (CAG) promoteur induite par le plasmide 13 car il permet une expression forte et stable. Pour l' expression de shRNA sous le contrôle d'un promoteur CAG, utiliser un système de cassette shRNA base mir30-pour sous - cloner le shRNA 14.
- On purifie l' ADN de plasmide avec un kit Maxi-prep selon les instructions du fabricant, et remettre en suspension l'ADN avec une solution saline tamponnée par HEPES (140 mM de NaCl, 0,75 mM de Na 2 HPO 4, HEPES 25 mM, pH 7,40). Ajuster la concentration de l'ADN pour ≥ 4 pg / pl.
- Préparer la solution d'ADN plasmidique à une concentration de 4 pg / pl, et ajouter une quantité minimale de colorant vert rapide (concentration finale de 0,01%) pour marquer le site d'injection. Lors de l'électroporation simultanée de plusieurs plasmides est nécessaire, ajuster la concentration totale de la solution d'ADN plasmidique à 4 pg / pl.
Remarque: La composition optimale de l'ADN de plasmide doit être déterminée en fonction de l'efficacité de transfection de chaque plasmide.
2. Stérilisation des instruments chirurgicaux et Saline
- des instruments chirurgicaux autoclave et la solution de NaCl à 0,9%.
3. Préparation du verre Micropipette
- Tirez pipettes de verre en utilisant un extracteur de pipette. Coupez la pointe de la pipette à un diamètre de 30-50 pm. Utilisez les paramètres suivants: Chaleur, 600; Velocity, 50; Temps, 75.
4. Chirurgie animale, injection d'ADN et électroporation
Note: Une plusFace à cette étape est décrite dans la figure 1. Bien que la procédure pour les bébés rats sont décrits ici, le procédé est également applicable à des animaux plus âgés qui utilisent la même procédure.
- Anesthésier le rat avec de l'isoflurane dans la zone d'induction jusqu'à ce que l'animal devient immobile en ajustant le débit d'oxygène à 0,4 L / min et la concentration d'isoflurane à 4% (vol / vol). Effectuer orteil pincement pour confirmer anesthetization bon.
- Placez le rat sur le plus chaud préchauffé sous un microscope binoculaire, et maintenir une anesthésie en administrant en continu isoflurane à travers le masque. Ajuster le débit d'oxygène à 0,2 L / min et la concentration d'isoflurane à 2% (vol / vol). Utilisez des gouttes oculaires pour prévenir la sécheresse des yeux si les yeux de l'animal sont ouverts.
- Fixer les jambes avec du ruban adhésif chirurgical.
- Nettoyer la peau sur la cuisse postérieure avec povidone-iode, et faire une incision avec un scalpel.
Note: Rasez les zones chirurgicales si les zones chirurgicales sont recouvertes de hair. - Exposer le nerf sciatique en créant une ouverture entre les quadriceps femoris et muscle biceps fémoral avec des aiguilles à coudre.
- Mouiller le nerf avec une solution de NaCl à 0,9%. Absorber l'excès d'eau avec du papier non pelucheux.
- Insérez la base d'une micropipette de verre sur un tube flexible, et remplir la quantité adéquate de solution d'ADN (au moins un microlitre) dans la micropipette en aspirant doucement.
- Soulevez le nerf exposé en tirant doucement sur le côté distal du nerf à l'aide d'une aiguille.
Note: Ne pas appliquer une tension sur le nerf pour minimiser le stress mécanique. - Insérer la micropipette de verre dans le site distal du nerf, et injecter la solution d'ADN par application d'une pression (par exemple par soufflage dans l'extrémité ouverte du tube flexible). Injecter la solution d'ADN jusqu'à ce que le nerf apparaît en vert (1 pi maximum). Parce que l'insertion fréquente de la micropipette peut endommager le nerf, ne pas insérer la micropipette plus de deux fois.
- Placer un tweezer type d'électrode de platine d'environ 1-2 mm en dehors du nerf. Remplir l'espace entre l'électrode et le culot avec une solution de NaCl à 0,9%.
Remarque: Ne tenez pas le nerf avec l'électrode pour éviter toute contrainte mécanique sur le nerf. - Appliquer des impulsions électriques sur le site d'injection en utilisant une électroporation avec l'électrode. Après la première série d'impulsions, inverser l'électrode et appliquer une autre série d'impulsions. Utilisez les paramètres suivants: tension, 50 V; durée d'impulsion, 5 ms; intervalle d'impulsion, 100 msec; nombre d'impulsions, 4 fois.
- Nettoyez le site d'électroporation avec une solution de NaCl à 0,9%.
- Répétez les étapes 04.04 au 04.11 sur le nerf sciatique controlatéral.
5. Post-électroporation
- Fermer les incisions avec la colle cyanoacrylate.
- Après séchage de la colle, nettoyer la plaie avec de la povidone-iode.
- Relâchez le chiot à partir du masque. Chauffer le chiot sur un plus chaud au moins pendant une heure, afin de lui permettre de se rétablir complètement de l'anesthésie. réo ne pas laisser le chiot sans surveillance jusqu'à ce qu'il ait repris connaissance suffisante.
- Après récupération de l'anesthésie, retourner le chiot chez le rat mère. Ne pas retourner le chiot jusqu'à guérison complète.
6. Post-chirurgie
- Maison des chiots de rat dans la cage jusqu'à ce que la conduite des expériences 11 (voir les exemples dans la figure 3). Administrer carprofène (5 mg / kg; ip), un médicament non-stéroïdiens anti-inflammatoires, ou de la buprénorphine (0,1 mg / kg, sc), un analgésique opioïde, si nécessaire.
Remarque: Si le chiot de rat ne pousse pas bien ou l'inflammation est observée autour du site de la chirurgie, exclure l'animal à partir des expériences.
Résultats
Un exemple d'un nerf sciatique transfectées avec la protéine fluorescente rouge (RFP) exprimant le plasmide est représenté sur la figure 2A. Les cellules présentant une morphologie bipolaire, une caractéristique de SCs, ont été faiblement transfectées avec DP. Aucune fluorescence de DP a été détectée dans les axones. Nous trouvons généralement ~ 100 SCs transfectées dans chaque nerf. Cette efficacité de transfection semble similaire à l'in vivo SC efficacité de l' infection en utilisant des vecteurs lentiviraux 4.
Expériences immunocoloration ont montré que la plupart (~ 96%) , les cellules de la DP-positif à P7 co-marquée pour S100, un marqueur de SC (figure 2B), et 91% des cellules de la DP-positif au P14 co-marquée pour PBM, un marqueur myélinisation SC (figure 2C), ce qui suggère que le transfert de gène par électroporation est hautement sélectif pour myélinisantes SC.
L'introduction de plusieurs gènes dans SCs in vivo sera extrêmement utile pour étudier les mécanismes de myélinisation / démyélinisation. Un avantage majeur de la méthode in vivo électroporation décrit ici est la capacité de transférer des gènes multiples avec une procédure simple. La figure 2D montre une image représentative d'un nerf sciatique transfectées avec un mélange de GFP et des plasmides RFP exprimant en utilisant électroporation vivo. Environ 97% des SCs étaient GFP et RFP positive double, ce qui suggère que la livraison très efficace de gènes multiples peut être réalisée par électroporation simplement des mélanges de plusieurs plasmides.
Chez les rongeurs, la myélinisation lance autour de la naissance, ce qui augmente de façon spectaculaire au cours des deux premières semaines après la naissance, puis diminue progressivement. Ainsi, en manipulant génétiquement SCs au cours de ces fenêtres de temps de développement, les mécanismes sous-jacents à ces différents stades de myélinisation peuvent être clarifiées. Les vecteurs lentiviraux sont un bon outil pour unenalyzing myélinisation, en particulier car ils ont une toxicité minimale, mais lentivirus seulement infecter néonatale nerfs sciatiques 5,6. A titre de comparaison, le transfert de gène à médiation par électroporation fonctionne bien lorsque la transfection est réalisée sur P3 (Figure 2E, partie supérieure) ou P14 (figure 2E, en bas).
Les applications du roman dans la méthode d'électroporation in vivo sont décrits ici. La figure 3A montre des images au microscope optique de GFP exprimant myélinisantes SCs à divers stades de développement (P7, P14, P21 et P31). Par l'analyse au microscope optique, les changements de paramètres morphologiques, tels que la longueur et le diamètre, peuvent être évalués. A noter que ces paramètres ont des valeurs similaires par rapport aux rats intacts les nerfs périphériques 15,16, ce qui indique que les nerfs développent électroporées sans effets néfastes significatifs. La figure 3B montre une image au microscope électronique de LacZ expressing myélinisantes SCs. Dans ce cas, LacZ a été utilisé comme marqueur d'expression. β-galactosidase en utilisant Bluo-gal, un substrat insoluble dans l'éthanol, permet l'analyse de la structure de la myéline SCs transfectées par microscopie électronique à 11,17. Dans ces expériences, le rôle des molécules de signalisation peut être examinée en faisant taire ou d'augmenter leur expression, permettant ainsi à l'analyse de la perte de fonction ou des effets de gain de fonction. En plus de l'analyse des tissus fixés, in vivo , le transfert de gène à médiation par électroporation peut également être appliquée à vivre des expériences d'imagerie. Par exemple, la figure 3C montre une myélinisation SC co-exprimant G-GECO1.1 18, un indicateur vert fluorescent cytosolique Ca 2+, et R-GECO1mt 19, un indicateur rouge fluorescent mitochondrial Ca 2+. En exprimant ces indicateurs, nous avons identifié une voie de signalisation qui contrôle cytosoliques et mitochondriales Ca 2+ concentrations dans myélinisantes SCs . Ainsi, la présente méthode peut être utilisée pour étudier une variété de mécanismes de signalisation, en particulier lorsque des sondes fluorescentes génétiquement codés sont disponibles pour détecter les signaux d'intérêt.
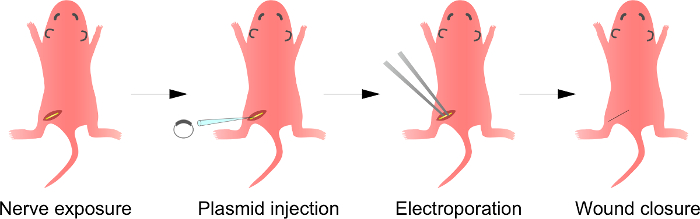
Figure 1:. Schéma de l'i n vivo électroporation Méthode d' abord, le nerf sciatique du rat anesthésié est exposé. En second lieu, l'ADN du plasmide est injecté dans le nerf sciatique. Troisièmement, les impulsions électriques sont délivrées au site d'injection à travers l'électrode en forme de pince. Enfin, la plaie est fermée avec de la colle. Cette procédure peut être répétée sur le nerf controlatéral. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
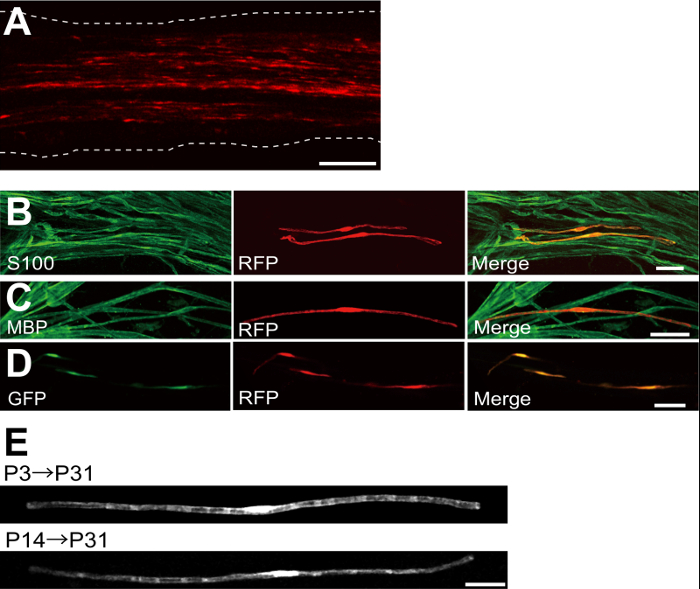
Figure 2: Les résultats représentatifs sur nerfs sciatiques transfectées (A) Une image représentative d'un nerf sciatique transfectées.. Le nerf a été transfecté avec le plasmide de DP exprimant à P3, et fixé à P7. (B) Une image représentative d'une cellule DP-transfectées à P7 montrant colocalisation avec S100, un marqueur de SC. (C) Une image représentative d'un nerf sciatique DP-transfectées à P14 montrant colocalisation avec PBM, un marqueur myélinisation SC. (D) Une image représentative d'un nerf sciatique cotransfectées avec la GFP et les plasmides de la DP-exprimant. SCs transfectées exprimés simultanément GFP et RFP. (E) Une image de myélinisation SCs à P31 transfectées à P3, lorsque la myélinisation commence ( en haut), et une image de SCs myélinisantes à P31 transfectées au P14, lorsque la plupart des grandes axones deviennent myélinisées ( en bas), ce qui suggère que transfection de SCs myélinisantes peut être atteint non seulement dans les nerfs néonatals, mais aussi dans les nerfs plus matures. Les barres d'échelle = 200 pm (A); 50 pm (BE). Ce chiffre a été modifié à partir de notre publication précédente 11. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
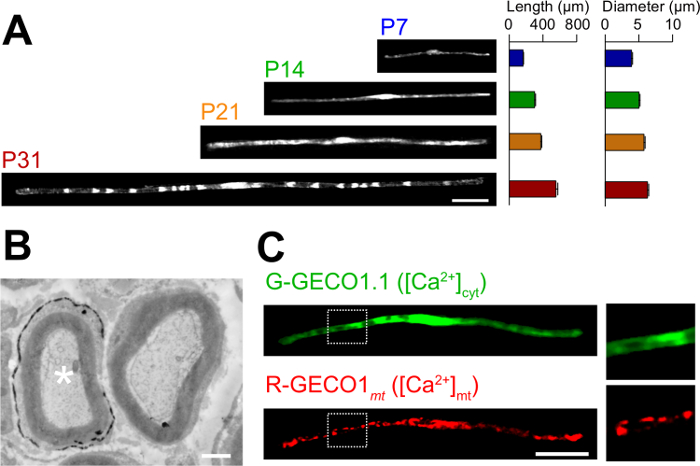
Figure 3: Application in vivo électroporation (A) Une analyse au microscope optique du développement de la myélinisation SCs.. nerfs sciatiques ont été électroporés avec le plasmide exprimant la GFP à P3, et ont été fixés à différents stades de développement (P7, P14, P21 et P31). Des images représentatives de GFP-positives SCs sont indiqués sur la gauche. La longueur moyenne et le diamètre sont résumés comme moyenne ± SEM (n = 30-47 de 3 nerfs) sur la droite. La longueur et le diamètre de myélinisation augmente SCs que le développement se poursuit. (B) Une image au microscope électronique d'un nerf sciatique transfectée avec un LacZ codant pour le plasmide. Un SC transfectée (astérisque blanc, à gauche) a été marqué avec finement précipités du produit de la réaction β-galactosidase. (C) Une image d'un SC cotransfecté avec G-GECO1.1, un indicateur vert fluorescent cytosolique Ca 2+, et R-GECO1mt, un indicateur rouge fluorescent mitochondrial Ca 2+. Les régions dans les rectangles en pointillés blancs sont représentés élargie dans les panneaux sur la droite. Barres d'échelle = 50 pm (A et C); 1 pm (B). Ce chiffre a été modifié à partir de notre publication précédente 11. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
In this paper, we describe a simple and efficient method that allows in vivo gene transfer to myelinating SCs in the rat sciatic nerve using electroporation. This method allows highly selective gene expression in myelinating SCs by simply applying electric pulses to the plasmid DNA-injected sciatic nerve. Because the molecular mechanisms of myelination and demyelination in the peripheral nervous system remain unclear, the present in vivo electroporation method will be a powerful tool to clarify the roles of multiple genes of interest in living animals.
A critical requirement of this method is to keep damage to the nerve during surgery to a minimal level. Should surgical damage cause excessive inflammation, the sciatic nerve may degenerate. To avoid this, one must conduct surgery with extreme care, so as to not damage the blood vessels around the nerve. Mechanical stress to the nerve during the surgery can also be a cause of nerve damage. To minimize mechanical stress, lifting the exposed nerve should be done as gently as possible, and the tweezer-type electrode should be placed close to the nerve without contact. Furthermore, electrical pulses that are too strong can cause undesirable large leg movement, which leads to mechanical stress, or can burn the nerve. If significant damages are observed in the nerves, we recommend reducing the electrical pulse intensities or placing the electrode further away from the nerve.
In our present protocol, CAG promoter-driven plasmids were used as expression vectors. CAG promoter-driven plasmids allow high levels of gene expression in myelinating SCs in vivo. We also have tried a CMV promoter, another widely used universal promoter for mammalian gene expression, but expression of the gene product was very weak. This is consistent with previous results, in which electroporation-mediated transfection was conducted in the embryonic brain20. Therefore, we recommend using CAG promoter-driven plasmids for the in vivo electroporation method.
Because axonal signaling is a key factor in myelination/demyelination21, gene modification in neurons is also important. However, delivery of transgenes using our in vivo electroporation method is limited to SCs. It has been reported that gene delivery into sciatic nerve axons can be achieved when in vivo electroporation is applied to dorsal root ganglion (DRG) neurons in adult rats22. This suggests that delivery of plasmid DNA to the cell body is likely to be critical for in vivo transfection of peripheral axons. Thus, to examine the involvement of axonal molecules in myelination/demyelination, researchers should use neuron-specific genetic methods such as genetically modified animals, neuron-specific viral vectors, or in vivo electroporation to DRG neurons.
Compared with current methods, such as the generation of genetically modified animal lines23 and delivery of transgenes by viral vectors4-6, gene modification of SCs by in vivo electroporation is simpler. This method only requires several days for plasmid DNA construction and one day for electroporation surgery. Plasmid DNA construction does not require a biohazard room that is usually essential for viral vector handling. In addition, one of the advantages of the electroporation method is the capacity for simultaneous expression of multiple gene products using a simple protocol. Our novel technique will be useful for analyzing the interaction of a variety of signaling molecules involved in myelination and demyelination. In particular, by permitting the cotransfection of a number of different intracellular fluorescent probes, our method should be a powerful tool for investigating intracellular signaling dynamics in SCs using live imaging experiments.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
This work was supported by grants from the Ministry of Education, Culture, Sports, Science and Technology to M.I. (21229004 and 25221304).
matériels
| Name | Company | Catalog Number | Comments |
| Genopure Plasmid Maxi Kit | Roche | 03 143 422 001 | Plasmid DNA purification kit |
| Fast Green CFC | WAKO | 069-00032 | Dye for DNA injection |
| GC 150T-10 | HARVARD APPARATUS | 30-0062 | Glass capillary |
| Suction tubing | Drummond | 05-2000-00 | Suction tubing for micro injection |
| MODEL P-97 | SUTTER INSTRUMENT CO. | Micropipette puller | |
| CUY21 Single Cell | BEX | Electroporator CUY21 Single Cell | Pulse generator |
| Electric warmer | KODEN | CAH-6A | Warmer during the surgery |
| Isofluolane | Mylan | 1119701G1076 | Anesthetic |
Références
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annu Rev Cell Dev Biol. 30, 503-533 (2014).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., Wang, H., Jaenisch, R. Generating genetically modified mice using CRISPR/Cas-mediated genome engineering. Nat Protoc. 9, 1956-1968 (2014).
- Cotter, L., et al. Dlg1-PTEN interaction regulates myelin thickness to prevent damaging peripheral nerve overmyelination. Science. 328, 1415-1418 (2010).
- Gonzalez, S., Fernando, R. N., Perrin-Tricaud, C., Tricaud, N. In vivo introduction of transgenes into mouse sciatic nerve cells in situ using viral vectors. Nat Protoc. 9, 1160-1169 (2014).
- Ozcelik, M., et al. Pals1 is a major regulator of the epithelial-like polarization and the extension of the myelin sheath in peripheral nerves. J Neurosci. 30, 4120-4131 (2010).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21, 583-593 (2008).
- Glatzel, M., et al. Adenoviral and adeno-associated viral transfer of genes to the peripheral nervous system. Proc Natl Acad Sci U S A. 97, 442-447 (2000).
- Homs, J., et al. Schwann cell targeting via intrasciatic injection of AAV8 as gene therapy strategy for peripheral nerve regeneration. Gene Ther. 18, 622-630 (2011).
- Aspalter, M., et al. Modification of Schwann cell gene expression by electroporation in vivo. J Neurosci Methods. 176, 96-103 (2009).
- Ino, D., et al. Neuronal Regulation of Schwann Cell Mitochondrial Ca(2+) Signaling during Myelination. Cell Rep. 12, 1951-1959 (2015).
- Struhl, K. Chapter 3; Subcloning of DNA fragments. Curr Protoc Mol Biol. , Unit3 16 (2001).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient selection for high-expression transfectants with a novel eukaryotic vector. Gene. 108, 193-199 (1991).
- Chang, K., Elledge, S. J., Hannon, G. J. Lessons from Nature: microRNA-based shRNA libraries. Nat Methods. 3, 707-714 (2006).
- Schlaepfer, W. W., Myers, F. K. Relationship of myelin internode elongation and growth in the rat sural nerve. J Comp Neurol. 147, 255-266 (1973).
- Webster, H. D. The geometry of peripheral myelin sheaths during their formation and growth in rat sciatic nerves. J Cell Biol. 48, 348-367 (1971).
- Weis, J., Fine, S. M., David, C., Savarirayan, S., Sanes, J. R. Integration site-dependent expression of a transgene reveals specialized features of cells associated with neuromuscular junctions. J Cell Biol. 113, 1385-1397 (1991).
- Zhao, Y., et al. An expanded palette of genetically encoded Ca(2)(+) indicators. Science. 333 (2), 1888-1891 (2011).
- Suzuki, J., et al. Imaging intraorganellar Ca2+ at subcellular resolution using CEPIA. Nat Commun. 5, 4153 (2014).
- Tabata, H., Nakajima, K. Labeling embryonic mouse central nervous system cells by in utero electroporation. Dev Growth Differ. 50, 507-511 (2008).
- Taveggia, C., Feltri, M. L., Wrabetz, L. Signals to promote myelin formation and repair. Nat Rev Neurol. 6, 276-287 (2010).
- Saijilafu, E. M., Hur, F. Q., Zhou, Genetic dissection of axon regeneration via in vivo electroporation of adult mouse sensory neurons. Nat Commun. 2, 543 (2011).
- Tanaka, Y., Hirokawa, N. Mouse models of Charcot-Marie-Tooth disease. Trends Genet. 18, S39-S44 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon