Method Article
In vivo - Gentransfer auf Schwann - Zellen in der Nagerischiasnerv durch Elektroporation
In diesem Artikel
Zusammenfassung
Here, we present an in vivo technique for gene transfer to Schwann cells (SCs) in the rodent sciatic nerve. This simple technique is useful for investigating signaling mechanisms involved in the development and maintenance of myelinating SCs.
Zusammenfassung
The formation of the myelin sheath by Schwann cells (SCs) is essential for rapid conduction of nerve impulses along axons in the peripheral nervous system. SC-selective genetic manipulation in living animals is a powerful technique for studying the molecular and cellular mechanisms of SC myelination and demyelination in vivo. While knockout/knockin and transgenic mice are powerful tools for studying SC biology, these methods are costly and time consuming. Viral vector-mediated transgene introduction into the sciatic nerve is a simpler and less laborious method. However, viral methods have limitations, such as toxicity, transgene size constraints, and infectivity restricted to certain developmental stages. Here, we describe a new method that allows selective transfection of myelinating SCs in the rodent sciatic nerve using electroporation. By applying electric pulses to the sciatic nerve at the site of plasmid DNA injection, genes of interest can be easily silenced or overexpressed in SCs in both neonatal and more mature animals. Furthermore, this in vivo electroporation method allows for highly efficient simultaneous expression of multiple transgenes. Our novel technique should enable researchers to efficiently manipulate SC gene expression, and facilitate studies on SC development and function.
Einleitung
The rapid transmission of sensory and motor information in the peripheral nervous system is permitted by the myelin sheath, which is formed by myelinating Schwann cells (SCs)1. Insulation of axons by the myelin sheath enables saltatory conduction, which increases the speed of nerve impulses. In disorders in which the development or maintenance of the myelin sheath is impaired, nerve conduction speed is reduced. This results in neuropathy involving motor and sensory dysfunction. Although there are many studies on the molecular mechanisms of myelination and demyelination in the peripheral nervous system, the roles of the numerous proteins involved in these processes remain unclear.
To study the molecular mechanisms of SC myelination/demyelination in vivo, genetic approaches have been used to modify gene expression in animals. A powerful approach is the use of knockout/knockin or transgenic animals. However, the generation of these animals is expensive and time consuming. For SC-specific gene manipulation, crossing floxed strains with Cre mice or other conditional gene expression methods are necessary. This again is laborious and time intensive. In recent years, a cutting-edge genetic technology, the CRISPR-Cas9 system, has made the generation of genetically modified mice much quicker (about 4 weeks)2,3, but this method is hindered by target sequence limitations, and suffers from off-target effects. As an alternative method, viral vector-mediated gene transfer is a faster and easier method of achieving gene transfer into SCs in vivo4-6. Indeed, the generation of viral vectors is less expensive, and takes a shorter time (within a few weeks), and gene manipulation of SCs can be achieved by simply injecting engineered viral vectors, such as adenoviral vectors, adeno-associated viral (AAV) vectors, and lentiviral vectors, into the sciatic nerve. Because these viral vectors have different characteristics, users have to choose the one best suited for their purpose. Adenoviral vectors infect axons and SCs in both young and mature sciatic nerves. In particular, adenoviral vectors have higher selectively for non-myelinating SCs than myelinating SCs. Adenoviruses can cause immune responses, and accordingly, immunodeficient strains should be used5. AAV vectors are currently the most widely used viral vectors, and allow in vivo gene transfer with lower toxicity7. AAV can transduce both axons and SCs by direct injection into the nerve fibers8,9. However, AAV-mediated protein expression usually requires 3 weeks or longer to reach maximum levels7,9. Therefore, it is difficult to analyze myelination, which actively progresses during the two week postnatal period. Lentiviral vectors have higher selectively for myelinating SCs than non-myelinating SCs, and do not have toxic effects on sciatic nerves. However, lentiviral vectors do not infect SCs in more mature nerves5, and therefore are unsuitable for analyzing events such as the demyelination process.
Electroporation is another faster and easier approach to achieve in vivo gene transfer. It has been reported that in vivo transfection of SCs can be achieved when electroporation is applied to transected rat sciatic nerves10. However, because this method requires nerve transection for gene delivery, the application is limited to the analysis of the damaged nerves. Here, we describe an alternative method that allows the delivery of transgenes into myelinating SCs in intact rat sciatic nerves using electroporation11. This method requires plasmid construction, which can usually be completed within a week. Then, by simply delivering electric pulses to the site on the sciatic nerve where the plasmid DNA was injected, highly selective transfection of myelinating SCs can be achieved in neonatal as well as in more mature animals. By electroporating multiple plasmids, simultaneous expression of a variety of genes can be easily achieved. The ability to simultaneous express multiple molecules, such as signaling proteins, short-hairpin RNAs (shRNAs) and functional probes, is crucial for investigating complex processes such as myelination and demyelination. The novel in vivo electroporation method described in this paper will be a powerful tool, allowing researchers to analyze the function of a multitude of molecules and their interactions in myelinating SCs.
Protokoll
Die Verwendung von Ratten für die Forschung wurde in Übereinstimmung mit den Richtlinien des Ausschusses für Tierschutz gegründet von der University of Tokyo.
1. Herstellung von Plasmid-DNA
- Erzeugen DNA - Plasmiden für in vivo Elektroporation durch Subklonieren der cDNA oder shRNA - Sequenz in einem Expressionsplasmid für Säugerzellen 12. Verwenden Sie einen Cytomegalovirus Immediate Early - Enhancer und Huhn β-Aktin - Promotor Fusion (CAG) Promotor getriebene Plasmid 13 , weil es starke und stabile Expression ermöglicht. Zur Expression von shRNAs unter der Kontrolle eines CAG - Promotor, verwenden eine mir30 Basis shRNA Kassettensystem zum Subklonieren der shRNA 14.
- Reinige Plasmid DNA mit einer maxi-prep Kits nach den Anweisungen des Herstellers, und Resuspendieren der DNA mit HEPES-gepufferter Kochsalzlösung (140 mM NaCl, 0,75 mM Na 2 HPO 4, 25 mM HEPES, pH 7,40). Passen Sie die Konzentration von DNA ug / ul zu ≥ 4. , um die Plasmid-DNA-Lösung auf eine Konzentration von 4 ug / ul, und fügen Sie eine minimale Menge an schnell grünen Farbstoff (Endkonzentration 0,01%) an der Injektionsstelle zu beschriften. Wenn gleichzeitige Elektroporation von mehreren Plasmiden erforderlich ist, stellen die Gesamtkonzentration der Plasmid-DNA-Lösung auf 4 & mgr; g / & mgr; l.
Anmerkung: Die optimale Zusammensetzung von Plasmid DNAs sollte entsprechend der Transfektionseffizienz von jedem Plasmid bestimmt werden.
2. Sterilisation von chirurgischen Instrumenten und Saline
- Autoklav chirurgischen Instrumenten und der 0,9% NaCl-Lösung.
3. Herstellung der Glasmikropipette
- Ziehen Glaspipetten mit einer Pipette Abzieher. Schneiden Sie die Spitze der Pipette auf einen Durchmesser von 30 bis 50 & mgr; m. Verwenden Sie die folgenden Parameter: Hitze, 600; Geschwindigkeit, 50; Zeit, 75.
4. Tierchirurgie, DNA-Injektion und Elektroporation
Hinweis: Ein überAnsicht dieses Schrittes ist in Figur 1 beschrieben ist . Obwohl das Verfahren für die Rattenjungen hier beschrieben werden, ist das Verfahren auch anwendbar auf reiferen Tieren nach dem gleichen Verfahren.
- Anästhesieren die Ratte mit Isofluran in dem Induktionsfeld, bis das Tier durch Einstellen der Sauerstoffströmung auf 0,4 L / min und der Isofluran-Konzentration auf 4% (vol / vol) unbeweglich wird. Führen Zehen Kneifen richtigen anesthetization zu bestätigen.
- Legen Sie die Ratte auf den vorgeheizten wärmer unter dem Binokular und Anästhesie aufrechtzuerhalten, indem kontinuierlich Isofluran durch die Gesichtsmaske verabreicht wird. Einstellen der Sauerstofffluss auf 0,2 L / min und der Isofluran-Konzentration auf 2% (vol / vol). Verwenden Sie Augentropfen Trockenheit Augen zu verhindern, wenn die Augen des Tieres geöffnet sind.
- Befestigen Sie die Beine mit chirurgischen Band.
- Reinigen Sie die Haut an der hinteren Oberschenkel mit PVP-Jod, und machen einen Schnitt mit dem Skalpell.
Hinweis: Shave chirurgische Bereiche, wenn die chirurgische Bereiche mit h abgedeckt sindLuft. - Setzen Sie die Ischiasnerv durch eine Öffnung zwischen den Quadrizeps femoris zu schaffen und Bizeps femoris mit Nähnadeln.
- Wet den Nerv mit 0,9% NaCl-Lösung. Absorbieren überschüssiges Wasser mit einem fusselfreien Papier.
- Legen Sie die Basis einer Glasmikropipette auf flexible Schläuche, und füllen Sie die ausreichende Menge an DNA-Lösung (mindestens ein Mikroliter) in die Mikropipette vorsichtig abgesaugt.
- Heben Sie den freiliegenden Nerv durch sanft die distale Seite des Nerven ziehen mit einer Nadel.
Hinweis: Legen Sie keine Spannung auf die Nerven mechanische Belastung zu minimieren. - Legen Sie die Glasmikropipette in die distale Stelle auf die Nerven, und injizieren durch Druck der DNA - Lösung (dh durch in das offene Ende des flexiblen Schlauchs weht). Injizieren DNA-Lösung, bis die Nerven grün (1 ul maximal) erscheint. Da häufiges Einsetzen des Mikro die Nerven schädigen können, legen Sie nicht die Mikropipette mehr als doppelt so hoch.
- Legen Sie eine TWEezer-Typ Platinelektrode etwa 1-2 mm vom Nerv. Füllen Sie die Lücke zwischen der Elektrode und dem Nerven mit 0,9% NaCl-Lösung.
Hinweis: Schließen Sie den Nerv mit der Elektrode nicht länger auf die Nerven mechanische Belastung zu vermeiden. - Übernehmen von elektrischen Impulsen auf die Injektionsstelle eine Elektroporator mit der Elektrode. Nach dem ersten Impuls gesetzt, um die Elektrode zu invertieren und einen weiteren Impuls Satz anzuwenden. Verwenden Sie die folgenden Parameter: Spannung, 50 V; Pulsdauer von 5 ms; Impulsintervall 100 ms; Pulszahl, 4 mal.
- Reinigen Sie die Elektroporation Stelle mit 0,9% NaCl-Lösung.
- Wiederholen Sie die Schritte 4,4-4,11 auf der Gegenischiasnerv.
5. Post-Elektroporation
- Schließen Sie die Schnitte mit Sekundenkleber.
- Nach den Leim trocknen, reinigen Sie die Wunde mit PVP-Jod.
- Lassen Sie den Welpen aus der Gesichtsmaske. Wärmen Sie den Welpen auf einem wärmeren zumindest für eine Stunde, um es zu ermöglichen, vollständig aus der Narkose zu erholen. Do nicht den Welpen unbeaufsichtigt lassen, bis es genügend Bewusstsein wiedererlangt hat.
- Nach der Erholung von der Anästhesie, kehren den Welpen der Mutter Ratte. Sie nicht den Welpen zurück, bis vollständig erholt.
6. Post-Chirurgie
- Haus die Rattenjungen in den Käfig , bis der Durchführung der Experimente 11 (siehe Beispiele in Abbildung 3). Verabreichen Carprofen (5 mg / kg, IP), ein nicht-steroidales entzündungshemmendes Medikament, oder Buprenorphin (0,1 mg / kg, sc), ein Opioid-Analgetikum, falls erforderlich.
Hinweis: Wenn die Rattenjungen nicht gut wachsen oder Entzündung ist rund um die Operationsstelle beobachtet, ausschließen, das Tier aus den Experimenten.
Ergebnisse
Ein Beispiel eines Ischiasnervs mit rot fluoreszierendes Protein (RFP) transfiziert exprimierenden Plasmids ist in 2A gezeigt. Die Zellen bipolare Morphologie zeigt, ein Merkmal von SCs wurden spärlich mit RFP transfiziert. Keine RFP-Fluoreszenz wurde in Axonen nachgewiesen. Wir finden in der Regel ~ 100 transfiziert SCs in jedem Nerv. Diese Transfektionseffizienz scheint ähnlich zu der in vivo Wirksamkeit SC - Infektion unter Verwendung von lentiviralen Vektoren 4.
Immunfärbungsexperimente zeigten , dass die meisten (~ 96%) RFP-positive Zellen bei P7 co-markiertem für S100, eine SC - Marker (Figur 2B), und 91% der RFP-positive Zellen bei P14 co-markiertem für MBP, einem myelinisierenden SC marker (2C), was darauf hindeutet , dass Gentransfer durch Elektroporation ist hochselektiv für myelinisierenden SCs.
Einführung mehrerer Gene in SCs in vivo wird sehr nützlich sein für die Mechanismen der Myelinisierung / Demyelinisierung zu untersuchen. Ein wesentlicher Vorteil der in - vivo - Elektroporation hier beschriebenen Verfahrens ist die Fähigkeit , mehrere Gene , die mit einem einfachen Verfahren zu übertragen. Figur 2D zeigt ein repräsentatives Bild eines Ischiasnervs mit einer Mischung von GFP transfiziert und RFP-exprimierenden Plasmiden in vivo Elektroporation verwendet. Über 97% der SCs waren GFP und RFP doppelt positiv, was darauf hindeutet, dass hocheffiziente Lieferung mehrerer Gene können durch einfaches Elektroporation Mischungen aus mehreren Plasmiden erreicht werden.
postnatal, und dann allmählich abnimmt Bei Nagetieren initiiert Myelinisierung rund um die Geburt, dramatisch während der ersten zwei Wochen zu erhöhen. Somit ist es durch genetisch SCs während dieser Entwicklungszeitfenster zu manipulieren, die Mechanismen, die diesen verschiedenen Stadien der Myelinisierung zugrunde liegen kann klären. Lentivirale Vektoren sind ein gutes Werkzeug für eineMyelinisierung nalyzing, vor allem , da sie eine minimale Toxizität, aber Lentiviren nur neonatalen 5,6 Ischiasnerven zu infizieren. Im Vergleich dazu arbeitet Elektroporation-vermittelte Gentransfer auch bei der Transfektion auf P3 (2E, oben) oder P14 (2E, unten) durchgeführt wird.
Die Anwendungen des neuartigen In - vivo - Elektroporation Verfahren werden hier beschrieben. 3A zeigt lichtmikroskopische Bilder der GFP-exprimierenden myelinisierenden SCs in verschiedenen Entwicklungsstadien (P7, P14, P21 und P31). Durch lichtmikroskopische Analyse Änderungen in morphologischen Parameter, wie Länge und Durchmesser, kann beurteilt werden. Beachten Sie, dass diese Parameter ähnliche Werte im Vergleich zu intakten Ratte peripheren Nerven 15,16 haben, was darauf hindeutet , dass die elektroporierten Nerven entwickeln , ohne erhebliche schädliche Wirkungen. 3B zeigt eine elektronenmikroskopische Aufnahme von LacZ-expressing myelinisierenden SCs. In diesem Fall wurde die LacZ als Expressionsmarker verwendet. β-Galactosidase - Färbung unter Verwendung bluO-gal, ein Ethanol-unlöslichen Substrat, ermöglicht die Analyse der Myelinstruktur transfizierter SCs durch Elektronenmikroskopie 11,17. In diesen Versuchen kann die Rolle der Signalmoleküle durch Silencing oder Erweiterung ihrer Expression untersucht werden, wodurch die Analyse der loss-of-function oder gain-of-function-Effekte. Zusätzlich zu der Analyse von fixierten Gewebes, in vivo Elektroporation-vermittelte Gentransfer kann auch auf Live - Imaging - Experimente angewendet werden. Beispielsweise zeigt 3C eine myelinisierenden SC Coexpression G-GECO1.1 18, ein grün fluoreszierendes cytosolischen Ca 2+ Indikator und R-GECO1mt 19 ein rot fluoreszierendes mitochondrialen Ca 2+ Indikator. Durch diese Indikatoren zum Ausdruck, identifizierten wir einen Signalweg, der 2+ Konzentrationen zytosolischen und mitochondrialen Ca steuert SCs in myelinisierende . Somit kann das vorliegende Verfahren verwendet werden, um eine Vielzahl von Signalisierungsmechanismen zu untersuchen, insbesondere, wenn genetisch kodierten fluoreszierenden Sonden verfügbar sind, die Signale von Interesse zu detektieren.
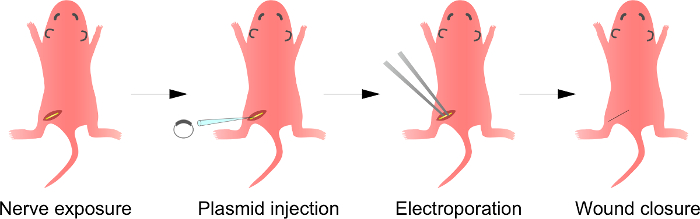
Abb . 1: Schematische Darstellung des i n vivo Elektroporation Methode Zuerst den Ischiasnerv der narkotisierten Ratten ausgesetzt ist . Zweitens wird Plasmid-DNA in den Ischiasnerv injiziert. Dritte, elektrische Impulse werden an der Injektionsstelle durch die zangenförmige Elektrode geliefert. Schließlich wird die Wunde mit Klebstoff verschlossen. Dieses Verfahren kann auf der kontralateralen Nerv wiederholt werden. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
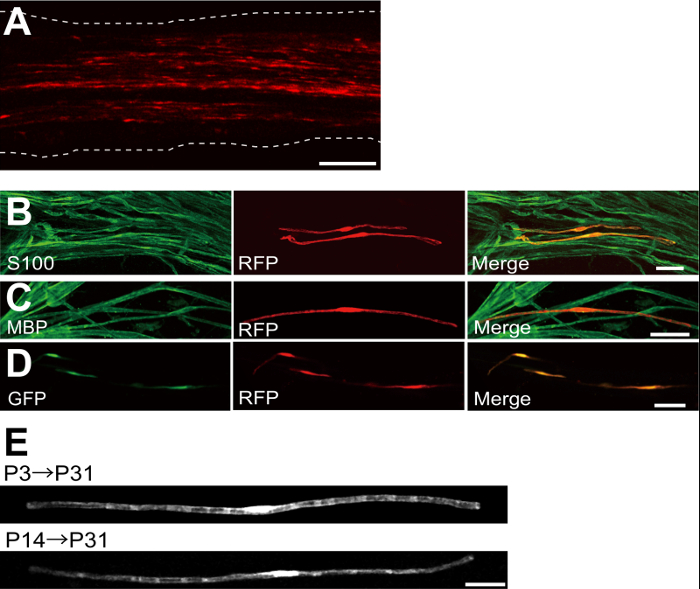
Abbildung 2: Repräsentative Ergebnisse auf Transfizierte Hüftnerven (A) Ein repräsentatives Bild eines transfizierten Ischiasnerv.. Der Nerv wurde mit RFP-exprimierenden Plasmid an P3 transfiziert und bei P7 fixiert. (B) Ein repräsentatives Bild eines RFP-transfizierten Zelle bei P7 zeigt Kolokalisation mit S100, einem SC - Marker. (C) Ein repräsentatives Bild eines RFP-transfizierten Ischiasnerv bei P14 Kolokalisation mit MBP zeigt eine myelinisierenden SC Marker. (D) Ein repräsentatives Bild eines Ischiasnervs cotransfiziert mit GFP und RFP-exprimierenden Plasmide. Transfizierte SCs ausgedrückt gleichzeitig GFP und RFP. (E) Ein Bild von SCs bei P31 transfiziert bei P3 myelinisierenden, wenn Myelinisierung beginnt (oben) und ein Bild von myelinisierenden SCs bei P31 auf P14 transfiziert, als die meisten großen Axone myelinated werden (unten), was darauf hindeutet , dass transfection von myelinisierenden SCs kann nicht nur in Neugeborenen-Nerven erreicht werden, sondern auch in den reiferen Nerven. Maßstabsbalken = 200 & mgr; m (A); 50 um (BE). Diese Zahl wurde von unserer früheren Veröffentlichung geändert 11. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
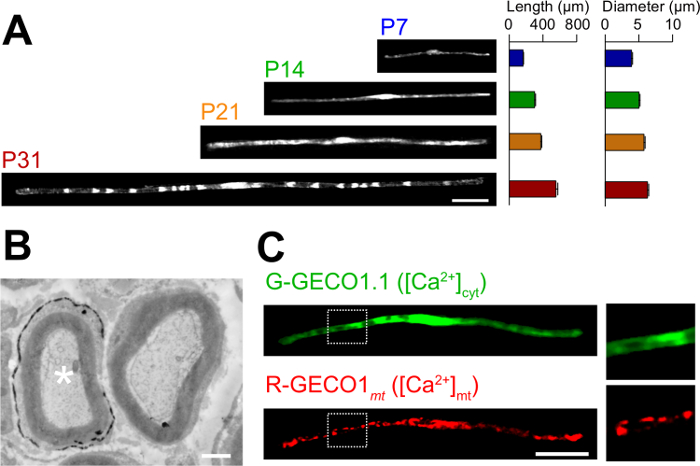
Abbildung 3: Die Anwendung von in vivo Elektroporation (A) Eine lichtmikroskopische Analyse der Entwicklung von SCs myelinisierenden.. Ischiasnerven wurden mit GFP-exprimierenden Plasmid an P3 elektroporiert, und wurden in verschiedenen Entwicklungsstadien (P7, P14, P21 und P31) festgelegt. Repräsentative Bilder von GFP-positiven SCs sind auf der linken Seite gezeigt. Die durchschnittliche Länge und Durchmesser sind als Mittelwert ± SEM zusammengefasst (n = 30-47 von 3 Nerven) auf der rechten Seite. Die Länge und der Durchmesser von myelinisierenden SCs zunimmt, wenn die Entwicklung fortschreitet. (B) Eine elektronenmikroskopische Aufnahme eines Ischiasnerv mit einem Plasmid - Codierung LacZ transfiziert. Transfizierte SC (weiße Stern, links) wurde fein mit Ausscheidungen der β-Galactosidase Reaktionsprodukt bezeichnet. (C) Ein Bild von einem SC cotransfiziert mit G-GECO1.1, einem grün fluoreszierenden cytosolischen Ca 2+ Indikator, und R-GECO1mt, ein rot fluoreszierendes mitochondrialen Ca2 + Indikator. Die Regionen innerhalb der weißen gepunkteten Rechtecke sind in den Platten auf der rechten Seite vergrößert dargestellt. Maßstabsbalken = 50 & mgr; m (A und C); 1 um (B). Diese Zahl wurde von unserer früheren Veröffentlichung geändert 11. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
In this paper, we describe a simple and efficient method that allows in vivo gene transfer to myelinating SCs in the rat sciatic nerve using electroporation. This method allows highly selective gene expression in myelinating SCs by simply applying electric pulses to the plasmid DNA-injected sciatic nerve. Because the molecular mechanisms of myelination and demyelination in the peripheral nervous system remain unclear, the present in vivo electroporation method will be a powerful tool to clarify the roles of multiple genes of interest in living animals.
A critical requirement of this method is to keep damage to the nerve during surgery to a minimal level. Should surgical damage cause excessive inflammation, the sciatic nerve may degenerate. To avoid this, one must conduct surgery with extreme care, so as to not damage the blood vessels around the nerve. Mechanical stress to the nerve during the surgery can also be a cause of nerve damage. To minimize mechanical stress, lifting the exposed nerve should be done as gently as possible, and the tweezer-type electrode should be placed close to the nerve without contact. Furthermore, electrical pulses that are too strong can cause undesirable large leg movement, which leads to mechanical stress, or can burn the nerve. If significant damages are observed in the nerves, we recommend reducing the electrical pulse intensities or placing the electrode further away from the nerve.
In our present protocol, CAG promoter-driven plasmids were used as expression vectors. CAG promoter-driven plasmids allow high levels of gene expression in myelinating SCs in vivo. We also have tried a CMV promoter, another widely used universal promoter for mammalian gene expression, but expression of the gene product was very weak. This is consistent with previous results, in which electroporation-mediated transfection was conducted in the embryonic brain20. Therefore, we recommend using CAG promoter-driven plasmids for the in vivo electroporation method.
Because axonal signaling is a key factor in myelination/demyelination21, gene modification in neurons is also important. However, delivery of transgenes using our in vivo electroporation method is limited to SCs. It has been reported that gene delivery into sciatic nerve axons can be achieved when in vivo electroporation is applied to dorsal root ganglion (DRG) neurons in adult rats22. This suggests that delivery of plasmid DNA to the cell body is likely to be critical for in vivo transfection of peripheral axons. Thus, to examine the involvement of axonal molecules in myelination/demyelination, researchers should use neuron-specific genetic methods such as genetically modified animals, neuron-specific viral vectors, or in vivo electroporation to DRG neurons.
Compared with current methods, such as the generation of genetically modified animal lines23 and delivery of transgenes by viral vectors4-6, gene modification of SCs by in vivo electroporation is simpler. This method only requires several days for plasmid DNA construction and one day for electroporation surgery. Plasmid DNA construction does not require a biohazard room that is usually essential for viral vector handling. In addition, one of the advantages of the electroporation method is the capacity for simultaneous expression of multiple gene products using a simple protocol. Our novel technique will be useful for analyzing the interaction of a variety of signaling molecules involved in myelination and demyelination. In particular, by permitting the cotransfection of a number of different intracellular fluorescent probes, our method should be a powerful tool for investigating intracellular signaling dynamics in SCs using live imaging experiments.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
This work was supported by grants from the Ministry of Education, Culture, Sports, Science and Technology to M.I. (21229004 and 25221304).
Materialien
| Name | Company | Catalog Number | Comments |
| Genopure Plasmid Maxi Kit | Roche | 03 143 422 001 | Plasmid DNA purification kit |
| Fast Green CFC | WAKO | 069-00032 | Dye for DNA injection |
| GC 150T-10 | HARVARD APPARATUS | 30-0062 | Glass capillary |
| Suction tubing | Drummond | 05-2000-00 | Suction tubing for micro injection |
| MODEL P-97 | SUTTER INSTRUMENT CO. | Micropipette puller | |
| CUY21 Single Cell | BEX | Electroporator CUY21 Single Cell | Pulse generator |
| Electric warmer | KODEN | CAH-6A | Warmer during the surgery |
| Isofluolane | Mylan | 1119701G1076 | Anesthetic |
Referenzen
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annu Rev Cell Dev Biol. 30, 503-533 (2014).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., Wang, H., Jaenisch, R. Generating genetically modified mice using CRISPR/Cas-mediated genome engineering. Nat Protoc. 9, 1956-1968 (2014).
- Cotter, L., et al. Dlg1-PTEN interaction regulates myelin thickness to prevent damaging peripheral nerve overmyelination. Science. 328, 1415-1418 (2010).
- Gonzalez, S., Fernando, R. N., Perrin-Tricaud, C., Tricaud, N. In vivo introduction of transgenes into mouse sciatic nerve cells in situ using viral vectors. Nat Protoc. 9, 1160-1169 (2014).
- Ozcelik, M., et al. Pals1 is a major regulator of the epithelial-like polarization and the extension of the myelin sheath in peripheral nerves. J Neurosci. 30, 4120-4131 (2010).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21, 583-593 (2008).
- Glatzel, M., et al. Adenoviral and adeno-associated viral transfer of genes to the peripheral nervous system. Proc Natl Acad Sci U S A. 97, 442-447 (2000).
- Homs, J., et al. Schwann cell targeting via intrasciatic injection of AAV8 as gene therapy strategy for peripheral nerve regeneration. Gene Ther. 18, 622-630 (2011).
- Aspalter, M., et al. Modification of Schwann cell gene expression by electroporation in vivo. J Neurosci Methods. 176, 96-103 (2009).
- Ino, D., et al. Neuronal Regulation of Schwann Cell Mitochondrial Ca(2+) Signaling during Myelination. Cell Rep. 12, 1951-1959 (2015).
- Struhl, K. Chapter 3; Subcloning of DNA fragments. Curr Protoc Mol Biol. , Unit3 16 (2001).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient selection for high-expression transfectants with a novel eukaryotic vector. Gene. 108, 193-199 (1991).
- Chang, K., Elledge, S. J., Hannon, G. J. Lessons from Nature: microRNA-based shRNA libraries. Nat Methods. 3, 707-714 (2006).
- Schlaepfer, W. W., Myers, F. K. Relationship of myelin internode elongation and growth in the rat sural nerve. J Comp Neurol. 147, 255-266 (1973).
- Webster, H. D. The geometry of peripheral myelin sheaths during their formation and growth in rat sciatic nerves. J Cell Biol. 48, 348-367 (1971).
- Weis, J., Fine, S. M., David, C., Savarirayan, S., Sanes, J. R. Integration site-dependent expression of a transgene reveals specialized features of cells associated with neuromuscular junctions. J Cell Biol. 113, 1385-1397 (1991).
- Zhao, Y., et al. An expanded palette of genetically encoded Ca(2)(+) indicators. Science. 333 (2), 1888-1891 (2011).
- Suzuki, J., et al. Imaging intraorganellar Ca2+ at subcellular resolution using CEPIA. Nat Commun. 5, 4153 (2014).
- Tabata, H., Nakajima, K. Labeling embryonic mouse central nervous system cells by in utero electroporation. Dev Growth Differ. 50, 507-511 (2008).
- Taveggia, C., Feltri, M. L., Wrabetz, L. Signals to promote myelin formation and repair. Nat Rev Neurol. 6, 276-287 (2010).
- Saijilafu, E. M., Hur, F. Q., Zhou, Genetic dissection of axon regeneration via in vivo electroporation of adult mouse sensory neurons. Nat Commun. 2, 543 (2011).
- Tanaka, Y., Hirokawa, N. Mouse models of Charcot-Marie-Tooth disease. Trends Genet. 18, S39-S44 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten