Method Article
أثار الإجهاد خلية والموت عن طريق التقليدية للأشعة فوق البنفسجية ليزر متحد البؤر المجهر
In This Article
Summary
Targeted manipulations to cause directed stress or death in individual cells have been relatively difficult to accomplish. Here, a single-cell-resolution ablation approach to selectively stress and kill individual cells in cell culture and living animals is described based on a standard confocal UV laser.
Abstract
Using a standard confocal setup, a UV ablation method can be utilized to selectively induce cellular injury and to visualize single-cell responses and cell-cell interactions in the CNS in real-time. Previously, studying these cell-specific responses after injury often required complicated setups or the transfer of cells or animals into different, non-physiological environments, confounding immediate and short-term analysis. For example, drug-mediated ablation approaches often lack the specificity that is required to study single-cell responses and immediate cell-cell interactions. Similarly, while high-power pulsed laser ablation approaches provide very good control and tissue penetration, they require specialized equipment that can complicate real-time visualization of cellular responses. The refined UV laser ablation approach described here allows researchers to stress or kill an individual cell in a dose- and time-dependent manner using a conventional confocal microscope equipped with a 405-nm laser. The method was applied to selectively ablate a single neuron within a dense network of surrounding cells in the zebrafish spinal cord. This approach revealed a dose-dependent response of the ablated neurons, causing the fragmentation of cellular bodies and anterograde degeneration along the axon within minutes to hours. This method allows researchers to study the fate of an individual dying cell and, importantly, the instant response of cells-such as microglia and astrocytes-surrounding the ablation site.
Introduction
وقد استخدم مضان المجهر منذ فترة طويلة لدراسة آثار الجينات المحورة في الجهاز العصبي المركزي الزرد، لا سيما آثارها على التنمية 1. وقد سمح عالية الدقة المجهر على خرائط تفصيلية لعمليات الخلوية العاملة في مجال التنمية في الدماغ، وتوليد العضلات، والعديد من الفعاليات التنموية الأخرى 2. كان يدرس وفاة خلية فردية أكثر تحديا، ويرجع ذلك أساسا إلى الصعوبات التقنية لاستحثاث موت الخلايا انتقائية خلال إجراءات التصوير القياسية. ومع ذلك، فإن الجمع بين وحيدة الخلية القرار التصوير والتقنيات الاجتثاث المستهدفة للغاية يسمح التحقيق في الاستجابات الخلوية فورية للإجهاد والإصابات، وكذلك التفاعلات خلية خلية يترتب على ذلك. فهم هذه العمليات أمر بالغ الأهمية، وخاصة للأمراض العصبية مثل مرض العصبون الحركي (الفرقة المتعددة الجنسيات)، التي يتبين فيها أن التفاعلات العصبية، الدبقية للمساهمة في تقدمالمرض 3.
القوات المتعددة الجنسيات، أو العضلية التصلب الجانبي (ALS)، هو مرض الاعصاب المدمر الذي يؤثر على الخلايا العصبية الحركية في الدماغ، القشرة الحركية، والحبل الشوكي. فقدان هذه الخلايا العصبية يؤدي إلى فقدان العضلات، والمرضى يموتون خلال 3-5 سنوات من التشخيص 4. الخلايا العصبية الحركية في النخاع الشوكي وصلة لألياف العضلات وتلعب دورا أساسيا في تسهيل تقلص العضلات. فشل هذه الاتصالات أو موت هذه الخلايا العصبية تضعف تدريجيا العضلات ويؤثر على قدرة المريض على ابتلاع، المشي، الكلام، والتنفس. تصور وفاة الخلايا العصبية الحركية والعواقب على المدى القصير في الحيوانات الحية يوفر فرصة ممتازة لفهم أفضل للعمليات الحيوية تشارك في التوازن الطبيعي للخلايا والمرض.
ظهرت الزرد كنظام نموذجا جذابا لدراسة أمراض الاعصاب 1. هذهويرجع ذلك إلى المزايا التي يوفرها هذا الكائن نموذج، مثل الإخصاب الخارجي، وقت التنموية قصيرة، والوصول البصري للجهاز العصبي، وسهولة transgenesis. وبالإضافة إلى ذلك، والقدرة على توليد بسهولة الزرد المعدلة وراثيا مركب تسمح لاستراتيجيات وضع العلامات متعددة من أنواع مختلفة من الخلايا. النهج الاجتثاث وراثي لقتل أنواع معينة من الخلايا تسمح اضطراب واسع نوعا ما، ولكنها تفتقر إلى مراقبة دقيقة من استهداف الخلايا الفردية 5. تقنيات بمساعدة الليزر، من ناحية أخرى، توفر السيطرة الزمانية والمكانية الجميلة واستخدمت لنماذج حيوانية مختلفة. في حين أن معظم نهج استخدام المعدات المتخصصة، مثل نابض الليزر 6، 7، 8، 9، 10، 11، 12 أو اثنين الفوتون مجموعة عمليات 13، وغيرهااتخذت المجموعات البحثية مؤخرا ميزة ليزر الأشعة فوق البنفسجية في المجاهر متحد البؤر التقليدية 14.
تقنية الموضحة هنا يجمع عالية الدقة متحد البؤر المجهري مع نهج بوساطة الليزر فوق البنفسجية أن تسبب الإجهاد الخلوي أو الوفاة بطريقة تعتمد على الجرعة في الخلايا العصبية الحركية المحدد. وهي تعتمد على استخدام تثبيت عادة ليزر 405 نانومتر، وقد اختبرت بنجاح في زراعة الخلايا والحيوانات الحية، ويسمح توصيف مفصل من التفاعلات الخلوية، مثل إزالة دبقية بعد وفاة الخلايا العصبية.
Protocol
ملاحظة: تصميم وسلوك، والإبلاغ عن التجارب على الحيوانات يجب أن تأخذ في الاعتبار المبادئ التوجيهية الحالية 15. يجب الموافقة على مثل هذا العمل في وقت مبكر عن طريق السلطة الرفق بالحيوان المحلية (في حالتنا، لجنة الأخلاقيات الحيوان من جامعة ماكواري).
1. إعداد الزرد لتركيب والأشعة فوق البنفسجية تذرية خلية
- توليد الزرد (دانيو rerio) معربا عن البروتينات الفلورية.
- للتعبير عن البروتينات الفلورية الفائدة في الزرد، نفذ حقن البلازميد إلى مرحلة خلية واحدة من البيض الزرد (كما هو موضح في أماكن أخرى 16) أو استخدام خطوط المعدلة وراثيا الفلورسنت. لتسمية أنواع خلايا متعددة، إنشاء خطوط الزرد المعدلة وراثيا المركبة عن طريق عبور خطوط المعدلة وراثيا أنشئت ذات الصلة إلى مسألة الفائدة. وضع رجل واحد وامرأة واحدة الزرد على كل جانب من زوج خزان التزاوج كاذبة أسفل في المساء وإزالة المفرق مع بداية ضوءفي صباح اليوم التالي (كما هو مفصل في أي مكان آخر 17). الحفاظ على الزرد في 28 درجة مئوية، والتعامل معها وفقا للبروتوكولات المعمول 17 و 18.
- جمع الأجنة بعد وضع البيض ناجحة عبر توتير خزان المياه التي تحتوي على أجنة من خلال مصفاة الشاي البلاستيكية. شطف البيض بالماء النظام ونقلها إلى المياه البيض في طبق بيتري.
- فحصها تحت المجهر الضوئي لتحديد الإخصاب. متجر تخصيب البيض في طبق بيتري ووضعها في حاضنة عند 28 ° C 18.
- اختياري: إجراء حقن مكروي لتسمية السكان خلية معينة.
ملاحظة: هذا هو أسلوب بديل يسمح للتعبير عن والتصور من البروتينات، دون الحاجة إلى رفع خطوط المعدلة وراثيا مستقرة. هذا الأسلوب هو أيضا مفيد عندما البروتين من الفائدة السامة ويحظر جيل من عبر مستقرةخطوط جينك.- حقن يبني البلازميد إلى مرحلة خلية واحدة من الأجنة الزرد، كما هو موضح في أماكن أخرى 19، 20، 21.
ملاحظة: النتائج هذا الأسلوب في التعبير فسيفساء من البروتين من الفائدة. هو الدافع وراء البروتين من الاهتمام من أحد المروجين من خيار (على سبيل المثال، islet1 22، -3mnx1 23، 24، التقى 25، أو MPEG1 26) يحيط بها Tol2 مقلوب يكرر 20.
- حقن يبني البلازميد إلى مرحلة خلية واحدة من الأجنة الزرد، كما هو موضح في أماكن أخرى 19، 20، 21.
- العمر الأسماك إلى الحجم المطلوب.
- رفع الأسماك إلى 3-5 أيام بعد الإخصاب (DPF) ووضعها تحت المجهر المركب الفلورسنت. فحص الحيوانات للتعبير fluorophore المناسب وتحديد السمك المسمى الزاهية. فصل اليرقات المناسبة في طبق آخر مع الماء البيض لتضمين في وقت متأخرr على (مخزن في 28 درجة مئوية الحاضنة).
يمكن أن توضع الأجنة إلى 0.2 ملي 1-فينيل-2-thioures حل (PTU) قارعو الأجراس في 24 ساعة بعد الإخصاب (HPF) لمنع تشكيل تصبغ: اختياري. يجب توخي الحذر مع PTU، كما هو سامة ويمكن أن يكون الفسيولوجية السلبية، وراثية، أو آثار شكلية. - للدراسات في مرحلة النمو المبكر (<2 DPF)، dechorionate الأجنة يدويا باستخدام الملقط حادة. Dechorionate أعداد كبيرة من الأجنة إنزيمي بإضافة pronase (2 ملغ / مل) إلى الماء البيض وتفرخ لهم لمدة 10 دقيقة عند 28 درجة مئوية.
- تمرير الأجنة بشكل دوري من خلال البلاستيك ماصة باستير لتخفيف dechorionation. إنهاء العملية عند الغالبية العظمى من الأجنة ظهرت من chorions عن طريق غسلها عدة مرات بالماء البيض.
- رفع الأسماك إلى 3-5 أيام بعد الإخصاب (DPF) ووضعها تحت المجهر المركب الفلورسنت. فحص الحيوانات للتعبير fluorophore المناسب وتحديد السمك المسمى الزاهية. فصل اليرقات المناسبة في طبق آخر مع الماء البيض لتضمين في وقت متأخرr على (مخزن في 28 درجة مئوية الحاضنة).
- إعداد الحلول لتضمين الزرد في الاغاروز.
- يعد حل التخدير عن طريق إضافة 4 جم / لتر MS222 (تريكين حل الأوراق المالية، ودرجة الحموضة 7.0)قطرة قطرة إلى طبق بتري تحتوي على الماء البيض. جرعة من 50 ملغ / لتر هي نقطة انطلاق موصى بها (الشكل 1A).
- إعداد تقييم الاغاروز ذوبان منخفضة (0،8-1،5٪) في الماء البيض وقسامة عليه في أنابيب microcentrifuge 1.5 مل. وضع قسامة في كتلة الحرارة قبل ساخنة (38-40 درجة مئوية) والسماح لها تتوازن إلى درجة الحرارة مجموعة (~ 30 دقيقة، الشكل 1B).
- اختياري: للتصوير على المدى الطويل (> 4 ساعات)، وإعداد دائرة الأغاروس ضئيلة داخل 35 ملم الزجاج السفلي طبق بتري والسماح لها مجموعة (الشكل التكميلي 1).
ملاحظة: هذه الخطوة الإضافية فعالة في تجنب أي حركة انخفاض الاغاروز كله مع الزرد خلال أطر زمنية أطول.- للقيام بذلك، مكان ~ 300 ميكرولتر من الاغاروز على الدائرة المقربة من طبق من الزجاج السفلي لإعداد دائرة على شكل دونات مع قليل من فتحة في الوسط، التي ترغب في وضع السمك (الخطوة 1.5.3. التكميلية الشكل 1) .
- جبل الزرد في الاغاروز للفحص المجهري.
- حدد 1-3 من الأسماك فرزهم عن الاجتثاث وتخدير اليرقات بنقلهم (باستخدام ماصة نقل) في طبق مع حل التخدير (الخطوة 1.4.1، الشكل 1C، حوالي 5 دقائق).
ملاحظة: الأسماك هي تخدير عندما تظهر حركة الوصادية الضحلة ومعدل ضربات القلب انخفض وأنه لم يعد عرض استجابة الهروب أثار اتصال (طير، وعدم السباحة بعيدا بعد بلطف لمس الذيل مع فرشاة). ضمان التخدير المناسب لعلاج الأخلاقية من الأسماك ومنع الوخز عند نقله إلى الاغاروز أو التعرض لضوء الفلورسنت. - بعد تأكيد التخدير، تمتص اليرقة باستخدام ماصة للتعديل (مع 200 ميكرولتر غيض قطع المقرر أن ~ 30 ميكرولتر) والسماح لها تنزل الى القاع من طرف. نقل اليرقة إلى الاغاروز مسخن (الخطوة 1.4.2) عن طريق الإفراج عن قطرة من السائل معاليرقة إلى الاغاروز (محاولة لتقليل كمية المياه البيض الخوض في الاغاروز، 1D الشكل).
- تمتص الأسماك محاطة الاغاروز. الاستغناء بسرعة في طبق 35 ملم زجاج القاع معدة مسبقا.
- استخدام المجهر تشريح وفرشاة الطلاء القياسية (بطانة طويلة، حجم 1) لوضع الحيوان داخل الاغاروز على الجانب (الرأس إلى اليسار) بحيث الجسم والذيل هي شقة (الشكل 1E). إذا كان يعمل مع الأسماك متعددة، محاذاة كل السمك في طبق بحيث تقع فيها بسهولة باستخدام المجهر متحد البؤر في وقت لاحق.
ملاحظة: بسرعة تنفيذ هذا الإجراء من المواقع والتوفيق (قد يتطلب بعض الممارسة، كما يبدأ الاغاروز لتعيين مباشرة بعد التعرض لدرجات الحرارة). - ترك الأسماك agarose جزءا لا يتجزأ عن 10-15 دقيقة حتى يتم تعيين الاغاروز بحزم. أعلى بعناية طبق بيتري 35 ملم مع ~ 2 مل من البيض المياه التي تحتوي على تريكين (الشكل 1F).
- حدد 1-3 من الأسماك فرزهم عن الاجتثاث وتخدير اليرقات بنقلهم (باستخدام ماصة نقل) في طبق مع حل التخدير (الخطوة 1.4.1، الشكل 1C، حوالي 5 دقائق).
2. إعداد مجهر متحد البؤر والتصوير معلمات
- وضع طبق بتري مع اليرقة جزءا لا يتجزأ من على المسرح المجهر مبائر والتركيز على الجانب الظهري للحبل الشوكي الحيوان (باستخدام مشرق الميدان). فحص الحيوان تحت التكبير المناسب (40X) ووضع الفلورسنت ووضع تصور لهيكل الفوائد (على سبيل المثال، وكثافة مضان من الخلايا العصبية المسماة أو حركة دبقية) للتأكد من أن جميع المعلمات التصوير هي حسب الحاجة لاستئصال لاحقة (الشكل 2). نحن نستخدم بشكل روتيني الهدف 40X لإجراء دراسات مرور الوقت لدينا.
- اختياري: لإجراء دراسة الوقت الفاصل بين لعدة ساعات، فإنه من المستحسن لتسجيل واحدة أو قبل بضعة وقت نقطة لالاجتثاث لتأسيس الاستجابة الفسيولوجية رابط الجأش من الخلية ومحيطها (على سبيل المثال، حركة دبقية لإنشاء السرعة الأساسية والحركة).
- تحديد سمك البنيةلدى عودتهم من الفائدة للالاجتثاث للأشعة فوق البنفسجية ليزر.
- باستخدام محرك ض، تحقق من أعلى وأسفل هيكل الفوائد (على سبيل المثال، سوما الخلية) من خلال التركيز يدويا صعودا وهبوطا. نلاحظ انخفاض ض الطائرة التي من شأنها أن يكون ذاب (على سبيل المثال، في مركز الخلية).
ملاحظة: من الخبرة، وكان هذا الأسلوب الأكثر فعالية من خلال استهداف الخلايا العصبية الحبل الشوكي التي وصفت الزاهية (ارتفاع نسبة الإشارة إلى الضوضاء التي تتيح سهولة التصور مرور الزمن بعد الاجتثاث، على سبيل المثال، الشكل 4) وablating منتصف سوما الخلية. نواة الخلية مضان يمكن أن يكون ميزة لضمان استهداف الصحيح وكفاءة الاجتثاث عالية.
- باستخدام محرك ض، تحقق من أعلى وأسفل هيكل الفوائد (على سبيل المثال، سوما الخلية) من خلال التركيز يدويا صعودا وهبوطا. نلاحظ انخفاض ض الطائرة التي من شأنها أن يكون ذاب (على سبيل المثال، في مركز الخلية).
3. تنفيذ المستهدفة ليزر تذرية من الخلايا الفردية في الحبل الشوكي الزرد
ملاحظة: للحصول على هذا النهج الاجتثاث والتصور، تم استخدام المجهر متحد البؤر (لايكا SP5). إجراءات الاجتثاث باستخدام الصمام الثنائي 405 نانومتر للدست خلية محددةهو مفصل خصام وفقا للبرنامج (لايكا تطبيق جناح، v2.7.3.9723). ومع ذلك، فإن أي المجهر متحد البؤر التقليدية التي هي مجهزة تجهيزا مع ليزر 405 نانومتر وFRAP (الانتعاش بعد مضان photobleaching من) أو وحدة التبييض تسمح للأداء التلاعب الخلية نفسها، ولكن يحتمل أن تكون مع إعدادات مختلفة قليلا، المعلمات، والأسماء.
- بدء تشغيل المعالج FRAP بالضغط على القائمة المنسدلة في أعلى القائمة البرمجيات (الشكل 3A، 1 و 2). مراقبة نافذة جديدة مع مختلف الخطوات التي تسمح للمجموعة تتكون من المعلمات محددة لالاستئصال بالليزر (الشكل 3B، 3).
- تحديد معالم صورة للنهج الاجتثاث عن طريق تحديد شكل وسرعة المسح الضوئي (الشكل 3B، 4)، والمتوسط (الشكل 3B، 5). شكل صورة 1024 س 1024 في سرعة المسح الضوئي 400 هرتز وخطكان معدله 4 الأكثر قابلة للتطبيق.
ملاحظة: هناك عادة لا حاجة لتغيير الكشف الطيفي (مثل المعلمات الإثارة أو الانبعاث)، كما تم تحديدها في اقتناء السابق.- إذا لم يكن قد تم اختيار ض الطائرة لالاجتثاث (كما هو موضح في الخطوة 2.4)، اضغط على زر "لايف" والتركيز من خلال العينة حتى هيكل الفلورسنت أو المطلوب ض الطائرة التي سوف يكون ذاب هو في تركيز.
- مرة واحدة يتم تعيين المعلمات الصورة العامة، والوصول إلى "بليتش" خطوة (الشكل 3C، 6) للسيطرة على مكونات الاجتثاث محددة.
ملاحظة: مزيج من كثافة الليزر (الشكل 3C، 8)، وسرعة المسح الضوئي، والمتوسط الذي تم تعيينه في خطوة 3.2 (الشكل 3B و 4 و 5)، فضلا عن عدد من حالات التكرار التي ستقام في خطوة 3.5 (الشكل 3E،12)، وتحديد مدة بقاء الكلي ليزر الأشعة فوق البنفسجية في العائد على الاستثمار، وبالتالي فإن كفاءة التبييض.- إشراك الليزر 405 نانومتر من خلال تفعيل ذلك لإجراء التبييض (الشكل 3C، 8).
وقد تحقق معظم النجاح مع الإعدادات المذكورة أعلاه مع شدة الليزر 405 نانومتر بين 60-80٪ في الإعداد التجريبية لدينا: ملاحظة. كن على علم بأن هذا الإخراج قوة الليزر هو أداة محددة، وسوف تختلف عن كل الإعداد متحد البؤر. - استخدام "تكبير" الخيار (الشكل 3C، 7) لتحقيق أقصى قدر من شدة تبيض في العائد على الاستثمار المختارة عن طريق الحد من مجال المسح الضوئي، وبالتالي تحقيق أقصى قدر من زمن السكون. بدلا من ذلك، استخدم خيار "نقطة بليتش" من البرنامج المفضل لهذه العملية.
- إشراك الليزر 405 نانومتر من خلال تفعيل ذلك لإجراء التبييض (الشكل 3C، 8).
- اختيار واحد أو متعددة رويس (الشكل 3D، 10) لالاجتثاث باستخدام أي من أدوات الرسم في مهب الريح الحصول على الصورآه (الشكل 3D، 9). استهداف أكمة المحور، على سبيل المثال، مع أداة رسم دائرية من حوالي 4-8 ميكرون.
ملاحظة: المنطقة الاجتثاث هو قابل للتعديل من بكسل واحد لمساحة أكبر، وهذا يتوقف على التطبيق. - بعد تأسيس العائد على الاستثمار، وحدد "دورة الزمن" زر (الشكل 3E، 11)، وتأكيد عدد من الدورات سيتم فحصها / ذاب (الشكل 3E و 12) ورويس. اختيار "ما قبل التبييض" وإطارات "ما بعد التبييض" كما هو مطلوب للسماح لمحة عامة عن الصورة كاملة قبل ومباشرة بعد عملية التبييض.
- بعد إنشاء كافة المعلمات الاجتثاث اللازمة، اضغط على "تشغيل تجربة" (الشكل 3E، 13) ومراقبة كفاءة الاجتثاث.
ملاحظة: في الإعداد FRAP لدينا، سيتم اتخاذ صورة واحدة قبل وبعد دورة FRAP مع البريد الليزر المناسبxcitation (على سبيل المثال، 488 نانومتر الإثارة للخلايا، معربا عن EGFP). هذه الصور ما قبل وما بعد الاجتثاث تسمح حكم سريع لكيفية مرض وتبييض عائدات الاستثمار ومدى فعالية المعلمات الاجتثاث الذي تم اختياره. - تكرار هذه العملية عن طريق ضبط كثافة الليزر (الشكل 3C، 8)، سرعة المسح الضوئي والمتوسط (الشكل 3B و 4 و 5)، والتكرار (الشكل 3E، 12) في حالة العائد على الاستثمار المختارة لا يزال يظهر كثافة مضان عالية بعد الانتهاء من دورة FRAP.
4. تنفيذ إجراء المتابعة، بما في ذلك الأسماك "الإنقاذ" أو التخلص
- إذا كانت التجربة هي المحطة، الموت ببطء الحيوانية مع جرعة زائدة من تريكين. إزالة الماء البيض واستبدالها حل سهم التخدير لمدة 10 دقيقة. لضمان القتل الرحيم، تحقق تحت المجهر لوقف ضربات القلب.
- اختياري:إذا كانت التجربة ليست محطة، وإزالة الأسماك بعناية من الاغاروز مع ملقط غرامة وفرشاة. ضع السمك في الماء البيض الطازج والسماح لها لاسترداد تحت الملاحظة لمدة 15 دقيقة. في حالة إرجاع سلوك السباحة العادي، وعودة الأسماك إلى الحاضنة.
- التخلص من الحيوانات المعدلة وراثيا وفقا لمجرى النفايات الكائنات المعدلة وراثيا المعتمد للمؤسسة.
النتائج
الطريقة الموصوفة هنا يسمح الاجتثاث من الخلايا العصبية الحركية في النخاع الشوكي الزرد باستخدام وحدة FRAP المجهر متحد البؤر التجاري. خطوط الزرد المعدلة وراثيا التي تعبر عن بروتين الفلورية الخضراء في الخلايا العصبية تحت سيطرة المروجين محددة، مثل - 3mnx1، islet1، أو الوفاء بها، واستخدمت. التعبير عن GFP مدفوعا المروج الخلايا العصبية الحركية (مثل -3mnx1 أو الحد) يسمح عالية الدقة التصور من أجسام الخلايا والمحاور الرئيسية، والفروع الطرفية يمتد إلى العضلات (الشكل 4 و فيديو 1).
وقد ذاب الخلايا العصبية في النخاع الشوكي من الأسماك القديمة لمدة 5 أيام-3- بنجاح، مع زمن السكون الشامل 60-80 الصورة في قوة الليزر ~ 70٪ والإعدادات العامة هو موضح في الخطوة 3. الاجتثاث الناجح يتحقق عندما يتلاشى مضان مباشرة بعد الاستئصالولم يستأنف (الشكل 5 و C و D). لم محاولات الاجتثاث مع خطوط الليزر الأخرى (مثل خط ليزر 488 نانومتر) لا يؤدي إلى زوال دائم، وأعيد مضان ضمن أطر زمنية قصيرة. الأهم من ذلك، أثبتت هذه التقنية السمات المميزة لموت الخلايا أفكارك في الخلايا العصبية ذاب الأشعة فوق البنفسجية، مثل وجود Annexin الخامس، والتغيرات المورفولوجية ثابتة من انحطاط somal، وblebbing محور عصبي من الخلايا العصبية ذاب 27.
ويؤكد خصوصية هذا النهج في التجارب باستخدام fluorophore photoconvertible Kaede الذي (أي مفاتيح الانبعاثات من الأخضر إلى الأحمر بعد التعرض لضوء الأشعة فوق البنفسجية)، حيث تم تحويل الخلايا العصبية المستهدفة واحدة (الشكل 5، A و B) بدون علامات الخلوية تدمير أكثر من عدة ساعات. استخدام قوة الليزر أعلى بدلا يؤدي رس انقراض الخلايا العصبية المستهدفة (أي photoconversion أو ظهور مضان) وphotoconversion (دون الموت) من الخلايا على مقربة (~ 20 ميكرون) إلى الموقع الاجتثاث (الشكل 5 و C و D).
واحدة ميزة هامة من هذه التقنية الاجتثاث التي يسببها الليزر هي التبعية جرعة من هذا النهج. لاستهداف الخلايا مع كثافات مختلفة، هي طبقات متعددة من صقل المتاحة عن طريق ضبط قوة الليزر (الشكل 3C، 8)، وسرعة المسح الضوئي والمتوسط خط (الشكل 3B و 4 و 5)، وحجم العائد على الاستثمار ليكون ذاب (الشكل 3D، 10)، والتكرار (الشكل 3E، 12). والجدير بالذكر أن هذا النهج يمكن أيضا أن تستخدم لتطبيق إجهاد الخلوي لخلايا فردية بدلا من استحثاث موت الخلايا. على سبيل المثال، كانت صقلقيمة للغاية لتقييم العمليات الخلوية أثناء وفاة الخلايا العصبية. كشفت الخلايا العصبية الحركية مع التوقعات محور عصبي الطويلة التي كانت ذاب مع شدة الليزر أقل للأشعة فوق البنفسجية مميزة "blebbing" (تكوين وتفتيت الحويصلات الخلوية)، التي بدأت في سوما المستهدفة، واستمر على طول محور عصبي مع مرور الوقت (40-90 دقيقة، الشكل (4) ، قدمت فيلم 3D من هذا الاجتثاث في فيديو 1). ونتيجة لذلك، تحوير مختلفة المعلمات الاستئصال بالليزر، وبالتالي فإن مستوى الإجهاد الخلوية التي يسببها وبالطبع وقت الوفاة يسمح للباحثين على مستوى عال من المرونة التجريبية.
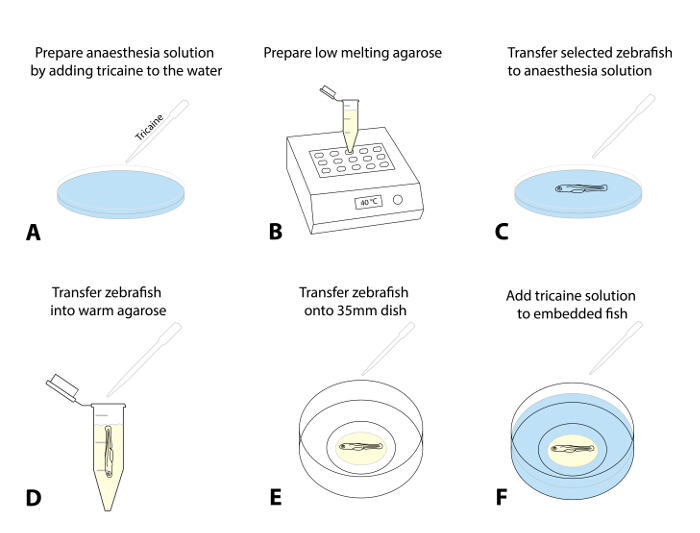
الشكل 1: التضمين من الزرد للتصوير الحية. (AF) تضمين إجراءات التصوير الحي: يضاف (A) تريكين إلى الماء البيض لتخدير الزرد ل تا معدل جرعة البداية من 50 ملغم / لتر. (ب) انخفاض ذوبان الاغاروز (0،8-1،5٪) من إعداد وارتفعت درجة حرارة تصل إلى 38-40 درجة مئوية. (C) باستخدام ماصة نقل، يتم نقل الزرد فحص والمحددة في طبق مع حل تريكين. بعد التخدير الناجح (حركة الوصادية الضحلة، وانخفاض معدل ضربات القلب، عدم وجود استجابة أثار اللمس)، يتم نقل الأسماك إلى الاغاروز مسخن (D). تقليل كمية المياه البيض التي يتم نقلها إلى الاغاروز لمنع تمييع لاحق. (E) نقل قطرة الاغاروز (~ 30 - 50 ميكرولتر) يحتوي على الزرد على طبق من الزجاج السفلي 35 ملم. أداء هذا تحت المجهر تشريح واستخدام فرشاة لمحاذاة بلطف الزرد إلى التوجه المفضل. انتظر 10-15 دقيقة، حتى يتم تعيين الاغاروز، وإضافة ~ 2 مل من محلول تريكين إلى الطبق (F). عنخ "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
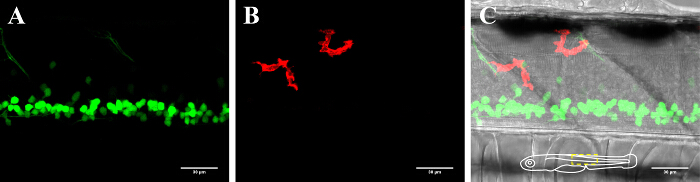
الشكل 2: تصور الخلايا العصبية والخلايا الدبقية الصغيرة في الحبل الشوكي من الزرد 3-DPF. التصور من الخلايا الدبقية الصغيرة والخلايا العصبية في النخاع الشوكي من الزرد المعدلة وراثيا من العمر لمدة 3 أيام، معربا عن (أ) الخلايا العصبية GFP إيجابية (islet1: GFP) و (ب) mCherry إيجابية الخلايا الدبقية الصغيرة (MPEG1: GAL4، UAS: mCherry). (C) صورة مركبة للقناة الخلايا العصبية والخلايا الدبقية الصغيرة جنبا إلى جنب مع صورة مشرق الميدان. إدراج التخطيطي في (C) يصور التوجه من الأسماك ويحدد منطقة المقدمة. شريط النطاق = 30 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
رقيقة الصفحات = "1"> 
الشكل (3): خطوات في عملية الاستئصال بالليزر والأشعة فوق البنفسجية (كما هو موضح في البروتوكول، الخطوة 3). خطوات للسيطرة على وحدة البرامج FRAP في البرنامج متحد البؤر (لايكا تطبيق جناح). (أ) بدء تشغيل وحدة FRAP كأداة لأداء الاستئصال بالليزر والأشعة فوق البنفسجية. (ب) إعداد ض الطائرة لالاجتثاث وغيرها من FRAP إعدادات مثل الشكل، والسرعة، والمتوسط، والتي ستحدد مدة انتظار الليزر. (ج) السيطرة على كثافة الليزر و "تكبير" الخيار لتحقيق أقصى قدر من الكفاءة التبييض. (D) اختيار واحدة أو عدة مناطق الفائدة (ROI) من شأنها أن يكون ذاب. (E) تحديد مسار وقت تبيض يحدد دورات التبييض وزمن السكون ليزر العام في رويس. الرجاء الضغط عليها البريد لعرض نسخة أكبر من هذا الرقم.
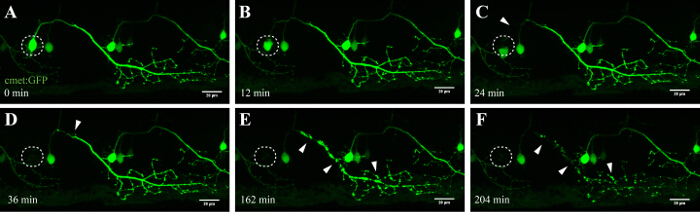
الشكل 4: انحطاط تقدمي من الخلايا العصبية-ذاب الأشعة فوق البنفسجية. الوقت الفاصل بين التصوير من التنكس العصبي من الخلايا العصبية في العمود الفقري-ذاب الأشعة فوق البنفسجية. (AF) الأشعة فوق البنفسجية إشعاع من الخلايا العصبية واحدة في العمود الفقري (تتحقق: GAL4، UAS: EGFP؛ A؛ دائرة) أدى إلى سوما من الخلايا العصبية تقلص والتقريب مع مرور الوقت (AC)، تليها تجزئة المحاور (CF، السهام) . بدأ انحطاط المحاور في سوما (موقع الاجتثاث) وتقدم تقدمي نحو النهاية البعيدة من محور عصبي حتى النهاية، اختفى مضان في سوما وأظهر محور عصبي كامل "blebbing" (DF). الحانات النطاق = 20 ميكرون. ويظهر الفيلم الوقت الفاصل-المقدمة 3D من هذا الاجتثاث في فيديو 1.وفاق / ftp_upload / 54983 / 54983fig4large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
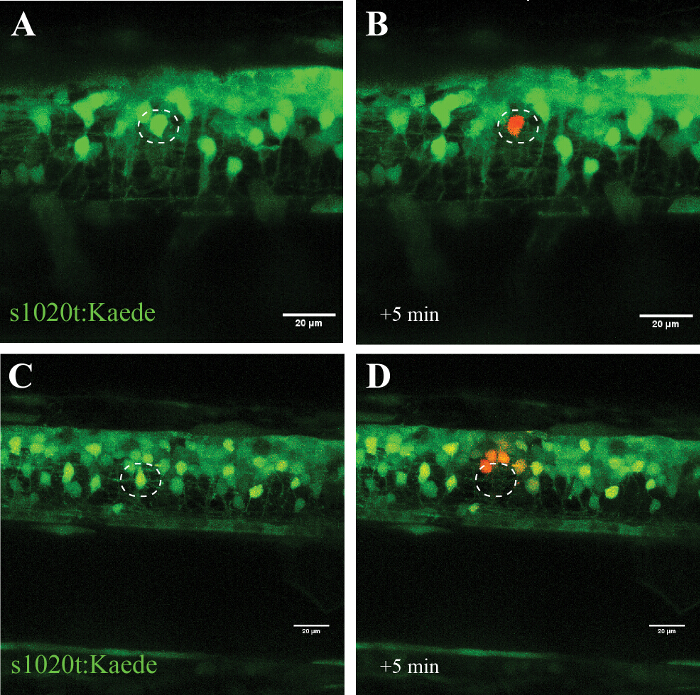
الرقم 5: التأكيد على تأثير وحيدة الخلية للاشعة فوق البنفسجية باستخدام fluorophore photoconvertible (Kaede الذي) في الخلايا العصبية الحركية. التحقق من وحيدة الخلية للاشعة فوق البنفسجية من خلال تفعيل fluorophore Kaede الذي photoconvertible في الخلايا العصبية. (م) الأشعة فوق البنفسجية من الخلايا العصبية المسماة مع Kaede الذي. الصمام (أ) Photoconversion من الخلايا العصبية واحدة (دائرة) مع قوة الليزر من 30٪ لمدة 10 ق لphotoconversion من Kaede الذي (من الأخضر إلى الأحمر) إلا في الخلايا العصبية الفردية المستهدفة (B). لاحظ أن الخلية تحويلها نجا لعدة ساعات ولم تظهر أي علامات مرئية من التدهور، مثل blebbing أو التقريب. الاجتثاث من الخلايا العصبية واحدة (C . أدت دائرة) مع قوة الليزر أعلى (95٪ لمدة 10 ق) في اختفاء المباشر للالخلايا العصبية (D) وphotoconversion لاحق من Kaede الذي في عدد صغير من الخلايا العصبية المحيطة بها داخل دائرة نصف قطرها حوالي 20 ميكرون. الحانات النطاق = 20 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
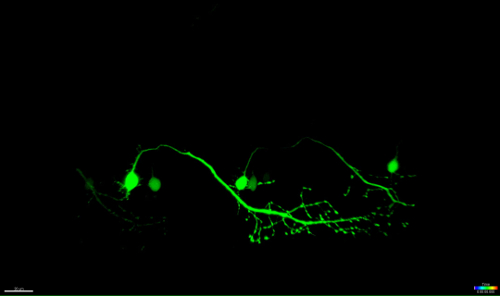
الفيديو 1: جعل سطح 3D (Imaris) من الخلايا العصبية للأشعة فوق البنفسجية ذاب هو موضح في الشكل (4).
الفيديو في الوقت الفاصل بين الخلايا العصبية هو مبين في الشكل (4) هو سطح تقديمها باستخدام برنامج التصور (Imaris، Bitplane). ويسلط الضوء على عملية تقلص سوما ذاب، تليها تجزئة المحاور anterogradely في نهاية البعيدة للخلية.euron_ablation-3D_rendered.mov "الهدف =" _ فارغة "> اضغط هنا لتحميل هذا الملف.
الشكل التكميلي 1: اختياري يلقي الاغاروز للتصوير منذ فترة طويلة.
لتجنب حركة الأسماك والاغاروز خلال الاستحواذ على المدى الطويل تحضير دونات دائرة شكل من الاغاروز على طول الحواف في منتصف الطبق 35 ملم الزجاج السفلي (A). السماح للمجموعة الاغاروز ل~ 10 دقيقة ونقل الأسماك إلى الدائرة الداخلية مع انخفاض الاغاروز (B). محاولة لتقليل كمية من الاغاروز لتضمين (فرشاة الاغاروز الزائد إلى الخارج بعد ويوجه الأسماك). الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
النهج ليزر تذرية
تقنيات الاجتثاث بمساعدة الليزر تسمح استهداف دقيق للمجموعات فردية أو صغيرة من الخلايا. الجمع بين هذه التقنية مع عالية الدقة المجهر والتلاعب الجيني في النماذج الحيوانية مثل الزرد يسمح للباحثين لدراسة منهجية مصير خلية فردية والتفاعلات بعد تعافيه من الاصابة.
الأشعة فوق البنفسجية (405 نانومتر) بروتوكول الاستئصال بالليزر الموصوفة هنا يوضح كيف الخلايا الفردية يمكن التشديد أو قتل انتقائي (بطريقة تعتمد على الجرعة)، في حين المجاورة الخلايا العصبية، الدبقية، وتترك محاور عصبية دون أن يصاب بأذى. لقد استخدمت بنجاح هذا النهج في تجارب زراعة الخلايا وهنا وصف نهج مفصل عن الحبل الشوكي الزرد. نقدم لك مجموعة من تنفيذ هذا النهج في الحبل الشوكي الزرد بالتشديد بشكل انتقائي على الخلايا العصبية الفردية ضمن شبكة من الخلايا الأخرى (الشكل 5، A و B)، أو عن طريق قتل الخلايا العصبية واحدة على الفور ودون الانتعاش (الشكل 5 و C و D).
سابقا، نظم الليزر المتخصصة، مثل ليزر نابض النيتروجين أو أنظمة ليزر ثنائي الفوتون كان مطلوبا، للحث على تلف الأنسجة وtransections 10، 11، 12، 13 العصب المحرك. وقد تم استخدام أنظمة ليزر هذه بنجاح أن تسبب تلف الخلايا، مثل الجلطة في الشرايين والأوردة 6، قصور كلوي حاد 7، وإصابة القلب 8، ودراسة موجات الكالسيوم والاستجابة دبقية بعد إصابات الدماغ 9. وعلاوة على ذلك، تستخدم Soustelle وزملاؤه الإعداد متحد البؤر التقليدية (351 نانومتر و 364 نانومتر ليزر الأشعة فوق البنفسجية) للحث على الأضرار التي لحقت الظهارية وخلايا الدبقية في ذبابة الفاكهة 14 </ سوب>.
أهمية نماذج الزرد لفهم ALS (والأمراض البشرية الأخرى)
الزرد هي نموذج المستخدمة على نطاق واسع الحي، وخاصة بالنسبة للدراسات التنموية 28، 29، 30. بينما لديهم بعض القيود، قدرتها على نموذج الأمراض التي تصيب البشر وإعطاء فهم الآليات الجزيئية المسببة للأمراض هائلة. تم راسخة نماذج الزرد لدراسة الفرقة المتعددة الجنسيات وأدت إلى رؤى الجزيئية المهمة 31، 32، 33، 34. خطوط الزرد المعدلة وراثيا يمكن أن تتولد بسرعة (4-5 أشهر)، والسماح للتتبع انتقائي من نوع خلية معينة، الميزات التي تجعلها إضافة قيمة إلى النماذج الحيوانية الحالية من المرض. الأجنة الزرد / اليرقات شفافة بصريا وتقدم من experi فريدة من نوعهاالمزايا العقلية التي تسمح الحية التصوير على المدى الطويل على مستوى وحيدة الخلية في الدماغ أو الحبل الشوكي، والتي لا يمكن أن يتحقق بسهولة في نماذج القوارض (أو في البشر). عندما جنبا إلى جنب مع التقنيات الجزيئية، مثل الاجتثاث وحيدة الخلية، وهذا يوفر منصة تجريبية فريدة لدراسة الآليات الجزيئية الدقيقة في الجسم الحي.
الخلايا العصبية الحركية يمكن انتقائي المستهدفة عن طريق الأشعة فوق البنفسجية ليزر تذرية
الخلايا العصبية في العمود الفقري في الزرد تبدأ في تطوير في غضون 10 ساعة بعد الولادة، وأنشأت بعد حوالي 48 ساعة 35 و 36. يسمح هذا التطور السريع التصور من هذه الخلايا العصبية في فترات زمنية قصيرة ومع إنتاجية عالية. توفر الخلايا العصبية الحركية على الرابط الأساسي بين الدماغ والعضلات و، في ALS، تتأثر في القشرة الحركية (الخلايا العصبية الحركية العليا)، والدماغ، والحبل الشوكي (أقل الخلايا العصبية الحركية). فقدان هذه الخلايا العصبية يؤدي حتما إلى موضمور scle والضعف. الخلايا العصبية الحركية في النخاع الشوكي من الزرد يمكن تحديد توقعاتهم متميزة وعن استخدام المروجين محددة الحركية العصبية مثل -3MNX1. استهداف سوما خلية من هذه الخلايا العصبية إسقاط كشفت انحطاط تقدمي على إسقاط محور عصبي مع مرور الوقت (الشكل 4 و فيديو 1). وحيدة الخلية القرار التصوير من الخلايا العصبية الحركية في العمود الفقري وأكدت بالإضافة إلى ذلك النبات فسفاتيديل ويترتب على ذلك Annexin V وضع العلامات بعد الاستئصال بالليزر (انظر الشكل 4 و فيديو التكميلية 3 في مرجع 27). على الرغم من أننا تقريرا تفعيل Annexin الخامس في الموت الخلايا العصبية بعد نهجنا الاجتثاث للأشعة فوق البنفسجية ليزر، ونحن لا نستطيع أن نجزم بأن تتالي الموت التي يتم تشغيلها أثناء هذه العملية المتسارعة يطابق تماما وفاة الخلايا العصبية الذي يحدث أثناء التنكس العصبي أو التوازن الطبيعي للخلايا.
في حين أن هذا النهج الاجتثاث هو تكرار للغايةو، استراتيجيات محددة التضمين مختلفة قد تؤثر أيضا على كفاءة الاجتثاث للأشعة فوق البنفسجية. في تجربتنا، وكان الأكثر نجاحا للحد من طبقة من الاغاروز نحن جزءا لا يتجزأ من الأسماك لدينا في. طبقات سمكا من تضمين المتوسطة مع طبقة إضافية من المياه البيض قد يقلل من قوة الأشعة فوق البنفسجية الواردة في نهاية المطاف من قبل الخلية بسبب التوهين وتناثر الآثار التي تحدث على طول مسار الشعاع.
في المستقبل، سوف عبور خطوط مختلفة الأسماك المعدلة وراثيا يسمح للتصور على المدى القصير فورا و(تصل إلى 12 ساعة) استجابات الخلايا المتضررة الأخرى، مثل الدبقية، إلى تدمير الخلايا التي يسببها الليزر. على سبيل المثال، كانت نجمية وغير الخلية سمية مستقلة في الاضطرابات العصبية مثل اعتلال الأعصاب الحركية في دائرة الضوء البحوث وتورط بشكل كبير في تسببها متفرقة والعائلية ALS 37 و 38. ومع ذلك، فإن الآليات الكامنة سمية الدبقية والانتقائيةنحو المحرك تبقى الخلايا العصبية واضحة. نحن وغيرنا جرت مؤخرا ميزة هذا النهج لدراسة ابتلاع الموت الخلايا العصبية بواسطة الخلايا الدبقية الصغيرة وتصور لإزالة مخلفات العصبية 27، 39، 40.
والجمع بين تقنية الاجتثاث مع عالية الدقة المجهر وعلامات لneuroinflammation تسمح للباحثين في المستقبل لتوسيع فهم وظيفة وحيدة الخلية ونظم خلايا مترابطة. توصيف هذه العمليات في الإعداد في الجسم الحي أمر بالغ الأهمية ليس فقط في إعدادات التنموية ولكن أيضا في نماذج من الأمراض العصبية، بما في ذلك القوات المتعددة الجنسيات، حيث قد تنخفض قيمته التفاعلات الخلوية 3، 41.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
This work was supported by the MND Research Institute of Australia and the Cure for MND Foundation [GIA 1638], the Snow Foundation, and Macquarie University [MQRDG 9201401462]. Imaging was carried out at the Microscopy Facility in the Department of Biomedical Sciences, Macquarie University. Other members of the MND research center are thanked for their contributions to the development of these methods and fish lines.
Materials
| Name | Company | Catalog Number | Comments |
| Agarose low melting | Fisher-Scientific | Dissolve in egg water with tricaine (0.02%) at 0.8 - 1.5% | |
| Tricaine | Argent Labs | MS-222 | 0.02% |
| Harvard standard wall Borosilicate with filament Capillary Glass | World Precision Instruments, Inc. | GC100F-10 (short) GC100F-15 (long) | Pull to a resistance of 2 - 7 MΩ |
| Egg water | 0.6 g Instant Ocean sea salt, 4 mL of 1 mg/mL methylene blue in 10 L deionized water | ||
| 1-phenyl-2-thiourea (PTU) | Sigma | P7629 | |
| Pronase | Sigma | 10165921001 | |
| Heat block | Select BioProducts | Digital block heater (SBD110_) | |
| Microinjection apparatus | World Precision Instruments, Inc. | Microinjection was performed by hand under a steromicroscope (Leica) with a loaded glass needle and a Picospritzer II (General Valve corporation) | |
| Stereoscope | Leica | Bright field illumination microscopy was performed on a Leica M165FC stereo dissection microscope (Leica) | |
| Microscope | Leica | SP5 | |
| 35 mm glass bottom dish | MatTek Corporation | P35G-0-20-C |
References
- Becker, T. S., Rinkwitz, S. Zebrafish as a genomics model for human neurological and polygenic disorders. Dev Neurobiol. 72 (3), 415-428 (2012).
- Wilt, B. A., et al. Advances in light microscopy for neuroscience. Annu Rev Neurosci. 32, 435-506 (2009).
- Philips, T., Robberecht, W. Neuroinflammation in amyotrophic lateral sclerosis: role of glial activation in motor neuron disease. Lancet Neurol. 10 (3), 253-263 (2011).
- Robberecht, W., Philips, T. The changing scene of amyotrophic lateral sclerosis. Nat Rev Neurosci. 14 (4), 248-264 (2013).
- White, D. T., Mumm, J. S. The nitroreductase system of inducible targeted ablation facilitates cell-specific regenerative studies in zebrafish. Methods. 62 (3), 232-240 (2013).
- Jagadeeswaran, P., Paris, R., Rao, P. Laser-induced thrombosis in zebrafish larvae: a novel genetic screening method for thrombosis. Methods Mol Med. 129, 187-195 (2006).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. (54), e2845(2011).
- Matrone, G., et al. Laser-targeted ablation of the zebrafish embryonic ventricle: a novel model of cardiac injury and repair. Int J Cardiol. 168 (4), 3913-3919 (2013).
- Sieger, D., Moritz, C., Ziegenhals, T., Prykhozhij, S., Peri, F. Long-range Ca2+ waves transmit brain-damage signals to microglia. Dev Cell. 22 (6), 1138-1148 (2012).
- Lewis, G. M., Kucenas, S. Motor nerve transection and time-lapse imaging of glial cell behaviors in live zebrafish. J Vis Exp. (76), (2013).
- Rosenberg, A. F., Wolman, M. A., Franzini-Armstrong, C., Granato, M. In vivo nerve-macrophage interactions following peripheral nerve injury. J Neurosci. 32 (11), 3898-3909 (2012).
- Villegas, R., et al. Dynamics of degeneration and regeneration in developing zebrafish peripheral axons reveals a requirement for extrinsic cell types. Neural Dev. 7, 19(2012).
- O'Brien, G. S., et al. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J Vis Exp. (24), (2009).
- Soustelle, L., Aigouy, B., Asensio, M. L., Giangrande, A. UV laser mediated cell selective destruction by confocal microscopy. Neural Dev. 3, 11(2008).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 8 (6), 1000412(2010).
- Essentials of Biology 2. JoVE. , JoVE Science Education Database. Mouse, Zebrafish, and Chick. Zebrafish Microinjection Techniques (2016).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. J Vis Exp. (69), e4196(2012).
- Westerfield, M. The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio).Vol.4th ed. , Univ. of Oregon Press. Eugene. (2000).
- Clark, K. J., Urban, M. D., Skuster, K. J., Ekker, S. C. Transgenic zebrafish using transposable elements. Methods Cell Biol. 104, 137-149 (2011).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Dev Dyn. 236 (11), 3088-3099 (2007).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), (2009).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. J Neurosci. 20 (1), 206-218 (2000).
- Arkhipova, V., et al. Characterization and regulation of the hb9/mnx1 beta-cell progenitor specific enhancer in zebrafish. Dev Biol. 365 (1), 290-302 (2012).
- Flanagan-Steet, H., Fox, M. A., Meyer, D., Sanes, J. R. Neuromuscular synapses can form in vivo by incorporation of initially aneural postsynaptic specializations. Development. 132 (20), 4471-4481 (2005).
- Hall, T. E., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin alpha2-deficient congenital muscular dystrophy. Proc Natl Acad Sci U S A. 104 (17), 7092-7097 (2007).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), 49-56 (2011).
- Morsch, M., et al. In vivo characterization of microglial engulfment of dying neurons in the zebrafish spinal cord. Front. Cell. Neurosci. , (2015).
- Grunwald, D. J., Eisen, J. S. Headwaters of the zebrafish -- emergence of a new model vertebrate. Nat Rev Genet. 3 (9), 717-724 (2002).
- Lele, Z., Krone, P. H. The zebrafish as a model system in developmental, toxicological and transgenic research. Biotechnol Adv. 14 (1), 57-72 (1996).
- Veldman, M. B., Lin, S. Zebrafish as a developmental model organism for pediatric research. Pediatr Res. 64 (5), 470-476 (2008).
- Kabashi, E., et al. Gain and loss of function of ALS-related mutations of TARDBP (TDP-43) cause motor deficits in vivo. Hum Mol Genet. 19 (4), 671-683 (2010).
- Laird, A. S., et al. Progranulin is neurotrophic in vivo and protects against a mutant TDP-43 induced axonopathy. PLoS One. 5 (10), 13368(2010).
- Lemmens, R., et al. Overexpression of mutant superoxide dismutase 1 causes a motor axonopathy in the zebrafish. Hum Mol Genet. 16 (19), 2359-2365 (2007).
- Ramesh, T., et al. A genetic model of amyotrophic lateral sclerosis in zebrafish displays phenotypic hallmarks of motoneuron disease. Dis Model Mech. 3 (9-10), 652-662 (2010).
- Hanneman, E., Trevarrow, B., Metcalfe, W. K., Kimmel, C. B., Westerfield, M. Segmental pattern of development of the hindbrain and spinal cord of the zebrafish embryo. Development. 103 (1), 49-58 (1988).
- Lewis, K. E., Eisen, J. S. From cells to circuits: development of the zebrafish spinal cord. Prog Neurobiol. 69 (6), 419-449 (2003).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. J Cell Biol. 187 (6), 761-772 (2009).
- Philips, T., Rothstein, J. D. Glial cells in amyotrophic lateral sclerosis. Exp Neurol. 262, Pt B 111-120 (2014).
- Mazaheri, F., et al. Distinct roles for BAI1 and TIM-4 in the engulfment of dying neurons by microglia. Nat Commun. 5, 4046(2014).
- van Ham, T. J., Kokel, D., Peterson, R. T. Apoptotic cells are cleared by directional migration and elmo1- dependent macrophage engulfment. Curr Biol. 22 (9), 830-836 (2012).
- Radford, R. A., et al. The established and emerging roles of astrocytes and microglia in amyotrophic lateral sclerosis and frontotemporal dementia. Front Cell Neurosci. 9, 414(2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved