Method Article
Das Auslösen Zellstress und Tod unter Verwendung von herkömmlichen UV-Laser konfokale Mikroskopie
In diesem Artikel
Zusammenfassung
Targeted manipulations to cause directed stress or death in individual cells have been relatively difficult to accomplish. Here, a single-cell-resolution ablation approach to selectively stress and kill individual cells in cell culture and living animals is described based on a standard confocal UV laser.
Zusammenfassung
Using a standard confocal setup, a UV ablation method can be utilized to selectively induce cellular injury and to visualize single-cell responses and cell-cell interactions in the CNS in real-time. Previously, studying these cell-specific responses after injury often required complicated setups or the transfer of cells or animals into different, non-physiological environments, confounding immediate and short-term analysis. For example, drug-mediated ablation approaches often lack the specificity that is required to study single-cell responses and immediate cell-cell interactions. Similarly, while high-power pulsed laser ablation approaches provide very good control and tissue penetration, they require specialized equipment that can complicate real-time visualization of cellular responses. The refined UV laser ablation approach described here allows researchers to stress or kill an individual cell in a dose- and time-dependent manner using a conventional confocal microscope equipped with a 405-nm laser. The method was applied to selectively ablate a single neuron within a dense network of surrounding cells in the zebrafish spinal cord. This approach revealed a dose-dependent response of the ablated neurons, causing the fragmentation of cellular bodies and anterograde degeneration along the axon within minutes to hours. This method allows researchers to study the fate of an individual dying cell and, importantly, the instant response of cells-such as microglia and astrocytes-surrounding the ablation site.
Einleitung
Die Fluoreszenzmikroskopie ist seit langem verwendet worden , um die Auswirkungen von Transgenen in der Zebrabärbling ZNS zu untersuchen, insbesondere deren Auswirkungen auf die Entwicklung ein. Hochauflösende Mikroskopie hat eine detaillierte Abbildung der zellulären Prozessen beteiligt in der Entwicklung des Gehirns, Muskel Generation erlaubt, und viele andere Entwicklungsereignisse 2. Das Studium der Tod einer einzelnen Zelle war eine größere Herausforderung, vor allem aufgrund der technischen Schwierigkeiten bei der Induktion selektiven Zelltod während der Standard-Bildgebungsverfahren. Allerdings erlaubt die Kombination von Single-Cell-auflösende Bildgebung und sehr gezielte Ablation Techniken, um die Untersuchung der unmittelbaren zellulären Reaktionen auf Stress und Verletzungen sowie der daraus resultierenden Zell-Zell-Interaktionen. diese Prozesse zu verstehen, ist kritisch, insbesondere für neurodegenerative Erkrankungen wie Motoneuronerkrankung (MND), wobei Neuron-Glia-Wechselwirkung gezeigt wurden dem Fortschreiten beizutragender Erkrankung 3.
MND oder amyotropher Lateralsklerose (ALS) ist eine verheerende neurodegenerative Erkrankung, die motorischen Neuronen in Hirnstamm, motorischen Cortex und Rückenmark betrifft. Der Verlust dieser Neuronen führt zu Muskelabbau, und die Patienten sterben innerhalb von 3 - 5 Jahre nach der Diagnose 4. Motorneuronen im Rückenmark Link zu den Muskelfasern und spielen eine wesentliche Rolle bei der Muskelkontraktion zu erleichtern. Der Ausfall dieser Mitteilung oder den Tod dieser Neurone schwächt sich allmählich die Muskeln und wirkt sich auf die Fähigkeit des Patienten zu schlucken, gehen, sprechen und atmen. den Tod eines motorischen Neurons Visualizing und die kurzfristigen Folgen in einem lebenden Tier bietet eine hervorragende Gelegenheit, die dynamischen Prozesse in normalen Zelle Homöostase und Krankheit beteiligt besser zu verstehen.
Zebrabärblinge haben als attraktives Modellsystem entstanden zu neurodegenerativen Erkrankungen 1 studieren. Diesist auf die von diesem Modellorganismus, wie externe Befruchtung, kurze Entwicklungszeit, optischen Zugang auf das Nervensystem und die einfache Transgenität angebotenen Vorteile. Darüber hinaus ermöglicht die Fähigkeit, leicht zu erzeugen Verbindung transgene Zebrafisch für mehrere Markierungsstrategien verschiedener Zelltypen. Genetische Ablation nähert sich spezifische Zelltypen erlauben ziemlich breite Störung zu töten, aber es fehlt die Feinsteuerung von Targeting einzelnen Zellen 5. Lasergestützte Techniken, andererseits bieten feine zeitliche und räumliche Steuerung und haben für verschiedene Tiermodelle verwendet. Während die meisten Ansätze verwenden spezielle Ausrüstung, wie beispielsweise gepulste Laser 6, 7, 8, 9, 10, 11, 12 oder Zweiphotonen Aufbauten 13, sonstigeForschungsgruppen haben vor kurzem die Vorteile eines UV - Lasers in herkömmlichen konfokalen Mikroskopen 14 entnommen.
Die hier beschriebene Technik kombiniert hochauflösende konfokale Mikroskopie mit einem UV-Laser-vermittelten Ansatz zellulären Stress und Tod in einer dosisabhängigen Weise in ausgewählten motorischen Neuronen verursachen. Es beruht auf der Verwendung der üblicherweise 405-nm-Laser installiert ist, erfolgreich in Zellkultur getestet und in lebenden Tieren und ermöglicht die detaillierte Charakterisierung von zellulären Wechselwirkungen, wie Mikroglia-Clearance nach neuronalen Tod.
Protokoll
HINWEIS: Planung, Durchführung und Berichterstattung von Tierversuchen muss 15 unter Berücksichtigung der aktuellen Leitlinien nehmen. Solche Arbeiten müssen von der lokalen Tierschutzbehörde (in unserem Fall der Tierethikkommission der Macquarie University) im Voraus genehmigt werden.
1. Bereiten Sie die Zebrabärblinge für Montage und UV Zellablation
- Generieren Zebrabärbling (Danio rerio) exprimieren , fluoreszierende Proteine.
- Fluoreszierende Proteine von Interesse in Zebrabärbling zum Ausdruck bringen, Plasmid - Injektionen in die ein Zellstadium des Zebrabärbling Ei (wie an anderer Stelle 16 beschrieben) , oder verwenden fluoreszierende transgenen Linien durchzuführen. Um mehrere Zelltypen erstellen Verbindung transgenen Zebrabärbling Linien durch Kreuzung etablierten transgenen Linien relevant für die Frage von Interesse beschriften. Legen Sie eine männliche und eine weibliche Zebrabärbling auf jeder Seite eines falschen Boden Paar Paarung Tank am Abend und entfernen Sie den Teiler mit dem Beginn der LichtAm nächsten Morgen (wie an anderer Stelle 17 beschrieben). Halten Sie den Zebrabärbling bei 28 ° C und behandeln sie entsprechend den etablierten Protokollen 17, 18.
- Sammeln Sie die Embryonen nach einer erfolgreichen Laich durch das Tankwasser belasten die Embryonen durch eine Kunststoff-Teesieb enthält. Spülen Sie die Eier mit System Wasser und übertragen sie in Ei Wasser in einer Petrischale.
- Untersuchen sie unter einem Lichtmikroskop Befruchtung zu bestimmen. Shop befruchteten Eier in einer Petrischale und legen Sie sie in einem Inkubator bei 28 ° C 18.
- Optional: Führen Sie eine Mikroinjektions spezifische Zellpopulationen zu beschriften.
ANMERKUNG: Dies ist eine alternative Methode, die für die Expression und Visualisierung von Proteinen ermöglicht, ohne die Notwendigkeit, stabile transgene Linien zu erhöhen. Dieses Verfahren ist auch vorteilhaft, wenn das interessierende Protein toxisch ist und verhindert die Erzeugung eines stabilen transgene Linien.- Injizieren Sie die Plasmid - Konstrukte in die ein Zellstadium der Genaktivität, wie an anderer Stelle beschrieben 19, 20, 21.
Hinweis: Dieses Verfahren führt in dem Mosaik Expression des Proteins von Interesse. Das Protein von Interesse aus einem Promotor der Wahl angetrieben wird (zB islet1 22, -3mnx1 23, 24, traf 25 oder MPEG1 26) , flankiert von Tol2 invertierten Wiederholungen 20.
- Injizieren Sie die Plasmid - Konstrukte in die ein Zellstadium der Genaktivität, wie an anderer Stelle beschrieben 19, 20, 21.
- Alter Die Fische auf die gewünschte Größe.
- Heben Sie den Fisch auf 3 - 5 Tage nach der Befruchtung (dpf) und legen Sie sie unter einem Fluoreszenz-Mikroskop Verbindung. Bildschirm, um die Tiere für geeignete Fluorophore Ausdruck und wählen Sie den hell markierten Fisch. Trennen Sie die entsprechende Larven in ein anderes Gericht mit Ei Wasser zum Einbetten spätr auf (Speicher in einem 28 ° C Inkubator).
Optional: Embryos in eine 0,2 mM 1-phenyl-2-thioures (PTU) Ringers-Lösung bei 24 h nach der Befruchtung (hpf) platziert werden, um die Bildung von Pigmentierung zu hemmen. Sorgfalt muss mit PTU genommen werden, da es toxisch ist und nachteilige physiologische haben kann, genetischen oder morphologische Effekte. - Für Studien in einem frühen Entwicklungsstadium (<2 dpf), dechorionate die Embryonen manuell scharf Pinzette. Dechorionate große Anzahl von Embryonen enzymatisch durch Zugabe von Pronase (2 mg / ml) zu dem Ei Wasser und Inkubieren sie für 10 min bei 28 ° C.
- Führen Sie die Embryonen in regelmäßigen Abständen durch eine Kunststoff-Pasteurpipette zu erleichtern dechorionation. Beenden Sie den Prozess, wenn die Mehrheit der Embryonen aus ihrem Chorion entstanden sind, indem sie mehrmals mit Ei Wasser waschen.
- Heben Sie den Fisch auf 3 - 5 Tage nach der Befruchtung (dpf) und legen Sie sie unter einem Fluoreszenz-Mikroskop Verbindung. Bildschirm, um die Tiere für geeignete Fluorophore Ausdruck und wählen Sie den hell markierten Fisch. Trennen Sie die entsprechende Larven in ein anderes Gericht mit Ei Wasser zum Einbetten spätr auf (Speicher in einem 28 ° C Inkubator).
- Bereiten Sie Lösungen für Zebrabärbling Einbettung in Agarose.
- Bereiten Sie eine Anästhesie-Lösung durch Zugabe von 4 g / L MS222 (Tricaine Stammlösung, pH 7,0)tropfenweise zu einer Petrischale Ei Wasser enthält. Eine Dosis von 50 mg / L ist ein empfohlenes Ausgangspunkt (1A).
- Bereiten Sie einen Vorrat von niedrig schmelzenden Agarose (0,8-1,5%) in Ei Wasser und Aliquotierung es in 1,5 ml-Mikrozentrifugenröhrchen. Einen aliquoten in einen vorgeheizten Wärmeblock (38 - 40 ° C) und lassen Sie es auf die eingestellte Temperatur ins Gleichgewicht (~ 30 min; 1B).
- Optional: Für längerfristige Bildgebung (> 4 h), ein wenig Agarose - Kreis innerhalb der Glasbodenschale Petri 35-mm vorbereiten und lassen Sie es (Supplementary Abbildung 1) zu setzen.
HINWEIS: Dieser zusätzliche Schritt bei der Vermeidung einer Bewegung des gesamten Agarose-Tropfen mit dem Zebrabärbling über einen längeren Zeitrahmen wirksam war.- Dazu Ort ~ 300 & mgr; l Agarose entlang dem inneren Kreis der Glasbodenschale einen Donut-förmigen Kreis mit einer kleinen Öffnung in der Mitte herzustellen , in denen die Fische zu setzen (Schritt 1.5.3; Ergänzende Abbildung 1) .
- Montieren Sie den Zebrabärbling in Agarose für die Mikroskopie.
- Wählen Sie 1 - 3 von der vorselektierten Fisch für die Ablation und betäuben die Larven von ihnen zu übertragen (unter Verwendung einer Transferpipette) in eine Schale mit der Anästhesie - Lösung (Schritt 1.4.1; 1C; ca. 5 min).
HINWEIS: Die Fische werden betäubt, wenn sie eine flache opercularen Bewegung und eine verminderte Herzfrequenz und nicht mehr eine Fluchtreaktion Touch-evozierte Anzeige (TEER; Versagen zu schwimmen weg nach sanft berühren ihren Schwanz mit einem Pinsel). Stellen Sie sicher, geeignete Anästhesie für die ethische Behandlung der Fische und zu verhindern Zucken bei der Übertragung in Agarose oder durch Einwirkung von Fluoreszenzlicht. - Nach der Anästhesie bestätigt wird, saugen eine Larve mit einer einstellbaren Pipette (mit einem cut-off von 200 ul Spitze auf ~ 30 & mgr; l) und lassen Sie es an der Unterseite der Spitze sinken. Übertragen die Larve in vorgeheizte Agarose (Schritt 1.4.2), indem ein Tropfen der Flüssigkeit mit der freisetzLarve in die Agarose (versuchen , die Menge von Ei Wasser geht in die Agarose zu minimieren; 1D).
- Saugen die durch Agarose umgeben Fisch. Dispense es schnell in die zuvor hergestellten Glasboden 35-mm-Schale.
- Verwenden Sie ein Präpariermikroskop und eine Standard - Pinsel (lange Liner, Größe 1) , um das Tier in der Agarose auf der Seite zu positionieren (Kopf nach links) , so dass Körper und Schwanz sind flach (Abbildung 1E). Wenn mit mehreren Fisch arbeiten, richten alle Fische in der Schale so, daß sie das konfokale Mikroskop später leicht entfernt werden.
HINWEIS: Schnell dieses Verfahren zum Positionieren und Ausrichten durchführen (es kann einige Übung erfordern, wie die Agarose sofort zu kälteren Temperaturen nach der Belichtung beginnt zu setzen). - Lassen Sie die Agarose eingebettete Fisch 10 - 15 min, bis die Agarose fest eingestellt ist. Nachfüllen vorsichtig die 35-mm - Petrischale mit ~ 2 ml Ei Wasser enthält Tricaine (1F).
- Wählen Sie 1 - 3 von der vorselektierten Fisch für die Ablation und betäuben die Larven von ihnen zu übertragen (unter Verwendung einer Transferpipette) in eine Schale mit der Anästhesie - Lösung (Schritt 1.4.1; 1C; ca. 5 min).
2. dem konfokalen Mikroskop und Bildgebungsparameter einrichten
- Legen Sie die Petrischale mit dem eingebetteten Larve auf dem konfokalen Mikroskop Bühne und konzentrieren sich auf die Rückenseite des Tieres Rückenmark (Hellfeld). Untersuchen Sie das Tier unter der entsprechenden Vergrößerung (40X) und fluoreszierende Einstellung und visualisieren die Struktur von Interesse (zB Fluoreszenzintensität der markierten Neuronen oder Mikroglia - Bewegung) , um zu bestätigen , dass alle Bildparameter wie für die nachfolgende Ablation benötigt wird (Abbildung 2). Wir verwenden routinemäßig die 40X Ziel unserer Zeitrafferstudien durchzuführen.
- Optional: Um eine Zeitraffer-Studie für mehrere Stunden durchzuführen, ist es ratsam , eine einzelne oder wenige Zeitpunkten vor der Aufzeichnung der ungestörte physiologische Reaktion der Zelle und ihrer Umgebung (zB Mikroglia - Bewegung zu etablieren Basisgeschwindigkeit zu etablieren Ablation und Motilität).
- Bestimmen Sie die Dicke der Strukturure von Interesse für die UV-Laserablation.
- Mit dem Z-Antrieb, überprüfen Sie die oben und unten an der Struktur von Interesse (zB die Zellsoma) durch manuelles Fokussieren auf und ab. Notieren Sie die z-Ebene , die ( zum Beispiel das Zentrum der Zelle) abgetragen wird.
HINWEIS: Aus Erfahrung war diese Methode am effektivsten durch Rückenmarksneuronen Targeting , die hell markiert wurden (ein hohes Signal-Rausch - Verhältnis , das einfach Zeitraffer Visualisierung nach der Ablation ermöglicht, zB Abbildung 4) und durch die Mitte des Abtragungs Zellsoma. Zellkern-Fluoreszenz kann von Vorteil sein, um die korrekte Ausrichtung und hohe Abtragseffizienz gewährleisten.
- Mit dem Z-Antrieb, überprüfen Sie die oben und unten an der Struktur von Interesse (zB die Zellsoma) durch manuelles Fokussieren auf und ab. Notieren Sie die z-Ebene , die ( zum Beispiel das Zentrum der Zelle) abgetragen wird.
Führen 3. Gezielte Laser Ablation einzelner Zellen im Zebrabärbling Spinal Cord
HINWEIS: Für diese Ablation und Visualisierung Ansatz, ein konfokales Mikroskop (Leica SP5) verwendet wurde. Die Ablationsverfahren unter Verwendung eines 405-nm-Diode für die zellspezifische destruction wird detailliert nach der Software (Leica Application Suite, v2.7.3.9723). jedes herkömmliche konfokale Mikroskop jedoch, die mit einem 405-nm-Laser und einer FRAP (Frap) oder Bleich-Modul ermöglicht es, die Leistung der gleichen Zelle Manipulationen, aber möglicherweise mit leicht unterschiedlichen Einstellungen, Parameter und Bezeichnungen versehen.
- Starten Sie den FRAP - Assistenten , indem der Software - Menü oben auf das Dropdown - Menü klicken (3A, 1 und 2). Beachten Sie ein neues Fenster mit verschiedenen Schritten, die den Aufbau der spezifischen Parameter für die Laser - Ablation ermöglicht (3B, 3).
- Bestimmen , die Bildparameter für die Ablation Ansatz durch Auswahl des Formats, Abtastgeschwindigkeit (3B, 4), und Mitteln (3B, 5). Ein Bildformat von 1024 x 1024 bei einer Abtastgeschwindigkeit von 400 Hz und einer Liniedurchschnittlich 4 war am besten anwendbar.
HINWEIS: Es ist in der Regel nicht erforderlich, um die spektrale Detektion (wie die Anregungs- oder Emissionsparameter) zu ändern, wie sie in den vorherigen Erwerb bestimmt wurden.- Wenn die z-Ebene für die Ablation nicht bereits ausgewählt wurde (wie in Schritt 2.4 beschrieben.), Drücken Sie die "Live" und konzentrieren sich durch die Probe, bis die Leuchtstoffstruktur oder die z-Ebene gewünscht, das abgetragen werden soll ist im Fokus.
- Sobald die allgemeine Bildparameter eingestellt sind, greifen Sie auf die "Bleach" Schritt (3C, 6) die spezifischen Ablation Komponenten zu steuern.
HINWEIS: Eine Kombination der Laserintensität (3C, 8), der Abtastgeschwindigkeit und der Mittelung , die in Schritt 3.2 (3B, 4 und 5) sowie die Anzahl der Wiederholungen festgelegt wurde , die in festgelegt werden Schritt 3.5 (3E,12), wird die gesamte Verweilzeit der UV - Laser an der ROI, bestimmen und somit die Bleicheffizienz.- Aktivieren Sie die 405-nm - Laser , indem sie es für die Bleichverfahren (3C, 8) zu aktivieren.
HINWEIS: - 80% in unserem Versuchsaufbau Die meisten Erfolg mit den oben genannten Einstellungen wurde zwischen 60 mit 405-nm-Laserintensitäten erreicht. Beachten Sie, dass diese Laserausgangsleistung ist gerätespezifisch und wird für jeden konfokalen Aufbau unterscheiden. - Verwenden Sie die "Zoom in" Option (3C, 7) , um die Bleichintensität bei der gewählten ROI zu maximieren , indem das Scanfeld reduziert, daher Verweilzeit zu maximieren. Alternativ können Sie die "Bleach Punkt" Option der Software der Wahl für diesen Prozess.
- Aktivieren Sie die 405-nm - Laser , indem sie es für die Bleichverfahren (3C, 8) zu aktivieren.
- Wählen Sie eine oder mehrere ROIs (3D, 10) für die Ablation durch eine der Ziehwerkzeuge in der Bildaufnahme unter Verwendung Window (3D, 9). Ziel der Axonhügel, zum Beispiel mit dem Kreiszeichenwerkzeug von ca. 4 - 8 um.
HINWEIS: Die Ablationsbereich von einem einzelnen Pixel zu einer größeren Fläche, je nach Anwendung einstellbar ist. - Nach den ROI Gründung, wählen Sie die "Time Course" Taste (Abbildung 3E, 11) und die Anzahl der Zyklen der ROIs gescannt / abgetragenen (Abbildung 3E, 12) bestätigen wird. Wählen Sie den "Pre-Bleach" und "Post-Bleach" Rahmen nach Wunsch einen Überblick über das gesamte Bild zu ermöglichen, unmittelbar vor und unmittelbar nach dem Bleichprozess.
- Nachdem alle notwendigen Ablationsparameter Festlegung, drücken Sie "Run Experiment" (Abbildung 3E, 13) und die Effizienz der Ablation zu überwachen.
HINWEIS: In unserem FRAP-Setup, ein einzelnes Bild wird mit dem entsprechenden Laser e vor und nach dem FRAP Zyklus genommen werdenxcitation (beispielsweise 488-nm - Anregung für EGFP-exprimierenden Zellen). Diese Pre- und Post-Ablation Bilder ermöglichen eine schnelle Beurteilung, wie zufriedenstellend war der ROI gebleicht und wie effektiv die gewählten Ablationsparameter waren. - Wiederholen des Prozesses durch Einstellen der Laserintensität (3C, 8), Abtastgeschwindigkeit und Mittelung (3B, 4 und 5), und Wiederholungen (3E, 12) , falls der ausgewählte ROI zeigt noch eine hohe Fluoreszenzintensität nach Beendigung der FRAP-Zyklus.
Führen 4. Follow-up-Verfahren, einschließlich Fisch "Rescue" oder Entsorgung
- Wenn das Experiment Terminal ist, euthanize das Tier mit einer Überdosis Tricaine. Entfernen Sie das Ei Wasser und ersetzen Sie es mit der Anästhesie-Stammlösung für 10 min. Um sicherzustellen, Euthanasie, überprüfen Sie unter dem Mikroskop für die Einstellung des Herzschlags.
- Optional:Wenn das Experiment nicht Terminal ist, entfernen Sie den Fisch vorsichtig aus der Agarose mit einer feinen Pinzette und einer Bürste. Den Fisch in frisches Ei Wasser und lassen Sie es 15 Minuten lang unter Beobachtung zu erholen. Wenn normale Schwimmverhalten zurückkehrt, kehren die Fische in den Inkubator.
- Entsorgen transgene Tiere nach den anerkannten GVO-Abfallstrom Institution.
Ergebnisse
Das hier beschriebene Verfahren erlaubt die Ablation von motorischen Neuronen im Rückenmark Zebrabärbling die FRAP-Modul eines handelsüblichen konfokalen Mikroskop. Transgene Zebrafisch Linien , die ein grün fluoreszierendes Protein , das in Neuronen unter der Kontrolle von bestimmten Promotoren, wie auszudrücken - 3mnx1, islet1 oder erfüllt, wurden verwendet. Die Expression von GFP angetrieben durch den Motor Neuron - Promotor (wie -3mnx1 oder met) ermöglicht hochauflösenden Darstellung der Zellkörper, der Haupt Axonen und den peripheren Zweige zu den Muskeln erstrecken (Figur 4 und Video 1).
Neurone im Rückenmark von 3- bis 5-Tage alten Fisch wurden erfolgreich abgetragenen, mit einer Gesamt Verweilzeit von 60 bis 80 s bei einer Laserleistung von ~ 70% und die allgemeinen in Schritt beschriebenen Einstellungen 3. Erfolgreiche Ablation erzielt, wenn die Fluoreszenz sofort nach der Ablation verblaßtund nie wieder aufnimmt (Figur 5, C und D). Versuche zur Ablation mit anderen Laserlinien (wie zum Beispiel die 488-nm-Laserlinie) führte zu keiner permanenten Fading und Fluoreszenz wurde in kurzen Zeitrahmen wiederhergestellt. Wichtig ist , zeigte dieses Verfahren kennzeichnenden Merkmale des apoptotischen Zelltods in den UV-ablatiert Neuronen, wie beispielsweise die Anwesenheit von Annexin V, konsistente morphologische Veränderungen von somal Degeneration und axonalen blebbing des abgetragenen Neuron 27.
Die Besonderheit dieses Ansatzes wird in den Experimenten bestätigt Kaede die Photokonvertierbare Fluorophore mit (das schaltet seine Emission von grün auf rot nach der Einwirkung von UV - Licht), wo eine einzelne gezielte Neuron (Abbildung 5, A und B) ohne Anzeichen einer zellulären umgewandelt wurde Zerstörung über mehrere Stunden. Verwendung einer höheren Laserleistung stattdessen führt to Extinktion des Zielneurons (ohne Photo oder Wiederauftreten von Fluoreszenz) und Photokonversion (ohne Tod) der Zellen in der Nähe (~ 20 & mgr; m) an die Ablationsstelle (Abbildung 5, C und D).
Ein wichtiger Vorteil dieses laserinduzierten Ablation Technik ist die Dosisabhängigkeit des Ansatzes. In den Zellen , die mit unterschiedlichen Intensitäten, mehrere Schichten von Feinabstimmung Ziel zur Verfügung , indem die Laserleistung eingestellt (3C, 8), der Abtastgeschwindigkeit und Zeilenmittelung (3B, 4 und 5), die Größe des ROI zu ablatierenden (3D, 10), und die Wiederholungen (3E, 12). Bemerkenswert ist, kann dieser Ansatz auch anstelle induzieren Zelltod zu einzelnen Zellen genutzt werden zellulären Stress anzuwenden. Zum Beispiel hat die Feinabstimmung gewesensehr wertvoll während des Todes eines Neurons zellulärer Prozesse zu bewerten. Motor - Neuronen mit langen Axonen Projektionen , die mit niedrigeren UV - Laserintensitäten ablatiert wurden ergab characteristic "blebbing" ( um die Bildung und die Fragmentierung von zellulärer Vesikel), die an der Ziel soma begonnen und fortgesetzt entlang des Axons im Laufe der Zeit (40-90 min; 4 , 3D - gerenderten Film dieser Ablation in Video 1). Folglich werden die verschiedenen Laserablation Parameter zu modulieren und damit die Höhe der induzierten zellulären Stress und den zeitlichen Verlauf des Todes ermöglicht ein hohes Maß an Flexibilität experimentelle Forscher.
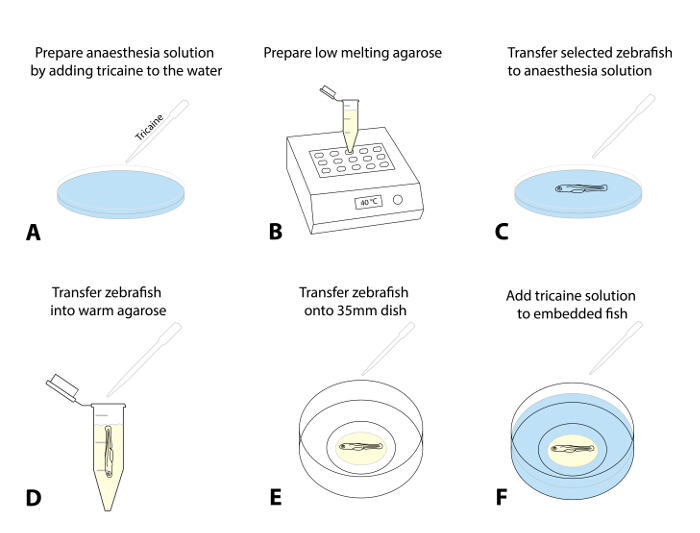
Abbildung 1: Einbettung von Zebrabärbling für die Live - Darstellung. (AF) Embedding Verfahren zur Echtzeit- Bildgebung: (A) Tricaine wird Ei Wasser hinzugefügt , um den Zebrabärbling ein zu betäuben ta Anfangsdosisrate von 50 mg / L. (B) Niedrig schmelzenden Agarose (0,8-1,5%) hergestellt und erwärmt auf 38 bis - 40 ° C. (C) Mit Hilfe einer Transferpipette, die überprüft und ausgewählt Zebrabärbling werden in eine Schale mit Tricaine Lösung übertragen. Nach erfolgreicher Sedierung (flache opercularen Bewegung, verminderte Herzfrequenz, das Fehlen eines berührungs evozierten Reaktion), ein Fisch in die vorgewärmte Agarose übertragen wird (D). Minimieren Sie die Menge von Ei-Wasser, das in die Agarose übertragen wird anschließender Verdünnung zu verhindern. (E) Bringen Sie einen Tropfen Agarose (~ 30 - 50 & mgr; l) mit dem Zebrabärbling auf einem Glasboden - 35-mm - Schale. Führen Sie diese unter einem Präpariermikroskop und mit einem Pinsel vorsichtig auf die Zebrabärbling auf ihre bevorzugten Orientierung auszurichten. Warten Sie 10 bis 15 Minuten, bis die Agarose eingestellt ist, und fügen Sie ~ 2 ml Tricaine Lösung in die Schale (F).ank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
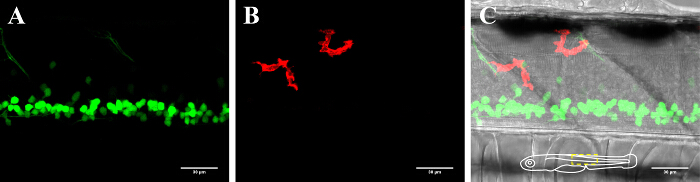
Abbildung 2: Darstellung von Neuronen und Mikroglia im Rückenmark eines 3-dpf Zebrabärbling. Visualisierung von Mikroglia und Neuronen im Rückenmark eines 3 Tage alten transgenen Zebrafisch exprimieren (A) GFP-positive Neurone (islet1: GFP) und (B) mCherry-positive Mikroglia (MPEG1: GAL4, UAS: mCherry). (C) Composite - Bild des Neurons und Mikroglia - Kanal zusammen mit dem Hellfeldbild. Die schematische Einlage in (C) zeigt die Orientierung des Fisch und umreißt den Bereich präsentiert. Maßstabsbalken = 30 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Figur 3: Die Schritte in dem Verfahren der UV - Laser - Ablation (wie in dem Protokoll ausgeführt, Schritt 3). Schritte, das FRAP Softwaremodul in der konfokalen Software (Leica Application Suite) zu steuern. (A) Starten des FRAP - Modul als Werkzeug UV - Laser - Ablation durchzuführen. (B) , um die z-Ebene für die Ablation und andere FRAP Einstellungen wie Format, Geschwindigkeit Einrichten und Mittelung, die die Verweilzeit des Lasers wird bestimmen. (C) Die Steuerung der Laserintensität und der "Zoom in" Option Bleicheffizienz zu maximieren. (D) Auswahl einer oder mehreren Regionen von Interesse (ROI) , das abgetragen werden soll. (E) Einstellen der Zeitverlauf der Bleiche bestimmt die Bleichzyklen und die Gesamtlaser Verweilzeit bei den ROIs. Bitte klicken sie e eine größere Version dieser Figur zu sehen.
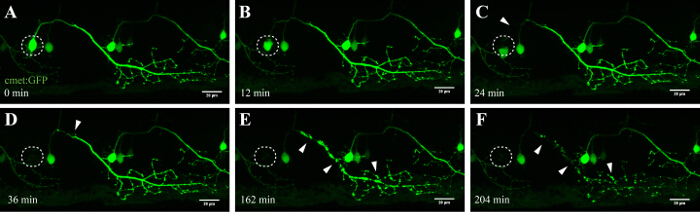
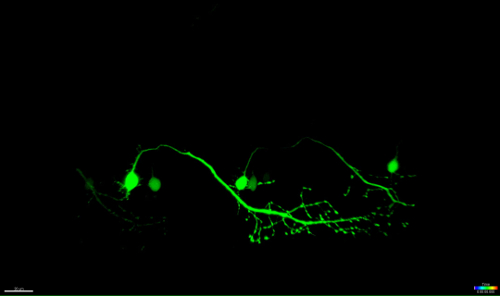
Abbildung 4: Anterograde Degeneration einer UV-ablatiert Neurons. Zeitraffer-Bildgebung des Neurodegeneration eines UV-abgetragenen spinalen Neuron. (AF) UV-Bestrahlung eines einzelnen spinalen Neuronen (met: GAL4 UAS: EGFP; A; circle) führte im Soma des Neurons Schrumpfen und Aufrunden der Zeit (AC), gefolgt von axonalen Fragmentierung (CF; Pfeilspitzen) . Die axonale Degeneration begann im Soma (Ort der Ablation) und fortgeschritten anterograde Richtung des distalen Endes des Axons , bis schließlich die Fluoreszenz im Soma verschwunden und die gesamte axon zeigte "blebbing" (DF). Maßstabsbalken = 20 um. Die 3D-gerenderten Zeitraffer-Film dieser Ablation wird in Video 1 gezeigt.es / ftp_upload / 54983 / 54983fig4large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
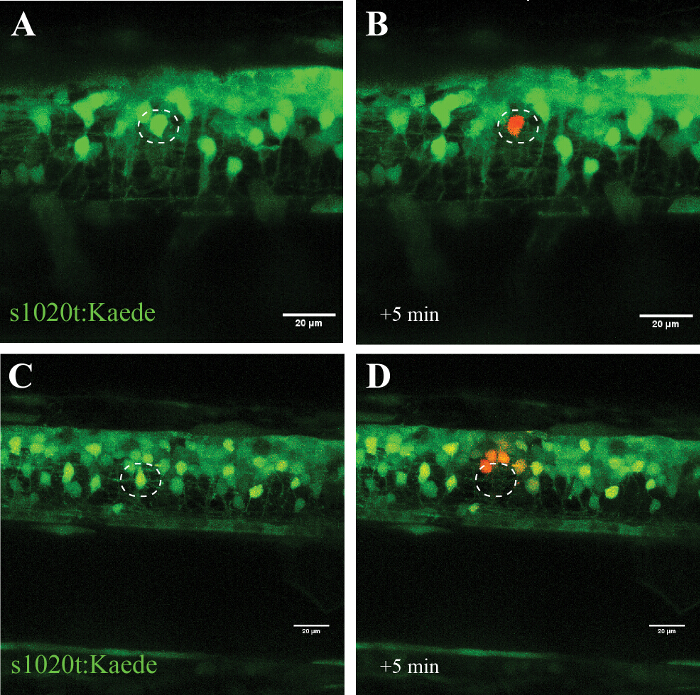
Abbildung 5: Bestätigung der Wirkung der Einzelzellen - UV - Bestrahlung eine Photokonvertierbare Fluorophor (Kaede) in einem Motor Neuron verwendet. Validierung der Einzelzellen-UV-Bestrahlung durch die Aktivierung des Photokonvertierbare Fluorophor Kaede in einem Neuron. (AD) UV - Bestrahlung von Neuronen mit Kaede markiert. (A) Photokonversion eines einzelnen Neurons (Kreis) mit einer Laserleistung von 30% für 10 s führte zu fotovoltaischen von Kaede (von grün bis rot) in nur die gezielte individuelle Neuron (B). Beachten Sie, dass das umgewandelte Zelle für mehrere Stunden überlebte und zeigte keine sichtbaren Anzeichen für eine Verschlechterung, wie blebbing oder Aufrundung. Ablation eines einzelnen Neurons (C ; Kreis) mit einer höheren Laserleistung (95% für 10 s) resultierte in unmittelbaren Verschwinden des Neurons (D) und nachfolgender Photokonversion von Kaede in einer kleinen Anzahl von umgebenden Neuronen innerhalb eines Radius von ungefähr 20 um. Maßstabsbalken = 20 um. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Video 1: 3D - Oberflächendarstellung (Imaris) des UV - abgetragenen Neuron in 4 dargestellt ist .
Die Zeitraffer-Video des Neurons in 4 dargestellt ist Oberfläche eine Visualisierungs-Software gerendert (Imaris, Bitplane). Sie weist auf den Schrumpfungsprozess des abgetragenen soma, gefolgt von axonalen Fragmentierungs anterograd zum distalen Ende der Zelle.euron_ablation-3D_rendered.mov "target =" _ blank "> Bitte hier klicken, um diese Datei herunterzuladen.
Ergänzende Abbildung 1: Optional Agarose Guss für die Langzeit - Bildgebung.
Um zu vermeiden, Bewegung des Fisches und der Agarose während einer Langzeiterfassung vorbereiten ein Donut geformt Kreis von Agarose entlang der Kanten in der Mitte des Glasboden-35-mm-Schale (A). Lassen Sie die Agarose-Set für ~ 10 min und übertragen Fisch in den inneren Kreis mit einem Tropfen Agarose (B). Versuchen Sie, die Menge an Agarose für die Einbettung zu minimieren (bürsten überschüssige Agarose nach außen, nachdem der Fisch Orientieren). Bitte klicken Sie hier , um diese Datei herunterzuladen.
Diskussion
Laserablation Approaches
Lasergestützte Ablation Techniken ermöglichen die genaue Ausrichtung der einzelne oder kleine Gruppen von Zellen. diese Technik mit der hochauflösenden Mikroskopie und genetische Manipulationen in Tiermodellen wie Zebrabärbling Die Kombination ermöglicht es den Forschern, das Schicksal einer einzelnen Zelle und die Wechselwirkungen nach der Verletzung systematisch zu untersuchen.
Die UV (405 nm) Laser-Ablation Protokoll hier skizziert beschrieben, wie einzelne Zellen (in dosisabhängiger Weise) selektiv hervorgehoben oder getötet werden, während Neuronen benachbarten, Glia und Axone unversehrt gelassen werden. Wir haben diesen Ansatz erfolgreich in Zellkulturexperimenten verwendet und beschreiben hier die detaillierte Vorgehensweise für den Zebrabärbling Rückenmark. Wir zeigen die Umsetzung dieses Ansatzes in der Zebrabärbling Rückenmark durch selektiv ein einzelnes Neuron in einem Netzwerk von anderen Zellen betont (Abbildung 5, A und B), oder durch ein einzelnes Neuron sofort und ohne Rückgewinnung (Abbildung 5, C und D) zu töten.
Zuvor spezialisierte Lasersystemen, wie gepulsten Stickstofflaser oder Zweiphotonen - Lasersystemen, waren erforderlich , um eine Gewebeschädigung und motorischen Nervenquerschnitten erhalten 10, 11, 12, 13 induzieren. Diese Lasersysteme wurden erfolgreich zu bewirken , eine Zellschädigung verwendet, wie Thrombose in Arterien und Venen 6, akutem Nierenversagen 7, Herzschädigung 8 und Calcium Wellen und Mikroglia - Antwort nach einer Hirnschädigung 9 zu studieren. Darüber hinaus verwendet Soustelle und Kollegen eine konventionelle konfokale Einrichtung (351-nm und 364-nm - UV - Laser) Schaden zu induzieren 14 bis epithelialen und Gliazellen in Drosophila </ Sup>.
Relevanz von Zebrabärbling Modelle für ALS (und andere menschliche Krankheiten) zu verstehen
Zebrabärblinge sind ein weit verbreitetes Modell Organismus, vor allem für Entwicklungsstudien 28, 29, 30. Während sie bestimmte Einschränkungen haben, ihr Potenzial Krankheit beim Menschen und geben ein Verständnis von pathogenen molekularen Mechanismen zu modellieren, ist enorm. Zebrabärbling - Modelle wurden für die Untersuchung von MND gut etabliert und haben zu wichtigen molekularen Erkenntnisse 31, 32, 33, 34. Transgene Zebrabärblinge Linien schnell erzeugt werden kann (4 - 5 Monate) und ermöglichen die gezielte Verfolgung eines bestimmten Zelltyp, Eigenschaften, die sie eine wertvolle Ergänzung zu aktuellen Tiermodellen von ALS zu machen. Zebrabärbling-Embryonen / Larven sind optisch transparent und bieten einzigartige Erfahmentalen Vorteile, die langfristige Live-Bildgebung auf Einzelzellebene im Gehirn oder Rückenmark, die in Nagetiermodellen ermöglichen (oder beim Menschen) leicht erreicht werden können. Wenn mit molekularen Techniken kombiniert werden , wie zum Beispiel Single-Cell - Ablation bietet dies eine einzigartige experimentelle Plattform für in vivo präzise molekulare Mechanismen zu studieren.
Motor Neurons Selektiv kann unter Verwendung UV-Laserablation Gezielte
Spinal - Neuronen in Zebrabärbling beginnen innerhalb von 10 Stunden nach der Geburt zu entwickeln und sind nach 35 ca. 48 h eingestellt, 36. Diese rasante Entwicklung ermöglicht die Visualisierung dieser Neuronen in kurzen Zeitrahmen und mit hohem Durchsatz. Motor Neuronen bilden die wesentliche Verbindung zwischen Gehirn und Muskeln und im ALS, betroffen sind in der motorischen Kortex (oberen motorischen Neuronen), Hirnstamm und Rückenmark (unterer Motor Neuronen). Verlust dieser Neuronen führt zwangsläufig zu muscle Atrophie und Schwäche. Motoneuronen im Rückenmark von Zebrabärbling können durch ihre unterschiedlichen Projektionen und durch die Verwendung von Motor-Neuron - spezifische Promotoren wie -3MNX1 identifiziert werden. Targeting der Zellsoma solcher Projizieren Neuronen zeigten die anterograde Degeneration entlang der axonalen Projektions im Laufe der Zeit (Abbildung 4 und Video 1). Einzellige auflösende Bildgebung von spinalen motorischen Neuronen zusätzlich Phosphatidylserin Translokation bestätigt und damit Annexin V-Kennzeichnung nach der Laser - Ablation (siehe Abbildung 4 und Ergänzungs Video 3 in Referenz 27). Obwohl wir die Aktivierung von Annexin V in sterbenden Neuronen nach unserer UV-Laserablation Ansatz zu melden, können wir nicht sicher sein, dass die Kaskade des Todes, die genau während dieser beschleunigten Prozess ausgelöst wird, um den neuronalen Tod übereinstimmt, die während der Neurodegeneration oder normalen Zellhomöostase auftritt.
Während diese Ablation Ansatz ist sehr gut reproduzierbarund spezifische, unterschiedliche Einbettungs Strategien könnten auch die Wirksamkeit des UV-Ablation beeinflussen. Nach unserer Erfahrung war es erfolgreichsten die Schicht aus Agarose zu minimieren wir unsere Fisch eingebettet in. Dickere Schichten des Einbettungsmedium mit einer zusätzlichen Schicht von Ei Wasser kann die UV-Leistung verringern letztlich durch die Zelle aufgrund Dämpfungs- und Streuungseffekte erhalten, die auftreten, entlang des Strahlengangs.
In Zukunft wird es der Überquerung von verschiedenen transgenen Fischlinien für die Visualisierung der unmittelbaren und kurzfristige (bis 12 h) Reaktionen von anderen betroffenen Zellen, wie Glia, dem laserinduzierten Zellzerstörung. Beispielsweise Astrozyten und nicht-zellautonomen Toxizität bei neurodegenerativen Erkrankungen wie ALS wurden in der Forschung Rampenlicht und werden in der Pathogenität von sporadischer und familiärer ALS 37, 38 stark verwickelt. Allerdings zugrunde liegenden Mechanismen Glia-Toxizität und Selektivitätin Richtung Motorneuronen bleiben unklar. Wir und andere haben kürzlich Vorteil dieses Ansatzes die Phagozytose von sterbenden Neuronen durch Mikroglia zu studieren und visualisiert die Clearance von neuronalen Reste 27, 39, 40.
die Ablation Technik mit hochauflösender Mikroskopie und Marker für neuroinflammation Kombination ermöglicht es Forschern in Zukunft das Verständnis der einzelnen Zellfunktion und miteinander verbundenen Zellsysteme zu erweitern. Charakterisierung dieser Prozesse in einem in vivo - Einstellung ist kritisch , nicht nur in Entwicklungs- Einstellungen , sondern auch in Modellen neurodegenerativer Erkrankungen, einschließlich MND, wo zelluläre Interaktionen 3 beeinträchtigt werden können, 41.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
This work was supported by the MND Research Institute of Australia and the Cure for MND Foundation [GIA 1638], the Snow Foundation, and Macquarie University [MQRDG 9201401462]. Imaging was carried out at the Microscopy Facility in the Department of Biomedical Sciences, Macquarie University. Other members of the MND research center are thanked for their contributions to the development of these methods and fish lines.
Materialien
| Name | Company | Catalog Number | Comments |
| Agarose low melting | Fisher-Scientific | Dissolve in egg water with tricaine (0.02%) at 0.8 - 1.5% | |
| Tricaine | Argent Labs | MS-222 | 0.02% |
| Harvard standard wall Borosilicate with filament Capillary Glass | World Precision Instruments, Inc. | GC100F-10 (short) GC100F-15 (long) | Pull to a resistance of 2 - 7 MΩ |
| Egg water | 0.6 g Instant Ocean sea salt, 4 mL of 1 mg/mL methylene blue in 10 L deionized water | ||
| 1-phenyl-2-thiourea (PTU) | Sigma | P7629 | |
| Pronase | Sigma | 10165921001 | |
| Heat block | Select BioProducts | Digital block heater (SBD110_) | |
| Microinjection apparatus | World Precision Instruments, Inc. | Microinjection was performed by hand under a steromicroscope (Leica) with a loaded glass needle and a Picospritzer II (General Valve corporation) | |
| Stereoscope | Leica | Bright field illumination microscopy was performed on a Leica M165FC stereo dissection microscope (Leica) | |
| Microscope | Leica | SP5 | |
| 35 mm glass bottom dish | MatTek Corporation | P35G-0-20-C |
Referenzen
- Becker, T. S., Rinkwitz, S. Zebrafish as a genomics model for human neurological and polygenic disorders. Dev Neurobiol. 72 (3), 415-428 (2012).
- Wilt, B. A., et al. Advances in light microscopy for neuroscience. Annu Rev Neurosci. 32, 435-506 (2009).
- Philips, T., Robberecht, W. Neuroinflammation in amyotrophic lateral sclerosis: role of glial activation in motor neuron disease. Lancet Neurol. 10 (3), 253-263 (2011).
- Robberecht, W., Philips, T. The changing scene of amyotrophic lateral sclerosis. Nat Rev Neurosci. 14 (4), 248-264 (2013).
- White, D. T., Mumm, J. S. The nitroreductase system of inducible targeted ablation facilitates cell-specific regenerative studies in zebrafish. Methods. 62 (3), 232-240 (2013).
- Jagadeeswaran, P., Paris, R., Rao, P. Laser-induced thrombosis in zebrafish larvae: a novel genetic screening method for thrombosis. Methods Mol Med. 129, 187-195 (2006).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. (54), e2845(2011).
- Matrone, G., et al. Laser-targeted ablation of the zebrafish embryonic ventricle: a novel model of cardiac injury and repair. Int J Cardiol. 168 (4), 3913-3919 (2013).
- Sieger, D., Moritz, C., Ziegenhals, T., Prykhozhij, S., Peri, F. Long-range Ca2+ waves transmit brain-damage signals to microglia. Dev Cell. 22 (6), 1138-1148 (2012).
- Lewis, G. M., Kucenas, S. Motor nerve transection and time-lapse imaging of glial cell behaviors in live zebrafish. J Vis Exp. (76), (2013).
- Rosenberg, A. F., Wolman, M. A., Franzini-Armstrong, C., Granato, M. In vivo nerve-macrophage interactions following peripheral nerve injury. J Neurosci. 32 (11), 3898-3909 (2012).
- Villegas, R., et al. Dynamics of degeneration and regeneration in developing zebrafish peripheral axons reveals a requirement for extrinsic cell types. Neural Dev. 7, 19(2012).
- O'Brien, G. S., et al. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J Vis Exp. (24), (2009).
- Soustelle, L., Aigouy, B., Asensio, M. L., Giangrande, A. UV laser mediated cell selective destruction by confocal microscopy. Neural Dev. 3, 11(2008).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 8 (6), 1000412(2010).
- Essentials of Biology 2. JoVE. , JoVE Science Education Database. Mouse, Zebrafish, and Chick. Zebrafish Microinjection Techniques (2016).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. J Vis Exp. (69), e4196(2012).
- Westerfield, M. The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio).Vol.4th ed. , Univ. of Oregon Press. Eugene. (2000).
- Clark, K. J., Urban, M. D., Skuster, K. J., Ekker, S. C. Transgenic zebrafish using transposable elements. Methods Cell Biol. 104, 137-149 (2011).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Dev Dyn. 236 (11), 3088-3099 (2007).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), (2009).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. J Neurosci. 20 (1), 206-218 (2000).
- Arkhipova, V., et al. Characterization and regulation of the hb9/mnx1 beta-cell progenitor specific enhancer in zebrafish. Dev Biol. 365 (1), 290-302 (2012).
- Flanagan-Steet, H., Fox, M. A., Meyer, D., Sanes, J. R. Neuromuscular synapses can form in vivo by incorporation of initially aneural postsynaptic specializations. Development. 132 (20), 4471-4481 (2005).
- Hall, T. E., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin alpha2-deficient congenital muscular dystrophy. Proc Natl Acad Sci U S A. 104 (17), 7092-7097 (2007).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), 49-56 (2011).
- Morsch, M., et al. In vivo characterization of microglial engulfment of dying neurons in the zebrafish spinal cord. Front. Cell. Neurosci. , (2015).
- Grunwald, D. J., Eisen, J. S. Headwaters of the zebrafish -- emergence of a new model vertebrate. Nat Rev Genet. 3 (9), 717-724 (2002).
- Lele, Z., Krone, P. H. The zebrafish as a model system in developmental, toxicological and transgenic research. Biotechnol Adv. 14 (1), 57-72 (1996).
- Veldman, M. B., Lin, S. Zebrafish as a developmental model organism for pediatric research. Pediatr Res. 64 (5), 470-476 (2008).
- Kabashi, E., et al. Gain and loss of function of ALS-related mutations of TARDBP (TDP-43) cause motor deficits in vivo. Hum Mol Genet. 19 (4), 671-683 (2010).
- Laird, A. S., et al. Progranulin is neurotrophic in vivo and protects against a mutant TDP-43 induced axonopathy. PLoS One. 5 (10), 13368(2010).
- Lemmens, R., et al. Overexpression of mutant superoxide dismutase 1 causes a motor axonopathy in the zebrafish. Hum Mol Genet. 16 (19), 2359-2365 (2007).
- Ramesh, T., et al. A genetic model of amyotrophic lateral sclerosis in zebrafish displays phenotypic hallmarks of motoneuron disease. Dis Model Mech. 3 (9-10), 652-662 (2010).
- Hanneman, E., Trevarrow, B., Metcalfe, W. K., Kimmel, C. B., Westerfield, M. Segmental pattern of development of the hindbrain and spinal cord of the zebrafish embryo. Development. 103 (1), 49-58 (1988).
- Lewis, K. E., Eisen, J. S. From cells to circuits: development of the zebrafish spinal cord. Prog Neurobiol. 69 (6), 419-449 (2003).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. J Cell Biol. 187 (6), 761-772 (2009).
- Philips, T., Rothstein, J. D. Glial cells in amyotrophic lateral sclerosis. Exp Neurol. 262, Pt B 111-120 (2014).
- Mazaheri, F., et al. Distinct roles for BAI1 and TIM-4 in the engulfment of dying neurons by microglia. Nat Commun. 5, 4046(2014).
- van Ham, T. J., Kokel, D., Peterson, R. T. Apoptotic cells are cleared by directional migration and elmo1- dependent macrophage engulfment. Curr Biol. 22 (9), 830-836 (2012).
- Radford, R. A., et al. The established and emerging roles of astrocytes and microglia in amyotrophic lateral sclerosis and frontotemporal dementia. Front Cell Neurosci. 9, 414(2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten