Method Article
Provocando estresse celular e morte utilizando convencional UV laser microscopia confocal
Neste Artigo
Resumo
Targeted manipulations to cause directed stress or death in individual cells have been relatively difficult to accomplish. Here, a single-cell-resolution ablation approach to selectively stress and kill individual cells in cell culture and living animals is described based on a standard confocal UV laser.
Resumo
Using a standard confocal setup, a UV ablation method can be utilized to selectively induce cellular injury and to visualize single-cell responses and cell-cell interactions in the CNS in real-time. Previously, studying these cell-specific responses after injury often required complicated setups or the transfer of cells or animals into different, non-physiological environments, confounding immediate and short-term analysis. For example, drug-mediated ablation approaches often lack the specificity that is required to study single-cell responses and immediate cell-cell interactions. Similarly, while high-power pulsed laser ablation approaches provide very good control and tissue penetration, they require specialized equipment that can complicate real-time visualization of cellular responses. The refined UV laser ablation approach described here allows researchers to stress or kill an individual cell in a dose- and time-dependent manner using a conventional confocal microscope equipped with a 405-nm laser. The method was applied to selectively ablate a single neuron within a dense network of surrounding cells in the zebrafish spinal cord. This approach revealed a dose-dependent response of the ablated neurons, causing the fragmentation of cellular bodies and anterograde degeneration along the axon within minutes to hours. This method allows researchers to study the fate of an individual dying cell and, importantly, the instant response of cells-such as microglia and astrocytes-surrounding the ablation site.
Introdução
A microscopia de fluorescência tem sido utilizada para estudar os efeitos de transgenes no SNC peixe-zebra, particularmente os seus efeitos sobre o desenvolvimento 1. Microscopia de alta resolução permitiu um mapeamento detalhado dos processos celulares envolvidos no desenvolvimento do cérebro, músculo geração, e muitos outros eventos de desenvolvimento 2. Estudar a morte de uma célula individual tem sido mais difícil, principalmente devido às dificuldades técnicas de induzir a morte celular selectiva durante procedimentos de imagem padrão. No entanto, a combinação de imagens resolução de uma única célula e técnicas de ablação altamente orientadas permite a investigação de respostas celulares imediatas ao stress e lesões, bem como das interacções célula-célula consequentes. A compreensão destes processos é crítica, particularmente para doenças neurodegenerativas tais como doença de neurónios motores (DNM), onde foram mostrados interacções neurónio-glia para contribuir para a progressãoda doença 3.
MND ou esclerose lateral amiotrófica (ELA), uma doença neurodegenerativa é devastador que afecta os neurónios motores do tronco cerebral, o córtex motor, e da medula espinal. A perda destes neurónios conduz a perda de massa muscular, e doentes morrem dentro de 3 - 5 anos de diagnóstico 4. neurônios motores no link da medula espinhal para as fibras musculares e desempenham um papel essencial na facilitação da contração muscular. Fracasso desta comunicação ou morte desses neurônios gradualmente enfraquece os músculos e afeta a capacidade do paciente de engolir, andar, falar e respirar. Visualizando a morte de um neurônio motor e as consequências a curto prazo em um animal vivo proporciona uma excelente oportunidade para compreender melhor os processos dinâmicos envolvidos na homeostase celular normal e na doença.
Zebrafish têm emergido como um sistema modelo atraente para estudar doenças neurodegenerativas 1. esteé devido às vantagens oferecidas por este organismo modelo, tal como a fertilização externa, curto tempo de desenvolvimento, o acesso óptico ao sistema nervoso, e facilidade de transgénese. Além disso, a capacidade de gerar facilmente peixes-zebra transgénicos composto permite múltiplas estratégias de rotulagem de diferentes tipos de células. Ablação genética abordagens para matar tipos específicos de células permitem bastante amplo distúrbio, mas falta o controle fino de alvejar células individuais 5. técnicas assistida por laser, por outro lado, proporcionar um controlo temporal e espacial finos e têm sido utilizados para diferentes modelos animais. Enquanto a maioria das abordagens usam equipamentos especializados, tais como lasers 6, 7, 8, 9, 10, 11, 12 ou de dois fótons set-ups 13 pulsada, outragrupos de pesquisa têm tomado recentemente vantagem de um laser UV em microscopia confocal convencionais 14.
A técnica aqui descrita combina microscopia confocal de alta resolução com uma abordagem mediada por laser de UV para causar o stress ou a morte celular de uma forma dependente da dose em neurónios motores seleccionados. Baseia-se no uso do laser 405 nm, normalmente instalado, foi testado com sucesso em culturas de células e em animais vivos, e permite a caracterização detalhada de interacções celulares, tais como a depuração microglial após a morte neuronal.
Protocolo
NOTA: concepção, realização e os relatórios de experiências com animais devem ter em conta as diretrizes atuais 15. Esse trabalho deve ser previamente aprovado pela autoridade de bem-estar animal local (no nosso caso, o Comité de Ética Animal da Universidade Macquarie).
1. Prepare o peixe-zebra para a montagem e UV celular Ablação
- Gerar peixe-zebra (Danio rerio) expressando proteínas fluorescentes.
- Para expressar as proteínas fluorescentes de interesse no peixe-zebra, realizar injecções de plasmídeo no estádio de uma célula do ovo peixe-zebra (como descrito noutro local 16) ou utilizar linhas transgénicas fluorescentes. Para rotular vários tipos de células, criar linhas de peixe-zebra transgénicos compostos cruzando linhas transgénicas estabelecidas pertinentes à questão dos juros. Coloque um macho e uma fêmea de peixe-zebra de cada lado de um tanque de fundo falso-acasalamento par durante a noite e remover o divisor com o aparecimento de luzna manhã seguinte (conforme detalhado em outra parte 17). Mantenha o peixe-zebra a 28 ° C e tratá-los de acordo com os protocolos estabelecidos 17, 18.
- Coletar os embriões após a desova bem sucedida por esforço a água do tanque contendo os embriões através de um coador de chá de plástico. Lavar os ovos com água do sistema e transferi-los em água ovo numa placa de Petri.
- Examiná-los sob um microscópio de luz para determinar a fertilização. Loja ovos fertilizados em uma placa de Petri e colocá-los em uma incubadora a 28 ° C 18.
- Opcional: Executar uma microinjeção para rotular populações de células específicas.
NOTA: Este é um método alternativo que permite a expressão de proteínas e visualização, sem a necessidade de aumentar a linhas transgénicas estáveis. Este método também é vantajoso quando a proteína de interesse é tóxico e proíbe a geração de um trans estávellinhas gênicas.- Injectar as construções de plasmídeos para o estádio de uma célula de embriões de peixe-zebra, como descrito noutro local 19, 20, 21.
NOTA: Este método resulta na expressão do mosaico da proteína de interesse. A proteína de interesse é conduzido a partir de um promotor de escolha (por exemplo, islet1 22, -3mnx1 23, 24, 25, met, ou MPEG1 26) flanqueada por repetições invertidas Tol2 20.
- Injectar as construções de plasmídeos para o estádio de uma célula de embriões de peixe-zebra, como descrito noutro local 19, 20, 21.
- A idade dos peixes para o tamanho desejado.
- Elevar o peixe para 3-5 dias após a fertilização (DPF) e colocá-los sob um microscópio composto fluorescente. Peneirar os animais para a expressão fluoróforo apropriado e selecione o peixe brilhantemente rotulados. Separar as larvas apropriada em outro prato com água de ovo para a incorporação tardiar em (loja em um 28 ° C incubadora).
Opcional: Os embriões podem ser colocadas em um 1-fenil-2-thioures solução 0,2 mM (PTU) Ringers às 24 h após a fertilização (HPF) para inibir a formação de pigmentação. Deve ser tomado cuidado com PTU, como é tóxico e pode ter fisiológica adversa, genética, ou efeitos morfológicos. - Para os estudos em um estágio inicial de desenvolvimento (<2 dpf), dechorionate os embriões manualmente usando uma pinça afiada. Dechorionate grandes números de embriões enzimaticamente por adição de pronase (2 mg / mL) para a água de ovo e incubando-os durante 10 min a 28 ° C.
- Passar os embriões periodicamente através de uma pipeta de Pasteur de plástico para facilitar dechorionation. Finalizar o processo, quando a maioria dos embriões surgiram a partir de seus córions, lavando-as com água várias vezes ovo.
- Elevar o peixe para 3-5 dias após a fertilização (DPF) e colocá-los sob um microscópio composto fluorescente. Peneirar os animais para a expressão fluoróforo apropriado e selecione o peixe brilhantemente rotulados. Separar as larvas apropriada em outro prato com água de ovo para a incorporação tardiar em (loja em um 28 ° C incubadora).
- Preparar soluções para incorporação em peixes-zebra de agarose.
- Prepara-se uma solução de anestesia por adição de 4 g / L de MS222 (solução estoque tricaina, pH 7,0)gota a gota a uma placa de Petri contendo água ovo. Uma dose de 50 mg / L é um ponto de partida recomendada (Figura 1A).
- Preparar um estoque de agarose de baixo ponto de fusão (0,8-1,5%) em água de ovo e aliquotar-lo em tubos de microcentrífuga de 1,5 mL. Colocar uma alíquota para um bloco de aquecimento pré-aquecida (38 - 40 ° C) e deixou-se equilibrar à temperatura conjunto (~ 30 min; Figura 1B).
- Opcional: Para imagens de longo prazo (> 4 h), prepare um pequeno círculo de agarose dentro de 35 mm com fundo de vidro placa de Petri e deixe-a definir (Figura Suplementar 1).
NOTA: Este passo extra foi eficaz em evitar qualquer movimento de toda a gota de agarose com o peixe-zebra em prazos mais longos.- Para fazer isso, o lugar ~ 300 mL de agarose ao longo do círculo interno do prato com fundo de vidro para preparar um círculo em forma de anel com uma pequena abertura no meio para colocar o peixe (passo 1.5.3; Suplementar Figura 1) .
- Monte o peixe-zebra em agarose para microscopia.
- Escolha 1-3 do peixe pré-rastreados para a ablação e anestesiar as larvas, transferindo-os (usando uma pipeta de transferência) num prato com a solução de anestesia (passo 1.4.1; Figura 1C; aproximadamente 5 minutos).
NOTA: Os peixes são anestesiados quando eles mostram um movimento opercular rasa e uma frequência cardíaca diminuiu e já não exibir uma resposta de fuga evocada-touch (TEER; incapacidade de nadar para longe após tocando suavemente sua cauda com uma escova). Certifique-se de anestesia adequada para o tratamento ético dos peixes e para evitar espasmos após a transferência em agarose ou exposição à luz fluorescente. - Após a anestesia é confirmada, aspirar uma larva usando uma pipeta ajustável (com uma ponta de 200 uL de corte definido para ~ 30 mL) e deixá-lo afundar para o fundo da ponta. Transferir a larva em agarose pré-aquecido (passo 1.4.2), através da libertação de uma gota de líquido com olarva em agarose (tentar minimizar a quantidade de água que entra ovo a agarose; a Figura 1D).
- Sugar o peixe rodeado por agarose. Dispensar-lo rapidamente para o prato previamente preparado de 35 mm com fundo de vidro.
- Use um microscópio de dissecação e um pincel padrão (longa forro, tamanho 1) para posicionar o animal dentro do agarose no lado (cabeça para a esquerda) para que corpo e cauda são planas (Figura 1E). Se estiver a trabalhar com peixes múltipla, alinhar todos os peixes no prato de modo que sejam facilmente localizadas utilizando o microscópio confocal mais tarde.
NOTA: executar rapidamente este procedimento de posicionamento e alinhamento (pode exigir um pouco de prática, como a agarose começa a definir imediatamente após a exposição a temperaturas mais frias). - Deixe o peixe incorporado-agarose por 10 - 15 minutos até que a agarose é definido com firmeza. Cuidadosamente encher a 35 mm placa de Petri com -2 mL de água contendo ovo tricaina (Figura 1F).
- Escolha 1-3 do peixe pré-rastreados para a ablação e anestesiar as larvas, transferindo-os (usando uma pipeta de transferência) num prato com a solução de anestesia (passo 1.4.1; Figura 1C; aproximadamente 5 minutos).
2. Configure o microscópio confocal e parâmetros de imagem
- Colocar a placa de Petri com a larva incorporado na platina do microscópio confocal e concentrar-se no lado dorsal da medula espinhal de animais (usando campo brilhante). Examinar o animal sob a ampliação adequada (40X) e configuração fluorescente e visualizar a estrutura de interesse (por exemplo, intensidade de fluorescência dos neurónios marcados ou movimento da microglia) para confirmar que todos os parâmetros de imagem são conforme necessário para ablação subsequente (Figura 2). Nós usam rotineiramente o objetivo 40X para realizar nossos estudos de lapso de tempo.
- Opcional: Para realizar um estudo de lapso de tempo de várias horas, é aconselhável para gravar um único ou poucos pontos de tempo antes da ablação para estabelecer a resposta fisiológica não perturbada da célula e o seu meio ambiente (por exemplo, o movimento da microglia para estabelecer a velocidade de linha de base e motilidade).
- Determinar a espessura da estruturaure de interesse para a ablação a laser UV.
- Usando o z-drive, verifique a parte superior e inferior da estrutura de interesse (por exemplo, a soma das células), concentrando-se manualmente para cima e para baixo. Nota-se o Z-avião que irá ser cauterizado (por exemplo, o centro da célula).
NOTA: A partir da experiência, este método era mais eficaz por segmentação neurónios da medula espinal que foram intensamente marcados (uma relação elevada sinal-para-ruído que permite a visualização de lapso de tempo fácil após a ablação, por exemplo, Figura 4) e por ablação a meio da soma celular. núcleo da célula de fluorescência pode ser uma vantagem para assegurar segmentação correta e alta eficiência de ablação.
- Usando o z-drive, verifique a parte superior e inferior da estrutura de interesse (por exemplo, a soma das células), concentrando-se manualmente para cima e para baixo. Nota-se o Z-avião que irá ser cauterizado (por exemplo, o centro da célula).
3. Execute alvejado Laser Ablation de células individuais na medula espinhal Zebrafish
NOTA: Para esta abordagem ablação e visualização, foi utilizado um microscópio confocal (Leica SP5). O procedimento de ablação usando um diodo 405 nm para dest específico de célulasruction é detalhado de acordo com o software (Leica Application Suite, v2.7.3.9723). No entanto, qualquer microscópio confocal convencional que está equipado com um laser de 405 nm e um FRAP (recuperação de fluorescência após a fotodegradação) ou lixívia módulo irá permitir que o desempenho das mesmas manipulações de células, mas potencialmente com um pouco diferentes configurações, parâmetros e nomes.
- Inicie o assistente FRAP, clicando no menu suspenso na parte superior do menu de software (Figura 3A, 1 e 2). Observar uma nova janela com diferentes etapas que permite a configuração dos parâmetros específicos para a ablação a laser (Figura 3B, 3).
- Determinar os parâmetros de imagem para a abordagem da ablação por seleccionar o formato, a velocidade de varrimento (Figura 3B, 4), e fazendo a média (Figura 3B, 5). Um formato de imagem de 1024 x 1024 a uma velocidade de varredura de 400 Hz e uma linhamédia de 4 foi mais aplicável.
NOTA: Geralmente não há necessidade de mudar a detecção espectral (como os parâmetros de excitação ou de emissão), como eles têm sido apurado na aquisição anterior.- Se o plano z para ablação ainda não tiver sido selecionado (como descrito no passo 2.4.), Pressione o botão "Live" e concentrar-se através da amostra até que a estrutura fluorescente ou plano z desejado que vai ser ablação é em foco.
- Uma vez que os parâmetros de imagem são gerais definido, o acesso a passo "alvejante" (Figura 3C, 6) para controlar os componentes de ablação específicos.
NOTA: Uma combinação de a intensidade do laser (Figura 3C, 8), da velocidade de varrimento, e o cálculo da média que foi definido no passo 3.2 (Figura 3B, 4 e 5), bem como o número de repetições que será definido em a etapa 3.5 (Figura 3E,12), vai determinar o tempo total de permanência do laser de UV a uma ROI, e, portanto, a eficiência do branqueamento.- Envolver-se o laser de 405 nm, ativando-o para o processo de branqueamento (Figura 3C, 8).
NOTA: A maioria de sucesso com as configurações acima mencionadas foi alcançada com intensidades de laser de 405 nm entre 60 - 80% em nossa configuração experimental. Esteja ciente de que esta saída de potência do laser é específico do instrumento e será diferente para cada configuração confocal. - Use o "zoom in" opção (Figura 3C, 7) para maximizar a intensidade de branqueamento na ROI selecionada, reduzindo o campo de leitura, portanto, maximizar o tempo de permanência. Como alternativa, use a opção "ponto de Bleach" do software de escolha para este processo.
- Envolver-se o laser de 405 nm, ativando-o para o processo de branqueamento (Figura 3C, 8).
- Selecione uma ou várias ROIs (Figura 3D, 10) para a ablação usando qualquer uma das ferramentas de desenho no vento aquisição de imagemow (Figura 3D, 9). Alvo o axónio colina, por exemplo, com a ferramenta de desenho circular de cerca de 4-8 um.
Nota: A área de ablação é ajustável a partir de um único pixel para uma área maior, dependendo da aplicação. - Depois de estabelecer o ROI, selecione o botão "Time Course" (Figura 3E, 11) e confirme o número de ciclos do ROIs serão verificados / ablação (Figura 3E, 12). Escolha a opção "Pré-Bleach" e frames "Post-Bleach" como desejado para permitir uma visão geral de toda a imagem imediatamente antes e imediatamente após o processo de branqueamento.
- Depois de estabelecer todos os parâmetros de ablação necessário, pressione "Run Experiment" (Figura 3E, 13) e monitorar a eficiência da ablação.
NOTA: Em nossa configuração FRAP, uma única imagem será tomada antes e após o ciclo FRAP com o laser adequado excitation (por exemplo, 488 nm de excitação para as células que expressam EGFP). Estas imagens pré e pós-ablação permitir um julgamento rápido de como satisfatoriamente o ROI foi clareado e quão eficaz os parâmetros de ablação foram escolhidas. - Repetir o processo ajustando a intensidade do laser (Figura 3C, 8), velocidade de varrimento e média (Figura 3B, 4 e 5), e repetições (Figura 3E, 12) no caso de o ROI seleccionado ainda mostra alta intensidade de fluorescência após a conclusão do ciclo FRAP.
4. Execute o Procedimento de Acompanhamento, incluindo peixes "Rescue" ou Alienação
- Se a experiência é terminal, sacrificar o animal com uma dose excessiva de tricaina. Retire a água ovo e substituí-lo com solução de anestesia para 10 min. Para garantir a eutanásia, verifique sob o microscópio para a cessação dos batimentos cardíacos.
- Opcional:Se a experiência não é terminal, retire o peixe com cuidado a partir da agarose com uma pinça fina e uma escova. Coloque o peixe na água ovo fresco e permitir que ele se recuperar sob observação durante 15 min. Se o comportamento normal de natação retorna, devolver o peixe para a incubadora.
- Descarte animais transgénicos de acordo com fluxo de resíduos OGM aprovado da instituição.
Resultados
O método descrito aqui permite a ablação de neurónios motores na espinal medula peixe-zebra utilizando o módulo FRAP de um microscópio confocal comercial. Linhas de peixes-zebra transgénicos que expressam uma proteína fluorescente verde em neurónios sob o controlo de promotores específicos, tais como - 3mnx1, islet1, ou Met, foram usadas. A expressão da GFP conduzida pelo promotor do neurónio motor (tais como -3mnx1 ou met) permite a visualização de alta resolução dos corpos celulares, os axónios principais, e os ramos periféricos que se estendem para os músculos (Figura 4 e vídeo 1).
Neurônios na medula espinhal de peixes de 3 a 5 dias de idade foram ablação bem sucedida, com um tempo total de permanência de 60 - 80 s em uma potência do laser de ~ 70% e as configurações gerais descrito no passo 3. ablação bem-sucedida é alcançada quando a fluorescência desaparece imediatamente após a ablaçãoe nunca retoma (Figura 5, C e D). As tentativas de ablação com outras linhas de laser (por exemplo, a linha de laser 488 nm) não resultou em desvanecimento permanente, e a fluorescência foi restaurada dentro de intervalos de tempo curtos. Mais importante, esta técnica mostrou características de morte celular apoptótica em neurónios ablated-UV, tal como a presença de anexina V, alterações morfológicas consistentes de degeneração Somal, e vesiculação axonal de neurónios a 27 excisada.
A especificidade desta abordagem é confirmado nas experiências utilizando o fluoróforo photoconvertible Kaede (que muda a sua emissão de verde para vermelho após a exposição à luz UV), em que um único neurónio alvo foi convertido (Figura 5, A e B) sem sinais de celular destruição ao longo de várias horas. Uso de uma potência do laser mais elevada, em vez leva tO extinção do neurónio alvo (sem fotoconversão ou reaparecimento da fluorescência) e fotoconversão (sem morte) das células em estreita proximidade (~ 20 pM) para a ablação local (Figura 5, C e D).
Uma vantagem importante desta técnica de ablação induzida por laser é a dependência da dose da abordagem. Para células com diferentes intensidades alvo, camadas múltiplas de ajuste fino estão disponíveis através do ajuste da potência do laser (Figura 3C, 8), a verificação de velocidade e a linha média (Figura 3B, 4 e 5), o tamanho da ROI a ser cauterizado (Figura 3D, 10), e as repetições (Figura 3E, 12). Notavelmente, esta abordagem também pode ser utilizada para aplicar o stress celular para células individuais, em vez de induzir a morte celular. Por exemplo, fine-tuning tem sidobastante valiosos para avaliar processos celulares durante a morte de um neurónio. Neurônios motores com projeções axonal longas que foram submetidas à ablação com intensidades de laser inferior UV revelou "formação de bolhas" característica (a formação e fragmentação de vesículas celulares), que teve início na soma alvo e continuou ao longo do axônio ao longo do tempo (40-90 min; Figura 4 ; 3D rendeu o filme deste ablação em video 1). Por conseguinte, a modulação dos diferentes parâmetros de ablação a laser e, portanto, o nível de stress celular induzido e o curso de tempo de morte permite aos investigadores um elevado grau de flexibilidade experimental.
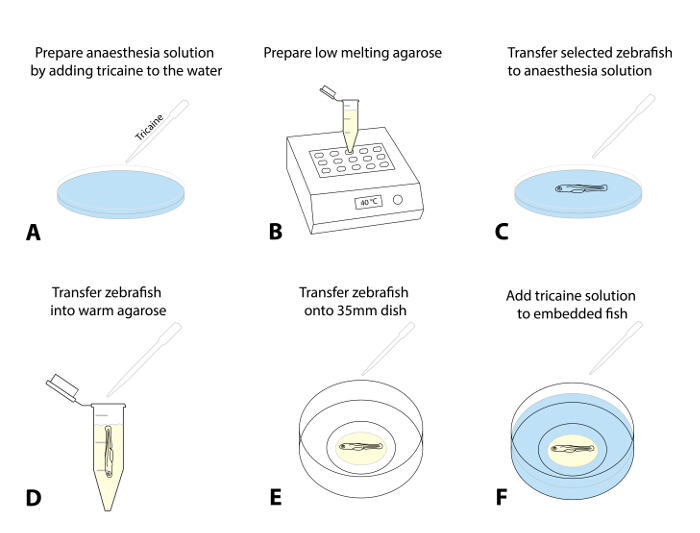
Figura 1: Incorporação de peixe-zebra para geração de imagens ao vivo. (AF) para geração de imagens ao vivo procedimento Incorporação: (A) tricaina é adicionado à água de ovo para anestesiar um peixe-zebra ta taxa de dose inicial de 50 mg / L. (B) de agarose de baixo ponto de fusão (0,8-1,5%) é preparado e aquecido a 38 - 40 ° C. (C) utilizando uma pipeta de transferência, o peixe-zebra rastreados e seleccionados são transferidos para um prato com solução tricaina. Após sedação sucesso (movimento opercular rasa, diminuição da frequência cardíaca, a falta de uma resposta evocada pelo toque), um peixe é transferido para a agarose pré-aquecido (D). Minimizar a quantidade de água de ovo que é transferido para a agarose para impedir a diluição subsequente. (E) Transferir uma gota de agarose (~ 30 - 50 mL) contendo o peixe-zebra em um prato com fundo de vidro de 35 mm. Executar este sob um microscópio de dissecação e usar uma escova para alinhar suavemente o peixe-zebra a sua orientação preferencial. Esperar 10 - 15 min, até que a agarose é definido, e adicionar ~ 2 mL de solução tricaina para o prato (F).ank "> Por favor clique aqui para ver uma versão maior desta figura.
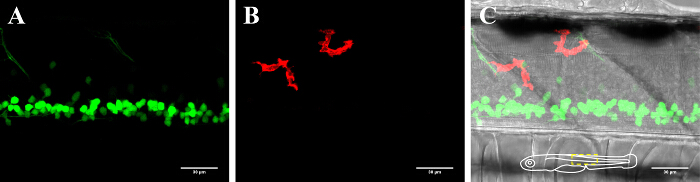
Figura 2: A visualização dos neurónios e microglia na medula espinhal de um peixe-zebra 3-dpf. Visualização de microglia e neurónios da medula espinhal de um 3-dias de idade, peixes-zebra transgénicos que expressam (A) neurónios GFP positivas (islet1: GFP) e (B) mCherry-positiva microglia (MPEG1: GAL4 UAS: mCherry). (C) Imagem composta do neurônio e microglia canal junto com a imagem de campo brilhante. A inserção esquemática em (C) ilustra a orientação do peixe e descreve a área apresentada. Barra de escala = 30 mm. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: Etapas do processo de ablação a laser UV (como previsto no protocolo, passo 3). Passos para controlar o módulo de software no software FRAP confocal (Leica Application Suite). (A) a partir do módulo de FRAP como uma ferramenta para efectuar a ablação a laser de UV. (B) Configurar o plano z para as configurações de ablação e outras FRAP como formato, velocidade e média, que irá determinar o tempo de permanência do laser. (C) O controlo da intensidade do laser e do "zoom in" opção para maximizar a eficiência de branqueamento. (D) Selecção de uma ou várias regiões de interesse (ROI) que vai ser cauterizado. (E) Definir o tempo de curso do branqueamento determina os ciclos de branqueamento e o tempo total de permanência de laser nas ROIs. Por favor, clique dela e para ver uma versão maior desta figura.
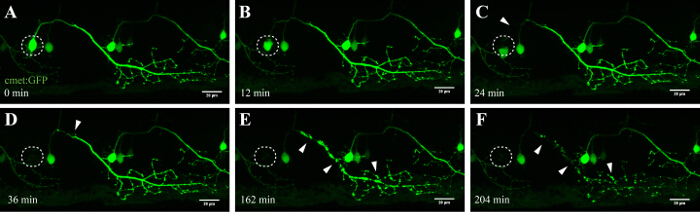
Figura 4: degeneração anterógrada de um neurônio ablated-UV. imagens de lapso de tempo da neurodegeneração de um neurônio espinhal ablated-UV. (AF) irradiação de UV de um único neurónio espinal (met: GAL4 UAS: EGFP; A; círculo) resultou no soma do neurónio encolhimento e o arredondamento para cima ao longo do tempo (CA), seguido por fragmentação axonal (CF; pontas de seta) . A degeneração axonal começou no Soma (local de ablação) e progrediu anterógrada para a extremidade distal do axónio até que, finalmente, a fluorescência no soma e desapareceu todo o axónio mostrou "formação de bolhas" (DF). Barras de escala = 20 uM. O filme de lapso de tempo-rendido 3D deste ablação é mostrado no vídeo 1.es / ftp_upload / 54983 / 54983fig4large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
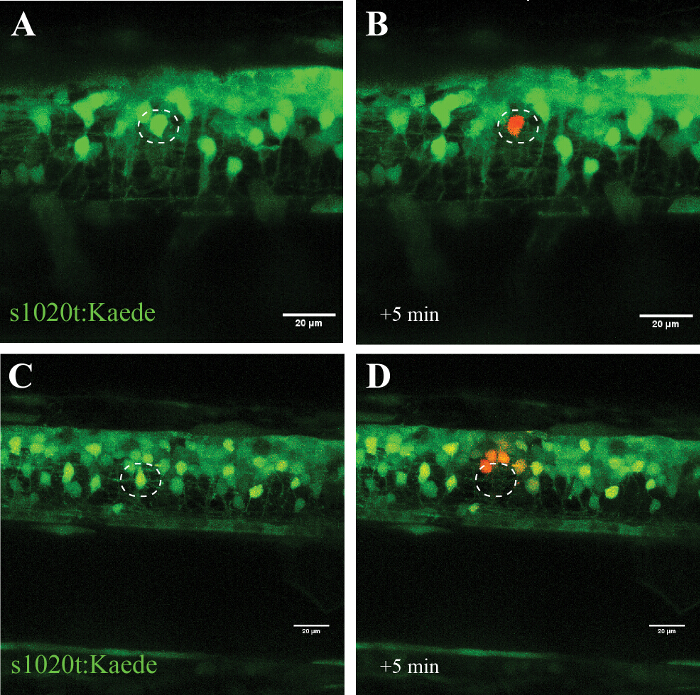
Figura 5: A confirmação do efeito da irradiação com UV de uma única célula utilizando um fluoróforo photoconvertible (Kaede) num neurónio motor. Validação de irradiação com UV de uma única célula através da activação do fluoróforo photoconvertible Kaede num neurónio. (AD) irradiação UV de neurônios marcados com Kaede. (A) fotoconversão de um único neurônio (círculo) com uma potência de laser de 30% para 10 s levou a fotoconversão de Kaede (de verde para vermelho) apenas no neurônio individual alvo (B). Note-se que a célula convertido sobreviveram durante várias horas e não mostraram sinais visuais de deterioração, tais como a formação de bolhas ou o arredondamento para cima. Ablação de um único neurônio (C ; círculo) com uma potência de laser mais elevado (95% para 10 s) resultou no desaparecimento imediato desse neurónio (D) e subsequente fotoconversão de Kaede em um pequeno número de neurónios circundantes num raio de cerca de 20 um. Barras de escala = 20 uM. Por favor clique aqui para ver uma versão maior desta figura.
Vídeo 1: 3D render superfície (Imaris) do neurónio UV ablated ilustrado na Figura 4.
O lapso de tempo vídeo do neurônio representado na Figura 4 é a superfície processado usando um software de visualização (Imaris, Bitplane). Destaca-se o processo de encolhimento do soma excisada, seguido por fragmentação axonal anterogradamente direcção da extremidade distal da célula.euron_ablation-3D_rendered.mov "target =" _ blank "> Clique aqui para baixar esse arquivo.
Figura Suplementar 1: elenco agarose opcional para a imagem latente de longa data.
Para evitar o movimento dos peixes e da agarose durante a aquisição de longo prazo preparar um donut em forma de círculo de agarose ao longo das bordas no meio do prato 35 milímetros com fundo de vidro (A). Deixe o conjunto de agarose para ~ 10 min e transferidos peixes para o círculo interno com uma gota de agarose (B). Tentar minimizar a quantidade de agarose para o encastre (escovar o excesso de agarose para o lado de fora depois de orientar o peixe). Por favor clique aqui para baixar esse arquivo.
Discussão
Abordagens ablação por laser
técnicas de ablação com laser permite a segmentação precisa dos indivíduos ou pequenos grupos de células. Combinar esta técnica com microscopia de alta resolução e manipulações genéticas em modelos animais, como peixe-zebra permite aos pesquisadores estudar sistematicamente o destino de uma célula individual e as interações após a lesão.
O protocolo de ablação a laser de UV (405 nm) aqui descrito apresenta como as células individuais podem ser salientado ou mortos selectivamente (de uma maneira dependente da dose), enquanto a vizinha neurónios, células da glia, e os axónios são deixados ilesos. Temos utilizado com sucesso esta abordagem em experiências de cultura de células e descrever aqui a abordagem detalhada para a medula espinhal peixe-zebra. Mostramos a implementação desta abordagem na medula espinhal peixe-zebra, salientando seletivamente um neurônio individual dentro de uma rede de outras células (Figura 5, A e B), ou por matar um único neurônio imediatamente e sem recuperação (Figura 5, C e D).
Anteriormente, sistemas de laser especializados, tais como laser pulsado-azoto ou sistemas de laser de dois fótons, foram necessárias para induzir a dano tecidual e transecções 10, 11, 12, 13 nervo motor. Estes sistemas laser têm sido utilizados com sucesso para causar danos às células, como trombose nas artérias e veias 6, lesão renal aguda 7, lesão cardíaca 8, e estudar as ondas de cálcio e microglial após a lesão cerebral 9. Além disso, Soustelle e seus colegas usaram uma configuração confocal convencional (351 nm e 364 nm lasers UV) para induzir danos ao epitélio e células gliais em Drosophila 14 </ Sup>.
Relevância dos modelos Zebrafish para Compreender ALS (e outras doenças humanas)
Peixe-zebra é um organismo modelo amplamente utilizado, especialmente para estudos de desenvolvimento 28, 29, 30. Embora eles têm algumas limitações, o seu potencial para modelar doenças humanas e dar uma compreensão dos mecanismos moleculares patogénicos é enorme. Modelos de peixe-zebra foram bem estabelecido para o estudo da MND e levaram a percepções moleculares importantes 31, 32, 33, 34. linhas de peixes-zebra transgénicos pode ser gerado rapidamente (4 - 5 meses) e permite o controlo selectivo de um tipo específico de célula, características que lhes um suplemento valioso para modelos animais correntes de ALS fazem. embriões de peixe-zebra / larvas são opticamente transparentes e oferecem experi únicavantagens mentais que permitem ao vivo por imagem a longo prazo no nível de uma única célula no cérebro ou na medula espinhal, que não podem ser prontamente conseguidas em modelos de roedores (ou em seres humanos). Quando combinado com técnicas moleculares, tais como a ablação de uma única célula, esta fornece uma plataforma experimental única para o estudo dos mecanismos moleculares precisos in vivo.
Os neurônios do motor pode ser seletivamente alvejado Usando UV Laser Ablation
Neurônios espinhais em peixes-zebra começar a desenvolver dentro de 10 h após o nascimento e são estabelecidas depois de aproximadamente 48 h 35, 36. Este rápido desenvolvimento permite a visualização desses neurônios em curto espaço de tempo e com alta taxa de transferência. neurônios motores constituir a principal ligação entre o cérebro e os músculos e, em ALS, são afetados no córtex motor (neurônios motores superiores), o tronco cerebral e da medula espinhal (neurônios motores inferiores). Perda desses neurônios leva inevitavelmente a muatrofia LECS e fraqueza. Neurônios motores da medula espinhal de peixe-zebra podem ser identificados por suas projeções distintas e pelo uso de moto-neurônio promotores específicos como -3MNX1. A segmentação da soma de células de tais neurônios projectam revelou a degeneração anterógrada ao longo da projeção axonal ao longo do tempo (Figura 4 e Video 1). Imaging resolução de uma única célula de neurônios motores espinhais, adicionalmente confirmada translocação fosfatidilserina e consequente anexina V-rotulagem após a ablação a laser (veja a Figura 4 e Suplementar Video 3 na Referência 27). Embora nós relatamos a ativação de anexina V na morte de neurônios após a nossa abordagem ablação a laser UV, não podemos ter certeza de que a cascata de morte que é acionado durante este processo acelerado corresponde exatamente a morte neuronal que ocorre durante a neurodegeneração ou homeostase celular normal.
Embora esta abordagem ablação é altamente reprodutívele, diferentes estratégias de incorporação específicas podem também afetar a eficiência da ablação UV. Em nossa experiência, foi mais bem sucedido para minimizar a camada de agarose que incorporado o nosso peixe em. Camadas mais espessas de incorporação médio com uma camada adicional de água ovo pode reduzir o poder UV finalmente recebido pelo celular devido à atenuação e efeitos de dispersão que ocorrem ao longo do caminho do feixe.
No futuro, o cruzamento de linhas diferentes de peixes transgénicos irão permitir a visualização do imediato e a curto prazo (até 12 h), as respostas de outras células afectadas, tais como células gliais, para a destruição de células induzida por laser. Por exemplo, astrócitos e toxicidade autónoma não-celular em doenças neurodegenerativas, tais como ALS têm sido o centro das atenções pesquisa e estão fortemente implicados na patogênese da esporádica e familial ALS 37, 38. No entanto, os mecanismos subjacentes a toxicidade e selectividade glialna direção do motor neurônios permanecem obscuros. Nós e outros recentemente levou vantagem dessa abordagem para estudar a imersão de morrer neurônios pela microglia e visualizou a depuração de restos neuronais 27, 39, 40.
Combinando a técnica de ablação com microscopia de alta resolução e marcadores para neuroinflamação permitirá aos investigadores no futuro para expandir a compreensão da função de célula única e sistemas de células interligadas. Caracterização destes processos em um ambiente in vivo é essencial não só em ambientes de desenvolvimento, mas também em modelos de doenças neurodegenerativas, incluindo MND, em que as interacções celulares pode ser prejudicada 3, 41.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
This work was supported by the MND Research Institute of Australia and the Cure for MND Foundation [GIA 1638], the Snow Foundation, and Macquarie University [MQRDG 9201401462]. Imaging was carried out at the Microscopy Facility in the Department of Biomedical Sciences, Macquarie University. Other members of the MND research center are thanked for their contributions to the development of these methods and fish lines.
Materiais
| Name | Company | Catalog Number | Comments |
| Agarose low melting | Fisher-Scientific | Dissolve in egg water with tricaine (0.02%) at 0.8 - 1.5% | |
| Tricaine | Argent Labs | MS-222 | 0.02% |
| Harvard standard wall Borosilicate with filament Capillary Glass | World Precision Instruments, Inc. | GC100F-10 (short) GC100F-15 (long) | Pull to a resistance of 2 - 7 MΩ |
| Egg water | 0.6 g Instant Ocean sea salt, 4 mL of 1 mg/mL methylene blue in 10 L deionized water | ||
| 1-phenyl-2-thiourea (PTU) | Sigma | P7629 | |
| Pronase | Sigma | 10165921001 | |
| Heat block | Select BioProducts | Digital block heater (SBD110_) | |
| Microinjection apparatus | World Precision Instruments, Inc. | Microinjection was performed by hand under a steromicroscope (Leica) with a loaded glass needle and a Picospritzer II (General Valve corporation) | |
| Stereoscope | Leica | Bright field illumination microscopy was performed on a Leica M165FC stereo dissection microscope (Leica) | |
| Microscope | Leica | SP5 | |
| 35 mm glass bottom dish | MatTek Corporation | P35G-0-20-C |
Referências
- Becker, T. S., Rinkwitz, S. Zebrafish as a genomics model for human neurological and polygenic disorders. Dev Neurobiol. 72 (3), 415-428 (2012).
- Wilt, B. A., et al. Advances in light microscopy for neuroscience. Annu Rev Neurosci. 32, 435-506 (2009).
- Philips, T., Robberecht, W. Neuroinflammation in amyotrophic lateral sclerosis: role of glial activation in motor neuron disease. Lancet Neurol. 10 (3), 253-263 (2011).
- Robberecht, W., Philips, T. The changing scene of amyotrophic lateral sclerosis. Nat Rev Neurosci. 14 (4), 248-264 (2013).
- White, D. T., Mumm, J. S. The nitroreductase system of inducible targeted ablation facilitates cell-specific regenerative studies in zebrafish. Methods. 62 (3), 232-240 (2013).
- Jagadeeswaran, P., Paris, R., Rao, P. Laser-induced thrombosis in zebrafish larvae: a novel genetic screening method for thrombosis. Methods Mol Med. 129, 187-195 (2006).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. (54), e2845(2011).
- Matrone, G., et al. Laser-targeted ablation of the zebrafish embryonic ventricle: a novel model of cardiac injury and repair. Int J Cardiol. 168 (4), 3913-3919 (2013).
- Sieger, D., Moritz, C., Ziegenhals, T., Prykhozhij, S., Peri, F. Long-range Ca2+ waves transmit brain-damage signals to microglia. Dev Cell. 22 (6), 1138-1148 (2012).
- Lewis, G. M., Kucenas, S. Motor nerve transection and time-lapse imaging of glial cell behaviors in live zebrafish. J Vis Exp. (76), (2013).
- Rosenberg, A. F., Wolman, M. A., Franzini-Armstrong, C., Granato, M. In vivo nerve-macrophage interactions following peripheral nerve injury. J Neurosci. 32 (11), 3898-3909 (2012).
- Villegas, R., et al. Dynamics of degeneration and regeneration in developing zebrafish peripheral axons reveals a requirement for extrinsic cell types. Neural Dev. 7, 19(2012).
- O'Brien, G. S., et al. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J Vis Exp. (24), (2009).
- Soustelle, L., Aigouy, B., Asensio, M. L., Giangrande, A. UV laser mediated cell selective destruction by confocal microscopy. Neural Dev. 3, 11(2008).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 8 (6), 1000412(2010).
- Essentials of Biology 2. JoVE. , JoVE Science Education Database. Mouse, Zebrafish, and Chick. Zebrafish Microinjection Techniques (2016).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. J Vis Exp. (69), e4196(2012).
- Westerfield, M. The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio).Vol.4th ed. , Univ. of Oregon Press. Eugene. (2000).
- Clark, K. J., Urban, M. D., Skuster, K. J., Ekker, S. C. Transgenic zebrafish using transposable elements. Methods Cell Biol. 104, 137-149 (2011).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Dev Dyn. 236 (11), 3088-3099 (2007).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), (2009).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. J Neurosci. 20 (1), 206-218 (2000).
- Arkhipova, V., et al. Characterization and regulation of the hb9/mnx1 beta-cell progenitor specific enhancer in zebrafish. Dev Biol. 365 (1), 290-302 (2012).
- Flanagan-Steet, H., Fox, M. A., Meyer, D., Sanes, J. R. Neuromuscular synapses can form in vivo by incorporation of initially aneural postsynaptic specializations. Development. 132 (20), 4471-4481 (2005).
- Hall, T. E., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin alpha2-deficient congenital muscular dystrophy. Proc Natl Acad Sci U S A. 104 (17), 7092-7097 (2007).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), 49-56 (2011).
- Morsch, M., et al. In vivo characterization of microglial engulfment of dying neurons in the zebrafish spinal cord. Front. Cell. Neurosci. , (2015).
- Grunwald, D. J., Eisen, J. S. Headwaters of the zebrafish -- emergence of a new model vertebrate. Nat Rev Genet. 3 (9), 717-724 (2002).
- Lele, Z., Krone, P. H. The zebrafish as a model system in developmental, toxicological and transgenic research. Biotechnol Adv. 14 (1), 57-72 (1996).
- Veldman, M. B., Lin, S. Zebrafish as a developmental model organism for pediatric research. Pediatr Res. 64 (5), 470-476 (2008).
- Kabashi, E., et al. Gain and loss of function of ALS-related mutations of TARDBP (TDP-43) cause motor deficits in vivo. Hum Mol Genet. 19 (4), 671-683 (2010).
- Laird, A. S., et al. Progranulin is neurotrophic in vivo and protects against a mutant TDP-43 induced axonopathy. PLoS One. 5 (10), 13368(2010).
- Lemmens, R., et al. Overexpression of mutant superoxide dismutase 1 causes a motor axonopathy in the zebrafish. Hum Mol Genet. 16 (19), 2359-2365 (2007).
- Ramesh, T., et al. A genetic model of amyotrophic lateral sclerosis in zebrafish displays phenotypic hallmarks of motoneuron disease. Dis Model Mech. 3 (9-10), 652-662 (2010).
- Hanneman, E., Trevarrow, B., Metcalfe, W. K., Kimmel, C. B., Westerfield, M. Segmental pattern of development of the hindbrain and spinal cord of the zebrafish embryo. Development. 103 (1), 49-58 (1988).
- Lewis, K. E., Eisen, J. S. From cells to circuits: development of the zebrafish spinal cord. Prog Neurobiol. 69 (6), 419-449 (2003).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. J Cell Biol. 187 (6), 761-772 (2009).
- Philips, T., Rothstein, J. D. Glial cells in amyotrophic lateral sclerosis. Exp Neurol. 262, Pt B 111-120 (2014).
- Mazaheri, F., et al. Distinct roles for BAI1 and TIM-4 in the engulfment of dying neurons by microglia. Nat Commun. 5, 4046(2014).
- van Ham, T. J., Kokel, D., Peterson, R. T. Apoptotic cells are cleared by directional migration and elmo1- dependent macrophage engulfment. Curr Biol. 22 (9), 830-836 (2012).
- Radford, R. A., et al. The established and emerging roles of astrocytes and microglia in amyotrophic lateral sclerosis and frontotemporal dementia. Front Cell Neurosci. 9, 414(2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados