Method Article
Desencadenar el estrés celular y la muerte Uso convencional UV láser confocal Microscopía
En este artículo
Resumen
Targeted manipulations to cause directed stress or death in individual cells have been relatively difficult to accomplish. Here, a single-cell-resolution ablation approach to selectively stress and kill individual cells in cell culture and living animals is described based on a standard confocal UV laser.
Resumen
Using a standard confocal setup, a UV ablation method can be utilized to selectively induce cellular injury and to visualize single-cell responses and cell-cell interactions in the CNS in real-time. Previously, studying these cell-specific responses after injury often required complicated setups or the transfer of cells or animals into different, non-physiological environments, confounding immediate and short-term analysis. For example, drug-mediated ablation approaches often lack the specificity that is required to study single-cell responses and immediate cell-cell interactions. Similarly, while high-power pulsed laser ablation approaches provide very good control and tissue penetration, they require specialized equipment that can complicate real-time visualization of cellular responses. The refined UV laser ablation approach described here allows researchers to stress or kill an individual cell in a dose- and time-dependent manner using a conventional confocal microscope equipped with a 405-nm laser. The method was applied to selectively ablate a single neuron within a dense network of surrounding cells in the zebrafish spinal cord. This approach revealed a dose-dependent response of the ablated neurons, causing the fragmentation of cellular bodies and anterograde degeneration along the axon within minutes to hours. This method allows researchers to study the fate of an individual dying cell and, importantly, the instant response of cells-such as microglia and astrocytes-surrounding the ablation site.
Introducción
Microscopía de fluorescencia se ha utilizado para estudiar los efectos de los transgenes en el pez cebra CNS, en particular sus efectos sobre el desarrollo 1. De alta resolución microscopía ha permitido un mapeo detallado de los procesos celulares implicados en el desarrollo del cerebro, la generación de músculo, y muchos otros eventos de desarrollo 2. El estudio de la muerte de una célula individual ha sido más difícil, debido principalmente a las dificultades técnicas de inducción de la muerte selectiva de células durante los procedimientos de formación de imágenes estándar. Sin embargo, la combinación de la resolución de imagen de una sola célula y técnicas de ablación altamente orientados permite la investigación de las respuestas celulares inmediatas a la tensión y lesión, así como de las interacciones célula-célula consiguientes. La comprensión de estos procesos es crítica, particularmente para enfermedades neurodegenerativas tales como enfermedad de la motoneurona (MND), donde las interacciones neurona-glía han demostrado que contribuyen a la progresiónde la enfermedad 3.
MND, o la esclerosis lateral amiotrófica (ELA), es una enfermedad neurodegenerativa devastadora que afecta a las neuronas motoras en el tronco cerebral, la corteza motora, y la médula espinal. La pérdida de estas neuronas conduce a la pérdida de músculo, y los pacientes mueren dentro de 3 - 5 años de diagnóstico 4. Las neuronas motoras en el enlace de la médula espinal a las fibras musculares y desempeñan un papel esencial en la facilitación de la contracción muscular. La falta de esta comunicación o la muerte de estas neuronas se debilita gradualmente los músculos y afecta a la capacidad del paciente de tragar, caminar, hablar y respirar. La visualización de la muerte de una neurona motora y las consecuencias a corto plazo en un animal vivo proporciona una excelente oportunidad para entender mejor los procesos dinámicos que intervienen en la homeostasis celular normal y la enfermedad.
El pez cebra se han convertido en un sistema de modelo atractivo para estudiar enfermedades neurodegenerativas 1. Estase debe a las ventajas ofrecidas por este organismo modelo, tales como la fertilización externa, tiempo de desarrollo corto, de acceso óptico en el sistema nervioso, y la facilidad de transgénesis. Además, la capacidad de generar fácilmente pez cebra transgénico compuesto permite múltiples estrategias de etiquetado de diferentes tipos de células. La ablación genética se acerca a matar a tipos celulares específicos permiten bastante amplio perturbación, pero carecen de la multa controla la orientación de las células individuales 5. técnicas asistidas por láser, por otro lado, proporcionan un control temporal y espacial fina y se han utilizado para diferentes modelos animales. Mientras que la mayoría de los enfoques utilizar equipos especializados, como el láser 6, 7, 8, 9, 10, 11, 12 o de dos fotones montajes 13 de impulsos, otragrupos de investigación han tomado recientemente las ventajas de un láser UV en los microscopios confocales convencionales 14.
La técnica descrita aquí combina alta resolución de la microscopía confocal con un enfoque de láser mediada por UV para causar estrés celular o la muerte de una forma dependiente de la dosis en las neuronas motoras seleccionados. Se basa en el uso del láser comúnmente instalado 405-nm, ha sido probado con éxito en cultivos celulares y en animales vivos, y permite la caracterización detallada de las interacciones celulares, tales como aclaramiento microglial después de la muerte neuronal.
Protocolo
NOTA: El diseño, la realización y presentación de informes de experimentos con animales deben tener en cuenta las directrices actuales 15. Este tipo de trabajo debe ser aprobado previamente por la autoridad local de bienestar de los animales (en nuestro caso, el Comité de Ética Animal de la Universidad de Macquarie).
1. Preparar el pez cebra para el montaje y la ablación de la célula UV
- Generar el pez cebra (Danio rerio) que expresan proteínas fluorescentes.
- Para expresar las proteínas fluorescentes de interés en el pez cebra, realizar inyecciones plásmido en el estadio de una célula del huevo del pez cebra (como se describe en otra parte 16) o utilizar líneas transgénicas fluorescentes. Para etiquetar múltiples tipos de células, crear líneas de pez cebra transgénico compuestos por el cruce de las líneas transgénicas establecidas pertinentes a la cuestión de interés. Coloque un macho y una hembra de pez cebra en cada lado del tanque de un par de falsos parte inferior de apareamiento en la noche y quitar el divisor con el comienzo de la luza la mañana siguiente (como se detalla en otro lugar 17). Mantenga el pez cebra a 28 ° C y manejarlos de acuerdo con los protocolos establecidos 17, 18.
- Recoger los embriones después de la siembra con éxito por el esfuerzo del agua del tanque que contiene los embriones a través de un colador de té de plástico. Enjuagar los huevos con agua del sistema y transferirlos en agua de huevo en una placa de Petri.
- Examinarlas con un microscopio óptico para determinar la fertilización. Tienda de los huevos fertilizados en una placa de Petri y colocarlos en una incubadora a 28 ° C 18.
- Opcional: Realice una microinyección para etiquetar las poblaciones de células específicas.
NOTA: Este es un método alternativo que permite la expresión y la visualización de las proteínas, sin la necesidad de elevar las líneas transgénicas estables. Este método también es ventajoso cuando la proteína de interés es tóxico y prohíbe la generación de un trans establelíneas génicas.- Inyectar las construcciones de plásmidos en la etapa de células de embriones de pez cebra, como se describe en otra parte 19, 20, 21.
NOTA: Este método da como resultado la expresión del mosaico de la proteína de interés. La proteína de interés se controla desde un promotor de elección (por ejemplo, Islet1 22, -3mnx1 23, 24, 25 conocido, o MPEG1 26) flanqueado por repeticiones invertidas Tol2 20.
- Inyectar las construcciones de plásmidos en la etapa de células de embriones de pez cebra, como se describe en otra parte 19, 20, 21.
- La edad de los peces al tamaño deseado.
- Elevar el pescado a 3 - 5 días después de la fertilización (DPF) y colocarlos bajo un microscopio compuesto fluorescente. Se tamizan los animales para la expresión fluoróforo apropiado y seleccionar los peces vivos marcado. Separar las larvas apropiada en otro plato de huevos con agua para incrustar finalesr en (la tienda en una incubadora a 28 °).
Opcionales: Los embriones se pueden colocar en una 1-fenil-2-thioures solución (PTU) Ringers 0,2 mM a 24 h después de la fecundación (HPF) para inhibir la formación de la pigmentación. Se debe tener cuidado con PTU, ya que es tóxico y puede tener fisiológico adverso, genética, o efectos morfológicos. - Para los estudios en una etapa temprana de desarrollo (<2 dpf), dechorionate los embriones de forma manual utilizando unas pinzas cortantes. Dechorionate gran número de embriones enzimáticamente mediante la adición de pronasa (2 mg / ml) para el agua de huevo y su incubación durante 10 min a 28 ° C.
- Pasar los embriones periódicamente a través de una pipeta Pasteur de plástico para facilitar dechorionation. Terminar el proceso cuando la mayoría de los embriones han surgido de sus chorions por lavado varias veces con agua huevo.
- Elevar el pescado a 3 - 5 días después de la fertilización (DPF) y colocarlos bajo un microscopio compuesto fluorescente. Se tamizan los animales para la expresión fluoróforo apropiado y seleccionar los peces vivos marcado. Separar las larvas apropiada en otro plato de huevos con agua para incrustar finalesr en (la tienda en una incubadora a 28 °).
- Preparar soluciones para la incrustación de pez cebra en agarosa.
- Preparar una solución de la anestesia mediante la adición de 4 g / L MS222 (solución madre tricaína, pH 7,0)gota a gota a una placa de Petri que contiene agua de huevo. Una dosis de 50 mg / L es un punto de partida recomendada (Figura 1A).
- Preparar un stock de agarosa de bajo punto de fusión (0,8 a 1,5%) en agua de huevo y alícuota en tubos de microcentrífuga de 1,5 ml. Colocar una alícuota en un bloque térmico precalentado (38 - 40 ° C) y dejar que se equilibre a la temperatura establecida (~ 30 min; Figura 1B).
- Opcional: Para imágenes a más largo plazo (> 4 h), preparar un pequeño círculo de agarosa dentro de la placa de Petri con fondo de vidrio de 35 mm y permitir que fije (Figura 1).
NOTA: Este paso adicional fue eficaz para evitar cualquier movimiento de toda la caída de agarosa con el pez cebra en marcos temporales más.- Para ello, el lugar ~ 300 l de agarosa a lo largo del círculo interno del plato con fondo de vidrio para preparar un círculo en forma de rosquilla con una pequeña abertura en el medio en el que colocar el pescado (paso 1.5.3, que complementa la figura 1) .
- Montar el pez cebra en agarosa para microscopía.
- Seleccionar 1 - 3 de los peces pre-seleccionados para la ablación y anestesiar las larvas mediante la transferencia de ellos (usando una pipeta de transferencia) en un plato con la solución de la anestesia (etapa 1.4.1; Figura 1C; aproximadamente 5 min).
NOTA: El pescado se anestesian cuando muestran un movimiento opercular poco profundas y un ritmo cardíaco disminuido y ya no muestran una respuesta de escape toque evocados (TEER; fallas en la natación de distancia después de tocar suavemente su cola con un pincel). Garantizar la anestesia apropiada para el tratamiento ético de los peces y para prevenir espasmos en la transferencia en agarosa o exposición a la luz fluorescente. - Después de que se confirmó la anestesia, aspirar una larva utilizando una pipeta ajustable (con una punta de 200 l de corte ajustado a ~ 30 l) y dejar que se hunda hasta el fondo de la punta. Transferir la larva en agarosa precalentado (paso 1.4.2) mediante la liberación de una gota de líquido con lalarva en la agarosa (tratar de minimizar la cantidad de agua de huevo de entrar en la agarosa; Figura 1D).
- Aspirar el pescado rodeado de agarosa. Dispensarla rápidamente en el plato de 35 mm con fondo de vidrio previamente preparada.
- Utilizar un microscopio de disección y un pincel de pintura estándar (palangrero, tamaño 1) en la posición del animal dentro de la agarosa en el lado (cabeza hacia la izquierda) para que el cuerpo y la cola son planas (Figura 1E). Si se trabaja con pescado múltiple, alinear todos los peces en el plato de manera que se encuentran fácilmente usando el microscopio confocal más adelante.
NOTA: realizar rápidamente este procedimiento de posicionamiento y alineación (que puede requerir un poco de práctica, como la agarosa empieza a ponerse inmediatamente después de la exposición a temperaturas más frías). - Deja a los peces de agarosa embebidos durante 10 - 15 min hasta que la agarosa se establece con firmeza. Arriba con cuidado el plato de Petri de 35 mm con ~ 2 ml de agua que contiene el huevo tricaína (Figura 1F).
- Seleccionar 1 - 3 de los peces pre-seleccionados para la ablación y anestesiar las larvas mediante la transferencia de ellos (usando una pipeta de transferencia) en un plato con la solución de la anestesia (etapa 1.4.1; Figura 1C; aproximadamente 5 min).
2. Establecer el microscopio confocal y parámetros de imagen
- Coloque la placa de Petri con la larva incrustado en la platina del microscopio confocal y se centran en el lado dorsal de la médula espinal de los animales (con campo brillante). Examine el animal con arreglo a la ampliación apropiada (40X) y el ajuste fluorescente y visualizar la estructura de interés (por ejemplo, la intensidad de fluorescencia de las neuronas marcadas o el movimiento de la microglia) para confirmar que todos los parámetros de imagen son tan necesarios para la ablación subsiguiente (Figura 2). Como rutina usamos el objetivo de 40X para realizar nuestros estudios de lapso de tiempo.
- Opcional: Para llevar a cabo un estudio de lapso de tiempo de varias horas, es recomendable grabar un único o unos pocos puntos de tiempo antes de la ablación para establecer la respuesta fisiológica no perturbada de la célula y su entorno (por ejemplo, el movimiento de la microglia para establecer la velocidad de la línea de base y la motilidad).
- Determine el espesor de la structure de interés para la ablación con láser UV.
- El uso de la z-drive, verificar la parte superior e inferior de la estructura de interés (por ejemplo, el soma celular), centrándose manualmente hacia arriba y abajo. Anotar el plano z que se realiza la ablación (por ejemplo, el centro de la célula).
NOTA: A partir de la experiencia, este método es más eficaz por la orientación neuronas de la médula espinal que fueron etiquetados brillantes (una alta relación señal-ruido que permite una fácil visualización de lapso de tiempo después de la ablación, por ejemplo, la Figura 4) y mediante la ablación de la mitad de la soma celular. fluorescencia núcleo de la célula puede ser de ventaja para asegurar la orientación correcta y de alta eficiencia de la ablación.
- El uso de la z-drive, verificar la parte superior e inferior de la estructura de interés (por ejemplo, el soma celular), centrándose manualmente hacia arriba y abajo. Anotar el plano z que se realiza la ablación (por ejemplo, el centro de la célula).
3. Realizar Targeted ablación con láser de las células individuales en la médula espinal de pez cebra
NOTA: Para este enfoque de ablación y la visualización, se utilizó un microscopio confocal (Leica SP5). El procedimiento de ablación utilizando un diodo de 405 nm para dest específico de la célularuction se detalla según el software (Leica Application Suite, v2.7.3.9723). Sin embargo, cualquier microscopio confocal convencional que está equipado con un láser de 405 nm y un (recuperación después de fluorescencia photobleaching) FRAP o módulo blanqueador permitirá que el rendimiento de las mismas manipulaciones celulares, pero potencialmente con un poco diferentes ajustes, parámetros, y nombres.
- Iniciar el asistente FRAP haciendo clic en el menú desplegable en la parte superior del menú de software (Figura 3A, 1 y 2). Observar una nueva ventana con diferentes pasos que permite la puesta en marcha de los parámetros específicos para la ablación por láser (Figura 3B, 3).
- Determinar los parámetros de la imagen para el enfoque de ablación por seleccionar el formato, la velocidad de exploración (Figura 3B, 4), y promediando (Figura 3B, 5). Un formato de imagen de 1024 x 1024 a una velocidad de barrido de 400 Hz y una líneapromedio de 4 era más aplicable.
NOTA: Generalmente no hay necesidad de cambiar la detección espectral (tales como los parámetros de excitación o de emisión), ya que se han determinado en la adquisición anterior.- Si todavía no se ha seleccionado el plano z para la ablación (como se describe en el paso 2.4.), Pulsar el botón "vivo" y se centran través de la muestra hasta que la estructura fluorescente o el plano z deseada que va a ser sometida a ablación es enfocado.
- Una vez establecidos los parámetros de la imagen en general, acceder a la etapa de "Bleach" (Figura 3C, 6) para controlar los componentes específicos de ablación.
NOTA: una combinación de la intensidad del láser (Figura 3C, 8), la velocidad de exploración, y el cálculo del promedio que se ha establecido en el paso 3.2 (Figura 3B, 4 y 5), así como el número de repeticiones que se encuentra en paso 3.5 (Figura 3E,12), va a determinar el tiempo total de permanencia del láser UV en el retorno de la inversión, y por lo tanto, la eficacia de blanqueo.- Enganche el láser de 405 nm mediante la activación por el procedimiento de blanqueo (Figura 3C, 8).
NOTA: La mayor éxito con los ajustes antes mencionados se logró con intensidades de láser 405 nm entre el 60 - 80% en nuestra configuración experimental. Tenga en cuenta que esta salida de potencia del láser es el instrumento específico y será diferente para cada configuración confocal. - Utilice el "zoom in" opción (Figura 3C, 7) para maximizar la intensidad de blanqueo en la ROI seleccionada mediante la reducción del campo de lectura, por lo tanto, maximizar el tiempo de permanencia. Como alternativa, utilice la opción de "punto de Bleach" del software de elección para este proceso.
- Enganche el láser de 405 nm mediante la activación por el procedimiento de blanqueo (Figura 3C, 8).
- Seleccione una o varias regiones de interés (Figura 3D, 10) para la ablación mediante el uso de cualquiera de las herramientas de dibujo en el viento de adquisición de imágenesow (Figura 3D, 9). Objetivo para el axón, por ejemplo, con la herramienta de dibujo circular de aproximadamente 4-8 micras.
Nota: El área de ablación es ajustable de un solo píxel de un área mayor, dependiendo de la aplicación. - Después de establecer la ROI, seleccione el botón "Lapso de tiempo" (Figura 3E, 11) y confirmar el número de ciclos de las ROI se analizarán los / ablación (Figura 3E, 12). Selecciona los marcos "Post-Bleach" "Preblanqueador" y como se desee para permitir una visión general de toda la imagen justo antes e inmediatamente después de que el proceso de blanqueo.
- Después de establecer todos los parámetros de ablación necesarias, presione "Ejecutar Experimento" (Figura 3E, 13) y controlar la eficacia de la ablación.
NOTA: En nuestra configuración FRAP, una sola imagen será tomada antes y después del ciclo de FRAP con la adecuada e láserxcitation (por ejemplo, 488 nm de excitación para las células EGFP-expresión). Estas imágenes pre y post ablación permiten un juicio rápido del grado de satisfacción con el retorno de la inversión se blanqueó y cuán efectivos eran los parámetros de ablación elegidos. - Repetir el proceso mediante el ajuste de la intensidad del láser (Figura 3C, 8), velocidad de exploración y el promedio (Figura 3B, 4 y 5), y las repeticiones (Figura 3E, 12) en caso de que el retorno de la inversión fija seleccionada muestra una alta intensidad de fluorescencia después de la finalización de la ciclo FRAP.
4. Realice el procedimiento de seguimiento, incluidos los peces "rescate" o eliminación
- Si el experimento es terminal, la eutanasia a los animales con una sobredosis de tricaína. Eliminar el agua de huevo y reemplazarlo con solución de anestesia durante 10 minutos. Para garantizar la eutanasia, comprobar bajo el microscopio para el cese de los latidos del corazón.
- Opcional:Si el experimento no es terminal, quitar el pescado con cuidado de la agarosa con unas pinzas finas y un cepillo. Coloque el pescado en agua fresca al huevo y permitir que se recupere en observación durante 15 min. Si el comportamiento normal de la natación regresa, regresa a los peces a la incubadora.
- Desechar los animales transgénicos de acuerdo con la corriente de residuos de OGM aprobados de la institución.
Resultados
El método aquí descrito permite la ablación de las neuronas motoras en la médula espinal de pez cebra mediante el módulo de FRAP de un microscopio confocal comercial. Líneas de pez cebra transgénico que expresan una proteína fluorescente verde en las neuronas bajo el control de promotores específicos, tales como - 3mnx1, Islet1, o se reunieron, se utilizaron. La expresión de GFP dirigido por el promotor de la neurona motora (como -3mnx1 o Met) permite la visualización de alta resolución de los cuerpos celulares, las principales axones, y las ramas periféricas que se extienden a los músculos (Figura 4 y de vídeo 1).
Las neuronas de la médula espinal de los peces de 3 a 5 días de edad, han sido ablación con éxito, con un tiempo total de permanencia de 60 - 80 s con una potencia de láser de ~ 70% y la configuración general descrito en el paso 3. La ablación efectiva es logra cuando la fluorescencia se desvanece inmediatamente después de la ablacióny nunca se reanuda (Figura 5, C y D). Los intentos de ablación con otras líneas de láser (por ejemplo, la línea de láser de 488 nm) no dieron como resultado la decoloración permanente, y la fluorescencia fue restaurada dentro de cortos periodos de tiempo. Es importante destacar que esta técnica demostró rasgos característicos de la muerte celular apoptótica en las neuronas ablación UV, tales como la presencia de Anexina V, cambios morfológicos consistentes de degeneración Somal, y formación de ampollas en axonal de la neurona separada por ablación 27.
La especificidad de este enfoque se confirma en los experimentos utilizando el fluoróforo fotoconvertible Kaede (que conmuta su emisión de verde a rojo después de la exposición a la luz UV), en el que se convierte una sola neurona específica (Figura 5, A y B) sin signos de celular destrucción durante varias horas. El uso de un láser de potencia más alto en lugar conduce to la extinción de la neurona objetivo (no fotoconversión o reaparición de fluorescencia) y fotoconversión (sin muerte) de las células en estrecha proximidad (~ 20 m) para el sitio de la ablación (Figura 5, C y D).
Una ventaja importante de esta técnica de ablación inducida por láser es la dependencia de la dosis del enfoque. Para dirigirse a las células con diferentes intensidades, múltiples capas de ajuste fino están disponibles mediante el ajuste de la potencia del láser (Figura 3C, 8), la velocidad y el promedio de línea de exploración (Figura 3B, 4 y 5), el tamaño de la ROI que se realiza la ablación (Figura 3D, 10), y las repeticiones (Figura 3E, 12). En particular, este enfoque también se puede utilizar para aplicar estrés celular a las células individuales en lugar de inducir la muerte celular. Por ejemplo, puesta a punto ha sidomuy valiosa para evaluar procesos celulares durante la muerte de una neurona. Las neuronas motoras con proyecciones axonales largas que fueron ablated con intensidades de láser inferior UV revelaron característica "formación de ampollas" (la formación y la fragmentación de las vesículas celulares), que se inició en el soma dirigida y continuó a lo largo del axón con el tiempo (40 - 90 minutos; la Figura 4 ; 3D representa la película de este ablación en video 1). En consecuencia, la modulación de los diferentes parámetros de ablación láser y por lo tanto el nivel de estrés celular inducido y el curso temporal de la muerte permite a los investigadores un alto nivel de flexibilidad experimental.
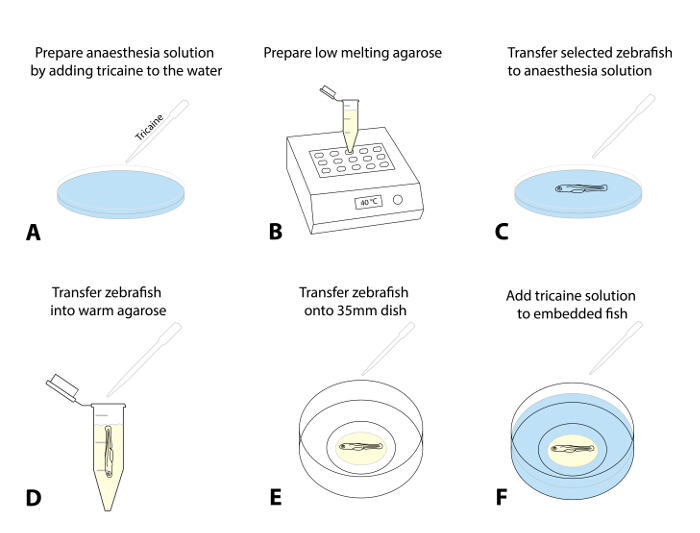
Figura 1: Incorporación de pez cebra para imágenes en vivo. (AF) Incorporación procedimiento de formación de imágenes en directo: (A) Tricaína se añade al agua de huevo para anestesiar el pez cebra una ta tasa de dosis inicial de 50 mg / L. (B) de agarosa de bajo punto de fusión (0,8 a 1,5%) se prepara y se calienta hasta 38 - 40 ° C. (C) El uso de una pipeta de transferencia, el pez cebra evaluado y seleccionado se transfiere a un plato con una solución de tricaína. Después de la sedación éxito (movimiento opercular superficial, disminución del ritmo cardíaco, la falta de una respuesta táctil evocados), un pez se transfiere a la agarosa precalentado (D). Reducir al mínimo la cantidad de agua que se transfiere de huevo en la agarosa para evitar la dilución posterior. (E) Transferencia de una gota de agarosa (~ 30 - 50 l) que contiene el pez cebra en una placa con fondo de vidrio 35-mm. Realice esto bajo un microscopio de disección y utilizar un cepillo para alinear suavemente el pez cebra para su orientación preferida. Espere 10 a 15 min, hasta que se establece la agarosa, y añadir ~ 2 ml de solución de tricaína al plato (F).ank "> Haga clic aquí para ver una versión más grande de esta figura.
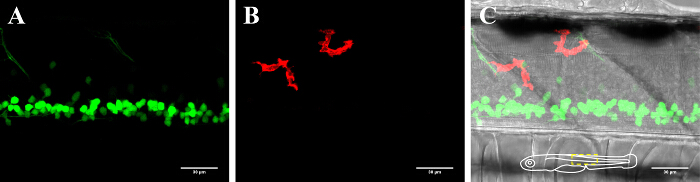
Figura 2: La visualización de las neuronas y la microglia en la médula espinal de un pez cebra 3-dpf. Visualización de microglia y neuronas en la médula espinal de un 3 días de edad, el pez cebra transgénico que expresa neuronas positivas para GFP (A) (Islet1: GFP) y (B) mCherry-positivas microglia (MPEG1: GAL4, UAS: mCherry). (C) Imagen compuesta del canal de neuronas y la microglia imagen del campo brillante junto con. El inserto esquemática en (C) muestra la orientación de los peces y describe el área presentada. Barra de escala = 30 micras. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Pasos en el proceso de ablación por láser UV (como se indica en el protocolo, paso 3). Pasos para controlar el módulo de software FRAP en el software confocal (Leica Application Suite). (A) A partir del módulo de FRAP como una herramienta para llevar a cabo la ablación por láser UV. (B) Configuración del plano z para la configuración de ablación y otra FRAP como el formato, la velocidad, y el promedio, que determinarán el tiempo de permanencia del láser. (C) El control de la intensidad del láser y el "zoom in" opción para maximizar la eficiencia de blanqueo. (D) Selección de una o varias regiones de interés (ROI) que se realiza la ablación. (E) Ajuste de la evolución en el tiempo de blanqueo determina los ciclos de blanqueo y el tiempo total de permanencia de láser en las regiones de interés. Por favor, haga clic en ella e para ver una versión más grande de esta figura.
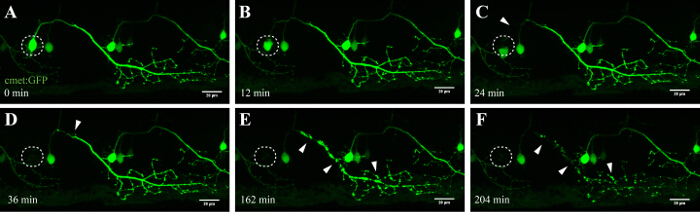
Figura 4: la degeneración anterógrada de una neurona ablación por UV. Time-lapse de la neurodegeneración de una neurona espinal ablación UV. (AF) irradiación UV de una sola neurona espinal (conocido: GAL4, UAS: EGFP; A; círculo) dio lugar a la soma de la neurona contracción y redondeo en el tiempo (AC), seguido por la fragmentación axonal (CF; puntas de flecha) . La degeneración axonal comenzó en el soma (sitio de la ablación) y progresó anterógrada hacia el extremo distal del axón hasta que finalmente, la fluorescencia en el soma desapareció y todo el axón mostró "blebbing" (DF). Barras de escala = 20 m. La película de lapso de tiempo 3D renderizada de esta ablación se muestra en vídeo 1.en / ftp_upload / 54983 / 54983fig4large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
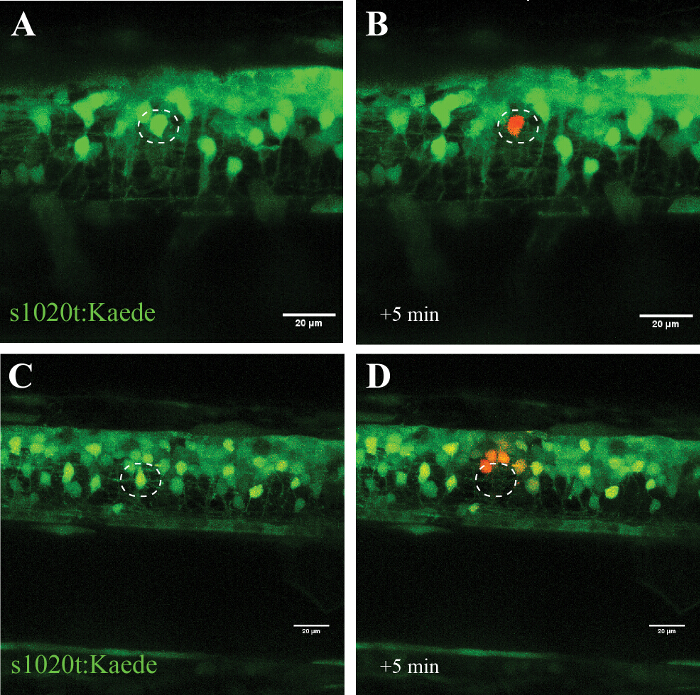
Figura 5: Confirmación del efecto de la irradiación UV de una sola célula usando un fluoróforo fotoconvertible (Kaede) en una neurona motora. Validación de la irradiación UV de una sola célula a través de la activación del fluoróforo fotoconvertible Kaede en una neurona. (AD) la irradiación UV de neuronas marcadas con Kaede. (A) Fotoconversión de una sola neurona (círculo) con una potencia de láser de 30% durante 10 s llevó a fotoconversión de Kaede (de verde a rojo) sólo en la neurona individuo afectado (B). Tenga en cuenta que la célula convertida sobrevivió durante varias horas y no mostró signos visuales de deterioro, tales como formación de ampollas o de redondeo hacia arriba. La ablación de una sola neurona (C ; círculo) con una potencia de láser más alto (95% durante 10 s) resultó en la desaparición inmediata de esa neurona (D) y la posterior fotoconversión de Kaede en un pequeño número de neuronas circundantes dentro de un radio de aproximadamente 20 micras. Barras de escala = 20 m. Haga clic aquí para ver una versión más grande de esta figura.
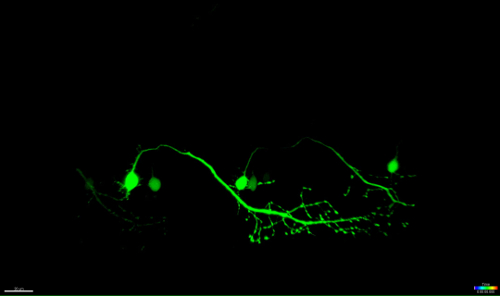
Video 1: Representación de superficie 3D (Imaris) de la neurona UV ablación ilustrado en la Figura 4.
El vídeo de lapso de tiempo de la neurona se muestra en la Figura 4 es la superficie mostrada usando un software de visualización (Imaris, Bitplane). Se destaca el proceso de contracción del soma separada por ablación, seguido por la fragmentación axonal anterogradely hacia el extremo distal de la célula.euron_ablation-3D_rendered.mov "target =" _ blank "> Haga clic aquí para descargar este archivo.
Suplementaria Figura 1: reparto de agarosa opcional para imágenes en tiempo largo.
Para evitar el movimiento de los peces y la agarosa durante la adquisición a largo plazo a preparar un donut en forma de círculo de agarosa a lo largo de los bordes en el centro de la placa de 35 mm con fondo de vidrio (A). Deje que el conjunto de agarosa durante ~ 10 min y se transfirió el pescado en el círculo interior con una gota de agarosa (B). Trate de minimizar la cantidad de agarosa para la incrustación (cepillar el exceso de agarosa al exterior después de orientar el pescado). Por favor, haga clic aquí para descargar este archivo.
Discusión
Enfoques de láser de ablación
Las técnicas de ablación por láser asistida permiten la orientación precisa de los grupos individuales o pequeños de células. La combinación de esta técnica con microscopía de alta resolución y las manipulaciones genéticas en modelos animales, tales como el pez cebra permite a los investigadores estudiar sistemáticamente el destino de una célula individual y las interacciones después de la lesión.
El protocolo de la ablación con láser UV (405 nm) que se describe aquí se describe cómo las células individuales se puede enfatizar o mueren selectivamente (de una manera dependiente de la dosis), mientras que la vecina neuronas, glia, y los axones se dejan ilesos. Hemos utilizado con éxito este enfoque en experimentos de cultivo celular y describir aquí el enfoque detallado para la médula espinal de pez cebra. Se demuestra la aplicación de este enfoque en la médula espinal pez cebra haciendo hincapié selectivamente una neurona individual dentro de una red de otras células (Figura 5, A y B), o matando a una sola neurona de inmediato y sin recuperación (Figura 5, C y D).
Anteriormente, los sistemas láser especializados, tales como láser pulsado-nitrógeno o sistemas de láser de dos fotones, se requirieron para inducir daño en los tejidos y cortes transversales 10, 11, 12, 13 de los nervios motores. Estos sistemas de láser se han utilizado con éxito para causar daño a las células, tales como la trombosis en arterias y venas 6, la lesión renal aguda 7, lesión cardiaca 8, y para estudiar las ondas de calcio y la respuesta microglial después de la lesión cerebral 9. Por otra parte, Soustelle y sus colegas utilizaron una configuración confocal convencional (351 nm y 364 nm láseres UV) para inducir daño epitelial y células gliales en Drosophila 14 </ Sup>.
La relevancia de los modelos de pez cebra para la comprensión de la ELA (y otras enfermedades humanas)
El pez cebra es un organismo modelo ampliamente utilizado, especialmente para estudios de desarrollo 28, 29, 30. Si bien tienen ciertas limitaciones, su potencial para modelar enfermedades humanas y dará una comprensión de los mecanismos moleculares patogénicos es enorme. Modelos de pez cebra han sido bien establecido para el estudio de la EMN y han dado lugar a importantes conocimientos moleculares 31, 32, 33, 34. líneas de pez cebra transgénico se pueden generar rápidamente (4 - 5 meses) y permiten que el seguimiento selectiva de un tipo específico de célula, las características que los hacen una valiosa adición a los modelos animales actuales de ALS hacen. embriones de pez cebra / larvas son ópticamente transparentes y ofrecen expe únicoventajas mentales que permiten-imágenes en vivo a largo plazo a nivel de una sola célula en el cerebro o la médula espinal, que no se pueden conseguir fácilmente en modelos de roedores (o en los seres humanos). Cuando se combina con técnicas moleculares, tales como la ablación de una sola célula, esto proporciona una plataforma experimental único para el estudio de los mecanismos moleculares precisos in vivo.
Las neuronas motoras pueden ser selectivamente que se hayan empleado ablación con láser UV
Neuronas de la médula en el pez cebra empiezan a desarrollarse dentro de 10 horas después del nacimiento y se establecieron después de aproximadamente 48 h 35, 36. Este rápido desarrollo permite la visualización de estas neuronas en cortos periodos de tiempo y con un alto rendimiento. Las neuronas motoras proporcionan el vínculo esencial entre el cerebro y los músculos y, en la ELA, se ven afectados en la corteza motora (neuronas motoras superiores), el tronco cerebral y la médula espinal (neuronas motoras inferiores). La pérdida de estas neuronas conduce inevitablemente a la muLa atrofia y debilidad Escleritos. Las neuronas motoras en la médula espinal de pez cebra se pueden identificar por sus proyecciones distintas y por el uso de motor de neuronas promotores específicos como -3MNX1. Orientación de la soma celular de tales neuronas que se proyectan reveló la degeneración anterógrada a lo largo de la proyección axonal en el tiempo (Figura 4 y de vídeo 1). Una sola célula de imágenes de resolución de las neuronas motoras espinales, además, confirmó la translocación de fosfatidilserina y Anexina V-consiguiente etiquetado después de la ablación por láser (véase la figura 4 y complementaria de vídeo 3 en la Referencia 27). A pesar de que se presenta la activación de Anexina V al morir las neuronas después de nuestro enfoque de la ablación por láser UV, no podemos estar seguros de que la cascada de la muerte que se activa durante este proceso acelerado coincide exactamente con la muerte neuronal que se produce durante la neurodegeneración o la homeostasis celular normal.
Si bien este enfoque ablación es altamente reproducibley, diferentes estrategias específicas de incrustación también pueden afectar a la eficacia de la ablación UV. En nuestra experiencia, fue más exitoso para reducir al mínimo la capa de agarosa que inmersos nuestros peces en. Las capas más gruesas de medio de inclusión con una capa adicional de agua de huevo puede reducir la potencia de los rayos UV finalmente recibida por la célula debido a la atenuación y los efectos de dispersión que se producen a lo largo de la trayectoria del haz.
En el futuro, el cruce de líneas diferentes de peces transgénicos permitirá la visualización de lo inmediato y de corto plazo (hasta 12 h) las respuestas de otras células afectadas, tales como células gliales, a la destrucción celular inducida por láser. Por ejemplo, los astrocitos y la toxicidad autónoma no celular en enfermedades neurodegenerativas como la ELA han sido el centro de atención de investigación y están fuertemente implicados en la patogenicidad de la ELA esporádica y familiar 37, 38. Sin embargo, los mecanismos subyacentes toxicidad glial y selectividadhacia el motor neuronas siguen sin estar claros. Nosotros y otros recientemente tomó ventaja de este enfoque para estudiar el entrampamiento de morir neuronas por la microglía y se visualizó la limpieza de los restos neuronales 27, 39, 40.
La combinación de la técnica de ablación con microscopía de alta resolución y marcadores para la neuroinflamación permitirá a los investigadores en el futuro para ampliar la comprensión de la función de las células individuales y sistemas de células interconectadas. La caracterización de estos procesos en un entorno in vivo es fundamental no sólo en los entornos de desarrollo, sino también en modelos de enfermedades neurodegenerativas, incluyendo la MND, donde las interacciones celulares pueden deteriorarse 3, 41.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
This work was supported by the MND Research Institute of Australia and the Cure for MND Foundation [GIA 1638], the Snow Foundation, and Macquarie University [MQRDG 9201401462]. Imaging was carried out at the Microscopy Facility in the Department of Biomedical Sciences, Macquarie University. Other members of the MND research center are thanked for their contributions to the development of these methods and fish lines.
Materiales
| Name | Company | Catalog Number | Comments |
| Agarose low melting | Fisher-Scientific | Dissolve in egg water with tricaine (0.02%) at 0.8 - 1.5% | |
| Tricaine | Argent Labs | MS-222 | 0.02% |
| Harvard standard wall Borosilicate with filament Capillary Glass | World Precision Instruments, Inc. | GC100F-10 (short) GC100F-15 (long) | Pull to a resistance of 2 - 7 MΩ |
| Egg water | 0.6 g Instant Ocean sea salt, 4 mL of 1 mg/mL methylene blue in 10 L deionized water | ||
| 1-phenyl-2-thiourea (PTU) | Sigma | P7629 | |
| Pronase | Sigma | 10165921001 | |
| Heat block | Select BioProducts | Digital block heater (SBD110_) | |
| Microinjection apparatus | World Precision Instruments, Inc. | Microinjection was performed by hand under a steromicroscope (Leica) with a loaded glass needle and a Picospritzer II (General Valve corporation) | |
| Stereoscope | Leica | Bright field illumination microscopy was performed on a Leica M165FC stereo dissection microscope (Leica) | |
| Microscope | Leica | SP5 | |
| 35 mm glass bottom dish | MatTek Corporation | P35G-0-20-C |
Referencias
- Becker, T. S., Rinkwitz, S. Zebrafish as a genomics model for human neurological and polygenic disorders. Dev Neurobiol. 72 (3), 415-428 (2012).
- Wilt, B. A., et al. Advances in light microscopy for neuroscience. Annu Rev Neurosci. 32, 435-506 (2009).
- Philips, T., Robberecht, W. Neuroinflammation in amyotrophic lateral sclerosis: role of glial activation in motor neuron disease. Lancet Neurol. 10 (3), 253-263 (2011).
- Robberecht, W., Philips, T. The changing scene of amyotrophic lateral sclerosis. Nat Rev Neurosci. 14 (4), 248-264 (2013).
- White, D. T., Mumm, J. S. The nitroreductase system of inducible targeted ablation facilitates cell-specific regenerative studies in zebrafish. Methods. 62 (3), 232-240 (2013).
- Jagadeeswaran, P., Paris, R., Rao, P. Laser-induced thrombosis in zebrafish larvae: a novel genetic screening method for thrombosis. Methods Mol Med. 129, 187-195 (2006).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. (54), e2845(2011).
- Matrone, G., et al. Laser-targeted ablation of the zebrafish embryonic ventricle: a novel model of cardiac injury and repair. Int J Cardiol. 168 (4), 3913-3919 (2013).
- Sieger, D., Moritz, C., Ziegenhals, T., Prykhozhij, S., Peri, F. Long-range Ca2+ waves transmit brain-damage signals to microglia. Dev Cell. 22 (6), 1138-1148 (2012).
- Lewis, G. M., Kucenas, S. Motor nerve transection and time-lapse imaging of glial cell behaviors in live zebrafish. J Vis Exp. (76), (2013).
- Rosenberg, A. F., Wolman, M. A., Franzini-Armstrong, C., Granato, M. In vivo nerve-macrophage interactions following peripheral nerve injury. J Neurosci. 32 (11), 3898-3909 (2012).
- Villegas, R., et al. Dynamics of degeneration and regeneration in developing zebrafish peripheral axons reveals a requirement for extrinsic cell types. Neural Dev. 7, 19(2012).
- O'Brien, G. S., et al. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J Vis Exp. (24), (2009).
- Soustelle, L., Aigouy, B., Asensio, M. L., Giangrande, A. UV laser mediated cell selective destruction by confocal microscopy. Neural Dev. 3, 11(2008).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 8 (6), 1000412(2010).
- Essentials of Biology 2. JoVE. , JoVE Science Education Database. Mouse, Zebrafish, and Chick. Zebrafish Microinjection Techniques (2016).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. J Vis Exp. (69), e4196(2012).
- Westerfield, M. The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio).Vol.4th ed. , Univ. of Oregon Press. Eugene. (2000).
- Clark, K. J., Urban, M. D., Skuster, K. J., Ekker, S. C. Transgenic zebrafish using transposable elements. Methods Cell Biol. 104, 137-149 (2011).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Dev Dyn. 236 (11), 3088-3099 (2007).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), (2009).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. J Neurosci. 20 (1), 206-218 (2000).
- Arkhipova, V., et al. Characterization and regulation of the hb9/mnx1 beta-cell progenitor specific enhancer in zebrafish. Dev Biol. 365 (1), 290-302 (2012).
- Flanagan-Steet, H., Fox, M. A., Meyer, D., Sanes, J. R. Neuromuscular synapses can form in vivo by incorporation of initially aneural postsynaptic specializations. Development. 132 (20), 4471-4481 (2005).
- Hall, T. E., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin alpha2-deficient congenital muscular dystrophy. Proc Natl Acad Sci U S A. 104 (17), 7092-7097 (2007).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), 49-56 (2011).
- Morsch, M., et al. In vivo characterization of microglial engulfment of dying neurons in the zebrafish spinal cord. Front. Cell. Neurosci. , (2015).
- Grunwald, D. J., Eisen, J. S. Headwaters of the zebrafish -- emergence of a new model vertebrate. Nat Rev Genet. 3 (9), 717-724 (2002).
- Lele, Z., Krone, P. H. The zebrafish as a model system in developmental, toxicological and transgenic research. Biotechnol Adv. 14 (1), 57-72 (1996).
- Veldman, M. B., Lin, S. Zebrafish as a developmental model organism for pediatric research. Pediatr Res. 64 (5), 470-476 (2008).
- Kabashi, E., et al. Gain and loss of function of ALS-related mutations of TARDBP (TDP-43) cause motor deficits in vivo. Hum Mol Genet. 19 (4), 671-683 (2010).
- Laird, A. S., et al. Progranulin is neurotrophic in vivo and protects against a mutant TDP-43 induced axonopathy. PLoS One. 5 (10), 13368(2010).
- Lemmens, R., et al. Overexpression of mutant superoxide dismutase 1 causes a motor axonopathy in the zebrafish. Hum Mol Genet. 16 (19), 2359-2365 (2007).
- Ramesh, T., et al. A genetic model of amyotrophic lateral sclerosis in zebrafish displays phenotypic hallmarks of motoneuron disease. Dis Model Mech. 3 (9-10), 652-662 (2010).
- Hanneman, E., Trevarrow, B., Metcalfe, W. K., Kimmel, C. B., Westerfield, M. Segmental pattern of development of the hindbrain and spinal cord of the zebrafish embryo. Development. 103 (1), 49-58 (1988).
- Lewis, K. E., Eisen, J. S. From cells to circuits: development of the zebrafish spinal cord. Prog Neurobiol. 69 (6), 419-449 (2003).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. J Cell Biol. 187 (6), 761-772 (2009).
- Philips, T., Rothstein, J. D. Glial cells in amyotrophic lateral sclerosis. Exp Neurol. 262, Pt B 111-120 (2014).
- Mazaheri, F., et al. Distinct roles for BAI1 and TIM-4 in the engulfment of dying neurons by microglia. Nat Commun. 5, 4046(2014).
- van Ham, T. J., Kokel, D., Peterson, R. T. Apoptotic cells are cleared by directional migration and elmo1- dependent macrophage engulfment. Curr Biol. 22 (9), 830-836 (2012).
- Radford, R. A., et al. The established and emerging roles of astrocytes and microglia in amyotrophic lateral sclerosis and frontotemporal dementia. Front Cell Neurosci. 9, 414(2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados