Method Article
従来のUVレーザー共焦点顕微鏡を用いて細胞ストレスと死のトリガ
要約
Targeted manipulations to cause directed stress or death in individual cells have been relatively difficult to accomplish. Here, a single-cell-resolution ablation approach to selectively stress and kill individual cells in cell culture and living animals is described based on a standard confocal UV laser.
要約
Using a standard confocal setup, a UV ablation method can be utilized to selectively induce cellular injury and to visualize single-cell responses and cell-cell interactions in the CNS in real-time. Previously, studying these cell-specific responses after injury often required complicated setups or the transfer of cells or animals into different, non-physiological environments, confounding immediate and short-term analysis. For example, drug-mediated ablation approaches often lack the specificity that is required to study single-cell responses and immediate cell-cell interactions. Similarly, while high-power pulsed laser ablation approaches provide very good control and tissue penetration, they require specialized equipment that can complicate real-time visualization of cellular responses. The refined UV laser ablation approach described here allows researchers to stress or kill an individual cell in a dose- and time-dependent manner using a conventional confocal microscope equipped with a 405-nm laser. The method was applied to selectively ablate a single neuron within a dense network of surrounding cells in the zebrafish spinal cord. This approach revealed a dose-dependent response of the ablated neurons, causing the fragmentation of cellular bodies and anterograde degeneration along the axon within minutes to hours. This method allows researchers to study the fate of an individual dying cell and, importantly, the instant response of cells-such as microglia and astrocytes-surrounding the ablation site.
概要
蛍光顕微鏡検査は、長いゼブラフィッシュCNSにおける導入遺伝子、開発1に、特にその効果の影響を研究するために使用されています。高解像度の顕微鏡検査は、脳の発達、筋肉の生成、および他の多くの発生事象2に関与する細胞プロセスの詳細なマッピングを可能にしました。個々の細胞の死を研究することは、主として標準的な画像化手順の間に選択的な細胞死を誘導する技術的な問題に、より困難となっています。しかし、単細胞解像度イメージングおよび高い標的アブレーション技術の組み合わせは、ストレスおよび傷害、ならびにその結果としての細胞間相互作用の直接の細胞応答の調査を可能にします。これらのプロセスを理解することは、特に、このようなニューロン - グリア相互作用が進行に寄与することが示されている運動ニューロン疾患(MND)、などの神経変性疾患のため、非常に重要です病気3の。
MND、または筋萎縮性側索硬化症(ALS)は、脳幹、運動皮質、および脊髄内の運動ニューロンに影響を与える破壊的な神経変性疾患です。これらのニューロンの損失は、筋肉の喪失につながり、患者は3以内に死亡-診断4の5年間。筋線維への脊髄リンクにおける運動ニューロンと筋収縮を促進する上で重要な役割を果たしています。これらのニューロンのこの通信や死亡の失敗は、徐々に筋肉を弱め、飲み込む歩き、話し、呼吸する患者の能力に影響を与えます。生きている動物で運動ニューロンの死と短期的な影響を可視化することは、より良い、正常な細胞の恒常性と疾患に関与する動的なプロセスを理解する絶好の機会を提供します。
ゼブラフィッシュは、神経変性疾患1を研究するための魅力的なモデル系として浮上しています。このこのような外部受精、短い発生時、神経系への光アクセス、および遺伝子導入のしやすさとして、このモデル生物によって提供される利点に起因しています。また、容易に化合物トランスジェニックゼブラフィッシュを生成する能力は、異なる細胞型の複数の標識戦略を可能にします。特定の細胞型を死滅させる遺伝子アブレーションアプローチはかなり広い妨害を許容するが、個々のセル5を標的の微調整を欠いています。レーザ支援技術は、一方で、微細な時間的および空間的な制御を提供し、異なる動物モデルに使用されています。ほとんどのアプローチは、他のパルスレーザ6、7、8、9、10、11、12または二光子セットアップ13などの特殊な装置を使用しながら研究グループは、最近、従来の共焦点顕微鏡14でUVレーザーを利用しています。
ここに記載された技術は、選択された運動ニューロンの用量依存的な方法で細胞ストレスや死を引き起こすUVレーザー媒介アプローチで高解像度の共焦点顕微鏡を組み合わせたものです。これは、細胞培養中で、生活動物で正常にテストされている一般的にインストールさ405 nmのレーザーの使用に依存しており、このような神経細胞死後のミクログリアのクリアランスなどの細胞間相互作用の詳細な特性評価を可能にします。
プロトコル
注:デザイン、行動、および動物実験の報告は現行のガイドライン15を考慮しなければなりません。このような作業は地元の動物福祉機関によって事前に承認されなければならない(私たちの場合には、マッコーリー大学の動物倫理委員会)。
1.マウントとUV細胞除去のためのゼブラフィッシュを準備
- ゼブラフィッシュ( ゼブラフィッシュ )の蛍光タンパク質を発現を生成します。
- 、ゼブラフィッシュで関心の蛍光タンパク質を発現する(他の場所で16説明したように)ゼブラフィッシュの卵の1細胞期にプラスミド注射を実行したり、蛍光トランスジェニック系統を使用します。複数の細胞型にラベルを付けるには、関心の質問に関連する確立されたトランスジェニック系統を交配することによって化合物のトランスジェニックゼブラフィッシュラインを作成します。夕方に偽底ペア交配タンクの両側に1人の男性と一人の女性ゼブラフィッシュを置き、光の発症と仕切りを削除翌朝(他の場所で17詳述)。 28℃でのゼブラフィッシュを維持し、確立されたプロトコール17、18に従ってそれらを扱います。
- プラスチック茶漉しを通して胚を含む水槽の水に負担することによって成功した産卵後の胚を収集します。システム水と卵をすすぎ、ペトリ皿に卵、水にそれらを転送します。
- 受精を決定するために光学顕微鏡下でそれらを調べます。ストアは、ペトリ皿に卵を受精し、28°C 18のインキュベーターに置いてください。
- オプション:特定の細胞集団を標識するためにマイクロインジェクションを実行します。
注:これは、安定したトランスジェニック株を上げる必要なく、タンパク質の発現および可視化を可能にする別の方法です。目的のタンパク質は毒性であり、安定したトランスの発生を禁止する場合は、この方法が有利ですジェニックライン。- 他の場所19、20、21に記載のように、ゼブラフィッシュ胚の1細胞期へのプラスミド構築物を注入します。
注:この方法は、目的のタンパク質のモザイク発現をもたらします。 Tol2のにより隣接選択肢のプロモーターから駆動され、目的のタンパク質( 例えば、22、-3mnx1 23、24を islet1、25、またはMPEG1 26に 会ったが )リピート20を反転しました。
- 他の場所19、20、21に記載のように、ゼブラフィッシュ胚の1細胞期へのプラスミド構築物を注入します。
- 所望のサイズに魚を熟成。
- 3に魚を上げる - 5日後に受精(DPF)および蛍光化合物の顕微鏡下に配置します。適切な蛍光体の発現のための動物を選別し、明るく標識された魚を選択します。後半に埋め込むために卵と水と別の皿に適切な幼虫を分離(28℃のインキュベーター内店舗)の研究。
オプション:胚は、色素沈着の形成を阻害するために24時間後に受精(HPF)で0.2mMの1-フェニル-2- thioures(PTU)リンゲル液に配置することができます。それは毒性があり、有害な生理学的、遺伝的、または形態学的な効果を持つことができるようにケアは、PTUで撮影する必要があります。 - 初期の発達段階(<2 DPF)での研究のために、シャープな鉗子を使用して手動で胚をdechorionate。卵水にプロナーゼ(2mg / ml)を添加し、28℃で10分間、それらをインキュベートすることにより酵素的に胚の多数Dechorionate。
- dechorionationを容易にするためにプラスチック製のパスツールピペットを介して定期的に胚を渡します。胚の大部分が卵の水でそれらを数回洗浄することによって、それらの絨毛膜から浮上しているプロセスを終了します。
- 3に魚を上げる - 5日後に受精(DPF)および蛍光化合物の顕微鏡下に配置します。適切な蛍光体の発現のための動物を選別し、明るく標識された魚を選択します。後半に埋め込むために卵と水と別の皿に適切な幼虫を分離(28℃のインキュベーター内店舗)の研究。
- アガロースでのゼブラフィッシュの埋め込みのためのソリューションを準備します。
- 4g添加することによって、麻酔液を調製/ L MS222(トリカインストック溶液、pH7.0)に卵水を含むペトリ皿に滴下しました。 50mg / Lの用量が推奨される開始点( 図1A)です。
- 卵水に - (1.5〜0.8%)と1.5 mLのマイクロ遠心チューブにそれを分取低融点アガロースの株式を準備します。予熱したヒートブロックにアリコートを置き(38から40°C)、それが設定温度(〜30分; 図1B)に平衡化しましょう。
- オプション:長期的なイメージング(> 4時間)については、35 mmのガラスボトムシャーレ内で少しアガロース円を準備し、それが( 補足図1)を設定することができます。
注:この余分なステップは、より長い時間枠にわたってゼブラフィッシュと全体アガロースドロップのあらゆる動きを回避することに有効でした。- 魚を置くている途中で少し開口を有するドーナツ状の円を準備するガラスボトムディッシュの内側の円に沿って、アガロースのように行うには、場所〜300μL(ステップ1.5.3; 補足図1) 。
- 顕微鏡観察のためにアガロースにゼブラフィッシュをマウントします。
- アブレーションのために事前スクリーニング魚の3と麻酔液(; 図1C;約5分ステップ1.4.1)で皿に(トランスファーピペットを使用して)、それらを転送することにより幼虫を麻酔- 1を選択します。
注:彼らは浅いふたの動きと減少した心拍数を表示したときに、魚麻酔し、もはや(TEER;離れて泳ぐの失敗は、後に軽くブラシで自分の尾に触れる)タッチ誘発エスケープ応答を表示しません。魚の倫理的な処置のための適切な麻酔を確認し、蛍光灯へのアガロースまたは曝露への転送時にけいれんを防ぐために。 - 麻酔が確認された後、(カットオフ200-μLチップセットへの〜30μLで)調整可能なピペットを用いて幼虫を吸うと、それは先端の底に沈むましょう。液体の滴を放出することによって予熱したアガロース(ステップ1.4.2)に幼虫を移しアガロースに幼虫(アガロースに入る卵水の量を最小限に抑えるようにしてください; 図1D)。
- アガロースに囲まれた魚を吸います。先に調製したガラスボトム35mmの皿に迅速に分注します。
- ボディと尾部が( 図1E)平らになるように、側のアガロース(左ヘッド)内で動物を配置するために解剖顕微鏡と標準のペイントブラシ(ロングライナー、サイズ1)を使用します。複数の魚を扱う場合、それらは後で簡単に共焦点顕微鏡を使用して位置するように皿にすべての魚を揃えます。
注:すばやく位置決めと整列のこの手順を実行する(アガロースは寒い温度に暴露した後、すぐに設定を開始するように、それはいくつかの練習が必要な場合があります)。 - アガロースがしっかりと設定されるまで15分 - 10のためのアガロース包埋魚を残します。注意深く〜2 mLの卵の水を含むトリカイン( 図1F)と35 mmのペトリ皿をトップアップ。
- アブレーションのために事前スクリーニング魚の3と麻酔液(; 図1C;約5分ステップ1.4.1)で皿に(トランスファーピペットを使用して)、それらを転送することにより幼虫を麻酔- 1を選択します。
2.共焦点顕微鏡およびイメージングパラメータを設定します
- 共焦点顕微鏡のステージ上の埋め込み幼虫とペトリ皿を置き、(明視野を使用して)動物脊髄の背側に焦点を当てます。適切な倍率(40X)と蛍光設定で動物を調べ、それに続くアブレーション( 図2)のために必要なすべての撮像パラメータであることを確認するために、関心のある構造( 例えば、標識されたニューロンまたはミクログリア運動の蛍光強度)を視覚化します。私たちは日常的に私たちの時間経過の研究を行うために40Xの対物レンズを使用しています。
- オプション:数時間タイムラプス研究を行うためには、非摂動生理細胞の応答とその環境( 例えば、ベースラインの速度を確立するミクログリアの動きを確立するために、前の切除に単一または少数の時点を記録することをお勧めしますおよび運動性)。
- 構造体の厚さを決定UVレーザーアブレーションのために関心のURE。
- Zドライブを使用して、手動で焦点を当てダウンによって関心の構造( 例えば、細胞体)の上下を確認してください。切除されますz面を下に注意してください( 例えば、セルの中心)。
注:(アブレーション後に簡単なタイムラプス可視化を可能にする高い信号対雑音比、 例えば、 図4)の経験から、この方法は、明るく標識した脊髄神経細胞を標的とすることによって、最も効果的であったとの中央を切除することにより、細胞体。細胞核の蛍光は、正しい標的と高いアブレーション効率を保証するために有利であり得ます。
- Zドライブを使用して、手動で焦点を当てダウンによって関心の構造( 例えば、細胞体)の上下を確認してください。切除されますz面を下に注意してください( 例えば、セルの中心)。
3.ゼブラフィッシュ脊髄に個々の細胞の標的化レーザーアブレーションを実行します
注:このアブレーションおよび可視化手法については、共焦点顕微鏡(ライカSP5)を用いました。細胞特異destに405 nmのダイオードを使用してアブレーション手技騒動は、ソフトウェア(ライカアプリケーションスイート、v2.7.3.9723)に従って詳述されています。しかし、405 nmのレーザー、FRAP(退色後蛍光回復)または漂白モジュールが装備されている任意の従来の共焦点顕微鏡は、潜在的に、わずかに異なる設定、パラメータ、および名前で、同じセル操作のパフォーマンスができるようになります。
- ソフトウェアメニュー( 図3A、1及び2)の上部にあるドロップダウンメニューをクリックしてFRAPウィザードを起動します。レーザーアブレーションのための特定のパラメータ( 図3B、3)のセットアップを可能にする異なるステップで新しいウィンドウを観察します。
- フォーマット、走査速度( 図3B、4) を選択し、平均することによりアブレーションアプローチの画像パラメータを決定する(図3B、5)。 400ヘルツの走査速度で1,024×1024の画像フォーマットとライン4の平均は最も適用しました。
注:彼らは以前の買収に決定されているように、(このような励起または放射パラメータなど)のスペクトル検出を変更する必要は一般的にありません。- アブレーション用のz平面は、既に(ステップ2.4に記載のように)選択されていない場合、押し「ライブ」ボタンとアブレーションされようとしている蛍光性の構造または所望のz平面になるまで、試料を通って焦点を合わせます焦点があっている。
- 一般的な画像パラメータを設定したら、「漂白剤」ステップ( 図3C、6)特定のアブレーション要素を制御するためにアクセスします。
注:レーザ強度の組み合わせ( 図3C、8)、走査速度、およびステップ3.2に設定された平均( 図3B、4及び5)、並びにに設定される繰り返しの回数、3.5( 図3Eのステップ12)、したがって漂白効率のROIでのUVレーザの全体的な滞留時間を決定し、あろう。- 漂白手順( 図3C、8)のためにそれを活性化することにより、405 nmのレーザーを係合します。
注: - 私たちの実験で80%上記の設定で、ほとんどの成功は、60との間に405 nmのレーザー強度で達成されました。このレーザー出力が機器固有のものであることに注意してください、すべての共焦点セットアップに異なります。 - したがって、滞留時間を最大化する、スキャンフィールドを減少させることによって選択されたROIで漂白強度を最大化するためのオプション「ズームイン」( 図3C、7) を使用します 。また、このプロセスのための選択のソフトウェアの「ブリーチポイント」オプションを使用します。
- 漂白手順( 図3C、8)のためにそれを活性化することにより、405 nmのレーザーを係合します。
- 画像取得風に描画ツールのいずれかを使用してアブレーションするための1つまたは複数のROI( 図3D、10) を選択OW( 図3D、9)。 8ミクロン - 約4の円形の描画ツールで、例えば、軸索小丘をターゲットにしています。
注:切除領域は、用途に応じて、単一の画素から大きな面積に調整可能です。 - ROIを確立した後、「時間経過」ボタン( 図3E、11) を選択したROIが( 図3E、12)アブレーション/スキャンされるサイクル数を確認します。漂白工程の後に直前と直後に画像全体の概要を可能にするために所望のように「プリブリーチ」と「ポスト・ブリーチ」フレームを選択してください。
- すべての必要なアブレーションパラメータを確立した後、プレス「ファイル名を指定して実行実験」( 図3E、13)とアブレーションの効率を監視します。
注:私たちのFRAPのセットアップでは、単一の画像は、適切なレーザーeでFRAPサイクルの前と後に撮影されますxcitation(EGFP発現細胞のために例えば、488 nm励起)。これら前後のアブレーション画像は、選択されたアブレーション・パラメータがあったか満足にROIを漂白して、どのように効果的なの迅速な判断を可能にします。 - 場合に選択されたROIはまだ完了後に高い蛍光強度を示すレーザ強度( 図3C、8)、スキャン速度と平均( 図3B、 図4、図 5)を調整することにより、プロセスを繰り返し、繰り返し( 図3E、12) FRAPサイクル。
4.「レスキュー」または処分魚を含め、フォローアップの手順を実行します
- 実験が端末である場合は、トリカインの過剰摂取で動物を安楽死させます。卵、水を除去し、10分間麻酔原液と交換してください。安楽死を確実にするために、ハートビートの停止のために顕微鏡下で確認してください。
- 任意:実験が端末でない場合、細かい鉗子やブラシでアガロースから慎重に魚を削除します。新鮮な卵水に魚を置き、15分間の観察下に回復することができます。通常の遊泳行動が返された場合、インキュベーターに魚を戻します。
- 機関の承認GMOの廃棄物の流れに応じてトランスジェニック動物を処分してください。
結果
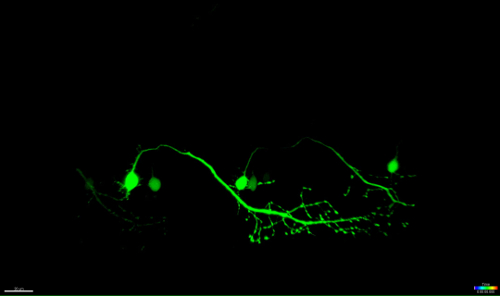
ここに記載された方法は、市販の共焦点顕微鏡のFRAPモジュールを使用してゼブラフィッシュ脊髄の運動ニューロンの切除を可能にします。ような特異的プロモーターの制御下で、神経細胞の緑色蛍光タンパク質を発現するトランスジェニックゼブラフィッシュ系統、 - 3mnx1、islet1、またはMetを使用しました。 (例えば-3mnx1として、または会った )運動ニューロンプロモーターにより駆動されるGFPの発現は、細胞体、メイン軸索、および筋肉に至る末梢枝( 図4およびビデオ1)の高解像度の可視化を可能にします。
3〜5日齢魚の脊髄内のニューロンが正常に60の全体的な滞留時間で、切除されてきた - 〜70%のレーザーパワーで80秒、ステップ3成功したアブレーションに記載された一般的な設定です蛍光は、切除直後にフェードインするときに達成そして、( 図5、C及びD)を再開することはありません。 (例えば488 nmのレーザーラインなど)他のレーザラインとアブレーションの試みは、永続的なフェージングをもたらさなかったし、蛍光は、短い時間枠内に復元されました。重要なことは、この技術は、アネキシンVの存在、ソマリ族変性の一貫した形態学的変化、およびアブレーションされたニューロン27の軸索ブレブ形成などのUV-アブレーションニューロンにおけるアポトーシス細胞死の特徴を、実証しました。
このアプローチの特異性は、細胞の兆候なしに、単一の標的ニューロンは変換されたphotoconvertibleフォア楓(それは、UV光への曝露後に緑から赤にその発光を切り替え)、( 図5、AおよびB)を使用した実験で確認されています数時間にわたって破壊。高いレーザパワーの使用法ではなくトンをリードOアブレーションサイト( 図5、CおよびD)に近接した細胞(〜20ミクロン)の対象となるニューロン(死亡なし)(なし光変換または蛍光の再出現)と光変換の絶滅。
このレーザー誘起アブレーション技術の1つの重要な利点は、アプローチの用量依存性です。異なる強度を有する細胞を標的とするために、微調整の複数の層は、レーザパワー( 図3C、8)、走査速度及びライン平均( 図3B、4及び5)を調整することにより入手可能であり、ROIの大きさは切除されます( 図3D、10)、および繰り返し( 図3E、12)。注目すべきことに、このアプローチはまた、代わりに細胞死を誘導する個々の細胞に細胞ストレスを印加するために利用することができます。例えば、微調整されています神経細胞の死の間に細胞プロセスを評価するのは非常に貴重。ターゲットを絞ったソーマで開始し、時間をかけて軸索に沿って継続的な低いUVレーザー強度で切除された長い軸索投射と運動ニューロン特徴的な「ブレブ形成」(セルラー小胞の形成および断片化)を明らかにし、(40から90分; 図4 ; 3D)は、 ビデオ1に、このアブレーションのムービーをレンダリング。その結果、異なるレーザアブレーションパラメータ、したがって、誘導された細胞ストレスのレベルと死の時間経過を調節することは研究者に実験的な高いレベルの柔軟性を可能にします。
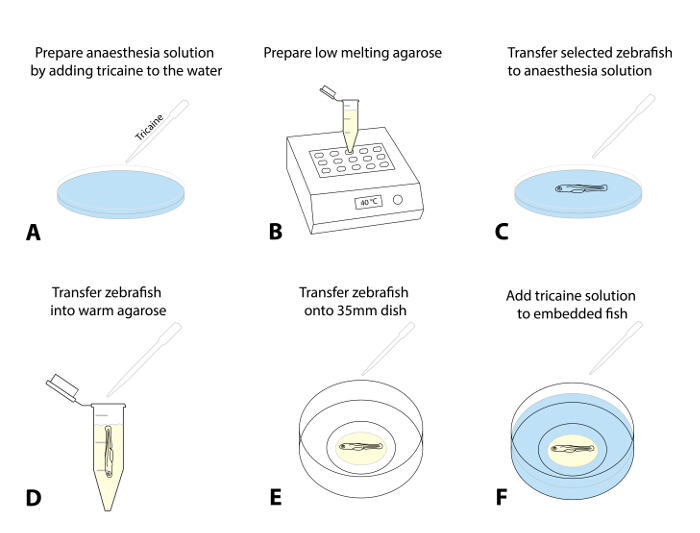
図1:ライブイメージングのためのゼブラフィッシュの埋め込み。 (AF)のライブイメージングのための手順を埋め込み:(A)トリカインは、ゼブラフィッシュaをanaesthetizeする卵水に添加され、 50 mg / Lでの線量率を起動TA。 (B)低融点アガロース(1.3 - 1.5%)を調製し、38まで温め、 - 40°C。トランスファーピペットを用いて(C)は 、スクリーニングおよび選択されたゼブラフィッシュは、トリカイン溶液で皿に移します。成功鎮静(浅いふたの移動は、心拍数、タッチ誘発応答の欠如の減少)の後に、魚を予熱アガロース(D)に移します。その後の希釈を防ぐためにアガロースに転送され、卵の水の量を最小限に抑えます。ガラスボトム35mmの皿にゼブラフィッシュを含む- (50μL〜30)(E)は 、アガロースの低下を転送します。解剖顕微鏡下で、これを実行し、静かにその好ましい方向にゼブラフィッシュを整列させるためにブラシを使用しています。アガロースが設定されるまで、15分、およびディッシュ(F)にトリカイン液の〜2 mLを加え- 10待ちます。ANK ">この図の拡大版をご覧になるにはこちらをクリックしてください。
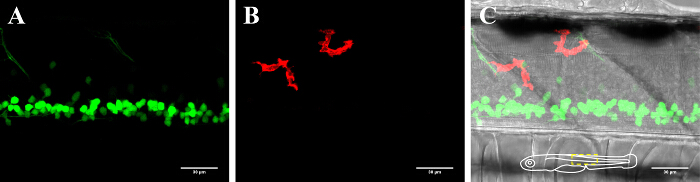
図2:3-DPFのゼブラフィッシュの脊髄の神経細胞とミクログリアの可視化。 3日齢のトランスジェニックゼブラフィッシュの脊髄におけるミクログリアと神経細胞の可視化を発現する(A)GFP陽性ニューロン(islet1:GFP)および(B)mCherryを陽性ミクログリア(MPEG1:GAL4、UAS:mCherryを)。 (C)一緒に明視野像とニューロンとミクログリアのチャンネルのコンポジット映像。 (C)の模式的インサートは、魚の向きを示していると発表エリアの概要を説明します。 =30μmのスケールバー。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図3:UVレーザアブレーションのプロセスのステップ(プロトコル、ステップ3で概説したように)。共焦点ソフトウェア(ライカアプリケーションスイート)でFRAPソフトウェアモジュールを制御するための手順。 (A)UVレーザーアブレーションを実行するためのツールとしてのFRAPモジュールの起動。レーザの滞留時間を決定する形式、速度、及び平均等アブレーションおよび他のFRAPの設定のためのz平面を設定する(B)。 (C)は、レーザ強度の制御と漂白効率を最大化するためのオプション「ズームイン」。切除されます(D)利息(ROI)の一つまたは複数の領域の選択。漂白の時間経過を設定(E)は、漂白サイクルと関心領域における全体的なレーザ滞留時間を決定します。 彼女をクリックしてください eは、この図の拡大版を表示します。
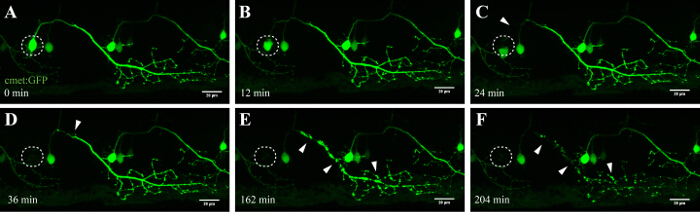
図4:UV-アブレーションされたニューロンの順行性変性。 UV-アブレーション脊髄ニューロンの神経変性のタイムラプスイメージング。 (AF)単一の脊髄神経細胞のUV照射( 会った:GAL4、UAS:EGFP;円)は、軸索の断片化に続いて、(AC)を縮小し、時間をかけて切り上げニューロンの細胞体が得られた(CF;矢頭) 。軸索変性は、ソーマ(アブレーションのサイト)で開始し、最終的には、細胞体中の蛍光が消失し、全体の軸索は「ブレブ形成」(DF)を示すまで軸索の先端に向かって順行を進行しました。スケールバー=20μmです。このアブレーションの3Dレンダリングタイムラプスムービーは、 ビデオ1に示されています。エス/ ftp_upload / 54983 / 54983fig4large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
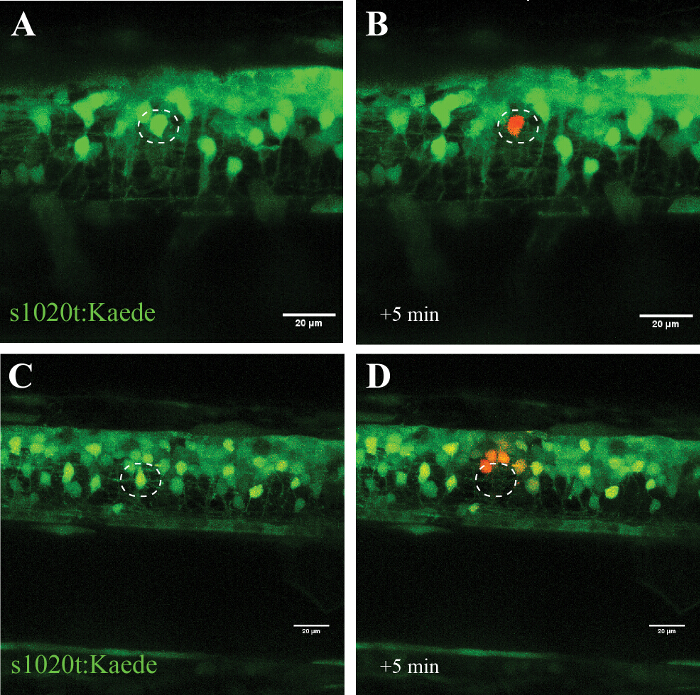
図5:運動ニューロンにphotoconvertibleフォア(楓)を使用して、単一細胞のUV照射の効果の確認。ニューロンにおけるphotoconvertibleフォアかえでの活性化を介して単一セルのUV照射の検証。楓で標識されたニューロンの(AD)UV照射。 10秒間30%のレーザーパワーを持つ単一ニューロン(円)の(A)光変換のみを対象と個々のニューロン(B)に(緑から赤に)楓の光変換につながりました。変換された細胞は数時間生存し、そのようなブレブ形成または切り上げなどの劣化の視覚的な兆候を示さなかったことに注意してください。単一ニューロンのアブレーション (Cは ;高いレーザパワー(10秒、95%)を有する円)は、そのニューロンの即時の消失(D)および約20μmの半径内の周囲のニューロンの数が少ない中で楓のその後の光変換をもたらしました。スケールバー=20μmです。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ビデオ1:図4に示すUVアブレーションニューロンの3D表面レンダリング(IMARIS)。
図4に示したニューロンのタイムラプスビデオは、可視化ソフトウェア(IMARIS、ビットプレーン)を使用して描画面です。これは、順行細胞の遠位端に向かって軸索の断片化に続いてアブレーションされたソーマの収縮過程を、強調しています。euron_ablation-3D_rendered.mov "ターゲット=" _空白 ">このファイルをダウンロードするにはこちらをクリックしてください。
補足図1:長時間撮影用のオプションのアガロースキャスト。
長期の取得中に魚の動きとアガロースを回避するためにグラスボトム35mmディッシュ(A)の中央に縁に沿ってアガロースのドーナツ状の円を準備します。 10分〜のためにアガロース集合を、アガロース(B)のドロップと内側の円の中に魚を移します。 (魚を配向した後、外部に余分なアガロースを磨く)埋め込み用のアガロースの量を最小限に抑えるようにしてください。 このファイルをダウンロードするにはこちらをクリックしてください。
ディスカッション
レーザーアブレーションアプローチ
レーザ支援アブレーション技術は、細胞の個人または小グループの正確なターゲティングを可能にします。このようなゼブラフィッシュなどの動物モデルで高解像度の顕微鏡検査と遺伝子操作でこの技術を組み合わせることで、研究者が体系的損傷後の個々の細胞の運命との相互作用を研究することができます。
ここで説明したUV(405 nm)のレーザーアブレーションプロトコルは、個々の細胞がストレスを受けたり殺さ選択(用量依存的に)、ニューロン、グリアに隣接しながら、そして軸索は無傷で残っていることができる方法について説明します。我々が正常に細胞培養実験では、このアプローチを利用し、ここでゼブラフィッシュ脊髄のための詳細なアプローチを説明してきました。私たちは、選択的に他の細胞( 図5、Aのネットワーク内の個々のニューロンを強調することにより、ゼブラフィッシュ脊髄にこのアプローチの実装を示し、 B)、または直ちに回復することなく、単一のニューロンを殺すことにより( 図5、CおよびD)。
以前は、このようなパルス化窒素レーザーまたは二光子レーザーシステムなどの特殊なレーザシステムは、13、12、11、組織損傷および運動神経離断10を誘導するために必要でした。これらのレーザシステムが正常にこのような動脈および静脈6における血栓症、急性腎障害7、心臓損傷8と細胞損傷を引き起こすこと、およびカルシウム波と脳損傷9後のミクログリア応答を研究するために利用されています。さらに、スーステルらは、 ショウジョウバエ 14 <における上皮の損傷およびグリア細胞を誘導するために、従来の共焦点セットアップ(351-nmおよび364 nmのUVレーザー)を使用しました/ SUP>。
ALSを理解するためのゼブラフィッシュモデルの妥当性(および他のヒト疾患)
ゼブラフィッシュは、特に発生研究28、29、30のために、広く使用されているモデル生物です。彼らは一定の制限がありますが、ヒト疾患をモデル化し、病原性の分子機構の理解を与えるために、その可能性は莫大です。ゼブラフィッシュモデルはMNDの研究のために十分に確立されており、重要な分子の洞察31、32、33、34につながっています。トランスジェニックゼブラフィッシュラインは急速に生成することができます(4から5ヶ月)と特定の細胞型、それらALSの現在の動物モデルに貴重な追加にする機能の選択的な追跡を可能にします。ゼブラフィッシュの胚/幼虫は、光学的に透明であり、ユニークなexperiを提供しています容易にげっ歯類モデル(またはヒトにおいて)で達成することができない脳または脊髄における単一細胞レベルで長期のライブイメージングを可能にする精神的な利点。このような単一セルのアブレーションなどの分子技術と組み合わせると、これは、in vivoで正確な分子メカニズムを研究するためのユニークな実験的なプラットフォームを提供します。
運動ニューロンが選択的にUVレーザーアブレーションを用いて標的化され得ます
ゼブラフィッシュにおける脊髄の神経細胞は、出生後10時間以内に開発するために開始し、後に約48時間35、36確立されています。この急速な発展は、短い時間枠内で、高スループットでこれらのニューロンの可視化を可能にします。運動ニューロンは、脳と筋肉の間に本質的なリンクを提供し、ALSで、運動皮質(上位運動ニューロン)、脳幹、および脊髄(下位運動ニューロン)に影響を受けています。これらのニューロンの損失は必然的にムーにつながりますSCLE萎縮さと弱さ。ゼブラフィッシュの脊髄の運動ニューロンは、それらの個別の突出部によって、および-3MNX1などのモーターニューロン特異的プロモーターの使用によって同定することができます。このような突出したニューロンの細胞体を標的とすることは時間をかけて軸索突起に沿って順行性変性( 図4とビデオ1)を明らかにしました。脊髄運動ニューロンの単一細胞の解像度イメージングは、さらに、レーザアブレーション( 図4およびリファレンス27で補足ビデオ3を参照)後にホスファチジルセリンの転座およびその結果としてのアネキシンV標識を確認しました。我々はUVレーザアブレーション法の後ニューロンを瀕死にアネキシンVの活性化を報告しているが、我々は、この加速処理中にトリガされた死のカスケードが正確に神経変性または正常な細胞の恒常性の間に起こる神経細胞死と一致していることを特定することはできません。
このアブレーションアプローチは、再現性の高いですがそして特定の、異なる埋め込み戦略は、UVアブレーションの効率に影響を与える可能性があります。我々の経験では、私たちが私たちの魚を埋め込みアガロースの層を最小限にするために最も成功した。卵の水の追加の層を含む培地を埋め込むより厚い層は、最終的減衰に起因するセルによって受信されたUV電力を低減し、発生する散乱効果ありビーム経路に沿って。
将来的には、異なるトランスジェニック魚のラインの交差は、レーザー誘起細胞破壊には、このようなグリアなどの他の影響を受けた細胞の応答(12時間まで)の即時および短期の可視化を可能にします。例えば、ALSなどの神経変性疾患におけるアストロサイトおよび非細胞自律的な毒性は、研究脚光を浴びていると重く孤発性および家族性ALS 37、38の病原性に関与しています。しかしながら、メカニズムはグリア毒性及び選択性の根底運動ニューロンに向かって不明なままです。我々と他の人は最近、ミクログリアによって瀕死のニューロンの飲み込みを研究するために、このアプローチの利点を取り、ニューロンの残党27、39、40のクリアランスを可視化しました。
高解像度の顕微鏡検査および神経炎症のマーカーでアブレーション技術を組み合わせることにより、将来の研究者は、単一細胞の機能と相互接続された細胞系の理解を広げることを可能にします。 in vivoでの設定で、これらのプロセスの特性は、発達の設定ではなく、また、細胞間相互作用は、3を損なわれる可能性があるMND、41を含む神経変性疾患のモデルではないだけに重要です。
開示事項
The authors declare that they have no competing financial interests.
謝辞
This work was supported by the MND Research Institute of Australia and the Cure for MND Foundation [GIA 1638], the Snow Foundation, and Macquarie University [MQRDG 9201401462]. Imaging was carried out at the Microscopy Facility in the Department of Biomedical Sciences, Macquarie University. Other members of the MND research center are thanked for their contributions to the development of these methods and fish lines.
資料
| Name | Company | Catalog Number | Comments |
| Agarose low melting | Fisher-Scientific | Dissolve in egg water with tricaine (0.02%) at 0.8 - 1.5% | |
| Tricaine | Argent Labs | MS-222 | 0.02% |
| Harvard standard wall Borosilicate with filament Capillary Glass | World Precision Instruments, Inc. | GC100F-10 (short) GC100F-15 (long) | Pull to a resistance of 2 - 7 MΩ |
| Egg water | 0.6 g Instant Ocean sea salt, 4 mL of 1 mg/mL methylene blue in 10 L deionized water | ||
| 1-phenyl-2-thiourea (PTU) | Sigma | P7629 | |
| Pronase | Sigma | 10165921001 | |
| Heat block | Select BioProducts | Digital block heater (SBD110_) | |
| Microinjection apparatus | World Precision Instruments, Inc. | Microinjection was performed by hand under a steromicroscope (Leica) with a loaded glass needle and a Picospritzer II (General Valve corporation) | |
| Stereoscope | Leica | Bright field illumination microscopy was performed on a Leica M165FC stereo dissection microscope (Leica) | |
| Microscope | Leica | SP5 | |
| 35 mm glass bottom dish | MatTek Corporation | P35G-0-20-C |
参考文献
- Becker, T. S., Rinkwitz, S. Zebrafish as a genomics model for human neurological and polygenic disorders. Dev Neurobiol. 72 (3), 415-428 (2012).
- Wilt, B. A., et al. Advances in light microscopy for neuroscience. Annu Rev Neurosci. 32, 435-506 (2009).
- Philips, T., Robberecht, W. Neuroinflammation in amyotrophic lateral sclerosis: role of glial activation in motor neuron disease. Lancet Neurol. 10 (3), 253-263 (2011).
- Robberecht, W., Philips, T. The changing scene of amyotrophic lateral sclerosis. Nat Rev Neurosci. 14 (4), 248-264 (2013).
- White, D. T., Mumm, J. S. The nitroreductase system of inducible targeted ablation facilitates cell-specific regenerative studies in zebrafish. Methods. 62 (3), 232-240 (2013).
- Jagadeeswaran, P., Paris, R., Rao, P. Laser-induced thrombosis in zebrafish larvae: a novel genetic screening method for thrombosis. Methods Mol Med. 129, 187-195 (2006).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. (54), e2845(2011).
- Matrone, G., et al. Laser-targeted ablation of the zebrafish embryonic ventricle: a novel model of cardiac injury and repair. Int J Cardiol. 168 (4), 3913-3919 (2013).
- Sieger, D., Moritz, C., Ziegenhals, T., Prykhozhij, S., Peri, F. Long-range Ca2+ waves transmit brain-damage signals to microglia. Dev Cell. 22 (6), 1138-1148 (2012).
- Lewis, G. M., Kucenas, S. Motor nerve transection and time-lapse imaging of glial cell behaviors in live zebrafish. J Vis Exp. (76), (2013).
- Rosenberg, A. F., Wolman, M. A., Franzini-Armstrong, C., Granato, M. In vivo nerve-macrophage interactions following peripheral nerve injury. J Neurosci. 32 (11), 3898-3909 (2012).
- Villegas, R., et al. Dynamics of degeneration and regeneration in developing zebrafish peripheral axons reveals a requirement for extrinsic cell types. Neural Dev. 7, 19(2012).
- O'Brien, G. S., et al. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J Vis Exp. (24), (2009).
- Soustelle, L., Aigouy, B., Asensio, M. L., Giangrande, A. UV laser mediated cell selective destruction by confocal microscopy. Neural Dev. 3, 11(2008).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 8 (6), 1000412(2010).
- Essentials of Biology 2. JoVE. , JoVE Science Education Database. Mouse, Zebrafish, and Chick. Zebrafish Microinjection Techniques (2016).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. J Vis Exp. (69), e4196(2012).
- Westerfield, M. The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio).Vol.4th ed. , Univ. of Oregon Press. Eugene. (2000).
- Clark, K. J., Urban, M. D., Skuster, K. J., Ekker, S. C. Transgenic zebrafish using transposable elements. Methods Cell Biol. 104, 137-149 (2011).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Dev Dyn. 236 (11), 3088-3099 (2007).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), (2009).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. J Neurosci. 20 (1), 206-218 (2000).
- Arkhipova, V., et al. Characterization and regulation of the hb9/mnx1 beta-cell progenitor specific enhancer in zebrafish. Dev Biol. 365 (1), 290-302 (2012).
- Flanagan-Steet, H., Fox, M. A., Meyer, D., Sanes, J. R. Neuromuscular synapses can form in vivo by incorporation of initially aneural postsynaptic specializations. Development. 132 (20), 4471-4481 (2005).
- Hall, T. E., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin alpha2-deficient congenital muscular dystrophy. Proc Natl Acad Sci U S A. 104 (17), 7092-7097 (2007).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), 49-56 (2011).
- Morsch, M., et al. In vivo characterization of microglial engulfment of dying neurons in the zebrafish spinal cord. Front. Cell. Neurosci. , (2015).
- Grunwald, D. J., Eisen, J. S. Headwaters of the zebrafish -- emergence of a new model vertebrate. Nat Rev Genet. 3 (9), 717-724 (2002).
- Lele, Z., Krone, P. H. The zebrafish as a model system in developmental, toxicological and transgenic research. Biotechnol Adv. 14 (1), 57-72 (1996).
- Veldman, M. B., Lin, S. Zebrafish as a developmental model organism for pediatric research. Pediatr Res. 64 (5), 470-476 (2008).
- Kabashi, E., et al. Gain and loss of function of ALS-related mutations of TARDBP (TDP-43) cause motor deficits in vivo. Hum Mol Genet. 19 (4), 671-683 (2010).
- Laird, A. S., et al. Progranulin is neurotrophic in vivo and protects against a mutant TDP-43 induced axonopathy. PLoS One. 5 (10), 13368(2010).
- Lemmens, R., et al. Overexpression of mutant superoxide dismutase 1 causes a motor axonopathy in the zebrafish. Hum Mol Genet. 16 (19), 2359-2365 (2007).
- Ramesh, T., et al. A genetic model of amyotrophic lateral sclerosis in zebrafish displays phenotypic hallmarks of motoneuron disease. Dis Model Mech. 3 (9-10), 652-662 (2010).
- Hanneman, E., Trevarrow, B., Metcalfe, W. K., Kimmel, C. B., Westerfield, M. Segmental pattern of development of the hindbrain and spinal cord of the zebrafish embryo. Development. 103 (1), 49-58 (1988).
- Lewis, K. E., Eisen, J. S. From cells to circuits: development of the zebrafish spinal cord. Prog Neurobiol. 69 (6), 419-449 (2003).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. J Cell Biol. 187 (6), 761-772 (2009).
- Philips, T., Rothstein, J. D. Glial cells in amyotrophic lateral sclerosis. Exp Neurol. 262, Pt B 111-120 (2014).
- Mazaheri, F., et al. Distinct roles for BAI1 and TIM-4 in the engulfment of dying neurons by microglia. Nat Commun. 5, 4046(2014).
- van Ham, T. J., Kokel, D., Peterson, R. T. Apoptotic cells are cleared by directional migration and elmo1- dependent macrophage engulfment. Curr Biol. 22 (9), 830-836 (2012).
- Radford, R. A., et al. The established and emerging roles of astrocytes and microglia in amyotrophic lateral sclerosis and frontotemporal dementia. Front Cell Neurosci. 9, 414(2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved